MAKALAH
UNSUR-UNSUR PERIODE 3 DAN PERIODE 4
Guru pembimbing : Siti Hamidah M.Kim
Disusun oleh :
Alfin M Alhumaedi
Renald afrialdi
Moch Erlangga Candra P
Yayan Revaldi
Kelas XII IPA 1
MA Alfalah Nagreg Bandung
BAB I
Unsur-unsur periode ketiga
Tabel 3.13 Beberapa sifat unsur-unsur periode ketiga
A. Sifat-sifat fisis
1) Titik cair dan didih
Seperti dapat dilihat pada Tabel 3.13, titik cair dan titik didih unsur-unsur periode ketiga dari kiri ke kanan meningkat secara bertahap dan mencapai puncaknya pada golongan IVA (silikon), kemudian turun secara drastis pada golongan VA (fosforus). Jadi, titik cair tertinggi dimiliki oleh silikon, sedangkan titik cair terendah dimiliki oleh argon (lihat gambar 3.6).
Kecenderungan titik cair dan titik didih unsur periode ketiga dapat dipahami sebagai berikut.
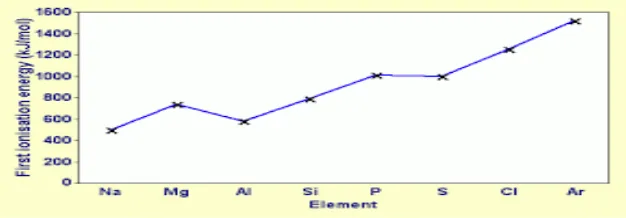
Gambar 3.7 Grafik energi ionisasi unsur-unsur periode ketiga
Natrium, magnesium, dan alumunium mempunyai ikatan logam. Seiring
dengan bertambahnya jumlah elektron valensi, kekuatan ikatan logam meningkat dari natrium hingga alumunium. Oleh karena itu, titik cair dan titik didihnya meningkat.
Silikon mempunyai struktur kovalen raksasa (seperti intan), setiap atom silikon
terikat secara kovalen pada empat atom silikon. Zat dengan struktur kovalen raksasa mempunyai titik leleh serta titik didih yang sangat tinggi.
Fosforus, belerang, klorin dan argon terdiri dari molekul-molekul nonpolar, sehingga hanya dikukuhkan oleh gaya van der waals yang relatif lemah.oleh karena itu, titik leleh serta titik didihnya relatif rendah. Sebagaimana anda ketahui, gaya van der waals bergantung pada molekul masa relatif.
2) Energi ionisasi
Kecenderungan energi ionisasi unsur-unsur periode ketiga diberikan pada Gambar 3.7. gambar terebut menunjukkan bahwa dari kiri ke kanan energi ionisasi cenderung bertambah.
Hal itu merupakan akibat bertambahnya muatan inti, sehingga daya tarik inti terhadap elektron terluar makin besar. Data tersebut juga menunjukkan bahwa energi ionisasi magnesium lebih besar daripada alumunium, dan energi ionisasi fosforus lebih besar daripada belerang. Penyimpangan ini terjadi karena unsur golongan IIA (magnesium) dan golongan VA (fosforus) mempunyai konfigurasi elektron yang relatif stabill, yaitu konfigurasi setengah penuh. Di lain pihak, alumunium dan belerang mempunyai satu elektrin yang terikat agak lemah.
Mg 1s2 2s2 2p6 3s2
Konfigurasi penuh : 3s2
Al 1s2 2s2 2p6 3s2 3p1
Elektron 3p1 terikat agak lemah
Konfigurasi setengah penuh : 3p3
S 1s2 2s2 2p6 3s2 3p4
Satu elektron 3p harus berpasangan sehingga cenderung mudah lepas.
3) Sifat logam dan nonlogam
Natrium, magnesium, dan alumunium merupakan logam sejati. Ketiga unsur itu merupakan konduktor listrik dan panas yang baik, serta menunjukkan kilap logam yang khas. Senyawa-senyawa natrium dan magnesium bersifat ionik, demikian juga sebagian besar senyawa alumunium. Natrium, magnesium, dan
alumunium larut dalam asam membentuk kation tunggal Na+, Mg2+, Al3+.
2Na(s) + 2H+(aq) → 2Na+(aq) + H
Reaksi alumunium dengan asam-asam itu hanya berlangsung sebentar kemudian terhenti karena terbentuknya lapisan oksida Al2O3 pada permukaan logam itu
yang bersifat inert.
Walaupun secara kimia sifat logam menurun dari natrium ke alumunium, sifat-sifat fisisnya justru meningkat. Titik cair, itik didih, rapatan, dan kekerasan meningkat dari natrium ke alumunium (lihat tabel 3.13). natrium merupakan logam yang ringan dan lunak,magnesium lebih keras, tetapi agak rapuh, sedangkan alumunium lebih kuat lagi. Peningkatan sifat fisis logam dari natrium ke alumunium berkaitan dengan pertambahan elektron valensi, sehingga kekuatan ikatan antar atom dalam logam meningkat.
belerang membentuk anion tunggal, yaitu Cl- dan S2-. Adapun fosforus hanya
membentuk anion poliaom, seperti PO43- dan PO33-.
B. Sifat pereduksi dan pengoksidasi unsur periode ketiga
Daya pereduksi unsur-unsur periode ketiga berkurang dari kiri ke kanan, sebaliknya daya pengoksidasinya bertambah. Jadi, pereduksi terkuat adalah natrium, sedangkan pengoksidasi terkuat adalah klorin. Kecenderungan tersebut sesuai dengan energi ionisasi yang cenderung bertambah dari kiri ke kanan.
2Na(s) → 2Na+(aq) + 2e Eo= +2,71 volt
2H2O(I) + 2e → 2OH-(aq) + H2 Eo= -0,83 volt
+
2Na(s) + 2H2O(I) → 2Na+(aq) + 2OH-(aq) + H2 Eo = +1,88
Reaksi sejenis dengan logam magnesium dan alumunium dengan air mempunyai potensial standar berturut-turut +1,54 volt dan +0,83 volt. Akan tetapi, pada kenyataannya magnesium hanya bereaksi lambat dengan air pada suhu kamar dan sedikit lebih cepat dengan air mendidih.
Mg(s) + 2H2O(I) → Mg(OH)2(s) + H2(g)
Natrium, magnesium, dan alumunium tergolong preduksi kuat, tetapi berkurang dari natrium ke alumunium. Daya pereduksi dari natrium, magnesium, dan alumunium dapat diperbandingkan dari reaksi unsur-unsur itu dengan air. Natrium bereaksi hebat dengan air (dengan mudah mereduksi air) membentuk natrium hidroksida dan gas hidrogen.
Dari Na ke Cl dalam periode ketiga, sifat pereduksi berkurang dan sifat pengoksidasi bertambah
Reaksi magnesium dengan air terhambat lapisan endapan magnesium hidroksida
Mg(OH)2 yang menutupi permukaan logam itu,karena magnesium hidroksida sukar
larut dalam air. Alumunium sama sekali tidak bereaksi dengan air tetapi beraksi
dengan uap air panas membentuk (Al2O3) dan gas hidrogen.
2Al(s) + 3H2O(g) → Al2O3(s) + 3H2(g)
Hidroksida unsur periode ketiga dapat dinyatakan sebagai M(OH)x, dengan
M = unsur periode ketiga (kecuali argon), dan x = nomor golongan. Hidroksida unsur periode ketiga terdiri atas NaOH, Mg(OH)2, Al(OH)3, Si(OH)4, P(OH)5,
S(OH)6, Cl(OH)7. Namun, Si(OH)4, P(OH)5, S(OH)6, dan Cl(OH)7 tidak
stabil.hidroksida-hidroksida itu melepas satu, dua, atau tiga molekul air.
Si(OH)4 → SiO(OH)2 atau H2SiO3
P(OH)5 → (PO(OH)3 atau H3PO4 + H2O
S(OH)6 → SO2(OH)2 atau H2SO4 + 2H2O
Cl(OH)7 → ClO3OH atau HClO4 + 3H2O
Sifat hidroksida unsur periode ketiga bergantung pada perbedaan keelektronegatifan dari unsur periode ketiga dan oksigen. Jika perbedaan itu besar, maka ikatan M-O akan bersifat ionik dan hidroksida bersifat basa, dalam air melepas ion OH-.
MOH → M+ + OH
-Sebaliknya, jiga perbedaan itu kecil, maka ikatan M-O akan bersifat kovalen
dan tidak dapat lagi melepas ion OH-. Oleh karena itu O-H bersifat polar, maka
ikatan itu dapat mengalami hidrolisis, sehingga melepas ion H+ dan larutannya
bersifat asam.
MOH → MO- + H+
Dari natrium ke klorin energi ionisasi bertambah. Oleh karena itu, sifat basa berkurang dan sifat asam bertambah. Sifat asam-basa unsur periode ketiga disimpulkan pada tabel 3.14
Titik Didih : 892 C
Apinya berwarna kuning, beroksidasi dalam udara, dan bereaksi kuat
dengan air, sehingga harus disimpan dalam minyak.
Karena sangat reaktif, natrium hampir tidak pernah ditemukan dalam
bentuk unsur murni.
Natrium mengapung di air, menguraikannya menjadi gas hidrogen dan
ion hidroksida. Jika digerus menjadi bubuk, natrium akan meledak dalam air secara spontan. Namun, biasanya ia tidak meledak di udara bersuhu di bawah 388 K.
Natrium juga bila dalam keadaan berikatan dengan ion OH- maka akan
membentuk basa kuat yaitu NaOH
Kegunaan :
• Dipakai dalam pebuatan ester
• NACl digunakan oleh hampir semua makhluk
• Na-benzoat dipakai dalam pengawetan makanan
• Na-glutamat dipakai untuk penyedap makanan
• Isi dari lampu kabut dalam kendaraan bermotor
• NAOH dipakai untuk membuat sabun, deterjen, kertas
• NAHCO3 dipakai sebagai pengembang kue
• Memurnikan logam K, Rb, Cs
Catatan :
Natrium Merupakan logam lunak, bewarna putih keperakan, reaktif
Bereaksi dengan cepat dengan air membentuk sodium hidroksida dan
hidrogen
Dapat bereaksi dengan Alkohol namun lebih lambat dibanding dengan
air
Tidak bereaksi terhadap nitrogen
Merupakan komponen terbesar kedua yang larut di air laut
Mudah ditemui pada sumber air alami
Dihasilkan dengan elektrolisis lelehan NaCl. Prosesnya disebut proses Downs, yaitu dengan menambah 58% CaCl2 dan KF pada elektrolisis lelehan NaCL. Tujuan penambahan untuk menurunkan titik
lebur NaCl hingga mencapai 550 C .
2. Magnesium
Magnesium umumnya dapat diperoleh melalui pengolahan air laut
sbg:
-Ca(OH)2 ditambahkan pada air laut agar meganesium mengendap
sebagai Mg(OH)2. Asam klorida kemudian ditambahkan sehingga
diperoleh kristal magnesium klorida Ca(OH)2(S) + Mg2+ è Mg(OH)2
(S) + Ca 2+
Mg(OH)2(s) + 2H+ + Cl-è MgCl2.6H2O
megnesium klorida, sebelum elektrolisis leburan kristal yang terbentuk ditambahkan magnesium klorida yang mengalami hidrolisis sebagian ke dalam campuran leburan natrium dan kalsium klorida
-Magnesium akan diperoleh pada katoda
sedangkan pada anoda akan terbentuk Cl2
- Sifat kimia
1) Reaksi dengan air
Bila Magnesium bereaksi dengan air maka kan menghasilkan larutan yang bersifat basa serta adanya pembebasan gas hidrogen.
Mg(s) + 2H2O(l) Mg(OH)2(aq) + H2(g)
2) Reaksi dengan Udara
Bila magnesium terbakar di udara maka akan menghasilkan padatan baru. 2Mg(s) + O2(g) MgO(s)
Dipakai pada proses produksi logam, kaca, dan semen
Untuk membuat konstruksi pesawat. Logamnya disebut magnalum Pemisah sulfur dari besi dan baja
Dipakai pada lempeng yang digunakan di industri percetakan Untuk membuat lampu kilat
Sebagai katalis reaksi organik
Catatan :
Banyak dipakai di industri karena ringan dan mampu membentuk aloi yang kuat
Termasuk unsur reaktif
Sebagian besar logam dapat dihasilkan dengan bantuan magnesium
Banyak ditemukan di alam dan dalam mineral : dolomite, magnetite,
olivine, serpentine teroksidasi. Karena sifat kereaktifannya maka Aluminium tidak ditemukan di alam dalam bentuk unsur melainkan dalam bentuk senyawa baik dalam bentuk oksida Alumina maupun Silikon.
v Sifat-sifat Aluminium yang lebih unggul bila dibandingkan dengan logam lain adalah sebagai berikut:
Ringan
Massa jenis Aluminium pada suhu kamar (29oC) sekitar 2,7 gr/cm3.
Kuat
Aluminium memiliki daya renggang 8 kg/mm3, tetapi daya ini dapat berubah menjadi lebih kuat dua kali lipat apabila Aluminium tersebut dikenakan proses pencairan atau roling. Aluminium juga menjadi lebih kuat dengan ditambahkan unsur-unsur lain seperti Mg, Zn, Mn, Si.
Ketahanan Terhadap Korosi
Aluminium adalah logam yang mempunyai daya tahan korosi yang lebih baik dibandingkan dengan besi dan baja lainnya.
Daya Hantar Listrik Yang Baik
Aluminium adalah logam yang paling ekonomis sebagai penghantar listrik karena massa jenisnya dari massa jenis tembaga, dimana kapasitas arus dari Aluminium kira-kira dua kali lipat dari kapasitas arus pada tembaga.
Anti Magnetis
Aluminium adalah logam yang anti magnetis.
Toksifitas
Aluminium adalah logam yang tidak beracun dan tidak berbau.
Kemudahan dalam proses
Aluminium mempunyai sifat yang baik untuk proses mekanik dari kemampuan perpanjangannya, hal ini dapat dilihat dari proses penuangan, pemotongan, pembengkokan, ekstrusi dan penempaan Aluminium
Sifat dapat dipakai kembali
Aluminium mempunyai titik lebur yang rendah, oleh karena itu kita dapat memperoleh kembali logam Aluminium dari scrap.
Kegunaan :
Untuk membuat logam hybrid yang dipakai pada pesawat luar angkasa Membuat berbagau alat masak
Menghasilkan permata bewarna-warni: Sapphire, Topaz, dll
Catatan :
Berupa logam lunak bewarna perak
Merupakan penghantar panas yang sangat baik da dapat menghantar
listrik
Sulit terkorosi karena membentuk lapisan oksida di permukaannya
Tidak beracun, non-magnetik dan sulit terbakar
Sumber utamanya adalah biji bauksit
Alumunium dapat diperoleh melalui proses Hall, yaitu:
Al2O3 (s) + 2NAOH (aq)è 2NaAIO2 (aq) + H2O
2NaAIO (aq) +HCL (aq) è Al(OH)3 + NaCl (aq)
Al(OH)3è Al2O3 (s) + 3H20
-Al2O3 yang diperoleh kemudian disaring dan dilelehkan baru kemudian dielektrolisis Anoda : 3O2- è O2(g) + 6e
Katoda : 2Al3 + 6e è 2Al
-Sebelum elektrolisis, ditambahkan kriolit (NaAIF6)
untuk menurunkan titik leleh AL2O3
4. Silikon
Struktur Atom : Kristal Kovalen raksasa
Wujud : Padat
Sifat kimia
Kegunaan :
Dipaki dalam pembuatan kaca
Terutama dipakai dalam pembuatan semi konduktor
Digunakan untuk membuat aloi bersama alumunium, magnesium, dan tembaga
Untuk membuat enamel Untuk membuat IC
Catatan :
Merupakan unsur elektropositif yang paling banyak dijumpai
Isotop alaminya terdiri atas isotop 28 (92,2%), isotop 29 (4,7%), isotop 30
(3,1%)
Memiliki sifat kimia seperti logam yang lain
Kemampuan semikonduktor akan meningkat jika ditambahkan pengotor
suhu
Ditemukan pada banyak senyawa dioksida dan berbagai macam silicate
Titik Lebur: 44 C
Berupa logam bewarna putih keperakan dan sangat ringan
Banyak dipakai di industri karena ringan dan mampu membentuk aloi yang
kuat
Termasuk unsur reaktif
Sebagian besar logam dapat dihasilkan dengan bantuan magnesium
Banyak ditemukan di alam dan dalam mineral : dolomite, magnetite,
olivine, serpentine
Senyawa yang terbentuk umumnya ikatan ion, namun ada juga berupa
ikatan kovalen
Kegunaan :
Dipakai pada proses produksi logam, kaca, dan semen
Untuk membuat konstruksi pesawat. Logamnya disebut magnalum
Pemisah sulfur dari besi dan baja
Dipakai pada lempeng yang digunakan di industri percetakan
Untuk membuat lampu kilat
Dipakai sebagai bahan dasar pembuatan asam sulfat
Digunakan dalam baterai
Dipakai pada fungisida dan pembuatan pupuk
Digunakan pada korek dan kembang api
Catatan :
-Zat murninya tidak berbau dan tidak berasa
-Memiliki struktur yang beragam, tergantung konsisi sekitar -Secara alami banyak terdapat di gunung berapi
-Komponen murninya tidak beracun namun senyawa yang terbentuk kebanyakan berbahaya bagi manusia
-Senyawa sulfur yang utama adalah SO2, dan SO3. SO2 berupa gas yang
mudah larut dalam air sehigga menyebabkan hujan asam -Efek yang ditimbulkan dapat sikurangi dengan cara
melewatkan air yang terkontaminasi pada padatan CaCO3.
SO3 merupakan bahan utama membuat asam sulfat
SO3 diperoleh dari oksidasi SO2 dengan katalis vanadium
7. Chlor
Dipakai pada proses pemurnian air
Cl2 dipakai pada disinfectan
KCl digunakan sebagai pupuk
ZnCl2 digunakan sebagai solder
NH4Cl digunakan sebagai pengisi batere
Digunakan untuk menghilangkan tinta dalam proses daur ulang kertas
Dipakai untuk membunuh bakteri pada air minum
Dipakai pada berbagai macam industri
Catatan :
Merupakan gas diatomik bewarna kehijauan
Termasuk gas yang beracun
Dalam bentuk padat dan cair merupakan oksidator yang kuat
Mudah bereaksi dengan unsur lain
Merupakan zat yang paling banyak terkandung di air laut
Terdapat juga dalam carnalite dan silvite
Diperoleh dengan cara mengelektrolisis larutan NaCl
8. Argon
Sifat fisis
Konfigurasi e- : [Ne] 3s2 3p 6
Sebagai pengisi bola lampu karena Argon tidak bereaksi dengan kawat
lampu
Dipakai dalam industri logam sebagai inert saat pemotongan dan proses
lainnya
Untuk membuat lapisan pelindung pada berbagai macam proses
Untuk mendeteksi sumber air tanah
Dipakai dalam roda mobil mewah
Catatan :
Merupakan gas yang tidak bewarna dan berasa
Tidak reaktif seperti halnya gas mulia yang lain
Dapat diperoleh dengan cara memaskan udarea dengan CaC2
Terdapat sekitar 1% argon di atmosfer
Terbentuk di atmosfer sebagai akibat dari proses sinar kosmik
Unsur-unsur transisi
A. Sifat-sifat umum transisi
Unsur transisi mempunyai sifat-sifat khas yang membedakannya dari unsur golongan utama, antara lain :
1. Sifat logam, semua unsur transisi tergolong logam dengan titik cair dan titik didih yang relatif tinggi.
2. Bersifat paramagnetik (sedikit tertarik kedalam medan magnet). 3. Membentuk senyawa-senyawa yang berwarna
4. Mempunyai beberapa tingkatan oksidasi 5. Membentuk berbagai macam ion kompleks
6. Berdaya katalitik, banyak unsur transisi atau senyawa yang berfungsi sebagai katalis, baik dalam proses industri maupun dalam metabolisme.
keluar medan magnet); dan senyawa-senyawanya tidak berwarna (putih). Zink hanya mempunyai satu tingkat oksidasi, yaitu +2.
Sifat-sifat khas unsur transisi tersebut dapat dijelaskan berdasarkan konfigurasin elektronnya. Sebagaimana dapat dilihat pada Gambar 3.8, unsur-unsur transisi periode keempat mengisi subkulit 3d, mulai dari d1
untuk skandium hingga d10 untuk zink. Perhatikan konfigurasi elektron dari
kromium dan tembaga yang mana subkulit 4s berisi satu elektron. Konfigurasi elektron kromium dan tembaga itu menunjukkan kestabilan subkulit d yang terisi penuh atau setengah penuh.
Sifat-sifat khas unsur transisi berkaitan dengan adanya subkulit d yang terisi tidak penuh. Oleh karena itu, ada pendapat yang mengatakan bahwa unsur transisi adalah unsur yang mempunyai subkulit d terisi tidak penuh paling tidak pada salah satu tingkat oksidasinya.semua unsur transisi periode keempat memenuhi definisi ini, kecuali zink. Pada tingkat oksidasi nol (sebagai unsur), maupun tingkat oksidasi +2 (satu-satunya tingkat oksidasi zink), subkulit 3d-nya terisi penuh :
Tembaga, meskipun pada tingkat oksidasi nol mengisi penuh subkulit 3d, namun pada tingkat oksidasi +2, terisi tidak penuh.
B. Sifat logam unsur transisi periode keempat
Semua unsur transisi periode keempat secara meyakinkan tergolong logam,baik dalam sifat kimia maupun sifat fisis. Sebagaimana dapat dilihat pada tabel 3.15, semua unsur transisi periode keempat mempunyai energi ionisasi yang relatif rendah (kurang dari 1.000 kJ mol-1)kecuali zink yang energi ionisasinya agaj besar (906 kJ mol-1). Sifat logam unsur transisi juga dicerminkan oleh nilai keelektronegatifannya yang rendah (kurang dari 2). Pada kenyataanya, semua unsur transisi periode keempat membentuk kation tunggak dengan bilangan oksidasi +1, +2, atau +3. Pada tingkat oksidasi rendah,senyawa unsur transisi bersifat ionik.
C. Sifat magnet
umumnya berifat paramagnetik. Feromagnetisme hanya diperlihatkan oleh beberapa logam, yaitu besi, kobal, dan nikel, serta logam-logam campur tertentu. Sifat magnet dari suatu zat dapat ditunjukkan dan diukur dengan neraca seperti pada Gambar 3.9. zat yang bersifat diamagnetik akan menunjukkan berat kurang, sedangkan yang bersifat paramagnetik menunjukkan berat lebih.
Sifat magnet zat berkaitan dengan konfigurasi elektronnya. Zat yang bersifat paramagnetik mempunyai setidaknya satu elektron tak berpasangan. Semakin banyak elektron tak berpasangan, semakin bersifat paramagnetik. Pengukuran sifat magnet dapat digunakan untuk menentukan jumlah elektron tak berpasangan dalam satu spesi.
D. Warna senyawa unsur transisi periode keempat
Pada umumnya unsur-unsur transisi periode keempat membentuk senyawa berwarna, baik dalam bentuk padat maupun dalam larutan.
Warna senyawa dari unsur transisi juga berkaitan dengan adanya subkulit d yang terisi tidak penuh. Senyawa dari Sc3+ dan Ti4+ tidak berwarna karena
subkulit 3d0nya kosong. Senyawa dari Zn2+ juga tidak berwarna karena subkulit
3d-nya terisi penuh.
E. Tingkat oksidasi unsur transisi periode keempat
Daftar pustaka
http://kuntar11.blogspot.co.id/2014/09/v-behaviorurldefaultvmlo.html