KIMIA FISIKA
1
ᴥ
Memahami sistem periodik
unsur
ᴥ
Memenuhi tugas kelompok
mata kuliah Kimia Fisika
Buku kimia untuk universitas,A.Hady
ana Pudjaatmaka Ph.D.)
PUSTAKA
PERKEMBANGAN SISTEM PERIODIK UNSUR
MENENTUKAN PERIODE DAN GOLONGAN SIFAT-SIFAT PERIODIK UNSUR
PENDAHULUAN
KESIMPULAN
1
SEJARAH SISTIM PERIODIK UNS
UR
2. NEWLANDS
3.
MENDELEEV
5. MODERN
4.LOTHAR MEYER
TRIADE (JOHAN DOBEREINER)
TAHUN 1829
Add an image
ᴥ Mengklasifikasikan unsur berdasarkan kemiripan s
ifat-sifatnya yang disebut sebagai Triad Doberain er.
ᴥ Setiap tiga unsur yang sifatnya mirip massa atom
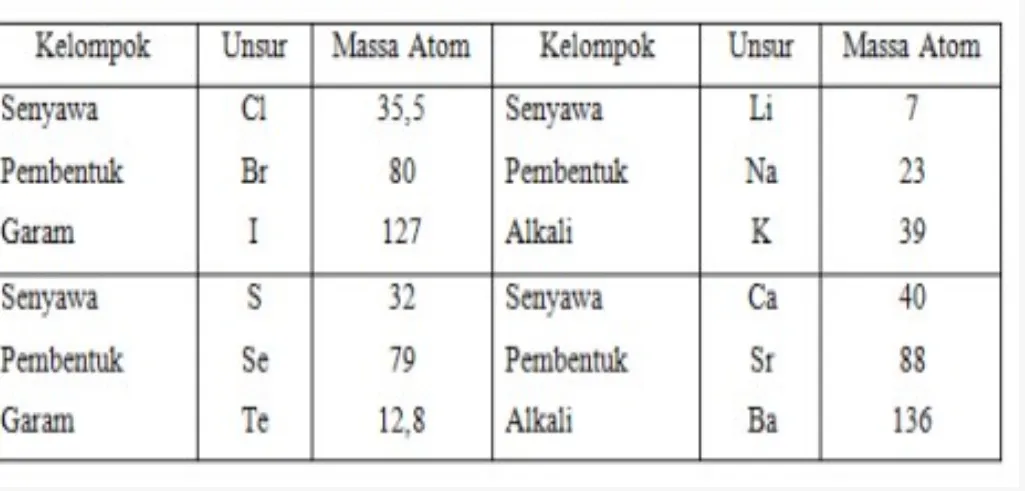
TABEL TRIADE DOBEREINER
TABEL PENGELOMPOKAN UNSUR UNSUR MENURUT TRIADE DOBEREIDER
KELEBIHAN
KEKURANGAN
Adanya keteratur
an setiap unsur ya
ng sifatnya mirip
masa atom (Ar) uns
ur yang kedua (ten
gah) merupakan mas
a atom rata-rata d
i masa atom unsur
pertama dan ketig
a.
HUKUM OKTAF NEWLANDS
TAHUN 1864
ᴥ
Unsur-unsur diurutkan berdasarkan kenaik
an massa atomnya , maka unsur yang berbe
da letak satu oktaf mempunyai sifat-sifa
t yang sangat mirip.
ᴥ
Karena setelah unsur kedelapan sifat-sif
atnya selalu terulang, maka dinamakan Hu
kum Oktaf atau Hukum Newlands.
KELEBIHAN
KEKURANGAN
Tidak memperhitungkan letak u
nsur-unsur yang belum ditemuk
an.
Terdapat banyak pasangan unsu
r yang terpaksa ditempatkan p
ada satu posisi daftar.
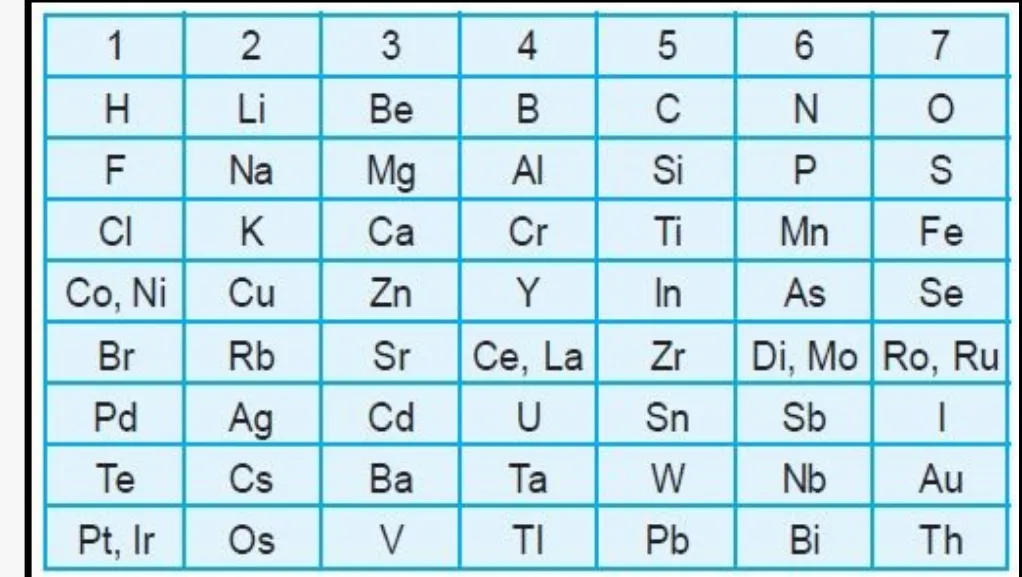
SISTEM PERIODIK PENDEK (MENDELEEV)
TAHUN 1869
Add an image
ᴥ
Mengelompokan unsur berdasarkan kenaikan
masa atom relative secara horisontal mem
bentuk baris yang disebut periode.
ᴥ
Penyusunan pada periode akan berhenti pad
a periode berikutnya jika terjadi pengula
an sifat unsur.
Valensi tertinggi suatu unsur s
ama dengan nomor golongannya. Beberapa unsur tidak disusun berdasar
kan kenaikan masa atomnya. Contoh : T e (128) sebelum I (127)
KELEBIHAN
KEKURANGAN
Dapat meramalkan si
fat unsur yang belu m ditemukan pada sa at itu.
Selisih masa unsur yang berurutan tidak selalu 2, tetapi berkisar antara 1 dan 4 sehingga suk ar meramalkan masa unsur yang belum diketahui secara tepat
Sifat kimia dan fisika unsur dalam satu go
longan mirip dan berubah secara teratur. Panjang periode tidak sama dan sebabnya tidak je
SISTEM PERIODIK UNSUR LOTHAR MEY
ER
TAHUN 1883
ᴥ
Sistem periodik berdasarkan massa
atom.
ᴥ
Sistem periodik pertama yang dibu
at berdasarkan kenaikan massa.
ᴥ
Pengelompokkan berdasarkan sifat
fisik unsur.
SISTEM PERIODIK MODERN
TAHUN 1913
ᴥ
Sering kita jumpai pada tabel per
iodik unsur.
ᴥ
Dalam tabel periodik unsur, susun
Add an image
2
CARA MENENTUKAN PERIODE DAN GOLONGAN
Pada dasarnya ditentukan menggunakan Prinsip Aufbau.
Prinsip Aufbau : Pengisian elektron dimulai dari tingkat ener gi terendah.
CATATAN!
S muatan maksimal 2
P muatan maksimal 6
D muatan maksimal 10
GOLONGAN
Add an image Add an image
Lajur vertikal disebut golongan.
Golongan disusun berdasarkan jumlah
elektron valensi (elektron pada kuli t terluar).
Unsur dalam satu golongan yang sama
cenderung memiliki sifat yang sama.
Golongan dibagi menjadi 2 yaitu :
GOLONGAN
Add an image Add an image
Golongan A disebut golongan uta ma.
• Unsur-unsur yang pengisian ele
ctron berakhir pada subkulit s atau p.
Struktur electron valensi = n s” np”
GOLONGAN
Add an image Add an image
Golongan B disebut golongan t
ransisi.
•
Unsur-unsur yang pengisian e
lectron berakhir pada subkul
it d.
Struktur electron valensi =
ns” (n-1) d”
PERIODE
Add an image
• Periode adalah unsur unsur yang b
erada pada 1 lajur horizontal.
• Periode ini didasarkan pada kenai
kan nomor atom atau pada kepemili kan jumlah kulit yang sama
Nomor perode = nomor kulit
terbesar
Periode = n
CARA MENENTUKAN PERIODE DAN GOLONGAN
CONTOH :
Unsur dengan nomor atom 11.
Konfigurasinya : 1s2 2s2 2p6 3s1
- n = 3, berarti periode 3 (kulit terakhir)
CARA MENENTUKAN PERIODE DAN GOLONGAN
CONTOH :
Unsur Sc dengan nomor atom 21.
Konfigurasinya : 1s2 2s2 2p6 3s2 3p6 4s2 3d1
- n = 4, berarti periode 4
- 4s2 3d1 berarti golongan IIIB.
CATATAN
UNTUK GOLONGAN B!!
Jika berjumlah 3: gol 3B, 4:gol 4B, 5:gol 5 B, 6:gol 6B, 7:gol 7B
CARA MENENTUKAN PERIODE DAN GOLONGAN
CONTOH :
Unsur Ce dengan nomor atom 58.
Konfigurasinya : 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹° 4p⁶ 5s² 4d¹° 5p⁶ 6s² 4f²
GOLONGAN LAKTINIDA DAN AKTINIDA
• Deret lantanida terdapat pada periode ke 6 dan
golongan III B, antara nomor 56 sampai 71
• Deret aktinida terdapat pada periode ke 7 dan
01
02
03
SIFAT GOLONGAN
ALKALI
Bereaksi hebat dengan
air dan termasuk loga
m yang ringan.
Dapat terbakar di u
dara
Sangat reaktif.
01
02
03
SIFAT GOLONGAN
ALKALI TANAH
Membentuk basa dengan senyawa lain
tetapi kurang larut dengan
air
Dapat ditemukan dal
am tanah
Mudah
terbakar, logam aktif, tetapi dengan ker
eaktifannya kurang
sehingga akan terbakar jika
01
02
03
04
SIFAT GOLONGAN HALOGEN
Keelektronegatifan tertinggi, jadi Hal ogen merupakan golongan paling non-log am.
Berwarna dan bersifat racun.
Unsur halogen umumnya berben tuk dwi-atom.
01
02
03
04
SIFAT GOLONGAN GAS MULIA
Keelektronegatifan tertinggi karena Haloge n merupakan golongan paling non-logam sehi ngga konfigurasi elektronnya yang terisi p enuh.
Energi ionisasinya yang sangat besar dan afinitas elektronnya yang sangat rendah, berupa gas.
Titik cair dan titik didih yang sangat rendah.
3
JARI-JARI ATOM & ENERG I IONISASI
AFINITAS ELEKTRO N
KEREAKTIFAN
LOGAM & NON LOGA M
KEELEKTRONEGATIF AN
TITIK DIDIH & TITK LELEH
JARI-JARI ATOM
Jarak dari inti atom ke orbital electron terl
uar yang stabil dalam suatu atom dalam keadaa n setimbang.
Jarak tersebut diukur dalam satuan pikometer
atau angstrom karena elektron-elektron senant iasa bergerak sehingga untuk mengukur jarak d ari inti atom amatlah sulit.
Jumlah kulit dan muatan inti atom menentukan
jari-jari atom.
Dalam suatu golongan dari atas ke bawah semak
in panjang
Dalam satu periode dari kiri ke kanan semakin
JARI-JARI ATOM
Dari kedua unsur Na dan Mg yang masing-masing mempunyai nomor atom 11 dan 12. Tentukan unsur yang memiliki jari – jari atom paling kecil.
Jawab:
11Na : 1s2, 2s2, 2p6, 3s1
Na terletak pada golongan I A dan periode 3
12Mg : 1s2, 2s2, 2p6, 3s2
Mg terletak pada golongan II A dan periode 3
Na dan Mg terletak pada periode yang sama yaitu 3.
Kedua unsur tersebut harus diurutkan ke samping kanan, yaitu: Na – Mg
Sifat jari – jari atom dari kiri ke kanan makin kecil.
Jadi, unsur Mg memiliki jari – jari atom paling kecil.
Source : smpsma.com
ENERGI IONISASI
• Energi Ionisasi adalah energi minimum yang diperlukan oleh atom netral dalam keadaan gas agar dapat melepaskan satu buah elektron pada kulit terluar.
• Untuk unsur golongan utama :
Dari kiri ke kanan dalam satu periode, energi ionisasi cenderung
semakin besar.
Dari atas ke bawah dalam golongan, energi ionisasi cenderung
ENERGI IONISASI
Berdasarkan tabel berikut, urutkan energi ionisasi unsur-unsur tersebut dalam suatu periode dari kiri ke kanan !
Jawaban :
T(738) < R(786) < Q(1012) < P(1251) < S(1521)
Karena dalam suatu periode dari kiri ke kanan, energi ionisasi cenderung semakin besar.
AFINITAS ELEKTRON
•
Afinitas elektron adalah besarnya energi yang
menyertai (dilepaskan/diserap) ketika suatu atom
dalam bentuk gas mengikat / menerima satu
elektron.
•
Y
(g) + 1e-
→
Y
-
(g)•
Unsur halogen memiliki afinitas elektron yang
besar sehingga paling mudah menerima elektron.
•
Unsur gas mulia memiliki afinitas paling kecil
sehingga sulit menerima elektron.
•
Afinitas elektron yang bertanda positif berarti
atom saat menyerap elektron memerlukan energi.
•
Afinitas elektron yang bertanda negatif berarti
AFINITAS ELEKTRON
• Memiliki pola sama dengan energi ionasi yaitu :
Dari kiri ke kanan dalam satu periode, afinitas elektron
cenderung semakin besar.
Dari atas ke bawah dalam golongan, afinitas electron
KEELEKTRONEGATIFAN
• Kelektronegatifan adalah kemampuan suatu atom untuk
menarik elektron dari atom lain.
• Diukur dengan menggunakan skala Pauling yang besarnya antara 0,7 (keelektronegatifan Cs) sampai 4 (keelektronegatifan F).
• Dalam satu periode (dari kiri ke kanan) harga keelektronegatifan semakin besar.
KEELEKTRONEGATIFAN
01
Afinitas elektron semakin kecil
02
Jari-jari atom semakin besar
03
Energi ionisasi semakin kecil
04
KEELEKTRONEGATIFAN
1.Jari-jari atom semakin kecil
2. Afinitas elektron semakin besar
3. Energi ionisasi semakin besar
4. Elektronegativitas semakin bes ar
KEELEKTRONEGATIFAN
CONTOH
SOAL
1. Tentukan unsur mana yang mempunyai keelektronegatifan yang lebih besar? Karbon(nomor atom= 6) dengan Oksigen (nomor atom=8)
KEELEKTRONEGATIFAN
CONTOH
SOAL
JAWAB :
2. Tentukan unsur mana yang mempunyai keelektronegatifan yang lebih besar? Fluorin (nomor atom=9) dengan Klorin(nomor atom=17)
• Fluorin mempunyai konfigurasi elektron F=2.7, terletak pada golongan VII A dan
periode 2
• Klorin mempunyai konfigurasi elektron Cl=2.8.7, terletak pada golongan VII A
dan periode 3
KELOGAMAN
o Logam (Bahasa Yunani: Metallon) adalah sebuah
unsur kimia yang siap membentuk ion (kation).
o Logam cenderung melepas atau membagi
elektron ketika bereaksi dengan unsur lain dan
masing-masing membentuk setidaknya satu basa oksida (bersifat ke elektropositifan).
o Logam dibedakan menjadi:
Logam Ferro : besi, baja, dan besi cor.
Logam Non Ferro : emas, perak dan timah.
o Logam (Bahasa Yunani: Metallon) adalah sebuah
unsur kimia yang siap membentuk ion (kation).
o Logam cenderung melepas atau membagi
elektron ketika bereaksi dengan unsur lain dan masing-masing membentuk setidaknya satu basa oksida (bersifat ke elektropositifan).
o Logam dibedakan menjadi:
Logam Ferro : besi, baja, dan besi cor.
Logam Non Ferro : emas, perak dan timah.
Sifat kelogaman dari kiri ke kanan semakin kecil
Massa jenis
yang tinggi
Memiliki titi
k didih dan t
itik lebur ya
ng tinggi
Memiliki sifa
t Meabilitas
dan Duktilita
s
Konduktor li
strik yang b
aik
Memiliki kond
uktivitas ter
mal yang ting
gi
UNSUR-UNSUR LOGAM
1. ALKALI :
Lithium (Li), Natrium (Na), Potassium (K), Rubidium (Rb), Cesium (Cs), Francium (Fr).
2. LOGAM ALKALI TANAH :
Beryllium (Be), Magnesium (Mg), Calcium (Ca), Strontium (Sr), Barium (Ba), Radium (Ra).
3. LOGAM TRANSISI : Lantanida dan Aktinida. 4. LOGAM LAINNYA :
NON LOGAM
• Kelompok unsur kimia yang bersifat elektronegatif, yaitu lebih sukar menarik
elektron valensi dari atom lain dari pada melepaskannya.
• Non logam mempunyai struktur terbuka.
• Dari kiri ke kanan pada tabel periodik sifat non logam semakin tinggi. • Dari atas ke bawah sifat non logam semakin kecil.
• Non logam dibagi menjadi non logam poliatomik, non logam diatomik, dan gas
mulia mono atomik.
1
2
3
4
5
ᴥ Tidak dapat memantulkan sinar
yang datang sehingga nonlog am tidak terlihat mengkilat.
Tidak dapat menghantarkan pana
s dan listrik sehingga diseb ut sebagai isolator.
Sangat rapuh sehingga tidak dapat
ditarik menjadi kabel atau dite mpa menjadi lembaran.
SIFAT-SIFAT NON LOGAM
• Densitas atau kepadatannya pun relatif rendah sehingga terasa
ringan jika dibawa.
Konduktivitas Termal, Titik didih
UNSUR-UNSUR NON LOGAM
1. HALOGEN :
Fluorine (F), Chlorine (Cl), Bromine (Br), Iodine (I), Astatine (At), Ununseptium (Uus).
2. GAS MULIA :
Helium (H), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe), Radon (Rn), Ununoctium (Uuo).
3. NONLOGAM LAINNYA :
METALOID
• Metaloid merupakan padatan rapuh yang menyerupai logam.
• Metaloid cenderung membagi elektron ketika bereaksi dengan un
sur lain, dan biasanya ditemukan secara alami dalam bentuk ga bungan.
• Sebagian besar metaloid adalah semikonduktor, serta mempunyai
METALOID
SIFAT
UNSUR
• Bersifat semi konduktor terhadap Listri
k
• Konduktivitas termal, titik lebur dan titi
k leleh yang cukup tinggi
• Memiliki struktur yang lebih terbuka.
1. Boron Alumunium : Boron (B)
KEREAKTIFAN
LOGAM
NON LOGAM
Reaktif artinya mudah bereaksi.
Kereaktifan suatu unsur ditentukan oleh jenis unsurnya.
• Makin kebawah makin reaktif
(makin mudah bereaksi), sebab makin mudah melepas elektron.
• Misal: kalium lebih reaktif
dibanding natrium.
- Cenderung membentuk ion positif
- Cenderung melepas elektron
- Energi ionisasi kecil
- Logam semakin reaktif jikamudah
melepas elektron
• Makin kebawah makin kurang
reaktif (makin sukar bereaksi), sebab makin sukar menangkap elektron.
• Misal: fluorin lebih reaktif
dibandingkan klorin.
cenderung membentuk ion negatif cenderung menangkap electron
keelektronegatifan besar
non logam makin reaktif jika mudah
Add an image
Add an image Add an image
TITIK DIDIH
• Dalam suatu periode, titik cair dan titik didih naik dari kiri ke kanan sampai golongan IV A, kemudian turun drastis.
• Titik cair dan titik didih terendah dimiliki oleh golongan VIII A. • Dalam suatu golongan, ternyata ada 2 jenis kecendrungan:
1. unsur-unsur golongan IA sampai IVA, titik cair dan titik rendah dari atas ke bawah.
TITIK LELEH
Satu golongan (atas ke bawah)
• Golongan I A sampai IV A dari atas ke bawah makin rendah tititk lelehnya
• Golongan V A sampai VIII A dari atas ke bawah titik leleh makin tinggi.
Satu periode (kiri ke kanan)
• Titik leleh makin bertambah
5
LOGAM –JARI JARI – EI + AE + EN +
LOGAM +
JARI JARI +
EI –
AE –
UNTUK LOGAM (IA, IIA, IIIA)
KEREAKTIFAN
TITIK LELEH DAN TITIK DIDIH
-+
+
-UNTUK NON LOGAM (IVA s.d VIIA)
KEREAKTIFAN
TITIK LELEH DAN
TITIK DIDIH
-+
Add an image Add an image
Add an image Add an image
Add an image
Add an image Add an image
Add an image Add an image
Thank You
Add an image