commit to user
DEGRADASI FOTOELEKTROKATALITIK METHYL ORANGE
PADA ELEKTRODA LAPIS TIPIS TiO2TERSENSITISASI
Disusun Oleh :
NOVITA PRAISTIA
M0308018
SKRIPSI
Diajukan untuk memenuhi sebagian persyaratan mendapatkan gelar
Sarjana Sains Kimia
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SEBELAS MARET
SURAKARTA
commit to user
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul “DEGRADASI FOTOELEKTROKATALITIK METHYL ORANGE PADA ELEKTRODA LAPIS TIPIS TiO2 TERSENSITISASI” belum pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi, dan sepanjang pengetahuan saya juga belum pernah ditulis atau dipublikasikan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, September 2012
commit to user
DEGRADASI FOTOELEKTROKATALITIK METHYL ORANGE
PADA ELEKTRODA LAPIS TIPIS TiO2TERSENSITISASI
NOVITA PRAISTIA
Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret
ABSTRAK
Telah dilakukan fotoelektrodegradasi methyl orange dengan menggunakan material fotokatalis TiO2 tersensitisasi kompleks Fe dengan ligan 1,10-fenantrolin, 2,2-bipiridin, dan 2,2-biquinoline-4,4-dicarboxylic acid. TiO2 disintesis melalui proses sol gel dengan bahan awal titanium (IV) tetraisopropoksida (TTiP) yang selanjutnya dilapistipiskan diatas plat indium tin oxide(ITO).
Penelitian ini bertujuan untuk mengetahui kinerja fotoelektroda ITO/TiO2/dye di daerah tampak yang meliputi pengaruh tegangan, lama penyinaran sinar tampak, pH larutan, dan konsentrasi larutan elektrolit NaCl. Identifikasi dan karakterisasi komposit dilakukan dengan spektrofotometer UV-Vis dan difraksi sinar X (XRD).
Hasil penelitian menunjukkan puncak karakteristik XRD TiO2 pada 2θ sebesar 25,35°; 37,90°; 48,10°; 54,15°; dan 54,95° yang merupakan hasil difraktogram kristal TiO2anatase. Karakteristik UV-Vis menunjukkan pergeseran panjang gelombang pada 516 nm. Kondisi optimum degradasi fotoelektrokatalitik methyl orange dengan fotokatalis lapis tipis ITO/TiO2/dye diperoleh pada tegangan -1V, pada pH 3 dengan waktu penyinaran sinar tampak selama 3 jam serta konsentrasi larutan elektrolit NaCl sebesar 1 M.
commit to user
Photoelectrocatalytic Degradation of Methyl Orange by Using Sensitized
TiO2Thin Layer Electrode
Novita Praistia
Department of Chemistry, Faculty of Mathematics and Science Sebelas Maret University
Abstract
Photoelectrodegradation of methyl orange using sensitized TiO2 photocatalyst material Fe complexes with ligands 1,10-phenanthroline, 2,2-bipyridine, and 2,2-biquinoline-4,4-dicarboxylic acid has been done. TiO2 has been synthesized by sol gel process with the starting material titanium (IV) tetraisopropoxide (TTiP) lined trimmed on indium tin oxide (ITO).
This study aims to determine the performance of ITO/TiO2/dye photoelectrode in visible area that includes the influence of voltage, the time of visible light irradiation given, the pH solution and electrolyte concentrations of NaCl solution. Identification and characterization of composites made with UV-Vis spectrophotometer and X-Ray Diffraction (XRD).
The results showed the characteristic XRD peaks of TiO2on 2θ 25.35°: 37.90°: 48.10°: 54.15°, and 54.95° which is the result of anatase TiO2 crystal difraktogram. Characteristics of UV-Vis showed a shift in wavelength at 516 nm. The optimum conditions photocatalyst photoelectrocatalytic degradation of methyl orange with a thin layer ITO/TiO2/dye obtained at the voltage -1V, at pH 3 with visible light irradiation time for 3 hours and the concentration of electrolyte solution of NaCl 1 M.
commit to user
MOTTO
“Cogito ergo sum”
(aku berpikir maka aku ada)
-Socrates-“Our greatest glory is not in never falling… but in rising every time we fall”
-Confucius-“Until you try, you don’t know what you can do”
James-commit to user
PERSEMBAHAN
Ku persembahkan karya kecilku ini untuk:
commit to user
KATA PENGANTAR
Puji syukur kepada Allah SWT atas segala limpahan nikmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penulisan skripsi ini. Shalawat dan salam senantiasa terlimpah curahkan kepada al-Mushthofa Sayyidinaa Muhammad, Rasulullah SAW dan para Sahabat serta Ahli Baitnya.
Skripsi yang berjudul “Degradasi Fotoelektrokatalitik Methyl Orange pada Elektroda Lapis Tipis TiO2 Tersensitisasi” ini disusun atas dukungan dari berbagai pihak, untuk itu penulis menyampaikan ucapan terima kasih kepada:
1. Bapak Prof. Ir. Ari Handono Ramelan, M.Sc, (Hons.) Ph.D selaku Dekan FMIPA UNS.
2. Bapak Dr. Eddy Heraldy, M.Si selaku Ketua Jurusan Kimia FMIPA UNS. 3. Dr. Sayekti Wahyuningsih, M.Si selaku pembimbing I, atas bimbingan,
dorongan, arahan, dan ilmu yang telah diberikan.
4. Candra Purnawan, M.Sc selaku pembimbing II, atas bimbingan, ilmu, dan wawasan tentang logika yang diberikan.
5. IF. Nurcahyo, M.Si selaku Ketua Lab. Kimia Dasar, FMIPA, Universitas Sebelas Maret, beserta laboran mbak Nanik dan mas Anang atas bantuannya selama di laboratorium kimia.
6. Dr. rer. nat. Atmanto Heru Wibowo, M.Si selaku Ketua Sub Lab. Kimia Pusat MIPA Universitas Sebelas Maret, beserta laboran (Mbak Retno, Pak Ken, Pak Baz, Mbak Wati, dkk).
7. Seluruh Dosen di Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret, atas ilmu yang telah diberikan.
8. Seluruh keluarga besar Kimia ‘08 yang telah banyak mengalami masa suka maupun duka bersama serta selalu membantu dan memberikan semangat dan menjadi tempat keluh kesah penulis.
9. Semua pihak yang tidak dapat penulis sebutkan satu persatu.
commit to user
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun dalam rangka untuk menyempurnakan skripsi ini. Akhir kata, semoga karya kecil ini dapat memberikan manfaat bagi ilmu pengetahuan dan bagi pembaca.
Wallahul Muwaffiq ilaa Aqwamith Thoriiq
Surakarta, September 2012
commit to user
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... ii
HALAMAN PERNYATAAN ... iii
ABSTRAK ... iv
ABSTRACT ... v
MOTTO ... vi
PERSEMBAHAN... vii
KATA PENGANTAR ... viii
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN... xvi
BAB I PENDAHULUAN ... 1
A. Latar Belakang Masalah... 1
B. Perumusan Masalah ... 3
1. Identifikasi Masalah ... 3
2. Batasan Masalah ... 6
3. Rumusan Masalah... 6
C. Tujuan Penelitian ... 7
D. Manfaat Penelitian ... 7
BAB II LANDASAN TEORI A. Tinjauan Pustaka... 8
1. Degradasi Fotoelektrokatalitik (Fotoelektrodegradasi) ... 8
2. Zat Warna ... 13
3. Semikonduktor Lapis Tipis TiO2... 14
4. Sensitisasi Semikonduktor ... 16
commit to user
6. Analisis... 19
a. Difraksi Sinar X... 19
b. Spektra UV-Vis ... 21
B. Kerangka Pemikiran... 22
C. Hipotesis... 24
BAB III METODOLOGI PENELITIAN ... 25
A. Metode Penelitian ... 25
B. Tempat dan Waktu Penelitian... 25
C. Alat dan Bahan ... 25
1. Alat-Alat yang Digunakan... 25
2. Bahan-Bahan yang Digunakan ... 26
D. Prosedur Penelitian ... 27
1. Pembuatan Elektroda ITO/TiO2-Fe dengan ligan 1,10-fenantrolin, 2,2-bipiridin dan2,2-biquinoline-4,4-dicarboxylic acid... 27
2. Pengukuran Proses Degradasi Fotoelektrokatalitik ... 27
a. Variasi Tegangan... 27
b. Variasi Waktu... 28
c. Variasi pH ... 28
d. Variasi Konsentrasi Elektrolit ... 29
3. Analisis Material Elektroda ... 29
E. Teknik Pengumpulan Data ... 29
1. Pengumpulan Data ... 29
2. Analisis Data... 30
BAB IV HASIL DAN PEMBAHASAN A. Sintesis dan Karakterisasi Titanium Dioksida (TiO2) ... 31
B. Sintesis dan Karakterisasi Dye... 32
commit to user
D. Degradasi Fotoelektrokatalitik Zat Warna Methyl Orange... 36
1. Degradasi Fotoelektrokatalitik Zat Warna Methyl Orange dengan Variasi Tegangan ... 36
2. Degradasi Fotoelektrokatalitik Zat Warna Methyl Orange dengan Variasi Waktu Penyinaran Sinar Tampak ... 41
3. Degradasi Fotoelektrokatalitik Zat Warna Methyl Orange dengan Variasi pH Larutan ... 42
4. Degradasi Fotoelektrokatalitik Zat Warna Methyl Orange dengan Variasi Konsentrasi NaCl ... 44
BAB V PENUTUP ... 46
A. Kesimpulan... 46
B. Saran... 46
commit to user
DAFTAR TABEL
Tabel 1. Nama dan sifat fisik methyl orange... 14 Tabel 2. Panjang gelombang maksimum FeCl2.4H2O, ligan bpy, ligan dcbq,
commit to user
DAFTAR GAMBAR
Gambar 1. Struktur kimia zat warna methyl orange... 14 Gambar 2. Skema fotosensitisasi partikel semikonduktor TiO2 (CB = pita
konduksi, VB = pita valensi), [M] dan [M]* ... 17 Gambar 3. Geometri TiO2 anatase yang berikatan dengan katekol. Ti(5)
menunjukkan ion Ti4+ pentakoordinat yang secara langsung mengikat katekol. Ti(6) menunjukkan ion Ti4+ heksakoordinat yang berdekatan dengan katekol ... 18 Gambar 4. Skema representasi dari transfer elektron antar muka setelah
penyerapan cahaya untuk cis-[Ru(dcbH2)2LL’] dengan beberapa ligan tambahan ... 19 Gambar 5. Spektra difraksi sinar X (XRD) TiO2hasil sintesis ... 32 Gambar 6. Spektroskopi UV-Vis pada kompleks Fe dengan tiga ligan
1,10-fenantrolin (phen), 2,2-bipiridin (bpy), dan 2,2-biquinoline-4,4-dicarboxylic acid(dcbq) ... 33 Gambar 7. Grafik ITO/TiO2/dye... 35 Gambar 8. Penurunan konsentrasi zat warna (%) dengan variasi tegangan
(waktu 3 jam, [NaCl] = 0,05 M, dan [methyl orange] = 5 ppm) ... 37 Gambar 9a. Skema sel fotoelektrokatalitik dengan potensial bias positif ... 37 Gambar 9b. Skema sel fotoelektrokatalitik dengan potensial bias negatif ... 39 Gambar 10. Grafik degradasi fotoelektrokatalitik methyl orange dengan
variasi tegangan... 41 Gambar 11. Penurunan konsentrasi zat warna dengan variasi waktu penyinaran
lampu halogen ([methyl orange] = 5 ppm, [NaCl] = 0,05 M, dan tegangan = -1V) ... 41 Gambar 12. Penurunan konsentrasi zat warna dengan variasi pH larutan
([methyl orange] = 5 ppm, [NaCl] = 0,05 M, tegangan = -1V, selama 3 jam) ... 42 Gambar 13. Beberapa struktur methyl orange(a) cationic form(b) zwitterionic
commit to user
commit to user
DAFTAR LAMPIRAN
Lampiran 1. Bagan Prosedur Kerja Sintesis dan Karakterisasi TiO2... 51
Lampiran 2. Bagan Prosedur Kerja Pembuatan Lapis Tipis TiO2... 52
Lampiran 3. Bagan Prosedur Kerja Sintesis dan Karakterisasi Dye... 53
Lampiran 4. Bagan Prosedur Kerja Sensitisasi dan Karakterisasi Dye... 54
Lampiran 5. Bagan Prosedur Kerja Aplikasi Material Semikonduktor ITO/TiO2/dye Hasil Sintesis untuk Degradasi Zat Warna Methyl Orange... 55
1. Degradasi Fotoelektrokatalitik Methyl OrangeVariasi Voltase55 2. Degradasi Fotoelektrokatalitik Methyl OrangeVariasi Waktu Penyinaran... 56
3. Degradasi Fotoelektrokatalitik Methyl Orange Variasi pH Larutan ... 57
4. Degradasi Fotoelektrokatalitik Methyl Orange Variasi Konsentrasi NaCl ... 58
Lampiran 6. Data Hasil Degradasi Fotoelektrokatalitik Methyl Orange dengan Variasi Voltase... 59
Lampiran 7. Data Hasil Degradasi Fotoelektrokatalitik Methyl Orange dengan Variasi Waktu Penyinaran Tampak ... 60
Lampiran 8. Data Hasil Degradasi Fotoelektrokatalitik Methyl Orange dengan Variasi pH Larutan... 61
Lampiran 9. Data Hasil Degradasi Fotoelektrokatalitik Methyl Orange dengan Variasi Konsentrasi NaCl... 62
Lampiran 10. Pola Difraksi Sinar X dari TiO2... 63
commit to user
BAB I
PENDAHULUAN
A. Latar Belakang
Industri tekstil merupakan industri yang memberikan kontribusi yang cukup besar pada pertumbuhan ekonomi nasional. Hal ini mengakibatkan buangan limbah industri tekstil juga cukup besar. Produksi tekstil melewati beberapa tahap proses yang semuanya berpotensi menghasilkan limbah, baik berupa limbah padat, gas, maupun cair. Limbah cair industri tekstil bersumber dari proses pewarnaan (dyeing), pencucian (washing), pengukuran (sizing), pencetakan (printing), dan penyempurnaan (finishing) (Atmajiet al., 1999). Dampak negatif industri tekstil terutama berasal dari proses pencelupan (dyeing). Limbah hasil pencelupan dapat mencemari lingkungan apabila air limbahnya langsung dibuang ke sungai atau selokan tanpa diolah terlebih dahulu. Warna limbah muncul karena adanya gugus kromofor dalam zat warna tekstil yang digunakan pada proses pencelupan. Zat warna methyl orange banyak digunakan dalam industri tekstil terutama sebagai pewarna kain pada proses pencelupan.
Secara khusus, beberapa peneliti telah memanfaatkan semikonduktor fotokatalis pada pengolahan limbah untuk mendegradasi zat warna. Metode degradasi yang biasa digunakan adalah fotodegradasi, elektrodegradasi, dan fotoelektrodegradasi. Houras (2000) melakukan penelitian tentang fotodegradasi oleh sinar matahari dengan menggunakan katalis TiO2. Hasilnya menunjukkan bahwa TiO2 mampu mendegradasi dan menghilangkan warna (decolorization) senyawa metilen biru pada temperatur kamar yang menghasilkan produk akhir berupa CO2, SO42-, NH4+, dan NO3-. Gunlazuardi (2001) melakukan fotoelektrodegradasi 10 ppm 2,4 diklorofenol menggunakan lapis tipis TiO2 dengan bahan penyangga logam dan sebagai counterelektroda dari batang nikel
krom dan disinari dengan lampu UV 10 W pada λ = 315-400 nm. Setelah waktu 4
jam didapatkan sekitar 30-45 % 2,4 diklorofenol bereaksi.
commit to user
modifikasi TiO2oleh dopingion logam dan fotosensitisasi oleh berbagai senyawa organik dan anorganik berwarna. Sehingga dapat memperpanjang fotorespon TiO2 di daerah tampak agar dapat digunakan untuk degradasi kontaminan organik berwarna dan polutan organik lainnya (Longo et al., 2003).Beberapa senyawa organik kromofor dan senyawa kompleks relevan berhasil digunakan sebagai fotosensitiser seperti: methylene blue and rhodamine B (Chatterjee and Mahata, 2002), 8-hydroxyquinoline (HOQ) (Chatterjee and Mahata, 2001), kompleks tris (4,4’-dicarboxy-2-2’–bipyridyl) ruthenium (II)(Cho and Choi, 2001), dan kompleks phthalocyanine(IIiev, 2002). Degradasi dengan menggunakan radiasi cahaya visibel dari senyawa-senyawa aromatis fenol, klorofenol, 1,2-dikloroetan, trikloroetilen dan surfaktan, seperti cetyl pyridinium chloride (CPC; kationik), sodium dodecylbenzene sulfonate (DBS, anionik) dan Triton-X 100 (netral) di dalam sistem pelarut air telah berhasil dilakukan menggunakan TiO2 yang dimodifikasi dengan methylene blue dan rhodamine B (Chatterjee and Mahata, 2002). Cho and Choi (2001) juga telah melakukan percobaan pemanfaatan TiO2 yang disensitisasi kompleks tris
(4,4’-dicarboxy-2-2’–bipyridyl) ruthenium (II)untuk degradasi CCl4 dengan radiasi cahaya visibel. Iliev (2002) melakukan fotooksidasi fenol dikatalisis TiO2termodifikasi kompleks
phthalocyaninemenggunakan radiasi tampak.
commit to user
diteliti sebelumnya, larut dalam pelarut polar, panjang gelombangnya pada daerah UV-Vis (Sokolowska, 1995).
Pada penelitian ini dilakukan fotoelektrodegradasi zat warna methyl orange pada elektroda lapis tipis TiO2 tersensitisasi dye Fe dengan ligan-ligan 1,10-fenantrolin, 2,2-bipiridin, dan 2,2-biquinoline-4,4-dicarboxylic acid menggunakan sumber radiasi tampak yang diperoleh dari lampu halogen 150 W.
B. Perumusan Masalah
1. Identifikasi Masalah
Metode preparasi katalis yang lazim digunakan antara lain extruding, tableting, sol gel, presipitasi, dan impregnasi (Xu et al., 1997; Bedja et al., 1995; Othmer, 1993). Impregnasi ini mencakup impregnasi basah dan impregnasi kering. Beberapa metode tersebut masing-masing memberikan hasil yang berbeda terhadap sifat-sifat material hasil sintesis. Selain itu, tingkat kesulitan dalam penerapan metode juga perlu dipertimbangkan. Oleh karena itu perlu dipilih suatu metode yang efektif dalam pembuatan lapis tipis ITO/TiO2 (ITO = indium tin
oxide).
Beberapa prekursor yang digunakan sebagai bahan awal pembuatan TiO2 antara lain larutan ammonium titanil oksalat (NH4)2TiO(C2O4)2H2O (Yamashinta
et al., 1999), titanium (IV) tetraisopropoksida (Ti-(O-C3H7)4) (Xu et al., 1999), Titanium (III) klorida, dan Titanium (IV) klorida (Ehrman et al., 1999). Ketersediaan prekursor merupakan salah satu yang harus dipertimbangkan. Berdasar pada hal ini, perlu dipilih satu prekursor yang tepat dalam pembuatan lapis tipis ITO/TiO2.
Beberapa metode dalam pembuatan lapis tipis antara lain split coating, doctor blade, dan spin coating. Teknik pembuatan lapis tipis dengan metode spin coating biasanya diaplikasikan untuk thin film, sedangkan untuk aplikasi solar celldigunakan metode split coatingdan doctor blade(Nening et al., 2010).
commit to user
logam transisi yang mampu berperan sebagai fotosensitiser merupakan kompleks logam yang memberikan warna akibat serapan senyawa kompleks di daerah tampak. Logam yang berada pada tingkat oksidasi rendah, mempunyai elektronegatifitas rendah, dan memiliki densitas elektron berlebih dapat menghasilkan transisi metal to ligand charge transfer (MLCT) yang akan memperkuat serapan di daerah tampak. Beberapa peneliti telah mensintesis kompleks sensitiser dengan logam Os(II), Cu(I), Re(I), Fe(II), dan Ir(III) (Whittle, 2001; Islam, 2001; Jayawera, 2001).
Beberapa senyawa organik kromofor dan senyawa kompleks relevan berhasil juga digunakan sebagai fotosensitiser yaitu: methylene blue dan rhodamine B (Chatterjee and Mahata, 2002), 8-hydroxyquinoline (HOQ) (Chatterjee and Mahata, 2001), kompleks tris (4,4’-dicarboxy-2-2’–bipyridyl) ruthenium (II)(Cho and Choi, 2001), dan kompleks phthalocyanine(IIiev, 2002). Degradasi dengan menggunakan radiasi cahaya visibel dari senyawa-senyawa aromatis fenol, klorofenol, 1,2-dikloroetan, trikloroetilen dan surfaktan, seperti cetyl pyridinium chloride (CPC; kationik), sodium dodecylbenzene sulfonate (DBS, anionik) dan Triton-X 100 (netral) di dalam sistem pelarut air telah berhasil dilakukan menggunakan TiO2 yang dimodifikasi dengan methylene blue dan
rhodamine B (Chatterjee and Mahata, 2002). Cho and Choi (2001) juga telah melakukan percobaan pemanfaatan TiO2 yang disensitisasi kompleks tris
(4,4’-dicarboxy-2-2’–bipyridyl) ruthenium (II) untuk degradasi CCl4 dengan radiasi cahaya visibel. Iliev (2002) melakukan fotooksidasi fenol dikatalisis TiO2 termodifikasi kompleks phthalocyaninemenggunakan radiasi tampak.
commit to user
1993:440) sehingga kurang berperanan dalam proses transfer elektron dari senyawa kompleks ke material semikonduktor.
Penggunaan material TiO2 sebagai semikonduktor fotokatalis banyak menggunakan kristal TiO2fase anatase. Telah banyak dilaporkan bahwa material TiO2dengan fase anatase memiliki fotorespon lebih baik dibandingkan fase rutile (Gunlazuardi, 2001). Kristalinitas bahan dan jenis kristal dapat karakterisasi dengan X-Ray Diffraction(XRD).
Sinar UV-Vis paling sering digunakan dalam fotodegradasi suatu zat, tetapi kurang merepresentasikan sinar matahari. Oleh karena itu, sinar tampak lebih direkomendasikan untuk proses degradasi fotoelektrokatalitik karena sinar tampak memiliki sifat-sifat dari sinar matahari.
commit to user
2. Batasan MasalahBerbagai permasalahan yang timbul dalam penelitian ini dibatasi sebagai berikut:
a. TiO2yang digunakan merupakan TiO2hasil sintesis dengan proses sol gel dan hidrotermal TTiP.
b. Pembuatan lapis tipis ITO/TiO2menggunakan metode split coating.
c. Sensitisasi plat ITO/TiO2dilakukan selama 24 jam direndam dalam kompleks
dye Fe dengan ligan 1,10-fenantrolin, 2,2-bipiridin, dan 2,2-biquinoline-4,4-dicarboxylic acid.
d. Degradasi fotoelektrokatalitik methyl orange dipengaruhi oleh beberapa parameter yaitu tegangan yang diberikan, lama penyinaran, pH, dan konsentrasi NaCl sebagai larutan elektrolit.
3. Rumusan Masalah
Berdasarkan latar belakang masalah di atas maka permasalahan yang akan diteliti dapat dirumuskan sebagai berikut:
a. Apakah dari material plat ITO/TiO2/dye hasil sintesis dari TTiP memiliki respon di daerah tampak?
b. Bagaimana pengaruh tegangan yang diberikan terhadap degradasi fotoelektrokatalitik zat warna methyl orange?
c. Bagaimana pengaruh lama penyinaran sinar tampak terhadap degradasi fotoelektrokatalitik methyl orange?
d. Bagaimana pengaruh pH larutan terhadap degradasi fotoelektrokatalitik methyl orange?
commit to user
C. Tujuan Penelitian
Sejalan dengan rumusan masalah yang telah dirumuskan di atas, maka tujuan penelitian ini adalah sebagai berikut:
1. Mengetahui respon fotoelektroda ITO/TiO2/dyehasil sintesis dari TTiP. 2. Mengetahui pengaruh tegangan terhadap degradasi fotoelektrokatalitik zat
warna methyl orange.
3. Mengetahui pengaruh lama penyinaran sinar tampak terhadap degradasi fotoelektrokatalitik zat warna methyl orange.
4. Mengetahui pengaruh pH larutan terhadap degradasi fotoelektrokatalitik zat warna methyl orange.
5. Mengetahui pengaruh konsentrasi larutan elektrolit NaCl terhadap degradasi fotoelektrokatalitik zat warna methyl orange.
D. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan alternatif penanganan masalah limbah industri tekstil menggunakan elektroda lapis tipis TiO2 tersensitisasi dye Fe dengan ligan 1,10-fenantrolin, 2,2-bipiridin, dan
2,2-biquinoline-4,4-dicarboxylic acid sehingga dapat dikembangkan untuk
commit to user
BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Degradasi Fotoelektrokatalitik (Fotoelektrodegradasi)
Fotokatalitik adalah suatu proses yang dibantu oleh adanya cahaya dan material katalis. Dengan pencahayaan ultra violet permukaan TiO2 mempunyai kemampuan menginisiasi reaksi kimiawi. Dalam media air, kebanyakan senyawa organik dapat dioksidasi menjadi karbondioksida dan air, berarti proses tersebut dapat membersihkan air dari pencemar organik. Senyawa-senyawa anorganik seperti sianida dan nitrit yang beracun dapat diubah menjadi senyawa lain yang relatif tidak beracun (Hoffmann et al., 1995).
Jika suatu semikonduktor tipe n dikenai cahaya (hν) dengan energi yang sesuai, maka elektron (e-) pada pita valensi akan pindah ke pita konduksi, dan meninggalkan lubang positif (hole, disingkat h+) pada pita valensi. Sebagian besar pasangan e-dan h+ akan berkombinasi kembali, baik di permukaan atau di dalam bulk partikel. Sementara itu sebagian pasangan e- dan h+ dapat bertahan sampai pada permukaan semikonduktor. Dimana h+ dapat menginisiasi reaksi oksidasi dan di lain pihak e-akan menginisiasi reaksi reduksi zat kimia yang ada di sekitar permukaan semikonduktor (Gunlazuardi, 2001).
Fenomena fotokatalitik pada permukaan TiO2dan kemungkinan aplikasi teknologinya menjadi lahan penelitian yang subur sampai saat ini. Luas jangkauan kemungkinan aplikasinya meliputi bidang-bidang: diversifikasi energi (fotoelectrochemical solar cell and water splitting), sintesa kimia organik (fotoelectrosyntesis), pengolahan limbah (water or gas detoxification and disinfection), pengembangan metode analis (TOC Analyzer, Selective Electrode), bidang kedokteran (anti cancer), dan bidang material (self cleaning glass and ceramics) (Hoffmann et al., 1995).
commit to user
suatu proses. Menurut He et al. (2003), penambahan anodik bias pada semikonduktor lapis tipis TiO2 menyebabkan pemisahan dari elektron tereksitasi dan hole dapat dipercepat. Elektrokatalitik merupakan bagian dari elektrokimia, prosesnya menggunakan prinsip elektrolisis dimana reaksi dapat terjadi bila diberi energi dari luar (reaksi tidak berjalan spontan).
Penyusun utama sel elektrokimia terdiri dari larutan elektrolit, elektroda, sirkuit luar, dan jembatan garam. Larutan elektrolit, merupakan larutan yang mampu menghantarkan aliran elektron, misalnya lelehan NaCl, larutan HCl, dan larutan KCl. Potensial akan terjadi selama ada pergerakan ion positif dan ion negatif, tetapi pergerakan atau kecepatan yang berbeda karena perbedaan ukuran antara ion positif dan negatif menimbulkan bagian yang lebih dominan positif dan sebaliknya, sehingga beda potensial terjadi karena perbedaan ukuran dan kecepatan ion bukan karena perbedaan konsentrasi, yang disebut junction potensial. Larutan elektrolit KCl memiliki ukuran ion K+ dan Cl- yang hampir sama besar sehingga kecepatan difusinya relatif sama, sehingga junction potensial dapat ditekan (Skoog, 1996). Elektroda adalah penghantar tempat listrik masuk ke dalam dan keluar dari zat-zat yang bereaksi. Elektroda dimana terjadi oksidasi disebut anoda dan elektroda yang mengalami reduksi disebut katoda. Dalam sirkuit luar elektron bergerak melalui kawat dari anoda menuju katoda. Elektron awalnya akan masuk ke katoda yang untuk melakukan reaksi reduksi, kemudian lewat jembatan garam menuju anoda. Anoda menghasilkan elektron yang mengalir kembali ke sirkuit luar dan begitu seterusnya. Jembatan garam diperlukan agar memungkinkan difusi ion-ion antara setengah sel kanan dan setengah sel kiri, sehingga larutan dapat bermuatan netral. Jembatan garam diisi larutan elektrolit yang tidak berubah secara kimia dalam proses itu seperti K2SO4, NaCl, KNO3, dan KCl.
commit to user
semikonduktor ZnO/Cu sebagai elektrokatalitik untuk menghasilkan chemical recycling dari CO2 yang bisa diaplikasikan untuk berbagai tujuan. Dengan fotoelektrokatalitik menggunakan lampu merkuri 500 W sebagai sumber sinar UV mampu memproduksi hidrogen dari air sekitar 26 l/h/m2. Sedangkan tanpa pemberian potensial listrik menghasilkan 0,075 – 0,42 l/h/m2. Aplikasi anodik bias potensial pada permukaan elektroda TiO2 yang dicelupkan dalam air mengurangi tingkat energi ferminya, dan karenanya menghasilkan pembentukan medan listrik di dekat interface pada daerah yang disebut sebagai lapisan deplesi. Level Fermi (Ef) merupakan level transisi yang tempatnya sedikit dibawah pita konduksi. Setiap elektron yang dipromosikan sebagai akibat tereksitasi oleh cahaya di daerah lapisan deplesi akan dipercepat bergerak ke dalam bulkmaterial dan selanjutnya dialirkan ke counterelektroda melalui sirkuit luar. Sebaliknya, h+ yang dihasilkan oleh cahaya disekitar lapisan deplesi akan dipercepat begerak ke permukaan dimana h+ akan bergerak bebas sebelum berrekombinasi di dalam semikonduktor. Oleh karenanya, jelas bahwa medan listrik akan secara signifikan meningkatkan pemisahan muatan, sehingga meningkatkan pembentukan radikal hidroksil, suatu fenomena yang diberi nama electric field enchancement effect field(efek peningkatan akibat medan listrik) (Gunlazuardi, 2001).
commit to user
penguraian zat warna berdasarkan penurunan absorbansi UV-Vis zat warna setelah degradasi.
Cahaya merupakan sumber energi foton. Radiasi cahaya dapat bersifat sebagai radiasi elektromagnetik yang memiliki sifat sebagai gelombang dan partikel. Pada saat terjadi interaksi antara cahaya dan materi, maka akan terjadi absorbsi energi oleh molekul yang terkena cahaya. Besarnya energi yang diabsorbsi tergantung pada panjang gelombang, intensitas radiasi, dan jenis ikatan kimia yang terdapat dalam molekul yang bersangkutan (Saraswati, 2003). Pada TiO2 energi gapnya (Eg = 3,0 eV untuk anatase dan Eg = 3,2 eV untuk rutile) sebanding dengan radiasi cahaya 388 nm yang merupakan daerah aktif UV pendek. Ao et al. (2004) melakukan fotodegradasi formaldehid menggunakan
TiO2 5% dengan lampu UV 6 W pada λ = 365. Pada jarak 14 cm dari larutan,
intensitas yang terukur sekitar 750 µW/cm2. Setelah 120 menit, formaldehid yang mampu terdegradasi sebesar 44,1 ppb. Sumber sinar matahari merupakan aplikasi praktis dan murah. Sinar matahari (sebagai sumber foton) dapat dimanfaatkan sebagai pengganti lampu UV, karena 10 % dari sinar matahari merupakan sinar UV (Linsebigler et al., 1995). Pada siang hari musim panas tak berawan dan dibawah sinar matahari langsung, intensitas sinar UV sekitar 120 mW/cm2 (Amemiya, 2004).
commit to user
Menurut Yu, J.C and L.Y.L. Chan (1998), proses fotodegradasi akan diawali dengan oksidasi ion OH- dari H2O membentuk radikal, setelah suatu semikonduktor (sebagai contoh adalah TiO2) menyerap cahaya membentuk hole. Mekanisme reaksi yang diusulkan adalah sebagai berikut:
TiO2 + hυ → h+TiO2 + e-TiO2
h+ + OH- → OH.
OH. + substrat→ produk
Reaksi fotoelektrodegradasi merupakan reaksi yang melibatkan cahaya (foton), aliran listrik dan katalis secara bersama-sama sehingga katalis ini dapat mempercepat fotoreaksi melalui interaksinya dengan substrat baik dalam keadaan dasar atau dalam keadaan tereksitasi. Gunlazuardi (2001) melakukan fotoelektrodegradasi 10 ppm 2,4-diklorofenol menggunakan lapis tipis TiO2 dengan bahan penyangga logam dan sebagai counterelektroda dari batang nikel
krom dan disinari dengan lampu UV 10 W pada λ = 315 – 400 nm. Setelah waktu
4 jam didapatkan sekitar 30 – 45 % 2,4-diklorofenol bereaksi. He et al. (2003) mendegradasi zat warna acid orange II menggunakan semikonduktor Ag-TiO2/ITO. Ternyata dengan metode elektrodegradasi didapatkan efisiensi degradasi yang lebih tinggi dibandingkan hanya dengan proses fotodegradasi. Dengan pemberian anodik bias pada lapis tipis TiO2 maka pemisahan dari elektron tereksitasi dan hole dapat dipercepat. External anodik bias pada illuminasi lapis tipis TiO2 yang ditempeli logam tidak hanya dapat memisahkan penangkapan elektron di pita konduksi dari proses oksidasi, tetapi juga dapat mengurangi elektron terakumulasi pada partikel logam, mengurangi rekombinasi holedan elektron serta memisahkan sisi reduksi dan oksidasi. Fujishima and Rao (1998) mengusulkan mekanisme reaksi elektrokatalitik pada anoda dan katoda settingalat water splittingsebagai berikut:
commit to user
2. Zat WarnaMolekul zat warna merupakan gabungan dari zat organik tidak jenuh dengan kromofor sebagai pembawa warna dan auksokrom sebagai pengikat warna dengan serat. Zat organik tidak jenuh yang dijumpai dalam pembentukan zat warna adalah senyawa aromatik antara lain senyawa hidrokarbon aromatik dan turunannya, fenol dan turunannya serta senyawa-senyawa hidrokarbon yang mengandung nitrogen. Gugus kromofor adalah gugus yang menyebabkan molekul menjadi berwarna.
Zat warna banyak digunakan dalam berbagai industri termasuk industri tekstil. Zat warna pada dasarnya adalah racun bagi tubuh manusia, meskipun ada zat warna tertentu yang relatif aman bagi manusia yaitu zat warna yang digunakan dalam industri pangan dan farmasi. Penggolongan zat warna berdasarkan pada sifat-sifat dan penggunaannya yaitu zat warna asam, basa, direct, mordan, komplek logam, azoat, belerang, bejana, dispersi, dan reaktif (Isminingsih et al., 1982).
Zat warna adalah senyawa organik berwarna yang digunakan untuk memberi warna ke suatu objek atau suatu kain. Proses terjadinya warna yang paling umum adalah adanya absorpsi cahaya dari panjang gelombang tertentu oleh suatu zat. Senyawa organik dengan konjugasi yang tinggi dapat menyerap cahaya pada panjang gelombang sekitar 4000 Å. Warna juga dapat terbentuk dari senyawa organometalik ataupun senyawa anorganik komplek. Zat warna tekstil/batik mempunyai sifat sulit diuraikan oleh bakteri biasa ataupun panas. Oleh karena itu kadar zat warna yang tinggi dalam perairan dapat mempengaruhi kehidupan air (Sugiharto, 1987:25).
commit to user
Methyl orange merupakan zat warna anionik azo. Methyl orangeadalah indikator pH yang biasanya digunakan pada titrasi. Methyl orange biasa digunakan pada titrasi karena perubahan warnanya yang jelas. Karena methyl orange dapat merubah warna pada pH asam kuat, maka biasa digunakan untuk titrasi asam. Methyl orange yang termasuk dalam zat warna azo, dalam jumlah besar bersifat toksik, karsinogenik. Struktur methyl orangeseperti pada Gambar 1.
Na+
Gambar 1. Struktur kimia zat warna methyl orange
Tabel 1. Nama dan sifat fisik methyl orange Berat molekul: 327.33 g/mol
Rumus molekul:
Nama kimia: 4-dimethylaminoazobenzene-4'-sulfonic acid sodium salt
Nama lain:
p-dimethylamino-azobenzenesulfonic acid
3. Semikonduktor Lapis Tipis TiO2
commit to user
juga bersifat non toksik, murah, dan memiliki sifat redoks yaitu mampu mengoksidasi polutan organik dan mereduksi sejumlah ion logam dalam larutan serta tersedia secara komersial dan preparasinya mudah dilakukan di laboratorium. Sifatnya yang anorganik menjadikannya tidak cepat rusak sehingga proses yang diinginkan dapat lebih lama dan relatif menekan biaya operasional (Xu et al., 1999). Berdasarkan sifat-sifat itulah TiO2 dipandang sebagai semikonduktor katalis yang paling tepat mengoksidasi atau mereduksi polutan organik. Efisiensi fotokatalitik TiO2sangat besar dipengaruhi oleh struktur kristal, ukuran partikel, luas permukaan, dan porositas yang berbeda-beda tergantung dari metode preparasinya. Bentuknya yang serbuk menyebabkannya mempunyai luas muka yang besar sehingga efektif sebagai katalis maupun catalyst support. Cara paling nyata untuk memperbaiki efisiensi fotokatalitik reaksi oksidasi adalah dengan meningkatkan luas muka fotokatalis. Secara praktek dibutuhkan partikel-partikel kecil TiO2 dengan luas muka yang tinggi yang cocok pada support inert sehingga mudah untuk mendapatkan kembali effluent yang diolah. Solusi alternatifnya adalah dengan mendukungkan partikel TiO2 pada material-material berpori dengan ukuran partikel yang tepat dan ini telah diteliti terhadap silica gel, karbon aktif, pasir, lempung, dan zeolit (Xu et al., 1999). Rahmawati dan Masykur (2003) melakukan penempelan TiO2 teknis pada permukaan grafit dan terbukti mampu bertindak sebagai fotokatalis pada degradasi warna larutan tetraetil amonium iodide dan I2 dalam asetonitril pada pemberian sinar dengan panjang gelombang pada kisaran UV-Vis.
commit to user
sebagai solar sel maupun fotokatalis dalam degradasi senyawa kimia berbahaya. Pembuatan lapis tipis semikonduktor pada suatu substrat merupakan inovasi untuk mendapatkan semikonduktor fotokatalis yang mudah ditangani dalam aplikasi fotokatalitik (dalam arti tidak mengalami kesulitan pemisahan semikonduktor dari larutan yang didegradasi) sehingga memungkinkan penggunaan lebih dari satu kali karena pencucian mudah dilakukan.
Rahmawati et al. (2006) melakukan sintesis material semikonduktor lapis tipis grafit/TiO2 menggunakan metode chemical bath deposition (deposisi dari larutan kimia) menggunakan surfaktan CTABr sebagai agen penghubung antar antara substrat grafit dengan material TiO2 yang terbentuk dari hidrolisis TiCl4. Variasi konsentrasi surfaktan CTABr yang digunakan adalah 4, 8, 12, dan 19.10 -3
M dengan variasi waktu perendaman selama 2, 3, 4 hari dengan pemanasan yang kontinyu pada suhu 60 °C kemudian dikalsinasi 450 °C selama 4 jam. Konsentrasi CTABr 16.10-3M dan waktu perendaman 4 hari ini merupakan kondisi optimal pada deposisi TiO2, hal ini ditunjukkan dari efisiensi konversi foton ke arus listrik yang menunjukkan efektivitas sifat fotokatalitik semikonduktor (%IPCE: Include Photon to Current Efficiency) paling tinggi sebesar 3,261.10 -2%.
Semikonduktor TiO2 dengan energi gap lebar (3,2 eV; λg = 388 nm) memiliki makrostruktur yang relatif rigid. Keterbatasan yang dimiliki oleh TiO2 ini dapat diperbaiki dengan cara memodifikasinya. Modifikasi material semikonduktor TiO2 merupakan upaya peningkatan efektivitas fotokatalitik semikonduktor, pencegahan rekombinasi electron-hole sehingga meningkatkan efisiensi konversi foton ke arus listrik (% IPCE: Induced Photon to Current Efficiency) dan peningkatan stabilitas fotokimia.
4. Sensitisasi Semikonduktor
commit to user
meningkatkan kisaran respon panjang gelombang pada daerah tampak dari bahan semikonduktor rekaan. Perubahan mekanisme perpindahan elektron yang terjadi dengan penambahan bahan sensitiser adalah induksi elektron berasal dari ligan dari proses MLCT atau MMLL’CT pada sensitiser. Ketika elektron diinjeksikan ke material TiO2, berarti ada sebuah elektron yang ditransfer keluar dari atom logam pusat. Mekanisme tersebut mirip dengan MLCT pada keadaan tereksitasi (Asbury et al., 2000 ).
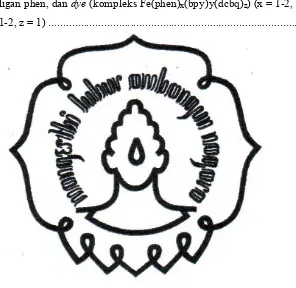
Mekanisme yang terjadi pada proses sensitisasi dari sensitiser ke material semikonduktor ditunjukkan pada Gambar 2, diawali dengan serapan cahaya tampak oleh sensitiser menyebabkan eksitasi elektron dari senyawa kompleks [M] pada keadaan ground statemenuju ke [M]*, [M]* menggambarkan tingkat energi orbital σ* atau π* dari ligan L, kemudian elektron tereksitasi tersebut akan diinjeksikan ke CB semikonduktor karena perbedaan tingkat energi keadaan terksitasi dan pita konduksi dari material kecil serta berdekatannya orbital anti bondingligan dengan pita konduksi material.
Elektron yang terkumpul pada pita konduksi TiO2 dapat mengalami beberapa alternatif mekanisme, misalnya elektron tereksitasi tersebut dapat didonorkan untuk mereduksi suatu akseptor elektron, atau dapat didonorkan ke sebuah lubang (hole) dan dapat juga menghasilkan arus listrik. Jadi pada sensitisasi TiO2 terjadi penginjeksian elektron dari senyawa sensitiser yang memiliki tingkat energi tereksitasi lebih tinggi dibandingkan dengan pita konduksi dari TiO2.
commit to user
Gambar 2 menggambarkan tingkat energi senyawa kompleks pada keadaan dasar dan pada keadaan tereksitasi. Eksitasi elektron menghasilkan kompleks tereksitasi, [M]+, kemudian elektron tereksitasi dapat mengalami sensitisasi ke CB dari TiO2.
Vinodgopal et al., 1995, telah berhasil menunjukkan adanya proses injeksi muatan dari tingkat energi keadaan tereksitasi sensitiser ke partikel semikonduktor dengan konstanta laju pada daerah 5,5 x 108 s-1 sampai dengan 1,0 x 108s-1pada bahan semikonduktor TiO2dengan sensitiser Ru(bpy)2-dcbpy)2+ (dcbpy = 4-4’-dikarboksi-2,2’-bipiridin).
5. Model Pengikatan TiO2dengan Dye
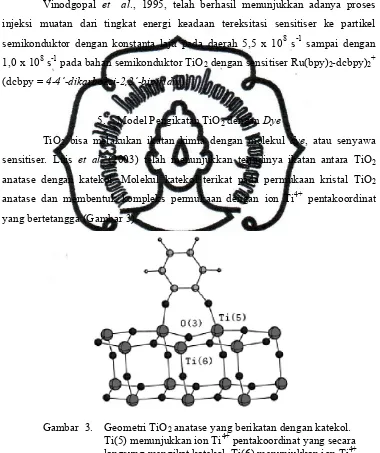
TiO2 bisa melakukan ikatan kimia dengan molekul dye, atau senyawa sensitiser. Luis et al. (2003) telah menunjukkan terjadinya ikatan antara TiO2 anatase dengan katekol. Molekul katekol terikat pada permukaan kristal TiO2 anatase dan membentuk kompleks permukaan dengan ion Ti4+ pentakoordinat yang bertetangga (Gambar 3).
Gambar 3. Geometri TiO2anatase yang berikatan dengan katekol. Ti(5) menunjukkan ion Ti4+pentakoordinat yang secara langsung mengikat katekol. Ti(6) menunjukkan ion Ti4+ heksakoordinat yang berdekatan dengan katekol.
commit to user
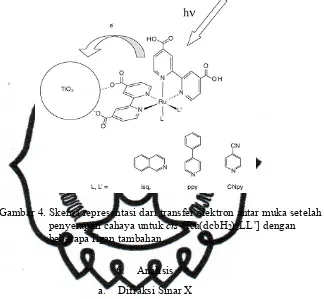
pada ligan bpy senyawa dye bereaksi spontan dengan gugus hidroksil permukaan pada permukaan TiO2 membentuk senyawa ester, sehingga terjadi ikatan yang stabil antara dyedan TiO2.
Gambar 4. Skema representasi dari transfer elektron antar muka setelah penyerapan cahaya untukcis-[Ru(dcbH2)2LL’] dengan beberapa ligan tambahan.
6. Analisis a. Difraksi Sinar X
Sinar X merupakan gelombang elektromagnetik dengan panjang
gelombang (λ) khas sebesar 0,1 nm. Bila elektron-elektron dari suatu kawat pijar
yang dipanasi dipercepat melalui suatu perbedaan potensial yang besar dan diperbolehkan menumbuk suatu sasaran logam di dalam sebuah tabung sinar X
maka sinar X dihasilkan dengan suatu distribusi λ yang kontinyu. Jika sinar X itu
commit to user
sinar pantul, maka perbedaan lintasan antara gelombang tersebut sebanding
dengan nλ. Sehingga menjadi persamaan Bragg’s (Persamaan 1):
2 d sin θ = n λ ………(1)
Keterangan : d = Jarak interplanar atau interatom (nm)
λ = Panjang gelombang logam standar (nm)
θ = Kisi difraksi sinar X (West, 1984)
Difraksi sinar X atau biasa disebut XRD merupakan alat yang digunakan untuk mengetahui pengaturan atom-atom dalam sebuah tingkat molekul. Pengaturan atom-atom tersebut dapat diinterpretasikan melalui analisa d spacing dari data difraksi sinar X. Nilai d spacingsangat tergantung pada pengaturan atom dan struktur jaringan polimer dalam material. Selain nilai d spacing, observasi tingkat kristalinitas bahan dan perubahan struktur mesopori dapat pula diketahui melalui data difraksi sinar X. Puncak yang melebar menunjukkan kristalinitas rendah (amorf), sedangkan puncak yang meruncing menunjukkan kristalinitas yang lebih baik (Park, N.G.et al., 2002).
Difraksi sinar X sangat penting pada identifikasi senyawa kristalin. Kekuatan dari cahaya yang terdifraksi tergantung pada kuantitas material kristalin yang sesuai di dalam sampel sehingga sangat mungkin mendapatkan analisa kuantitatif dari sejumlah relatif konstituen dari campuran senyawa padatan (Ewing, 1960). Suatu zat selalu memberikan pola difraksi yang khas. Apakah zat itu dalam keadaan murni atau merupakan campuran zat. Hal ini merupakan dasar dari analisa kualitatif secara difraksi. Sedangkan analisa kuantitatif berdasarkan intensitas garis difraksi yang sesuai dengan salah satu komponen campuran bergantung pada perbandingan konstituen tersebut. Hanawalt dalam tahun 1936 membuat kumpulan pola difraksi dari sejumlah zat yang diketahui. Setiap pola
bubuk dikarakterisasi oleh kedudukan garis 2θ dan intensitas (I) tetapi karena
commit to user
Langkah-langkah yang ditempuh dalam analisa kualitatif adalah sebagai berikut:
1. Membuat pola difraksi dari zat yang tidak diketahui.
2. Menghitung nilai d setiap garis atau dengan menggunakan tabel yang
memberikan hubungan antara d dan 2θ untuk berbagai karakteristik.
3. Memandang data d eksperimental dengan data d dari tabel dengan kemungkinan kesalahan dalam setiap set nilai adalah ± 0,02 Å.
4. Membandingkan intensitas relatifnya dengan nilai-nilai yang ada pada tabel (standar).
b. Spektra UV-Vis
Pada spektrofotometer UV, sinar kontinyu dihasilkan oleh lampu awan muatan hydrogen atau deuterium (D2), sedangkan sinar tampak dihasilkan oleh lampu Wolfram. Panjang gelombang UV-Vis jauh lebih pendek daripada panjang gelombang radiasi IR. Panjang gelombang UV-Vis berada pada kisaran 180-800 nm.
Prinsip dasar spektroskopi UV-Vis adalah terjadinya transisi elektronik yang disebabkan penyerapan sinar UV-Vis yang mampu mengeksitasi elektron dari orbital yang kosong. Umumnya, transisi yang paling mungkin adalah transisi pada tingkat tertinggi (HOMO) ke orbital molekul yang kosong pada tingkat terendah (LUMO). Pada sebagian besar molekul, orbital molekul terisi pada tingkat energi terendah adalah orbital σ yang berhubungan dengan ikatan σ,
sedangkan orbital π berada pada tingkat energi yang lebih tinggi. Orbital non
ikatan (n) yang mengandung elektron-elektron yang belum berpasangan berada pada tingkat energi yang lebih tinggi lagi, sedangkan orbital-orbital anti ikatan
yang kosong yaitu σ* dan π* menempati tingkat energi yang tertinggi.
commit to user
promosi elektron akan menyerap pada panjang gelombang yang lebih pendek. Molekul yang memerlukan energi yang lebih sedikit akan menyerap pada panjang gelombang yang lebih panjang. Senyawa yang menyerap cahaya pada daerah tampak (yaitu senyawa yang berwarna) mempunyai elektron yang lebih mudah dipromosikan daripada senyawa yang menyerap pada panjang gelombang UV yang lebih pendek.
Terdapat dua jenis pergeseran pada spektra UV-Vis, yaitu pergeseran ke panjang gelombang yang lebih besar disebut pergeseran merah (red shift), yaitu menuju tingkat energi lebih rendah, dan pergeseran ke panjang gelombang yang lebih pendek disebut pergeseran biru (blue shift), yaitu menuju ke tingkat energi yang lebih tinggi (Hendayana, 1994).
Intensitas penyerapan dijelaskan dengan hukum lambert-beer, dimana fraksi cahaya yang diabsorbsi tidak tergantung pada kekuatan sumber cahaya mula-mula dan fraksi yang diabsorbsi tergantung pada banyaknya mol (ketebalan/konsentrasi) yang dapat mengabsorbsi. Oleh karena itu absorbsi cahaya merupakan fungsi dari molekul yang mengabsorbsi, maka cara yang tepat untuk menyatakan absorbansi adalah:
A = ε b C………(2)
Dimana: ε= absorptivitas molar (mol-1cm-1L) b = tebal lintasan (cm)
C = konsentrasi larutan (mol L-1)
Dengan menggunakan metode kurva kalibrasi, yaitu dengan membuat grafik absorbansi versus konsentrasi dapat diperoleh suatu kurva linier. Melalui pengukuran absorbansi suatu sampel dan menginterpolasikannya ke kurva kalibrasi, maka konsentrasi sampel dapat ditentukan (Underwood, A.L. dan R.A. Day, 1981).
B. Kerangka Pemikiran
commit to user
seluruh cahaya matahari (gap energi TiO2 sekitar 3,2 eV, sebanding dengan cahaya 388 nm). Pada aplikasi visible like photocatalytic, dilakukan sensitisasi TiO2 yaitu dengan senyawa berwarna, baik dari senyawa organik ataupun senyawa anorganik. Sensitiser dari senyawa kompleks memiliki kelebihan yaitu lebih stabil dan transisi elektronik MLCT dapat terjadi disamping transisi π ke π* sehingga dapat menginisiasi transfer elektron ke pita konduksi material TiO2. Kombinasi material TiO2 dengan senyawa kompleks melibatkan transisi elektronik dari senyawa kompleks. Senyawa kompleks berwarna memiliki transisi di daerah tampak. Jadi, penambahan senyawa kompleks pada permukaan TiO2 akan meningkatkan respon TiO2 di daerah tampak. TiO2 yang tersensitisasi dye, seperti halnya TiO2 sendiri, memiliki sifat fotokatalitik. Keberadaan dye pada TiO2 mengubah karakter fotokatalitik TiO2 menjadi fotokatalis yang bekerja di daerah tampak.
commit to user
proses degradasi fotoelektrokatalitik zat warna methyl orange. Spesiasi substrat kationik/anionik dipengaruhi oleh pH. Zat warna methyl orange memiliki gugus sulfonat di dalam strukturnya, yang spesiasinya dipengaruhi oleh pH sistem. Pada pH rendah gugus sulfonat ada sebagai -SO3H2, Pada pH netral ada sebagai -SO3H dan pada pH tinggi ada sebagai -SO32-. Muatan netto dari methyl orange mempengaruhi mobilitas methyl orange menuju anoda atau katoda. Pengaruh keadaan larutan elektrolit sistem terhadap degradasi fotoelektrokatalitik zat warna methyl orange yaitu semakin besar konsentrasi NaCl yang digunakan, semakin kurang aktivitas elektrolitnya. Hal ini disebabkan karena persebaran bulk material dari NaCl yang terlalu besar sehingga mempengaruhi degradasi fotoelektrokatalitik zat warna methyl orange.
C. Hipotesis
1. Material plat ITO/TiO2-dyememiliki respon di daerah tampak.
2. Semakin negatif tegangan yang diberikan maka semakin banyak penurunan konsentrasi methyl orange.
3. Semakin lama penyinaran sinar tampak, degradasi fotoelektrokatalitik methyl orangesemakin besar.
4. Semakin ekstrim pH asam maka semakin banyak penurunan konsentrasi methyl orange.
commit to user
BAB III
METODOLOGI PENELITIAN
A. Metode Penelitian
Metode penelitian yang dilakukan adalah metode eksperimen secara kualitatif dan kuantitatif. Penelitian tersebut menjelaskan proses degradasi fotoelektrokatalitik dye anionik (methyl orange) pada elektroda ITO/TiO2-Fe dengan ligan 1,10-fenantrolin, 2,2-bipiridin, dan 2,2-biquinoline-4,4-dicarboxylic acidmenggunakan sumber radiasi tampak yang diperoleh dari lampu halogen 150 W.
Analisa kuantitatif yang dilakukan menggunakan spektrometer UV-Vis untuk melihat hubungan konsentrasi lawan waktu sedangkan spektra UV-Vis diukur untuk melihat perubahan spektra sensitiser dyemaupun substrat dyeselama proses fotoelektrodegradasi.
B. Tempat dan Waktu Pelaksanaan
Eksperimen penelitian dilakukan di Sub Laboratorium kimia UPT Laboratorium Pusat Universitas Sebelas Maret dan di Laboratorium Kimia Dasar FMIPA Universitas Sebelas Maret, mulai bulan Desember 2011 – Juli 2012.
C. Alat dan Bahan
1. Alat
Peralatan yang digunakan dalam penelitian ini adalah: a. Peralatan gelas dan plastik dari Pyrex dan Duran
b. Autoclave
c. Oven
d. Fotoreaktor yang dilengkapi elektroda SCE dan elektroda counterdan sumber radiasi visibel lampu halogen 150 W
commit to user
h. Sanwa Multimeter Digital CD 751 (skala µA (2 angka belakang koma), mV
dan Ω)
i. Thermolyne Furnace4800 (maks temperatur 1000 ˚C)
j. Neraca Analitik Sartorius BP 110 (maks : 110 g; min : 0,001 g) k. Desikator
l. Penangas air m. Statif dan klem
n. Stopwatch
o. Spatula
p. pH meter (WalklabTI 9000)
2. Bahan Bahan yang digunakan dalam penelitian ini adalah: a. Titanium tetraisopropoksida (TTIP) (Merck) b. 2,2-bipiridin (Merck)
c. 2,2-biquinoline-4,4-dicarboxylic acid(Merck) d. 1,10-fenantrolin (Merck)
e. Asam asetat (Merck) f. Aquades
g. Gelas konduktif indium tin oxide(ITO) h. FeCl2.4H2O (Merck)
i. NaCl (Merck) j. HCl (Merck)
k. Methyl orange(Merck) l. DMSO (Merck) m. Indikator pH (Merck) n. Etanol (Merck) o. Es batu
commit to user
D. Prosedur Penelitian
1. Pembuatan Elektroda ITO/TiO2-Fe dengan ligan 1,10-fenantrolin, 2,2-bipiridin dan2,2-biquinoline-4,4-dicarboxylic acid
Sebanyak 10 mL titanium isopropoksida (TTiP) dihidrolisis dengan menambahkan 100 mL larutan asam asetat (pH = 2) di dalam waterbath(5 - 10 °C). Hidrolisis dilakukan sampai diperoleh larutan sol transparan. Sol transparan yang diperoleh kemudian dipindahkan ke dalam oven, dijaga pada suhu 150 °C selama 12 jam. Setelah didinginkan sampai dengan suhu kamar, gel yang diperoleh disonikasi selama 30 menit untuk menjamin homogenitas (mengacu Yang, et al., 2010). Suspensi yang dihasilkan kemudian dikalsinasi selama 2 jam pada suhu 400 °C. Sebanyak 0,5 gram TiO2 serbuk dilarutkan dalam 2,1 mL etanol kemudian distirrer selama 10 menit, lalu disonikasi, dan distirrer kembali selama 10 menit. Setelah itu, sol yang terbentuk dilapiskan pada gelas ITO (indium tin oxide) dengan ketebalan ± 1 mm, dikeringkan pada suhu kamar kemudian diannealingpada suhu 200 °C selama 10 menit.
Ligan 1,10-fenantrolin, 2,2-bipiridin, dan 2,2-biquinoline-4,4-dicarboxylic acid dilarutkan dalam larutan DMSO/Etanol (1:20) dengan perbandingan ligan 2:2:1 pada konsentrasi 1x10-3M. Setelah itu, ditambahkan Fe dengan konsentrasi dan pelarut yang sama secara bertetes-tetes. Larutan kompleks ini distirrer selama 3 hari tanpa terkena cahaya. Elektroda TiO2/ITO selanjutnya disensitisasi dengan menambahkan larutan alkoholik dari Fe dengan ligan 1,10-fenantrolin, 2,2-bipiridin, dan 2,2-biquinoline-4,4-dicarboxylic acid dan diimersi selama ± 24 jam.
2. Pengukuran Proses Degradasi Fotoelektrokatalitik a. Variasi Tegangan
commit to user
sebagai elektroda counter. Potensiostat digunakan untuk mengatur tegangan bias yang dikenakan ke elektroda kerja dan mengukur parameter fotoelektrokimia. Lampu halogen (150 W) digunakan untuk sumber radiasi tampak. Variasi tegangan yang diberikan sebesar -1V; -0,8V; -0,6V; -0,4V; -0,2V; 0V; 0,2V; 0,4V; 0,6V; 0,8V; dan 1V. Masing-masing larutan dianalisis dengan spektrofotometer UV-Vis untuk mendapatkan tegangan optimum.
b. Variasi Waktu
Degradasi fotoelektrokatalitik methyl orange dengan variasi waktu dilakukan di dalam fotoreaktor dengan sumber sinar lampu halogen 150 W. Sebanyak 25 mL larutan methyl orange5 ppm yang diberi 5 tetes larutan elektrolit NaCl 0,05 M diberi tegangan melalui elektroda ITO/TiO2/dye dan elektroda Cu sebesar -1V. Plat ITO/TiO2 sebagai elektroda kerja dan logam Cu sebagai elektroda counter. Potensiostat digunakan untuk mengatur tegangan bias yang dikenakan ke elektroda kerja dan mengukur parameter fotoelektrokimia. Lampu halogen (150 W) digunakan untuk sumber radiasi tampak. Dengan tegangan optimum yang diberikan, pengukuran absorbansi larutan methyl orange masing-masing dilakukan setiap 30, 60, 120, 180, 240, dan 300 menit. Dari percobaan ini akan didapatkan waktu optimum.
c. Variasi pH
masing-commit to user
masing larutan dianalisis dengan spektroskopi UV-Vis. Dari percobaan ini didapatkan pH optimum.
d. Variasi Konsentrasi Elektrolit
Sebanyak 25 mL larutan methyl orange ditambahkan larutan elektrolit NaCl dengan variasi konsentrasi 0,05 M; 0,5 M; 1 M; 2 M; 3 M; 4 M; dan 5 M menggunakan waktu dan tegangan optimum. Plat ITO/TiO2 sebagai elektroda kerja dan logam Cu sebagai elektroda counter. Potensiostat digunakan untuk mengatur tegangan bias yang dikenakan ke elektroda kerja dan mengukur parameter fotoelektrokimia. Lampu halogen (150 W) digunakan untuk sumber radiasi tampak.
Analisis UV-Vis kuantitatif dilakukan untuk melihat hubungan antara penurunan konsentrasi lawan waktu, sedangkan spektra UV-Vis diukur untuk melihat perubahan spektra sensitiser dye maupun substrat dye selama proses fotoelekrodegradasi.
3. Analisis Material Elektroda
Morfologi dan struktur lapis tipis nano-TiO2 dikarakterisasi dengan difraksi sinar X (XRD).
E. Teknik Pengumpulan Data
1. Pengumpulan Data
Tingkat degradasi fotoelektrokatalitik zat warna methyl orange dipengaruhi oleh variabel bebas berupa tegangan, waktu penyinaran dengan sinar tampak, dan pH larutan. Variabel terikatnya adalah prosentase penurunan konsentrasi zat warna. Penurunan konsentrasi zat warna didapatkan dari data absorbansi zat warna sebelum dan setelah proses degradasi fotoelektrokatalitik. Data yang dikumpulkan adalah tegangan dan absorbansi. Harga absorbansi dikonversi menjadi konsentrasi dan persen penurunan konsentrasi zat warna.
commit to user
dan 2,2-biquinoline-4,4-dicarboxylic acid menggunakan sumber radiasi tampak. Data diperoleh dengan mencatat perubahan absorbansi zat warna sebelum dan sesudah dilakukan proses degradasi fotoelektrokatalitik, kemudian menginterpolasikannya ke kurva kalibrasi (absorbansi lawan konsentrasi). Konsentrasi sampel dapat ditentukan dan dibuat kurva waktu lawan konsentrasi. Variabel terikat pada penelitian ini adalah penurunan konsentrasi degradasi pada 30, 60, 120, 180, 240, dan 300 menit.
Karakterisasi material elektroda kerja: ITO/TiO2 dan ITO/TiO2-Fe dengan ligan 1,10-fenantrolin, 2,2-bipiridin, dan 2,2-biquinoline-4,4-dicarboxylic aciddilakukan dengan menggunakan XRD.
2. Analisis Data
Proses degradasi fotoelektrokatalitik substrat dyeanionik (methyl orange) pada elektroda ITO/TiO2-Fe dengan ligan 1,10-fenantrolin, 2,2-bipiridin, dan
2,2-biquinoline-4,4-dicarboxylic acid menggunakan sumber radiasi tampak. Analisis data untuk menjelaskan proses degradasi fotoelektrokatalitik tersebut dilakukan dengan mengukur penurunan konsentrasi setelah degradasi pada 30, 60, 120, 180, 240, dan 300 menit.
Tingkat kristalinitas dianalisa dari data XRD. Puncak yang melebar menunjukkan kristalinitas yang rendah, sedangkan puncak yang meruncing tajam menunjukkan kristalinitas yang lebih baik. Pergeseran dan penandaan pola puncak menandakan terjadinya perubahan d spacing (jarak antar bidang kristal) atau transformasi bentuk dari kisi kristal. Struktur dan sistem Kristal TiO2hasil sintesis dapat diketahui berdasarkan difraktogram XRD yang dibandingkan dengan standar JCPDS (Joint Commite Powder Difraction Standart).
commit to user
BAB IV
HASIL DAN PEMBAHASAN
A. Sintesis dan Karakterisasi Titanium Dioksida (TiO2)
Sintesis TiO2pada penelitian ini dilakukan dengan proses sol gel, seperti telah dilakukan oleh Wahyuningsih dkk (2007). Untuk menghasilkan kristal TiO2 anatase lebih banyak pada hasil sintesis TiO2 maka diperlukan kondisi sintesis tertentu dan strategi-strategi tertentu.
Reaksi secara keseluruhan dari sintesis TiO2 dengan bahan awal TTiP diharapkan mengikuti reaksi:
H+
Ti(iPr) + CH3COOH Suspensi TiO2
90 °C
Suspensi TiO2 Sol gel TiO2
150 °C
Sol gel TiO2 Xerogel TiO2
400 °C
Xerogel TiO2 Powder TiO2(Anatase)
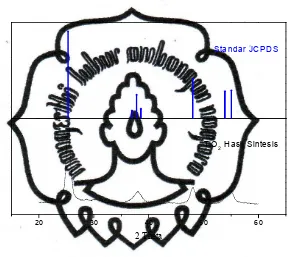
Hasil sintesis TiO2dikarakterisasi dengan difraksi sinar X menggunakan
radiasi Cu Kα (λ = 1,541 Å). Untuk mengetahui keberadaan TiO2 fase anatase,
puncak-commit to user
puncak pada 2Ɵ = 25,35° (d101 = 3,509 Å), 2Ɵ = 37,90° (d004 = 2,368 Å), 2Ɵ = 48,10° (d200= 1,887 Å), 2Ɵ = 54,15° (d105= 1,693 Å), dan 2Ɵ = 54,95° (d211= 1,667 Å) yang merupakan daerah karakterisasi TiO2anatase sesuai dengan standar JCPDS No. 782-486. Dari gambar tersebut menunjukkan bahwa pada suhu 400 °C terbentuk TiO2fase anatase murni, sedangkan TiO2fase rutile tidak terjadi.
20 30 40 50 60
2 Theta
TiO
2 H asil Sintesis
Standar JCPDS
Gambar 5. Spektra difraksi sinar X (XRD) TiO2hasil sintesis
B. Sintesis dan KarakterisasiDye
commit to user
larutan senyawa kompleks yang dihasilkan dikarakteristik dengan UV-Vis. Spektra UV-Vis Senyawa kompleks Fe(phen)x(bpy)y(dcbq)z (x = 1-2, y = 1-2 z = 1) ditunjukkan pada Gambar 6.
Gambar 6. Spektroskopi UV-Vis pada kompleks Fe dengan ligan
1,10-fenantrolin (phen), 2,2-bipiridin (bpy), dan 2,2-biquinoline-4,4-dicarboxylic acid(dcbq)
Spektra dye dari kompleks Fe(phen)x(bpy)y(dcbq)z (x = 1-2, y = 1-2 z = 1) menghasilkan dua puncak serapan maksimum yaitu pada λ1= 303 nm dan λ2= 515 nm. Spektra FeCl2.4H2O memiliki 2 puncak serapan maksimum pada 252 nm dan 332 nm); ligan 2,2’-bipiridin memiliki 2 puncak serapan maksimum pada 224 nm dan 281 nm) dan ligan 2,2’-biquinoline-4,4’dicarboxylic acid memiliki 2 puncak serapan maksimum pada 265 nm dan 330 nm, sedangkan pada ligan 1,10-fenantrolin hanya memiliki 1 serapan maksimum pada 264 nm seperti yang terangkum pada Tabel 2.
Pada λ1dye memiliki puncak melebar pada panjang gelombang 303 nm
dan terjadi pergeseran panjang gelombang ke arah yang lebih besar (batokromik)
dari logamnya yaitu dari 252 nm menjadi 303 nm. Selain itu pada λ1dyejuga terjadi
pergeseran batokromik dari ligan-ligannya yaitu dari 244 nm (bpy), 265 nm (dcbq), dan 264 nm (phen) menjadi 303 nm. Pergeseran ini diperkirakan
commit to user
terjadinya transisi intra ligand (π→π*) akibat penyerapan energi oleh elektron
-elektron π dari orbital bonding ke orbital nonbonding. Pergeseran batokromik
yang terjadi pada ligan menunjukkan terjadinya konjugasi yang menyebabkan energi antara orbital bonding ke orbital nonbonding semakin kecil sehingga diperoleh panjang gelombang yang lebih besar, yang kemungkinan disebabkan oleh pembentukan kompleks.
Tabel 2. Panjang gelombang maksimum FeCl2.4H2O, ligan bpy, ligan dcbq, ligan phen, dan dye(kompleks Fe(phen)x(bpy)y(dcbq)z(x
Pada λ2dye menunjukkan puncak melebar dengan panjang gelombang
maksimum 515 nm dan terjadi pergeseran panjang gelombang ke arah yang lebih besar (batokromik) dari logamnya yaitu dari 332 nm menjadi 515 nm. Pergeseran batokromik diperkirakan terjadinya transisi metal to ligand charge transfer (MLCT) yang karakteristiknya memiliki intensitas yang lebih tinggi dibandingkan transisi d-d. Fenomena MLCT cenderung terjadi pada senyawa kompleks dari ion logam dengan bilangan oksidasi rendah (densitas elektron pada orbital d besar) yang mengikat ligan yang memiliki orbital kosong *, sehingga memungkinkan terjadi ikatan balik (back bonding) dari ion logam ke ligan. Cho et al. (2001) juga telah memperlihatkan kompleks (RuII(bpy-COOH)2)32+ yang mengalami pelebaran pita absorbansi pada =467 nm sebagai interaksi metal to ligand charge transfer(MLCT) dalam kompleks.
commit to user
memekatkan warna kromofor sehingga meningkatkan intensitas dan panjang gelombang pada absorbsi. Puncak panjang gelombang menunjukkan adanya
eksitasi elektron dari π ke π* dan n ke π* untuk ikatan rangkap terkonjugasinya.
Penentuan struktur senyawa kompleks [Fe(phen)x(bpy)y(dcbq)z] tidak dilakukan pada penelitian ini.
C. Sensitisasi Dye
Plat ITO/TiO2 direndam dalam kompleks dye Fe dengan ligan 1,10-fenantrolin, 2,2-bipiridin, dan 2,2-biquinoline-4,4-dicarboxylic acid yang telah disintesis selama tiga hari. Proses sensitisasi dyeini dilakukan selama 24 jam agar didapatkan hasil yang sempurna. Hasilnya menunjukkan adanya perubahan warna dari lapis tipis ITO/TiO2dari putih menjadi merah muda. Berikut grafik ITO/TiO2 yang telah disensitisasi dianalisis menggunakan UV-Vis padat.
Gambar 7. Grafik ITO/TiO2/dye
ITO/TiO2/dye memiliki puncak pada panjang gelombang maksimum 516 nm. Pada lapis tipis ITO/TiO2/dye memiliki respon pada daerah tampak yang lebar yang dimungkinkan karena interaksi metal to ligand charge transferterjadi (MLCT) yang merupakan hasil respon dari dye pada permukaan oksida. Dikarenakan adanya perpindahan elektron dari senyawa kompleks dyeke material TiO2 sehingga ada sebuah elektron yang ditransfer keluar dari atom logam pusat
commit to user
(Asbury et al., 2000). Pengamatan hasil spektra ini relevan dengan hasil penelitian Vinodgopal et al.(1995) yang telah menunjukkan pelebaran pita absorbsi setelah penambahan senyawa kompleks sensitiser. Pelebaran pita absorbansi ini bermanfaat dalam memperluas fotorespon dari TiO2. Kontribusi MLCT juga menyebabkan berubahnya densitas elektron yang mengalami transisi, antara logam dan ligan yang dikenai. Perubahan ini terjadi di dalam ground state(Cole, et al., 2001).
D. Degradasi Fotoelektrokatalitik Zat Warna Methyl Orange
Eksperimen pengukuran degradasi fotoelektrokatalitik dilakukan dengan membuat reaktor one compartement yang dapat dilewati oleh elektrolit NaCl, dimana elektroda counter Cu dalam satu wadah dengan elektroda kerja ITO/TiO2/dye . Potensiostat digunakan untuk mengatur tegangan yang dikenakan ke elektroda kerja. Lampu halogen 150 W digunakan sebagai sumber energi foton. Proses degradasi fotoelektrokatalitik methyl orange dilakukan beberapa variasi yaitu variasi tegangan, variasi waktu penyinaran, variasi pH, dan variasi konsentrasi elektrolit.
1. Degradasi Fotoelektrokatalitik Zat Warna Methyl Orangedengan Variasi Tegangan
Pengukuran tegangan menggunakan multimeter. Variasi tegangan yang digunakan adalah -1V; -0,8V; -0,6V; -0,4V; -0,2V; 0V; 0,2V; 0,4V; 0,6V; 0,8V;
dan 1V. Methyl orange yang digunakan untuk proses degradasi
fotoelektrokatalitik adalah sebesar 5 mg/L, sedangkan konsentrasi larutan NaCl yang digunakan yaitu 0,05 M dan waktu penyinaran dengan lampu halogen selama 3 jam. Hasil degradasi fotoelektrokatalitik zat warna methyl orangeuntuk masing-masing tegangan dapat dilihat pada gambar berikut.
commit to user
TiO2/dye. Reaksi fotoelektrokatalitik oleh TiO2/dye lebih dapat berjalan jika TiO2/dye diposisikan sebagai fotoanoda pada proses reaksi fotoelektrodegradasi. TiO2yang berlaku sebagai fotoanoda (diberi muatan positif) kurang mendegradasi
methyl orange, sehingga dapat disimpulkan bahwa eksitasi dye yang menghasilkan ecb pada permukaan TiO2 kurang dapat menginisiasi reaksi fotoelektrodegradasi methyl orange yang bermuatan negatif. Jadi ketika negatif bias lebih efektif daripada positif bias, maka mekanisme mengikuti direct electrochemical oxidationkarena photogenerationoleh eksitasi dyedihambat oleh negatif bias.
Gambar 8. Penurunan konsentrasi zat warna (%) dengan variasi tegangan (waktu 3 jam, [NaCl] =0,05 M, dan [methyl orange] = 5 ppm)
Pada pemberian potensial bias positif, yang menjadi fotoanoda adalah TiO2/dye dan fotokatoda adalah logam Cu. Reaksi yang mungkin terjadi sebagai berikut:
commit to user
commit to user
di permukaan TiO2/dye. TiO2juga dapat mengalami oksidasi secara elektrokimia menghasilkan elektron e-cb dan hole (h+vb). hole (h+vb) dapat menginisiasi reaksi oksidasi dan di lain pihak e-cb akan menginisiasi reaksi reduksi pada permukaan semikonduktor (Linsebigler et al., 1995). Mekanisme reaksi reduksi-oksidasi yang terjadi adalah h+vb dapat mengoksidasi air atau gugus hidroksil pada methyl
orangeyang teradsorb pada permukaan untuk membentuk radikal hidroksil (OH.) dan di lain pihak, e-cbdapat mereduksi oksigen yang teradsorb untuk membentuk anion radikal superoksida dan hidroperoksida (Wang, 2006). Proses reaksi reduksi-oksidasi dipengaruhi oleh potensial redoks dari h+vb dan e-cb. Potensial redoks h+vb dari semikonduktor TiO2 anatase sebesar 2,53V ( vs SHE) dan potensial redoks dari e-cb sebesar -1V. Potensial oksidasi yang dimiliki oleh h+vb kecil sehingga air dan atau gugus hidroksil dapat teroksidasi pada permukaan TiO2 serta potensial reduksi yang dimiliki oleh e-cb dapat menghasilkan radikal hidroksil (OH.) yang merupakan spesi pengoksidasi kuat (2,8V vs SHE) untuk mengoksidasi kebanyakan zat organik menjadi air, asam mineral, dan karbon dioksida (Gunlazuardi, 2001).
Pada bias negatif, yang menjadi fotoanoda adalah logam Cu dan fotokatoda adalah TiO2/dye, maka fotosensitisasi TiO2 yang menghasilkan ecb tidak dapat secara efektif menginisiasi reaksi fotoelektrodegradasi MO. Pada pemberian potensial bias negatif, penurunan konsentrasi MO kemungkinan disebabkan oleh reaksi fotoelektrokatalitik tanpa eksitasi dye dan reaksi elektrokimia langsung (direct electrochemical). Reaksi yang terjadi mungkin sebagai berikut:


![Gambar 2. Skema fotosensitisasi partikel semikonduktor TiOcommit to user 2 (CB = pita konduksi, VB = pita valensi), [M] dan [M]*](https://thumb-ap.123doks.com/thumbv2/123dok/3143143.1729609/34.612.164.480.537.666/gambar-skema-fotosensitisasi-partikel-semikonduktor-tiocommit-konduksi-valensi.webp)