TEMBAKAU (Nicotiana Tabacum L.) DI KECAMATAN SUMBERSARI KABUPATEN JEMBER
LAPORAN PRAKTIKUM
Oleh:
GOLONGAN C/KELOMPOK 2
PROGRAM STUDI ILMU TANAH FAKULTASPERTANIAN
UNIVERSITAS JEMBER 2018
i
ISOLASI BAKTERI Bacillus sp DI RIZOSFER TANAH TANAMAN TEMBAKAU (Nicotiana tabacum L.) DI KECAMATAN SUMBERSARI
KABUPATEN JEMBER
LAPORAN PRAKTIKUM
diajukan guna melengkapi tugas praktikum dan memenuhi salah satu syarat untuk menyelesaikan mata kuliah Biologi Tanah
Oleh: Golongan C/Kelompok 2 1. SERUNI VEBIAN H. (171510301005) 2. ULIL AMRI (171510301019) 3. YENI WAHYU N. (171510301028) 4. ALAUDIN NUR F. (171510301044)
PROGRAM STUDI ILMU TANAH FAKULTASPERTANIAN
UNIVERSITAS JEMBER 2018
ii
Isolasi Bakteri Bacillus sp Di Rizosfer Tanah Tanaman Tembakau (Nicotiana Tabacum L.) Di Kecamatan Sumbersari Kabupaten Jember
Identification And Isolation Bacillus sp Bacteria In The Rizosphere Soil Of Tobacco Plant (Nicotiana Tabacum L.) In Sumbersari District, Jember Regency
Agung Panggalih, Seruni Vebian Heksanayla, Ulil Amri, Yeni Wahyu Ningsih, dan Alaudin Nur Fatah
Program Studi Ilmu Tanah, Fakultas Pertanian Universitas Jember
RINGKASAN
Pengambilan sampel ini dilakukan pada bulan September 2018 di lahan tembakau. Tanaman tembakau merupakan tanaman semusim (annual) yang termasuk komoditas perkebunan yang banyak dibudidayakan di indonesia. Tanah merupakan suatu sistem kehidupan yang kompleks yang mengandung berbagai jenis organisme baik mikro maupun makro. Mikroorganisme dalam tanah dipengaruhi oleh beberapa faktor diantaranya zat hara dalam tanah, kelembaban, tingkat aerasi, suhu, ph dan perlakuan pada tanah. Mikroba dalam tanah khususnya bakteri Bacillus Sp. yang terdapat di rhizosfer tanaman mampu meningkatkan pertumbuhan tanaman dan perlindungan terhadap patogen tertentu. Respirasi tanah menjadi salah satu indikator dari aktivitas biologi seperti mikroba, akar, dan kehidupan lain di dalam tanah. Hasil penelitian menunjukkan bahwa aktivitas mikroba tanah pada tanaman tembakau diketahui dengan hasil uji PUTK yaitu memiliki pH 5-6 (agak masam), fosfor yang rendah, kalium yang rendah, dan C-Organik yang rendah kurang dari 2 cm. Jenis fauna tanah yang ditemukan pada lahan tanaman tembakau makrofauna, yaitu ulat, semut, keliwung, dan kaki seribu. Respirasi dari minggu pertama sampai terakhir mengalami penurunan. Jumlah total mikroorganisme yaitu 146,67 x 106 (CFU)g-1 dan bakteri pelarut fosfat yaitu 47,75 x 106 (CFU)g-1. Penelitian mengenai isolasi dan identifikasi bakteri Bacillus Sp. yang ada di rhizosfer pada tanaman tembakau perlu dilakukan untuk mengetahui dampaknya terhadap kesuburan tanah pada tanaman tembakau. Kata Kunci : Tanaman Tembakau, Respirasi tanah, Bacillus Sp.
SUMMARY
This sampling was carried out on September 2018 in tobacco land. Tobacco plants are annual (annual) plants which include plantation commodities that are widely cultivated in Indonesia. Soil is a complex life system that contains various types of organisms both micro and macro. Microorganisms in the soil are influenced by several factors including nutrients in the soil, humidity, aeration level, temperature, pH and treatment of the soil. Microbes in the soil especially Bacillus Sp. which is found in the rhizosphere of plants can improve plant growth and protection against certain pathogens. Soil respiration is one indicator of biological activities such as microbes, roots, and other life in the soil. The result
iii
showed that microbial activity of soil in tobacco plants is known by the results of measurements which have a pH of 5-6 (somewhat acidic), low phosphorus, low potassium, and low C-Organic less than 2 cm. The type of soil fauna found on the land of makrofauna tobacco plants, namely caterpillars, ants, keliwung, and millipedes. Respiration from the first week to the last decreased. The total number of microorganisms is 146,67 X 106 (CFU)g-1 and phosphate solvent bacteria is 47,75 x 106 (CFU)g-1. Research on the isolation and identification of Bacillus Sp. Bacteria. which is in the rhizosphere in tobacco plants needs to be done to determine the impact on soil fertility on tobacco plants.
ii PRAKATA
Puji syukur ke hadirat Allah SWT atas segala rahmat dan karunia-Nya sehingga kami dapat menyelesaikan Laporan Akhir Praktikum Biologi Tanah yang berjudul “Isolasi Bakteri Bacillus Sp Di Rizosfer Tanah Tanaman Tembakau (Nicotiana Tabacum L.) Di Kecamatan Sumbersari Kabupaten Jember”. Laporan akhir praktikum ini disusun untuk memenuhi salah satu persyaratan menyelesaikan Praktikum Biologi Tanah pada Program Studi Ilmu Tanah Fakultas Pertanian Universitas Jember.
Penyusunan laporan akhir praktikum ini tidak lepas dari bantuan berbagai pihak. Oleh karena itu, kami menyampaikan terima kasih kepada:
1. Dr. Ir. Cahyoadi Bowo selaku Kepala Program Studi Ilmu Tanah Fakultas Pertanian Universitas Jember;
2. Dr. Ir. Tri Candra Setiawati, M.Sc selaku Dosen Pengampu Mata Kuliah Biologi Tanah;
3. Tim Asisten Laboratorium Biologi Tanah; 4. Anggota kelompok C/2;
5. Semua pihak yang tidak dapat disebutkan satu per satu.
Kami juga menerima segala kritik dan saran dari semua pihak demi kesempurnaan laporan akhir praktikum ini. Akhirnya kami berharap semoga laporan akhir praktikum ini dapat bermanfaat.
Jember, November 2018 Tim Penyusun
iii DAFTAR ISI Cover ... i Ringkasan ... ii Prakata ...iv Daftar Isi ...v
Daftar Tabel ...vii
Daftar Gambar ...viii
Bab 1. Pendahuluan ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 2
1.3 Tujuan ... 2
1.4 Manfaat ... 3
Bab 2. Tinjauan Pustaka ... 4
2.1 Tanaman Tembakau ... 4
2.2 Biofisik Tanah ... 5
2.3 Soil Fauna ... 5
2.4 Respirasi ... 6
2.5 Populasi Mikroorganisme Total ... 7
2.6 Populasi Mikroorganisme Spesifik ... 8
2.7 Hipotesis ... 10
Bab 3. Metode Praktikum ...11
3.1 Biofisik Tanah ...11
3.2 Soil Fauna ...14
3.3 Respirasi ...15
3.4 Populasi Mikroorganisme dalam Tanah...18
3.5 Populasi Mikroorganisme Spesifik ...21
Bab 4. Hasil dan Pembahasan ...25
4.1 Hasil ...25
4.1.1 Biofisik Tanah ...25
iv
4.1.3 Respirasi Tanah ...28
4.1.4 Populasi MO Total Tanah ...29
4.1.5 Populasi MO Spesifik Tanah ...30
4.2 Pembahasan Umum ...31 Bab 5. Penutup ...39 5.1 Kesimpulan ...39 5.2 Saran ...39 Daftar Pustaka Lampiran Peta Jenis Tanah Dokumentasi Lembar ACC Flowchart
v
DAFTAR TABEL
Tabel Judul Halaman
4.1 Kondisi Lingkungan 25
4.2 Sifat Kimia Tanah 25
4.3 Soil Fauna Titik 1 26
4.4 Soil Fauna Titik 2 27
4.5 Respirasi Tanah 28
4.6 Populasi MO Total Tanah 29
4.7 Populasi Mikroorganisme Spesifik 30
DAFTAR GAMBAR
Gambar Judul Halaman
BAB 1. PENDAHULUAN
1. Latar Belakang
Tanaman tembakau (Nicotiana tabacum L.) merupakan tanaman yang spesifik, sehingga tiap daerah penghasil tembakau memiliki ciri khas dan mutu tembakau yang dihasilkan berbeda sehingga hanya berkembang di suatu wilayah yang terbatas. Salah satu wilayah di Jawa Timur yang memiliki potensi pengembangan tembakau lokal adalah jember. Jember merupakan kota yang memiliki potensi alam yang begitu luar biasa. Tembakau salah satu potensi alam tersebut. Tembakau adalah produk pertanian semusim yang bukan termasuk komoditas pangan, melainkan komoditas perkebunan yang banyak dibudidayakan di Indonesia. Tembakau merupakan tanaman introduksi yang sebagian sudah beradaptasi dan berkembang di suatu daerah dan dengan daerah pengembangannya. Tembakau di daerah jember biasanya ditanam pada akhir musim hujan dan dipanen pada musim kemarau sehingga jenis tembakaunya dikenal dengan sebutan tembakau cerutu. Masyarakat pada umumnya mengetahui bahwa daun tembakau sebagai bahan baku utama rokok dan cerutu yang dianggap mempunyai dampak negatif. Tembakau sendiri juga mempunyai manfaat positif meskipun mengandung dampak negatif yaitu tembakau bisa sebagai anti radang, obat diabetes, dan antibodi (Rochman dan Hamida, 2017).
Potensi lahan biasanya bergantung pada keadaan biofisik lahan yang meliputi iklim, sifat tanah, topografi dan vegetasi. Penggunaan lahan harus sesuai dengan potensinya karena akan berdampak negatif terhadap lingkungan jika potensi tersebut tidak sesuai. Tanah yang baik diperlukan untuk menghasilkan tembakau berkualitas tinggi. Lingkungan biofisik adalah lingkungan yang terdiri dari komponen abiotik dan abiotik yang berhubungan dan saling mempengaruhi satu sama lain. Komponen biotik merupakan mahkluk hidup seperti hewan, tumbuhan, dan manusia sedangkan komponen abiotik terdiri dari benda-benda mati seperti tanah, air, udara, cahaya matahari.Kualitas lingkungan biofisik dikatakan baik jika interaksi antar komponen berlangsung dengan seimbang (Gao etal.,2017).
Fauna tanah merupakan hewan yang hidup ditanah, baik yang hidup dipermukaan tanah maupun yang terdapat dalam tanah. Fauna tanah merupakan bagian dari ekosistem lahan yang keberadaanya tergantung kondisi lahan yang baik dari vegetasi. Fauna tanah baik makrofauna maupun mesofauna hingga mikrofauna sangat penting untuk proses dekomposisi sehingga berperan dalam perbaikan kesuburan tanah. Keberadaan tanah dapat dijadikan parameter dari kualitas tanah, fauna tanah yang digunakan sebagai bioindikator kesuburan tanah tentunya memiliki jumlah yang relatif melimpah (Ibrahim, 2014).
Menurut Muwarni (2015), mikroorganisme yang dibawah terdapat tanah berukuran sangat kecil sehingga untuk mengamatinya diperlukan alat bantuan dengan ukuran yang kecil. Mikroorganisme tertentu dapat menyebabkan kerugian dan keuntungan. Mikroorganisme mengatur dan mempengaruhi ekosistem seperti perubahan nutrisi dan dekomposisi, tanaman, pertumbuhan dan promosi serta struktur tanah (Bowles et al.,2014).
Tanaman biasanya diperlukan pernapasan atau pergerakan oksigen dari udara luar kedalam sel dalam jaringan atau yang disebut respirasi. Respirasi terjadi di stomata atau mulut daun.respirasi diawali dengan adanya penangkapan oksigen dari lingkungan. Respirasi dilakukan dengan tujuan untuk mendapatkan suatu energi.
1.2 Rumusan Masalah
1. Bagaimana aktivitas dan populasi mikroba tanah pada lahan tanaman tembakau di Kecamatan Sumbersari ?
2. Bagaimana hubungan aktivitas populasi mikroba tanah terhadap kesuburan tanah tanaman tembakau di Kecamatan Sumbersari ?
1.3 Tujuan
1. Untuk mengetahui aktivitas dan populasi mikroba tanah pada lahan tanaman tembakau di Kecamatan Sumbersari
2. Untuk mengetahui hubungan aktivitas populasi mikroba tanah terhadap kesuburan tanah tanaman tembakau di Kecamatan Sumbersari
1.4 Manfaat
Bagi mahasiswa dapat memahami dan mengenal tentang mikroba di dalam tanah serta dapat mengetahui kandungan apa saja yang terdapat di dalam tanah tembakau.
BAB 2. TINJAUAN PUSTAKA
2.1 Tanaman Tembakau
Tanaman tembakau (Nicotiana tabacum L.) merupakan salah satu tanaman Tropis asli Amerika Tanaman tembakau merupakan tanaman semusim yang bukan termasuk komoditas pangan melainkan tanaman tenbakau merupakan tanaman perkebunan yang banyak dibudidayakan khususnya di negara Indonesia sendiri
.
Tanaman tembakau merupakan salah satu tanaman perkebunan unggul yang yang mempunyai nilai ekonomis tinggi dan sudah lama diusahakan oleh petani tembakau. Tanaman tembakau merupakan bahan utama yang menghasilkan rokok dan cerutu. Tanaman tembakau dapat diklasifikasikan sebagai berikut : Divisio : SpermatophytaSub diviso : Angiospermae Class : Dicotyledoneae Ordo : Solanales Famili : Solanaceae Genus : Nicotiana
Spesies : Nicotiana tabacum L.
Tanaman tembakau sendiri mempunyai akar tunggang dan akar tanaman tembakau sensitif terhadap air yang berlebihan karena dengan berlebihannya air dapat mengganggu pertumbuhan akar dan dapat membuat tanaman tembakau mati dan busuk. Batang tanaman tembakau terbentuk agak bulat, lunak, tidak bercabang, dan semakin keujung semakin kecil. Batang tanaman tembakau mempunyai diameter kurang lebih 5 cm (Eurika, 2017).
Tembakau mempunyai daun berbentuk bulat lonjong, ujung runcing tulang daun menyirip, dan tepi daun agak bergelombang. Tanaman tembakau mempunyai 28-32 helai daun perbatang dengan ketebalan berbeda beda tergantung varietas. Pertumbuhan daun berselang-seling mengelilingi batang tanaman tembakau itu sendiri. Dalam tembakau proses penuaan pematangan tanaman tembakau sendiri bertahap dimulai dari ujung daun, kemudian bagian bawahnya. Bunga tanaman tembakau merupakan bunga majemuk yang terdiri dari
beberapa tandan dan pada setiap pandan berisi bisa sampai 15 bunga. Bentuk bunga pada tanaman tembakau ialah berbentuk terompet dan mempunyai bentuk yang panjang. Bunga tenaman tembakau sendiri mempunyai fungsi sebagai alat penyerbukan sehingga dari penyerbukan tersebut dihasilkan biji untuk perkembangbiakan.
2.2 Biofisik Tanah
Tanah merupakan bagian yang ada di kerak bumi yang terbentuk dari mineral dan bahan organik. Tanah sendiri merupakan lapisan permukaan bumi yang secara fisik berfungsi sebagai tempat tumbuh dan berkembangnya perakaran. Tanah merupakan media tempat tumbuhnya tanaman. Tanah juga bukan tempat tumbuhnya tanaman, melainkan tanah juga sebagai habitat bagi organisme-organisme yang ada di dalam tanah. Oleh karena itu, organisme-organisme tanah ditentukan oleh kualitas vegetasi di atasnya. Aktivitas organisme yang ada di dalam tanah juga akan mempebgaruhi pertumbuhan tanaman (Widyati, 2013).
Biofisik merupakan suatu lahan yang terdiri dari dua komponen, yaitu komponen biotik dan komponen abiotik. Dua komponen tersebut saling berhubungan dan saling mempengaruhi satu sama lainnya. Komponen biotik meliputi makhluk hidup seperti tanaman, hewan, dan manusia, sedangkan komponen abiotik terdiri dari benda-benda mati seperti tanah, air, udara, dan cahaya matahari. Dapat dikatakan baik jika komponen biotik dan komponen abiotik berinteraksi dengan seimbang. Proses biofisik yang berguna untuk mengontrol mikroba dan dispersi dalam tanah. Biofisik tanah juga berpengaruh terhadap keseuaian lahan yang akan dilakukan proses penanaman (Jayanti, 2013).
2.3 Fauna Tanah
Upaya dalam meningkatkan kesuburan tanah, tidak dilakukannya dengan cara mengolah tanah. Terdapat beberapa makhluk hidup yang ada di dalam tanah yang dibedakan menjadi mikroorganisme, makroorganisme, dan mesoorganisme. Mikroorganisme dalam tanah bisa di contohkan sebagai nematoda, makroorganisme dicontohkan sebagai cacing tanah, sedangkan mesoorganisme di
contohkan sebagai protozoa. Makhluk hidup yang ada di dalam tanah juga dapat membantu proses kesuburan tanah, salah satunya adalah mikroorganisme. Mikroorganisme di dalam taah dibagi menjadi dua jenis, yaitu mikroorganisme yang merugikan dan mikroorganisme yang menguntungkan. Mikroorganisme dalam tanah berperan sebagi penyedia unsur hara bagi tanaman. Tingkat kesuburan tanah dapat juga dilihat dengan banyak atau sedikitnya mikroorganisme yang ada di dalam tanah. Jika mikroorganisme dalam tanah banyak, maka tingkat kesuburan tanah bisa dikatakan baik (Yunus dkk., 2017).
Tanaman tembakau umumnya di arahkan pada lahan kering, karena tanaman tembakau tidak membutuhkan banyak air untuk pertumbuhannya. Tanaman tembakau jika kebanyakan air maka akar tanaman tembakau menjadi busuk dan tanaman tambakau akan mati. Untuk mempertahankan fungsi tanah pada tanaman tembakau salah satunya dengan meningkatkan jumlah fauna-fauna yang ada di dalam tanah dengan pemberian bahan organik. Fauna dalam tanah dapat berperan penting dalam dekomposisi suatu tanah. Adanya bahan organik yang cukup dalam tanah, makrofauna dapat bekerja dengan baik untuk menguraikan bahan organik dan tanah dapat mempertahankan produktivitas tanah dengan didukung faktor abiotik (Nurrohman, 2018).
2.4 Respirasi Tanah
Respirasi merupakan proses pertukaran gas antara oksigen (O2) yang dibutuhkan untuk metabolisme sel dan gas karbondioksida (CO2) yang dihasilkan sebagai sisa oksidasi tubuh. Jenis respirasi dapat dibedakan menjadi 2 berdasarkan ketersediaan oksigen yaitu respirasi anaerob dan aerob. Respirasi anaerob adalah proses respirasi yang tidak membutuhkan oksigen sedangkan respirasi aerob adalah proses respirasi yang membutuhkan oksigen. Respirasi tidak hanya terjadi dalam tumbuhan dan hewan, tetapi juga terjadi di tanah (Isnaeni, 2006).
Fluktuasi temperatur dan tekanan udara, angin, serta penggantian udara oleh air hujan menghasilkan perbedaan tekanan antara atmofer dan tanah sehingga mempunyai pengaruh kecil terhadap gerakan gas antara tanah dan atmosfer. Pertukaran gas secara difusi yang disebabkan oleh perbedaan tekanan parsial O2
yang cukup tinggi dan CO2 lebih rendah di atmosfer menjadikan oksigen bergerak ke dalam tanah dan CO2 mengalir keluar dari tanah sehingga proses tersebut dinamakan respirasi tanah. Frekuensi pori berisi udara dan kontinuitasnya yang dijadikan dasar untuk mengukur permeabilitas tanah ke udara merupakan penentu besarnya pertukaran gas. Besarnya pertukaran gas dipengaruhi oleh distribusi ukuran partikel, struktur, dan kandungan air (Sutanto, 2005).
Respirasi tanah merupakan suatu tolak ukur karbondioksida (CO2) yang dilepaskan dari tanah yang berasal dari penguraian bahan organik tanah (SOM) oleh mikroba tanah, respirasi dari akar tanaman, dan fauna tanah. Respirasi tanah menjadi salah satu indikator dari aktivitas biologi seperti mikroba, akar, dan kehidupan lain di dalam tanah. Respirasi ini juga menjadi aktivitas penting bagi ekosistem di dalam tanah dan dari kesehatan tanah karena menunjukkan tingkat aktivitas mikroba, kandungan SOM, serta dekomposisinya. Penetapan respirasi tanah berdasarkan penetapan jumlah CO2 yang dihasilkan dan jumlah O2 yang digunakan oleh mikroorganisme tanah (Pangestuning dkk., 2017).
Bahan organik tanah merupakan salah satu sumber karbon (C) paling penting dalam ekosistem baik di dalam tanah maupun sekitarnya. Perubahan iklim yang mengakibatkan pemanasan di masa depan akan mengubah penyimpanan karbon (C) dalam tanah melalui efek suhu pada respirasi mikroba. Respirasi mikroba tanah merupakan proses utama dalam siklus karbon terestrial (C). Mikroorganisme tanah lebih banyak respirasi C secara mutlak dan per unit mikroba biomassa C saat mendekomposisi substrat N-rendah. Mikroorganisme ketika tumbuh pada substrat N-rendah tidak memiliki cukup N untuk membangun biomassa yang banyak seperti dimungkinkan oleh konsentrasi C sehingga mikroorganisme membuang C melalui respirasi sebagai CO2 untuk membuat substrat agar memenuhi kebutuhan nutrisi. Efek N pada respirasi mikroba di tanah lebih tergantung pada pH awal tanah daripada ketersediaan C tanah (Spohn, 2015).
2.5 Populasi Mikroorganisme Total
Organisme tanah terdiri dari fauna tanah dan mikroorganisme. Organisme tanah memegang peranan sangat penting terhadap kelangsungan hidup tumbuhan
diatasnya sebaliknya aktivitas mereka juga tergantung pada kondisi vegetasi. Tanaman berperan menyuplai bahan organik ke dalam tanah baik melalui produksi serasah maupun eksudat akar. Organisme tanah berperan dalam proses dekomposisi bahan organik, musuh bagi patogen yang menyerang tanaman, dan distribusi serta pencampuran bahan organik sehingga penting dalam membantu pertumbuhan dan produktivitas tanaman (Widyati, 2013).
Mikroorganisme tanah merupakan jasad hidup yang memiki ukuran sangat kecil terdapat di dalam tanah. Setiap sel tunggal mikroorganisme mempunyai kemampuan untuk melangsungkan aktivitas hidup yaitu dapat mengalami pertumbuhan, menghasilkan energi, dan bereproduksi sendiri. Pertumbuhan individu (sel) pada mikroorganisme dapat berubah langsung menjadi pertumbuhan populasi. Batasan antara pertumbuhan sel dan populasi menjadi sulit untuk diamati dan dibedakan karena perubahannya yang terlalu cepat dan kemudian kadang-kadang terjadi sebagai satu kesatuan populasi (Fifendy dan Biomed, 2015).
Kapasitas tukar kation (KTK), C-Organik, dan pH merupakan sifat kimia tanah yang dapat mempengaruhi jumlah mikroorganisme yang ada di dalam tanah. Jumlah mikroorganisme yang melimpah menggambarkan tingkat kesuburan tanah beserta sifat tanah secara biologis. Total mikroorganisme menjadi salah satu faktor yang mempengaruhi aktivitas mikroorgansime tanah. Aktivitas mikroorganisme menurun jika total mikroorganisme sedikit disertai pH tanah masam, bahan organik rendah, dan kapasitas tukar kation (KTK) tanah yang rendah. Suhu tanah yang semakin tinggi, maka semakin sedikit mikroorganisme yang mampu bertahan sehingga populasi mikroorganisme akan menurun (Sinaga dkk., 2015).
2.6 Populasi Mikroorganisme Spesifik (Bacillus Sp)
Basillus sp merupakan mikroorganisme berupa bakteri aerobik, memiliki endospora (struktur dengan dinding yang tebal dan lapisan tambahan pada sel
bakteri yang dibentuk dibagian dalam membran sel), sel berbentuk batang, dan
mikroorganisme yang paling beragam dan secara komersial menguntungkan. Bakteri ini tersebar secara luas di air, udara, maupun tanah dimana terlibat dalam berbagai transformasi kimia bersaing dengan pseudomonas dan actinomycetes. Kemampuan mereka dalam beradaptasi di lingkungan ekstrem (tahan suhu dan pH tinggi maupun rendah) menjadikan bakteri ini sumber penting untuk enzim secara komersial. Strain bacillus sp saat ini digunakan untuk produksi 4 jenis utama produk yaitu enzim, antibodi, biokimia halus (termasuk penambah rasa dan suplemen makanan), dan insektisida (Harwood, 1989).
Bakteri bacillus sp. selain digunakan dalam proses industri, bakteri ini juga memiliki potensi mendegradasi plastik karena mampu tumbuh dalam medium yang digunakan. Isolat Bacillus mampu mendegradasi plastik lebih tinggi pada plastik hitam daripada plastik yang terdapat di plastik putih dan transparan karena inokulum uji degradasi molekul bukan pada molekul asli. Bakteri susah mendegradasi karena tingkat kejenuhan molekul meningkat dimana tertutupnya molekul asli plastik oleh molekul polimer zat-zat tambahan yang adanya pada plastik hitam. Bakteri bacillus sp. Mampu menggunakan ppolimer plasti sebagai sumber karbon sehingga mampu membelah diri (Marjayandari dan Shovitri., 2015).
Bacillus sp. bertahan hidup pada tanah rhizosfer karena dapat membentuk endospora dimana bakteri lain akan mati akibat pemanasan. Hasil pewarnaan gram pada isolat bakteri pada tanah rhizosfer menunjukkan gram positif, bentuk sel batang dengan berbagai ukuran dan rangkaian yang berbeda-beda. Kemampuan dalam melarutkan fosfat ditandai dengan terbentuknya holozone (zona bening) di sekitar koloni bakteri. Beberapa jenis bakteri bacillus sp. menghasilkan enzim ekstraseluler yang dapat menghidrolisis protein dan polisakarida kompleks. Isolat bakteri bascillus sp. dapat melarutkan fosfat melalui sekresi asam organik, juga dapat menghasilkan Indole Acetic Acid (IAA). Holozone (zona terbentuk) terbentuk karena adanya aktivitas melarutkan dan memecahnya ikatan fosfat dengan unsur lain seperti kalsium (Ca) oleh bakteri. Mekanisme lain dapat terjadi karena enzim fitase yang dihasilkan oleh bakteri sedang beraktivitas (Mukamto dkk., 2015).
Bakteri bacillus sp. merupakan salah satu bakteri tanah pelarut fosfat yang memiliki kemampuan untuk melarutkan P di dalam tanah. Bacillus sp. mampu memproduksi dan melepaskan suatu asam organik yang membentuk kompleks stabil dengan kation-kation pengikat P sehingga mengubah fosfat menjadi mudah terlarut dalam tanah. Bakteri bacillus sp. berpotensi memiliki kemampuan menjadi isolat PGPR dan biocontrol sehingga dapat digunakan sebagai biofertilizers dan agen biokontrol. Plant Growth Promoting Rizobacteria (PGPR) dapat mempengaruhi mekanisme pertumbuhan tanaman secara langsung maupun tidak langsung dan meningkatkan produktivitas tananman sehingga diharapkan dapat mengurangi polusi dan melestarikan lingkungan dalam semangat pertanian ekologis (Gheeta et al., 2014).
2.7 Hipotesis
1. Jumlah Mikroorganisme di lahan tembakau daerah sumbersari memiliki populasi yang baik
2. Aktivitas dan populasi mikroorganisme memiliki hubungan yang positif terhadap kesuburan tanah tembakau di Kecamatan Sumbersari Kabupaten ember.
BAB 3. METODE PRAKTIKUM
2.1 Biofisik Tanah 3.1.1 Waktu dan Tempat
Waktu dan tempat praktikum biologi tanah acara pertama yaitu Biofisik Tanah di lakukan di Desa Sumbersari untuk pengambilan sampel tanah pada hari selasa 25 September 2018 pukul 11.40-Selesai.
3.1.2 Alat
1. Sekop atau sendok tanah 2. Bor tanah
3. Kantong plastik (plastik klip) 4. Pisau/gunting
5. Ember atau baskom plastis 6. Kotak es (ice box)
7. Kertas/karton label
8. Botol selai bertutup atau botol lain yang sejenis (untuk contoh tanah anaerobik)
9. Parafilm atau selotip
3.1.3 Bahan 1. Alkohol 90-95% 2. Tanah
3.1.4 Prosedur kerja
1. Menetapkan lokasi sampling dan siapkan alat serta bahan
2. Bersihkan permukaan tanah di lokasi/titik pengambilan contoh dari tanaman dan serasah (litter). Kemudian tetapkan volume penggalian tanah, misalnya 20 x 20 x 20 cm atau 10 x 10 x 20 cm (panjang, lebar dan kedalaman), yang penting ukuran volume pengambilan contoh ini konsisten di tiap titik pengambilan contoh.
3. Menggali tanah dengan sendok tanah atau spatula (kape). Gunakan bor tanah untuk pengambilan contoh tanah pada kedalaman tertentu.
4. Bersihkan tanah galian dari sisa tanaman dan potongan akar.
5. Dengan sendok tanah, memasukkan sejumlah tanah dengan volume atau berat tertentu (sesuai kebutuhan) ke dalam kantong plastik dan diberi label. Mengunakan botol selai bertutup atau yang sejenis untuk contoh tanah anaerobik. Untuk contoh komposit, contoh tanah ini dimasukkan ke dalam ember atau baskom plastik untuk digabung dengan anak contoh tanah lain. Setelah diaduk rata dengan sendok tanah, sejumlah tanah dengan volume atau berat tertentu (sesuai kebutuhan) dimasukkan ke dalam kantong plastik dan diberi label.
6. Masukkan segera contoh tanah ke dalam kotak es agar terhindar dari suhu tinggi. Pemberian es batu dalam kotak es dilakukan bila perjalanan contoh tanah ke laborato-rium memerlukan waktu lama.
7. Uji hara dengan PUTK a. Uji P :
1. Masukkan setengah sendok tanah kedalam tabung glass.
2. Kemudian tambahkan 3 ml P1 dan 10 butir P2 ke dalam tabung gelas. 3. Setelah semua di masukkan diamkan selama 10 menit.
4. Setelah di diamkan selama 10 menit kemudian bandingkan warna pada kertas tabel yang tersedia
b. Uji K
1. Masukkan setengah sendok tanah kedalam tabung gelas. 2. Tambahkan 4 ml K1 kedalam tabung gelas.
3. Tambahkan 2 tetes K2 ke dalam tabung gelas. 4. Tambahkan 2 ml K3 ke dalam tabung gelas.
5. Setelah semuanya di masukkan diamkan beberapa saat. 6. Setelah di diamkan, lihat kabut putih pada tabung gelas. c. Uji C-Organik
1. Masukkan setengah sendok tanah kedalam tabung gelas. 2. Tambahkan 1 ml C1 kedalam tabung gelas.
3. Tambahkan 3 tetes C2 ke dalam tabung gelas.
4. Setelah semua dimasukkan diamkan selama 10 menit . 5. Setelah di diamkan, amati ketinggian busanya.
3.1.5 Diagram Alir
Memasukkan sample ke dalam tabung reaksi masing-masing Memasukkan sample pada box ice
Menguji hara dengan PUTK
Mengambil ½ sendok tanah untuk uji N Mengambil ½ sendok tanah untuk uji pH Mengambil ½ sendok tanah untuk uji K Mengambil ½ sendok tanah untuk uji P Memasukkan 2 ml N-1 Memasukkan 2 ml P-1 Memasukkan 2 ml K-1 Memasukkan 2 ml pH-1 Memasukkan 2 ml N-2 Menambahkan 5-10 tetes N-4 Menambahkan 5-10 tetes P-4 Menambahkan 1tetes K-3 Memasukkan 1-2 tetes pH-1-2 Memasukkan 1 tetes K-2
Memasukkan sample pada plastic clip dan diberi label Menetapkan lokasi sampling dan menyiapkan alat dan bahan
Menentukan pengambilan sample tanah panjang, lebar, dan kedalaman Menggali tanah dengan cangkul/sekop
3.2 Soil Fauna
3.2. Soil Fauna
3.2.1 Waktu dan Tempat
Waktu dan tempat praktikum Biologi acara kedua yaitu Soil Fauna mengenai identifikasi soil fauna dan menghitung populasi dilakukan di Laboratorium Biologi Jurusan Tanah pada hari selasa tanggal 02 Oktober 2018 pukul 11.40 WIB – Selesai.
3.2.2 Alat
1. Meteran kayu ukuran 1 m, meteran gulung ukurang 50 m terbuat dari logam atau fiber glass, meteran siku dari kayu atau logam.
2. Kayu/bambu persegi dengan ukuran 25x25 cm 3. Cangkul
4. Kantung kain (dari katun) 5. Mikroskop 6. Termometer 7. Higrometer 3.2.3 Bahan 1. Tanah Sampel 3.2.4 Proseur kerja
1. Tetapkan lokasi titik pengambilan sampel tanah 2. Tetapkan posisi blok dengan ukuran 25x25 cm
3. Letakkan kayu/bambu yang berbentuk persegi dengan ukuran 25x35 cm ke posisi blok yang sudah ditentukan
4. Cangkul sisi-sisi blok hingga kedalaman 20-30 cm 5. Ambil tanah blok
Mengacak masing-masing tabung reaksi kemudian mendiamkannya selama 5-10 menit. Membandingkan warna yang dihasilkan dan membaca status hara
6. Letakkan tanah sampel ke kain yang sudah disediakan 7. Amati fauna tanah yang ada di tanah tersebut
8. Setelah selesai mengamati makrofauna, sampel tanah dikembalikan ke tempat semula.
3.2.5 Diagram Alir
3.3 Respirasi
3.3.1 Waktu dan Tempat
Waktu dan tempat praktikum Biologi acara kedua yaitu Respirasi dilakukan di Laboratorium Biologi Jurusan Tanah pada hari selasa tanggal 02 Oktober 2018 pukul 11.40 WIB – Selesai.
Menetapkan lokasi titik pengambilan sampel tanah
Menetapkan posisi blok dengan ukuran 25x35 cm
Meletakkan kayu/bambu yang berbentuk persegi dengan ukuran 25x35 cm ke posisi blok yang sudah ditentukan
Mencangkul sisi-sisi blok hingga kedalaman 20-30 cm
Mengambil tanah blok
Menetapkan lokasi titik pengambilan sampel tanah
Menetapkan posisi blok dengan ukuran 25x35 cm
Meletakkan kayu/bambu yang berbentuk persegi dengan ukuran 25x35 cm ke posisi blok yang sudah ditentukan
3.3.2 Alat 1. Buret
2. Stoples plastik kedap udara 3. Botol plastic 4. Stirrer 5. Labu Erlenmeyer 6. Corong 7. Beaker Glass 3.3.3 Bahan 1. KOH 0,2 N 2. BaCl2 3 N 3. HCl 0,2 N
4. Indikator fenoptalin dan metil orange 0,1 % (1 g /100 ml alcohol 96%)
3.3.4 Prosedur Kerja
1. Masukan 100 g contoh tanah pada kapasitas lapang ke dalam stoples, dan 1 botol plastik terbuka berisi 10 ml 0,2N KOH lalu stoples ditutup rapat selama 7 hari inkubasi. Cara yang sama juga dilakukan untuk kontrol, yaitu stoples yang tidak diisi contoh tanah. Setelah 7 hari, ambil botol plastik yang berisi KOH dan CO2 yang sudah terikat, lalu tambahkan 2 tetes indikator fenoptalin dan titrasi dengan 0,2 N HCl sampai warna larutan berubah dari merah muda menjadi bening.
2. Selanjutnya tetesi KOH dengan 2 tetes metil orange sehingga larutan berubah menjadi kuning. Titrasi kembali dengan HCl 0,2N sampai warna kuning berubah menjadi orange.
3. Kadar CO2 pada masing-masing perlakuan diperoleh setelah dikurangi kadar CO2 pada stoples tanpa tanah. Kadar air tanah ditentukan setelah pengukuran CO2 dan hasilnya dinyatakan dalam berat kering oven 105° C.
4. Tentukan normalitas dengan memasukkan 16,67 ml HCl 37% (12 N) ke dalam labu ukur 1 l, kemudian encerkan dengan akuades sampai volume 1.000 ml.
5. Masukkan 9,535 g boraks (Na2B4O7.H2O BM=381,42) ke dalam labu ukur 250 ml dan encerkan dengan akuades sampai volume 250 ml.
6. Masukkan 10 ml boraks dan 2 tetes indikator meil orange ke dalam labu Erlenmeyer, lalu titrasi dengan HCl.
7. Perhitungan t = a mg 381,42/2 r =(a − b) × t × 2,4 × 100 n Keterangan :
r = jumlah CO2 yang dihasilkan
a = ml HCl untuk stoples dengan contoh tanah
b = ml HCl untuk stoples tanpa contoh tanah (blanko) t = normalitas HCl
n = jumlah hari inkubasi
3.3.5 Diagram Alir
Memasukan 100 g contoh tanah pada kapasitas lapang ke dalam stoples, dan 1 botol plastik terbuka berisi 10 ml 0,2N KOH lalu stoples ditutup rapat selama
7 hari inkubasi. Cara yang sama juga dilakukan untuk kontrol, yaitu stoples yang tidak diisi contoh tanah. Setelah 7 hari, ambil botol plastik yang berisi
KOH dan CO2 yang sudah terikat, lalu menambahkan 2 tetes indikator fenoptalin dan titrasi dengan 0,2 N HCl sampai warna larutan berubah dari
merah muda menjadi bening.
Selanjutnya menetesi KOH dengan 2 tetes metil orange sehingga larutan berubah menjadi kuning. Titrasi kembali dengan HCl 0,2N sampai warna
kuning berubah menjadi orange.
Kadar CO2 pada masing-masing perlakuan diperoleh setelah dikurangi kadar CO2 pada stoples tanpa tanah. Menentukan kadar air tanah setelah pengukuran
3.4 Populasi Mikroorganisme Total 3.4.1 Waktu dan Tempat
Waktu dan tempat praktikum biologi tanah acara keempat yaitu populasi MO total mengenai identifikasi dan menghitung populasi mikroorganisme total di lakukan di Laboratorium Biologi Jurusan Ilmu Tanah pada hari selasa 16 Oktober 2018 pukul 11.40-Selesai. 3.4.2 Alat 1. Botol Kocok 2. Tabung Reaksi 3. Autoklaf 4. Cawan Petri 5. Inkubas
Menentukan normalitas dengan memasukkan 16,67 ml HCl 37% (12 N) ke dalam labu ukur 1 l, kemudian mengenencerkan dengan akuades sampai
volume 1.000 ml.
Memasukkan 9,535 g vboraks (Na2B4O7.H2O BM=381,42) ke dalam labu ukur 250 ml dan mngencerkan dengan akuades sampai volume 250 ml.
Perhitungan t = a mg
381,42/2
r =(a − b) × t × 2,4 × 100 n
Memasukkan 10 ml boraks dan 2 tetes indikator meil orange ke dalam labu Erlenmeyer, lalu menitrasinya dengan HCl.
3.4.3 Bahan
1. Larutan Fisiologis 2. Sampel Tanah
3. Kapas Aluminium Foil 4. Medium Biakan
3.4.4 Prosedur kerja
a. Pembuatan seri pengenceran 1. Membuat larutan fisiologis
2. Masukkan 90 ml larutan fisiologis ke dalam botol kocok 3. Masukkan 9 ml larutan fisiologis pada tabung reaksi
4. Siapkan 7 tabung reaksi kemudian tutup tabung reaksi dengan kapas, sebelumnya menutup kapas dengan aluminium Oil
5. Autoklaf tabung reaksi selama 20 menit pada temperature 1210C 6. Dinginkan larutan tersebut sampai suhu antara 42-450C
7. Timbang 10 gram sampel tanah dan memasukkannya dalam botol kocok yang berisi 90 ml larutan fisiologis, kemudian mengocoknya selama 5 menit.
8. Pipet larutan tersebut sebanyak 1 ml dan memasukkannya ke tabung reaksi berisi 9 ml larutan fisiologis selanjutnya mengocoknya.
9. Pindahkan 1 ml larutan 10-1 ini ke dalam 9 ml larutan fisiologis selanjutnya hingga pengenceran 10-8b.
b. Pembuatan Medium Biakan Bakteri Tanah
1. Larutkan masing-masing bahan dalam Erlenmeyer
2. Sterilkan medium dalam autoklaf dengan temperature 1210 C selama 15 menit.
c. Pembuatan Medium Biakan Fungi Tanah
1. Larutkan masing-masing bahan dalam Erlenmeyer 2. Autoklaf medium
3. Dinginkan sampai suhu 50-550 C d. Isolasi Mikroorganisme
1. Ambil 1 ml larutan tanah dari serial pengeneran 10-4 sampai 10-8 2. Masukkan dalam cawan petri steril
3. Tuangkan kurang lebih 12-15 ml medium biakan ke cawan petri berisi 1 ml larutan tanah
4. Beri label pada masing-masing cawan peri 5. Balik cawan bila agar memadat
6. Inkubasi biakan mikroorganisme pada suhu ruang
3.4.5 Perhitungan
Pada metode perhitungan cawan ini dilakukan pengenceran yang bertingkat yang ditujukan untuk membentuk konsentrasi dari suatu suspensi bakteri. Sampel yang telah di encerkan di hitung ke dalam cawan baru kemudian di tuang ke mediumnya (metode tuang). Kemudian setelah diinkubasi selama 24-48 jam, amati koloni yang tumbuh dan koloni yang diamati hanyalah koloni yang berjumlah 30-300 koloni. Setelah diperoleh data jumlah koloni dari pengamatan jumlah koloni bakteri, selanjutnya adalah menghitung jumlah mikroorganisme dari sampel tanah dengan menggunakan rumus sebagai berikut:
CFU = Jumlah koloni x Faktor Pengenceran
3.4.6 Diagram Alir
Membuat seri pengenceran dengan cara memipet 10-1 sejumlah 1 ml ke dalam larutan fisiologis di tabung reaksi kemudian memvortex agar suspense mikrobia homogen. Suspensi yang baru dibuat ini adalah pengenceran 100 kali
atau 10-2. Begitulah seterusnya sampai memperoleh pengenceran 10 -7.
Memipet 1 ml dari pengenceran10 -6, 10 -7 dan 10 -8 ke dalam cawan petri steril dan mengulang sampai 3 kali setiap pengencaran tersebut.
Menyiapkan dan mendinginkan media PCA dengan temperatur 40 – 45°C, kemudian menuangkan dalam petri tersebut + 15 ml lewat bunsen, memutar 3
kali agar media rata keseluruh cawan.
Setelah media benar – benar padat, menginkubasi pada temperatur yang diinginkan meletakkan cawan terbalik pada incubator agar uap air tidak
3.5 Mikroorganisme Spesifik 3.5.1 Waktu dan Tempat
Waktu dan tempat praktikum biologi tanah acara kelima yaitu populasi Mikroorganisme Spesifik mengenai pengamatan mikroorganisme dan menghitung populasi mikroorganisme di lakukan di Laboratorium Biologi Jurusan Ilmu Tanah pada hari selasa 23 Oktober 2018 pukul 11.40-Selesai.
3.5.2 Alat
1. Erlenmeyer 250 ml
Menyiapkan cawan petri steril dan larutan fisiologis 9 ml dalam tabung reaksi dan mengautoclave, masing – masing kelompok.
Menyiapkan contoh tanah menimbang 10 gram ke dalam 90 ml larutan fisiologisdan menempatkan dalam Erlenmeyer 250 ml, larutan tersebut bernilai
10-1. Melakukan penggojokan selama 15 menit.
Menginkubasikan 5 – 7 hari kemudian melakukan perhitungan. Jumlah koloni di dua cawan petri yang berturut – turut pengencerannya dari contoh yang
sama harus merupakan kelipatan 10 yang sama dengan pengenceran.
Bila dari pengenceran yang paling tinggi jumlah koloni melebihi 300 koloni percawan petri berarti bahwa pengenceran terlalu rendah, sebaliknya bila pengenceran yang paling rendah jumlah koloni kurang dari 30, ini berarti bahwa pengenceran terlalu tinggi, jika semua cawan petri menghasilkan koloni
yang memuaskan, memilih cawan petri yang berisi 30 sampai 300 koloni percawan petri. Untuk memudahkan perhitungan, menggunakan Colony
Counter Number.
Perhitungan dari hasil. Mengalikan rata – rata jumlah koloni per cawan petri dengan faktor pengenceran untuk mendapatkan jumlah mikroorganisme total per gram contoh (tanah) kering udara. Mengkonversikan hasil ini ke jumlah
mikroorganisme didalam 1 gram tanah kering mutlak dengan memperhitungkan kadar air tanah.
2. Tabung Reaksi 3. Autoclave 4. Micropippete 5. Bunsen 6. Cawan peri 7. Laminar Air Flow
8. Colonoy Counter Number
3.5.3 Bahan
1. Media Pykovskaya
2. Larutan Fisiologis (8.5 gr/ liter) 3. Alkohol
4. Spirtus 5. Kapas steril
3.5.4 Prosedur Kerja
1. Masing – masing kelompok menyiapkan cawan petri steril dan larutan fisiologis 9 ml dalam tabung reaksi dan diautoclave.
2. Siapkan contoh tanah timbang 10 gram ke dalam 90 ml larutan fisiologis yang ditempatkan dalam Erlenmeyer 250 ml, larutan tersebut bernilai 10-1 3. Buat seri pengenceran dengan cara memipet 10-1 sejumlah 1 ml ke dalam
larutan fisiologis di tabung reaksi kemudian di vortex agar susupensi bacteria homogen. Susupensi yang baru dibuat ini adalah pengenceran 100 kali atau 10-2. Begitulah seterusnya sampai diperoleh pengenceran 10-7.
4. Pipet 1 ml dari pengenceran10-5, 10-6 dan 10-7 ke dalam cawan petri steril dan ulang sampai 3 kali setiap pengencaran tersebut.
5. Siapkan media Pykovskaya yang telah didinginkan dengan temperature 40 – 45oC, kemudian tuangkan dalam petri tersebut + 15 ml lewat bunsen, putar 3 kali agar media rata keseluruh cawan.
6. Setelah media benar – benar padat, inkubasikan pada temperatur yang diinginkan letakkan cawan terbalik pada incubator agar uap air tidak menempel pada cawan petri.
7. Inkubasikan 5 – 7 hari kemudian lakukan perhitungan. Jumlah koloni di dua cawan petri yang berturut – turut pengencerannya dari contoh yang sama harus merupakan kelipatan 10 yang sama dengan pengenceran.
8. Bila dari pengenceran yang paling tinggi jumlah koloni melebihi 300 koloni percawan petri berarti bahwa pengenceran terlalu rendah, sebaliknya bila pengenceran yang paling rendah jumlah koloni kurang dari 30 , ini berarti bahwa pengenceran terlalu tinggi,jika semua cawanpetri menghasilkan koloni yang memuaskan, pilih cawan petri yang berisi 30 sampai 300 koloni percawan petri. Untuk memudahkan perhiutungan gunakan Colony Counter Number.
9. Perhitungan dari hasil. Kalikan rata – rata jumlah koloni per cawan petri dengan faktor pengenceran untuk mendapatkan jumlah mikroorganisme total per gram contoh (tanah) kering udara. Hasil ini dikonversikan ke jumlah mikroorganisme didalam 1 gram tanah kering mutlak dengan memperhitungkan kadar air tanah.
3.5.5 Perhitungan
Metode perhitungan cawan didasarkan pada bahwa setiap sel yang hidup dapat berkembang menjadi koloni. Pada metode perhitungan cawan dilakukan pengenceran yang bertingkat yang mana ditujukan untuk membentuk konsentrasi dari suatu suspensi bakteri. Sampel yang telah di encerkan ini di hitung ke dalam cawan baru kemudian di tuang ke mediumnya (metode tuang). Kemudian setelah diinkubasi selama 24-48 jam, amati koloni yang tumbuh dan koloni yang diamati hanyalah koloni yang berjumlah 30-300 koloni. Setelah diperoleh data jumlah koloni dari pengamatan jumlah koloni bakteri, selanjutnya adalah menghitung jumlah mikroorganisme dari sampel tanah dengan menggunakan rumus sebagai berikut:
3.5.6 Diagram Alir
Masing – masing kelompok menyiapkan cawan petri steril dan larutan fisiologis 9 ml dalam tabung reaksi dan diautoclave.
Menyiapkan contoh tanah dan menimbang 10 gram ke dalam 90 ml larutan fisiologis yang ditempatkan dalam Erlenmeyer 250 ml, larutan tersebut bernilai 10-1
Membuat seri pengenceran dengan cara memipet 10-1 sejumlah 1 ml ke dalam larutan fisiologis di tabung reaksi kemudian di vortex agar susupensi bacteria homogen. Susupensi yang baru dibuat ini adalah pengenceran 100 kali atau 10-2. Begitulah seterusnya sampai diperoleh pengenceran 10-7.
Pipet 1 ml dari pengenceran10-5, 10-6 dan 10-7 ke dalam cawan petri steril dan ulang sampai 3 kali setiap pengenceran tersebut.
Siapkan media Pykovskaya yang telah didinginkan dengan temperature 40 – 45oC, kemudian tuangkan dalam petri tersebut + 15 ml lewat bunsen, putar 3 kali agar media rata keseluruh cawan.
Setelah media benar – benar padat, inkubasikan pada temperatur yang diinginkan letakkan cawan terbalik pada incubator agar uap air tidak menempel pada cawan petri.
Menginkubasikan 5 – 7 hari kemudian lakukan perhitungan. Jumlah koloni di dua cawan petri yang berturut – turut pengencerannya dari contoh yang sama harus merupakan kelipatan 10 yang sama dengan pengenceran.
Bila dari pengenceran yang paling tinggi jumlah koloni melebihi 300 koloni percawan petri berarti bahwa pengenceran terlalu rendah, sebaliknya bila pengenceran yang paling rendah jumlah koloni kurang dari 30 , ini berarti bahwa pengenceran terlalu tinggi,jika semua cawanpetri menghasilkan koloni yang memuaskan, memilih cawan petri yang berisi 30 sampai 300 koloni percawan petri. Untuk memudahkan perhiutungan gunakan Colony Counter Number.
Perhitungan dari hasil. Mengalikan rata – rata jumlah koloni per cawan petri dengan faktor pengenceran untuk mendapatkan jumlah mikroorganisme total per
gram contoh (tanah) kering udara. Mengkonversikan hasil ini ke jumlah mikroorganisme didalam 1 gram tanah kering mutlak dengan memperhitungkan
BAB 4. HASIL DAN PEMBAHASAN 4.1 Hasil
4.1.1 Biofisik Tanah
Tabel 4.1 Kondisi Lingkungan Wilayah Tanaman Tembakau
1. Form No : 002/lab.BT/JT/2018
2. Kode SL (Satuan Lahan) :
3. Tanggal Pemantauan : 25 september 2018
4. Nama Kelompok : 2/C
5. GPS-UTM : X=8◦10’15.4”S
Y=113◦43’39,7”E
6. Ketinggian : 269 mdpl
7. Jenis Tanah : Andisol coklat
Dusun : Karang Baru Desa : Karang Rejo Kecamatan : Sumbersari Kabupaten : Jember Propinsi : Jawa Timur
8. Vegetasi : Tembakau
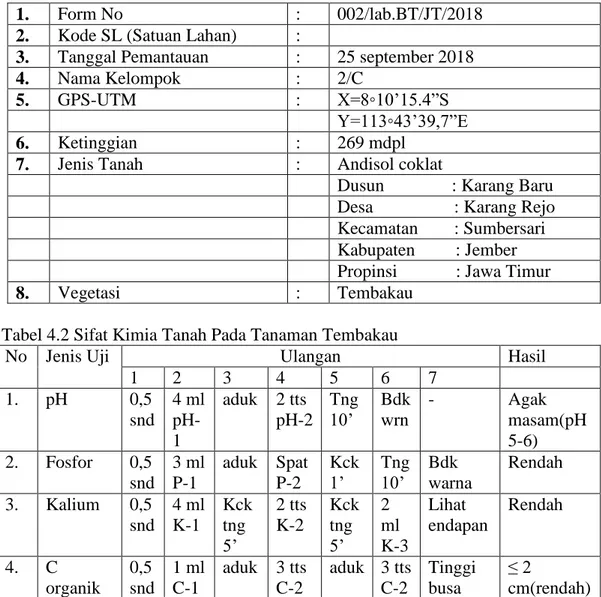
Tabel 4.2 Sifat Kimia Tanah Pada Tanaman Tembakau
No Jenis Uji Ulangan Hasil
1 2 3 4 5 6 7 1. pH 0,5 snd 4 ml pH-1 aduk 2 tts pH-2 Tng 10’ Bdk wrn - Agak masam(pH 5-6) 2. Fosfor 0,5 snd 3 ml P-1 aduk Spat P-2 Kck 1’ Tng 10’ Bdk warna Rendah 3. Kalium 0,5 snd 4 ml K-1 Kck tng 5’ 2 tts K-2 Kck tng 5’ 2 ml K-3 Lihat endapan Rendah 4. C organik 0,5 snd 1 ml C-1 aduk 3 tts C-2 aduk 3 tts C-2 Tinggi busa ≤ 2 cm(rendah) Berdasarkan data yang diperoleh pada saat pelaksanaan analisis biofisik tanah di Desa Karang Rejo Kecamatan sumbersari Kabupaten Jember pada lahan vegetasi tembakau diperoleh yaitu kandungan K dan P rendah, C-organik rendah kurang dari 2 cm. Keadaan kemasaman tanah pada lahan tembakau menunjukkan angka 5-6 (agak masam).
4.1.2 Makro Fauna Tanah
2. Kelompok : 2/C
3. Lokasi : Jl. Tidar Sumbersari Kabupaten Jember Suhu : 34◦C
Kelembaban : 47% 4. Vegetasi : Tembakau
Tabel 4.3 Soil Fauna Titik Pengambilan Sampel Pertama
No Jenis Makro Fauna Jumlah Diskripsi
1.
7
Ulat tanah (Agrotis Ipsilan) Ulat tanah menjadi hama
pada tanaman Klasifikasi : Kingdom : Animalia Fylum :Arthropoda Kelas :Insecta Ordo :Lepidoptera Family :Noctulidae Genus :Agrotis Spesies :Agrotis
Spenes :Argotis Ipsilon
2. 90 Semut hitam(Dolichoderus Thoracicus)
Sarang semut hitam biasanya berda di atas permukaan tanah (tumpukan seresah) Klasifikasi : Filum : Arthropoda Kelas :Hexapoda Ordo :Hymenoptera Family :Formicidae Sub Family :Dolichoderinae Genus :Dolichopderus Spesies :Dolichoderus Thoracicus Smith) 3. 1 Klasifikasi : Kingdom :Animalia Kelas :Diplopoda Ordo :Spirosmeptidae Family :Spirosmeptidae Genus :Spirostreptus Keluwing termasuk hewan herbivora
Gerak lambat, bila disentuh cepat menggulung Berwarna kuning keputihan Memiliki sepasang antena di depan kepalanya
Tabel 4.4 Soil Fauna Titik Pengambilan Sampel Kedua
No Jenis Makro Fauna Jumlah Diskripsi
1.
1
Kaki Seribu (Julus Virgatus) Habitat kaki seribu di
tempat lembab Hewan herbivora Klasifikasi :
Kingdom :Animalia Sub Kingdom :Invertebrata Phylum :Arthropoda Kelas :Myrlopoda Ordo :Diploda Family :Juluidade Genus :Julus
Spesies :Julus Virgatus 2.
95
Semut hitam(Dolichoderus Thoracicus)
Sarang semut hitam biasanya berda di atas permukaan tanah (tumpukan seresah) Klasifikasi : Filum : Arthropoda Kelas :Hexapoda Ordo :Hymenoptera Family :Formicidae Sub Family :Dolichoderinae Genus :Dolichopderus Spesies :Dolichoderus Thoracicus Smith)
Berdasarkan hasil praktikum lapang acara soil fauna di darah sumbersari tidar dengan suhu 34 derajat celcius dan kelembab 47% dengan vegetasi tembakau. Mengetahui makro fauna yang ada di dalam tanah tembakau di lakukan dengan pengambilan 2 titik sampel tanah. Pengambilan sampel tanah yang akan di amati makro faunanya yaitu dengan cara menggunakan balok persegi ukuran 25x25 cm dengan sekop untuk mengambil tanahnya, kemudia tanah tersebut diletakkan di atas kain berwarna putih agar makro faunanya terlihat jelas. Titik pengambilan sampel yaitu adanya ulat tanah dengan ordo diploda sejumlah 7, ciri-ciri berwarna coklat ukuran tubuh kira-kira 1-1,5 cm dan ulat tanah menjadi hama pada tanaman, makro fauna yang kedua yaitu semut hitam dengan ordo hymenoptera sejumlah 90 pada titik pengambilan pertama, pada titik pengambilan kedua yaitu sejumlah 95 semut dengan ciri-ciri memiliki antena, tubuhnya terdiri dari tiga bagian yaitu kepala, dada dan perut serta semut memiliki 3 pasang kaki.
Makro fauna jenis keluwing dengan ordo spirosmeptidae pada titik pengambilan pertama sejumlah 1 keluwing dengan ciri-ciri berwarna kuning keputihan, memiliki sepasang antena di depan kepalanya, apabila disentuh keluwing cepat menggulung. Makro fauna selanjutnya yaitu ditemukan kaki seribu dengan ordo diploda pada titik pengambilan pertama dengan ciri-ciri warna yang coklat dan memiliki jumlah pasang kaki yang banyak.
4.1.3 Respirasi Tanah
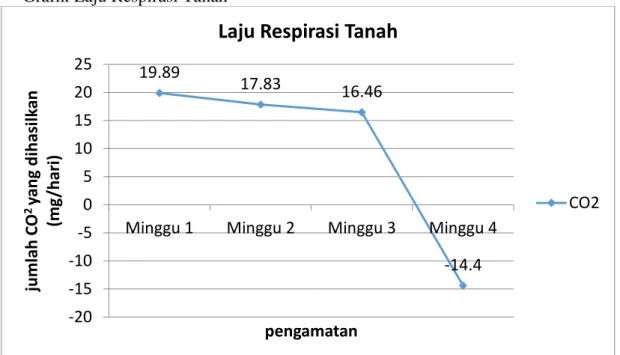
Tabel 4.5 Respirasi Tanah Pada Tanaman Kopi Robusta Pengamatan Ke- Tanggal a b t n R (mg/hari) 1 16-10-18 3,4 ml 0,5 0,2 7 19,89 2 23-10-18 3,3 ml 0,7 0,2 7 17,83 3 30-10-18 3,2 ml 0,8 0,2 7 16,46 4 6-10-18 0,5 ml 2,6 0,2 7 -14,4
Grafik Laju Respirasi Tanah
Gambar 4.1 Grafik Respirasi Tanah
Berdasarkan dari hasil tabel di atas, pengamatan respirasi tanah yang sudah di lakukan dapat diketahui bahwa pengamatan respirasi tertinggi pada minggu pertama dan pengamatan resprasi terendah pada minggu terakhir atau keempat. Hal ini karena pada minggu pertama kandungan bahan organiknya banyak sehingga hasil respirasinya tinggi. Minggu kedua hingga minggu terakhir hasil pengamatan respirasi mulai menurun karena kabdungan bahan organik tiap minggunya berkurang.sehingga dapat diperoleh pada grafik yang menunjukkan hasil respirasi tiap minggu yang menurun.
4.1.4 Penetapan Populasi Mikroorganisme
Tabel 4.6 Jumlah Populasi Mikroorganisme Total Pada Tanaman Tembakau
Pengenceran Ulangan Rata-rata Jumlah Bakteri 1 2 3 10-6 90 80 270 146,67 146,67 X 106 10-7 30 spread 100 - 10-8 Spread 50 30 - 19.89 17.83 16.46 -14.4 -20 -15 -10 -5 0 5 10 15 20 25
Minggu 1 Minggu 2 Minggu 3 Minggu 4
ju m la h C O 2 ya n g d ih asi lk an (m g/h ar i) pengamatan
Laju Respirasi Tanah
Berdasarkan hasil yang didapatkan menunjukkan bahwa jumlah total bakteri pada cawan petri yaitu sebesar 146,67 x 106 (CFU) g-1. Pengenceran dilakukan pada seri pengenceran 10-6,10-7, dan 10-8 dengan 3 kali pengulangan pada media yang digunakan yaitu media PCA (Plate Count Agar). Seri pengenceran 10-6, pada ulangan 1 jumlah bakteri sebanyak 90, ulangan 2 jumlah bakterinya sebanyak 80 sehingga didapatkan jumlah bakteri rata-rata sebesar 146,67, dan ulangan 3 jumlahnya sebanyak 270. Seri pengenceran 10-7, pada ulangan 1 jumlah bakteri sebanyak 30, ulangan 2 jumlah bakterinya spread, dan ulangan 3 jumlahnya sebanyak 100. Seri pengenceran 10-8, hanya ulangan 2 dan 3 yang sesuai jumlahnya yaitu 50 dan 30 sedangkan ulangan 1 menunjukkan spread (menyebar) sehingga tidak digunakan. Semua ulangan pada seri pengenceran 10-7, dan 10-8 tidak digunakan karena tidak sesuai ketentuan perhitungan koloni.
4.1.5 Penetapan Populasi Mikroorganisme spesifik (Bacillus sp.) Tabel 4.7 Jumlah Mikroorganisme spesifik Bacillus sp. (Pycovskaya)
Pengenceran Ulangan Rata-rata Jumlah Bakteri 1 2 3 10-5 10 110 100 105 10-6 50 80 90 85 47,75 x 106 10-7 30 spread spread -
Berdasarkan hasil yang didapatkan menunjukkan bahwa jumlah total bakteri pada cawan petri yaitu sebesar 47,75 x 106 (CFU) g-1. Pengenceran dilakukan pada seri pengenceran 10-5,10-6, dan 10-7 dengan 3 kali pengulangan pada media yang digunakan yaitu media pykoskaya. Seri pengenceran 10-5, pada ulangan 1 jumlah bakteri sebanyak 10, ulangan 2 jumlah bakterinya sebanyak 110, dan ulangan 3 jumlahnya sebanyak 100. Seri pengenceran 10-6, pada ulangan 1 jumlah bakteri sebanyak 50, ulangan 2 jumlah bakterinya sebanyak 80,
dan ulangan 3 jumlahnya sebanyak 90 sehingga didapatkan jumlah bakteri rata-rata sebesar 85. Seri pengenceran 10-7, hanya ulangan 1 yang sesuai jumlahnya yaitu 30 sedangkan ulangan 2 dan 3 menunjukkan spread (menyebar) sehingga tidak digunakan. Rata-rata jumlah bakteri seri pengenceran 10-7 yaitu 30. Semua ulangan pada seri pengenceran 10-7, ulangan 1 pada seri pengenceran 10-5 dan 10-6 tidak digunakan karena tidak sesuai ketentuan perhitungan koloni. Jumlah koloni normal yang dihitung untuk aturan perhitungan yaitu diantara 30 sampai dengan 300. Kejadian seperti spreader (koloni menyebar) yang menyebabkan kerusakan pertumbuhan koloni dan penghambatan atau tidak tumbuh, tidak digunakan dalam perhitungan koloni (Purwadi dkk., 2017).
4.2 Pembahasan
Pengambilan sampel tanah praktikum kali ini dilakukan pada lahan tembakau di daerah Sumbersari yang terletak di Jember dengan ketinggian 0-269 mdpl. Tujuan dari praktikum ini adalah untuk mengetahui biofisik tanah yaitu kandungan C-organik, pH tanah, Kalium serta Fosfor yang ada di tanah tembakau, jenis makro dan mikro fauna yang ada pada tanaman tembakau, mengetahui respirasi tanah vegetasi tembakau, mengetahui populasi mikroorganisme atau jumlah bakteri dan jumlah mikroorganisme spesifik yaitu bacillus sp dalam tanah tembakau pada Rizosfer tanah tembakau. Pengambilan sampel tanah merupakan kegiatan mengambil dan menganalisis tentang keadaan tanah untuk meningkatkan pengetahuan serta membantu petani dalam pengelolaan tanaman. Pengambilan sampel tanah harus memperhatikan biofisik lingkungan tersebut.
Biofisik merupakan informasi mengenai komponen biotik dan abiotik yang berhubungan serta saling mempengaruhi satu dengan lainnya. Komponen biotik merupakan mahkluk hidup seperti hewan, tumbuhan dan manusia. Berdasarkan data yang sudah didapat pada lahan pertanian sumbersari mendapat hasil seperti diatas.pengujian sampel tanah dilakukan dengan menggunakan PUTK untuk menguji coba pada tanah lahan kering (tanaman tembakau) yaitu uji Ph tanah, uji C-organik, Uji-F (fosfor), dan uji K. pH tanah merupakan tingkat keasaman atau
kebasa-an suatu tanah atau benda yang diukur dengan skala pH Pada uji Ph tanah yang kami amati memiliki ph tanah yang agak masam yaitu 5-6. Tanah yang memiliki sifat agak asam ini bisa dikarenakan curah hujan yang tinggi pada lahan pertanian tembakau dan memiliki drainase yang kurang baik. Semakin tinggi kemasaman tanah maka ketersediaan hara makro semakin rendah, apabila ketersediaan hara mikro semakin tinggi maka dapat meracuni tanaman.
Fosfor merupakan unsur hara mikro dan esensial bagi pertumbuhan. Fosfor biasa disebut sebagai kunci dari kehidupan karena terlibat langsung hampir pada semua proses. Uji-F (fosfor) mendapatkan hasil dengan melihat warna pada reaksi tersebut. Kandungan fosfor lahan pertanian tembakau mempunyai kandungan yang rendah dan menunjukkan warna pengujian berwarna non andisol atau berstatus sedang dengan rekomendasi tanaman untuk tanah yang mimiliki fosfor sedang yaitu jagung 175, kedelai 150, padi gogo 150.Unsur hara fosfor sangat penting bagi tanaman untuk menigkatkan produktivitas tanaman (Putri dkk.,2014).
Unsur K pada dasarnya berasal dari mineral yang terdiri dari primer tanah dan merupakan unsur hara utama ketiga setelah N dan P. Unsur hara kalium juga merupakan salah satu unsur yang sangat mobile didalam tanah yang berguna untuk memberi daya tahan terhadap kekeringan pada tanaman dan penyakit tanaman masih terdapat yang kekurangan unsur K. Salah satu penyebab kekurangan unsur kalium pada tanaman disebabkan karena unsur kalium ditanah yang rendah dan juga dapat disebabkan tingginya curah hujan yang menyebabkan unsur ini larut dalam air dan terbawa arus. Uji-K mendapatkan hasil dengan melihat endapan yang ada di reaksi tersebut. Hasil yang kami dapatkan tidak ada endapan dan dengan tidak ada endapan maka memiliki status rendah kalsium. Uji-K dapat direkomendasikan jagung, kedelai, dan padi gogo.
Warna tanah menunjukkan kandungan C-organik tanah tersebut. Kandungan bahan organik sangat erat berkaitan dengan KTK (kapasitas tukar kation). Uji C-organik mendapatkan hasil dengan melihat busa yang tersedia. Lahan pengamatan kami mendapatkan dengan tinggi busa yang rendah dengan tinggi busa kurang dari 2 cm. Menurut Silamon dkk, (2015) semakin curam
lereng maka aliran permukaan akan semakin besar dimana tanah yang banyak mengandung bahan organik akan turut terangkut dan terbawa ke tempat yang lebih rendah. C-organik tanah merupakan penyangga biologi tanah yang mampu menyeimbangkan hara dalam tanah dan menyediakan unsur hara bagi tanaman secara efisien. Fungsi dari C-organik dapat meningkatkan kesuburan tanah dan menyediakan mikro hara dan faktor-faktor pertumbuhan lainnya yang biasanya tidak disediakan oleh pupuk kimia (anorganik).
Mengetahui beberapa jenis makro dan mikro fauna yang ada pada tanaman tembakau itu sendiri menggunakan metode ring dengan lebar 25x25 cm. Praktikum ini dilakukan pada dua titik sampel, pada dua titik sampel tesebut terdapat fauna tanah yang berbeda-beda. Fauna tanah merupakan makhluk hidup yang tanah, baik yang hidup di dalam tanah maupun yang hidup di permukaan tanah. Fauna tanah adalah organisme yang sebagian atau seluruh hidupnya berada pada dalam tanah. Fauna tanah terdiri dari makro fauna, mikro fauna, dan meso fauna. Makro fauna yaitu makhluk hidup yang ada di dalam tanah yang mempunyai ukuran lebih dari 1cm misalnya cacing tanah, mpllusca, hexapoda dan sebagainya. Meso fauna yaitu makhluk hidup yang hidup d dalam tanah dan mempunyai ukuran tubuh 200 µm – 1cm, misalnya beberapa jenis serangga, nematoda dan sebagainya, sedangkan mikro fauna merupakan makhluk hidup yang ada di dalam tanah yang mempunyai ukuran 20 µm – 200 µm, misalnya protozoa. Keberadaan fauna tanah sangat dipengaruhi oleh kondisi tanah, salah satunya adanya seresah sebagai bahan organik dalam tanah. Keberadaan fauna tanah dapat dijadikan parameter dari kualitas tanah, fauna tanah yang digunakan sebagai bioindikator dalam kesuburan suatu tanah (Nurrohman, dkk. 2015).
Kehidupan fauna tanah dapat dipengaruhi oleh kondisi lingkungan yang merupakan tempat hidupnya. Factor yang mempengaruhi kahidupan fauna tanah itu diantaranya pH tanah, temperature tanah, temperature udara, kelembapan tanah,intensitas cahaya serta vegetasi-vegetasi yang ada. Kondisi lingkungan juga dapat menyebabkan adanya perbedaan jenis fauna-fauna tanah. Suhu merupakan salah satu factor fisika tanah yang sangat menentukan kehadiran dan kepadatan suatu organisme yang ada dalam tanah. Suhu berpengaruh dalam ekosistem
karena suhu merupakan syarat yang dibutuhkan suatu organisme untuk hidup dan bekembang secara baik. Umumnya fauna tanah lebih suka pada suhu-suhu agak rendah. Vegetasi juga dapat menentukan kelimpahan dan distribusi fauna tanah. Lokasi yang diambol merupakan lokasi yang didominasi oleh tanaman tembakau. Pada tanaman tembakau sendiri mempunyai keanekaragaman fauana tanah, mulai dari makrofauna, mikrofauan, dan mesofauna. Pada lahan praktikum yang kita lakukan hanya terdapat makrofauana diantaranya ulat, semut, keliwung, dan kaki seribu (Haneda dan Asti, 2014).
Respirasi tanah merupakan suatu indikasi subur tidaknya tanah dengan melihat populasi mikroorganisme dalam suatu tanah tertentu. Mikroorganisme sangat berpengaruh nyata terhadap kesuburan tanah, hal tersebut dapat dilihat dari fungsi mikroorganisme tanah yang berperan sebagai decomposer bahan-bahan organik yang dapat menjadi nutrisi baru bagi tanah dan menjadikan tanah memiliki kandungan hara yang mencukupi bagi tanaman yang berada di tanah tersebut. Mengidentifikasi dan mengetahui aktifitas dan jumlah mikroorganisme dalam tanah dapat menggunakan metode penghitungan jumlah mikroorganisme secara langsung dan juga menghitung kadar karbondioksida yang dikeluarkan atau dilepas oleh mikroorganisme dalam jangka waktu tertentu. Mengetahui kesuburan tanah dapat diketahui dengan cara lain seperti korelasi antara jumlah C organik tanah dengan jumlah mikroorganisme tanah, yang berkorelasi semakin tinggi nilai C organik tanah maka jumlah mikroorganisme di dalam tanah tersebut dipastikan banyak yang berkorelasi juga dengan jumlah karbondioksida yang dihasilkan mikroorganisme tanah juga tinggi (Nasution dkk, 2015).
Kadar karbon tanah setiap minggunya mengalami penurunan secara signifikan. Hal tersebut selaras dengan teori semakin banyak mikroorganisme dalam tanah, maka kadar karbondioksida yang keluar akan semakin banyak. Kadar karbondioksida setiap minggunya menurun dapat diakibatkan jumlah C-Organik dalam tanah yang menurun sehingga aktifitas mikroorganisme terbatas yang mempengaruhi jumlah karbondioksida yang dihasilkan. Tanah gambut yang memiliki kadar C-organik sangat tinggi berbanding lurus dengan aktifitas mikroorganisme yang tinggi dan kadar karbondioksida yang dihasilkan juga
sangat tinggi sehingga tanah gambut dapat dikatakan sebagai tanah yang menghasilkan kadar karbon tinggi dan penyebab pemanasan global (Saleh dkk, 2017).
Aktivitas mikroorganisme dimana nilai respirasi yang semakin tinggi, maka mikroorganisme memproduksi CO2 semakin tinggi pula. Faktor yang mempengaruhi aktivitas mikroorganisme tanah adalah pH, bahan organik, kapasitas tukar kation dan total mikroorganisme. pH tanah masam, bahan organik di tanah rendah, kapasitas tukar kation tanah rendah dan total mikroorganisme tanah sedikit maka aktivitas mikroorganisme tanah mengalami penurunan. Pengukuran respirasi mikroorganisme menggunakan metode jar dan metode titrimetri. Metode jar yaitu menginkubasi sampel tanah selama 14 hari ditempat gelap lalu melanjutkan dengan menggunakan metode titrimetri dimana menghitung produksi CO2 oleh mikroorganisme dari proses titrasi. Inkubasi sampel tanah harus ditempat gelap karena ada bakteri yang bersifat fotosintetik. Bakteri fotosintetik jika ada cahaya maka CO2 akan digunakan untuk melakukan fotosintesis sehingga mengakibatkan pengukuran repirasi menjadi kurang akurat. Oleh karena itu, inkubasi harus dilakukan ditempat yang gelap (Sinaga dkk., 2015).
Mikroorganisme tanah adalah salah satu faktor penting pada ekosistem tanah karena mempengaruhi siklus, ketersediaan unsur hara tanaman, dan stabilitas struktur tanah. Total mikroorganisme yang tinggi terjadi karena adanya akumulasi bahan organik dari lahan yang berada di atasnya. Bahan organik adalah makanan (energi) bagi mikroorganisme sehingga lahan-lahan yang memiliki persentase bahan organik yang tinggi akan memiliki jumlah mikroorganisme tanah yang lebih besar. Proses dekomposisi bahan organik banyak dilakukan oleh mikroorganisme. Pertumbuhan populasi mikroorganis memenunjukkan terjadi pertambahan kuantitas mikroorganisme yang dinyatakan dengan ukuran, pertambahan jumlah, dan ukuran koloni.Populasi mikroorganisme dinyatakan dengan satuan CFU (Coloni Form Unit).
Pertumbuhan mikroorganisme meningkat secara kuantitas berbanding lurus dengan bertambahnya masa inkubasi bahan organik di dalam media tanah.
petumbuhan tersebut menunjukkan seiring bertambahnya waktu inkubasi, bahan organik di dalam tanah mengalami proses dekomposisi. Jumlah populasi mikroorganisme yang meningkat terjadi karena kandungan bahan organik dalam tanah juga meningkat. Populasi mikroorganisme apabila tidak dapat dihitung populasi dengan satuan CFU (Coloni Form Unit) untuk menunjukkan hubungan populasi mikroorganisme dengan kandungan unsur hara karbon, maka dilakukan pembagian grade atau tingkatan dalam satu cawan (Sukaryorini dkk., 2016).
Metode yang digunakan untuk menghitung populasi (koloni) pada sampel yaitu metode hitungan cawan atau metode cawan agar. Prinsip dari metode hitungan cawan yaitu jumlah mikroba yang masih hidup ditumbuhkan dalam media agar. Sel mikroba yang masih hidup ditumbuhkan ke dalam media agar sehingga sel mikroba akan berkembangbiak dan membentuk koloni yang dapat dilihat langsung dengan mata tanpa bantuan alat bantu (mikroskop misalnya). Metode cawan agar dibedakan atas dua cara yaitu metode tuang dan metode sebar.
Metode cawan agar merupakan metode yang cukup sensitif. Hal ini dikarenakan hanya sel mikroorganisme yang hidup yang dapat dihitung. Selain itu beberapa sel yang berdekatan dapat dihitung sekaligus sebagai suatu koloni. Jumlah koloni mikroorganisme dihitung menggunakan alat colony counter number. Cara menghitung koloni pada cawan yaitu cawan yang dipilih dan dihitung merupakan cawan yang mengandung jumlah koloni 30 sampai 300. Beberapa koloni yang bergabung menjadi satu merupakan suatu kumpulan koloni yang besar dimana jumlah koloninya diraguakan, dapat dihitung sebagai satu koloni atau spread. Perhitungan koloni untuk menghitung jumlah total mikroorganisme fungi dan bakteri dilakukan dengan cara pengenceran, dengan cara memipet 10-1 sejumlah 1 ml ke dalam larutan fisiologis kemudian di vortex agar suspense mikroba homogen. Untuk melakukan perhitungan jumlah koloni mikroba membuat pengenceran 10-6,10-7,108 dengan jumlah pipet masing-masing 1 ml dan menuangkan ke dalam cawan petri steril dan mengulangi sampai 3 kali pengenceran,kemudian menyiapkan media PCA yang sudah didinginkan dengan temperatur 40-45◦C dan menuangkan dalam cawan petri kurang lebih 15 ml lewat bunsen dengan memutar 3 kali agar media tersebar rata keseluruh cawan. Setelah