PENGARUH PEMBERIAN SEDIAAN GEL EKSTRAK TEMPE TERHADAP PENYEMBUHAN LUKA PADA TIKUS DIABETES:
TINJAUAN EKSPRESI TNF-α DAN KOLAGEN.
TESIS
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Magister Farmasi (M. Farm.)
Program Studi Magister Farmasi
Disusun oleh:
Ignatius Adi Kurniawan, S. Farm., Apt. NIM: 178122005
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
YOGYAKARTA 2020
Persetujuan Pembimbing
PENGARUH PEⅣ BERIAN SEDRAN GEL EKSTRAK TEMPE TERHADAP PENYEMBUHAN LUKA PADA TIKUS DIABETES:
TINJAUAN EKSPRESI TNF‐α DAN KOLAGEN
Naskah Tesis yang dittukan oleh: Ignatius Adi Kumiawm,S Fa....,Apt
NIM:178122005 h C O 0 0 ん ヽ ノ 0 1 0 4 n ︶
¨
h
呻
血 e TPENGESAHAN TESIS BERJUDUL
PENGARUH PEPIBERIAN SEDIAAN GEL EKSTRAK TE■ IPE TERHADAP PEDIYEⅣBUHAN LUKA PADA TIKUS DIABETES:
TINJAUAN EKSHこ SI TNF―α DAN KOLAGEN
lgnatius Adi Kumiawan, S. Farm., Apt.
Dipertahankan di hadapan panitia penguji tesis
Fakultas Farmasi
Universitas Sanata Dharma Pada tanggal 23 Janrari 2OZ0
Mengetahui Fakultas Farmasi
itas Sanata Dhamra Dekan
Pallitla Pcngllli:
l Dr Srl Hanati Ylllianl,Apt
2 Phcbc Hcndra,ヽ4 Si,Ph D,Apt
3 Maン5,′an Hanono,Ph D,/つt
Tanda tapgan Srr Hartini, Apt.
iv
HALAMAN PERSEMBAHAN “Urip Iku Urup”
Tesis ini dipersembahkan untuk Fakultas Farmasi Universitas Sanata Dharma, teman-teman semua yang membaca naskah ini dan semua orang yang saya kasihi.
PER}TYATAAI\I KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa tesis yang saya tulis
ini
tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ikniah. Apabiladi
kemudian hari ditemukan indikasi plagiarisme dalam naskah ini, maka saya bersedia menangg@g segala sanksi sesuai peraturan perundang-undangan yang berlaku.Sleman,15 Janurai 2020
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILⅣⅡAH UNTUK KEPENTINGAN AKADEMIS
Yallg bcltanda tangan di bawah ini,saya mahasis、 va Univcrsitas Sanata Dhalllla:
Nama : Ignatius Adi Kumiawan, S. Farm., Apt. Nomor Mahasiswa : 178122005
Demi pengembangan
ilmu
pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul "PENGARUHPEMBERIAN SEDIAAN
GEL
EKSTRAK
TEMPE
TERHADAPPENYEMBUHAN LUI.A, PADA TIKUS DIABETES: TINJAUAN EKSPRESI
TNF-tr DAN KOLAGEN" beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak unhrk menyimpan, mengalihkan dalam bentuk lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di intemet atau rnedia lain untuk kepentingan akademis tanpa perlu meminta izin saya atau memberi royalty kepada saya selama tetap mencanhrmkan nama saya sebagai penulis. Demikian pemyataan ini saya buat dengan sebenar-benamya.
Dibuat di Slcman
Ignatius Adi Kumiawan, S. Farm., Apt. Pada tanggal 15 Januari 2020
vii PRAKATA
Puji dan syukur penulis haturkan ke hadirat Tuhan Yang Maha Esa karena atas berkat dan rahmat kasih-Nya penulis dapat menyelesaikan tesis yang berjudul “PENGARUH PEMBERIAN SEDIAAN GEL EKSTRAK TEMPE TERHADAP PENYEMBUHAN LUKA PADA TIKUS DIABETES: TINJAUAN EKSPRESI TNF-α DAN KOLAGEN” dengan baik dan lancar. Tesis ini disusun sebagai salah satu syarat memperoleh gelar Magister Farmasi (M. Farm.) Program Studi Magister Farmasi. Penulis berharap agar tesis ini dapat berguna bagi para pembaca, menjadi sumber pengetahuan tentang pengembangan sediaan wound healing dan menjadi inspirasi untuk melakukan penelitian yang lebih berkembang nantinya. Penulis tesis ini tidak lepas dari banyak bantuan, dukungan, semangat, dan saran dari berbagai pihak. Oleh karena itu, penulis ingin mengucapkan terima kasih kepada:
1. Ibu Dr. Yustina Sri Hartini, Apt. selaku Dekan Fakultas Farmasi Universitas Santa Dharma.
2. Ibu Aris Widayati, M.Si., Ph.D., Apt. selaku Kaprodi Magister Farmasi Fakultas Farmasi Universitas Sanata Dharma.
3. Ibu Dr. Sri Hartati Yuliani, Apt. selaku dosen pembimbing yang telah memberikan ilmu, saran dan bimbingan dengan sabar dalam penelitian ini.
4. Ibu Phebe Hendra, M.Si., Ph.D., Apt selaku dosen penguji yang telah bersedia memberikan saran bagi penelitian ini.
5. Bapak Maywan Hariono, Ph.D., Apt. selaku dosen penguji yang telah bersediamemberikan saran bagi penelitian ini.
6. Keluarga penulis yang telah memberikan doa, semangat dan dukungan.
7. Ibu drh. Sitarina Widyarini, MP.,PhD atas diskusi dan saran yang diberikan dalam penelitian ini.
8. Bapak drh. Sugiyono, M.Sc atas diskusi dan saran yang diberikan dalam penelitian ini. 9. Bapak Yuli, Bapak Wagiran, Bapak Triyono, Ibu Agustin, Ibu Arsiyah, Yosua dan
Yolanda atas bantuan dan kerjasamanya dalam kegiatan di laboratorium. 10. Bapak FA. Ottok yang telah membantu kelancaran administrasi selama studi.
12. Semua pihak yang tidak dapat disebutkan penulis satu per satu yang ikut berkontribusi dalam penyusunan tesis.
Penulis menyadari bahwa masih terdapat kekurangan di dalam tesis ini. Oleh karena itu dengan terbuka dan senang hati penulis menerima kritik dan saran yang membangun dari para pembaca. Akhir kata, semoga tesis ini dapat bermanfaat dan selamat membaca.
Ignatius Adi Kurniawan, S.Farm., Apt. Sleman, 15 Januan 2020
ix DAFTAR ISI
PERSETUJUAN PEMBIMBING... ii
HALAMAN PENGESAHAN... iii
HALAMAN PERSEMBAHAN... iv
PERNYATAAN KEASLIAN KARYA... v
LEMBAR PERNYATAAN PUBLIKASI... vi
PRAKATA... vii DAFTAR ISI... ix DAFTAR GAMBAR... x DAFTAR LAMPIRAN... xi 1. INTISARI... 1 2. LATAR BELAKANG... 2.1 Urgensi Penelitian…………... 2.2 Tujuan Penelitian... 2.3 Luaran... 2 2 2 2 3. TINJAUAN PUSTAKA... 3.1 Luka... 3.2 Luka Diabetes... 3.3 Ekstrak Tempe... 3.4 Landasan Teori... 3.5 Hipotesis... 4 4 5 6 7 7 4. METODE PENELITIAN... 4.1 Jenis dan Rancangan Penelitian... 4.2 Variabel dan Definisi Operasional... 4.3 Bahan Penelitian... 4.4 Alat Penelitian... 4.5 Alur Penelitian... 4.6 Skema Kerja Penelitian... 8 8 8 9 9 9 10 5. HASIL DAN PEMBAHASAN... 12
6. KESIMPULAN DAN SARAN... 26
7. REFERENSI... 27
x
DAFTAR GAMBAR
Gambar 1. Alur Penelitian…………... 9 Gambar 2. Hasil pewarnaan IHK a. negatif; b. positif lemah; c. positif; d. positif kuat... 16 Gambar 3. Histogram ekspresi TNF-α pada hari ke 3... ... 16 Gambar 4.Hasil penampakan kolagen (a) Kolagen intensitas lemah; (b) kolagen intensitas sedang; (c) kolagen intensitas kuat. Kolagen memberikan tampilan hijau kebiruan... 18 Gambar 5. Histogram ekspresi kolagen pada hari ke 7……... 18 Gambar 6. Histogram kapilarisasi hari ke 7... 21 Gambar 7. Penampilan pembuluh darah pada pengamatan histologi. (a) tampak membujur (kelompok diabetes perlakuan basis); (b) tampak melintang (kelompok diabetes perlakuan formula 2). ... 21 Gambar 8. Penampilan re-epitelisasi pada pengamatan histologi (a) contoh re- epitelisasi kelompok diabetes (formula 1); (b) contoh re-epitelisasi kelompok non diabetes (formula 1) ... 21 Gambar 9. Histogram re-epitelisasi hari ke 7... 22 Gambar 10. Histogram penyembuhan luka hari ke 7... 24
xi
DAFTAR LAMPIRAN
Lampiran 1. Lembar Ethical Clearance... 31 Lampiran 2. Rerata Kadar Glukosa hari ke-0 dan ke-7 pada kelompok non diabetes (A) dan diabetes (B) ... 32 Lampiran 3. LoA dan Naskah Publikasi……... 33
1
1. INTISARI
Diabetes merupakan salah satu penyakit yang disebabkan adanya gangguan metabolisme. Angka kejadian diabetes terus mengalami peningkatan setiap tahunnya di Indonesia. Diabetes mellitus dapat menimbulkan berbagai komplikasi, salah satunya adalah ulkus diabetikum. Kondisi ulkus diabetikum dapat mengakibatkan infeksi dan berujung pada tindakan amputasi. Populasi penderita diabetes yang meningkat juga berdampak pada peningkatan kejadian ulkus diabetikum sebagai komplikasi dari diabetes. Tujuan penelitian ini adalah mengetahui pengaruh pemberian sedian gel ekstrak tempe secara topikal dalam penyembuhan luka pada kondisi diabetes dan non diabetes, mengetahui perbedaan ekspresi tumor necrosis factor alpha (TNF-α) dan pembentukan serat-serat kolagen.
Penelitian ini merupakan penelitian eksperimental dengan mengunakan hewan uji tikus (Wistar) jantan, dengan umur 8 minggu, dengan bobot rata-rata 150-200 g. Hewan uji dibagi menjadi dua kelompok besar, yaitu kelompok diabetes dan non diabetes. Setiap kelompok dibagi menjadi lima kelompok uji yaitu kelompok tanpa perlakuan, perlakuan basis, perlakuan gel ekstrak 2,5%, 5% dan 7,5%. Penyembuhan luka pada hari ke-7 dibuat dengan punch biopsy (ukuran 5mm) pada kulit punggung hewan uji. Gel ekstrak tempe dioleskan dua kali sehari selama tujuh hari. Parameter yang diukur dalam penelitian ini adalah kadar glukosa darah, pengamatan ekspresi TNF-α pada hari ke-3 dan ekspresi kolagen, re-epitelisasi, pembuluh darah dan penyembuhan luka pada hari ke-7. Pengolahan data TNF-α dan kolagen dilakukan dengan berbantukan peranti lunak image-J. Hasil data yang diperoleh selanjutnya diolah menggunakan analisa statistik uji-t.
Hasil yang didapat dari penelitian adalah pemberian sediaan ekstrak tempe memberikan pengaruh yang signifikan terhadap ekspresi TNF-α dan kolagen. Pemberian sediaan ekstrak tempe tidak berpengaruh secara signifikan terhadap kecepatan penyembuhan luka pada kondisi non diabetes dan diabetes sampai dengan pengamatan hari ke-7.
2
2. LATAR BELAKANG
Diabetes merupakan salah satu penyakit ganguan metabolik yang ditandai dengan meningkatnya kadar glukosa dalam darah. Hal ini dapat disebabkan oleh menurunnya jumlah produksi insulin dari sel beta pankreas dan adanya resistensi reseptor insulin. Gangguan metabolik ini mempengaruhi kualitas kesehatan penderita dengan berbagai macam kondisi penyerta yang mungkin ditimbulkan. Penderita diabetes mengalami proses penyembuhan luka yang lebih lama, hal ini dapat memicu terjadinya infeksi lebih lanjut1.
Luka yang terjadi pada kondisi diabetes memiliki durasi inflamasi lebih lama dibandingkan dengan kondisi normal, sehingga memperlama proses penyembuhan luka2. Luka kronis dapat mengakibatkan peningkatan kondisi infeksi, abses, gangren, septikemia, dan penyakit penyerta lainnya3. Angka kejadian ulkus diabetikum di Indonesia adalah 15 % dari penderita diabetes, 32,5 % dan 23,5 % di antaranya sampai pada kematian dan amputasi4.
Sediaan penyembuh luka untuk penderita diabetes perlu dikembangkan untuk menurunkan potensi terjadinya amputasi pada penderita diabetes, yang diakibatkan timbulnya ulkus diabetikum. Sediaan topikal untuk penyembuh luka harus memenuhi beberapa syarat, diantaranya adalah mampu menjaga kelembaban pada area luka, tidak toksik, mudah dibersihkan dan tidak dapat ditembus oleh bakteri yang dapat meningkatkan kemungkinan terjadinya infeksi. Selain itu sediaan penyembuh luka diharapkan dapat mempercepat penyembuhan 5.
Tempe adalah bahan yang dapat dikembangkan menjadi sediaan penyembuh luka. Proses fermentasi kedelai menjadi tempe dapat meningkatkan kandungan isoflavon, seperti genistein dan daidzein6. Genistein merupakan salah satu contoh
isoflavon aglikon. Bentuk aglikon dari isoflavon lebih aktif dibandingkan dengan bentuk glikosidanya7. Genistein dapat mempercepat proses penyembuhan luka dengan mempengaruhi respon inflamasi. Pemberian secara peroral pada mencit (non-diabetes), terbukti mempercepat proses penyembuhan luka8. Pada mencit diabetes, pemberian genistein secara peroral, mempercepat proses penyembuhan luka9. Pada penelitian tersebut, genistein berpengaruh dengan mempercepat berakhirnya fase inflamasi8. Pemberian sub kutan terbukti meningkatkan proses penyembuhan luka10.
3
Penelitian ini dilakukan untuk mengetahui pengaruh pemberian secara topikal sediaan gel ekstrak tempe terhadap proses penyembuhan luka. TNF-α adalah protein yang di produksi oleh makrofag, dengan ukuran 17kDa dan terdiri dari 212 asam amino. TNF-α merupakan protein protein yang berada diluar sel dan terlibat dalam TNF-α adalah penanda inflamasi yang sedang terjadi pada proses penyembuhan luka. Tingginya jumlah TNF-α pada kondisi luka menyebabkan berkurangnya pembentukan serat-serat kolagen11. Kolagen secara struktural dan fungsional merupakan protein
utama dari matriks ekstraseluler yang juga terlibat dalam penyembuhan luka pada jaringan. Dengan penggunaan sediaan yang mengandung ekstrak genistein secara topikal diharapkan dapat menurunkan ekspresi TNF-α serta meningkatkan pembentukkan serat-serat kolagen sehingga dapat mempercepat proses penyembuhan luka pada kondisi non diabetes dan diabetes.
2.1 Urgensi Penelitian
Jumlah penderita diabet di Indonesia ada sekitar 10,3 juta dan 15-30% menderita luka yang bisa berakhir dengan amputasi. Sementara itu belum banyak pengembangan mengenai sediaan penyembuh luka. Sediaan yg berasal dari bahan alam dipercaya mempunyai lebih banyak keuntungan oleh karena itu perlu dikembangkan sediaan penyembuh luka dengan bahan aktif dari alam salah satu di antaranya adalah tempe. Penelitian ini dilakukan untuk mengembangkan sediaan topikal yang dapat mempercepat penyembuhan luka diabetes dan non diabetes dengan memanfaatkan bahan baku ekstrak tempe.
2.2 Tujuan Penelitian
2.2.1 Mengetahui perbedaan ekspresi TNF-α dan pembentukan serat-serat kolagen dengan pemberian ekstrak tempe yang mengandung genistein secara topikal pada tikus non diabetes dan diabetes.
2.2.2 Mengetahui pengaruh pemberian ekstrak tempe yang mengandung genistein secara topikal dalam penyembuhan luka pada kondisi non diabetes dan diabetes.
2.3 Luaran
Luaran yang diharapkan dari penelitian ini adalah parameter ekspresi TNF-α dan pembentukan serat-serat kolagen dengan pemberian ekstrak tempe secara topikal pada tikus non diabetes dan tikus diabetes dalam mempercepat penyembuhan luka pada penderita diabetes mellitus. Selain itu, hasil penelitian
4
sudah dipublikasikan (luaran penelitian) di jurnal nasional bereputasi SINTA-S2 (Green tick) yaitu Jurnal Farmasi Sains dan Komunitas (JFSK).
3. TINJAUAN PUSTAKA 3.1. Luka
Luka didefinisikan sebagai kerusakan atau gangguan pada struktur dan fungsi anatomi normal. Luka dapat bervariasi mulai dari kerusakan sederhana pada epitelial kulit, hingga luka yang lebih dalam yang meluas ke jaringan subkutan dengan kerusakan pada struktur lain seperti urat, otot, pembuluh darah, saraf, organ parenkim, bahkan tulang12. Proses penyembuhan luka adalah respon fisiologis normal terhadap cedera yang terjadi dan umumnya mengarah pada pemulihan struktur dan fungsi normal pada jaringan yang rusak13. Proses penyembuhan luka dapat dibagi menjadi empat fase, yaitu hemostasis, inflamasi, proliferasi, dan remodeling2 .
Pada fase hemostasis atau tahap koagulasi, terjadi vasokonstriksi untuk mengurangi hilangnya darah. Trombosit akan datang dan menempel pada dinding pembuluh darah yang terluka untuk melepaskan platelet-derived growth factor (PDGF) dan transforming growth factor-beta (TGF-β), sehingga terjadi agregasi platelet dan koagulasi, yang menyebabkan pembentukan bekuan fibrin14 . Fase selanjutnya adalah inflamasi, yang ditunjukkan adanya netrofil dan makrofag pada area luka. Kedua nya berperan dalam fagositosis jaringan yang tidak berguna dan mikroorganisme asing pada luka3.
Fase inflamasi menjadi penentu dalam keberhasilan proses penyembuhan luka. Pada fase ini melibatkan neutrofil dan makrofag dalam penyembuhan luka. Makrofag membentuk merangsang pembentukan sitokin pro-inflamasi seperti interleukin-1 (IL-1),
interleukin-6 (IL-6) dan TNF-α. TNF-α terlibat secara erat dalam gangguan
penyembuhan luka. Apoptosis (kematian sel) fibroblas dapat terjadi dengan adanya induksi oleh TNF-α. Peningkatan TNF-α pada kondisi kronis dapat menyebabkan kegagalan proses penyembuhan luka dan menurunkan produksi kolagen pada luka15.
Pada fase proliferasi, terjadi perbanyakan sel endotelial, deposisi, dan sintesis matriks ekstraseluler serta pembentukan jaringan granulasi dan kolagen. Fase ini dipengaruhi oleh matrix metalloproteinase (MMP), TGF-β, epidermal growth factor
5
(EGF), dan interleukin-116. Pada fase terakhir yaitu remodeling, terjadi penghentian proses inflamasi, pembentukan bekas luka, pemulihan morfologi jaringan normal, dan pengaturan kembali matriks kolagen pada kulit. Sel yang sudah tidak dibutuhkan pada penyembuhan luka juga akan dihilangkan dengan apoptosis pada fase ini3.
3.2. Luka Diabetes
Luka pada penderita diabetes merupakan permasalahan yang serius, karena membutuhkan perawatan yang lama dan dapat menyebabkan amputasi. Diabetes melibatkan stress oksidatif yang menghasilkan radikal bebas yang menyebabkan kerusakan jaringan17. Diabetes juga mencegah fibroblas membentuk matriks ekstraseluler dan keratinosit yang memadai untuk re-epitelisasi luka. Selain itu, intensitas dan durasi respon inflamasi pada diabetes juga meningkat3. Pasien diabetes juga memiliki komplikasi mayor berupa perlambatan proses penyembuhan luka yang disebabkan oleh meningkatnya apoptosis, infiltrasi selular yang tertunda, penurunan angiogenesis, dan penurunan pembentukan dan pengaturan dari jaringan kolagen11. Luka pada penderita diabetes merupakan permasalahan yang serius, karena membutuhkan perawatan yang lama dan dapat menyebabkan amputasi. Proses penyembuhan pada penderita diabetes berbeda dengan pasien normal18, termasuk tidak berfungsinya respon inflamasi, penurunan formasi granulasi jaringan dan terganggunya angiogenesis19. Abnormalitas seluler lain yang muncul pada penderita diabetes di antaranya makrofag pada penderita diabetes memperlihatkan peningkatan TNF-α,
interleukin 1-beta (IL-1ß) dan penurunan vascular endhotelial growth factor (VEGF)20.
TNF-α adalah sitokin proinflamasi yang diproduksi terutama oleh monosit dan makrofag. TNF-α memiliki banyak fungsi dalam proses inflamasi dan terlibat dalam beberapa patogenesis berbagai penyakit seperti kanker, kelainan imunitas dan diabetes. TNF-α memiliki dua reseptor yaitu TNFR1 dan TNFR2. TNF-α berikatan dengan TNFR1
menyebabkan terjadinya apoptosis pada sel. Ekspresi TNF-α dapat dijadikan salah satu penanda dalam penyembuhan luka diabetes pada fase inflamasi21. Menurunnya ekspresi
TNF-α menunjukkan terkendalinya proses inflamasi pada proses penyembuhan luka diabetes. Penurunan TNF-α memiliki korelasi dengan berkurangnya apoptosis fibroblas dan meningkatnya proliferasi fibroblas21. Bertambah banyaknya jumlah fibroblas akan meningkatkan pembentukan kolagen pada proses penyembuhan luka diabetes22.
6
Kolagen adalah protein dengan bentuk triple helix¸ yang merupakaan komponen utama dari matriks ekstra seluler (ECM) molekul protein heliks tiga unit, yang membentuk bagian utama dari ECM. Kolagen adalah protein terbanyak yang terdapat pada jaringan kulit yang disintesis oleh fibroblas. Kolagen memiliki 3 jenis yaitu kolagen tipe 1, 2 dan 3. Kolagen tipe 3 berperan dalam fase awal penyembuhan luka, di ikuti dengan peningkatan jumlah kolagen tipe 1 pada fase remodelling. Tingkat kepadatan kolagen berkontribusi terhadap kekuatan jaringan yang terbentuk dalam proses penyembuhan luka22.
3.3. Ekstrak Tempe
Tempe adalah produk dari kedelai oleh Rhizopus oligosporus maupun Rhizopus
oryzae. Proses fermentasi kedelai dapat meningkatkan kadar isoflavon, salah satunya
adalah genistein. Selain itu, proses fermentasi juga mengubah sebagian besar glukosida dalam kedelai menjadi bentuk aglikon6. Genistein termasuk dalam isoflavon aglikon, dengan bentuk aglikon lebih aktif dibandingkan dengan bentuk glikosida. Maserasi dengan menggunakan etanol adalah satu cara untuk mendapatkan genistein dari tempe23.
Genistein dilaporkan memiliki berbagai aktivitas farmakologi, seperti antihemolitik, antioksidan, antifungi, dan antikanker7. Genistein mampu mempengaruhi proses penyembuhan luka pada tahap awal. Dalam penelitian yang dilakukan oleh Park dkk8, pemberian diet genistein selama dua minggu sebelum kondisi luka meningkatkan proses penyembuhan luka. Kelompok hewan uji dengan perlakuan genistein, menunjukkan ukuran luka yang lebih kecil dibanding kelompok kontrol tanpa perlakuan. Perlakuan genistein juga menurunkan ekspresi TNF-α dalam jaringan luka, terhadap kelompok perlakuan23. Genistein mempengaruhi kondisi inflamasi dengan cara menurunkan intraseluler reactive oxygen species (ROS) pada jalur pensinyalan nuclear
factor kappa beta (NF-κB) dan adenosine monophosphate-activated protein kinase
(AMPK). NF-κB dan AMPK berperan dalam transripsi mediator inflamasi seperti TNF-α, IL-6, IL-1ß dan mediator lainya24.
Genistein memiliki beberapa mekanisme dalam mempercepat proses penyembuhan luka. Pada fase inflamasi, senyawa ini memperpendek fase inflamasi, dengan menurunkan ekspresi TNF-α25. Pada fase proliferasi dan remodeling,
7
peningkatan jumlah fibroblas dapat meningkatkan jumlah kolagen pada area luka. Pada fase proliferasi dan remodelling. Genistein juga dapat menekan ekspresi MMP-2 dan MMP-9 melalui penekanan aktifitas NF-κB26. Peningkatan proses pembentukan kolagen dalam fibroblas salah satunya adanya interaksi genistein dan estrogen reseptor, hal ini dapat terjadi karena kemiripan sturktur genistein dengan estrogen27.
3. 4. Landasan Teori
Penderita diabetes memiliki proses penyembuhan luka lebih lama dibandingkan penderita dengan kondisi normal. Kondisi ini dipengaruhi oleh lamanya fase inflamasi yang terjadi pada kondisi luka pada penderita diabetes. Tingginya ekspresi TNF-α pada fase inflamasi menyebabkan meningkatnya apoptosis fibroblas, menurunnya proliferasi fibroblas dan meningkatnya produksi MMP. Proses pembentukan kolagen menjadi terganggu dengan menurunnya produksi kolagen dan meningkatnya degradasi oleh MMP. Dengan lamanya proses inflamasi dan penurunan jumlah kolagen, mempengaruhi lamanya proses penyembuhan luka.
Genistein memiliki efek terhadap penyembuhan luka dengan lebih dari satu mekanisme. Genistein dapat menurunkan ekspresi TNF-α pada fase inflamasi sehingga dapat meningkatkan produksi kolagen dan menurunkan degradasi matriks ekstraseluler. Selain itu produksi genistein yang terkandung di dalam ekstrak tempe memiliki potensi untuk menyembuhkan luka diabetes.
3.5. Hipotesis
Sediaan gel ekstrak tempe yang diberikan secara topikal memiliki pengaruh dalam penyembuhan luka pada kondisi diabetes dan non diabetes. Sediaan gel ekstrak tempe mempengaruhi ekspresi TNF-α dan pembentukan serat-serat kolagen pada kondisi luka diabetes dan non diabetes
8
4. METODE PENELITIAN
4.1 Jenis dan Rancangan Penelitian
Penelitian dengan judul “Pengaruh Pemberian Sediaan Gel Ekstrak Tempe Terhadap Penyembuhan Luka Pada Tikus Diabetes: Tinjauan Ekspresi TNF-α dan Kolagen.” merupakan penelitian eksperimental murni.
4.2 Variabel Penelitian dan Definisi Operasional 4.2.1 Variabel Penelitian
a. Variabel bebas : variasi kadar ekstrak tempe pada gel sebagai sediaan topikal penyembuh luka.
b. Variabel tergantung : diameter luka, ekspresi TNF-α pada jaringan, jumlah serat kolagen yang terbentuk pada jaringan.
c. Variabel pengacau:
1) Variabel pengacau terkendali : galur tikus, umur tikus, bobot tikus, prosedur perlakuan dan pengukuran, kondisi aplikasi sediaan pada luka, wadah penyimpanan sediaan.
2) Variabel pengacau tak terkendali : kondisi ruangan saat perlakuan, suhu dan kelembaban udara saat aplikasi sediaan.
4.2.2 Definisi Operasional
a. Hewan uji yang digunakan adalah tikus wistar jantan berumur 8 minggu dengan bobot antara 150-200gram.
b. Ketebalan olesan yang digunakan adalah jumlah gel yang di oleskan yaitu gel dengan berat 75-100mg
c. Ekspresi TNF-α adalah protein TNF-α yang terwarnai coklat dalam pengecatan menggunakan imunohistokimia (IHK).
d. Kolagen adalah serat matrik ekstraseluler pada kulit, berwarna biru setelah dilakukan pengecetan menggunakan Masson Trichrome.
e. Luka dibuat pada punggung hewan uji dengan diameter 5 mm dan menembus sub kutan
f. Tikus diabetes adalah hewan uji yang telah di induksi dengan menggunakan
streptozotocin dengan dosis 45 mg/kg bb dan memiliki kadar glukosa diatas 200
9
g. Tikus non diabetes adalah hewan uji yang tidak mendapatkan induksi streptozotocin dan memiliki kadar glukosa dibawah 200mg/dl.
h. Formula 1 adalah sediaan hidrogel dengan kadar ekstrak tempe 2,5%. i. Formula 2 adalah sediaan hidrogel dengan kadar ekstrak tempe 5%. j. Formula 3 adalah sediaan hidrogel dengan kadar ekstrak tempe 7,5%.
4.3 Bahan Penelitian
Sediaan hidrogel yang diperoleh dari Laboratorium FTSF Fakultas Farmasi Universitas Sanata Dharma Yogyakarta dengan bahan aktif ekstrak tempe terstandar genistein 443,365 μg/ml, streptozotocin (cayman), buffer sitrat, ketamin injeksi, slide mikroskop poly-l-lysine (cova), netral buffer formalin 10% (bio-optica), GOD FS (diasys), masson’s trichrome goldner (bio-optica), antibodi anti TNF-α (fine test), kit deteksi IHK (fine test).
4.4 Alat Penelitian
Kandang hewan coba, spektrofotometer, centrifuge 3000-5000rpm, tissue
processor, hot Plate, staining Jar, microtome, inkubator, mikroskop.
4.5 Alur Penelitian
10
4.6 Skema Kerja Penelitian
a. Waktu dan tempat penelitian
Perlakuan hewan coba, pengambilan sampel darah dan jaringan dilakukan di laboratorium pusat pangan dan gizi sekolah pasca sarjana Fakultas Kedokteran Hewan UGM. Pembuatan preparat histologi, pengecatan, dan pengamatan kolagen sampel dilakukan pada laboratorium Patologi Fakultas Kedokteran Hewan UGM. Penelitian ini telah mendapat ethical clearance dari Komisi Etik Laboratorium Penelitian Dan Pengujian Terpadu Universitas Gadjah Mada No. 00084/04/LPPT/X/2016.
b. Eksperimental animal model
Hewan uji di perlakukan dalam kandang individu dengan kondisi kelembaban 50-60%, suhu ruangan 20-250C. Tikus tidak diberi makan selama 12 jam sebelum dilakukan induksi streptozotocin (STZ). Induksi STZ intra peritonial diberikan dengan dosis 45 mg/kgBB yang sudah dilarutkan dalam citrate buffer (0,1M) pH 4,5. Setelah 4 hari, darah diambil dari retro orbital plexus dan diukur kadar glukosa darah dengan reagen GOD FS. Kondisi diabetes tercapai jika kadar glukosa >200mg/dl.
Pada hari ke-4 setelah induksi dengan menggunakan STZ, tikus dibius dengan ketamine hydrochloride (25 mg/kg bb) melalui intramuscular. Bulu tikus dicukur pada bagian punggung dan dioleskan 10% povidon iodine. Setelah kering dilakukan biopsy pada jaringan kulit menggunakan punch byopsy dengan ukuran 5 mm pada punggung hewan coba melalui Plexus Retroorbitalis, sebanyak 1 ml.
Pengambilan gambar dilakukan pada punggung hewan coba yang dilukai. Setelah satu jam, sediaan dioleskan pada jaringan luka. Pengolesan dilakukan sebanyak 2 kali sehari selama 7 hari. Pengambilan darah diulangi pada hari ke-0 dan hari ke-7. Sampel darah dari retro orbital plexus diukur kadar glukosa menggunakan reagen GOD FS. Sampel darah yang terkumpul dilakukan sentrifugasi dengan kecepatan 4000 rpm selama 15 menit.
i. Pengukuran kadar glukosa darah.
Sampel darah diambil dari hewan coba direaksikan dengan reagen GOD FS, kemudian dibaca dengan menggunakan spektofotometer UV-Visibel dengan Panjang gelombang 500nm.
11 ii. Pengamatan penyembuhan luka.
Pengamatan penyembuhan luka dilakukan dengan mengukur diameter luka awal dan luka pada hari pengamatan. Diameter didapat dari rata-rata dua area luka pada punggung kanan dan kiri hewan uji dengan mengukur diameter luka28.
Pengukuran persen penyembuhan luka dihitung dengan menggunakan rumus berikut:
Penyembuhan luka (%) = x 100%
iii. Pembuatan sediaan blok paraffin.
Sampel jaringan luka pada kulit diambil pada hari ke-3 dan 7. Sampel yang didapatkan di rendam kedalam neutral buffer formalin 10% selama 24-48 jam. Untuk selanjutnya dipotong, dan dilanjutkan dengan pemrosesan jaringan menggunakan Tissue Processor. Jaringan kemudian dibaut menjadi sediaan blok paraffin.
iv. Pemotongan sampel.
Pemotongan jaringan sampel menggunakan microtome dengan ketebalan <5μm. Hasil potongan direntangkan di atas air di dalam waterbath (50-60°C), dan dilekatkan di atas slide mikroskop. Slide mikroskop kemudian diletakkan di atas hot plate (56-65°C) selama kurang lebih 5 menit.
v. Pengecatan Masson’s Trichrome Goldner.
Sampel jaringan di atas slide mikroskop direaksikan dengan pereaksi Weigert’s
iron, Picric acid, Poceau acid, Phosphomolybdic, dan Light Grenn. Tata cara
pengecatan mengikuti langkah kerja dari Masson’s Trichrome Goldner kit dari Bio Optica (04-011802)
vi. Pengecatan IHK TNF-α
Sampel jaringan yang sudah dilekatkan pada slide poly-l-lyisne, di proses rehidrasi dan dilanjutkan pengecatan IHK sesuai dengan langkah kerja dari
manual book FineTest rabbit-DAB (Poly-HRP) Detection IHC Kit (IHC0007).
vii. Pengamatan kolagen.
Pengamatan kolagen dilakukan dengan menggunakan mikroskop dengan perbesaran 100x. Warna hijau muda yang muncul adalah kolagen yang terdapat pada jaringan uji. Derajat pembentukan kolagen dilihat dari sebaran jumlah
12
kolagen yang terdapat pada jaringan luka. Pengukuran dilakukan dengan menggunakan peranti lunak Image-J. Pengukuran kepadatan kolagen ditunjukkan dengan sebaran prosentase area dari kolagen dan tingkat intensitas dari pewarnaan kolagen.
vii. Pengamatan TNF-α.
Pengamatan TNF-α pada jaringan dilakukan dengan menggunakan mikroskop perbesaran 100x. Warna coklat pada jaringan uji adalah tampilan TNF-α yang terwarnai dengan DAB. Penilaian tampilan TNF-α dilakukan dengan menggunakan bantuan piranti lunak image-J. Penilaian TNF-α ditunjukkan dengan data prosentase intensitas dari staining high positive, positive, low
positive dan negative.
viii. Analisa hasil.
Hasil pengamatan kolagen dan TNF-α menggunakan sistem skoring berdasarkan persentase sebaran dan intensitas pewarnaan. Skor persentase sebaran di kelompokkan menjadi lima (0 = 0%, 1= <10%, 2=10-50%, 3= 51-80%, 4 > 80%). Skor intensitas pewarnaan dikelompokkan menjadi empat (0 = negative, 1 = low positive, 2 = positive, 3 = high positive). Hasil uji penjumlahan skor sebaran dan intensitas pewarnaan dianalisa menggunakan statistik uji T dengan tingkat kepercayaan 95% (p < 0,05).
5. HASIL DAN PEMBAHASAN
Kondisi diabetes kelompok perlakuan dipastikan dengan melakukan pengukuran glukosa pada hari ke 0 dan 7. Pengujian kadar glukosa dilakukan dengan menggunakan serum dari dua kelompok diabetes dan non diabetes. Sampel diambil pada hari ke 0 bertujuan untuk memastikan kadar glukosa sebelum dilakukan pembuatan luka pada kelompok diabetes dan non diabetes. Setelah mendapatkan induksi STZ, kelompok diabetes pada hari ke 0 memiliki kadar glukosa di atas 200mg/dl. Sedangkan pada kelompok non diabetes, didapatkan kadar glukosa di bawah 200mg/dl. Pada hari ke-7 dilakukan pengukuran ulang kadar glukosa dari dua kelompok. Hal ini bertujuan untuk memastikan bahwa hewan uji tetap dalam kondisi diabetes. Semua kelompok diabetes memiliki kadar glukosa diatas 200mg/dl, sedangkan kelompok non diabetes di bawah 200mg/dl.
13
Hewan uji dengan kondisi diabetes memiliki ciri-ciri yang berbeda dengan hewan normal. Gejala umum yang dapat ditemui adalah polifagi, poliuri dan polidipsi. Pada pagi hari dapat dilihat bahwa urin di dasar kandang kelompok diabetes lebih banyak daripada kelompok non diabetes. Selain itu pakan dan air berkurang lebih banyak pada kelompok diabetes. Kondisi bulu hewan uji memiliki tekstur yang kaku dan kasar pada kelompok diabetes.
Penyembuhan luka dipengaruhi oleh proses yang cukup panjang dan komplek. Tahap inflamasi, terjadi setelah berakhirnya hemostatis. Pada fase inflamasi, sel yang paling banyak berperan adalah makrofag. Makrofag M1 sebagai pro-inflamasi mengeksresikan sitokin yang meningkatkan inflamasi, salah satunya adalah TNF-α. Ketika fase inflamasi hampir berakhir, dimulailah fase proliferasi dan dilanjutkan dengan fase remodeling.
14
Tabel 1. Ekspresi TNF-α hari ke-3, ekspresi kolagen, pembuluh darah, re-epitelisasi dan kecepatan penyembuhan luka pada hari ke-7.
Kelompok Rerata TNF-α ± SE Hari ke-3 Rerata Kolagen ± SE Hari ke-7 Rerata Pembuluh darah Hari ke-7
Rerata Re-epitelisasi Hari
ke-7
Rerata Penyembuhan luka Hari ke-7 Diabetes Tanpa Perlakuan 5,333±0,441 3,625±0,324 3,111±0,423 107,989±20,690 12,977%±7,780 Diabetes Basis 4,125±0,295* 3,400±0,245 3,889±0,111* 80,0889±9,009 0,000%±0,000 Diabetes Formula 1 3,923±0,329* 3,833±0,167 3,222±0,324 62,856±17,130 34,052%±6,538 Diabetes Formula 2 4,077±0,329* 4,778±0,278* 2,111±0,455* 87,733±11,048 29,374%±9,085 Diabetes Formula 3 3,545±0,413* 5,000±0,408* 3,000±0,500 93,578±21,627 26,332%±4,812 Non diabetes Tanpa
Perlakuan 3,800±0,262 4,500±0,267 2,889±0,484 66,467±12,394 29,83%±7,641 Non diabetes Basis 3,778±0,324* 4,875±0,227 3,333±0,373 70,800±15,446 19,605%±7,992 Non diabetes Formula 1 3,000±0,189* 4,800±0,374 2,333±0,527 77,533±13,438 41,567%±6,580 Non diabetes Formula 2 3,000±0,333* 4,833±0,401 2,444±0,475 127,922±20,685* 15,443%±6,313 Non diabetes Formula 3 3,250±0,131* 4,667±0,333 3,889± 0,111* 68,833±9,474 34,687%±2,643
15
Pengamatan ekspresi TNF-α dilakukan dengan menggunakan preparat histologi dari jaringan kulit yang dilukai. Jaringan kulit dilakukan secara spesifik dengan menggunakan pengecatan IHK. Pengecatan IHK adalah pengecatan yang sangat spesifik, dikarenakan menggunakan ikatan yang spesifik terhadap protein target. Rabbit
Polyclonal anti TNF-α (antibodi primer) berikatan secara spesifik protein TNF-α yang
tersedia pada jaringan sampel. Antibodi primer akan dikonjugasi oleh antibodi sekunder (Goat anti Rabbit-HRP) dan direaksikan dengan kromogen DAB. Tampilan visual dari TNF-α akan berwana coklat yang menandakan adanya reaksi konjugasi dan pewarnaan DAB. Semakin coklat tampilan warna mengindikasikan semakin banyaknya TNF-α yang terdapat pada jaringan sampel.
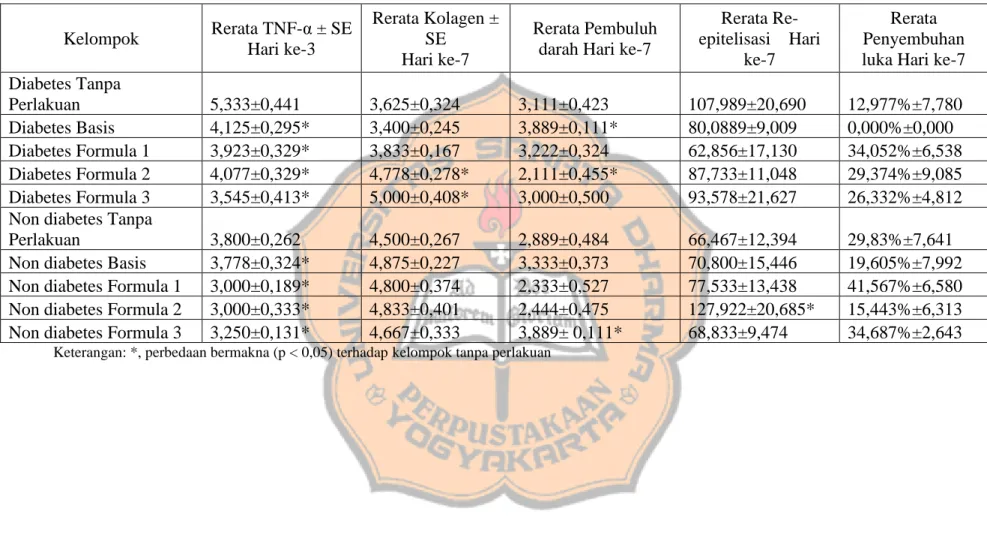
Pembacaan ekspresi TNF-α dengan menggunakan bantuan piranti lunak image-J dilakukan dengan menggunakan menu IHC-profiler. Menu Plug-in IHC-profiler memberikan hasil data berupa sebaran pewarnaan (dalam prosentase) dan intensitas pewarnaan (negatif, positif lemah, positif dan positif kuat). Hasil pengamatan diukur dengan menggunakan sistem skor intensitas dan sebaran dari TNF-α. Intensitas sebaran TNF-α yang dihitung adalah luas area dari bagian luka yang memberikan visualisasi berwarna coklat. Intensitas pewarnaan terbagi menjadi 4 level (Gambar 2). Hasil skor dari intensitas sebaran dan pewarnaan ditambahkan untuk memberikan skor dari ekspresi TNF-α.
16
Gambar 2. Hasil pewarnaan IHK a. negative; b. positif lemah; c. positif; d. positif kuat.
Gambar 3. Histogram ekspresi TNF-α pada hari ke-3
Pemberian sediaan gel ekstrak tempe memberikan pengaruh terhadap ekspresi TNF-α pada jaringan luka hari ke-3. Pada semua kelompok hewan coba dengan kondisi diabetes, memiliki ekspresi TNF-α lebih kuat dibandingkan kelompok non diabetes (Gambar 3). Terdapat pebedaan yang bermakna (p<0,05) pada kelompok tanpa perlakuan antara diabetes dan non diabetes (Tabel 1). Kelompok tanpa perlakuan menunjukkan ekspresi TNF-α paling besar jika dibandingkan kelompok perlakuan
17
dengan basis dan sediaan gel dengan ekstrak tempe. Pada kelompok formula 3 pada kelompok diabetes memberikan ekspresi TNF-α yang paling rendah dibandingkan dengan kelompok lainnya. Kelompok perlakuan non diabetes, pemberian formula 1 memperlihatkan ekspresi TNF-α paling rendah pada kelompok tersebut. Pemberian sediaan basis, formula 1, 2 dan 3 pada kelompok diabetes, memperlihatkan skor TNF-α yang lebih rendah dan berbeda signifikan (p<0,05) terhadap tanpa perlakuan. Pada kelompok hewan dengan kondisi non diabetes, pemberian sediaan formula 1, 2 dan 3 berpengaruh signifikan terhadap ekspresi TNF-α (p<0,05). Kelompok formula 3 tidak menunjukkan perbedaan bermakna ekspresi TNF-α pada kelompok antara kelompok diabetes dan non diabetes. Kelompok formula 3 menunjukkan hasil skor terendah pada kelompok uji non diabetes (Tabel 1).
Pada kondisi diabetes, TNF-α terekspresi lebih kuat pada area luka. Hal ini menyebabkan fase inflamasi berlangsung lebih lama dan tertunda nya fase proliferasi. TNF-α yang tetap tinggi pada area luka memberikan pengaruh terhadap penghambatan proliferasi dan meningkatnya apoptosis fibroblas. Rendahnya jumlah fibroblas dapat mempengaruhi jumlah kolagen yang disintesis. Rendahnya ekspresi TNF-α menunjukkan bahwa tahap inflamasi akan berakhir dan dimulainya tahap proliferasi.
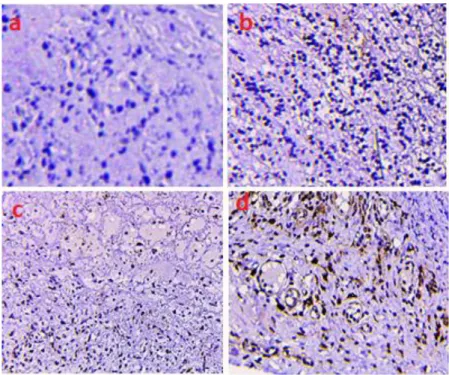
TNF-α berpengaruh terhadap proses pembentukan fibroblas dan sintesis kolagen. Ekspresi TNF-α yang lebih rendah menunjukan akan berakhirnya fase inflamasi dan dimulainya fase proliferasi. Pada fase ini, salah satu materi yang terlibat adalah proliferasi fibroblas dan sintesis kolagen. Semakin rendahnya ekspresi TNF-α pada area luka, akan meningkatkan jumlah prolifererasi dan menurunkan apoptosis fibroblas. Pertambahan jumlah fibroblas pada jaringan kulit akan meningkatkan sintesis kolagen. Dengan tingginya jumlah fibroblas, maka produksi kolagen akan meningkat. Kolagen yang terbentuk pada fase proliferasi tersebar merata pada area luka. Warna hijau kebiruan yang lemah menunjukkan intensitas kolagen yang rendah. Kolagen yang terbentuk akan menjadi lebih padat yang ditunjukkan dengan warna yang lebih tua dan memiliki bentuk seperti serabut (Gambar 4).
18
Gambar 4. Hasil penampakan kolagen (a) Kolagen intensitas lemah; (b) kolagen intensitas sedang; (c) kolagen intensitas kuat. Kolagen memberikan tampilan hijau kebiruan.
Pengukuran kolagen dilakukan dengan menggunakan bantuan piranti lunak
image-j. Menu yang digunakan dalam pengukuran ini adalah adalah colour deconvulsion dengan separasi pilihan untuk masson trichrome. Data yang dihasilkan
dari penggunaan bantuan aplikasi image-j adalah prosentase sebaran kolagen dalam luasan area luka. Selain itu dapat dihasilkan penilaian intensitas pewarnaan kolagen pada preparat (negatif, lemah, sedang, kuat).
Gambar 5. Histogram ekspresi kolagen pada hari ke-7
Hasil perbandingan skor antara kelompok uji, didapatkan perbedaan bermakna akibat perlakuan sedian ekstrak tempe terhadap kolagen. Pada kelompok diabetes, skor kolagen setiap kelompok perlakuan basis dan formula dibandingkan dengan kelompok tanpa perlakuan (Gambar 5). Hasil skor kolagen didapatkan adanya perbedaan bermakna antara formula 2 dan 3 terhadap kelompok tanpa perlakuan (p<0,05) (Tabel 1). Skor kolagen pada kelompok non diabetes, tidak menunjukkan adanya perbedaan bermakna antara kelompok tanpa perlakuan dengan kelompok perlakuan (sampel,
19
formula 1, 2 dan 3). Pada perbandingan antara kelompok diabetes dan non diabetes, kelompok formula 2 dan 3 tidak memberikan perbedaan terhadap skor kolagen (p<0,05) (Tabel 1). Pemberian perlakuan formula 2 dan 3 pada kelompok diabetes, dapat memberikan pengaruh pembentukan kolagen yang sama dengan kelompok non diabetes. Hal ini dimungkinkan karena ekstrak tempe yang ditambahkan secara bertingkat (formula 1,2 dan 3) pada kondisi diabetes, memberikan pengaruh yang berbanding lurus terhadap pembentukan kolagen.
Pada kondisi diabetes, kolagen yang terbentuk akan terdegradasi lebih banyak dibandingkan kondisi non diabetes. Tingginya keberadaan enzim MMP (Matriks Metaloproteinase) pada kondisi diabetes, menyebabkan semakin banyaknya kolagen yang terdegradasi. Hal ini dapat menyebabkan jumlah kolagen yang teramati pada kelompok diabetes akan lebih rendah daripada kelompok non diabetes. Dengan semakin banyaknya kolagen yang terdegradasi dan berkurangnya jumlah kolagen dapat menyebabkan menurunnya kelenturan dan kekuatan dari jaringan yang terbentuk selama proses penyembuhan luka. Kolagen yang lebih banyak terdapat pada area luka, akan membantu meningkatkan kekuatan jaringan terhadap tekanan dan regangan pada kulit.
Semakin besar pemberian ekstrak tempe memberikan pengaruh terhadap penurunan TNF-α (Gambar 3) dan peningkatan kolagen (Gambar 5). Pola skor TNF-α dan kolagen memiliki pola yang berbanding terbalik. TNF-α yang tinggi berpotensi menurunkan jumlah kolagen pada area luka, dengan memperlama fase inflamasi dan meningkatkan apoptosis fibroblas. Pada kelompok diabetes menunjukkan pola bahwa TNF-α yang tinggi (hari ke-3), menampilkan skor yang rendah pada kelompok perlakuan yang sama. Rendahnya skor TNF-α (hari ke-3) pada kelompok diabetes formula 3, memperlihatkan tinggi nya skor kolagen (hari ke-7) kelompok diabetes. Sedangkan tingginya skor TNF-α (hari ke-3) kelompok diabetes tanpa perlakuan, memperlihatkan rendahnya skor kolagen (hari ke-7) kelompok diabetes.
Ekstrak tempe memberikan pengaruh terhadap TNF-α pada semua kelompok hewan uji diabetes dan non diabetes. Pemberian kadar ekstrak tempe 2,5%, 5% dan 7,5% dapat menurunkan TNF-α pada kelompok hewan uji diabetes dan non diabetes (Gambar 3). Pada kondisi diabetes, pemberian ekstrak tempe dengan kadar 7,5% memberikan pengaruh terkuat dalam menurunkan TNF-α dibandingkan dengan kadar 2,5% dan 5%. Pada kelompok uji non diabetes, pemberian kadar ekstrak tempe 2,5%,
20
5% dan 7,5% juga memberikan pengaruh terhadap penurunan TNF-α dibandingkan kelompok kontrol tanpa perlakuan. Semua sediaan dengan variasi kadar ekstrak tempe dapat menurunkan TNF-α. Dengan berhasil diturunkannya TNF-α diharapkan dapat meningkatkan sintesis kolagen dan mempercepat proses penyembuhan luka.
Pemberian ekstrak tempe meningkatkan jumlah kolagen pada kelompok hewan uji diabetes (Gambar 5). Perlakuan dengan kadar ekstrak tempe 5% dan 7,5% memberikan pengaruh yang signifikan terhadap jumlah kolagen pada kondisi diabetes. Hasil skor kolagen (kelompok diabetes) pemberian ekstrak tempe 5% dan 7,5% sangat berdekatan dengan hasil skor kelompok non diabetes. Dengan demikian, pemberian ekstrak tempe dengan kadar 5% dan 7,5% diduga dapat memberikan pengaruh yang sama pada penyembuhan luka kondisi diabetes dan non diabetes.
Pengamatan pembuluh darah dilakukan dengan melakukan pengamatan histologis menggunakan pengecatan hematoxylin eosin. Pada perbesaran 100x, eritrosit akan terwarnai dengan warna merah. Pada pengamatan melintang, pembuluh darah tampak seperti lingkaran yang berisi eritrosit. Sedangkan pada pembuluh darah yang teramati membujur, akan tampak seperti saluran yang terisi eritrosit (Gambar 7). Pembuluh darah kemudian di hitung dan dilakukan skoring.
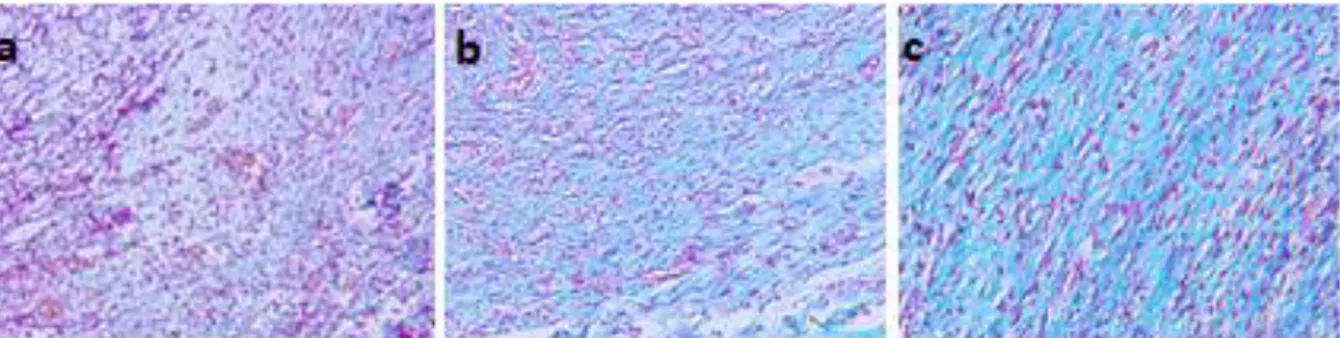
Dari hasil pengamatan histologi, hasil skoring tertinggi pembuluh darah yang terbentuk dimiliki oleh kelompok diabetes tanpa perlakuan (Gambar 6). Sedangkan kelompok terendah ditunjukan oleh kelompok formula 3 (Gambar 6). Pada kelompok uji non diabetes, skor tertinggi ditunjukan oleh kelompok formula 3. Sedangkan kelompok terendah dari non diabetes adalah formula 2. Dari hasil uji perbandingan antar kelompok dengan taraf kepercayaan 95% (p<0,05) ditemukan bahwa hanya kelompok formula 2 (nilai skor lebih rendah) yang memiliki perbedaan signifikan dengan kelompok tanpa perlakuan diabetes (Tabel 1). Hal ini dimungkinkan terjadi karena hasil pengamatan histologi pembuluh darah yang teramati tidak dalam posisi yang sama. Terdapat hasil histologi pembuluh darah dalam posisi melintang dan membujur, sehingga sebaran jumlah pembuluh darah terdapat perbedaan.
21
Gambar 6. Histogram kapilarisasi hari ke-7
Gambar 7. Penampilan pembuluh darah hari ke-7 pada pengamatan histologi. (a) tampak membujur (kelompok diabetes perlakuan basis); (b) tampak melintang (kelompok diabetes perlakuan formula 2).
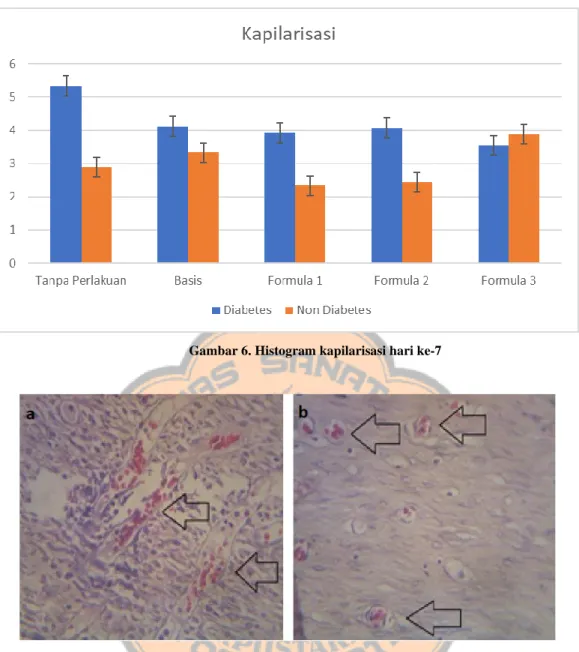
Gambar 8. Penampilan re-epitelisasi hari ke-7 pada pengamatan histologi (a) contoh re-epitelisasi kelompok diabetes (formula 1); (b) contoh re-epitelisasi kelompok non diabetes (formula 1).
22
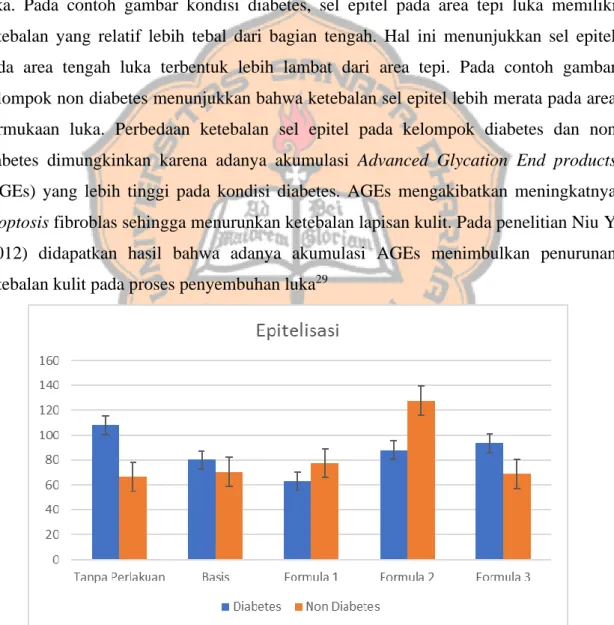
Pengamatan re-epitelisasi dilakukan dengan menggunakan pewarnaan
hematoxylin eosin, dan dilihat dibawah mikroskop (Gambar 8). Sel epitel tampak
berjajar memanjang dengan ukuran sel yang terlihat lebih kecil. Sel epitel yang terbentuk memiliki ketebalan yang berbeda-beda antar kelompok diabetes dan non diabetes. Proses re-epitelisasi terjadi melalui mobilisasi sel epitel dari tepi jaringan menuju tengah jaringan yang terluka.
Re-epitelisasi pada area luka memiliki ketebalan yang berbeda-beda. Sel epitel yang terbentuk tidak selalu memiliki ketebalan yang sama dalam proses penyembuhan luka. Pada contoh gambar kondisi diabetes, sel epitel pada area tepi luka memiliki ketebalan yang relatif lebih tebal dari bagian tengah. Hal ini menunjukkan sel epitel pada area tengah luka terbentuk lebih lambat dari area tepi. Pada contoh gambar kelompok non diabetes menunjukkan bahwa ketebalan sel epitel lebih merata pada area permukaan luka. Perbedaan ketebalan sel epitel pada kelompok diabetes dan non diabetes dimungkinkan karena adanya akumulasi Advanced Glycation End products (AGEs) yang lebih tinggi pada kondisi diabetes. AGEs mengakibatkan meningkatnya
apoptosis fibroblas sehingga menurunkan ketebalan lapisan kulit. Pada penelitian Niu Y
(2012) didapatkan hasil bahwa adanya akumulasi AGEs menimbulkan penurunan ketebalan kulit pada proses penyembuhan luka29
23
Ekstrak tempe yang diberikan sebanyak 5% pada kelompok non diabetes, memiliki perbedaan yang bermakna terhadap re-epitelisasi (p<0,05) (Tabel 1). Formula 2 memberikan gambaran re-epitelisasi tertinggi dibandingkan kelompok lain (Gambar. 10), dari kondisi diabetes dan non diabetes. Pemberian kadar ekstrak tempe sejumlah 5% dimungkinkan adalah jumlah yang tepat dari genistein meningkatkan epitelisasi pada kelompok non diabetes (Tabel 1). Pemberiaan ekstrak tempe pada kelompok non diabetes tidak menunjukan adanya pola yang berbanding lurus antara penambahan kadar ekstrak dengan peningkatan re-epitelisasi (Gambar 9). Hal ini dimungkinkan bahwa untuk meningkatkan re-epitelisasi diperlukan jumlah kadar ekstrak tempe yang lebih spesifik.
Pemberian gel ekstrak tempe tidak memberikan pengaruh terhadap re-epitelisasi pada kelompok dengan kondisi diabetes. Semua kadar ekstrak tempe tidak memberikan pengaruh signifikan terhadap re-epitelisasi pada kelompok diabetes (Tabel 1). Hal ini dimungkinan adanya kadar glukosa yang tinggi sehingga menyebabkan meningkatnya (AGEs). AGEs yang tinggi dapat menggangu homestasis dermal dengan menurunkan proliferasi, pematangan keratinosit dan meningkatkan apoptosis keratinosit28.
Pengukuran diameter luka dilakukan untuk mengetahui pemyembuhan luka pada kulit. Pembuatan luka pada hari ke 0 dengan menggunakan punch biopsy menghasilkan luka dengan bentuk bulat. Pembuatan luka dilakukan pada bagian kanan atau kiri dari ruas tulang belakang. Hal ini dilakukan untuk menghindari peregangan akibat aktivitas pergerakan tulang belakang. Pengamatan dan pengukuran diameter luka dilakukan pada hari ke-7 untuk mengetahui penyembuhan luka.
Pemilihan pengamatan penyembuhan luka pada hari ke-7, bertujuan untuk mengetahui kecepatan penutupan luka yang terjadi pada pertengahan fase proliferasi. Fase inflamasi yang berakhir lebih cepat, ditandai menurunya ekspresi TNF-α, diduga memiliki pengaruh dalam penyembuhan luka pada pertengahan fase proliferasi. Pada fase ini proses proses pembentukan kolagen, pembuluh darah dan re-epitelisasi sudah dimulai.
Pada hari ke-7 belum ditemukan luka yang menutup dengan sempurna. Dari beberapa hewan uji sudah mengalami penurunan ukuran diameter luka. Luka pada beberapa hewan coba juga masih tertutup keropeng. Keropeng mengganggu pengamatan dan pengukuran diameter luka. Keropeng dibiarkan hinga terlepas dengan
24
sendirinya untuk mencegah terjadinya luka kembali saat keropeng dilepaskan secara disengaja.
Gambar10. Histogram penyembuhan luka hari ke-7
Penyembuhan luka (hari ke-7) kelompok hewan non diabetes memiliki rata-rata penyembuhan luka yang lebih cepat dibandingkan kelompok diabetes (Gambar 10). Dari hasil perbandingan antar kelompok, didapatkan bahwa empat kelompok (Basis; formula 1; formula 3; tanpa perlakuan) pada kelompok non diabetes memiliki penyembuhan luka yang lebih tinggi dibandingkan dengan kelompok diabetes. Kelompok perlakuan dengan menggunakan formula 2, penyembuhan luka pada hewan uji normal lebih rendah daripada kondisi non diabetes. Kelompok hewan non diabetes formula 2 memiliki keropeng sehingga mengganggu dalam pengamatan dan pengukuran diameter luka.
Skala penyembuhan luka dipaparkan dalam skala 0-100%. Dan kelompok perlakuan dengan basis menunjukkan penyembuhan luka yang lebih rendah dibandingkan dengan kelompok tanpa perlakuan. Pada pemberian formula 2, penyembuhan luka kondisi normal lebih rendah dibandingkan dengan kondisis diabetes. Hal ini dimungkinkan adanya keropeng yang masih menutupi sebagian area luka, sehingga peneliti mengalami kendala dalam melakukan pengukuran.
Pola penyembuhan luka memiliki pola yang berbeda antara kelompok hari ke-7. Penyembuhan luka pada kelompok diabetes hari ke-7, kelompok perlakuan basis
25
memiliki penyembuhan luka paling rendah dan kelompok perlakuan lainya. Penggunaan formula 2 pada kelompok non- diabetes memiliki prosentase paling tinggi, selanjutnya adalah formula 2, 3 dan kelompok tanpa perlakuan. Prosentase penyembuhan luka pada kelompok non-diabetes pada hari ke-7, formula 1 menunjukkan prosentase penyembuhan luka terbesar dibandingkan formula 2, 3, tanpa perlakuan dan diabetes.
Penyembuhan luka pada hari ke-7 tidak memiliki perbedaan yang signifikan antar kelompok perlakuan. Dari hasil pengujian data penyembuhan luka pada hari ke-7 antar kelompok uji Diabetes, setiap perlakuan dibandingkan dengan kelompok tanpa perlakuan. Dari hasil pengujian dengan menggunakan taraf kepercayaan 95% (p<0,50), tidak ditemukan perbedaan yang signifikan antar kelompok tanpa perlakuan, perlakuan basis, formula 1, 2 dan 3 (Tabel 1). Hasil uji juga menunjukkan hasil yang sama pada kelompok uji non diabetes. Hal ini dimungkinkan karena penutupan dan penyembuhan luka dipengaruhi melalui proses yang kompleks dan bertahap. Hari ke-7 adalah hari tengah dalam proses proliferasi30. Pada hari ke-7 di duga kecepatan penutupan luka belum dapat dibedakan antar kelompok perlakuan. Hasil ini diduga adanya kemungkinan bahwa kecepatan penutupan luka yang cukup signifikan terjadi setelah hari ke-7 atau hampir berakhirnya fase proliferasi (hari ke-14).
Durasi proses proliferasi yang belum mencukupi diduga menjadi penyebab belum adannya perbedaan penyembuhan luka pada hari ke-7. Hal ini menyebabkan belum tercapainya beberapa kondisi optimal yang mendukung penutupan luka. Belum optimalnya proses proliferasi, diferensiasi, migrasi dan adhesi sel dalam tahap ini. Migrasi keratinosit ke area luka yang belum terjadi dengan sempurna, sehingga penutupan luka belum terjadi dengan maksimal. Selain itu adanya sel nekrosis pada area luka juga menghambat migrasi sel epitel, sehingga penutupan jaringan menjadi lebih lambat.
26
6. KESIMPULAN DAN SARAN
Kesimpulan yang diperoleh dalam penelitian ini adalah
a. Pemberian secara topikal sediaan genistein memberikan pengaruh terhadap ekspresi TNF-α pada hari ke-3 kelompok diabetes dan non diabetes. Pemberian sediaan ekstrak tempe dapat mempengaruhi ekspresi kolagen hari ke-7 pada kelompok diabetes.
b. Pemberian sediaan gel ekstrak tempe secara topikal tidak memberikan pengaruh yang signifikan terhadap penyembuhan luka sampai pada pengamatan hari ke-7 pada kondisi non diabetes dan diabetes.
Saran dalam penelitian ini adalah
a. Perlu dilakukan penelitian lebih lanjut menggunakan sediaan gel dengan waktu pengamatan yang lebih lama.
b. Perlu dilakukan penelitian lebih lanjut dengan menggunakan variasi kadar ekstrak tempe yang lebih tinggi.
c. Pengujian dan pengamatan ekspresi TNF-α dapat dilakukan pada sampel tissue
homogenate, dengan menggunakan metode ELISA (Enzyme Linked Immunosorbent Assay). Metode uji ini dapat digunakan untuk melihat secara kuantitatif TNF-α
pada jaringan luka.
d. Perlu dilakukan penelitian lebih lanjut dengan menggunakan biomarker TGF-β1, VEGF, AGEs, EGF, kolagen tipe 1 dan kolagen tipe 3 untuk mengetahui pengaruh sediaan terhadap proses penyembuhan luka.
27
7. REFERENSI
1. Sharp A, Clark J. Diabetes and its effects. Nurs Stand. 2011;25(45):41-47. http://gateway.library.qut.edu.au/login?url=http://search.ebscohost.com/login.as px?direct=true&db=c8h&AN=2011217249&site=ehost-live&scope=site.
2. Young, A. and McNaught, C.E., 2011. The Physiology of Wound Healing.
Surgery, 29 (10), 475-479.
3. Hamed, S., Bennett, C. L., Demiot, C., Ullmann, Y., Teot, L., & Desmouliere, A., 2014. Erythropoietin, A Novel Repurposed Drug: An Innovative Treatment for Wound Healing in Patients with Diabetes Mellitus. Wound Repair and
Regeneration, 22, 23-33.
4. Utami, D.T., Karim, D., 2014. Diabetes mellitus dengan ulkus diabetikum 1–7. 5. Gupta, B., Agarwal, R., Alam, M.S., 2011. Hydrogels for wound healing
applications, Biomedical Hydrogels: Biochemistry, Manufacture and Medical Applications. Woodhead Publishing Limited. doi:10.1016/B978-1-84569-590-3.50009-6
6. Utari, 2010. Tempe Terhadap Kadar Isoflavon ( Effects Of Soybean Processing. 7. Iskandar, Y.M. and Priatni, S., 2008. Isoflavones Aglicone of Tempe Malang
Fried Slices. Indo. J. Chem., 8 (3), 437– 442.
8. Park, E., Lee, S.M., Jung, I.K., Lim, Y., Kim, J.H., 2011. Effects of genistein on early-stage cutaneous wound healing. Biochem. Biophys. Res. Commun. 410, 514–519. doi:10.1016/j.bbrc.2011.06.013
9. Eo, H., Ann, J.-Y., Lim, Y., 2015. Dietary Supplementation of Genistein Attenuates Inflammatory Responses and Oxidative Stress during Cutaneous Wound Healing in Diabetic Mice. J. Agric. Sci. 7, 80–92. doi:10.5539/jas.v7n2p80
10. Tie, L., An, Y., Han, J., Xiao, Y., Xiaokaiti, Y., Fan, S., Liu, S., Chen, A.F., Li, X., 2013. Genistein accelerates refractory wound healing by suppressing superoxide and FoxO1/iNOS pathway in type 1 diabetes. J. Nutr. Biochem. 24, 88–96. doi:10.1016/j.jnutbio.2012.02.011
11. Asai, J., Takenaka, H., Hirakawa, S., Sakabe, J.-i., Hagura, A., Kishimoto, S., et
28
Enhancing Angiogenesis and Lymphangiogenesis. The American Journal of
Pathology, 181 (6), 2217-2224.
12. Velnar, T., Bailey, T., Smrkolj, V., 2009. The wound healing process: An overview of the cellular and molecular mechanisms. J. Int. Med. Res. 37, 1528– 1542. doi:10.1177/147323000903700531
13. Barati F, Javanbakht J, Adib-hashemi F, et al. Histopathological and clinical evaluation of Kombucha tea and Nitrofurazone on cutaneous full-thickness wounds healing in rats : an experimental study. Diagn Pathol. 2013;8(1):1. doi:10.1186/1746-1596-8-120
14. Beldon P. Basic science of wound healing. Surgery. 2010;28(9):409-412. doi:10.1016/j.mpsur.2010.05.007
15. Dong, W., 2016. Activation of α7nAChR Promotes Diabetic Wound Healing.pdf. doi:DOI: 10.1007/s10753-015-0295-x
16. Greaves NS, Ashcroft KJ, Baguneid M, Bayat A. Current understanding of molecular and cellular mechanisms in fibroplasia and angiogenesis during acute wound healing. J Dermatol Sci. 2013. doi:10.1016/j.jdermsci.2013.07.008 17. Teoh SL, Latiff AA, Das S. The effect of topical extract of Momordica charantia
( bitter gourd ) on wound healing in nondiabetic rats and in rats with diabetes induced by streptozotocin. 2009;(Dm):815-822. doi:10.1111/j.1365-2230.2008.03117.x
18. Falanga, V., 2005. Wound healing and its impairment in the diabetic foot.
19. Cianfarani, F., Zambruno, G., Brogelli, L., Sera, F., Lacal, P.M., Pesce, M., Capogrossi, M.C., Failla, C.M., Napolitano, M., Odorisio, T., 2006. Placenta Growth Factor in Diabetic Wound Healing Altered Expression and Therapeutic Potential 169, 1167–1182. doi:10.2353/ajpath.2006.051314
20. Zykova, S.N., Jenssen, T.G., Berdal, M., Olsen, R., Myklebust, R., Seljelid, R., 2000. Altered Cytokine and Nitric Oxide Secretion In Vitro by Macrophages From Diabetic Type II – Like db / db Mice 49.
21. Rosyid FN. Role of TNF-α in Diabetic Ulcer Healing Process. In: The 2nd International Conference on Science, Technology, and Humanity. ; 2016:142-149.
29
of clinical research and practice, (June 2011).
23. Yuliani, S. H. et al. (2018) ‘Optimization of genistein and daidzein extraction from a tempeh- fermented product of soybean’, Journal of Pharmacy & Pharmacognosy Research, 6(4), pp. 231–241.
24. Li1 J, Li2 J, Yue1 Y, et al. Genistein suppresses tumor necrosis factor α-induced inflammation. Drug Des Devel Ther. 2014;8:315-323. http://dx.doi.org/10.2147/DDDT.S52354.
25. Park E, Lee SM, Jung IK, Lim Y, Kim JH. Effects of genistein on early-stage cutaneous wound healing. Biochem Biophys Res Commun. 2011;410(3):514-519. doi:10.1016/j.bbrc.2011.06.013
26. Yuliawati, D., Mintaroem, K. and Sutrisno, S. (2018) ‘Inhibitory effect of genistein on MMP-2 and MMP-9 expression through suppressing NF-kB activity in peritoneum of murine model of endometriosis’, Asian Pacific Journal of Reproduction, 7(6), pp. 261–265. doi: 10.4103/2305-0500.246344.
27. Irrera N, Pizzino G, Anna RD, et al. Dietary Management of Skin Health: The Role of Genistein. MDPI. 2017:1-10. doi:10.3390/nu9060622.
28. Kintoko, 2017. Effect of Diabetes Condition on Topical Treatment of Binahong Leaf Fraction in Wound Healing Process. Majalah Obat Tradisional, 22 (August), 103–110.
29. Putte L Van, Schrijver S De, Moortgat P. The effects of advanced glycation end products (AGEs) on dermal wound healing and scar formation: a systematic review. SAGE. 2016. doi:10.1177/2059513116676828
30. Niu Y, Cao X, Song F, et al. Reduced dermis thickness and AGE accumulation in diabetic abdominal skin. Int J Low Extreme Wounds. In: Int J Low Extreme Wounds.; 2012; 11: 224–230.
31. Gonzalez AC de O, Costa TF, Andrade Z de A, Medrado ARAP. Wound healing - A literature review. An-Bras Dermatol. 2016;91(5):614-620. doi:10.1590/abd1806-4841.
30
8. BIOGRAFI PENULIS
Ignasius Adi Kurniawan, S. Farm., Apt. Lahir di Semarang pada tanggal 26 Agustus 1982. Riwayat pendidikan formal yang telah ditempuh oleh penulis adalah SD 1 Candi Lama Semarang (1988-1994). SMP N 2 Semarang (1994-1997). SMA N 5 Semarang (1997-2000). Sarjana Farmasi di Universitas Sanata Dharma Yogyakarta (2000-2005). Profesi Apoteker di Universitas Sanata Dharma Yogyakarta (2005-2006). Pada bulan Februari 2018, penulis melanjutkan pendidikan di Magister Farmasi di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
31
32
Lampiran 2. Rerata Kadar Glukosa hari ke-0 dan ke-7 pada kelompok non diabetes (A) dan diabetes (B)
Kelompok
Rerata Kadar Glukosa ± SE
(mg/dl) Kelompok
Rerata Kadar Glukosa ± SE (mg/dl)
H-0 H-7 H-0 H-7
Non diabetes Tanpa
Perlakuan 66,17±1,31 75,31±2,40
Diabetes Tanpa
Perlakuan 258,87±1,08 261,34±0,96 Non diabetes Basis 68,05±1,13 73,97±1,60 Diabetes Basis 268,57±2,97 272,64±3,85
Non diabetes Formula 1 65,71±2,19 71,72±3,11 Diabetes Formula 1 265,93±1,92 270,38±2,08 Non diabetes Formula 2 65,34±2,14 76,15±1,44 Diabetes Formula 2 262,10±1,91 265,60±2,38 Non diabetes Formula 3 69,40±1,80 78,66±1,61 Diabetes Formula 3 262,18±1,82 265,72±2,386 (A) (B)
33