BAB 2
TINJAUAN PUSTAKA
2.1 Sejarah Sabun
Sabun ditemukan oleh orang Mesir kuno beberapa ribu tahun yang lalu. Pembuatan sabun oleh suku bangsa Jerman dilaporkan oleh Julius Caesar. Teknik pembuatan sabun dilupakan orang dalam zaman kegelapan ( Dark Ages), namun ditemukan kembali selama Renaissance. Penggunaan sabun mulai meluas pada bad ke- 18.
Dewasa ini sabun dibuat praktis sama dengan teknik yang digunakan pada zaman yang lampau. Lelehan lemak sapi atau lemak lain dipanaskan dengan lindi ( natrium hidroksida) dan karenanya terhidrolisis menjadi gliserol dan garam natrium dari asam lemak. Dulu digunakan abu kayu ( yang mengandung basa seperti kalium karbonat) sebagai ganti lindi (lye = larutan alkali) (Fessenden, 1992).
2.2. Pengertian Sabun
Sabun adalah garam logam alkali ( biasanya garam natrium) dari asam- asam lemak. Sabun mengandung terutama garam C16 dan C18, namun dapat juga mengandung beberapa karboksilat dengan bobot atom lebih rendah. Sekali penyabunan itu telah lengkap, lapisan air yang mengandung gliserol dipisahkan dan gliserol dipulihkan dengan penyulingan. Gliserol digunakan sebagai pelembab dalam tembakau, industri farmasi dan kosmetik. (sifat melembabkan timbul dari gugus- gugus hidroksil yang dapat berikatan hidrogen dengan air dan mencegah penguapan air itu). Sabun dimurnikan dengan mendidihkannya dalam air bersih untuk membuang lindi yang berlebih, NaCl, dan gliserol. Zat tambahan (additive) seperti batu apung, zat warna dan parfum kemudian ditambahkan.
Suatu molekul sabun mengandung suatu rantai hidrokarbon panjang plus ion. Bagian hidrokarbon dari molekul itu bersifat hidrofobik dan larut dalam zat- zat non polar, sedangkan ujung ion bersifat hidrofilik dan larut dalam air. Karena adanya
rantai hidrokarbon, sebuah molekul sabun secara keseluruhan tidaklah benar- benar larut dalam air. Namun sabun mudah tersuspensi dalam air karena membentuk misel (micelles), yakni segerombolan ( 50 -150) molekul yang rantai hidrokarbonnya mengelompok dengan ujung- ujung ionnya yang menghadap ke air.(Fessendan, 1992)
Deterjen berasal dari kata detergene yang berarti “membersihkan”, yang sesuai dengan tujuan semula pembuatan campuran itu. Pada awal abad ke - 19 di Jerman ditemukan bahan sintetik, semula sebagai bahan pencuci pakaian, dan dipakai sebagai bahan pengganti konvensional yang disebut sebagai deterjen sintetik (synthetic detergents = syndet).
Terdapat berbagai nama lain untuk syndet, yaitu cleanser bar, detergent bar, synthetic toilet soap. Istilat tenside yang popular di Eropa merupakan istilah yang semula lebih bersifat teknis untuk menamai mekanisme kerja bahan- bahan ini, yaitu aktif di tegangan permukaan (tenside) namun di negara lain lebih sering disebut sebagai surfaktan ( Wasitaatmaja, 2007 ) .
2.3. Komposisi Sabun
Sabun konvensional yang dibuat dari lemak dan minyak alami dengan garam alkali serta sabun deterjen saat ini yang dibuat dari bahan sintetik, biasanya mengandung surfaktan, pelumas, antioksidan, deodoran, warna, parfum, pengontrol pH, dan bahan tambahan khusus.
• Surfaktan
Surfaktan adalah bahan terpenting dari sabun. Lemak dan minyak yang dipakai dalam sabun berasal dari minyak kelapa ( asam lemak C12), minyak zaitun (asam lemak C16 - C18). Penggunaan bahan berbeda menghasilkan sabun yang berbeda, baik secara fisik maupun kimia.
• Pelumas
Untuk menghindari rasa kering pada kulit diperlukan bahan yang tidak saja meminyaki kulit tetapi juga berfungsi untuk membentuk sabun yang lunak, misalnya asam lemak bebas, gliserol,lanolin, paraffin lunak, dan minyak almon, bahan sintetik ester asam sulfosuksinat. Bahan- bahan tersebut selain
meminyaki kulit juga dapat menstabilkan busa dan berfungsi sebagai peramas (plasticizers).
• Antioksidan
Untuk menghindari kerusakan lemak, terutama bau tengik, dibutuhkan bahan penghambat oksidasi, misalnya stearil hidrazid dan butilhydroxytoluene
(0,02%- 0,1%). • Deodoran
Deodoran dalam sabun mulai dipergunakan sejak tahun 1950, namun oleh karena khawatir efek samping, penggunaannya dibatasi. Bahan yang digunakan adalah TCC ( trichloro carbinilide).
• Warna
Pewarna sabun dibolehkan sepanjang memenuhi syarat dan peraturan yang ada, pigmen yang digunakan biasanya stabil dan konsentrasinya kecil sekali (0,01 – 0,5%). Titanium dioksida 0,01% ditambahkan pada berbagai sabun untuk menimbulkan efek berkilau.
• Parfum
Isi sabun tidak lengkap bila tidak ditambahkan parfum sebagai pewangi. Pewangi ini harus berada dalam pH dan wana yang berbeda pula. Setiap pabrik memilih bau dan warna sabun bergantung pada permintaan pasar atau masyarakat pemakainya.
• Pengontrol pH
Penambahan asam lemak yang lemah, misalnya asam sitrat, dapat menurunkan pH sabun
• Bahan tambahan khusus
Berbagai bahan tambahan untuk memenuhi kebutuhan pasar, produsen, maupun segi ekonomi dapat dimasukkan kedalam formula sabun. Dewasa ini dikenal berbagai macam sabun khusus, misalnya
a. Sabun transparan yang menambahkan sukrosa dan gliserin b. Deodorant, yang menambahkan triklorokarbon, triklosan,
diklorofen.
c. Antiseptik (medicated) yang menambahkan bahan antiseptik, misalnya fenol, kresol, dan sebagainya
d. Sabun bayi yang lebih berminyak
2.4 Cara Kerja Sabun
Kemampuan sabun untuk menyingkirkan lemak dari pakaian juga berpangkal dari “sejenis melarutkan yang sejenis”. Bila sabun bersentuhan dengan minyak atau lemak yang mengotori pakaian , ekor hidrofob dari anion larut dalam lemak. Minyak berangsur- angsur terpisah dari serat pakaian dan terbungkus dalam misel yang menjerat minyak didalamnya. Misel mengemulsikan minyak dan mempertahankannya dalam suspensi sehinggga dapat terbawa oleh air bilasan ( Brady, 1994)
Surfaktan adalah prinsip kerja dari setiap deterjen, yang jika dilarutkan kedalam cairan cenderung memekat pada permukaan cairan tersebut. Kesanggupan ini disebabkan sifat fisiokimia yang dualistik, yaitu mempunyai bagian yang senang pada pelarut (filik) dan bagian yang tidak senang pada pelarut ( fobik). Jika pelarutnya air, maka surfaktan akan berada di batas antara air dan yang dilarutkan dan tegak lurus terhadap batas tersebut dengan bagian yang bersifat filik berada dalam air
Dua jenis surfaktan yang dikenal, yatiu:
1. Surfaktan ionik, yakni surfaktan yang bila terlarut dalam pelarut (air) akan terurai menjadi ion negatif dan positif
2. Surfaktan nonionik ( tidak berionisasi), misalnya poliglikol ester dan alkohol jenuh.
Selain sebagai pelarut, surfaktan dapat bekerja sebagai pembasah, pembentuk busa, dan pengemulsi. Pada sabun, surfaktan bekerja sebagai pelarut ( kotoran dan lemak), pengemulsi, dan pembentuk busa. Meskipun banyaknya busa tidak mempengaruhi daya larut dan daya bersih sabun, namun masih banyak orang menyukai busa sabun dalam pencucian.
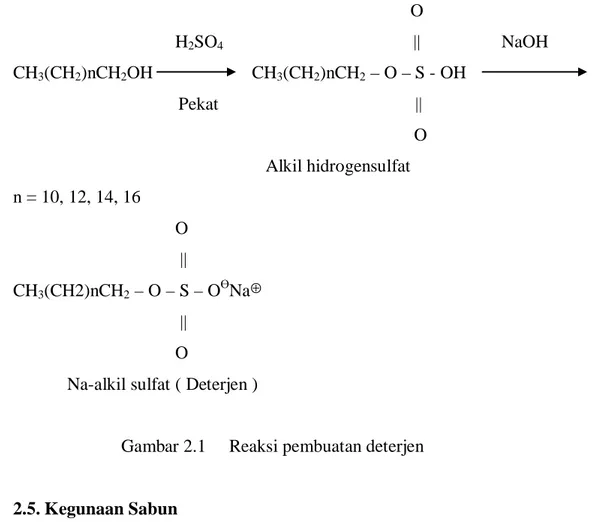
Pada dasarnya deterjen anionik mempunyai kemiripan dengan sabun. Deterjen mengandung gugus yang sangat polar, bermuatan negatif (dalam hal ini –SO3-) dan rantai hidrokarbon yang panjang yang dapat melarutkan oli dan vaselin. Bahan dasar pembuatan deterjen adalah rantai panjang alkohol jenuh C12 hingga C18. Berikut langkah-langkah pembuatan deterjen.
O H2SO4 || NaOH CH3(CH2)nCH2OH CH3(CH2)nCH2 – O – S - OH Pekat || O Alkil hidrogensulfat n = 10, 12, 14, 16 O || CH3(CH2)nCH2 – O – S – OӨNa⊕ || O
Na-alkil sulfat ( Deterjen )
Gambar 2.1 Reaksi pembuatan deterjen
2.5. Kegunaan Sabun
Kegunaan sabun adalah kemampuannya mengemulsi kotoran berminyak sehingga dapat dibuang dengan pembilasan. Kemampuan ini disebabkan oleh dua sifat sabun.
1. Rantai hidrokarbon sebuah molekul sabun larut dalam zat non- polar, seperti tetesan- tetesan minyak.
2. Ujung anion molekul sabun, yang tertarik pada air, ditolak oleh ujung anion molekul- molekul sabun yang menyembul dari tetesan minyak lain. Karena tolak menolak antara tetes sabun- minyak, maka minyak itu tidak dapat saling bergabung tetapi tetap tersuspensi ( Fessenden, 1992).
Sabun digunakan sebagai bahan pembersih kotoran, terutama kotoran yang bersifat sebagai lemak atau minyak karena sabun dapat mengemulsikan lemak atau minyak . Jadi sabun dapat bersifat sebagai emulgator (Poedjiadi, 2004).
2.6. Densitas
Rapat massa atau densitas material yang didefinisikan sebagai
ρ.
Dalam beberapa kasus (misalnya, di Amerika Serikat ), kerapatan juga didefinisikan sebaga
Secara matematis, kerapatan didefinisikan sebagai massa dibagi volume:
(2.1)
dimana ρ adalah kerapatan, m adalah massa, dan V adalah volume. Dari persamaan ini, kerapatan massa harus memiliki satuan massa per volume.
Secara umum, kerapatan dapat diubah dengan mengubah baik Meningkatkan tekanan selalu meningkatkan densitas material. Peningkatan suhu umumnya menurun densitas (Anonim1 , 2011).
2.7. Tegangan Permukaan 2.7.1 Tegangan Antar Muka
Permukaan zat cair mempunyai sifat ingin meregang, sehingga permukaannya seolah- olah ditutupi oleh suatu lapisan yang elastis. Hal ini disebabkan adanya gaya tarik menarik antara partikel sejenis di dalam zat cair sampai ke permukaan.
Di dalam cairan, tiap molekul ditarik oleh molekul lain yang sejenis di dekatnya dengan gaya yang sama kesegala arah. Pada permukaan cairan, tiap molekul ditarik oleh molekul sejenis didekatnya dengan arah hanya kesamping dan kebawah, tetapi tidak ditarik oleh molekul diatasnya karena diatas permukaan cairan berupa fase uap ( udara ) dengan jarak antara molekul sangat renggang.
Adanya gaya atau tarikan ke bawah menyebabkan permukaan cairan berkontraksi dan berada dalam keadaan tegang. Tegangan ini disebut dengan tegangan permukaan.
Besarnya tegangan permukaan cairan bergantung pada gaya tarik antara molekul- molekulnya. Ketika gaya tarik besar, seperti dengan H2O, tegangan
V m
=
permukaan besar. Sebaliknya, cairan seperti bensin yang tersusun atas molekul- molekul non polar mempunyai tegangan permukaan yang kecil karena tarikan antarmolekul lebih lemah.
Zat yang tegangan permukaannya rendah sangat mudah membasahi permukaan bagaimanapun keadaan permukaannya. Pelarut hidrokarbon, misalnya nafta atau bensin, menyebar pada kaca maupun permukaan berminyak dengan mudahnya, sebab tarikan sesama molekul hidrokarbon sangat lemah. Hampir tidak ada usaha untuk memperluas permukaan cairan, akibatnya mereka mudah menyebar pada permukaan apapun ( Brady, 1994 ).
2.7.2 Faktor- Faktor Yang Mempengaruhi Tegangan Permukaan a. Jenis cairan
Pada umumnya cairan yang memiliki gaya tarik antara molekulnya besar, seperti air, maka tegangan permukaannya juga besar. Sebaliknya pada cairan seperti bensin karena gaya tarik antara molekulnya kecil, maka tegangan permukaannya juga kecil. b. Suhu
Tegangan permukaan cairan turun bila suhu naik, karena dengan bertambahnya suhu molekul- molekul cairan bergerak lebih cepat dan pengaruh interaksi antara molekul berkurang sehingga tegangan permukaannya menurun.
c. Adanya zat terlarut
Adanya zat terlarut pada cairan dapat menaikkan atau menurunkan tegangan permukaan. Untuk air adanya elektrolit anorganik dan non elektrolit tertentu seperti sukrosa dan gliserin menaikkan tegangan permukaan. Sedangkan adanya zat- zat seperti sabun, detergen, dan alkohol adalah efektif dalam menurunkan tegangan
2.8. Metode Penentuan Tegangan Permukaan 2.8.1. Metode Cincin Du Nouy
Metode cincin du nouy merupakan metode yang paling baik digunakan karena lebih akurat dan cepat dalam pengukuran tegangan permukaan deterjen, serum, suspensi, koloid dan lain- lain.
Gaya yang dibutuhkan untuk mengangkat cincin dari permukaan air dapat dihitung dari persamaan :
RF F
4
β
γ =
(2.2)
R = jari- jari rata- rata cincin
F = gaya yang dibutuhkan untuk mengangkut cincin dari permukaan
β = faktor koreksi yang dihitung dengan persamaan berikut :
(
)
2 a − β =(
)
c R F R b + − 2 1 2 2 4 1 4 ρ ρ π π (2.3) a = 0, 725 b = 0,09075 m-1det2 c = 0,04534 – 1,679 ( r/ R)r = Jari- jari kawat yang digunakan untuk membuat cincin R = jari- jari rata- rata lingkaran
P1 = massa jenis cairan yang ada di bawah P2 = massa jenis cairan yang berada di atas
Ketika mengukur tegangan permuakaan cairan- cairan, harus diperhatikan bahwa cairan yang ada dibawah benar- benar membasahi cincin (Bird , 1987)
2.8.2. Metode Tekanan Gelembung Maksimum
Tegangan permukaan menyebabkan adanya perbedaan tekanan pada kedua sisi permukaan cairan yang lengkung. Tekanan pada sisi yang cembung. Ketika pertama kali tekanan dikenakan, jari- jari gelembung sangat besar. Sementara gelembung itu mengembang, jari- jarinya akan semakin kecil sampai nilai minimum. Pada keadaan
ini jari- jari gelembung sama dengan jari- jari tabung gelas. Bila tekanan terus dinaikkan, jari- jari gelembung akan membesar kembali sampai akhirnya gelembung ini lepas dari tabung gelas dan naik ke permukaan cairan, jelas bahwa tekanan maksimum diperoleh pada saat jari- jari minimum. Tekanan maksimum ini bukan hanya disebabkan perbedaan tekanan pada kedua sisi gelembung, tetapi juga disebabkan oleh adanya tekanan hidrostatik ( yang bergantung pada ketinggian tabung gelas dalam cairan ). Jadi tekanan maksimum yang terbaca pada manometer adalah :
(
0)
2γ ρ ρ ρ = + − ∆ gh r maks (2.4)r = jari- jari tabung gelas
h = jarak ujung tabung gelas dari permukaan cawan ρ = Massa jenis cairan
ρ0 =Massa jenis uap cair ( biasanya diabaikan karena ρ0 << ρ ) ( Bird, 1987) Metode tekanan gelembung maksimum memiliki keakuratan di bawah 10 %, yang mana tidak tergantung pada jarak kontak dan hanya merupakan sebuah pengetahuan dasar dari densitas suatu cairan ( Jika menggunakan pipa ganda ) dan pengukurannya juga relatif cepat. Rata- rata sebuah gelembung harganya sekitar 1/ sek (Adamson 1990).
2.8.3. Metode Kenaikan Kapiler
Metode ini didasarkan pada kenyataan bahwa bila sebatang pipa kapiler dimasukan kedalam cairan maka permukaan cairan dalam pipa kapiler dapat mengalami kenaikan atau penurunan. Apabila cairan membasahi bejana ( θ < 90 ) maka permukaan cairan akan naik. Sedangkan bila cairan tidak membasahi bejana ( θ > 90 ) permukaan cairan akan turun. Peristiwa naik turunnya permukaan cairan dalam kapiler ini disebut dengan kapilaritas.
Kenaikan atau penurunan cairan dalam kapiler disebabkan oleh adanya tegangan permukaan yang bekerja pada permukaan cairan yang menyentuh dinding
sepanjang keliling pipa. Akibat tegangan permukaan ini pipa akan memberikan gaya reaksi pada permukaan cairan yang besarnya sama tapi arahnya berlawanan
( Yazid, 2005 ).
Pada peristiwa terangkatnya cairan pada kolom pipa, besarnya gaya keatas akibat tegangan permukaan diberikan persamaan :
F1 = 2 π r γ cos θ (2.5)
F1 = Gaya ke atas akibat tegangan permukaan r = Jari- jari kapiler
γ = tegangan permukaan θ = sudut kontak
Kenaikan cairan tidak dapat berlangsung terus, karena pada permukaan cairan juga bekerja gaya akibat berat cairan ( F2 ) yang arahnya ke bawah sebesar :
F2 = d V g (2.6)
Karena V = π r2 h, maka :
F2 = π r2 h d g (2.7)
d = rapatan cairan g = percepatan grafitasi
h = kenaikan atau penurunan cairan dalam kapiler
Pada saat setimbang berlaku F1 dan F2 , sehingga diperoleh :
2 π r γ cos θ = π r2 h d g (2.8) θ γ cos 2 r h g d = (2.9)
Untuk cairan yang membasahi bejana seperti air θ≈ 0, sehingga cos θ = 1. Persamaan menjadi : 2 r h g d = γ (2.10)
Sedangkan untuk cairan yang tidak membasahi bejana seperti raksa θ = 140, sehingga cos θ = - 0,766 ( berharga negatip). Akibatnya h memiliki harga negatip yang berarti cairan mengalami penurunan atau ditekan dalam kapiler.
2.8.4. Metode Lempengan Wilhelmy
Metode ini didasarkan pada gaya yang diperlukan untuk menarik pelat tipis dari permukaan cairan. Pelat digantung pada salah satu lengan neraca dan dimasukkan kedalam cairan yang akan diselidiki. Besarnya gaya tarik pada neraca yang digunakan untuk melepas pelat dari permukaan cairan dicatat. Pada saat pelat terlepas berlaku hubungan :
F = W + 2 lγ (2.11)
Sehingga tegangan permukaan dapat dihitung sebagai :
l W F 2 − = γ (2.12)
Dimana : γ = tegangan permukaan F = gaya tarik yang dicatat W = berat lempeng ( pelat ) 1 = lebar lempeng
2 = faktor karena ada dua permukaan pada lempeng
Dalam metode ini diandaikan sudut kontak θ = 00, dan pengaruh dari ujung- ujung lempeng dapat diabaikan ( Yazid, 2005 ).
Pada metode ini, digunakan lempengan mika tipis atau kaca slide mikrosip yang digantung pada neraca. Pengukuran dapat dilakukan dengan cara statistik ataupun dengan detasment yang secara akurat diberikan pada persamaan ideal.
Jika pengukurannya dilakukan dengan metode detasmen, prosedurnya hampir sama dengan metode cincin Du Nouy, tetapi faktor koreksi hanya 0,1 % ( Adamson, 1990).
2.9. Bahan Aktif Pembentuk Deterjen
Bahan aktif merupakan bahan inti dari detergen sehingga bahan ini harus ada dalam proses pembuatan deterjen. Secara fungsional bahan aktif ini mempunyai andil dalam meningkatkan daya bersih. Ciri dari bahan aktif adalah busanya sangat banyak.
1. Sodium lauril eter sulfat (SLES)
Sodium lauril sulfat dibuat dari lauril alkohol diperoleh dengan hidrolisis lemak
CH3(CH2)10CH2OH + HOSO2H CH3(CH2)10CH2SO2OH + H2O lauril alkohol asam sulfat hidrogen lauril sulfat
NaOH O || CH3 (CH2)11- O- S- O-Na+ + H2O || O non polar / rantai lipofilik,
polar,
rantai hidropilik sodium laurel eter sulfat
Gambar 2.2 Reaksi pembentukan sodium lauril eter sulfat
(Hart, 1991) Rumus Molekul :CH 3 (CH 2) 11 OSO 3 Na
Berat Molekul : 290 – 310 g/ mol Ciri Fisik : bubuk putih Kelarutan : 150 gr/ l
pH : 9 -10
Densitas : 1.05 gr/ cm3
Sifat- sifat : - merupakan surfaktan anionik - ramah lingkungan
- merupakan bahan pembuat busa
- merupakan surfaktan dengan produksi terbesar karena biaya yang relatif rendah
(http://www.chemicalland21.com)
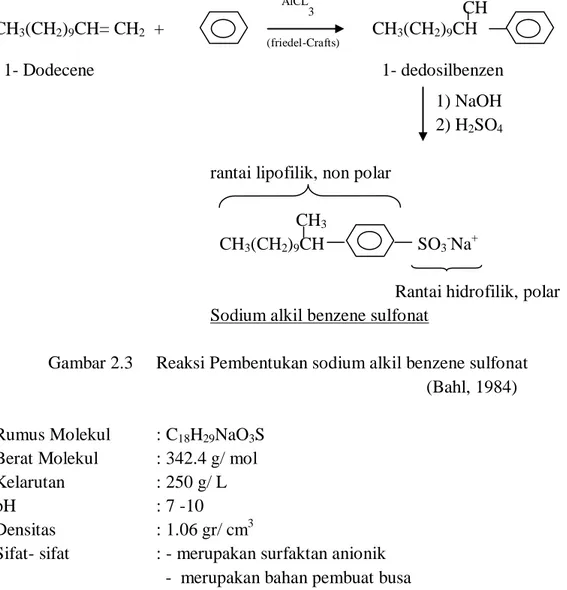
Sodium alkil benzene sulfonat dihasilkan dari 1 dedosin melalui reaksi Friedel Crafts. AlCL3 CH CH3(CH2)9CH= CH2 + CH3(CH2)9CH (friedel-Crafts) 1- Dodecene 1- dedosilbenzen 1) NaOH 2) H2SO4 rantai lipofilik, non polar
CH3
CH3(CH2)9CH SO3-Na+
Rantai hidrofilik, polar
Sodium alkil benzene sulfonat
Gambar 2.3 Reaksi Pembentukan sodium alkil benzene sulfonat (Bahl, 1984) Rumus Molekul : C18H29NaO3S
Berat Molekul : 342.4 g/ mol Kelarutan : 250 g/ L
pH : 7 -10
Densitas : 1.06 gr/ cm3
Sifat- sifat : - merupakan surfaktan anionik - merupakan bahan pembuat busa
- bersifat biodegradable karena mengandung rantai atom C yang panjang
(www.scienceinthebox.com)
2.10 Bahan Baku Pembentuk Deterjen 1. Bahan Aktif ( Active ingredient )
Bahan aktif merupakan bahan inti dari detergen sehingga bahan ini harus ada dalam proses pembuatan deterjen. Dalam penelitian ini menggunakan sodium lauril eter sulfat dengan nama dagang Texapon. Secara fungsional bahan aktif ini mempunyai andil dalam meningkatkan daya bersih. Ciri dari bahan aktif adalah busanya sangat banyak.
2. Bahan pengisi ( Filler )
Biasanya garam dapat yang tersedia secara umum adalah Natrium Klorida (NaCl). Senyawa natrium adalah penting dalam perindustrian kimia, kaca, logam, kertas, petrolium, sabun dan tekstil. Sabun pada umumnya merupakan garam natrium dengan beberapa jenis asam lemak. Bahan ini berfungsi sebagai pengisi dari seluruh campuran bahan baku. Pemberian bahan ini berguna untuk memperbanyak atau memperbesar volume.
3. Bahan tambahan ( aditif )
Keberadaan bahan aditif dapat meningkatkan nilai jual deterjen. Dalam penelitian ini menambahkan EDTA sebagai pengikat logam sadah dan pengawet.
4. Bahan pewarna
Bahan pewarna dalam pembuatan sabun dimaksudkan untuk meningkatkan nilai jual. Dalam penelitian ini menggunakan pewarna hijau sintetik
5. Bahan pewangi ( parfum )
Keberadaan parfum memegang peranan besar dalam hal keterkaitan konsumen akan produk deterjen. Dalam penelitian ini, digunakan bahan pewangi beraroma lemon.
Adalah penting dalam kandungan deterjen pembersih piring untuk memiliki karakteristik tertentu seperti baik membersihkan lemak dan memungkinkan untuk menguras tanpa goresan pada piring. Bahan ini harus memiliki sifat berbusa.. Seperti telah dibahas dalam formulasi untuk deterjen serbuk, yang konvensional mengandung fosfat, silakat, dan alkali lainnya. Tetapi memiliki kelemahan tertentu seperti menyebabkan bercak, bergaris, terutama saat deterjen ini untuk digunakan di daerah air sadah. Terlepas dari itu kelemahan lain adalah bahwa konstituen padat yang dilarutkan ke dalam air sadah sulit untuk mengukur jumlah partikel padat yang larut di dalam cairan.
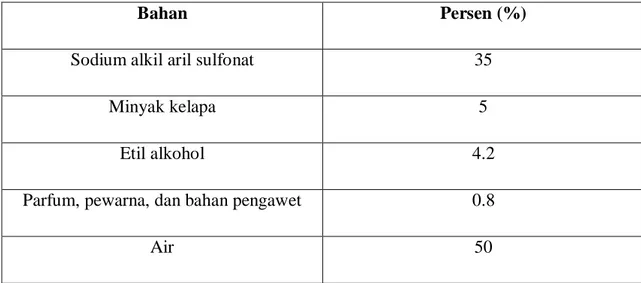
Berikut ini adalah kandungan dalam pembuatan deterjen sabun cuci piring cair yang dapat digunakan secara manual maupun mekanik.
Bahan Persen (%)
Sodium alkil aril sulfonat 35
Minyak kelapa 5
Etil alkohol 4.2
Parfum, pewarna, dan bahan pengawet 0.8
Air 50
Tabel 2.1 Resep sabun cuci piring buatan sendiri
(Board, 2002)