ASIDOLISIS ENZIMATIK FRAKSI MINYAK SAWIT
DENGAN ASAM STEARAT UNTUK SINTESIS
COCOA BUTTER EQUIVALENTS
(Enzymatic Acidolysis of palm oil fractions with stearic acid for the synthesis of cocoa butter equivalents)
Abstract
Enzymatic acidolysis of each fraction of palm oil (refined, bleached, deodorized palm oil, RBDPO; palm olein; soft palm midfraction, sPMF) and stearic acid at various reaction times and weight ratios was studied for the synthesis of cocoa butter equivalents (CBE). Triacylglycerol (TAG) composition, solid fat content (SFC) and slip melting point (SMP) were analyzed in the reaction mixtures, before dan after enzymatic acidolysis reaction. Enzymatic acidolysis of the substrates resulted in the formation of a complex mixture of acylglycerols and free fatty acids. Concentration of several TAGs were increased, some were decreased, and several new TAGs were formed. Synthesis of target TAGs (POS, SOS) increased with increasing proportion of stearic acid to 5:4 weight ratio in the substrates and reached equilibrium after 36-48 hours acidolysis were reflected in the degree of interesterification (DI) and CBE index (IC) values. The resulting changes in the TAG composition of the substrates were reflected in the SFC and SMP values. The relationship between TAG composition (TAG groups) and the SFC value at each measuring temperature can be expressed in a multiple linear regression model. The SFC values at various measuring temperature could be accurately predicted from the proportion of MMM (OOO), StStM (POP, POS, SOS), StStD (PLP, SLP, SLS) TAG groups, either single or combined.
Keywords : enzymatic acidolysis, palm oil fractions, triacylglycerol, solid fat content, cocoa butter equivalents
Abstrak
Asidolisis enzimatik dari masing-masing fraksi minyak sawit (refined, bleached, deodorized palm oil, RBDPO; olein sawit; soft palm midfraction, sPMF) dan asam stearat pada berbagai waktu reaksi dan rasio berat dipelajari untuk sintesis cocoa butter equivalents (CBE). Analisis dilakukan terhadap komposisi triasilgliserol (TAG), solid fat content (SFC) dan slip melting point (SMP) dalam campuran reaksi sebelum dan sesudah reaksi asidolisis enzimatik. Transesteferikasi enzimatik dari substrat menghasilkan pembentukan campuran kompleks dari asilgliserol dan asam lemak bebas. Konsentrasi beberapa TAG meningkat, beberapa menurun dan beberapa TAG baru terbentuk. Sintesis TAG target (POS, SOS) meningkat dengan meningkatnya proporsi asam stearat dalam substrat dan mencapai kesetimbangan
setelah 36-48 jam asidolisis yang tercermin dalam nilai derajat interesterifikasi (DI) dan indeks CBE (IC). Perubahan dalam komposisi TAG substrat tercermin dalam profil SFC dan nilai SMP. Hubungan antara komposisi TAG (kelompok TAG) dan nilai SFC pada masing-masing suhu pengukuran dapat dinyatakan dalam model regresi linear berganda. Nilai SFC pada berbagai suhu pengukuran dapat secara akurat diprediksi dari proporsi kelompok TAG MMM (OOO), StStM (POP, POS, SOS), StStD (PLP, PLS, SLS), secara tunggal atau pun gabungan.
Kata kunci : asidolisis enzimatik, fraksi minyak sawit, triasilgliserol, solid fat content, cocoa butter equivalents
Pendahuluan
CB dianggap sebagai lemak ideal dan pilihan dalam industri coklat confectionery karena mempunyai karakteristik unik. Komposisi CB hampir 80% didominasi oleh tiga TAG simetrik, saturated-unsaturated-saturated (StUSt), yaitu palmitat-oleat-palmitat (POP, 16;8-19.0%), palmitat-oleat-stearat (POS, 38.0-43.8%) dan stearat-oleat-stearat (SOS, 22.8-30.0%) (Lipp et al. 2001). Konsekuensinya CB bersifat keras dan rapuh di bawah suhu ruang, tetapi ketika dimakan, CB meleleh sempurna di mulut dengan tekstur creamy yang lembut dan suatu sensasi dingin (Gunstone 2002). Polimorfismenya juga berpengaruh besar terhadap sifat-sifat fisik dari produk coklat, seperti kilap (gloss), derak (snap), kontraksi, ketahanan panas, pelelehan yang cepat dan tajam di mulut, serta ketahanan bloom (Osborn dan Akoh 2002a).
Banyak keterbatasan menyangkut penggunaan CB, antara lain suplai yang tidak stabil, harga relatif mahal, kurang memadai untuk digunakan pada iklim panas serta kualitasnya bervariasi. Selain itu, proses tempering diperlukan untuk produk coklat yang sepenuhnya menggunakan CB dalam formulasinya, karena cenderung akan mengalami blooming (Zaidul et al. 2007, Torbica et al. 2006, Fuji Oil Europe 2004). Berbagai alasan tersebut mendorong dikembangkannya specialty fats alternatif CB oleh para peneliti maupun industri minyak dan lemak, sehingga dikenal istilah cocoa butter alternatives (CBA). Review tentang CBA yang meliputi klasifikasi dan sifat-sifatnya dapat ditemukan dalam artikel Lipp dan Anklam (1998). Salah satu
jenis CBA yang mempunyai sifat fisikokimia mirip CB dan sepenuhnya kompatibel dengan CB adalah cocoa butter equivalents (CBE).
CBE berperilaku seperti CB dan dapat dicampur dengan CB pada proporsi berapapun tanpa mengubah karakteristik pelelehan, rheologi, dan pengolahan, sehingga kualitas akhir produk tetap dipertahankan. CBE didesain agar mengandung komposisi TAG mirip CB, sehingga sifat-sifatnya diharapkan mirip dan kompatibel dengan CB dalam campuran untuk pembuatan coklat (Zaidul et al. 2007). Oleh karena itu, CBEs mempunyai nilai ekonomi paling tinggi di antara jenis CBA lainnya (Balle, 2006). CBE mempunyai peranan antara lain untuk memperbaiki toleransi terhadap lemak susu, meningkatkan daya simpan pada suhu tinggi, mengendalikan blooming, serta memberikan alternatif secara ekonomi terhadap penggunaan CB dalam formulasi coklat (Wainwright 1999).
Akhir-akhir ini teknik interesterifikasi enzimatik menjadi salah satu pilihan dalam proses produksi CBE. Menurut Osborn dan Akoh (2002a) perhatian terhadap reaksi interesterifikasi, baik dari sudut pandang gizi maupun fungsional terus meningkat karena memungkinkan untuk dihasilkannya margarin bebas asam lemak trans, cocoa butter alternatives (CBA), dan pangan rendah kalori; memperbaiki sifat-sifat fisik dan fungsional pangan serta memperbaiki kualitas nutrisi lemak dan minyak. Selama interesterifikasi akan terjadi redistribusi asam lemak dalam TAG, sehingga akan mengubah komposisi asam lemak dalam TAG. Perubahan jumlah dan jenis TAG tersebut akan mempengaruhi karakteristik fisik minyak dan lemak, seperti sifat pelelehan dan kristalisasi (Idris dan Dian 2005).
Interesterifikasi enzimatik lebih menawarkan banyak keuntungan dibandingkan dengan interesterifikasi kimia. Reaksi enzimatik lebih spesifik, kondisi reaksinya mild serta limbah yang dihasilkannya minimal. Selain itu apabila enzim yang digunakan dalam bentuk amobil, maka dapat digunakan berulang sehingga secara ekonomi lebih menguntungkan (Willis dan Marangoni 2002). Interesterifikasi kimia biasanya bersifat acak dan sulit dihentikan jika reaksi berlangsung sangat cepat, sedangkan reaksi interesterifikasi enzimatik biasanya berlangsung lebih lambat dan lebih mudah untuk dikendalikan.
Interesterifikasi enzimatik untuk sintesis lemak dengan profil TAG mirip CB dapat dilakukan melalui reaksi transesterifikasi ataupun asidolisis. Transesterifikasi merupakan reaksi pertukaran gugus asil antara dua ester, yaitu antara dua triasilgliserol. Sedangkan asidolisis merupakan reaksi perpindahan gugus asil antara suatu asam dengan suatu ester, atau dapat diartikan sebagai inkorporasi asam lemak bebas baru ke dalam triasilgliserol (Willis dan Marangoni 2002).
Asidolisis merupakan reaksi interesterifikasi yang paling banyak digunakan untuk TAG terstruktur. Produksi CBE secara asidolisis enzimatik dapat dilakukan dengan menggunakan lipase spesifik sn-1,3 yang mengkatalisis inkorporasi asam stearat dan palmitat pada posisi sn-1,3 dari minyak awal yang mengandung asam oleat pada posisi sn-2 sampai komposisi yang mirip dengan CB diperoleh (Ciftci et al. 2009). Efisiensi dari reaksi asidolisis untuk produksi CBE tergantung pada parameter reaksi yaitu rasio substrat, suhu reaksi, waktu reaksi, konsentrasi enzim dan kandungan air (Ciftci et al. 2008).
Sedangkan reaksi asidolisis enzimatik antara lain telah dilakukan oleh Chong et al. (1992) dari asam stearat dan olein sawit; Mojovic et al. (1993) dari palm oil mid fraction (PMF) dan asam stearat dalam n-heksana; Satiawihardja et al. (2001) dari asam stearat dan olein sawit dalam n-heksana ; Wang et al. (2006) dari minyak biji teh dan metil palmitat/metil stearat ; Ciftci et al. (2009) dari refined olive pomace oil (ROPO) dan asam palmitat/asam stearat; serta Pinyaphong dan Phutrakul (2009) dari minyak sawit dan metil palmitat/metil stearat.
Tujuan penelitian ini adalah untuk mengevaluasi proses sintesis triasilgliserol khas CBE secara asidolisis enzimatik dari substrat fraksi-fraksi minyak sawit dengan asam stearat dalam upaya mendapatkan teknologi proses produksi CBE skala laboratorium beserta informasi pengendaliannya. Evaluasi yang dilakukan meliputi kajian terhadap pengaruh jenis substrat, rasio substrat dan waktu reaksi terhadap perubahan profil TAG dan sifat pelelehannya (profil SFC) setelah reaksi asidolisis serta mendapatkan hubungan antara profil TAG dengan profil SFC.
Bahan dan Metode
Bahan. Bahan yang digunakan dalam penelitian ini antara lain refined, bleached, deodorized palm oil (RBDPO), olein sawit (PT Asian Agri, Jakarta). Soft palm midfraction (sPMF), cocoa butter (CB) (PT Karya Putrakreasi Nusantara, Wilmar Group, Medan). Lipase spesifik-1,3 amobil komersial dari Thermomyces lanuginosa yang disebut Lipozyme TL IM (Novozyme A/S, Bagsvaerd, Denmark). Standar triasilgliserol (TAG) murni (OOO, POO, SOO, PPP, SSS) dari Sigma (St. Louis, MO USA), asam stearat (Merck) serta bahan-bahan kimia untuk analisis. Untuk melengkapi standar TAG, TAG murni dicampur dengan minyak/lemak yang telah diketahui komposisi TAG-nya, yaitu RBDPO (PLO, PLP, OOO, POO, PPP), CB (POP, POS, SOS, SOA) dan FHSO (PPP, PPS, PSS,SSS).
Pengukuran aw enzim. Pengukuran aktivitas air (aw) enzim dilakukan secara
langsung menggunakan aw-meter Shibaura WA-60. Kalibrasi dilakukan
menggunakan NaCl dengan aw = 0.7509. Sebanyak 1 gram sampel enzim diletakkan
pada tempat sampel pada aw-meter Shibaura WA-60. Selanjutnya aw-meter ditutup
dan ditunggu sampai angka hasil pengukuran pada aw-meter konstan.
Asidolisis Enzimatik. Reaksi asidolisis enzimatik mengacu pada metode yang dimodifikasi dari Chong et al. (1992), Mojovic et al. (1993), Satiawihardja et al. (2001) dan Ciftci et al. (2009). Sebanyak 5 g substrat campuran masing-masing fraksi minyak sawit (RBDPO, Olein Sawit, sPMF) dengan asam stearat pada rasio berat 5:3 dimasukkan ke dalam labu Erlenmeyer 25 mL. Selanjutnya enzim lipase sebanyak 6% (b/b minyak) ditambahkan ke dalam campuran substrat yang sudah dipanaskan terlebih dahulu pada suhu sekitar 68-70°C selama 10 menit. Reaksi interesterifikasi (asidolisis) dilakukan secara batch dengan kecepatan orbital shaker 200 rpm, suhu reaksi 68-70°C dan waktu reaksi 4 sampai 48 jam. Pemisahan enzim dari hasil asidolisis dilakukan dengan cara penyaringan menggunakan kertas saring (dalam keadaan panas). Selain itu reaksi asidolisis juga dilakukan terhadap substrat pada
berbagai rasio berat (5:1 sampai 5:5) untuk masing-masing fraksi minyak sawit dengan asam stearat dengan waktu reaksi 20 jam.
Komposisi Triasilgliserol. Analisis komposisi TAG mengacu pada metode yang dimodifikasi dari AOCS Official Methods Ce 5c, 1997. Komposisi TAG dianalisis menggunakan HPLC Hewlett Packard series 1100 dengan detektor Indeks Refraksi (Refractive index, RI). Laju aliran fase gerak (aseton : asetonitril, 85 : 15 v/v) sebesar 0.8 mL/menit. Kolom yang digunakan adalah dua kolom C-18 ( Microsorb MV dan Zorbax Eclipse XDB–C18, 4.6 x 250 mm, ukuran partikel 5 µm) yang dipasang secara seri. Sampel dilarutkan dalam aseton atau campuran aseton : kloroform (2:1 v/v) dengan konsentrasi 5%, lalu disuntikkan ke dalam HPLC sebanyak 20 μL. Analisis komposisi TAG dilakukan terhadap substrat sebelum dan sesudah reaksi asidolisis.
Derajat Interesterifikasi (DI). Peningkatan konsentrasi TAG selama interesterifikasi dinyatakan sebagai derajat interesterifikasi (DI) yang didefinisikan sebagai total konsentrasi TAG (%area) yang meningkat konsentrasinya pada waktu reaksi tertentu, [TAGIt], terhadap total konsentrasi TAG (%area) yang meningkat tersebut pada awal
reaksi, [TAGI0] (Ghazali et al. 1995 dan Chen et al. 2007). Sedangkan [TAGIt] dan
[TAGI0
[TAGI
] dihitung relatif terhadap total konsentrasi TAG pada masing-masing campuran reaksi. Selanjutnya DI dapat dapat dihitung menggunakan formula berikut:
t
DI = --- ] [TAGI0]
Solid Fat Content (SFC). Analisis SFC (IUPAC 2.150 ex 2.323, 1987) hasil interesterifikasi menggunakan Bruker Minispec PC 100 NMR Analyzer. Sebelum analisis, sampel dilelehkan terlebih dahulu pada suhu 80°C. Sampel dimasukkan ke dalam tabung NMR dengan menggunakan pipet tetes sebanyak 2.5 mL (setinggi dry block), lalu dipanaskan pada suhu 60°C selama 30 menit pada alat pemanas kering. Setelah itu sampel disimpan pada suhu 0°C selama 90 menit, selanjutnya sampel disimpan selama 40 jam pada suhu 26°C. Sampel disimpan lagi pada suhu 0°C
selama 90 menit. Setelah itu sampel diinkubasi pada suhu 10, 20, 25, 30, 35, 40 dan 45°C selama 60 menit. Setelah inkubasi, sampel siap dianalisis. Kalibrasi NMR menggunakan standar SFC 0%, 31.5% dan 72.9%.
Slip Melting Point (SMP). Analisis SMP (AOCS Official Methods Cc 3-25, 2005) dilakukan terhadap substrat sebelum dan sesudah reaksi asidolisis. Sampel yang telah disaring dilelehkan dan dimasukkan ke dalam tabung kapiler (3 buah) setinggi 1 cm. Selanjutnya disimpan dalam refrigerator pada suhu 4-100C selama 16 jam. Tabung kapiler diikatkan pada termometer dan termometer tersebut dimasukkan ke dalam gelas kimia (600 mL) berisi air (sekitar 300 mL). Suhu air dalam gelas kimia diatur pada suhu 8 – 100C di bawah titik leleh sampel dan suhu air dipanaskan pelan-pelan (dengan kenaikan 0.50C – 10C/menit ) dengan pengadukan (magnetic stirrer). Pemanasan dilanjutkan dan suhu diamati dari saat sampel meleleh sampai sampel naik pada tanda batas atas. Slip melting point dihitung berdasarkan rata-rata suhu dari ketiga sampel yang diamati.
Analisis Statistik. Hubungan matematik antara komposisi triasilgliserol dengan solid fat content diduga melalui regresi linear berganda dengan pendekatan regresi bertahap (stepwise regression) menggunakan Software SPSS Statistics 17.0. R2 digunakan untuk mengukur proporsi variabilitas dari variabel bebas untuk model yang digunakan.
Hasil dan Pembahasan
Reaksi interesterifikasi yang dikatalisis enzim lipase dapat dilakukan pada media yang berbeda, baik dalam pelarut organik maupun dalam sistem bebas pelarut organik. Sintesis dalam sistem bebas pelarut organik menawarkan beberapa keuntungan meliputi dampak lingkungan yang minimal dengan menghindarkan penggunaan pelarut organik yang toksik dan mudah terbakar, penghematan biaya yang signifikan karena tidak adanya proses lebih lanjut serta tahap purifikasi yang lebih mudah dan lebih sedikit (Chaibakhsh et al. 2009).
Pada penelitian ini, proses asidolisis enzimatik dilakukan pada sistem bebas pelarut organik dengan suhu reaksi dipertahankan pada 68-70°C, sehingga substrat tetap dalam keadaan cair. Asam stearat yang digunakan pada penelitian ini mempunyai SMP tinggi (sekitar 67-70°C), sehingga digunakan suhu minimum 68°C untuk menjaga berlangsungnya reaksi. Lipase (Lipozyme TL IM) yang digunakan mempunyai aw sekitar (0.369 ± 0.027). Reaktivitas Lipozyme TL IM tidak
dipengaruhi oleh perubahan aw dari 0.1130 ke 0.5289, tetapi peningkatan aw
Lipozyme TL IM relatif stabil pada sistem bebas pelarut organik pada kisaran suhu 55 – 80°C. Interesterifikasi dengan katalis Lipozyme TL IM sedikitnya membutuhkan 6% enzim untuk mencapai kesetimbangan derajat interesterifikasi dalam 6 jam reaksi pada 60°C. Selain itu, Lipozyme TL IM tidak selektif terhadap asam lemak atau TAG dalam sistem yang digunakan (Zhang et al. 2001).
mengakibatkan peningkatan pembentukan ALB (Ronne et al. 2005). Sedangkan menurut Zhang et al. (2001), pengurangan kadar air lipase dari 6% sampai 3% tidak mempengaruhi aktivitas lipase, tetapi cenderung menurunkan pembentukan DAG dalam sistem. Hal ini mengindikasikan bahwa air di dalam sistem, baik yang dibawa oleh enzim atau bahan baku dapat meningkatkan pembentukan produk samping, seperti ALB dan DAG.
Pengaruh Waktu Reaksi Terhadap Komposisi TAG
Pengaruh waktu reaksi terhadap komposisi TAG selama sintesis CBE secara asidolisis enzimatik dipelajari masing-masing pada substrat RBDPO/Asam Stearat (5:3, b/b), Olein Sawit/FHSO (5:3, b/b) serta sPMF/FHSO (5:3, b/b) dengan waktu reaksi dari 4 sampai 48 jam. Pada Gambar 7.1 dapat dilihat profil kromatogram hasil analisis komposisi TAG substrat (sPMF/Asam Stearat) sebelum dan sesudah reaksi asidolisis selama 20 jam. Sedangkan komposisi TAG beberapa jenis substrat selengkapnya pada berbagai waktu reaksi dapat dilihat pada Tabel 7.1 (RBDPO/Asam Stearat), 7.2 (Olein Sawit/Asam Stearat) dan 7.3 (sPMF/Asam Stearat).
Gambar 7.1 Profil kromatogram hasil analisis komposisi TAG sPMF (atas) dan substrat sPMF/Asam Stearat sesudah reaksi asidolisis (bawah)
Waktu Retensi (menit)
R es pon D et ek tor ( nR IU ) PO P 0 20000 40000 60000 80000 D ia s ilg lis e ro l PL L PL O OL O PL P SO O PO O PPP SO O PO S SO S 10 20 30 40 50
Waktu Retensi (menit)
R es pon D et ek tor ( nR IU ) 10 15 20 25 30 35 40 45 50 55 0 5000 10000 15000 20000 25000 OL O PL O PL P OOO PO O PO P PPP SO O P OS PPS SO S PSS SSS D ia s ilg lis e ro l 20 30 40 50
Proses asidolisis enzimatik terhadap masing-masing substrat mengakibatkan terbentuknya campuran kompleks asilgliserol dan asam lemak bebas (ALB). Menurut Zhang et al. (2001), untuk interesterifikasi dengan katalis lipase spesifik-1,3, ALB dan sn-1,2(2,3)-DAG yang terbentuk merupakan produk samping hidrolisis. Proses asidolisis enzimatik juga mengakibatkan perubahan besar dalam komposisi TAG substrat. Profil TAG memperlihatkan adanya peningkatan dan penurunan konsentrasi beberapa TAG serta terbentuknya beberapa TAG baru.
Menurut Malcata et al. (1992), mekanisme yang diusulkan untuk asidolisis dari olive atau butter oil dengan asam kaprilat menggunakan katalis lipase adalah sebagai berikut: E + G1↔ EG1 ↔ EQ1-I ↔ EQ1 EQ + I 1 + W ↔ E + Q E + Q 1 2↔ EQ2 EQ + W 2 + I ↔ EQ2-I ↔ EG2 ↔ E + G2
W melambangkan molekul air, I melambangkan spesies intermediate yang mengandung satu atau lebih gugus alkohol dari reaktan gliserida G1 dan G2
melambangkan produk gliserida, Q1 melambangkan residu asam lemak secara umum
dari gliserida bahan baku, dan Q2
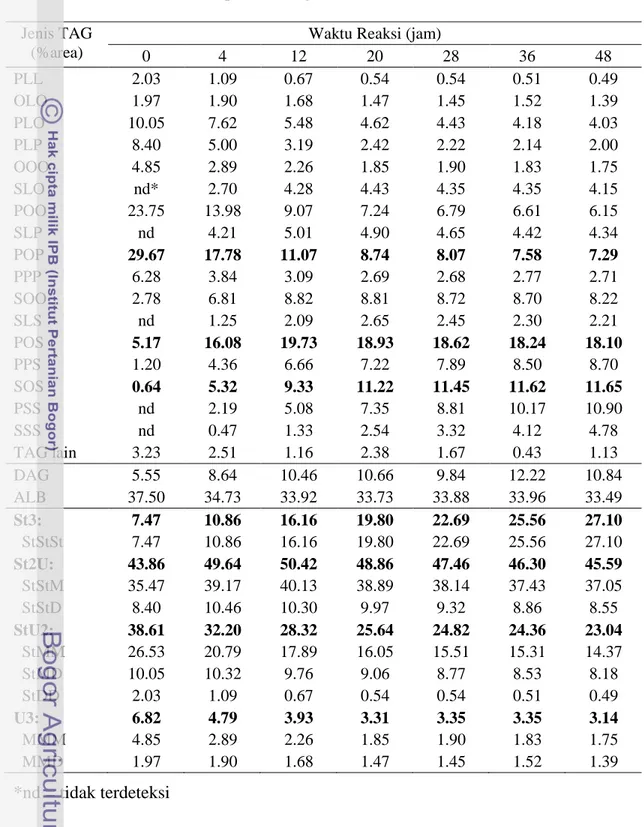
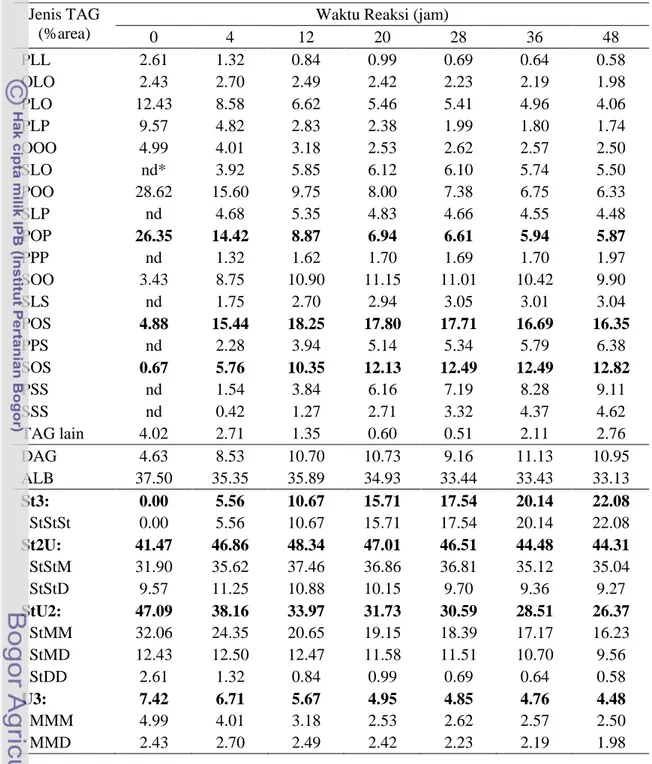
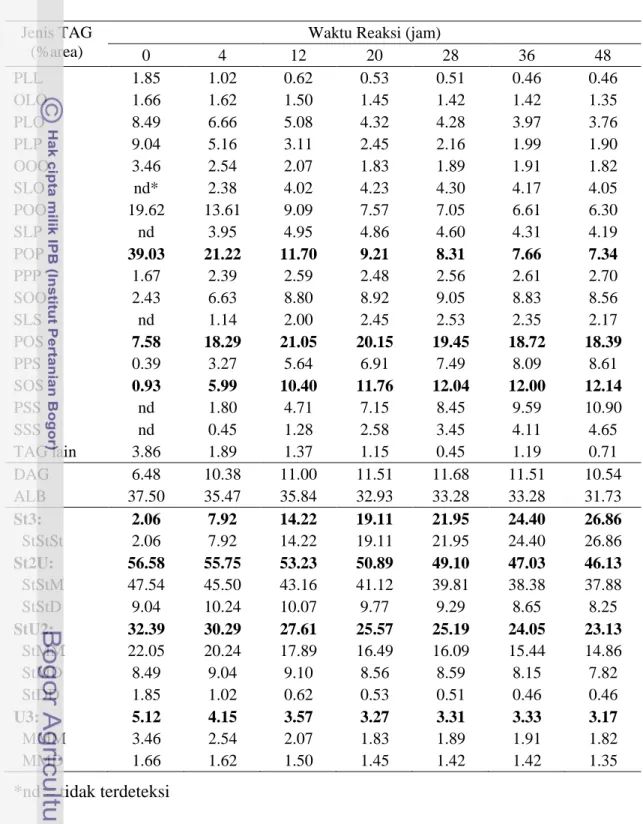
Proses asidolisis enzimatik memberikan pola perubahan yang hampir sama dalam komposisi TAG untuk ketiga jenis substrat. Perubahan paling besar terjadi terutama pada TAG dominan dalam substrat. Sebagai ilustrasi, untuk waktu reaksi 20 jam, pada substrat RBDPO/Asam Stearat, Olein Sawit/Asam Stearat dan sPMF/FHSO pada rasio berat 5:3, konsentrasi TAG POP menurun masing-masing dari 29.6, 26.35 dan 39.03% menjadi 8.74, 6.94 dan 9.21%.
melambangkan asam lemak bebas yang disuplai ke dalam sistem reaksi.
Sementara itu, komponen TAG target (POS dan SOS), konsentrasinya meningkat cukup tinggi. Pada substrat RBDPO/Asam Stearat, konsentrasi TAG POS dan SOS meningkat masing-masing dari 5.17% dan 0.64% menjadi 18.93% dan 11.22%. Pada substrat Olein Sawit/Asam Stearat, konsentrasi TAG POS dan SOS
meningkat masing-masing dari 4.88% dan 0.67% menjadi 17.80% dan 12.13%. Sedangkan pada substrat sPMF/Asam Stearat, konsentrasi TAG POS dan SOS meningkat masing-masing dari 7.58% dan 0.93% menjadi 20.13% dan 11.76%. Bahkan TAG POS menjadi TAG dominan pada semua jenis substrat untuk semua waktu reaksi. Secara umum substrat sPMF/Asam Stearat memberikan TAG POS tertinggi diikuti dengan substrat RBDPO/Asam Stearat dan Olein Sawit/Asam Stearat. Walaupun demikian, peningkatan TAG POS tertinggi pada substrat RBDPO/Asam Stearat, sedangkan substrat Olein Sawit/Asam Stearat dan sPMF/Asam Stearat peningkatan TAG POS-nya hampir sama. Secara umum, TAG POS terus meningkat sampai waktu reaksi 12 jam, selanjutnya cenderung terjadi penurunan. Sedangkan TAG SOS terus meningkat sampai waktu reaksi 36 jam, selanjutnya cenderung konstan.
Selain itu, beberapa TAG baru juga terbentuk pada semua jenis substrat seperti SLO, SLP, SLS, PSS dan SSS. Sedangkan pada substrat Olein Sawit/Asam Stearat juga terbentuk TAG PPP yang sebelumnya tidak ada, tetapi terdapat pada substrat yang lain. Sintesis TAG maupun pembentukan TAG baru cenderung konstan setelah waktu reaksi 36 jam. Perubahan-perubahan ini mengindikasikan terjadi pertukaran asil antara TAG dari fraksi-fraksi minyak sawit (sumber POP, POO) dengan TAG asam stearat dalam campuran reaksi selama reaksi asidolisis seperti halnya interesterifikasi yang dilakukan oleh Mojovic et al. (1993) terhadap substrat PMF dengan asam stearat dalam heksana. Hasil ini juga sejalan dengan hasil penelitian Noor Lida et al. (1998) yang melaporkan bahwa selama interesterifikasi, terjadi penurunan dan peningkatan konsentrasi beberapa jenis TAG serta terjadi sintesis beberapa jenis TAG baru.
Tabel 7.1 Komposisi triasilgliserol hasil asidolisis RBDPO dengan Asam Stearat (5:3, b/b) pada berbagai waktu reaksi
Jenis TAG
(%area)
Waktu Reaksi (jam)
0 4 12 20 28 36 48 PLL 2.03 1.09 0.67 0.54 0.54 0.51 0.49 OLO 1.97 1.90 1.68 1.47 1.45 1.52 1.39 PLO 10.05 7.62 5.48 4.62 4.43 4.18 4.03 PLP 8.40 5.00 3.19 2.42 2.22 2.14 2.00 OOO 4.85 2.89 2.26 1.85 1.90 1.83 1.75 SLO nd* 2.70 4.28 4.43 4.35 4.35 4.15 POO 23.75 13.98 9.07 7.24 6.79 6.61 6.15 SLP nd 4.21 5.01 4.90 4.65 4.42 4.34 POP 29.67 17.78 11.07 8.74 8.07 7.58 7.29 PPP 6.28 3.84 3.09 2.69 2.68 2.77 2.71 SOO 2.78 6.81 8.82 8.81 8.72 8.70 8.22 SLS nd 1.25 2.09 2.65 2.45 2.30 2.21 POS 5.17 16.08 19.73 18.93 18.62 18.24 18.10 PPS 1.20 4.36 6.66 7.22 7.89 8.50 8.70 SOS 0.64 5.32 9.33 11.22 11.45 11.62 11.65 PSS nd 2.19 5.08 7.35 8.81 10.17 10.90 SSS nd 0.47 1.33 2.54 3.32 4.12 4.78 TAG lain 3.23 2.51 1.16 2.38 1.67 0.43 1.13 DAG 5.55 8.64 10.46 10.66 9.84 12.22 10.84 ALB 37.50 34.73 33.92 33.73 33.88 33.96 33.49 St3: 7.47 10.86 16.16 19.80 22.69 25.56 27.10 StStSt 7.47 10.86 16.16 19.80 22.69 25.56 27.10 St2U: 43.86 49.64 50.42 48.86 47.46 46.30 45.59 StStM 35.47 39.17 40.13 38.89 38.14 37.43 37.05 StStD 8.40 10.46 10.30 9.97 9.32 8.86 8.55 StU2: 38.61 32.20 28.32 25.64 24.82 24.36 23.04 StMM 26.53 20.79 17.89 16.05 15.51 15.31 14.37 StMD 10.05 10.32 9.76 9.06 8.77 8.53 8.18 StDD 2.03 1.09 0.67 0.54 0.54 0.51 0.49 U3: 6.82 4.79 3.93 3.31 3.35 3.35 3.14 MMM 4.85 2.89 2.26 1.85 1.90 1.83 1.75 MMD 1.97 1.90 1.68 1.47 1.45 1.52 1.39 *nd = tidak terdeteksi
Tabel 7.2 Komposisi triasilgliserol hasil asidolisis Olein Sawit dengan Asam Stearat (5:3, b/b) pada berbagai waktu reaksi
Jenis TAG
(%area)
Waktu Reaksi (jam)
0 4 12 20 28 36 48 PLL 2.61 1.32 0.84 0.99 0.69 0.64 0.58 OLO 2.43 2.70 2.49 2.42 2.23 2.19 1.98 PLO 12.43 8.58 6.62 5.46 5.41 4.96 4.06 PLP 9.57 4.82 2.83 2.38 1.99 1.80 1.74 OOO 4.99 4.01 3.18 2.53 2.62 2.57 2.50 SLO nd* 3.92 5.85 6.12 6.10 5.74 5.50 POO 28.62 15.60 9.75 8.00 7.38 6.75 6.33 SLP nd 4.68 5.35 4.83 4.66 4.55 4.48 POP 26.35 14.42 8.87 6.94 6.61 5.94 5.87 PPP nd 1.32 1.62 1.70 1.69 1.70 1.97 SOO 3.43 8.75 10.90 11.15 11.01 10.42 9.90 SLS nd 1.75 2.70 2.94 3.05 3.01 3.04 POS 4.88 15.44 18.25 17.80 17.71 16.69 16.35 PPS nd 2.28 3.94 5.14 5.34 5.79 6.38 SOS 0.67 5.76 10.35 12.13 12.49 12.49 12.82 PSS nd 1.54 3.84 6.16 7.19 8.28 9.11 SSS nd 0.42 1.27 2.71 3.32 4.37 4.62 TAG lain 4.02 2.71 1.35 0.60 0.51 2.11 2.76 DAG 4.63 8.53 10.70 10.73 9.16 11.13 10.95 ALB 37.50 35.35 35.89 34.93 33.44 33.43 33.13 St3: 0.00 5.56 10.67 15.71 17.54 20.14 22.08 StStSt 0.00 5.56 10.67 15.71 17.54 20.14 22.08 St2U: 41.47 46.86 48.34 47.01 46.51 44.48 44.31 StStM 31.90 35.62 37.46 36.86 36.81 35.12 35.04 StStD 9.57 11.25 10.88 10.15 9.70 9.36 9.27 StU2: 47.09 38.16 33.97 31.73 30.59 28.51 26.37 StMM 32.06 24.35 20.65 19.15 18.39 17.17 16.23 StMD 12.43 12.50 12.47 11.58 11.51 10.70 9.56 StDD 2.61 1.32 0.84 0.99 0.69 0.64 0.58 U3: 7.42 6.71 5.67 4.95 4.85 4.76 4.48 MMM 4.99 4.01 3.18 2.53 2.62 2.57 2.50 MMD 2.43 2.70 2.49 2.42 2.23 2.19 1.98 *nd = tidak terdeteksi
Tabel 7.3 Komposisi triasilgliserol hasil asidolisis sPMF dengan Asam Stearat (5:3, b/b) pada berbagai waktu reaksi
Jenis TAG
(%area)
Waktu Reaksi (jam)
0 4 12 20 28 36 48 PLL 1.85 1.02 0.62 0.53 0.51 0.46 0.46 OLO 1.66 1.62 1.50 1.45 1.42 1.42 1.35 PLO 8.49 6.66 5.08 4.32 4.28 3.97 3.76 PLP 9.04 5.16 3.11 2.45 2.16 1.99 1.90 OOO 3.46 2.54 2.07 1.83 1.89 1.91 1.82 SLO nd* 2.38 4.02 4.23 4.30 4.17 4.05 POO 19.62 13.61 9.09 7.57 7.05 6.61 6.30 SLP nd 3.95 4.95 4.86 4.60 4.31 4.19 POP 39.03 21.22 11.70 9.21 8.31 7.66 7.34 PPP 1.67 2.39 2.59 2.48 2.56 2.61 2.70 SOO 2.43 6.63 8.80 8.92 9.05 8.83 8.56 SLS nd 1.14 2.00 2.45 2.53 2.35 2.17 POS 7.58 18.29 21.05 20.15 19.45 18.72 18.39 PPS 0.39 3.27 5.64 6.91 7.49 8.09 8.61 SOS 0.93 5.99 10.40 11.76 12.04 12.00 12.14 PSS nd 1.80 4.71 7.15 8.45 9.59 10.90 SSS nd 0.45 1.28 2.58 3.45 4.11 4.65 TAG lain 3.86 1.89 1.37 1.15 0.45 1.19 0.71 DAG 6.48 10.38 11.00 11.51 11.68 11.51 10.54 ALB 37.50 35.47 35.84 32.93 33.28 33.28 31.73 St3: 2.06 7.92 14.22 19.11 21.95 24.40 26.86 StStSt 2.06 7.92 14.22 19.11 21.95 24.40 26.86 St2U: 56.58 55.75 53.23 50.89 49.10 47.03 46.13 StStM 47.54 45.50 43.16 41.12 39.81 38.38 37.88 StStD 9.04 10.24 10.07 9.77 9.29 8.65 8.25 StU2: 32.39 30.29 27.61 25.57 25.19 24.05 23.13 StMM 22.05 20.24 17.89 16.49 16.09 15.44 14.86 StMD 8.49 9.04 9.10 8.56 8.59 8.15 7.82 StDD 1.85 1.02 0.62 0.53 0.51 0.46 0.46 U3: 5.12 4.15 3.57 3.27 3.31 3.33 3.17 MMM 3.46 2.54 2.07 1.83 1.89 1.91 1.82 MMD 1.66 1.62 1.50 1.45 1.42 1.42 1.35 *nd = tidak terdeteksi
Peningkatan konsentrasi TAG selama interesterifikasi, menurut Ghazali et al. (1995) dan Chen et al. (2007) dinyatakan sebagai derajat interesterifikasi (DI) yang didefinisikan sebagai total konsentrasi TAG (%area) yang meningkat konsentrasinya pada waktu reaksi tertentu, [TAGIt], terhadap total konsentrasi TAG (%area) yang
meningkat tersebut pada awal reaksi, [TAGI0]. Sedangkan [TAGIt] dan [TAGI0]
dihitung relatif terhadap total konsentrasi TAG pada masing-masing campuran reaksi. Pada Tabel 7.4 dapat dilihat jenis-jenis TAG yang meningkat dan menurun konsentrasinya serta TAG baru yang terbentuk setelah reaksi asidolisis enzimatik. Tabel 7.4 Perubahan komposisi TAG substrat setelah asidolisis enzimatik
Perubahan komposisi TAG Jenis TAG
TAG yang meningkat konsentrasinya PPPa), SOO, POS, PPSb), SOS
TAG yang menurun konsentrasinya PLL, OLO, PLO, PLP, OOO, POO, POP, PPP
TAG baru yang terbentuk
c)
SLO, SLP, PPPd), SLS, PPSe), PSS, SSS
a)
sPMF/Asam Stearat b)RBDPO/Asam Stearat dan sPMF/Asam Stearat
c)
RBDPO/Asam Stearat d)Olein Sawit/Asam Stearat
e)
Olein Sawit/Asam Stearat dan sPMF/Asam Stearat
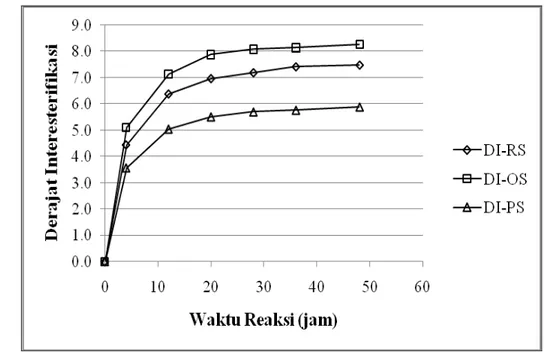
Pada Gambar 7.2 dapat dilihat Derajat Interesterifikasi (DI) masing-masing jenis substrat pada berbagai waktu reaksi. TAG yang meningkat konsentrasinya (termasuk TAG baru yang terbentuk) setelah asidolisis, yang dijadikan dasar perhitungan DI adalah TAG SLO, SLP, SOO, SLS, POS, PPS, SOS, PSS dan SSS. Untuk substrat Olein Sawit/Asam Stearat dan sPMF/Asam Stearat ditambah dengan TAG PPP yang juga meningkat konsentrasinya setelah reaksi asidolisis. Sedangkan untuk substrat RBDPO/Asam Stearat, TAG PPP tersebut justru mengalami penurunan karena substrat tersebut mengandung TAG PPP lebih tinggi dari substrat yang lain, sehingga peluang untuk berreaksi dengan TAG lain lebih besar. Walaupun demikian, konsentrasi TAG tertentu yang tinggi pada substrat awal tidak selalu mengalami penurunan setelah reaksi asidolisis enzimatik.
Pada Gambar 7.2 terlihat bahwa Substrat Olein Sawit/Asam Stearat mempunyai DI yang paling tinggi diikuti oleh substrat RBDPO/Asam Stearat dan RBDPO/Asam Stearat pada semua waktu reaksi. Pada substrat Olein Sawit/Asam Stearat terlihat bahwa konsentrasi TAG SOS meningkat paling tinggi relatif terhadap TAG SOS awal, diikuti TAG POS dan PPP. Peningkatan konsentrasi tersebut juga relatif paling tinggi dibandingkan dengan substrat RBDPO/Asam Stearat dan sPMF/Asam Stearat. Pada Gambar 7.2 juga terlihat bahwa DI mulai menunjukkan nilai konstan setelah waktu reaksi 36 jam, yang mengindikasikan bahwa kesetimbangan reaksi terjadi pada waktu-waktu tersebut.
Sebagai ilustrasi, TAG SOS dan POS dapat terbentuk dari reaksi transesterifikasi antara TAG POP atau POO dengan Asam Stearat menggunakan katalis lipase spesifik-1,3:
POP + S →POS + SOS POO + S → POS + SOS
Konsentrasi TAG (POP+POO) yang tinggi dalam substrat tidak selalu menghasilkan produk TAG POS dan SOS dengan konsentrasi yang tinggi pula. Hal ini mengindikasikan bahwa proporsi antara TAG (POP+POO) dan Asam Stearat yang menentukan konsentrasi TAG POS dan SOS yang terbentuk. Dengan demikian, substrat Olein Sawit/Asam Stearat memberikan proporsi TAG dengan Asam Stearat yang paling baik untuk menghasilkan produk-produk TAG yang menentukan perhitungan DI. Kesesuaian proporsi TAG dengan Asam Stearat berikutnya adalah substrat RBDPO/Asam Stearat diikuti sPMF/Asam Stearat.
DI dapat digunakan untuk menentukan waktu reaksi yang sesuai untuk menghasilkan TAG target yang diinginkan atau untuk mengetahui sampai seberapa lama tidak ada lagi peningkatan konsentrasi TAG dengan bertambahnya waktu reaksi. Selain itu, DI juga dapat disetarakan dengan aktivitas interesterifikasi jika konsentrasi enzim serta kondisi reaksi diperhitungkan.
Gambar 7.2 Derajat Interesterifikasi (DI) masing-masing jenis substrat pada berbagai waktu reaksi. Keterangan: RS, RBDPO/Asam Stearat; OS, Olein
Sawit/Asam Strearat; PS, sPMF/Asam Stearat
Sementara itu, Bloomer et al. (1990) mengukur aktivitas interesterifikasi berdasarkan reaksi etil stearat dan PMF yang dinyatakan sebagai inkorporasi stearat ke dalam TAG monounsaturated dari produk, yang dirumuskan dengan formula:
Σ = (% POS + 2 [% SOS]) / 2 (% POP + % POS + % SOS) x 100
Selanjutnya formula tersebut dalam penelitian ini dinyatakan sebagai indeks CBE (IC) seperti yang dilakukan oleh Satiawihardja et al. (2001) untuk mengetahui kedekatan proporsi TAG POP, POS dan SOS hasil interesterifikasi maupun hasil fraksinasi produk interesterifikasi (CBE) terhadap proporsi TAG utama CB tersebut. CB yang digunakan pada penelitian ini mempunyai indeks CBE 56.89 (POP = 15.40%, POS = 38.57%, SOS = 26.49%).
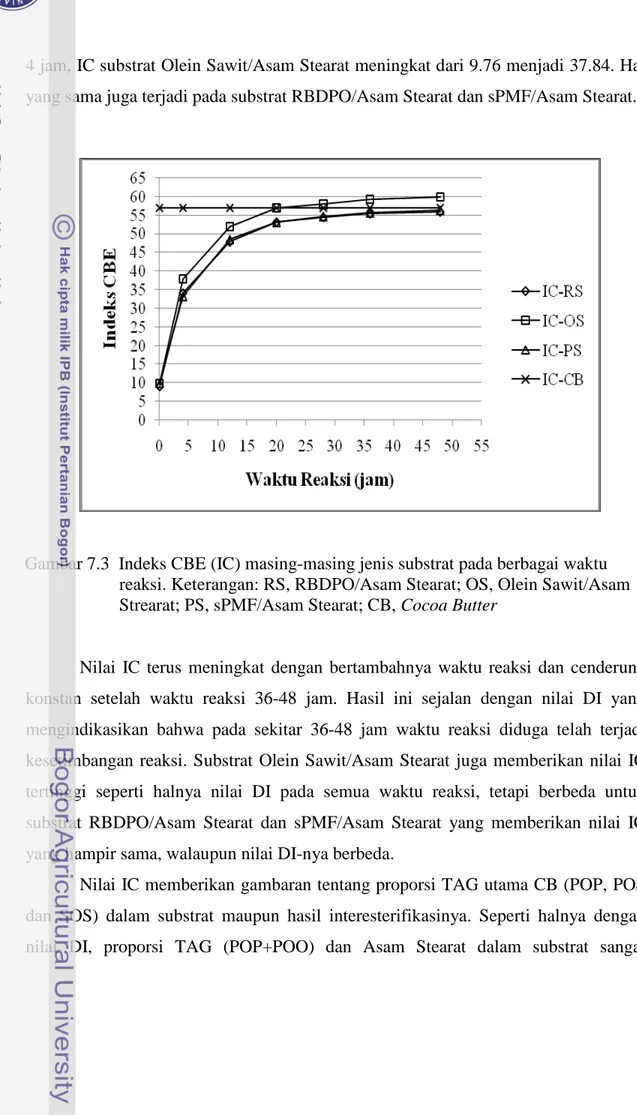
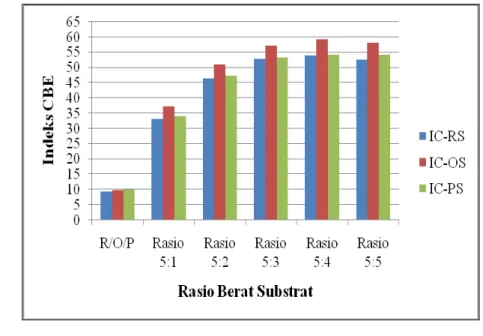
Pada Gambar 7.3 dapat dilihat indeks CBE (IC) masing-masing jenis substrat setelah interesterifikasi pada berbagai waktu reaksi. Proses asidolisis enzimatik mengakibatkan terjadinya peningkatan nilai IC. Sebagai contoh setelah waktu reaksi
4 jam, IC substrat Olein Sawit/Asam Stearat meningkat dari 9.76 menjadi 37.84. Hal yang sama juga terjadi pada substrat RBDPO/Asam Stearat dan sPMF/Asam Stearat.
Gambar 7.3 Indeks CBE (IC) masing-masing jenis substrat pada berbagai waktu reaksi. Keterangan: RS, RBDPO/Asam Stearat; OS, Olein Sawit/Asam Strearat; PS, sPMF/Asam Stearat; CB, Cocoa Butter
Nilai IC terus meningkat dengan bertambahnya waktu reaksi dan cenderung konstan setelah waktu reaksi 36-48 jam. Hasil ini sejalan dengan nilai DI yang mengindikasikan bahwa pada sekitar 36-48 jam waktu reaksi diduga telah terjadi kesetimbangan reaksi. Substrat Olein Sawit/Asam Stearat juga memberikan nilai IC tertinggi seperti halnya nilai DI pada semua waktu reaksi, tetapi berbeda untuk substrat RBDPO/Asam Stearat dan sPMF/Asam Stearat yang memberikan nilai IC yang hampir sama, walaupun nilai DI-nya berbeda.
Nilai IC memberikan gambaran tentang proporsi TAG utama CB (POP, POS dan SOS) dalam substrat maupun hasil interesterifikasinya. Seperti halnya dengan nilai DI, proporsi TAG (POP+POO) dan Asam Stearat dalam substrat sangat
menentukan konsentrasi TAG target (POS dan SOS) yang terbentuk, sebagaimana reaksi yang diilustrasikan sebelumnya. Substrat Olein Sawit/Asam Stearat memberikan komposisi TAG substrat dengan proporsi yang paling baik, sehingga memberikan nilai IC yang paling tinggi. Sedangkan substrat RBDPO/Asam Stearat dan sPMF/Asam Stearat memberikan nilai IC yang hampir sama.
Neff et al. (1999) dan Silva et al. (2009) mengelompokkan TAG menjadi empat kelompok menggunakan lambang U untuk gugus asam lemak tidak jenuh (unsaturated) dan St untuk gugus asam lemak jenuh (saturated). Kelompok tersebut adalah St3 (trisaturated), St2U (disaturated), StU2 (monosaturated) dan U3 (triunsaturated). Selanjutnya Neff et al. (1999) juga mengelompokkan TAG berdasarkan derajat ketidakjenuhannya, dengan lambang St, M, D dan T. St mengandung asam lemak jenuh (St = palmitat, oleat), M mengandung asam lemak monoene (M = oleat), D mengandung asam lemak diene (D = linoleat) dan T mengandung asam lemak triene (T = linolenat), sehingga diperoleh kombinasi StStSt (PPP, SSS), StStM (POP, POS) , StStD (PLP), StMM (POO) dan seterusnya. Pada dasarnya pengelompokan TAG tersebut merupakan penjabaran dari pengelompokan TAG sebelumnya secara lebih terperinci. Pengelompokan selengkapnya untuk masing-masing substrat pada berbagai rasio berat juga dapat dilihat pada Tabel 7.1, 7.2 dan 7.3. Pada Tabel tersebut terlihat bahwa komposisi TAG St3, St2U, StU2, U3 relatif konstan setelah waktu reaksi 36-48 jam.
Secara umum, proses asidolisis enzimatik mengakibatkan peningkatan konsentrasi kelompok TAG St3, yang terus meningkat dengan semakin lamanya waktu reaksi. Sedangkan kelompok TAG St2U meningkat konsentrasinya sampai waktu reaksi 12 jam dan cenderung menurun dengan semakin lamanya waktu reaksi. Sementara itu, kelompok TAG StU2 dan U3, konsentrasinya cenderung menurun dengan semakin lamanya waktu reaksi. Sementara itu, DAG yang terbentuk selama reaksi asidolisis juga meningkat dengan bertambahnya waktu reaksi, tetapi cenderung konstan setelah waktu reaksi 36-48 jam. Sedangkan ALB yang terdeteksi pada kromatogram HPLC cenderung konstan sejak awal reaksi, karena pada dasarnya
dalam reaksi asidolisis terjadi pertukaran ALB yang ada dalam substrat dengan yang teresterifikasi dalam TAG.
Pengaruh Waktu Reaksi Terhadap Profil SFC dan SMP
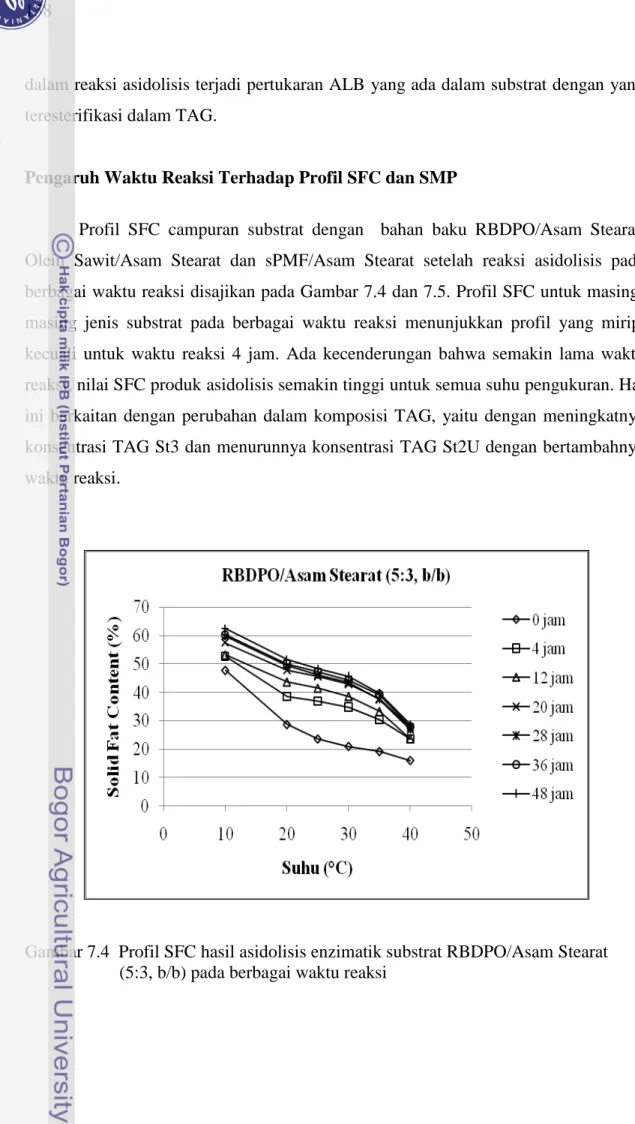
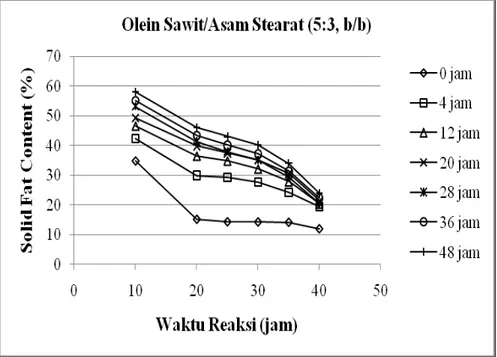
Profil SFC campuran substrat dengan bahan baku RBDPO/Asam Stearat, Olein Sawit/Asam Stearat dan sPMF/Asam Stearat setelah reaksi asidolisis pada berbagai waktu reaksi disajikan pada Gambar 7.4 dan 7.5. Profil SFC untuk masing-masing jenis substrat pada berbagai waktu reaksi menunjukkan profil yang mirip, kecuali untuk waktu reaksi 4 jam. Ada kecenderungan bahwa semakin lama waktu reaksi, nilai SFC produk asidolisis semakin tinggi untuk semua suhu pengukuran. Hal ini berkaitan dengan perubahan dalam komposisi TAG, yaitu dengan meningkatnya konsentrasi TAG St3 dan menurunnya konsentrasi TAG St2U dengan bertambahnya waktu reaksi.
Gambar 7.4 Profil SFC hasil asidolisis enzimatik substrat RBDPO/Asam Stearat (5:3, b/b) pada berbagai waktu reaksi
Gambar 7.5 Profil SFC hasil asidolisis enzimatik substrat Olein Sawit/Asam Stearat (5:3, b/b) (atas) dan sPMF/Asam Stearat (5:3, b/b) (bawah) pada berbagai waktu reaksi
Sementara itu , pada Tabel 7.5 terlihat bahwa SMP produk asidolisis untuk berbagai jenis substrat pada berbagai waktu reaksi tidak banyak berbeda. Nilai SMP hasil asidolisis setelah waktu reaksi 28 jam cenderung hampir sama. Nilai SMP paling tinggi hanya terlihat pada awal reaksi (waktu reaksi 4 jam), selanjutnya untuk waktu reaksi berikutnya nilai SMP untuk semua jenis substrat menunjukkan nilai yang hampir sama. Hal ini berkaitan dengan profil SFC maupun profil TAG-nya.
Tabel 7.5 SMP masing-masing jenis substrat (5:3, b/b) setelah asidolisis enzimatik pada berbagai waktu reaksi
Waktu Reaksi Jenis Substrat RBDPO/Asam Stearat Olein Sawit / Asam Stearat sPMF/Asam Stearat S M P (°C) 0 jam 4 jam 12 jam 20 jam 28 jam 36 jam 48 jam 59.7-59.8 48.8-49.0 46.7-47.9 47.0-48.0 46.8-47.0 46.2-46.6 46.4-47.0 59.5-59.7 47.2-47.7 45.0-45.1 44.8-45.2 44.5-45.1 44.6-45.2 44.2-45.8 60.0-60.3 47.4-48.0 45.8-46.0 45.0-45.8 45.1-45.5 45.5-45.8 45.0-45.2
Pengaruh Rasio Substrat Terhadap Komposisi TAG
Pada penelitian ini dipelajari pengaruh rasio berat substrat campuran masing-masing fraksi minyak sawit dengan FHSO terhadap komposisi TAG setelah reaksi transesterifikasi enzimatik. Komposisi TAG pada masing-masing jenis substrat sebelum dan sesudah reaksi transesterifikasi disajikan pada Tabel 7.6 (RBDPO/Asam Stearat), Tabel 7.7 (Olein Sawit/Asam Stearat), dan Tabel 7.8 (sPMF/Asam Stearat).
Penelitian ini juga menunjukkan bahwa sintesis POS dan SOS dalam reaksi asidolisis enzimatik meningkat hanya sampai rasio substrat 5:4, sedangkan di atas konsentrasi tersebut penambahan asam stearat tidak lagi meningkatkan sintesis POS dan SOS.
Tabel 7.6 Komposisi TAG RBDPO dan hasil asidolisis enzimatik substrat RBDPO/Asam Stearat pada berbagai rasio berat
Jenis TAG (%area)
RBDPO Rasio Berat Substrat
(5:1) (5:2) (5:3) (5:4) (5:5) PLL 2.03 0.84 0.64 0.54 0.51 0.57 OLO 1.97 2.57 1.78 1.47 1.35 1.29 PLO 10.05 6.75 5.09 4.62 4.31 4.33 PLP 8.40 3.75 2.78 2.42 2.44 2.51 OOO 4.85 3.51 2.37 1.85 1.78 1.82 SLO nd* 2.70 3.79 4.43 4.33 4.08 POO 23.75 12.85 9.03 7.24 7.23 7.55 SLP nd 3.02 4.20 4.90 5.09 4.98 POP 29.67 15.42 10.86 8.74 9.11 9.67 PPP 6.28 6.03 3.87 2.69 2.64 2.87 SOO 2.78 6.61 8.23 8.81 8.86 8.76 SLS nd 1.44 1.67 2.65 2.87 2.79 POS 5.17 13.93 18.29 18.93 20.08 20.00 PPS 1.20 8.43 8.71 7.22 6.77 6.91 SOS 0.64 4.09 8.18 11.22 12.36 11.81 PSS nd 4.35 7.26 7.35 6.88 6.65 SSS nd 0.90 2.23 2.54 2.28 2.15 TAG lain 3.23 2.81 1.03 2.38 1.10 1.28 DAG 5.55 14.7 11.82 10.66 9.78 8.25 ALB 0.15 18.53 27.81 35.55 42.15 47.64 St3: 7.47 19.71 22.07 19.80 18.58 18.57 StStSt 7.47 19.71 22.07 19.80 18.58 18.57 St2U: 43.86 41.65 45.97 48.86 51.95 51.76 StStM 35.47 33.43 37.33 38.89 41.55 41.48 StStD 8.40 8.22 8.64 9.97 10.40 10.28 StU2: 38.61 29.75 26.77 25.64 25.24 25.29 StMM 26.53 19.46 17.26 16.05 16.08 16.32 StMD 10.05 9.45 8.88 9.06 8.65 8.40 StDD 2.03 0.84 0.64 0.54 0.51 0.57 U3: 6.82 6.07 4.15 3.31 3.14 3.11 MMM 4.85 3.51 2.37 1.85 1.78 1.82 MMD 1.97 2.57 1.78 1.47 1.35 1.29 *nd = tidak terdeteksi
Tabel 7.7 Komposisi TAG olein dan hasil asidolisis enzimatik substrat Olein Sawit/Asam Stearat pada berbagai rasio berat
Jenis TAG (%area)
Olein Sawit
Rasio olein/Asam Stearat (b/b)
(5:1) (5:2) (5:3) (5:4) (5:5) PLL 2.61 1.42 1.14 0.99 0.95 0.97 OLO 2.43 4.32 2.93 2.42 2.15 2.14 PLO 12.43 8.70 6.05 5.46 4.93 5.05 PLP 9.57 3.68 2.84 2.38 2.19 2.39 OOO 4.99 5.09 3.40 2.53 2.37 2.51 SLO nd* 3.92 5.50 6.12 6.36 6.34 POO 28.62 14.20 9.69 8.00 7.51 8.06 SLP nd 3.14 4.34 4.83 5.31 5.50 POP 26.35 12.34 8.36 6.94 6.65 7.21 PPP nd 3.53 2.29 1.70 1.48 1.38 SOO 3.43 8.38 10.40 11.15 11.33 11.40 SLS nd 1.08 2.09 2.94 3.72 3.73 POS 4.88 13.92 16.92 17.80 18.41 18.78 PPS nd 5.69 5.80 5.14 4.43 3.91 SOS 0.67 4.51 9.11 12.13 13.88 13.67 PSS nd 3.46 5.81 6.16 5.65 4.46 SSS nd 0.89 2.09 2.71 2.38 1.81 TAG lain 4.02 1.76 1.26 0.60 0.32 0.69 DAG 6.48 15.49 11.93 11.51 11.30 10.29 ALB 0.14 16.41 26.47 33.55 40.09 46.55 St3: nd 13.56 16.00 15.71 13.93 11.56 StStSt nd 13.56 16.00 15.71 13.93 11.56 St2U: 41.47 38.66 43.65 47.01 50.16 51.28 StStM 31.90 30.77 34.38 36.86 38.94 39.66 StStD 9.57 7.89 9.27 10.15 11.22 11.62 StU2: 47.09 36.61 32.77 31.73 31.07 31.82 StMM 32.06 22.58 20.09 19.15 18.84 19.46 StMD 12.43 12.61 11.55 11.58 11.29 11.39 StDD 2.61 1.42 1.14 0.99 0.95 0.97 U3: 7.42 9.41 6.32 4.95 4.52 4.65 MMM 4.99 5.09 3.40 2.53 2.37 2.51 MMD 2.43 4.32 2.93 2.42 2.15 2.14 *nd = tidak terdeteksi
Tabel 7.8 Komposisi TAG sPMF dan hasil asidolisis substrat sPMF/Asam Stearat pada berbagai rasio berat
Jenis TAG (%area)
sPMF Rasio sPMF/Asam Stearat (b/b)
(5:1) (5:2) (5:3) (5:4) (5:5) PLL 1.85 0.85 0.58 0.53 0.59 0.54 OLO 1.66 2.73 1.77 1.45 1.30 1.26 PLO 8.49 6.76 4.91 4.32 4.26 4.13 PLP 9.04 3.96 2.72 2.45 2.46 2.56 OOO 3.46 3.67 2.40 1.83 1.65 1.49 SLO 0.00 2.71 3.79 4.23 4.18 4.16 POO 19.62 13.42 9.04 7.57 7.41 7.60 SLP 0.00 2.98 4.21 4.86 4.86 4.87 POP 39.03 15.43 10.75 9.21 9.28 9.50 PPP 1.67 5.55 3.84 2.48 2.24 2.19 SOO 2.43 7.07 8.40 8.92 9.06 9.14 SLS 0.00 1.14 1.65 2.45 2.63 2.62 POS 7.58 14.90 18.55 20.15 20.98 21.25 PPS 0.39 7.98 8.56 6.91 6.24 5.97 SOS 0.93 4.36 8.65 11.76 12.94 13.23 PSS 0.00 4.23 6.86 7.15 6.57 6.43 SSS 0.00 0.90 1.92 2.58 2.45 2.52 TAG lain 3.86 1.38 1.40 1.15 0.91 0.55 DAG 4.63 16.38 12.04 10.73 10.53 9.44 ALB 0.10 17.37 26.24 35.43 41.94 46.17 St3: 2.06 18.66 21.18 19.11 17.49 17.10 StStSt 2.06 18.66 21.18 19.11 17.49 17.10 St2U: 56.58 42.76 46.53 50.89 53.15 54.02 StStM 47.54 34.69 37.96 41.12 43.20 43.97 StStD 9.04 8.07 8.57 9.77 9.95 10.05 StU2: 32.39 30.81 26.72 25.57 25.51 25.57 StMM 22.05 20.49 17.44 16.49 16.47 16.74 StMD 8.49 9.47 8.70 8.56 8.44 8.29 StDD 1.85 0.85 0.58 0.53 0.59 0.54 U3: 5.12 6.40 4.17 3.27 2.95 2.75 MMM 3.46 3.67 2.40 1.83 1.65 1.49 MMD 1.66 2.73 1.77 1.45 1.30 1.26 *nd = tidak terdeteksi
Sementara itu, hasil interesterifikasi substrat olein sawit dengan asam stearat tanpa solven yang dilakukan oleh Chong et al. (1992), pada kondisi optimumnya memberikan formasi komposisi triasilgliserol SOS (10.8%), POS (18.6%) dan POP (9.9%). Hasil ini tidak berbeda jauh dengan beberapa produk asidolisis yang dihasilkan dalam penelitian ini meskipun dengan rasio berat substrat dan enzim yang berbeda.
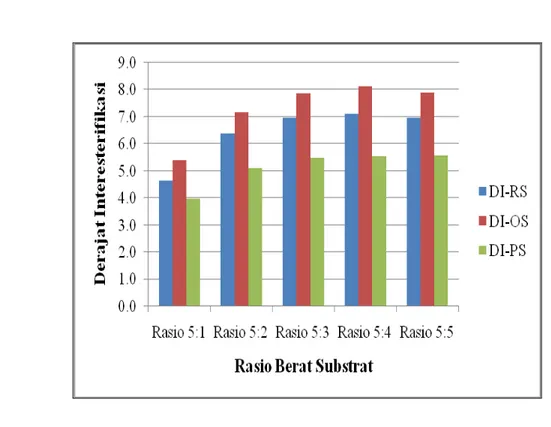
Pada Gambar 7.6 dapat dilihat Derajat Interesterifikasi (DI) masing-masing jenis substrat pada berbagai rasio berat. Pada prinsipnya, TAG yang dijadikan dasar perhitungan DI sama dengan TAG yang telah diuraikan sebelumnya untuk reaksi asidolisis. Substrat Olein Sawit/Asam Stearat mempunyai DI yang paling tinggi diikuti oleh substrat RBDPO/Asam Stearat dan sPMF/FHSO untuk masing-masing rasio berat substrat.
Pada Gambar 7.6 terlihat pula bahwa DI menunjukkan nilai yang meningkat sampai rasio berat 5:4 dan selanjutnya menurun lagi semua jenis substrat. Pada rasio berat 5:4 substrat Olein Sawit/Asam Stearat memberikan nilai DI paling tinggi, berturut-turut substrat RBDPO/Asam Stearat dan sPMF/Asam Stearat. Tinggi rendahnya nilai DI konsisten untuk semua jenis substrat. Seperti penjelasan sebelumnya, fenomena ini sangat dipengaruhi oleh proporsi TAG terhadap Asam Stearat dalam substrat yang menentukan besar kecilnya peluang TAG yang dihasilkan
Pada Gambar 7.7 dapat dilihat indeks CBE (IC) masing-masing jenis substrat setelah asidolisis enzimatik pada berbagai rasio berat. Proses asidolisis mengakibatkan terjadinya peningkatan nilai IC. Nilai IC meningkat dengan meningkatnya konsentrasi asam stearat sampai rasio berat 5:4 (fraksi minyak sawit : asam stearat) untuk semua jenis substrat. Setelah rasio tersebut, nilai IC relatif konstan atau sedikit menurun.
Nilai IC tertinggi diperoleh pada substrat Olein Sawit/Asam Stearat diikuti oleh sPMF/Asam Stearat dan RBDPO/Asam Stearat. Tinggi rendahnya nilai IC tidak selalu sejalan dengan tinggi rendahnya nilai DI. Hal ini dapat dimaklumi karena nilai DI ditentukan berdasarkan peningkatan konsentrasi TAG secara keseluruhan, sedangkan nilai IC ditentukan hanya berdasarkan TAG utama CB (POP, POS, SOS).
Walaupun demikian, nilai IC tidak dapat memberikan gambaran tentang komposisi TAG hasil asidolisis maupun profil pelelehannya, tetapi hanya kedekatannya dengan proporsi TAG utama CB (POP, POS, SOS).
Gambar 7.6 Derajat Interesterifikasi (DI) masing-masing jenis substrat pada berbagai rasio berat. Keterangan: RS, RBDPO/Asam Stearat; OS, Olein
Gambar 7.7 Indeks CBE (IC) masing-masing jenis substrat pada berbagai rasio berat. Keterangan: RS, RBDPO/Asam Stearat; OS, Olein Sawit/Asam Stearat; PS, sPMF/Asam Stearat
Pengaruh Rasio Substrat TerhadapProfil SFC dan SMP
Profil SFC campuran substrat dengan bahan baku RBDPO/Asam Stearat, Olein Sawit/Asam Stearat dan sPMF/Asam Stearat sesudah reaksi interesterifikasi (asidolisis) disajikan pada Gambar 7.8 dan 7.9. Sebagai pembanding digunakan SFC masing-masing fraksi minyak sawit sebelum dicampur asam stearat, karena asam stearat yang terlalu tinggi dalam campuran substrat akan mengganggu kristalisasi. Hal ini tentu saja akan berpengaruh terhadap hasil pengukuran SFC. Menurut Hashimoto et al. (2001), adanya triasilgliserol St3, diasilgiserol (DAG) dan asam lemak bebas (ALB) akan mengganggu kristalisasi PMF, sehingga harus dihilangkan.
Profil SFC produk asidolisis memberikan kisaran (range) pelelehan yang lebih melebar dibandingkan dengan bahan bakunya. Tinggi rendahnya nilai SFC dipengaruhi oleh proporsi antara bahan baku dengan asam stearat dalam campuran substrat awal. Semakin tinggi konsentrasi RBDPO, Olein Sawit dan sPMF dalam campuran substrat, maka nilai SFC produk asidolisis semakin rendah pada masing-masing suhu pengukuran.
Keterangan: RS51, RS52, RS53, RS54, RS55; rasio berat substrat RBDPO/Asam Stearat masing-masing 5:1, 5:2, 5:3, 5:4 dan 5:5
Gambar 7.8 Profil SFC fraksi-fraksi minyak sawit (atas) serta hasil asidolisis substrat RBDPO/Asam Stearat (bawah) pada berbagai rasio berat
Keterangan: OS51, OS52, OS53, OS54, OS55; rasio berat substrat Olein Sawit/Asam Stearat masing-masing 5:1, 5:2, 5:3, 5:4 dan 5:5
PS51, PS52, PS53, PS54, PS55; rasio berat substrat sPMF/Asam Stearat masing-masing 5:1, 5:2, 5:3, 5:4 dan 5:5
Gambar 7.9 Profil SFC hasil asidolisis substrat Olein Sawit/Asam Stearat (atas) dan sPMF/Asam Stearat (bawah) pada berbagai rasio berat
Proses interesterifikasi enzimatik (asidolisis) juga mengakibatkan terjadinya penurunan SMP pada berbagai jenis dan rasio berat substrat (RBDPO, Olein Sawit, sPMF) (Tabel 7.8). Produk hasil asidolisis berbentuk padat pada suhu ruang, dengan SMP berkisar antara 37.0 sampai 58.5°C (Tabel 7.9). SMP tersebut relatif lebih rendah dibandingkan dengan substrat awal sebelum asidolisis yang mempunyai nilai SMP berkisar antara 51.1-62.1°C.
Penurunan nilai SMP terutama disebabkan oleh perubahan komposisi TAG dalam produk asidolisis enzimatik, selain akibat berubahnya komposisi ALB dan DAG dalam campuran substrat tersebut. Selain itu juga terlihat bahwa pada substrat dengan proporsi asam stearat tinggi, penurunan nilai SMP-nya relatif lebih kecil dibandingkan dengan substrat dengan proporsi asam stearat yang relatif lebih kecil. Hal ini mengindikasikan bahwa nilai SMP pada produk asidolisis sangat ditentukan oleh proporsi ALB dalam campuran substrat. SMP menunjukkan suhu ketika lemak dalam pipa kapiler yang diletakkan dalam air menjadi cukup lunak untuk melesat (slip) ke atas dan diperkirakan mengandung lemak padat sekitar 5% (Noor Lida et al., 1998).
Tabel 7.9 SMP masing-masing jenis substrat sebelum (BA) dan sesudah (SA) reaksi asidolisis enzimatik pada berbagai rasio berat
Rasio Berat Substrat
Jenis Substrat RBDPO/Asam Stearat Olein Sawit/Asam
Stearat sPMF/Asam Stearat SMP SMP SMP BA SA BA SA BA SA Rasio 5:1 Rasio 5:2 Rasio 5:3 Rasio 5:4 Rasio 5:5 52.0-52.6 57.2-57.6 59.7-59.8 60.6-61.3 61.0-62.1 40.9-43.0 43.1-44.5 47.0-48.0 53.0-53.2 58.3-58.5 52.9-53.1 57.0-57.4 59.5-59.7 60.5-61.5 61.0-62.0 37.0-37.2 40.0-40.2 44.8-45.2 50.8-51.4 55.8-56.0 51.1-52.0 57.0-57.2 60.0-60.3 60.7-61.0 61.4-61.9 39.5-40.2 41.0-41.2 45.0-45.8 53.1-53.3 56.2-56.3
Hubungan Komposisi TAG dan SFC
Menurut Neff et al. (1999), pengelompokan TAG dengan lambang St, M, D dan T lebih mencerminkan korelasi komposisi TAG dengan titik leleh, solid fat index dan kemungkinan peningkatan stabilitas oksidatif. Oleh karena itu, pada penelitian ini dibuat model berdasarkan pendugaan melalui regresi linear berganda dengan pendekatan regresi bertahap (stepwise regression) dari hubungan matematik antara SFC dengan konsentrasi (%area) kelompok TAG. Pada Tabel 7.10 dapat dilihat model untuk memprediksi SFC produk asidolisis pada berbagai suhu pengukuran dari konsentrasi (%area) kelompok TAG secara tunggal maupun gabungan. Data yang dianalisis merupakan data gabungan dari produk asidolisis semua jenis substrat pada berbagai rasio berat.
Tabel 7.10 Model untuk memprediksi SFC produk asidolisis pada berbagai suhu pengukuran dari konsentrasi kelompok TAG secara tunggal maupun gabungan SFC10 = 1.89 StStM – 11.55 (R2= 0.97; σ = 1.29) SFC20 = 65.22 – 9.79 MMM (R2= 0.94; σ = 2.04) SFC25 = 2.12 StStM – 32.16 (R2= 0.94; σ = 2,12) SFC30 = 2.22 StStM – 38.99 (R2= 0.94; σ = 2.25) SFC35 = 2.36 StStM – 49.97 (R2= 0.93; σ = 2.55) SFC40 = 0.83 ALB – 4.97 (R2 = 0.96; σ = 1.91) SFC10 = 15.69 + 1.30 StStM – 3.05 MMM (R2= 0.99; σ = 1.29) SFC20 = 51.77 – 7.25 MMM + 0.23 ALB (R2= 0.97; σ = 1.39) SFC25 = 11.42 + 1.18 StStM – 4.88 MMM (R2= 0.96; σ = 1.62) SFC30 = 1.79 StStM + 1.53 StStD – 36.73 (R2= 0.97; σ = 1.59) SFC35 = 1.77 StStM + 2.07 StStD – 46.91 (R2= 0.98; σ = 1.26) SFC40 = 0.56 ALB + 0.87 StStM – 25.83 (R2= 0.99; σ = 1.07)
Solid Fat Content pada 10°C (SFC10), SFC25, SFC30, SFC35 dapat diprediksi secara akurat dari konsentrasi (%area) kelompok TAG yang sama, yaitu
T AG T ungga l T AG G abunga n
StStM (POP, POS, SOS) secara tunggal. Sedangkan SFC20 dapat diprediksi dari TAG MMM (OOO), dan SFC40 dari ALB. Sementara itu, gabungan dari TAG StMM dan MMM dapat digunakan untuk memprediksi SFC10 dan SFC25, sedangkan TAG StStM dan StStD (PLP, SLP) untuk memprediksi SFC30 dan SFC35. Sementara itu SFC10 dapat diprediksi dari TAG MMM dan ALB, sedangkan SFC40 dapat diprediksi dari TAG StStM dan ALB.
R2 dapat digunakan untuk membandingkan dua regresi berganda dengan variabel terikat (Y) yang sama, tetapi banyaknya variabel bebas (X) berbeda. Semakin besar nilai R2 (mendekati 1), maka semakin baik model tersebut memprediksi. Pada Tabel 7.10 terlihat bahwa TAG secara tunggal maupun gabungan mempunyai nilai R2
Sebagai ilustrasi, pada Gambar 7.10 dapat dilihat SFC hasil pengukuran produk asidolisis pada 30°C menggunakan NMR Analyzer dengan SFC pada suhu tersebut sebagai hasil prediksi SFC berdasarkan kelompok TAG secara tunggal (TAG StMM) sesuai dengan model pada Tabel 7.9. Pada Gambar 7.9 tersebut terlihat bahwa hasil prediksi dari TAG StStM (POP, POS, SOS) tersebut tidak berbeda jauh dari SFC hasil pengukuran (R
yang hampir sama, sehingga ketepatan prediksinya juga hampir sama. Oleh karena itu, prediksi SFC produk asidolisis dari kelompok TAG secara tunggal sudah cukup untuk memberikan prediksi yang akurat dan model yang lebih sederhana tentu saja lebih disukai.
2
= 0.94). Sebagai pembanding konsentrasi TAG StStM pada CB dengan SFC pada suhu pengukuran 30°C. SFC pada 30°C penting untuk menunjukkan kompatibilitas terhadap CB.
Gambar 7.10 Prediksi SFC hasil asidolisis pada 30°C dari kelompok TAG StStM Simpulan
Asidolisis enzimatik substrat menghasilkan terbentuknya campuran kompleks asilgliserol dan asam lemak bebas. Selama asidolisis enzimatik, pertukaran asil terjadi terutama antara grup palmitoil dari substrat berbasis sawit dengan stearoil dari asam stearat. Konsentrasi beberapa TAG meningkat, beberapa TAG menurun dan beberapa TAG baru terbentuk.
Reaksi asidolisis enzimatik diperkirakan mencapai kesetimbangan setelah waktu reaksi 36-48 jam untuk masing-masing fraksi minyak sawit/asam stearat pada rasio berat 5:3, konsentrasi enzim 6% (b/b minyak), suhu reaksi 68-70°C dan kecepatan orbital shaker 200 rpm. Sintesis TAG khas CB (POS,SOS) yang dinyatakan sebagai indeks CBE (IC) meningkat seiring meningkatnya proporsi asam stearat sampai rasio berat 5:4 (fraksi minyak sawit : asam stearat) dalam campuran substrat, tetapi tidak selalu seiring dengan derajat intersterifikasi (DI). Sintesis TAG khas CBE (POS, SOS) diperkirakan mencapai kesetimbangan setelah waktu reaksi 36-48 jam. Perubahan komposisi TAG dalam produk asidolisis enzimatik tercermin dalam profil SFC dan menentukan nilai SMP.
Hubungan antara komposisi TAG (kelompok TAG) dan nilai SFC pada masing-masing suhu pengukuran dapat dinyatakan dalam model regresi linear berganda. Nilai SFC pada berbagai suhu pengukuran secara akurat dapat diprediksi dari proporsi kelompok TAG MMM (OOO), StStM (POP, POS, SOS) dan StStD (PLP, SLP, SLS), secara tunggal ataupun gabungan.
Daftar Pustaka
[AOCS] American Oil Chemists’ Society. 2005. Official Methods and Recommended Practices of the American Oil Chemists’ Society. Illinois: Am Oil Chem Soc Press, Champaign.
Balle J. 2006. Business Area Chocolate and Confectionery Fats. Capital Market Day, October 3, 2006.
Bloomer S, Adlercreutz P, Mattiasson B. 1990. Triglyceride interesterification by lipases. 1. Cocoa butter equivalents from a fraction of palm oil. J Am Oil Chem Soc 67(8):519-524.
Chaibakhsh N, Rahman MBA, Abd-Azis S, Basri M, Salleh AB, Rahman RNZRA. 2009. Optimized lipase-catalyzed synthesis of adipate ester in a solvent-free system. J Ind Microbiol Biotechnol 36:1149–1155.
Chen CW, Chong CL, Ghazali HM, Lai OM. 2007. Interpretation of triacylglycerol profiles of palm oil, palm kernel oil and their binary blends. Food Chemistry 100:178-191.
Chong CN, Hoh YM, Wang CW. 1992. Fractionation procedures for obtaining cocoa butter-like fat from enzymatically interesterified palm olein. J Am Oil Chem Soc 69(2):137-140.
Ciftci ON, Fadiloglu S, Gogus F. 2009. Utilization of olive-pomace oil for enzymatic production of cocoa butter-like fat. J Am Oil Chem Soc 86:119-125.
Ciftci ON, Fadiloglu S, Kowalski B, Gogus F. 2008. Synthesis of cocoa butter triacylglycerols using a model acidolysis system. Grasas Y Aceites 59(4):316-320.
Fuji Oil Europe. 2004. Confectionery.
Februari 2007].
Ghazali HM, Hamidah S, Che Man YB. 1995. Enzymatic transesterification of palm olein with nonspecific and 1,3-specific lipases. J Am Oil Chem Soc 72(6):633-639.
Gunstone FD. 2002. Food applications of lipids. Di dalam: Akoh CC, Min DB, editor. Food Lipids Chemisty, Nutrition, and Biotechnology. Ed ke-2. New York: Marcel Dekker, Inc.
Idris NA, Dian NLHM. 2005. Interesterified palm products as alternatives to hydrogenation. Asia Pac J Clin Nutr 14(4):396-401.
[IUPAC] International Union of Pure and Applied Chemistry Norm Version. 1987. 2.150 (Ex 2.323) Solid Content Determination in Fats by NMR (Low Resolution Nuclear Magnetic Resonance).
Lipp M, Anklam E. 1998. Review of cocoa butter and alternatives fats for use in chocolate – Part A. Compositional data. Food Chemistry 62(1):73-97.
Lipp M, Simoneau C, Ulberth F, Anklam E, Crews C, Brereton P, Greyt W de, W Schwack W, Wiedmaiers C. 2001. Composition of genuine cocoa butter and cocoa butter equivalents. Journal of Food Composition and Analysis 14:399-408.
Malcata FX, Reyes HR, Garcia HS, Hill CG, Amudson CH. 1992. Kinetics and mechanisms of reactions catalysed by immobilized lipases. Enzyme Microb Technol 14:426-446.
Mojovic L, Marinkovic SS, Kukic G, and Novakovic GV. 1993. Rhizopus arrhizus lipase-catalyzed interesterification of the midfraction of palm oil to a cocoa butter equivalent Fat. Enzyme Microb Technol 15:438-443.
Neff WE, List GR, Byrdwell WC. 1999. Effect of triacylglycerol composition on functionality of margarine basestocks. Lebensm-Wiss u-Technol 32:416-424. Noor Lida HMD, Rahim Md. Ali A. 1998. Physicochemical characteristics of
palm-based oil blends for the production of reduced fat spreads. J Am Oil Chem Soc 75:1625-1631.
Pinyaphong P, Phutrakul S. 2009. Synthesis of cocoa butter equivalent from palm oil by Carica papaya lipase-catalyzed interesterification. Chiang Mai J Sci 36(3):359-368.
Ronne TH, Pedersen LS, Xu X. 2005. Triglyceride selectivity of immobilized Thermomyces lanuginosa lipase in interesterification. J Am Oil Chem Soc 82(10):737-743.
Satiawihardja B, Hariyadi P, Budiyanto S. 2001. Studi Pembuatan Mentega Coklat Tiruan dari Minyak Sawit dengan Proses Interesterifikasi Enzimatik. Laporan Penelitian Hibah Bersaing VII / 1-3 Perguruan Tinggi Tahun Anggaran 1998/2001. Bogor: Fateta, IPB.
Silva RC, Cotting LN, Poltronieri TP, Balcao VM, de Almeida DB, Goncalves LAG, Grimaldi R, Gioielli LA. 2009. The effects of enzymatic interesterification on the physical-chemical properties of blends of lard and soybean oil. LWT – Food Science and Technology 42: 1275-1282.
Osborn HT, Akoh CC. 2002a. Structured lipids – novel fats with medical, nutraceutical, and food applications. Comprehensive Reviews in Food Science and Food Safety 3:110-120.
Torbica A, Jovanovic O, Pajin B. 2006. The advantages of solid fat content determination in cocoa butter and cocoa butter equivalents by the Karlshamns method. Eu. Food Res Technol 222:385-391.
Wainwright B. 1999. Specialty fats and oils. Di dalam: Widlak N, editor. Physical Properties of Fats, Oils and Emulsifiers. Illinois: Am Oil Chem Soc Press, Champaign.
Wang HX, Wou H, Ho CT, Weng XC. 2006. Cocoa butter equivalent from enzymatic interesterification tea seed oil and fatty acid methyl esters. Food Chemistry 97:661-665.
Willis WM, Marangoni AG. 2002. Enzymatic Interesterification. Di dalam: Akoh CC, Min DB, editor. Food Lipids Chemistry, Nutrition and Biotechnology. Ed ke-2. New York: Marcel Dekker, Inc.
Zaidul ISM, Nik Norulaini NA, Mohd Omar AK, Smith Jr RL. 2007. Blending of supercritical carbon dioxide (SC-CO2) extracted palm kernel oil fractions and
palm oil to obtain cocoa butter replacers. Journal of Food Engineering 78: 1397-1409.
Zhang H, Xu X, Nilsson J, Mu H, Adler-Nissen J, Hoy CE. 2001. Production of margarine fats by enzymatic interesterification with silica-granulated Thermomyces lanuginosa lipase in a large-scale study. J Am Oil Chem Soc 78(1):57-64.