BAB II
TINJAUAN PUSTAKA
2.1 Sistem Pencernaan
Sistem pencernaan berhubungan dengan penerimaan makanan dan mempersiapkannya untuk diasimilasi oleh tubuh. Saluran pencernaan terdiri atas mulut, farinx, tekak, usofagus, kerongkongan, ventrikulus, lambung, usus halus, dan usus besar (Pearce, 1999).
Sistem pencernaan mempunyai fungsi utama yaitu untuk menyuplai nutrisi bagi sel-sel tubuh (Muttaqin dan Kumala, 2013). Sistem pencernaan (sistem alimenter) berfungsi untuk memindahkan zat gizi atau nutrien (setelah memodifikasinya), air, dan elektrolit dari makanan yang kita makan ke dalam lingkungan internal tubuh (Sherwood, 2001).
2.2 Lambung
Lambung adalah ruang berbentuk kantung mirip huruf J yang terletak di antara esofagus dan usus halus. Fungsi terpenting lambung adalah menyimpan makanan yang masuk sampai disalurkan ke usus halus dengan kecepatan yang sesuai untuk pencernaan dan penyerapan yang optimal. Fungsi kedua lambung adalah untuk mensekresikan asam klorida (HCl) dan enzim-enzim yang memulai pencernaan protein. Akhirnya, melalui gerakan mencampur lambung, makanan yang masuk dihaluskan dan dicampur dengan sekresi lambung untuk menghasilkan campuran kental yang dikenal sebagai kimus (Sherwood, 2001). Lambung adalah bagian dari saluran pencernaan yang dapat mekar paling banyak (Pearce, 1999). Lambung merupakan pelebaran saluran cerna antara
kerongkongan dan usus dua belas jari (Laksman, 2005). Meskipun bagian dari tabung makanan, lambung bukan sebuah tabung, melainkan lebih kepada sebuah kantong yang merupakan pelebaran dari esofagus dan usus halus (Scanlon dan Tina, 2007).
2.2.1 Anatomi lambung
Morfologi organ tubuh tikus analog dengan morfologi organ manusia. Oleh karena itu, sering digunakan sebagai hewan pengujian obat sebelum diberikan pada manusia. Salah satu organ tikus yang analogis dengan organ manusia adalah lambung (Malole, dkk., 1989).
Lambung berlokasi di bagian atas rongga perut, disebelah kiri hati dan diatas limpa (Scanlon dan Tina, 2007). Lambung dibagi menjadi tiga bagian berdasarkan perbedaan anatomis, histologis, dan fungsional. Fundus adalah bagian lambung yang terletak di atas lubang esofagus. Bagian tengah atau utama lambung adalah korpus (badan). Lapisan otot polos di fundus dan korpus relatif tipis, tetapi bagian bawah lambung, antrum, memiliki otot yang jauh lebih tebal. Diantara regio-regio tersebut juga terdapat perbedaan kelenjar di mukosa. Bagian akhir lambung adalah sfingter pilorus, yang berfungsi sebagai sawar antara lambung dan bagian atas usus halus, duodenum (Sherwood, 2001). Lambung mempunyai dua buah lengkungan atau kurvatura yaitu kurvatura minor yang membentuk batas kanan lambung dan kurvatura mayor yang membentuk batas kiri lengkungan.
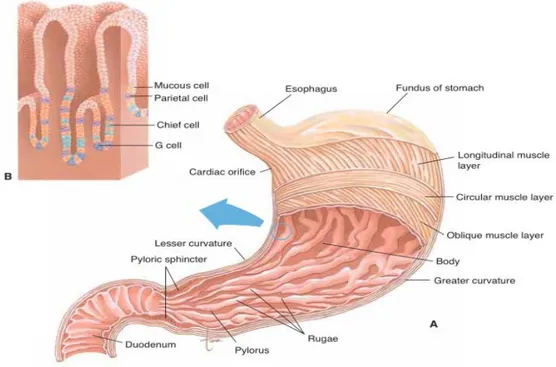
Berikut merupakan gambaran bentuk anatomi dari lambung yang dapat dilihat pada Gambar 2.1
Gambar 2.1 Anatomi lambung.
Keterangan: (A) Tampilan depan lambung. Dinding lambung dipotong untuk menunjukkan lapisan otot dan kerutan mukosa. (B) Kelenjar-kelenjar lambung, menunjukkan sel-sel yang menghasilkannya (Scanlon dan Tina, 2007).
2.2.2 Fisiologi lambung
Lambung melakukan beberapa fungsi. Fungsi terpenting adalah menyimpan makanan yang masuk sampai disalurkan ke usus halus dengan kecepatan yang sesuai untuk pencernaan dan penyerapan yang optimal. Makanan yang dikonsumsi hanya beberapa menit memerlukan waktu beberapa jam untuk dicerna dan diserap. Karena usus halus adalah tempat utama pencernaan dan penyerapan, lambung perlu menyimpan makanan dan menyalurkannya sedikit demi sedikit ke duodenum dengan kecepatan yang tidak melebihi kapasitas usus (Sherwood, 2001).
Fungsi kedua lambung adalah untuk mensekresikan asam klorida (HCl) dan enzim-enzim yang memulai pencernaan protein (Sherwood, 2001). Fungsi pencernaan dan sekresi lambung berkaitan dengan pencernaan protein, sintesis dan sekresi enzim-enzim pencernaan. Selain mengandung sel-sel yang mensekresi mukus, mukosa lambung juga mengandung dua tipe kelenjar tubular yang penting yaitu kelenjar oksintik (gastrik) dan kelenjar pilorik. Kelenjar oksintik terletak pada bagian corpus dan fundus lambung, meliputi 80% bagian proksimal lambung. Kelenjar pilorik terletak pada bagian antral lambung. Kelenjar oksintik bertanggung jawab membentuk asam dengan mensekresikan mukus, asam hidroklorida (HCl), faktor intrinsik dan pepsinogen. Kelenjar pilorik berfungsi mensekresikan mukus untuk melindungi mukosa pilorus, juga beberapa pepsinogen, renin, lipase lambung dan hormon gastrin (Guyton dan Hall, 2007). Akhirnya, melalui gerakan mencampur lambung, makanan yang masuk dihaluskan dan dicampur dengan sekresi lambung untuk menghasilkan campuran kental yang disebut kimus (Sherwood, 2001).
Lambung menerima makanan dari usofagus melalui orifisium kardiak dan bekerja sebagai penimbun sementara, sedangkan kontraksi otot mencampur makanan dengan getah lambung. Gelombang peristaltik dimulai tinggi di fundus, berjalan berulang-ulang, setiap menit tiga kali dan merayap perlahan-lahan ke pilorus. Perjalanan makanan masuk lambung praktis berjalan lancar pada waktu orang sedang makan, tetapi perjalanan makanan keluar lambung tidak dimulai segera. Mula-mula makanan harus dibuat cair, kemudian jumlah kecil, kira-kira 70 cc, berjalan melalui lubang pilorik masuk duodenum. Isi lambung sangat asam dan ketika jumlah kecil itu masuk duodenum, sfingter pilorik menutup sampai isi
asam itu sebagian telah dinetralkan oleh kerja getah duodenum, pankreas dan empedu yang alkalis. Bila otot sfingter mengendor lagi maka duodenum menerima kiriman lain dari isi lambung (Pearce, 1999).
Kelenjar dalam lapisan mukosa lambung mengeluarkan sekret yaitu cairan pencerna penting, getah lambung. Getah ini adalah cairan asam bening tak berwarna. Mengandung 0,4 persen asam hidroklorida (HCl), yang mengasamkan semua makanan dan bekerja sebagai zat antiseptik dan disinfektan, membuat banyak organisme yang ikut masuk bersama makanan, tidak berbahaya, dan menyediakan lingkungan untuk pencernaan makanan protein (Pearce, 1999). Setiap hari lambung mengeluarkan 2 liter getah lambung. Beberapa enzim perncerna terdapat dalam getah lambung (Sherwood, 2001).
Perangsangan sekresi getah lambung sebagian diterima dari rangsangan saraf dan sebagian dari rangsangan kimiawi. Sekresi mulai pada awal orang makan, bila melihat dan mencium makanan, akan merangsang sekresi. Hal ini sering disebut “tahap fisik”. Rasa makanan kemudian merangsang sekrsi karena kerja saraf. Makanan di dalam lambung menimbulkan rangsangan kimiawi karena menyebabkan dinding lambung melepaskan hormon (perangsang kimia) yang disebut gastrin. Sekresi getah lambung dapat dihalangi oleh sistem saraf simpatis, seperti yang terjadi pada gangguan emosi, seperti marah atau takut. Kita sering bicara tentang orang yang mual karena rasa takut, dalam hal ini sebenarnya lambungnya yang menolak untuk diisi (Pearce, 1999).
Sel-sel parietal secara aktif mengeluarkan HCL ke dalam lumen kantung lambung, yang kemudian mengalirkannya ke dalam lumen lambung. pH isi lumen turun sampai serendah 2 akibat sekresi HCl. Ion hidrogen (H+) dan ion klorida
(Cl-) secara aktif ditransportasikan oleh pompa yang berbeda di membran plasma sel parietal. Walaupun sebenarnya HCl tidak mencerna apapun dan tidak mutlak diperlukan bagi fungsi saluran pencernaan, zat ini melakukan beberapa fungsi yang membantu pencernaan. Asam hidroklorida (1) mengaktifkan prekursor enzim pepsinogen menjadi enzim aktif pepsin, dan membentuk lingkungan asam yang optimal untuk aktivitas pepsin; (2) membantu penguraian serat otot dan jaringan ikat, sehingga partikel makanan berukuran besar dapat dipecah-pecah menjadi partikel-partikel kecil; dan (3) bersama dengan lisozim air liur membunuh bakteri yang masuk melalui lambung (Sherwood, 2001).
Pepsin dihasilkan dari pepsinogen dalam lingkungan asam hidroklorida dan bekerja atas protein, mengubahnya menjadi bahan yang lebih mudah larut, yang disebut pepton. Rennin ialah ragi yang membekukan susu membentuk kasein dari kaseinogen yang dapat larut. Sebuah enzim yang memecahkan lemak disebut lipase lambung, terdapat dalam jumlah kecil di dalam lambung, dan pencernaan lemak dimulai di sini (Pearce, 1999). Mukosa lambung juga mensekresi bikarbonat, bikarbonat dan mukus membentuk lapisan tak teraduk yang mempunyai pH sekitar 7,0. Lapisan tak teraduk ini ditambah membran permukaan sel mukosa dan tautan kedap di antaranya membentuk sawar bikarbonat mukosa yang melindungi sel mukosa dari kerusakan oleh asam lambung (Ganong, 2008). Dalam keadaan normal cairan lambung juga mengandung enzim yang dikenal sebagai faktor pembuat darah dari Castle. Faktor ini perlu untuk absorpsi vitamin B12 sianokobalamin (unsus hematinik).
2.2.3 Histologi lambung
Lambung terdiri atas 4 lapisan, yaitu lapisan peritoneal luar yang merupakan lapisan serosa, lapisan submukosa, lapisan mukosa, dan membran mukosa (Pearce, 1999).
Dinding saluran pencernaan memiliki struktur umum yang sama di sebagian besar panjangnya dari esofagus sampai anus, dengan variasi lokal yang khas untuk tiap-tiap daerah. Potongan melintang saluran pencernaan memperlihatkan empat lapisan jaringan utama. Dari yang paling dalam ke paling luar lapisan-lapisan itu adalah mukosa, submukosa, muskularis eksterna, dan serosa (Sherwood, 2001).
2.2.3.1 Serosa
Lapisan peritoneal luar yang merupakan lapisan serosa (Pearce, 1999). Pembungkus jaringan ikat di sebelah luar saluran pencernaan adalah serosa, yang mengeluarkan cairan serosa encer yang melumasi dan mencegah gesekan antara organ-organ pencernaan dan visera di sekitarnya. Di sepanjang saluran pencernaan, serosa berhubungan dengan mesentrium, yang menggantung organ-organ pencernaan ke dinding dalam rongga abdomen seperti sebuah ayunan. Perlekatan itu menghasilkan friksi relatif, yang menunjang organ-organ pencernaan dalam posisinya, sementara masih memungkinkan kebebasan berlangsungnya gerakan mendorong dan mencampur (Sherwood, 2001). 2.2.3.2 Lapisan berotot atau muskularis eksterna
Lapisan berotot yang terdiri atas 3 lapis, (a) serabut longitudinal, yang tidak dalam dan bersambung dengan otot usofagus, (b) serabut sirkuler yang paling tebal dan terletak di pilorus serta membentuk otot sfinkter, dan berada di
bawah lapisan pertama, dan (c) serabut oblik yang terutama dijumpai pada fundus lambung dan berjalan dari orofisium kardiak, kemudian membelok ke bawah melalui kurvatura minor (lengkung kecil) (Pearce, 1999).
Serat-serat otot polos bagian dalam (berdampingan dengan submukosa) berjalan sirkuler mengelilingi saluran. Kontraksi serat-serat sirkuler ini menyebabkan kontriksi atau penurunan garis tengah lumen di titik kontraksi. Kontraksi serat-serat di lapisan luar, yang berjalan secara longitudinal di sepanjang saluran menyebabkan saluran memendek. Bersama-sama, aktivitas kontraktil lapisan otot polos menghasilkan gerakan propulsif dan mencampur. Suatu jaringan saraf lain, pleksus meintrikus, terdapat di antara kedua lapisan otot, dan bersama dengan pleksus submukosa, membantu aktivitas usus lokal (Sherwood, 2001).
2.2.3.3 Lapisan submukosa
Lapisan submukosa terdapat dibawah lapisan mukosa. Tunika submukosa meluas ke dalam rugae atau lipatan memanjang lambung, dan terdiri atas jaringan ikat jarang, dengan serat-serat kolagen dan elastin. Selain fibroblast, terdapat pula kumpulan limfosit dan sel plasma, terutama dekat kardia dan pilorus, serta sel mast dan biasanya terdapat beberapa lemak. Tunika submukosa mengandung pembuluh darah, pembuluh limfa dan saraf perifer dari pleksus submukosa (Leeson, dkk., 1989).
Lapisan submukosa yang terdiri atas jaringan areolar berisi pembuluh darah dan saluran limfe (Pearce, 1999). Submukosa (di bawah mukosa) adalah lapisan tebal jaringan ikat yang menyebabkan saluran pencernaan memiliki elastisitas dan distensibilitas. Lapisan ini memiliki pembuluh darah
dan limfe yang lebih besar, keduanya bercabang-cabang ke arah dalam ke lapisan mukosa dan ke arah luar ke lapisan otot di sekitarnya. Yang juga terdapat di dalam submukosa adalah jaringan saraf yang dikenal sebagai pleksus submukosa, yang membantu mengontrol aktivitas lokal masing-masing bagian usus (Sherwood, 2001).
2.2.3.4 Lapisan mukosa
Lapisan mukosa yang terletak di sebelah dalam, tebal, dan terdiri atas banyak kerutan atau rugae, yang hilang bila organ itu mengembang karena berisi makanan (Pearce, 1999). Mukosa melapisi permukaan luminal saluran pencernaan (Sherwood, 2001).
Membran mukosa
Membran mukosa dilapisi epitelium silindris dan berisi banyak saluran limfe. Semua sel-sel itu mengeluarkan sekret mukus. Permukaan mukosa ini dilintasi saluran-saluran kecil dari kelenjar lambung. Semua ini berjalan dari kelenjar lambung tubuler yang bercabang-cabang dan lubang-lubang salurannya dilapisi oleh epitelium silinder. Epitelium ini bersambung dengan permukaan mukosa dari lambung. Epitelium dari bagian kelenjar yang mengeluarkan sekret berubah-ubah dan berbeda-beda di beberapa daerah lambung (Pearce, 1999). Komponen utama mukosa adalah membran mukosa, suatu lapisan epitel bagian dalam berfungsi sebagai permukaan protektif serta mengalami modifikasi di daerah-daerah tertentu untuk sekresi dan absorpsi. Membran mukosa mengandung sel eksokrin untuk sekresi getah pencernaan, sel endokrin untuk sekresi hormon saluran pencernaan, dan sel epitel yang khusus untuk penyerapan nutrien (Sherwood, 2001). Membran mukosa lambung berbentuk irreguler seperti tiang,
membentuk lipatan longitudinal yang disebut rugae dan jumlahnya tergantung pada tinggi rendahnya rentangan organnya. Membran mukosa terdiri dari tiga komponen yaitu epitelium, lamina propria, dan muskularis mukosa. Epitel permukaan mukosa ditandai oleh adanya lubang sumuran yang terletak rapat satu dengan yang lain dan dilapisi epitel sejenis. Bentuk dan kedalaman dari sumuran ini serta sifat kelenjarnya berbeda pada tiap bagian lambung (Leeson, dkk., 1989). b. Lamina propria
Adalah lapisan tengah jaringan ikat yang tipis tempat epitel melekat. Pembulu-pembuluh darah halus, pembuluh limfe, dan serat saraf berjalan melewati lamina propria, dan lapisan ini mengandung gut associated lymphoid tissue (GALT) yang penting dalam pertahanan melawan bakteri usus (Sherwood, 2001).
Mukosa muskularis
Mukosa muskularis adalah lapisan otot polos di sebelah luar yang terletak di sebelah lapisan submukosa (Sherwood, 2001).
Kelenjar kardia
Terletak paling dekat dengan lubang yang ada di sebelah usofagus. Kelenjar di sini berbentuk tubuler, baik sederhana maupun bercabang dan mengeluarkan sekret mukus alkali (Pearce, 1999). Kelenjar kardia hanya terdapat pada daerah yang terletak 2 sampai 4 cm dari muara kardia. Sel-sel yang menyusun kelenjar terutama terdiri dari sel-sel penghasil mukus dan mirip dengan sel-sel kardia esofagus tetapi juga terdapat sedikit sel-sel parietal penghasil asam dan beberapa sel enteroendokrin (Leeson, dkk., 1989).
Terdahulu bekerja, kelenjarnya tubuler dan berisi berbagai jenis sel. Beberapa sel, yaitu sel asam atau oxintik, menghasilkan asam yang terdapat dalam getah lambung. Dan yang lain lagi menghasilkan musin (Pearce, 1999).
Kelenjar pilorik
Kelenjar dalam saluran pilorik juga berbentuk tubuler. Terutama menghasilkan mukus alkali (Pearce, 1999).
Permukaan mukosa pada umumnya tidak datar dan halus, tetapi dipenuhi oleh lipatan-lipatan dengan banyak “bukit” dan “lembah”, sehingga luas permukaan yang tersedia untuk absorpsi sangat meningkat. Pola pelipatan permukaan dapat dimodifikasi oleh kontraksi mukosa muskularis (Sherwood, 2001).
2.2.4 Mekanisme pertahanan mukosa lambung
Lambung dapat menampung isinya yang mengandung asam kuat dan banyak enzim proteolitik tanpa merusak dirinya sendiri dengan membentuk lapisan pelindung. Selain itu, sawar lain yang melindungi mukosa dari kerusakan oleh asam adalah lapisan mukosa itu sendiri. Pertama, membran luminal sel mukosa lambung hampir tidak dapat ditembus oleh H+, sehingga asam tidak dapat menembus ke dalam sel dan menyebabkan kerusakan sel. Selain itu, tepi-tepi lateral sel-sel tersebut saling bersatu di dekat batas luminal mereka melalui hubungan taut erat (tight junction), sehingga asam tidak dapat berdifusi di antara sel-sel dari lumen ke dalam submukosa di bawahnya. Sifat mukosa lambung yang memungkinkan lambung menampung asam tanpa ia sendiri mengalami kerusakan tersebut membentuk sawar mukosa lambung (gastric mucosal barrier). Mekanisme protektif ini diperkuat oleh kenyataan bahwa seluruh lapisan lambung
diganti setiap tiga hari. Karena pertukaran mukosa yang sangat cepat, sel-sel biasanya telah diganti sebelum mereka aus karena terpajan ke lingkungan sangat asam yang tidak bersahabat tersebut cukup lama untuk mengalami kerusakan (Sherwood, 2001).
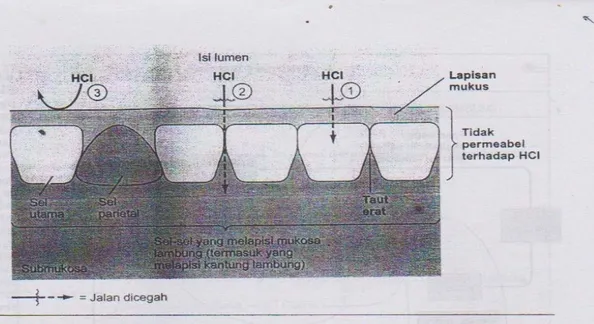
Mekanisme lambung dan duodenum yang normal dalam menahan efek korosif dari pepsin-asam (yaitu, resistensi mukosa terhadap jejas atau pertahanan mukosa) belum sepenuhnya terjelaskan. Meskipun demikian, berbagai faktor yang berperan dan yang dianggap berfungsi dalam pertahanan mukosa, telah dikenali (Isselbacher, 2000). Lapisan mukosa lambung juga melindungi mukosa dari kerusakan oleh asam, pada Gambar 2.2 di bawah ini.
Gambar 2.2 Sawar mukosa lambung.
Keterangan: Sawar mukosa lambung mencakup faktor-faktor berikut yang memungkinkan lambung menahan asam tanpa mencederai dirinya sendiri: sel-sel mukosa lambung yang disatukan oleh taut-erat yang mencegah HCL menembus celah di antara sel (1), dan membran luminal sel-sel ini impermeabel terhadap H+ sehingga HCL tidak dapat menembus ke dalam sel (2), lapisan mukus pada mukosa lambung juga membentuk proteksi (3) (Sherwood, 2001).
Mekanisme pertahanan mukosa lambung diantaranya faktor pelindung lokal dan neurohormonal, yang memungkinkan mukosa tahan terhadap berbagai faktor perusak. Mekanisme pertahanan mukosa lambung akan dijelaskan dibawah ini (Fornai, dkk., 2011).
2.2.4.1 Mukus lambung
Permukaan mukosa lambung dilindungi oleh selapis mukus, yang berasal dari sel epitel permukaan dan sel leher mukosa. Mukus ini berfungsi sebagai sawar protektif mengatasi beberapa bentuk cedera terhadap mukosa lambung. Karena sifat lubrikasinya, mukus melindungi mukosa lambung dari cedera mekanis. Mukus membantu melindungi dinding lambung dari pencernaan-diri (self-digestion) karena pepsin dihambat apabila berkontak dengan lapisan mukus yang membungkus dinding lambung. (Namun, mukus tidak mempengaruhi aktivitas pepsin di lumen, tempat berlangsungnya pencernaan protein makanan). Karena bersifat alkalis, mukus membantu melindungi lambung dari cedera asam dengan menetralisir HCl yang terdapat di dekat mukosa lambung (Sherwood, 2001).
Bagaimana lambung dapat menampung isinya yang mengandung asam kuat dan banyak enzim proteolitik tanpa merusak dirinya sendiri, bahwa mukus membentuk lapisan pelindung. Selain itu, sawar lain yang melindungi mukosa dari kerusakan oleh asam adalah lapisan mukosa itu sendiri. Pertama, membran luminal sel mukosa lambung hampir tidak dapat ditembus oleh H+, sehingga asam tidak dapat menembus ke dalam sel dan menyebabkan kerusakan sel. Selain itu, tepi-tepi lateral sel-sel tersebut saling bersatu di dekat batas luminal mereka melalui hubungan erat (tight junction), sehingga asam tidak dapat berdifusi di
antara sel-sel dari lumen ke dalam submukosa di bawahnya. Sifat mukosa lambung yang memungkinkan lambung menampung asam tanpa ia mengalami kerusakan tersebut membentuk sawar mukosa lambung (gastric mucosal barrier). Mekanisme protektif ini diperkuat oleh kenyataan bahwa seluruh lapisan lambung diganti setiap 3 hari. Karena pertukaran mukosa yang sangat cepat, sel-sel biasanya telah diganti sebelum mereka aus karena terpajan ke lingkungan sangat asam yang tidak bersahabat tersebut cukup lama untuk mengalami kerusakan (Sherwood, 2001).
Mukus lambung penting dalam pertahanan mukosa dan dalam mencegah ulserasi peptik. Mukus lambung disekresi oleh sel mukosa pada epitel mukosa lambung dan kelenjar lambung. Sekresi mukus dirangsang oleh iritasi mekanis atau kimiawi dan oleh rangsang kolinergik. Mukus lambung terdapat dalam dua fase: dalam cairan lambung pada fase terlarut dan sebagai lapisan jeli mukus yang tidak larut, kira-kira tebalnya 0,2 mm, yang melapisi permukaan mukosa lambung. Normalnya gel mukus disekresi secara terus menerus oleh sel epitel mukosa lambung dan secara kontinu dilarutkan oleh pepsin yang disekresi ke dalam lumen lambung. Mukus lambung merupakan suatu glikoprotein polimer yang besar (2 x 106 berat molekul), mengandung empat subunit yang dihubungkan oleh jembatan disulfida. Depolimerisasi subunit glikoprotein pada mukus, melalui pencernaan peptik atau pemutusan ikatan disulfida, menyebabkan glikoprotein tidak mampu membentuk atau mempertahankan jeli. Jika intak, jeli mukus ini bertindak sebagai lapisan air yang tidak permeabel terhadap penetrasi oleh makromolekul seperti pepsin (34.000 berat molekul). Molekul pepsin yang disekresi ke dalam lumen lambung tidak dapat masuk kembali dengan adanya jeli mukus yang intak,
sehingga berpotensi melindungi sel mukosa dari jejas proteolitik. Ketebalan jeli meningkat dengan adanya prostaglandin E dan berkurang dengan adanya obat antiinflamasi nonsteroid (NSAID), termasuk aspirin. Glikoprotein mukus lambung juga mengandung determinan antigenik yang digunakan untuk mengklasifikasikan substansi golongan darah AB(H). Kurang lebih tiga perempat populasi mensekresikan cairan lambung yang mengandung substansi AB(H) ini, dan individu demikian disebut sekretor (Isselbacher, 2000).
2.2.4.2 Ion bikarbonat
Ion bikarbonat, yang disekresikan oleh sel nonparietal epitel lambung, memasuki jeli mukosa, berperan pada pembangunan lingkungan-mikro di dalam jeli dengan gradien ion hidrogen yang besar diantara zona jeli yang menghadap ke lumen (pH 1 sampai 2) dan zona yang berhubungan dengan sel mukosa lambung (pH 6 sampai 7). Sebagai lapisan air yang tidak teraduk, jeli mukus memperlambat ion hidrogen untuk berdifusi kembali ke permukaan mukosa lambung, hal ini memungkinkan pendaparan (buffering) oleh bikarbonat di dalam jeli. Sekresi bikarbonat lambung dirangsang oleh kalsium, seri tertentu dari prostaglandin E dan F , agen kolinergik dan dibutiril siklik guanosin monofosfat. Sekresi bikarbonat lambung dihambat oleh OAINS, termasuk aspirin, dan oleh asetazolamid, agen alfa-adrenergik dan etanol (Isselbacher, 2000).
Normalnya, permukaan lumen dan sambungan intraseluler yang ketat dari sel epitel lambung memberikan barrer mukosa lambung yang hampir total impermeabel terhadap difusi balik ion-ion hidrogen dari lumen; barier ini tampaknya menjadi komponen penting dari resistensi mukosa terhadap jejas asam-peptik. Barier ini dapat terputus oleh asam empedu, salisilat, etanol, dan
asam-asam lemah organik, sehingga memungikinkan terjadinya difusi balik ion-ion hidrogen dari lumen ke dalam jaringan lambung. Hal ini dapat menyebabkan jejas sel, pelepasan histamin dari sel mast, rangsangan sekresi asam yang lebih lanjut, kerusakan pembuluh-pembuluh darah kecil, perdarahan mukosa, dan erosi atau ulserasi. Interupsi barier mukosa lambung ini tampaknya berperan pada gastritis erosif hemoragika yang berhubungan dengan konsumsi salisilat atau etanol dan dengan bentuk jejas mukosa lambung lainnya. Karena tingginya kecepatan aktivitas metabolik dan perlunya oksigen dalam jumlah besar, upaya mempertahankan aliran darah normal ke mukosa lambung merupakan suatu komponen penting pada resistensi mukosa terhadap jejas. Penurunan aliran darah mukosa, yang disertai oleh difusi balik ion hidrogen dari lumen, penting dalam menimbulkan kerusakan mukosa lambung (Isselbacher, 2000).
2.2.4.3 Prostaglandin
Prostaglandin merupakan asam lemak rantai 20 karbon yang dihasilkan oleh asam arakhidonat melalui enzim cyclooxygenase (Sunil, dkk., 2012). Mukosa lambung merupakan sumber produksi prostaglandin, seperti Prostaglandin E2 (PGE2) dan Prostaglandin I2 (PGI2) yang dianggap sebagai faktor penting untuk pemeliharaan integritas mukosa dan perlindungan terhadap faktor melukai. Prostaglandin dapat mengurangi produksi asam, merangsang produksi mukus, bikarbonat, dan fosfolipid, meningkatkan aliran darah mukosa, dan mempercepat restitusi epitel dan penyembuhan mukosa. Prostaglandin E2 diketahui dapat menekan pelepasan dari histamin dan TNF-α dari mukosa lambung, dimana pelepasan dari TNF-α dapat mengakibatkan kerusakakn jaringan pada ulkus lambung (Fornai, dkk., 2011).
Prostaglandin terdapat dalam jumlah besar di dalam mukosa lambung. Bermacam-macam prostaglandin, terutama dari seri E, terlihat menghambat jejas mukosa lambung yang disebabkan oleh berbagai macam agen. Prostaglandin endogen merupakan elemen penting membangun pertahanan mukosa. Prostaglandin ini merangsang sekresi mukus lambung dan bikarbonat mukosa lambung dan duodenum, yang mendapar sebagian besar asam lambung yang telah disekresi. Prostaglandin berperan dalam mempertahankan aliran darah mukosa lambung dan dalam integritas barier mukosa lambung. Prostaglandin mempermudah pembaruan sel epitel dalam responnya terhadap jejas mukosa (Isselbacher, 2000).
2.2.4.4 Sel-sel epitel
Lapisan sel epitel permukaan merupakan pertahanan mukosa berikutnya. Sel epitel ini bertanggung jawab untuk memproduksi mukus, bikarbonat, dan komponen lain dari penghalang mukosa lambung. Permukaan sel epitel mampu membentuk penghalang terus menerus yang dapat mencegah difusi kembali asam dan pepsin. Faktor protektif lain yang relevan tersedia dalam sel epitel diwakili oleh heat shock protein, yang diaktifkan dalam respon terhadap stres termasuk kenaikan suhu, stres oksidatif dan agen sitotoksik lainnya. Protein ini dapat mencegah denaturasi protein dan melindungi sel terhadap cedera. Cathelicidin dan beta-defensin adalah peptida kationik yang memainkan peran yang relevan dalam sistem pertahanan bawaan pada permukaan mukosa, mencegah kolonisasi bakteri (Fornai, dkk., 2011).
Pembaharuan sel mukosa
Pembaharuan sel epitel lambung terkoordinasi dengan baik untuk menjamin penggantian sel yang rusak. Proses pembaharuan epitel lengkap membutuhkan waktu sekitar 3-7 hari, sedangkan penggantian sel kelenjar secara keseluruhan membutuhkan waktu berbulan. Namun, pembaharuan epitel permukaan setelah kerusakan terjadi sangat cepat yaitu beberapa menit. Proses pergantian sel diatur oleh faktor pertumbuhan. Secara khusus, ditandai ekspresi reseptor faktor pertumbuhan epidermal (EGF-R). Reseptor tersebut dapat diaktifkan oleh faktor pertumbuhan mitogenik, seperti TGF-α dan IGF-1. Selain itu, PGE2 dan gastrin dapat transaktif dengan EGF-R dan mempromosikan aktivasi MAPK akibat proliferasi sel. EGF tidak terdeteksi pada mukosa normal, meskipun terdapat pada cairan lambung yang dapat merangsang proliferasi sel mukosa dalam kasus cedera (Fornai, dkk., 2011).
Aliran darah mukosa
Aliran darah mukosa sangat penting untuk memberikan oksigen dan nutrisi dan untuk menghilangkan racun dari mukosa lambung. Sel endotel, lapisan mikrovaskular ini menghasilkan NO dan prostasiklin (PGI2) yang bertindak sebagai vasodilator, sehingga melindungi mukosa lambung terhadap kerusakan dan menangkal berbagai efek vasokonstriktor termasuk leukotrien C4, tromboksan A2, dan endotelin. Selain itu, NO dan PGI2 menjaga kelangsungan hidup sel-sel endotel dan menghambat platelet dan adhesi leukosit ke mikrovaskular sehingga mencegah terjadinya mikroiskemia (Fornai, dkk., 2011).
Ketika mukosa lambung terkena iritasi atau difusi asam, maka terjadi peningkatan kecepatan aliran darah mukosa. Peningkatan aliran darah dianggap sebagai
mekanisme penting untuk mencegah cedera sel mukosa lambung dan penurunan nekrosis jaringan. Peningkatan aliran darah mukosa dimediasi oleh pelepasan NO, telah dibuktikan bahwa NO melindungi mukosa lambung terhadap cedera yang disebabkan oleh etanol atau endothelin-1, sedangkan penghambtan sintesis NO meningkatkan cedera mukosa (Fornai, dkk., 2011).
2.2.4.7 Saraf sensori
Pembuluh darah mukosa dan submukosa lambung dipersarafi oleh neuron sensori aferen, yang diatur dalam pleksus di dasar lapisan mukosa. Saraf sensori dapat mendeteksi keasaman atau difusi asam, dimana aktivasi saraf sensori tersebut memodulasi kontraksi arteri pada submukosa sehingga mengatur aliran darah mukosa. Secara khusus, stimulasi saraf sensori menyebabkan pelepasan kalsitonin yang berhubungan dengan peptida (CGRP) dan substansi P dari saraf disekitar pembuluh besar submukosa. CGRP kemudian berkontribusi pada pemeliharaan integritas mukosa lambung melalui vasodilatasi pembuluh darah di submukosa yang dimediasi oleh pelepasan NO. Persarafan sensori memiliki peran penting dalam perlindungan mukosa dengan meningkatkan sensitivitas lambung (Fornai, dkk., 2011).
2.2.4.8 Mekanisme neurohormonal
Pertahanan mukosa lambung didukung oleh sistem saraf pusat dan faktor hormonal. Diketahui bahwa aktivasi nervus vagal merangsang sekresi mukus dan meningkatkan pH sel epitel dalam lambung. Hormon lainnya, termasuk gastrin, kolestokinin, thyrotropin-releasing hormon, bombesin, EGF, peptida YY, dan neurokinin A memainkan peran penting dalam regulasi mekanisme pelindung lambung (Fornai, dkk., 2011).
2.3 Ulkus Lambung
2.3.1 Definisi ulkus lambung
Walaupun terdapat proteksi yang dibentuk oleh mukus, sawar mukosa lambung, dan pertukaran sel yang cepat, proteksi tersebut kadang-kadang rusak, sehingga dinding lambung mengalami cedera akibat isinya yang sangat asam dan enzimatik tersebut. Apabila hal ini terjadi, timbul erosi atau ulkus peptikum dinding lambung (Sherwood, 2001).
Ulkus peptikum ialah suatu istilah untuk menunjuk kepada suatu kelompok penyakit ulseratif saluran makanan bagian atas yang melibatkan terutama bagian proksimal duodenum dan lambung, yang mempunyai patogenesis yang sama-sama melibatkan asam-pepsin. Bentuk utama ulkus peptikum yang umum adalah ulkus duodenum dan ulkus lambung, keduanya merupakan penyakit kronik (Isselbacher, 2000).
Ulkus peptikum atau ulkus peptikumum merupakan keadaan dimana kontiunitas mukosa lambung terputus dan meluas sampai di bawah epitel. Kerusakan mukosa yang tidak meluas sampai ke bawah epitel disebut erosi, walaupun seringkali dianggap juga sebagai ulkus (Fry, 2005). Menurut defenisi, ulkus peptikum dapat ditemukan pada setiap bagian saluran cerna yang terkena getah asam lambung, yaitu esofagus, lambung, duodenum, jejenum, dan setelah tindakan gastroenterostomi. Ulkus peptikum diklasifikasikan atas ulkus akut dan ulkus kronis, hal tersebut menggambarkan tingkat kerusakan pada lapisan mukosa yang terlibat (Aziz, 2008).
Ulkus lambung dan duodenum pada manusia terutama berkaitan dengan rusaknya sawar yang secara normal mencegah iritasi dan autodigesti mukosa oleh sekresi lambung (Ganong, 2008).
Apabila sawar mukosa lambung rusak (baik karena melemah atau rusak atau dikalahkan oleh sekresi yang berlebihan), asam dan pepsin berdifusi ke dalam mukosa dengan konsekuensi patofisiologis serius. Asam memicu pengeluaran histamin, suatu stimulan asam yang kuat yang diproduksi dan disimpan dalam jumlah besar di mukosa (Masih belum diketahui apakah histamin berperan dalam keadaan normal). Histamin yang dikeluarkan tersebut merangsang sekresi lebih banyak asam, yang dapat berdifusi kembali ke mukosa untuk merangsang pengeluaran histamin lebih lanjut, yang memicu pengeluaran lebih banyak asam, dan seterusnya, sehingga tercipta suatu lingkaran setan. Erosi mukosa, atau ulkus, terus membesar di bawah pengaruh asam dan pepsin yang kadarnya meningkat. Dua konsekuensi paling serius adanya ulkus adalah (1) perdarahan akibat kerusakan kapiler submukosa dan (2) perforasi dinding lambung akibat erosi total menembus dinding yang disebabkan oleh kerja HCL dan pepsin, sehingga isi lambung yang berbahaya tersebut masuk ke dalam rongga abdomen (Sherwood, 2001).
2.3.2 Patofisiologi
Beaumont mengamati bahwa aktivitas lambung bervariasi sesuai respons terhadap perubahan keadaan emosi yang tidak berkaitan dengan proses pencernaan__hal ini menjadi dasar gangguan pencernaan selama periode stres emosi (Sherwood, 2001).
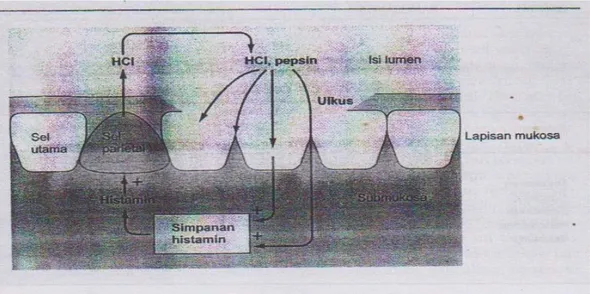
Asam dan pepsin berdifusi ke dalam mukosa dengan konsekuensi patofisiologis serius seperti yang terlihat pada Gambar 2.3 di bawah ini.
Gambar 2.3 Pembentukan ulkus.
Keterangan : Apabila asam dan pepsin mampu menembus sawar mukosa lambung yang melemah, asam merangsang pengeluaran histamin yang tersimpan di submukosa. Histamin pada gilirannya merangsang sel- sel parietal untuk mengeluarkan lebih banyak asam, yang berdifusi menembus sawar yang rusak untuk memicu pengeluaran lebih banyak histamin, sehingga terjadi lingkaran setan. Terbentuk ulkus yang secara progresif membesar karena asam dan pepsin terus menyebabkan erosi mukosa lambung (Sherwood, 2001).
Syarat untuk terjadinya ulkus peptikum adalah adanya getah lambung yang mengandung asam klorida dan pepsin (tanpa asam tak ada ulkus) (Mutschler, 2010). Penyebab umum dari ulserasi peptikum adalah ketidakseimbangan antara kecepatan sekresi cairan lambung dan derajat perlindungan yang diberikan oleh sawar mukosa gastroduodenal dan netralisasi asam lambung oleh cairan duodenum. Semua daerah yang secara normal terpapar oleh cairan lambung dipasok dengan baik oleh kelenjar mukus, antara lain kelenjar mukus campuran pada esofagus bawah dan meliputi sel mukus penutup pada mukosa lambung; sel mukus pada leher kelenjar lambung; kelenjar pilorik profunda (menyekresi sebagian besar mukus); dan akhirnya kelenjar Brunner pada duodenum bagian
atas yang menyekresi mukus sangat alkali (Guyton dan Hall, 2007). Ulkus peptikum terjadi jika efek agresif asam-pepsin lebih banyak daripada efek protektif pertahanan mukosa lambung atau mukosa duodenum. Kemampuan/kapasitas normal mukosa lambung atau duodenum bagian proksimal untuk menahan efek-efek korosif asam dan pepsin ialah unik dalam tubuh. Hal itu tidak sama dengan yang dimiliki oleh jaringan lain __ karena itu kerentanan mukosa esofagus terhadap cedera karena getah lambung yang mengalir kembali, ulserasi usus halus yang sering jika dikaitkan secara operatif kepada mukosa lambung yang mensekresi secara aktif, dan korosi kulit dapat diramalkan menyebabkan fistula gastrokutaneus (Isselbacher, 2000).
Banyak yang telah dipelajari mengenai mekanisme yang mengatur sekresi asam lambung dan faktor yang tampaknya penting dalam perkembangan ulkus peptikum. Perhatian fisiologi lambung memberikan suatu pengertian mengenai beberapa elemen etiologik dan juga suatu dasar yang rasional untuk pengobatan dan pencegahan ulkus peptikum (Isselbacher, 2000).
Sebagai tambahan terhadap perlindungan mukus dari mukosa, duodenum dilindungi oleh sifat alkali dari sekresi usus halus, terutama adalah sekresi pankreas-yang mengandung sejumlah besar natrium bikarbonat, berfungsi menetralisir asam klorida cairan lambung – sehingga menginaktifkan pepsin untuk mencegah pencernaan mukosa (Lewis, 2000).
Ulkus peptikum dapat disebabkan oleh (1) sekresi asam dan pepsin yang berlebihan oleh mukosa lambung, atau (2) berkurangnya kemampuan sawar mukosa gastroduodenalis untuk berlindung dari sifat pencernaan dari kompleks asam – pepsin ( Muttaqin dan Kumala, 2013).
2.3.2.1 Penyebab khusus 1. Infeksi bakteri H. Pylori.
Penyebab pasti ulkus, sampai beberapa waktu yang lalu belum diketahui, tetapi dalam suatu temuan baru yang mengejutkan, bakteri Helicobacter pylori diperkirakan merupakan penyebab pada hampir 90% kasus ulkus peptikum. Infeksi oleh mikroorganisme ini tampaknya memperlemah sawar mukosa lambung (Sherwood, 2001).
Dalam lima tahun terakhir, ditemukan paling sedikit 75% pasien ulkus peptikum menderita infeksi kronis pada bagian akhir mukosa lambung, dan bagian mukosa duodenum oleh bakteri H. Pylori. Sekali pasien terinfeksi, maka infeksi dapat belangsung seumur hidup kecuali bila kuman diberantas dengan pengobatan antibakterial. Lebih lanjut lagi, bakteri mampu melakukan penetrasi sawar maupun dengan melapaskan enzim-enzim pencernaan yang mencairkan sawar. Akibatnya cairan asam kuat pencernaan yang disekresi oleh lambung dapat berpenetrasi ke dalam jaringan epitelium dan mencernakan epitel, bahkan juga jaringan-jaringan di sekitarnya. Keadaan ini menuju kepada kondisi ulkus peptikum (Muttaqin dan Kumala, 2013).
2. Peningkatan sekresi asam
Pada kebanyakan pasien yang menderita ulkus peptikum di bagian awal duodenum, jumlah sekresi asam lambungnya lebih besar dari normal, bahkan sering dua kali lipat dari normal.
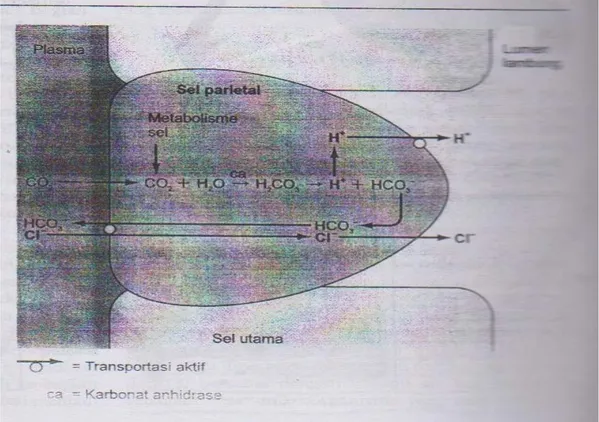
Sekresi asam hidroklorida lambung dapat dilihat pada Gambar 2.4 di bawah ini.
Gambar 2.4 Mekanisme sekresi HCl.
Keterangan: Sel-sel parietal lambung secara aktif mengeluarkan H+ dan Cl- melalui kerja dua pompa yang berbeda. Ion H+ yang disekresikan berasal dari H2CO3 yang dibentuk di dalam sel dari CO2 yang
dihasilkan dari proses metabolisme di dalam sel atau berdifusi masuk dari plasma. Ion Cl- yang disekresikan diangkut ke sel parietal dari plasma. Ion HCO3- yang dihasilkan dari penguraian H2CO3
dipindahkan ke dalam plasma sebagai penukar Cl- yang disekresikan (Sherwood, 2001).
Walaupun setengah dari peningkatan asam ini mungkin disebabkan oleh infeksi bakteri, percobaan pada hewan ditambah bukti adanya perangsangan berlebihan sekresi asam lambung oleh saraf pada manusia yang menderita ulkus peptikum mengarah kepada sekresi cairan lambung yang berlebihan (Guyton dan Hall, 2007). Predisposisi peningkatan sekresi asam diantaranya adalah faktor psikogenik seperti pada saat mengalami depresi atau kecemasan dan merokok (Muttaqin dan Kumala, 2013).
3. Konsumsi obat-obatan
Obat-obatan seperti OAINS/obat anti-inflamasi nonsteroid seperti indometasin, ibuprofen, asam salisilat mempunyai efek penghambatan siklo-oksigenase sehingga menghambat sintesis prostaglandin dari asam arakhidonat secara sistemik, termasuk pada epitel lambung dan duodenum. Pada sisi lain, hal ini juga menurunkan sekresi HCO3- sehingga memperlemah perlindungan mukosa
(Muttaqin dan Kumala, 20013). Aspirin dan NSAIDs lain diketahui dengan jelas mengakibatkan peptik ulser dan obat ini lebih sering dihubungkan dengan lesi pada ulkus lambung daripada ulkus duodenum (Chung dan Byung-Wook, 2012). Efek lain dari obat ini adalah merusak mukosa lokal melalui difusi non-ionik ke dalam sel mukosa. Obat ini juga berdampak terhadap agregasi trombosit sehingga akan meningkatkan bahaya perdarahan ulkus (Kee dan Evelyn, 1995).
4. Stres fisik
Stres fisik yang disebabkan oleh syok, luka bakar, sepsis, trauma, pembedahan, gagal napas, gagal ginjal, dan kerusakan susunan saraf pusat (Lewis, 2000). Bila kondisi stres fisik ini berlanjut, maka kerusakan epitel akan meluas dan kondisi ulkus peptikum menjadi lebih parah (Muttaqin dan Kumala, 2013).
5. Refluks usus-lambung
Refluks usus-lambung dengan materi garam empedu dan enzim pankreas yang berlimpah dan memenuhi permukaan mukosa dapat menjadi predisposisi kerusakan epitel mukosa (Muttaqin dan Kumala, 2013).
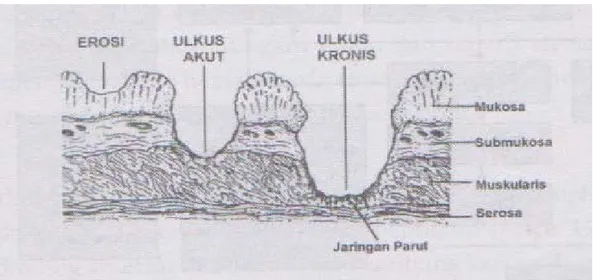
Faktor-faktor di atas menyebabkan kerusakan epitel mulai dari erosi yang berlanjut pada ulkus akut, kemudian ulkus kronis, dan terbentuknya jaringan parut; maka akan terjadi penetrasi dari seluruh dinding lambung (Gambar 2.5).
Gambar 2.5 Ilustrasi ulkus peptikum.
Keterangan: Ilustrasi ulkus peptikum meliputi gambaran erosi, ulkus akut dan ulkus kronis pada dinding lambung (Lewis, 2000).
2.3.3 Gambaran klinis
Nyeri abdomen seperti terbakar (dispepsia) sering terjadi di malam hari. Nyeri biasanya terletak di area tengah epigastrum, dan nyeri bersifat ritmik.
Nyeri yang terjadi ketika lambung kosong (di malam hari).
Nyeri yang terjadi segera setelah atau selama makan. Kadang nyeri dapat menyebar ke punggung atau bahu.
Penurunan berat badan juga biasanya menyertai ulkus lambung (Corwin, 2009). Obat-obatan yang efektif pada terapi ulkus lambung adalah yang menurunkan sekresi asam lambung atau yang meningkatkan resistensi mukosa terhadap serangan asam-pepsin. Sekresi asam dari sel parietal diturunkan oleh antagonis histamin H2 atau oleh inhibitor pompa proton yang dapat menghasilkan kondisi
dari sel parietal. Inhibitor pompa proton sangat efektif dalam menunjang penyembuhan ulkus, bahkan pada pasien yang resisten terhadap antagonis H2.
Penguat mukosa meningkatkan penyembuhan ulkus dengan terikat pada dasar ulkus. Hal ini memberikan perlindungan fisik dan memungkinkan sekresi HCO3-
untuk mengembalikan gradien pH, yang normalnya terdapat pada lapisan mukus (Neal, 2006).
2.3.4 Komplikasi
Komplikasi ulkus peptikum adalah ulkus yang “membandel” (intraktibilitas), perdarahan, perforasi, dan obtruksi pilorus. Setiap komplikasi ini merupakan indikasi pembedahan (Price dan Wilson, 1995).
1. Intraktibilitas
Komplikasi ulkus peptikum yang paling sering adalah intraktibilitas, yang berarti bahwa terapi medis telah gagal mengatasi gejala-gejala secara adekuat. Pasien dapat terganggu tidurnya oleh nyeri, kehilangan waktu untuk bekerja, memerlukan perawatan di rumah sakit, atau hanya tidak mampu mengikuti program terapi. Intraktibilitas merupakan alasan tersering untuk anjuran pembedahan. Perubahan menjadi ganas tidak perlu terlalu dipertimbangkan baik untuk ulkus lambung maupun ulkus duodenum. Ulkus ganas sejak semula sudah bersifat ganas, paling tidak menurut pengetahuan mutakhir, ulkus yang memulai perjalanan dengan jinak akan tetap jinak tanpa mengalami degenerasi ganas (Muttaqin dan Kumala, 2013).
2. Perdarahan
Perdarahan merupakan komplikasi ulkus peptikum yang sangat sering terjadi, sedikitnya ditemukan pada 25% kasus selama perjalanan penyakit (Guyton dan
Hall, 2007). Walaupun ulkus pada setiap tempat dapat mengalami perdarahan, namun yang tersering adalah di dinding posterior bulbus duodenum, karena pada tempat ini dapat terjadi erosi arteria pankreatikoduodenalis atau arteria gastroduodenallis. Gejala-gejala yang dihubungkan dengan perdarahan ulkus tergantung pada kecepatan kehilangan darah. Kehilangan darah yang ringan dan kronik dapat mengakibatkan anemia defisiensi besi. Feses dapat positif akan darah samar atau mungkin hitam dan seperti ter (melena). Perdarahan masif dapat mengakibatkan hematemesis (muntah darah), menimbulkan syok, dan memerlukan transfusi darah serta pembedahan darurat (Muttaqin dan Kumala, 2013).
3. Perforasi
Kira-kira 5% dari semua ulkus akan mengalami perforasi, dan komplikasi ini bertanggung jawab atas sekitar 65% kematian akibat ulkus peptikum (Price dan Wilson, 1995). Ulkus biasanya terjadi pada dinding anterior duodenum atau lambung karena daerah ini hanya diliputi oleh peritoneum. Pada kondisi klinik, pasien dengan komplikasi perforasi datang dengan keluhan nyeri mendadak yang parah pada abdomen bagian atas. Dalam beberapa menit timbul peritonitis kimia akibat keluarnya asam lambung, pepsin, dan makanan yang menyebabkan nyeri hebat. Kondisi nyeri tersebut menyebabkan pasien takut bergerak atau bernapas. Auskultasi abdomen menjadi senyap dan saat palpasi, abdomen mengeras seperti papan. Perforasi akut biasanya dapat didiagnosa berdasarkan gejala-gejala saja. Diagnosis dipastikan melalui adanya udara bebas dalam rongga peritoneal, dinyatakan sebagai bulan sabit transulen antara bayangan hati dan diafragma.
Udara tentu saja masuk rongga peritoneal melalui ulkus yang mengalami perforasi (Azis, 2008).
4. Obstruksi
Obstruksi pintu keluar lambung akibat peradangan dan edema, pilorospasme, atau jaringan perut terjadi pada sekitar 5% pasien ulkus peptikum. Obstruksi timbul lebih sering pada pasien ulkus duodenum, tetapi kadang terjadi bila ulkus lambung terletak dekat dengan sfingter pilorus. Anoreksia, mual, dan kembung setelah makan merupakan gejala-gejala yang sering timbul, kehilangan berat badan juga sering terjadi. Bila obstruksi bertambah berat, dapat timbul nyeri dan muntah (Mineta, 1983).
2.3.5 Mekanisme penyembuhan ulkus lambung
Ulkus lambung terjadi akibat adanya nekrosis jaringan terutama dipicu oleh iskemia dengan peghentian pengiriman nutrisi dan pembentukan ROS. Penyembuhan ulkus merupakan proses yang kompleks, dimana perbaikan jaringan sendiri setelah cedera dan restitusi terhadap integritas. Menurut Schmassmann (1998), fase dan waktu penyembuhan ulkus dapat digambarkan sebagia berikut: tahap pengembangan ulkus (dalam waktu 3 hari setelah cedera) ditandai dengan nekrosis jaringan, infiltrasi inflamasi, pembentukan tepi ulkus (de-diferensiasi) dan pengembangan granulasi jaringan; fase penyembuhan (setelah 3-10 hari setelah cedera) yang mencakup penyembuhan awal (migrasi cepat sel epitel) diikuti oleh proses penyembuhan akhir (angiogenesis, perbaikan granulasi jaringan, dan reeepitelisasi), tahap perbaikan (20-40 hari setelah ulkus) yang terdiri dari perbaikan kelenjar, muskularis mukosa, propia muskularis; fase pematangan (40-150 hari setelah ulkus) ditandai dengan pematangan dan
diferensiasi sel-sel khusus. Penyembuhan ulkus diprakarsai oleh pembentukan faktor pertumbuhan epidermal (EGF-R) dan faktor pertumbuhan yang berasal dari platelet (PDGF). Selama penyembuhan granulasi jaringan mengalami perbaikan terus menerus, dimana sel-sel inflamasi muncul pada fase awal penyembuhan dilanjutkan oleh fibroblast dan mikrovaskular dalam fase penyembuhan akhir. 2.4 Asam Asetilsalisilat (Aspirin)
2.4.1 Uraian bahan
Rumus bangun : Asam Asetilsalisilat
Gambar 2.6 Rumus bangun asam asetil salisilat. Rumus molekul : C9H804
Berat molekul : 180,16
Sinonim : aspirin, asetosal
Asam asetilsalisilat mengandung tidak kurang dari 99,5% dan tidak lebih dari 100,5% C9H804, dihitung terhadap zat yang telah dikeringkan.
Pemerian : Hablur putih, umumnya seperti jarum atau lempengan tersusun, atau serbuk hablur putih; tidak berbau atau berbau lemah. Stabil di udara kering; di dalam udara lembab secara bertahap terhidrolisa menjadi asam salisilat dan asam asetat.
Kelarutan : Sukar larut dalam air; mudah larut dalam etanol; larut dalam kloroform; dan dalam eter agak sukar larut dalam
eter mutlak.
Penyimpanan : Dalam wadah tertutup rapat (Depkes RI, 1995). 2.4.2 Mekanisme terjadi ulkus pada lambung
Berbagai obat dikenal mencederai mukosa lambung. Obat ini mencakup aspirin dan obat-obat NSAID lain, asam empedu, enzim pankreatik dan etanol. Obat anti-inflamasi nonsteroid (AINS) bertanggung jawab untuk sebagian besar ulkus lambung. Hal ini dianggap karena disebabkan secara primer pertahanan mukosa berkurang oleh terhambatnya sintesis prostaglandin mukosa lambung (Isselbacher, 2000).
Efek samping yang paling sering terjadi yang disebabkan oleh asam asetilsalisilat adalah induksi tukak peptik (tukak duodenum dan tukak lambung) yang kadang-kadang disertai anemia sekunder akibat perdarahan saluran cerna. Dua mekanisme terjadinya iritasi lambung ialah: (1) iritasi yang bersifat lokal yang menimbulkan difusi kembali asam lambung ke mukosa dan menyebabkan kerusakan jaringan; (2) iritasi atau perdarahan lambung yang bersifat sistemik melalui hambatan PGE2
dan PGI2. Kedua PG ini banyak ditemukan di mukosa lambung dengan fungsi
menghambat sekresi asam lambung dan merangsang sekresi mukus usus halus yang bersifat sitoprotektif. Mekanisme kedua ini terjadi pada pemberian parenteral. Uji klinik menyimpulkan bahwa gangguan saluran cerna penghambat selektif COX-2 lebih ringan daripada COX-1 (Tanu, 2007).
Aspirin dengan NSAID lain, toksik secara langsung terhadap mukosa lambung, dan menghabiskan sama sekali prostaglandin mukosa endogen yang protektif dengan menghambat sintesis prostaglandin. Aspirin dan NSAID lain dapat membantu perkembangan ulkus lambung dengan menghentikan sawar mukosa,
yang memungkinkan difusi balik ion hidrogen yang dapat melukai mukosa lambung. Obat ini mengurangi sekresi mukus lambung dan sekresi bikarbonat duodeni serta dapat meningkatkan sekresi asam lambung. Kehabisan prostaglandin juga mengganggu penyusunan kembali sel epitelial setelah cedera (Isselbacher, 2000).
Erosi yang disebabkan oleh obat-obatan AINS, terutama ditemukan di daerah antrum, namun dapat juga menyeluruh. Secara mikroskopik, terdapat erosi dengan regenerasi epitel, dan ditemukan reaksi sel inflamasi neutrofil yang minimal (Mansjoer, 1999).
2.5 Alginat
Alginat adalah salah satu kelompok polisakarida yang terbentuk dalam dinding sel algae coklat, dengan kadar mencapai 40% dari total berat kering dan memegang peranan penting dalam mempertahankan struktur jaringan algae (Rasyid, 2003). Alginat merupakan karbohidrat, seperti gula dan selulosa dan merupakan polimer struktural pada ganggang laut sama seperti selulosa pada tanaman (Andersen, dkk., 2012). Alginat adalah suatu polimer yang diperoleh dari alga coklat (Phaeophyceae). Alginat yang terkandung dalam rumput laut coklat merupakan
polisakarida yang terdiri dari residu asam β – d – manuronat dengan asam α – l - guluronat. Alginat yang biasa digunakan adalah dalam bentuk natrium alginat yang larut dalam air dan jika dilarutkan dalam larutan kalsium klorida segera terbentuk gel kalsium alginat yang tidak larut dalam air (Morris, dkk., 1980). Di Indonesia yang paling banyak ditemukan adalah jenis Sargassum dan Turbinaria. Produksi tahunan diperkirakan sekitar 38.000 ton per tahun.
Selain itu, alginat yang berbeda dapat diproduksi oleh bekteri dengan cara fermentasi (Andersen, dkk., 2012).
Karakteristik natrium alginat adalah:
Pemerian : Serbuk tidak berbau dan berasa, putih sampai coklat kekuningan pucat.
Kelarutan : Larut dalam air, praktis tidak larut dalam etanol, eter, pelarut organik dan asam.
Tak tercampurkan : Dengan turunan acridine, kristal violet, fenilmerkuri asatat dan nitrat, garam kalsium, logam berat.
2.5.1 Struktur alginat
Alginat merupakan kopolimer linear yang mengandung lebih dari 700 residu asam uronat yaitu β – d – manuronat dan asam α – l – guluronat dengan ikatan 1,4. Rantai alginat yang hanya mengandung residu asam manuronat disebut blok M, rantai alginat yang hanya mengandung residu asam guluronat disebut blok G dan rantai alginat yang mengandung residu asam manuronat serta asam guluronat disebut blok G-M (Draget, dkk., 2005), seperti Gambar 2.6 dibawah ini.
2.5.2 Sifat dan kegunaan alginat
Asam alginat diekstraksi dari ganggang coklat dan dinetralisasikan dengan natrium bikarbonat untuk membentuk natrium alginat. Asam alginat tidak dapat larut dalam air dan secara umum pada industri untuk melarutkannya dilakukan dengan penambahan natrium ataupun kalsium (Morris, dkk., 1980).
Kegunaan dari alginat didasarkan pada 3 sifat utamanya adalah: Kemampuan untuk larut dalam air serta meningkatkan viskositas larutan. Kemampuannya untuk membentuk gel.
Kemampuannya membuat film (natrium alginat) serta serat (kalsium alginat). Dengan kemampuan alginat yang dapat membentuk gel, sehingga banyak digunakan untuk berbagai aplikasi industri, termasuk makanan dan obat-obatan. Dalam beberapa tahun terakhir penelitian tentang alginat sebagian besar bergeser ke arah aplikasi biomedis (Andersen, dkk., 2012). Alginat banyak digunakan untuk keperluan medis, antara lain untuk bahan memperbaiki dan regenerasi jaringan seperti pembuluh darah, kulit, tulang rawan, ikatan sendi, sistem penyampaian obat dan beberapa formulasi pencegahan terjadinya refluks gastroesofageal. Hal ini disebabkan karena sifatnya yang biodegradable dan biocompatible, antibakteri, nontoksik, dan tidak menyebabkan alergi. Dalam memperbaiki jaringan dan organ-organ yang rusak alginat semakin banyak digunakan dalam berbagai bentuk fisik antara lain larutan, dispersi, gel, serat dan lain-lain (Sun dan Huaping, 2013).
Sediaan alginat akan menyebar di dalam lambung dan melepaskan obat-obat yang tergabung, ke dinding lambung dengan kemampuan menyebar lebih baik daripada
isi lumen lambung dengan pembentukan jel pada permukaan (Tonnesen dan Jan, 2002).
2.5.2.1 Natrium alginat pada pengobatan ulkus lambung
Natrium alginat menutupi/melapisi lesi, mencegah kerja merusak dari pepsin dan asam hidroklorida, dan melindungi permukaan mukosa daluran pencernaan bagian atas. Studi juga menerangkan bahwa natrium alginat meningkatkan produksi heksosamin lambung pada ulkus lambung tikus yang disebabkan oleh asam hidroklorida. Saat ini, ditegaskan efek natrium alginat pada ulkus lambung yang diinduksi dengan indometasin, dan perlindungan tambahan pada kerusakan usus halus yang diakibatkan oleh indometasin, gejala anemia, mengurangi panjang usus halus, meningkatkan respon inlamasi, dan tekanan oksidasi di usus halus telah diamati. Pada study baru-baru ini, natrium alginat juga menghambat penurunan kadar hemoglobin yang disebabkan oleh indometasin, padahal rebamipid menunjukkan efek yang tidak signifikan. Sebab itu, kami menegaskan bahwa natrium alginat mendatangkan efek mukoprotektif dan efek menhentikan perdarahan di saluran pencernaan bagian bawah dan juga efek perlindungan pada lambung. Natrium alginat mengurangi lebar ulkus yang diinduksi dengan indometasin dan aktivitas myeloperoxidase pada lambung dan usus. Natrium alginat mencegah peningkatan permeabilitas mikrovaskular, jumlah dismutasi superoksida, aktivitas glutation peroksidase dan aktivitas katalase pada cedera usus halus oleh induksi indometasin. Natrium alginat juga mencegah pengurangan sel darah merah dan sel darah putih pada cedera usus halus oleh induksi indometasin. Terlebih lagi, natrium alginat menekan penipisan mukus yang disebabkan oleh indometasin dan menghambat perembesan enterobakteria
ke dalam usus halus. Natrium alginat memperbaiki cedera saluran cerna yang diinduksi oleh obat-obat antiinflamasi nonsteroid dengan cara menghilangkan bakteri-bakteri (Yamamoto, dkk., 2014).
Pada lambung, natrium alginat meningkatkan kadar heksosamin, yaitu glikoprotein pada mukus lambung. Satoh et al melaporkaan bahwa makanan yang mengandung serat pangan larut, memperbaiki lesi usus yang disebabkan oleh indometasin. Mereka melaporkan hubungan yang kuat antara viskositas dan sifat mukoprotektif dari serat pangan larut. Natrium alginat dengan molekul kecil juga mencegah cedera usus halus, tetapi tidak dengan CMC-Na. Maka dari itu, kami menegaskan bahwa efek protektif dari natrium alginat tidak tetgantung pada viskositasnya. Barcelo dkk (2000) juga melaporkan bahwa natrium alginat meningkatkan sekresi mucin, tetapi selulosa tidak, pada kolon tikus. Mereka melaporkan bahwa asam glukoronat dan asam galakturonat juga meningkatkan jumlah mucin dan ditunjukkan bahwa asam uronat, yang merupakan gugus utama pada natrium alginat, memainkan peranaan penting dalam sekresi mukus. Hasil penelitian menegaskan bahwa efek terapetik dari natrium alginat tidak tergantung pada viskositas. Oleh karena itu, natrium alginat dapat menjadi pengobatan efektif untuk ulkus lambung yang disebabkan oleh NSAIDs dan cedera mukosa usus (Yamamoto, dkk., 2014).
2.6 Omeprazol 2.6.1 Uraian bahan
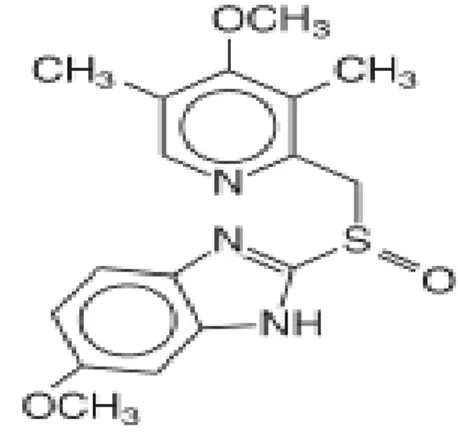
Rumus bangun : Omeprazol
Gambar 2.8 Rumus bangun omeprazol (Brunton, dkk., 2008). Rumus molekul : C17H19N3O3S
Berat molekul : 345,42
Sinonim : 5 - Metoksi – 2 - [[(4-metoksi-3,5-dimetil-2 piridinil) metil] sulfinil] benzimidazol [73590-58-6]
Omeprazol mengandung tidak kurang dari 98,0% dan tidak lebih dari 102,0% C17H19N3O3S, dihitung terhadap zat yang telah dikeringkan.
Pemerian : Serbuk putih hampir putih, melebur pada suhu 150° hingga 160° disertai penguraian.
Kelarutan : Larut dalam diklorometan, agak sukar larut dalam metanol dan dalam etanol, sangat sukar larut dalam air.
Wadah dan penyimpanan : Simpan di tempat dingin, dalam wadah tertutup rapat dan terlindung dari cahaya (Ditjen Binfar dan Alkes RI, 2013).
Penghambat pompa proton merupakan penghambat sekresi asam lambung lebih kuat dari AH2. Obat ini bekerja di proses terakhir produksi asam lambung, lebih distal dari AMP. Saat ini yang digunakan di klinik adalah omeprazol, esomeprazol, lansoprazol, rabeprazol dan pantoprazol. Perbedaan antara kelima sediaan tersebut adalah pada substitusi di cincin piridin dan/atau benzimidazol. Omeprazol adalah campuran rasemik isomer R dan S. Esomeprazol adalah isomer S omeprazol (S-omeprazol) yang mengalami eliminasi lebih lambat dari R-omeprazol (Tanu, 2007).
2.6.2 Farmakodinamik
Penghambat pompa proton adalah suatu prodrug yang membutuhkan suasana asam untuk aktivasinya. Setelah diabsorpsi dan masuk ke sirkulasi sistemik obat ini akan berdifusi ke sel parietal lambung, terkumpul di kanalikuli sekretoar dan mengalami aktivasi disitu menjadi bentuk sulfonamid tetrasiklik. Bentuk aktif ini berikatan dengan gugus sulfuhidril enzim H+, K+, ATPase (enzim ini dikenal sebagai pompa proton) dan berada di membran apikal sel parietal. Ikatan ini menyebabkan terjadinya penghambatan enzim tersebut. Produksi asam lambung terhenti 80% s/d 95%, setelah penghambatan pompa proton tersebut (Tanu, 2007).
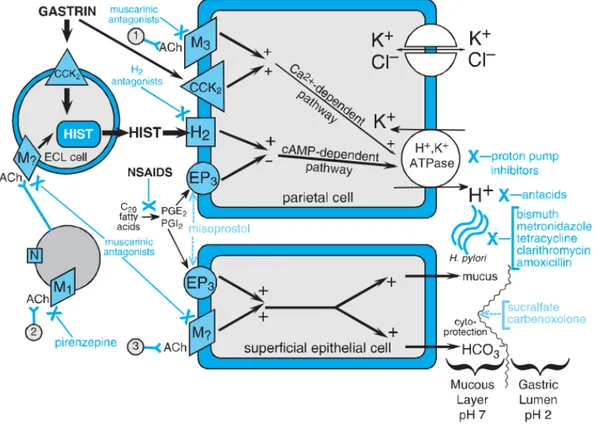
Regulasi fisiologis dan farmakologi dari sekresi asam: basis terapi gangguan asam dapat dilihat pada Gambar 2.9 di bawah ini.
Gambar 2.9 Regulasi fisiologis dan farmakologi dari sekresi asam: basis terapi gangguan asam.
Keterangan: Menunjukkan interaksi antara sel enterochromaffin-like (ECL) yang mensekresikan histamin, sel parietal yang mensekresikan asam, dan sel epitel permukaan yang mensekresikan mukus dan bikarbonat yang bersifat sitoprotektif. Jalur fisiologis, ditunjukkan dengan garis hitam, dapat bersifat stimulasi (+) atau penghambatan (-). 1 dan 3 menandakan kemungkinan masukan dari postganglion serabut saraf kolinergik, sedangkan 2 menunjukkan masukan dari nervus vagus. Sifat agonis dan masing-masing reseptor membrannya yaitu : reseptor asetilkolin (Ach), muskarinik (M), dan nikotinik (N); gastrin, reseptor kolesitokinin 2 (CCK2); histamin (HIST), reseptor H2; dan prostaglandin E2 (PGE2), reseptor EP3. Aksi obat ditunjukkan dengan garis terpisah. X yang berwarna biru menunjukkan target antagonis. Tulisan berwarna biru menunjukkan obat-obat yang mengobati gangguan asam lambung. NSAIDs adalah obat-obat yang bersifat ulserogenik (Brunton, dkk., 2008).
Tahap akhir sekresi ion hidrogen oleh sel parietal dicapai dengan enzim (H+, K+ - ATPase) yang membantu sebagai pompa proton, yang menukarkan hidrogen dengan kalium. H+, K+ - ATPase terletak pada membran apikal dan aparatus tubulovesikular sel parietal. Permukaan luminal enzim transmembran
tidak terlindung dari pH asam luminal lambung. Omeprazol, suatu inhibitor khas dari H+, K+ - ATPase sel parietal, telah terbukti luar biasa kuatnya dalam mengurangi sekresi asam lambung. Omeprazol, suatu benzimidazol yang disubtitusikan mengikat pada H+, K+ - ATPase, secara tidak reversibel menginaktifkan enzim itu. Omeprazol suatu basa lemah, ialah suatu prodrug yang menjadi terkonsentrasi dalam lingkungan asam (di bawah pH 4) menghasilkan ikatan gugus sulfur aktif yang membentuk disulfida kovalen dengan H+, K+ - ATPase, dengan demikian mendenaturasikan dan menginaktifkan enzim itu. Omeprazol selengkapnya memblokir sekresi hambatan sekresi asam basal dan asam yang dirangsang. Obat ini menghasilkan penghambatan sekresi asam lambung, dengan sembuhnya sekresi asam yang memerlukan sintesis enzim baru. Efek maksimum omeprazol terjadi dalam 2 jam, dengan 50% penghambatan maksimum pada 24 jam dan lamanya penghambatan yang bertahan selama 72 jam. Dengan penentuan dosis sekali sehari dicapai suatu efek datar (plateau) setelah 4 hari, dan setelah tidak dilanjutkan, aktivitas sekresi asam lambung kembali secara berangsur-angsur pada 3 sampai 5 hari (Isselbacher, 2000).
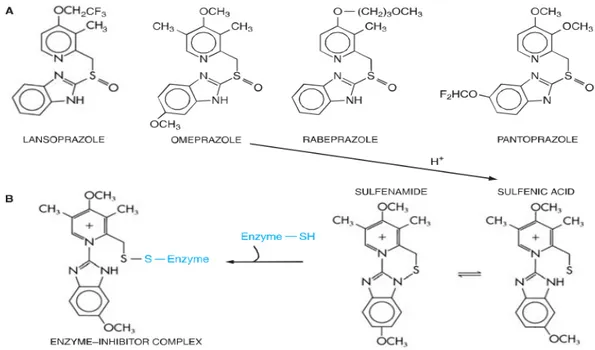
Penghambatan enzim H+, K+, ATPase (pompa proton) oleh omeprazol dan perubahan omeprazol menjadi sulfenamida dalam kanakuli sekretoar sel parietal dapat dilihat pada Gambar 2.10 berikut ini.
Gambar 2.10 A. Penghambat enzim H+, K+, ATPase (pompa proton); B. Perubahan omeprazol menjadi sulfenamida dalam kanakuli sekretoar sel parietal.
Keterangan: Sulfenamida berikatan secara kovalen dengan gugus sulfuhidril pada pompa proton, dengan demikian dapat menghambat aktivitasnya secara irreversibel. Tiga penghambat pompa proton lainnya mengalami perubahan yang sama (Brunton, dkk., 2008). Penghambatan berlangsung lama antara 24-48 jam dan dapat menurunkan sekresi asam lambung basal atau akibat stimulasi, lepas dari jenis perangsangan histamin, asetilkolin atau gastrin. Hambatan ini sifatnya ireversibel, produksi asam baru dapat kembali setelah 3-4 hari pengobatan dihentikan (Tanu, 2007). 2.6.3 Farmakokinetik
Penghambat pompa proton sebaiknya diberikan dalam sediaan salut enterik untuk mencegah degradasi zat aktif tersebut dalam suasana asam. Sediaan ini tidak mengalami aktivasi di lambung sehingga bioavailabilitasnya lebih baik. Tablet yang pecah di lambung mengalami aktivasi lalu terikat pada berbagai gugus sulfuhidril mukus dan makanan. Bioavailabilitasnya akan menurun sampai dengan 50% karena pengaruh makanan. Oleh sebab itu sebaiknya diberikan 30
menit sebelum makan. Obat ini mempunyai masalah bioavailabilitas, formulasi berbeda memperlihatkan presentasi jumlah absorpsi yang bervariasi luas. Bioavailabilitas tablet yang bukan salut enterik meningkat dalam 5-7 hari, ini dapat dijelaskan dengan berkurangnya produksi asam lambung setalah obat bekerja. Obat ini dimetabolisme di hati oleh sitokrom P450
(CYP) terutama CYP2C19 dan CYP3A4 (Tanu, 2007). 2.6.4 Indikasi
Indikasi penghambat pompa proton sama dengan AH2 yaitu pada penyakit peptik. Terhadap sindrom Zolinger-Ellison, obat ini dapat menekan produksi asam lambung lebih baik dari AH2 pada dosis yang efek sampingnya tidak terlalu mengganggu (Tanu, 2007).
2.6.5 Efek samping
Efek samping yang umum terjadi adalah mual, nyeri perut, konstipasi, flatulence, dan diare. Dilaporkan pula terjadi myopati subakut, artralgia, sakit kepala dan ruam kulit. Keadaan hipergastrinemia lebih sering terjadi dan lebih berat pada penggunaan PPI dibandingkan dengan H2 antagonis. Sebesar 5-10% pasien yang menggunakan PPI secara kronik level gastrinnya meningkat sampai >500 ng/L. Keadaan hipergastrinemia ini dapat menyebabkan rebound hipersekresi asam lambung pada penghentian terapi PPI yang akibatnya dapat menginduksi tumor gastrointestinal (Tanu, 2007).
2.6.6 Interaksi obat
PPI dapat mempengaruhi eliminasi beberapa obat yang mempunyai jalur metabolisme yang sama dengannya antara lain warfarin (esomeprazol, lansoprazol,
omeprazol dan rabeprazol), diazepam (esomeprazol, omeprazol) dan siklosporin (omeprazol dan rabeprazol). Di antara PPI hanya omeprazol yang dapat menghambat aktivitas enzim CYP2C19 (sehingga menurunkan klirens disulfiram, fenitoin dan beberapa obat lain yang dimetabolisme oleh enzim tersebut) serta menginduksi CYP1A2 (sehingga meningkatkan klirens imipramin, beberapa obat antipsikotik, takrin dan teofilin) (Tanu, 2007).