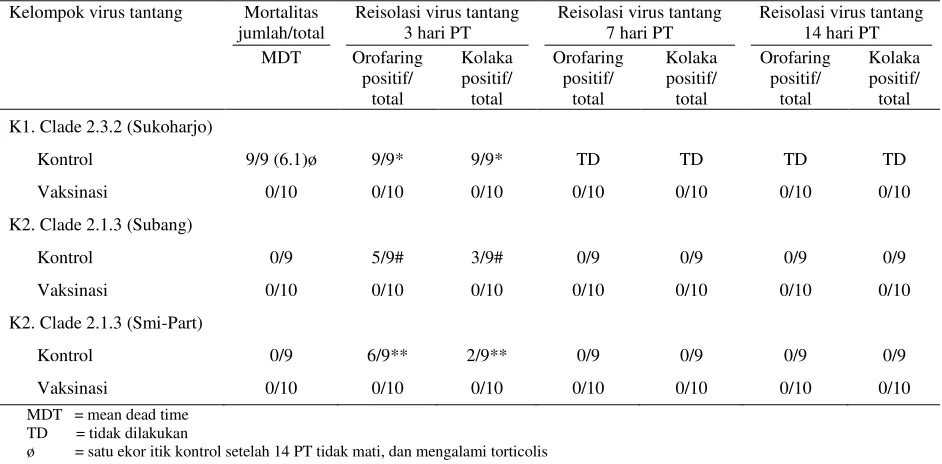
Prototipe Virus ADuckSukoharjoBbvw-1428-92012 Sebagai Kandidat Vaksin AI Subtipe H5N1 Clade 2.3.2 pada Itik Lokal
Teks penuh
Gambar

Dokumen terkait
Budući da se realno zavarivanje provodilo na konstrukcijskom čeliku S355, potrebno je komponentama osnovnog materijala, „SHEET1_COMPO“ i „SHEET2_COMPO“ , pridodati
Audit kinerja merupakan suatu proses yang sistematis untuk memperoleh dan mengevaluasi bukti secara obyektif, agar dapat melakukan penilaian secara independen atas
Proses pendidikan memiliki sejumlah tujuan yang ingin dicapai. berdasarkan tujuan–tujuan inilah, semua kegiatan dirancang untuk memfasilitasi siswa dalam memperoleh
Bimbingan di SD lebih banyak melibatkan orang tua murid, mengingat pentingnya pengaruh orang tua dalam kehidupan anak selama di SD, Bimbingan di sekolah dasr hendaknya
Menejeman adalah aktivitas mengatur kegiatan organisasi layanan bimbingan dan konseling dalam rangka mencapai tujuan bimnbingan dan konseling yang ditetapkan sebagai
Pengujian dilakukan sama seperti pengujian aktivitas antioksidan pada ekstrak kulit buah jeruk keprok, tetapi sampel yang digunakan adalah sediaan splash mask berupa
Ilmu-ilmu hayati yang memiliki obyek kompleks dan awal perkembangannya merupakan bidang kajian diskriptif, tetap sarat dengan bahasan ilmiah yang bersifat Newtonian dan
Kegiatan ini dilakukan dengan tujuan mengetahui efektifitas penggunaan ikan sebagai biokatalisator pada kolam pembesaran udang galah, sedang target yang ingin dicapai adalah