PENUNTUN PRAKTIKUM
MIKROBIOLOGI
A K U A T I K
Oleh:
Dr. Ir. YUNILAS, M.P
Dr. ERI YUSNI, MSc
FAKULTAS PERTANIAN
LATIHAN 1
PENGENALAN ALAT
Tujuan:
1. Mengenal bermacam-macam peralatan yang digunakan dalam praktikum mikrobiologi.
2. Mengetahui fungsi dari peralatan yang digunakan secara benar.
Pendahuluan
Mikrobiologi merupakan suatu ilmu yang mempelajari tentang kehidupan
mikroorganisme meliputi morfologi, struktur, fungsi serta metabolisme yang dilakukan
dalam proses kelangsungan hidupnya yang tidak dapat dilihat dengan mata telanjang.
Dibutuhkan peralatan khusus yang mendukung untuk tercapainya tujuan dalam
pengamatan mikroorganisme.
Peralatan yang digunakan haruslah dalam keadaan steril atau bebas dari kuman,
bakteri, virus dan jamur. Perlu adanya pengetahuan tentang cara – cara atau teknik sterilisasi. Hal ini dilakukan karena alat – alat yang digunakan memiliki teknik sterilisasi yang berbeda (Dwidjoseputro, 2003).
Sebelum melakukan praktikum, terlebih dahulu kita harus mengenal atau
mengetahui tentang peralatan yang digunakan dalam melakukan praktikum tersebut.
Hal ini berguna untuk mempermudah kita dalam melaksanakan percobaan, sehingga
resiko kecelakaan di laboratorium dapat ditanggulangi. Kebersihan dan kesempurnaan
alat sangat penting untuk bekerja di laboratorium. Alat yang kelihatan secara kasat
mata, belum tentu bersih, tergantung pada pemahaman seorang analis mengenai apa
artinya bersih. Alat kaca seperti gelas piala atau erlenmeyer paling baik dibersihkan
dengan sabun atau deterjen sintetik. Pipet, buret, dan labu volumetrik mungkin
memerlukan larutan deterjen panas untuk bisa bersih benar (Day dan Underwood,
1998).
Prosedur Kerja
Peralatan yang digunakan dalam praktikum laboratorium mikrobiologi aukuatik
meliputi:
1. Ose / Jarum Inokulum (inoculating loop)
Ose/ jarum merupakan jarum inoculum yang terbuat dari kawat nichrome atau platinum, digunakan untuk menginokulasi mikrobia dari suatu media ke media lainnya. Jarum inokulasi terbuat dalam dua bentuk yaitu bentuk ujung jarum yang berbentuk lingkaran (loop) dan disebut ose atau inoculating loop/transfer loop, dan yang berbentuk lurus disebut inoculating needle/Transfer needle. Bentuk jarum ose (inoculating loop) digunakan untuk melakukan streak di permukaan agar, sedangkan inoculating needle digunakan untuk inokulasi secara tusukan pada agar tegak (stab inoculating). Jarum inokulum berfungsi untuk memindahkan biakan mikroorganisme untuk ditanam/ditumbuhkan ke media baru.
2. Tabung reaksi (Reaction Tube / Test Tube)
Tabung reaksi merupakan peralatan kaca yang berfungsi sebagai wadah untuk pengenceran, menumbuhkan mikroba dan pengujian biokimiawi. Tabung reaksi terbuat dari dua macam model yaitu ada yang memiliki tutup dan ada yang tidak. Tabung reaksi yang tidak memiliki tutup sebagai gantinya dapat ditutup dengan kapas, metal, plastik atau aluminium foil. Tabung reaksi digunakan sebagai wadah yang diisi media padat, semi padat dan cair. Tabung reaksi diisi media padat dalam bentuk media agar tegak
(deep tube agar) dan agar miring (slants agar).
3. Cawan Petri (Petri Dish)
Cawan petri merupakan wadah yang berfungsi untuk kegiatan isolasi, pemurnian dan membiakkan (kultivasi) mikroorganisme. Cawan petri terdiri dari berbagai ukuran diameter. Cawan dengan diameter 15 cm dapat menampung media sebanyak 15-20 ml, sedangkan cawan berdiameter 9 cm dapat diisi media sebanyak 10 ml.
4. Mikropipet (Micropippete) dan Tip
pengambilannya (adjustable volume pipette) antara 1μl sampai 20 μl, atau mikropipet yang tidak bisa diatur volumenya, hanya tersedia satu pilihan volume (fixed volume
pipette) misalnya mikropipet 5 μl. Dalam penggunaannya, mikropipet memerlukan tip.
5. Gelas ukur (Graduated Cylinder)
Gelas ukur berfungsi untuk mengukur volume suatu cairan, seperti labu erlenmeyer, gelas ukur memiliki beberapa pilihan berdasarkan skala volumenya.
6. Labu Erlenmeyer (Erlenmeyer Flask)
Labu erlenmeyar berfungsi untuk menampung larutan, bahan atau cairan Labu Erlenmeyer juga dapat digunakan untuk meracik dan menghomogenkan bahan-bahan sebagai penyusun komposisi media, menampung akuades, kultivasi mikroba dalam kultur cair, dll. Ukuran erlenmeyer beragam sesuai dengan kebutuhan volume cairan yang akan digunakan. Volume cairan yang dapat ditampungnya yaitu 25 ml, 50 ml, 100 ml, 250 ml, 300 ml, 500 ml, 1000 ml, dsb.
7. Beaker Glass
Beaker glass merupakan alat yang memiliki banyak fungsi. Beaker glass dapat digunakan untuk preparasi media, menampung akuades dll.
8. Batang L (L Rod) disebut juga spreader.
Batang L berfungsi dalam isolasi dan pembiakan mikroba yaitu untuk menyebarkan cairan di permukaan media supaya mikroba yang tersuspensi dalam cairan tersebut tersebar merata.
9. Tabung Durham (Durham Tube)
10.Termometer (thermometer)
Termometer berfungsi untuk mengukur suhu suatu larutan atau ruang inkubator. Prinsip kerjanya yaitu mengukur suhu sesuai laju air raksa di dalam thermometer. Termometer adalah batang kaca yang panjangnya 300 mm, diameter 6-7 mm berisi air raksa dan gas, serta dilengkapi dengan skala derajat Celcius.
Apparatus
1. Autoklaf (Autoclave)
Autoklaf merupakan alat pemanas yang digunakan untuk mensterilisasi suatu alat atau bahan menggunakan uap bersuhu dan bertekanan tinggi (1210C, 15 lbs) selama kurang lebih 15 menit. Suhu yang tinggi akan membunuh microorganisme. Autoklaf ditujukan untuk membunuh endospora, yaitu sel resisten yang diproduksi oleh bakteri, tahan terhadap pemanasan, kekeringan, dan antibiotik. Endospora dapat dibunuh pada suhu 100 °C, yang merupakan titik didih air pada tekanan atmosfer normal. Pada suhu 121 °C, endospora dapat dibunuh dalam waktu 4-5 menit, dimana sel vegetatif bakteri dapat dibunuh hanya dalam waktu 6-30 detik pada suhu 65 °C. Perhitungan waktu sterilisasi autoklaf dimulai ketika suhu di dalam autoklaf mencapai 121 °C. Jika objek yang disterilisasi cukup tebal atau banyak, transfer panas pada bagian dalam autoklaf akan melambat, sehingga terjadi perpanjangan waktu pemanasan total untuk
memastikan bahwa semua objek bersuhu 121 °C untuk waktu 10-15 menit. Perpanjangan waktu juga dibutuhkan ketika cairan dalam volume besar akan diautoklaf karena volume yang besar membutuhkan waktu yang lebih lama untuk mencapai suhu sterilisasi.
2. Oven
Oven berfungsi untuk sterilisasi kering. Alat-alat yang disterilkan menggunakan oven antara lain peralatan gelas seperti cawan petri, tabung reaksi, dll. Sterilisasi kering dengan oven dilakukan dengan cara memanaskan pada suhu 180oC selama 1 jam.
Hot plate stirrer dan Stirrer bar (magnetic stirrer) berfungsi untuk menghomogenkan suatu larutan dengan pengadukan. Pelat (plate) yang terdapat dalam
alat ini dapat dipanaskan sehingga mampu mempercepat proses homogenisasi. Pengadukan dengan bantuan batang magnet Hot plate dan magnetic stirrer seri SBS-100 dari SBS® misalnya mampu menghomogenkan sampai 10 L, dengan kecepatan sangat lambat sampai 1600 rpm dan dapat dipanaskan sampai 425oC.
4. Pembakar Bunsen (Bunsen Burner)
Bunsen adalah salah satu alat yang berfungsi untuk mensteril. Api yang menyala dapat membuat aliran udara karena oksigen dikonsumsi dari bawah dan diharapkan kontaminan ikut terbakar dalam pola aliran udara tersebut. Dalam sterilisasi jarum ose atau yang lain, bagian api yang paling cocok untuk memijarkannya adalah bagian api yang berwarna biru (paling panas).
5. Inkubator (Incubator)
Inkubator adalah alat untuk menginkubasi atau memeram mikroba pada suhu yang terkontrol. Alat ini dilengkapi dengan pengatur suhu dan pengatur waktu.
6. Penangas air (Water bath)
Penangas air berfungsi untuk menyimpan media agar (yang digunakan untuk analisa dengan teknik tuang/pure plate ) supaya media tetap dalam kondisi leleh/cair,
bisanya suhu diatur pada kisaran 40-45oC. Untuk menjaga air pada penangas air tidak terkontaminasi mikro organisme maka perlu ditambahkan citric acid 0.3% dan potassium sorbat 0.1%.
7. pH Meter
pH meter berfungsi untuk mencek derajat keasaman/pH media, karena derajat keasaman sangan berpengaruh terhadap pertumbuhan mikroba.
8. Timbangan digital / neraca digital
Biological Safety Cabinet (BSC) atau disebut juga Laminar Air Flow (LAF) adalah alat yang berguna untuk bekerja secara aseptis karena BSC mempunyai pola
pengaturan dan penyaring aliran udara sehingga menjadi steril dan aplikasisinar UV beberapa jam sebelum digunakan.
10. Colony counter
Colony counter adalah alat yang berfungsi untuk mempermudah perhitungan koloni yang tumbuh setelah diinkubasi di dalam cawan karena adanya kaca pembesar. Selain itu alat tersebut dilengkapi dengan skala/ kuadran yang sangat berguna untuk pengamatan pertumbuhan koloni sangat banyak. Jumlah koloni pada cawan Petri dapat ditandai dan dihitung otomatis yang dapat di-reset.
11. Mikroskop Cahaya (Brightfield Microscope)
Mikroskop Cahaya merupakan salah satu alat untuk melihat sel mikroorganisme. Kita dapat mengamati sel bakteri yang tidak dapat dilihat dengan mata telanjang. Pada umumnya mata tidak mampu membedakan benda dengan diameter lebih kecil dari 0,1 mm.
12. Mikroskop stereo (Zoom Stereo Microscope)
Mikroskop ini berfungsi untuk melihat objek yang membutuhkan perbesaran tidak terlalu besar. Di Laboratorium Mikrobiologi, mikroskop stereo biasanya
digunakan untuk mengamati secara detail bentuk koloni dan jamur.
Alat-alat lain yang perlu diketahui di laboratorium mikrobiologi: pelobang sumuran, haemositometer, kaca obyek, kaca obyek cekung, shaker incubator, shaker resiprok, vortex, glass pin, kaca penutup, pinset, gelas arloji, disk blank, disk antibiotik, filter bakteri, tabung Durham.
Pertanyaan:
1. Jelaskan berbagai peralatan yang digunakan beserta fungsinya dalam praktikum mikrobiologi!
2. Coba jelaskan prinsip kerja alat autoclave!
LATIHAN 1
PENGENALAN PERALATAN LABORATORIUM MIKROBIOLOGI
Nama/NIM :
Fakultas/Program Studi : Hari/Tanggal : Group/Kelompok :
LATIHAN 2
STERILISASI
Tujuan:
1. Mengetahui beberapa metode sterilisasi alat dan bahan dalam pengamatan mikrobiologis.
2. Mengetahui perbedaan metode sterilisasi serta dapat melakukannya sesuai prosedur.
Pendahuluan
Sterilisasi merupakan suatu proses pembebasan bahan atau alat dari semua bentuk organism hidup. Berdasarkan alat yang digunakan maka sterilisasi ada dikelompokan atas 2 yaitu sterilisasi basah dan sterilisasi kering. Sterilisasi basah menggunakan autoclave, umumnya yang disterilkan bahan-bahan mengandung air seperti media, aquades atau larutan lainnya. Sedangkan sterilisasi kering menggunakan oven, umumnya yang disterilkan peralatan peralat seperti tabung reaksi, cawan petri dll. Berdasarkan prosedur kerja maka sterilisasi dibedakan atas sterilisasi secara fisik, mekanik dan kimiawi. Sterilisasi secara fisik adalah sterilisasi yang dilakukan dengan pemanasan dan penyinaran. Pemanasan (pembakaran) secara langsung seperti pemanasan jarum ose atau pinset, pemanasan kering dengan menggunakan oven. Sterilisasi secara kimiawi dengan cara menyemprot atau membilas alat dengan desinfektan dan anti septik. Sedangkan sterilisasi secara mekanik adalah sterilisasi menggunakan saringan berpori sangat kecil antara 0.22 mikron sampai 0.45 mikron sehingga mikroba tertahan pada saringan biasa disebut sebagai sterilisasi mekanik. Cara ini biasanya dilakukan untuk sterilisasi bahan yang tidak tahan atau peka terhadap panas seperti antibiotik ataupun senyawa enzim.
Berbagai metode sterilisasi
1. Sterisasi Fisik
a. Pemanasan basah menggunakan autoclave
- Pemanasan melalui penguapan (uap air) menggunakan autoclave pada suhu 1210C dengan tekanan 15 psi/2 atm selama 15 menit:
- Merebus (boiling)
- HTST (high temperature short time): pemanasan pada suhu 720C selama 15 detik
- LTLT (low temperature short time): pemanasan pada suhu 650C selama 30 menit
b. Pemanasan kering dengan pembakaran atau penggunaan oven
- Pembakaran (incenerasi)
- Pemanasan menggunakan oven dengan adanya udara panas pada suhu 1800C selama 2 jam atau pada suhu 2100C selama 30 menit
c. Radiasi (dengan sinar ultra violet)
2. Secara Kimia
a. Penggunaan desinfektan dan anti septik b. Penggunaan pengawet
c. Penggunaan antibiotic
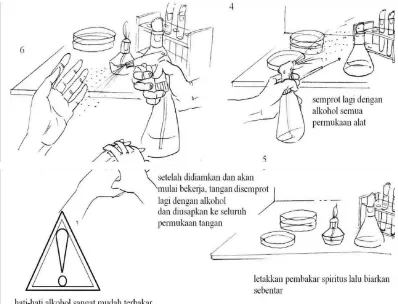
Gambar 2. Sterilkan meja kerja sebelum melakukan kegiatan
3. Secara Mekanik
Filtrasi (penyaringan cairan atau penyaringan udara)
Pelaksanaan Praktikum:
Bahan dan Alat
Bahan : Aquadesh, alkohol 70%, spritus, aluminium foil, kapas, plastik, kertas label, lakban bening, selotip, serbet/lap tangan, tali (benang bola), tisu gulung, kain kasa steril, kapas, kertas minyak/layang-layang, wipol (desinfektan).
Prosedur Kerja
a. Sterilisasi Kering (menggunakan oven)
1. Peralan kaca seperti awan petri dan tabung reaksi dicuci bersih lalu mengeringkan peralatan
2. Peralatan kaca tersebut dibungkus dengan kertas minyak/layang-layang
3. Peralatan yang sudah dibungkus dimasukan kedalam oven lalu atur suhu 1800C selama 2 jam atau pada suhu 210 0C selama 30 menit
4. Tekan tombol power
5. Setelah 2 jam atau 30 menit (tergantung suhu yang digunakan), turunkan suhu dan matikan tombol power.
6. Setelah suhu turun, peralatan yang telah disterilkan tersebut diambil dan dikeluarkan dari dalam oven lalu diletakkan di tempat yang bersih.
b. Sterilisasi Basah (menggunakan autoklaf)
1. Peralatan dan media yang akan disterilkan dibungkus dengan kertas minyak/layang-layang aluminium poil dan plastic tahan panas
2. Masukkan semua alat dan media yang sudah disiapkan ke dalam keranjang dan masukkan ke dalam autoclave
3. Tutup dengan rapat dan kunci pintu autoklaf 4. Tekan tombol On
5. Atur suhu 1210C pada tekanan 15 psi (2 atm) selama 15 menit
6. Tekan tombol Enter, sterilisasi akan berakhir pada saat alaram berbunyi. 7. Tekan tombol off, biarkan beberapa menit sampai suhu dalam autoklaf turun. 8. Buka pintu autoklaf dan keluarkan alat dan bahan yang telah disterilkan tadi. c. Sterilisasi Kimiawi
1. Peralatan cawan petri dan gelas obyek (terbuat dari bahan gelas) dicuci hingga bersih lalu dikeringkan peralatan dengan kain lap halus.
2. Siapkan larutan alkohol (70%). 3. Siapkan kapas steril.
Kerja Aseptis:
1. Sebelum mulai kerja tangan disemprot dengan alcohol 70%
2. Lingkungan kerja, meja disemprot dengan alcohol
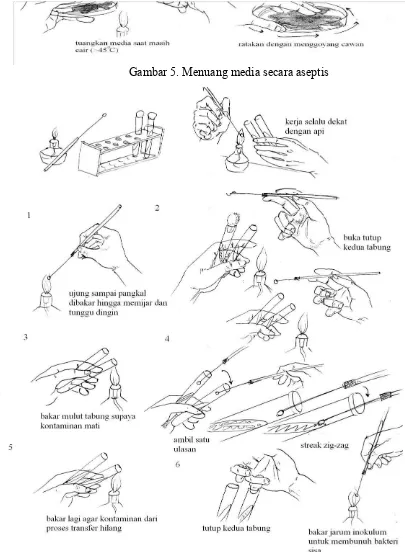
3. Peralatan dan bahan yang sudah disterilkan seperti tabung/cawan/Erlenmeyer sebaikknya bagian mulut (bagian yang memungkinkan kontaminasi masuk) dibakar/dilewatkan api terlebih dahulu.
4. Peralatan pinset, batang L, spider, dan lain-lain dapat disemprot alcohol terlebih dahulu lalu dibakar.
5. Jarum ose yang sudah dipijarkan harus ditunggu dingin dahulu atau dapat ditempelkan tutup cawan bagian dalam untuk mempercepat transfer panas yang terjadi.
6. Jika bekerja di ruang safety cabinet tidak perlu memakai pembakar bunsen tapi jika diluar safety cabinet maka semakin banyak sumber api maka semakin terjamin kondisi aseptisnya.
Pertanyaan:
1. Apa yang dimaksud dengan sterilisasi, steril dan sterilitas? 2. Mengapa peralatan yang akan digunakan harus disterilkan?
3. Jelaskan pengertian aseptic dan bagaimana prinsip kerja secara aseptic!
LATIHAN 3
MEMBUAT MEDIA PERTUMBUHAN
Tujuan:
1. Mengetahui berbagai jenis dan fungsi media. 2. Mengetahui cara membuat media pertumbuhan.
Pendahuluan
Media pertumbuhan mikroba dibutuhkan mulai dari proses isolasi sampai pada tahap pengamatan. Media pertumbuhan mikroorganisme adalah media yang mengandung berbagai zat-zat makanan (nutrisi) yang diperlukan mikrobia untuk pertumbuhan dan perkembangannya. Unsur-unsur tersebut terdiri dari unsur makro (C,H,O, N dan P) dan unsur mikro (Fe, Mg serta vitamin) dan bahan tambahan lainnya seperti phenol red yang berfungsi sebagai indikator kemasaman media dan antibiotik. Media pertumbuhan bagi mikrobia ini dapat bentuk media cair ataupun media padat.
Bahan penyusun media pertumbuhan mikroba umumnya terdiri dari bahan dasar seperti air sebagai pelarut dan agar atau gelatin ataupun silica gel yang berfungsi memadatkan media. Media pertumbuhan dibedakan juga berdasarkan sifat fisik, komposisi penyusunnya serta tujuan.
Macam-Macam Media Pertumbuhan 1. Media Berdasar Sifat Fisik
a. Media padat (solid) adalah media yang mengandung agar 1-2% sehingga setelah dingin media menjadi padat.
b. Media setengah padat (semi solid) adalah media yang mengandung agar 0.3 - 0.4% sehingga menjadi sedikit kenyal, tidak padat dan tidak begitu cair.
c. Media cair (liquid) adalah media yang tidak mengandung agar, contohnya adalah NB (nutrient broth), LB (lactose broth).
2. Media Berdasarkan Komposisi
b. Media semi sintesis adalah media yang sebagian komposisinya diketahui secara pasti, misalnya PDA (potato dextrose agar) yang mengandung agar, dekstrosa dan ekstrak kentang.
c. Media non sintesis adalah media yang dibuat dengan komposisi yang tidak dapat diketahui secara pasti dan biasanya langsung diekstrak dari bahan dasarnya, misalya tomato juice agar, brain heart infution agar, pancreatic.
3. Media Berdasarkan Tujuan
a. Media untuk isolasi: Media ini mengandung semua senyawa essensial untuk pertumbuhan mikroba, misalnya nutrient broth, blood agar.
b. Media selektif/penghambat: Media yang selain mengandung nutrisi juga ditambahn suatu zat tertentu sehingga media tersebut dapat menekan pertumbuhan mikroba lain dan merangsang pertumbuhan mikroba yang diinginkan, seperti Luria bertani medium yang ditambah amphisilin untuk merangsang e.coli, resisten antibiotic dan menghambat kontaminan yang peka.
c. Media diperkaya (enrichment): Media yang mengandung komponen dasar untuk pertumbuhan mikroba dan ditambah komponen kompleks seperti darah, serum, kuning telur. Media diperkaya juga bersifat selektif untuk mikroba tertentu. Bakteri yang tumbuh pada media ini tidak hanya membutuhkan nutrisi sederhana untuk berkembangbiak, tetapi membutuhkan komponen kompleks: blood tellurite agar, bile agar, serum agar.
d. Media untuk peremajaan kultur: Media umum atau spesifik yang digunakan untuk
peremajaan kultur.
e. Media untuk menentukan kebutuhan nutrisi spesifik: Media ini digunakan untuk mendiagnosis atau menganalisis metabolism suatu mikroba.
f. Media untuk karakterisasi bakteri: Media yang digunakan untuk mengetahui kemampuan spesifik suatu mikroba. Kadang-kadang indicator ditambahkan untuk menunjukkan adanya perubahan kimia.
g. Media differsial: bertujuan untuk mengidentifikasi mikroba dari campurannya berdasakan karakter spesifik yang ditunjukkan pada media diffential.
(kultur bakteri aerob) dan pH sesuai serta 4) Harus bebas dari mikroba lain dan steril.
Bahan dan Alat
Bahan : Aquadesh, Media Nutrien Agar (NA), Media Nutrien Broth (NB), Media PDA, Tryptone Soya Agar (TSA), kapas, kertas layang, plastik, alkohol 70%, spritus, kapas steril, aluminium foil, tissu, kertas label.
Alat: Lampu bunsen, cawan petri, tabung reaksi, erlenmeyer, timbangan, hot plate, stirer, batang pengaduk, spatula, autoklaf, beaker glas, jarum ose, mikro pipet, pinset, gelas ukur, rak tabung reaksi, botol aquades, botol semprot/spyer, timbangan digital, autoclave, oven, incubator, lemari pendingin/freezer, stirer, vortex.
Prosedur Kerja
A. Pembuatan Media Umum (Cara I):
1. Timbang media sesuai prosedur di kemasan. Media ditimbang secara hati-hati lalu masukkan kedalam Erlenmeyer
2. Media yang ada di erlemnmeyer ditambah aquades dan aduk sampai homogen dengan batang pengaduk
3. Setelah homogen media dipanaskan dengan hati-hati menggunakan penangas/elemen pemanas sambil diaduk sampai media tercampur homogen (ditunjukkan dengan warna yang kuning jernih). Perhatian: pada saat pemanasan jangan sampai terbentuk buih berlebihan sampai meluap!
4. Media dituangkan ke dalam tabung reaksi dengan volume tertentu menggunakan pipet volume: 5 ml untuk agar miring, 10 ml untuk agar tegak, lalu diautocklaf. Tutup tabung reaksi dengan penutup tabung (penutupan jangan terlalu rapat!)
5. Media NB dituangkan ke dalam tabung reaksi masing- masing tabung reaksi 8 ml. Tutup tabung reaksi dengan kapas atau penutup tabung (penutupan jangan
terlalu rapat!)
6. Sterilkan seluruh media dalam tabung reaksi tersebut dengan menggunakan
rak tabung dan biarkan memadat, media NA 5 ml inkubasikan miring dan biarkan memadat. Media sisa NA tuangkan dalam cawan petri dan biarkan
memadat. Media NA 15 ml dibiarkan sampai suhu 45-50oC (untuk isolasi mikroorganisme).
8. Media NB dalam tabung reaksi biarkan dingin. Seluruh media NA dan NB ini akan digunakan untuk percobaan selanjutnya.
Gambar 3. Pembuatan media agar
B. Pembuatan Media Umum (Cara II):
Bahan yang diperlukan antara lain: kentang sebanyak 100 gram, dektrosa 5 gram, aga 15 gram dan aquadest sebanyak 500 ml
Cara Kerja
1. Kentang dikupas dan iris, lalu cuci bersih dan selanjutnya direbus dengan aquadest selama 1-2 jam
2. Ekstrak kentang disaring menggunakan penyaring sampai 500 ml
3. Ekstrak kentang ditambah agar dan dektrosa, aduk hingga homogeny serta didihkan diatas kompor atau hot plate stirrer.
4. pH diatur hingga 5-6 dengan menambahkan HCl atau NaOH dan ukur dengan pH meter.
pinggan atau agar miring 6. Sterilkan media dengan autoklaf
Nutrien Broth (NB)
Komposisi untuk media NB sama dengan NA tetapi tidak memakai agar sebagai pemadat. Proses pembuatannyapun lebih sederhana, tidak memerlukan panas, peptone dan beef extract akan mudah larut sempurna pada air suhu kamar jika diaduk.
C. Pembuatan Media Selektif:
masing CMC, xylan, lignin dan manan), streptomisin 0,01 %, pH diatur 4,5.
Prosedur Kerja
1. Timbang semua bahan sesuai formulasinya, lalu masukkan kedalam Erlenmeyer 2. Media yang ada di erlemnmeyer ditambah aquades dan aduk sampai homogen
dengan batang pengaduk
3. Setelah homogen media dipanaskan dengan hati-hati menggunakan penangas/elemen pemanas sambil diaduk sampai media tercampur homogen 4. Media dituangkan ke dalam tabung reaksi dengan volume tertentu menggunakan
pipet volume: 5 ml untuk NA miring, 10 ml untuk NA tegak, lalu diautocklaf. Tutup tabung reaksi dengan penutup tabung (penutupan jangan terlalu rapat!)
5. Sterilkan seluruh media dalam tabung reaksi tersebut dengan menggunakan
Pertanyaan:
1. Jelaskan pengertian dan fungsi media pertumbuhan!
2. Mengapa media pertumbuhan yang akan digunakan harus disterilkan? 3. Jelaskan cara membuat media umum untuk pertumbuhan bakteri!
4. Pada pembuatan media selektif ada bahan tertentu dimasukkan, apa tujuan dari penambahan bahan tersebut?
Lembaran Pengamatan
LATIHAN 3
MEMBUAT MEDIA PERTUMBUHAN
Nama/NIM :
Fakultas/Program Studi : Hari/Tanggal : Group/Kelompok :
No. Nama Bahan Formula Metode Sterilisasi
LATIHAN 4
ISOLASI BAKTERI DARI LINGKUNGAN AKUATIK
Tujuan:
1. Mengetahui teknik mengisolasi bakteri dengan benar
2. Mengkarakteristik koloni bakteri yang diisolasi dari lingkungan aquatik
Pendahuluan
Mikroba ditemukan di alam dalam kondisi campuran dan hampir tidak
ditemukan sebagai spesies tunggal. Mereka melakukan aktivitas secara bersama-sama
dengan membentuk suatu hubungan yang saling bersinergis, simbiosis, suksesi, bahkan
ada yang bersifat antagonis. Untuk melakukan pengamatan terhadap mikroorganisme
biasanya diperlukan suatu teknik pemisahan spesis-spesis yang berbeda dari populasi
campuran atau biakan campuran menjadi spesies-spesies tunggal sebagai biakan murni.
Isolasi mikroorganisme adalah suatu upaya pemindahan mikroba diluar dari lingkungan alamiahnya untuk mendapatkan biakan murni. Pemisahan mikroorganisme dari lingkungan bertujuan untuk memperoleh biakan murni yang sudah tidak bercampur lagi dengan mikroba lainnya. Prinsip dari isolasi mikroba adalah memisahkan satu jenis
mikroba dengan mikroba lainnya yang terdapat pada suatu substrat atau lingkungan sekitarnya. Sehingga dalam mempelajari ilmu mikroorganisme kita harus mengerti dan memahami bagaimana mendapatkan mikroba murni dengan cara mengisolasi dan memisahkan mikrobia tersebut sesuai dengan tujuannya. Melalui isolasi kita dapat mempelajari morfologi, biologi ataupun karakteristik mikrobia tersebut.
Sifat hidup bakteri secara umum adalah sapotrofik pada sisa buangan hewan
ataupun tanaman yang sudah mati, tetapi banyak juga parasitik pada hewan, manusia,
dan tanaman dengan menyebabkan banyak penyakit (Suriawiria 2008). Menurut
Waluyo (2007), pengamatan bekteri dapat dilakukan secara individual, satu per satu,
Bentuk koloni berbeda-beda untuk setiap spesies, dan bentuk tersebut merupakan ciri
khas bagi suatu spesies tertentu.
Beberapa faktor yang perlu diperhatikan dalam melakukan isolasi mikroba yaitu antara lain: sifat setiap jenis mikroba yang akan diisolasi, tempat hidup atau asal mikroba tersebut, medium pertumbuhan yang sesuai, cara menginokulasi mikroba, cara menginkubasi mikroba, cara menguji bahwa mikroba yang diisolasi telah berupa kultur murni dan sesuai dengan yang dimaksud dan cara memelihara agar mikroba yang telah diisolasi tetap merupakan kultur murni.
Bahan dan Alat:
Bahan : Sampel sumber isolat berupa air kolam, air laut atau air di daerah rawa-rawa, Aquadesh, Media Nutrien Agar (NA), media agar seletif dimodifikasi (Yunilas, 2013), kapas, kertas layang, plastik, alkohol 70%, spritus, aluminium foil, tissu, kertas label,
Alat: Lampu Bunsen, cawan petri, tabung reaksi, erlenmeyer, pipet volumetrik, timbangan, botol sampel, hot plate, stirer, batang pengaduk, spatula, autoklaf, ikubator.
Prosedur Kerja:
1. Sampel air kolam diambil dengan menggunakan botol steril. Botol yang telah berisi
air hasil sampling dimasukkan ke dalam coolbox untuk menjaga agar bakteri tidak mati kemudian dibawa ke laboratorium untuk dianalisis.
2. Sampel dipindahkan ke tabung reaksi steril setelah sampai dilaboratorium
3. Siapkan media agar selektif, lalu lakukan isolasi menggunakan metode goresan pada media agar dengan cara membakar jarum ose supaya steril dan kemudian dicelup pada sampel air.
4. Jarum yang telah di celup digoreskan pada media agar selektif.
5. Koloni yang tumbuh diamati morfologinya meliputi bentuk, elevasi, tepi dan warna koloni.
6. Koloni bakteri yang sudah tumbuh pada medium agar umum (selektif) dipindahkan lagi ke medium yang baru untuk mendapatkan isolate murni.
7. Pemurnian dilakukan sampai diperoleh koloni tunggal menggunakan metode cawan gores (streak plate). Isolat murni yang telah diperoleh disimpan di dalam agar miring Nutrient Agar (NA).
Pertanyaan:
1. Coba jelaskan pengertian isolasi dan inokulasi!
2. Jelaskan metode yang dapat dilakukan dalam inokulasi!
Lembaran Pengamatan
LATIHAN 4
ISOLASI BAKTERI DARI LINGKUNGAN AQUATIK
Nama/NIM :
Fakultas/Program Studi : Hari/Tanggal : Group/Kelompok :
Hasil dan Pengamatan MorfolobiKoloni Bakteri
LATIHAN 5
TEKNIK BIAKAN MURNI
Tujuan:
1. Mengetahui prinsip dasar teknik biakan
2. Mendapatkan 1 jenis mikroorganisme yang diinginkan
Pendahuluan
Teknik biakan murni pertama kali dilakukan oleh Robert Koch pada tahun 1843
– 1910, seorang ahli kebangsaan Jerman. Bakteri yang dimurnikan adalah bakteri Bacillus anthracis penyebab penyakit antrax pada sapi dan domba di Eropa pada saat itu. Biakan murni adalah biakan yang hanya terdiri dari satu jenis mikroorganisme, sedangkan biakan campuran adalah biakan yang terdiri dari berbagai jenis mikroorganisme.
Biakan murni dari suatu biakan campuran dapat diperoleh dengan beberapa metode. Biakan murni diperlukan dalam berbagai metode mikrobiologis, antara lain digunakan dalam mengidentifikasi mikroba. Untuk mengamati ciri-ciri kultural
Gambar 5. Menuang media secara aseptis
Gambar 6. Memindahkan biakan secara aseptis
Metode Teknik Biakan Murni
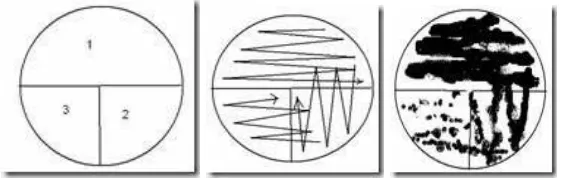
1. Metode cawan gores (streak plate method)
metode cawan gores yang dilaksanakan dengan baik kebanyakan akan menyebabkan terisolasinya mikroorganisme yang diinginkan. Ada beberapa tipe goresan yaitu:
sinambung, radian, kuadran dan goresan T.
Gambar 7. Streak PlateMethod secara Goresan Sinambung
Gambar 8. Streak Plate Method secara Goresan T
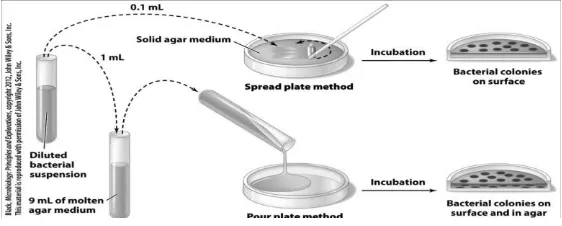
2. Metode cawan sebar (spread plate method)
Gambar 9. Metode agar sebar dan agar tuang 3. Metode cawan tuang (pour plate method)
Cara ini dasarnya ialah menginokulasi medium agar yang sedang mencair pada
temperatur 45-50oC dengan suspensi bahan yang mengandung mikroba, dan menuangkannya ke dalam cawan petri steril. Setelah inkubasi akan terlihat koloni-koloni yang tersebar di permukaan agar yang mungkin berasal dari 1 sel bakteri, sehingga dapat diisolasi lebih lanjut.
Bahan dan Alat
Bahan:
Media NA, PDA, kultur bakteri, kultur jamur, wipol, alcohol.
Alat:
Cawan petri, tabung reaksi, pipet serologi, propipet, jarum ose noddle, hockey stick, spatula, vortex, lampu Bunsen, Incubator, Pemanas air.
Prosedur Kerja:
1) Metode Cawan Gores
1. Tuang media agar NA cair ke dalam cawan petri secara aseptis, lalu biarkan memadat.
2. Inokulasi satu ose bakteri dari biakan campuran ke dalam media NA tadi dengan cara menggores sesuai tipe goresan yang diinginkan (radian, kuadran, sinambung, tipe goresan T).
3. Media NA yang telah diinokulasi, dibungkus dengan kertas pembungkus, selanjutnya diinkubasi selama 24 jam pada suhu 37 0C.
4. Amati pertumbuhan bakterinya! b) Metode Cawan Tuang
ke tabung reaksi berisi aquadest steril, kemudian lakukan seri pengeceran 10-2. 2. Ambil sebanyak 0,1-1mL dan diinokulasi ke dalam media agar NA cair suhu
berkisar 45-500C.
3. Media NA yang sudah diinokulasi tersebut di vortex supaya homogen. 4. Tuang media NA tersebut ke dalam cawan petri secara aseptis.
5. Ratakan dengan cara memutar membentuk angka delapan, lalu dibiarkan memadat.
6. Bungkus media agar NA tersebut dengan kertas pembungkus, selanjutnya diinkubasi selama 24 jam pada suhu 37 0C.
7. Amati pertumbuhan bakterinya!
c) Metode Cawan Sebar
1. Tuang media agar NA cair ke dalam cawan petri secara aseptis, lalu biarkan memadat.
2. Siapkan 3 tabung masing masing berisi 10 mL, 9 mL dan 9 mL aquadest.
3. Ambil 1 ose koloni bakteri dari biakan campuran secara aseptis lalu dimasukan ke tabung reaksi berisi aquadest steril 10 ml, kemudian lakukan seri pengeceran dan dihomogen dengan vortex, hasilnya disebut suspensi.
4. Ambil 1 ml suspense kemudian diinokulasi pada tabung reaksi kedua berisi 9 mL aquadest, demikian juga pada tabung selanjutnya.
5. Hasil pengenceran dari tabung 2 dan 3 diambil masing-masing sebanyak 0,1 mL dan diinokulasi ke dalam media agar NA yang telah memadat tadi.
6. Hockey stickdisterilkan dengan cara dicelup pada alcohol dan dibakar.
7. Tebarkan/sebarkan kultur bakteri dengan hockey sticksecara merata dan biarkan sampai permukaan agar mengering.
8. Setelah mengering, bungkus dengan kertas pembungkus, selanjutnya diinkubasi selama 24 jam pada suhu 37 0C.
9. Amati pertumbuhan bakterinya!
d) Teknik Biakan Murni untuk jamur/fungi
aseptis ke dalam media PDA dengan cara menotolkannya pada permukaan media.
3. Bungkus dengan kertas pembungkus, selanjutnya diinkubasi selama 24-48 jam pada suhu ruang atau 29 0C.
4. Amati pertumbuhan koloni fungi/jamur!
Pertanyaan:
1. Jelaskan tujuan melakukan biakan murni!
2. Jelaskan beberapa metode yang dapat dilakukan dalam biakan murni!
Lembaran Pengamatan
LATIHAN 5
TEKNIK BIAKAN MURNI
Nama/NIM :
Fakultas/Program Studi : Hari/Tanggal : Group/Kelompok :
No. Kode Isolate
LATIHAN 6
PENGAMATAN MORFOLOGI PROTOZOA
Tujuan:
1. Mengetahui morfologi protozo dari sampel air
2. Mengidentifikasi spesies protozoa dari sampel air
Pendahuluan
Protozoa (protista) adalah hewan bersel satu, berinti sejati dan tidak memiliki dinding sel. Bentuk tubuh setiap protozoa berbeda-beda antara satu dengan yang lainnya, pada fase yang berbeda dalam siklus hidupnya. Berdasarkan pergerakannya, protozoa dikelompokkan atas yaitu Flagellata (bergerak menggunakan flagel, misalnya Trypanosoma dan Tricomanas), Rhizopoda (bergerak dengan pseudopodia atau kaki semu, misalnya Amoeba), Ciliata (bergerak dengan cilia atau rambut getar, misalnya Paramecium), dan Sporozoa (tidak memiliki alat gerak, misalnya Plasmodium Sp.).
Pada umumnya protozoa hidup soliter pada habitat yang beragam. Sebagian besar hidup di air laut atau air tawar, misalnya di selokan, kolam, sungai, danau, rawa ataupun genangan air. Disamping itu, ada juga yang hidup di tanah, pohon dan batu. Protozoa berperan sebagai pengendalikan populasi bakteri dengan jalan memangsa bakteri sebagai makanannya, sehingga dapat mengontrol jumlah populasi Bakteri di
alam. Sebagian protozoa berperan sebagai plankton (zooplankton) dan benthos yang
menjadi makanan hewan air, terutama udang, kepiting, ikan, dll. Fosil Foraminifera
menjadi petunjuk sumber minyak, gas, dan mineral.
Bahan dan Alat
Bahan: air kolam ikan, air kolam udang, air rawa
Alat: Mikroskop, Object Glass, Cover Glass, Handscone, Masker (b/p), Pipet tetes, Tissue
Prosedur Kerja
1. Ambillah sample dengan pipet tetes.
2. Teteskan pada object glass yang bersih. Kemudian tutup dengan cover glass.
3. Amatilah dibawah mikroskop dengan pembesaran 100x dan temukan protozoa apa saja yang ada
4. Catat hasil pengamatan, di gambar atau difoto.
Lembaran Pengamatan
LATIHAN 6
PENGAMATAN MORFOLOGI PROTOZOA
Nama/NIM :
Fakultas/Program Studi : Hari/Tanggal : Group/Kelompok :
LATIHAN 7
ISOLASI DAN IDENTIFIKASI BAKTERI PATOGEN
Tujuan:
1. Mahasiswa mampu mengisolasi bakteri pathogen dari ikan 2. Mahasiswa mampu meidentifikasi bakteri pathogen dari ikan
Pendahuluan
Penyakit pada ikan timbul karena adanya interaksi yang tidak seimbang antara inang dan lingkungannya. Kondisi ikan yang stres, kekurangan gizi, dan pemberian pakan yang berlebihan juga dapat menyebabkan penyakit pada ikan. Ikan budidaya sangat rentan terhadap infeksi mikroorganisme patogen seperti virus, bakteri, jamur dan parasit. Penularan bisa melalui air, ikan yang terkena penyakit, pakan, wadah budidaya, dan peralatan.
Penyakit yang disebabkan oleh bakteri memperlihatkan gejala-gejala seperti kehilangan nafsu makan, luka-luka pada permukaan tubuh, pendarahan pada insang, perut membesar berisi cairan, sisik lepas, sirip ekor lepas, jika dilakukan pembedahan akan terlihat pembengkakan dan kerusakan pada hati, ginjal dan limpa. Isolasi bakteri penting dilakukan agar dapat dilakukan upaya-upaya pencegahan terhadap serangan penyakit tersebut. Disamping itu perlu dilakukan uji biokimiawi untuk mengetahui reaksi kimia yang terjadi di dalam tubuh mikroorganisme. Hasil uji biokimiawi dapat digunakan untuk mengidentifikasi suatu mikroorganisme.
medium Tryptone Soya Agar (TSA), aquades steril, alkohol 70%, kapas, kertas label, kain kasa, alumunium foil dan zat untuk pewarnaan sel bakteri seperti kristal violet, iodin, alkohol aseton, dan safranin.
Alat yang digunakan pada penelitian ini adalah alat tulis, termometer, timbangan analitik, pH meter, cawan petri, tabung reaksi, gelas ukur, object glass, bunsen, laminar air flow, labu Erlenmeyer, autoclave, pipet tetes, hand spray, sarung tangan, masker, oven, inkubator, mikroskop, jarum ose, alat-alat bedah dan Alat untuk pengukuran kualitas air meliputi: pH meter, DO meter, termometer, refrakto meter.
Prosedur Kerja
Isolasi
Sumber isolat adalah permukaan kulit ikan dan ginjal. Isolasi dilakukan dengan mengambil lendir di luka pada permukaan kulit ikan menggunakan jarum ose steril kemudian menggoreskan ke media TSA 2% secara zig zag. Hasil isolasi bakteri.
Inkubasi pada suhu antara 26-30oC selama 24-48 jam.
Prngamatan morfologi koloni yang tumbuh (warna, bentuk, tepian, permukaan
koloni/(elevasi). Inoulasi secara berulang pada media tumbuh bakteri (media TSA 2%).
Identifikasi
Prosedur pewarnaan bakteri yaitu membuat ulasan bakteri pada objek glass
(freparat ulas) difiksasi diatas api.
Lakukan pewarnaan dengan larutan kristal violet, larutan lugol, alkohol 95% dan safranin.
Preparat yang sudah kering kemudian ditetesi dengan minyak imersi untuk
diamati menggunakan mikroskop dengan perbesaran 1000x.
Uji biokimia yang dapat dilakukan meliputi: katalase, oksidase, O/F, MIO, TSIA, gelatin, LIA, MR-VP, Citrate dan uji gula.
Kualitas air
Pengamatan kualitas air meliputi: suhu, pH, oksigen terlarut, amonia dan salinitas menggunakan termometer, pH meter, DO meter, dan refraktometer.
LATIHAN 7
ISOLASI DAN IDENTIFIKASI BAKTERI PATOGEN
Nama/NIM :
Fakultas/Program Studi : Hari/Tanggal : Group/Kelompok :
No. Sampel Jumlah pH Suhu Oksigen terlarut
DAFTAR PUSTAKA
Alexopoulos,C.J and Mims,C.W. 1979. Introductory Mycology, 3rd Edition. John-wiley and Sons. New York.
Cappuccino, J.G. and N. Sherman, 1987. Microbiology a Laboratory Manual; 2 th ED., California. The Benjamins Columning Publishing Company.
Hadioetomo RS.1993. Mikrobiologi Dasar dalam Praktek: Teknik dan Prosedur Dasar Laboratorium. Jakarta: Gramedia Utama.
Hidayat, Nur. Masdiana C. Padaga, Sri Suhartini. 2006. Mikrobiologi
Industri.Yogyakarta: Andi Offset.
Lay,B.W. 1994. Analisa Mikroba di Laboratorium. Penerbit Rajawali. Jakarta. Pelczar, M.J. and E.C.S. Chan, 2005. Mikrobiologi I. UI-Press. Jakarta Prescott, L.M. 2003. Microbiology. Mc Graw Hill. New York.
LAPORAN PRAKTIKUM
MIKROBIOLOGI AKUATIK
TAHUN AJARAN 2016/2017
Oleh:
NAMA :
STAMBUK :
KELOMPOK :
HARI/TGL :
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN, 2017
HALAMAN PENGESAHAN
Judul : Laporan Lengkap Praktikum
Laporan Lengkap : Disusun Sebagai Salah Satu Syarat Untuk Lulus
Praktikum Mikrobiologi Akuatik Pada Program
Studi Manajemen Sumberdaya Perairan Fakultas
Pertanian Universitas Sumatera Utara
Nama :
Stambuk :
Kelompok/Hari :
Telah Diperiksa dan Disetujui Oleh :
NIP.
Tanggal Pengesahan :
DAFTAR ISI
KATA PENGANTAR DAFTAR ISI
BAB I. PENDAHULUAN ………
BAB II. TINJAUAN PUSTAKA ………..
2.1. Peralatan Laboratorium Mikrobiologi……… 2. 2. Sterilisasi ……….. 2.3. Membuat Media Pertumbuhan ………..………. 2. 4. Isolasi Bakteri Dari Lingkungan Akuatik...……… 2. 5. Teknik Biakan Murni………. BAB III. MATERI DAN METODA
3.1. Peralatan Laboratorium Mikrobiologi……… 3. 2. Sterilisasi ……….. 3.3. Membuat Media Pertumbuhan ………..………. 3. 4. Isolasi Bakteri Dari Lingkungan Akuatik...……… 3. 5. Teknik Biakan Murni………. .
BAB IV. HASIL DAN PEMBAHASAN
2. 4. Isolasi Bakteri Dari Lingkungan Akuatik...……… 2. 5. Teknik Biakan Murni……….
BAB V. KESIMPULAN ………
KATA PENGANTAR
Puji dan Syukur penulis panjatkan kehadirat Allah SWT Tuhan semesta alam
berkah rahmad dan hidayah-Nya penulis telah dapat menyelesaikan buku Penuntun
Praktikum Mikrobiologi Akuatik pada Laboratorium Mikrobiologi Akuatik.
Buku ini dibuat sebagai panduan mahasiswa dalam melakukan praktikum
Mikrobiologi Akuatik pada Program Studi Sumberdaya Perairan Fakultas Pertanian
Universitas Sumatera Utara. Materi yang dipraktikumkan merupakan aplikasi dari
materi-materi yang diperoleh dalam perkuliahan, dengan harapan dapat memperkaya
wawasan pengetahuan praktis mahasiswa tentang mikrobiologis akuatik.
Penulis menyadari buku ini masih jauh dari kesempurnaan, oleh karena itu
kritik dan saran yang konstruktif sangat dibutuhkan. Akhir kata penulis ucapkan
terimakasih, semoga buku ini dapat bermanfaat bagi semua amiin…!
Medan, Agustus 2017
Penulis
KATA PENGANTAR ……….. i
DAFTAR ISI ………. ii
TATA TERTIB PRAKTIKUM ……….. iii
Latihan 1. Pengenalan Alat ……… 1
Latihan 2. Sterilisasi ………. 8
Latihan 3. Membuat Media Pertumbuhan...……… 13
Latihan 4. Isolasi Bakteri Dari Lingkungan Akuatik………. 19
Latihan 5. Teknik Biakan Murni ……… 23
Latihan 6. Pengamatan Morfologi Protozoa…...………... 29
Latihan 7. Isolasindan Identifikasi Bakteri Patogen ………. 31
1 Praktikan wajib hadir 15 menit sebelum praktikum dimulai, mengenakan jas Lab, masker, sarung tangan, sandal.
2 Praktikan dan asisten wajib menguasai materi praktikum yang akan
dilakukan.
3 Praktikan tidak diperkenankan memasuki laboratorium sebelum praktikum dimulai.
4 Meja kerja bebas dari peralatan pribadi seperti tas, hand phone, dompet dll. 5 Praktikan dan asisten wajib memahami tentang keselamatan kerja (safety)
laboratorium.
6 Cuci tangan sebelum dan sesudah bekerja dengan antiseptic dan/atau sabun 7 Meja kerja harus disterilisasi sebelum dan sesudah bekerja (tindakan aseptis) 8 Praktikan yang merusak alat atau bahan kimia, baik dilakukan sengaja atau
tidak sengaja, maka kelompok praktikum yang bersangkutan wajib mengganti alat atau bahan kimia tersebut dengan jenis dan kualitas yang sama.
9 Setiap praktikum harus menjaga kebersihan laboratorium dan
mengembalikan alat dan bahan yang telah digunakan ke tempat semula dalam kondisi yang seharusnya.
10 Praktikan yang tidak mengikuti praktikum selama 3 (tiga) kali tanpa alasan yang dibenarkan tidak boleh mengikuti praktikum selanjutnya dan dianggap mengundurkan diri dari praktikum.
11 Praktikan wajib menyerahkan laporan praktikum sebelumnya apabila akan mengikuti praktikum berikutnya.
12 Penilaian dan penentuan nilai akhir menjadi wewenang dosen pengampu praktikum.
Puji dan Syukur penulis panjatkan kehadirat Allah SWT Tuhan semesta alam
berkah rahmad dan hidayah-Nya penulis telah dapat menyelesaikan buku Penuntun
Praktikum Mikrobiologi Akuatik pada Laboratorium Mikrobiologi Akuatik.
Buku ini dibuat sebagai panduan mahasiswa dalam melakukan praktikum
Mikrobiologi Akuatik pada Program Studi Sumberdaya Perairan Fakultas Pertanian
Universitas Sumatera Utara. Materi yang dipraktikumkan merupakan aplikasi dari
materi-materi yang diperoleh dalam perkuliahan, dengan harapan dapat memperkaya
wawasan pengetahuan praktis mahasiswa tentang mikrobiologis akuatik.
Penulis menyadari buku ini masih jauh dari kesempurnaan, oleh karena itu
kritik dan saran yang konstruktif sangat dibutuhkan. Akhir kata penulis ucapkan
terimakasih, semoga buku ini dapat bermanfaat bagi semua amiin…!
Medan, September 2017
KATA PENGANTAR ……….. i
DAFTAR ISI ………. ii
TATA TERTIB PRAKTIKUM ……….. iii
Latihan 1. Pengenalan Alat ……… 1
Latihan 2. Sterilisasi ………. 9
Latihan 3. Media Pertumbuhan Mikroorganisme...……… 14
Latihan 4. Teknik Isolasi Bakteri ………... 20
Latihan 5. Teknik Biakan Murni ……… 26
Latihan 6. Uji Aktifitas Enzim Secara Kualitatif ………... 32
Latihan 7. Pengamatan Bakteri Secara Mikroskopis ………. 35