LAPORAN PRAKTIKUM
MIKROBIOLOGI AKUAKULTUR
Disusun oleh: Darmawan Setia Budi
C151120151
MAYOR ILMU AKUAKULTUR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
KATA PENGANTAR
Puji syukur atas nikmat dan karunia Allah SWT, sehingga penulis dapat menyelesaikan laporan praktikum Mikrobiologi Akuakultur ini dengan baik. Rasa terimakasih yang sebesar-besarnya penulis sampaikan kepada Ibu Dr. Ir. Widanarni, M.Si selaku koordinator mata kuliah Mikrobiologi Akuakultur beserta tim yang telah memberikan petunjuk dan membimbing dalam pelaksanaan praktikum sampai penulisan laporan praktikum ini.
Laporan praktikum ini penulis selesaikan dalam rangka memenuhi tugas akhir semester satu pada mata kuliah Mikrobiologi Akuakultur. Laporan praktikum ini disusun berdasarkan hasil praktikum yang dilaksanakan di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor setiap hari Rabu, pukul 13.30-16.30 WIB.
Penulis menyadari bahwa dalam penyusunan laporan ini, masih terdapat kesalahan-kesalahan dalam penulisannya. Oleh karena itu, penulis sangat mengharapkan kritik dan saran yang membangun. Selain itu, dengan laporan penulis juga mengharapkan ada banyak manfaat bagi kita semua untuk menambah ilmu pengetahuan terutama yang berhubungan dengan mikrobiologi akuakultur.
Bogor, 11 Januari 2013
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
KATA PENGANTAR ... ii
DAFTAR ISI ... iii
RIWAYAT PENULIS ... iv
LAPORAN PRAKTIKUM 1. Penyiapan Medium, Sterilisasi Bahan dan Peralatan ... 1
2 Isolasi Bakteri dan Fungi dari Lingkungan Akuatik ... 13
3. Pewarnaan Gram ……... 23
4. Karakterisasi Sifat Biokimia dan Fisiologi Bakteri ... 33
5. Morfologi Fungi …….………... 42
6. Perhitungan Bakteri dengan Metode Hitungan Cawan ………... 53
7. Penanda Antibiotik Resisten ……… 62
8. Pengaruh Suhu dan Salinitas Terhadap Viabilitas Bakteri ... 69
9. Pengaruh Bahan Antimikroba Terhadap Pertumbuhan Bakteri ... 78
10. Seleksi Bakteri Probiotik untuk Akuakultur ... 90
RIWAYAT PENULIS
Penulis dilahirkan di Lumajang tanggal 18 September 1988 dari ayah Sudarmasto dan ibu Titin Sukowati. Penulis merupakan anak kedua dari 3 bersaudara. Pendidikan formal yang pernah dilalui penulis adalah SDN 1 Rogotrunan IV (lulus tahun 2000), SMPN 1 Lumajang (lulus tahun 2003), dan SMAN 1 Lumajang (lulus tahun 2006). Gelar Sarjana Perikanan diperoleh dari program studi Teknologi dan Manajemen Perikanan Budidaya pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, pada tahun 2011 dengan skripsi yang berjudul “Transplantasi Sel Testikular Ikan Gurame pada Ikan Nila”.
Selama menjadi mahasiswa strata satu di IPB, penulis aktif pada organisasi kemahasiswaan, di antaranya adalah Himpunan Mahasiswa Akuakultur (HIMAKUA) sebagai staf divisi kewirausahaan pada periode 2008 dan Forum Keluarga Muslim FPIK (FKM-C) sebagai kepala divisi coorporation pada periode 2009. Penulis juga aktif menjadi asisten praktikum beberapa mata kuliah, di antaranya Dasar-dasar Akuakultur (2008/2009), Fisiologi Hewan Air (2008/2009 dan 2009/2010), Manajemen Kualitas Air (2009/2010), serta Dasar-dasar Genetika Ikan (2009/2010).
Penulis pernah mendapatkan pendanaan DIKTI pada Program Kreativitas Mahasiswa bidang Penelitian (PKM-P) pada tahun 2009. Pada tahun 2010, penulis menjadi salah satu delegasi IPB pada Pekan Ilmiah Nasional (PIMNAS) XXIII yang dilaksanakan di Universitas Mahasaraswati Denpasar Bali, melalui Program Kreativitas Mahasiswa bidang Gagasan Tertulis (PKM-GT) dengan judul artikel ”Pengembangan Manipulasi Fish Germ Cells: Peningkatan Produksi dan Pelestarian Diversitas Sumberdaya Ikan di Indonesia”, dan berhasil meraih penghargaan setara perak.
Praktikum ke-1 Tanggal : 19 September 2012 m.k. Mikrobiologi Akuakultur Kelompok : XI
Asisten : Rahman
Adni Zein
Dewi Nurhayati Firsty Rahmatia Titi Nur Cahyati Dendi Hidayatullah Wahyu Afrilasari Nurlita Christyaningsih
PENYIAPAN MEDIUM, STERILISASI BAHAN DAN
PERALATAN
Disusun oleh: Darmawan Setia Budi
C151120151
MAYOR ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
I. PENDAHULUAN
1.1. Latar Belakang
Mikrobiologi ialah telaah mengenai organisme hidup yang berukuran mikroskopis (Pelczar & Chan, 1986). Organisme mikroskopis (mikroba) ini dapat hidup di berbagai tempat yang sesuai dengan kriteria persyaratan hidup masing-masing organisme tersebut. Sehingga untuk bisa mengisolasi mikroba pada biakan murni dalam laboratorium diperlukan medium yang cocok. Hingga saat ini telah banyak dikenal jenis-jenis medium untuk membiakkan mikroba. Setiap jenis medium memiliki kandungan nutrisi yang berbeda satu sama lain, bergantung pada jenis mikroba target yang akan inokulasikan.
Populasi mikroba di alam sekitar kita sangat besar dan kompleks. Mikroba hampir terdapat di semua tempat di bumi ini, termasuk di sekitar kita. Hal ini menyebabkan inokulasi mikroba membutuhkan kerja yang aseptik agar mikroba yang terinokulasi adalah benar-benar mikroba yang kita inginkan. Namun sebelumnya tentu harus dipersiapkan peralatan dan medium yang aseptik pula.
Pembuatan biakan mikroba murni membutuhkan medium yang sesuai serta peralatan dan medium yang steril atau tidak mengandung mikroba yang lain. Oleh karena itu pengetahuan dan ketrampilan mengenai penyiapan medium serta sterilisasi bahan dan peralatan sangat diperlukan untuk menunjang hal ini.
1.2. Tujuan
Praktikum ini bertujuan mempelajari prosedur umum untuk merekonstitusi (mengembalikan kepada keadaan asalnya) medium berbentuk bubuk (terdehidrasi) dan menaruhnya dalam jumlah yang dikehendaki ke dalam wadah-wadah yang sesuai, serta mempelajari berbagai macam prosedur sterilisasi bahan dan peralatan.
II. METODOLOGI
2.1. Waktu dan Tempat
Praktikum Penyiapan Medium, Sterilisasi Bahan dan Peralatan ini dilaksanakan pada hari Rabu 19 September 2012 dan pengamatan pada hari Kamis 20 September 2012, bertempat di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
2.2. Alat dan Bahan
Alat-alat yang digunakan dalam praktikum ini adalah gelas ukur, erlenmeyer, timbangan digital, kertas timbang (alumunium foil), sprayer, spatula atau sendok, batang pengaduk, pemanas air, tabung reaksi dan cawan petri steril, kapas, pipet volumetrik, keranjang tabung reaksi, tissu, dan kertas bekas. Bahan-bahan yang digunakan adalah medium TSA, aquades, dan alkohol.
2.3. Prosedur Sterilisasi dan Pembuatan Media
Sebelum disterilkan dengan autoklaf, pipet dibungkus dengan kertas. Kertas A4 bekas di bagi menjadi empat bagian sama panjang. Ujung kertas dilipat menjadi segitiga siku-siku. Ujung pipet dimasukkan ke dalam segitiga tersebut. Kertas diputar ke arah badan pipet hingga menutupi seluruh pipet. Pipet yang telah dibungkus dimasukkan ke dalam autoklaf.
Gambar 1. Teknik membungkus pipet ukur untuk sterilisasi pada praktikum Mikrobiologi Akuakultur 2012.
Cawan petri yang akan disterilkan dibungkus dengan kertas A4 bekas. Cawan petri diletakkan terbalik di atas kertas. Kertas dilipat menjadi dua bagian yang sama hingga menutupi seluruh cawan petri. Ujung kertas yang masih tersisa dilipat hingga menyerupai segitiga kemudian ditekuk ke bagian bawah cawan petri. Setelah itu cawan petri yang sudah dibungkus dimasukkan dalam autoklaf.
Gambar 2. Pembungkusan cawan petri untuk sterilisasi pada praktikum Mikrobiologi Akuakultur 2012.
Pembuatan medium agar pada cawan petri dikerjakan secara aseptik di atas api bunsen. Sebelum melakukan penuangan media ke dalam petri, meja tempat kerja dan tangan praktikan disemprot terlebih dahulu menggunakan alkohol 70%.
Gambar 3. Pembuatan medium agar pada cawan petri pada praktikum Mikrobiologi Akuakultur 2012.
III. HASIL DAN PEMBAHASAN
3.1. Hasil
Berikut ini adalah tabel hasil praktikum penyiapan medium dan sterilisasi bahan dan peralatan.
Tabel 1. Kontaminan yang terjadi pada penuangan medium ke cawan petri
No. Tabung Kontaminan
Gambar 5. Hasil pengamatan media agar pada cawan petri setelah inkubasi 24 jam Berdasar tabel 1. dan gambar 5. diperoleh hasil bahwa setelah inkubasi selama 24 jam seluruh media agar yang dibuat tidak ditumbuhi kontaminan.
3.2. Pembahasan
Pengamatan terhadap suatu jenis mikroba dapat dilakukan dengan membuat biakan murni terlebih dahulu, yang dimaksud biakan murni adalah tidak lebih dari satu jenis mikroba yang terdapat dalam suatu wadah biakan bakteri (Pelczar & Chan, 1986). Untuk membuat biakan murni diperlukan peralatan dan medium yang steril. Komposisi bahan dalam medium bergantung pada jenis bakteri yang akan diinkubasi. Bahan-bahan yang menunjang untuk pembuatan medium umumnya adalah kaldu nutrien dan agar nutrien.
Menurut Madigan et al. (1997) nutrien dibagi menjadi dua, yaitu makronutrien yang dibutuhkan dalam jumlah besar yaitu karbon, nitrogen, pospat, sulfur, potasium, magnesium, kalsium, sodium; dan mikronutrien yang dibutuhkan dalam jumlah sedikit yaitu kromium, kobalt, tembaga, mangan, besi, dan seng. Masing-masing unsur tersebut memiliki fungsi yang berbeda bagi kelangsungan hidup mikroba itu sendiri.
Komposisi kaldu nutrien adalah ekstrak daging sapi, pepton, dan air; empuk, dikonsentrasikan menjadi pasta. Nilai nutrisi yang terkandung di dalamnya adalah substansi jaringan hewan yang dapat larut dalam air, meliputi karbohidrat, senyawa nitrogen organik, vitamin yang dapat larut dalam air, dan garam-garaman (Pelczar & Chan, 1986).
Pepton merupakan produk yang dihasilkan dari bahan-bahan yang mengandung protein seperti daging, kasein, dan gelatin. Fungsi pepton yaitu sebagai sumber utama nitrogen organik, dapat mengandung vitamin dan kadang-kadang karbohidrat, dan bergantung pada jenis bahan berkandungan protein yang dicernakan (Pelczar & Chan, 1986).
membentuk gel bila suhu dikurangi sampai di bawah 45oC. Agar bukan sumber nutrien bagi bakteri (Pelczar & Chan, 1986).
Yeast ekstrak, yaitu suatu ekstrak cair sel khamir, tersedia secara komersial dalam bentuk bubuk. Yeast ekstrak merupakan sumber yang amat kaya akan vitamin B, juga mengandung nitrogen dan senyawa-senyawa karbon (Pelczar & Chan, 1986).
Media yang digunakan dalam praktikum ini berupa media TSA (Trypticase Soya Agar) agar padat. Media TSA memiliki komposisi pepton dari kasein 17 gram, pepton dari kedelai 3 gram, glukosa 2.5 gram, NaCl 5 gram, K2HPO4 2.5 gram, dan aquades 1 liter (Acumedia, 2010).
Banyak persyaratan yang harus dipenuhi agar dapat menumbuhkan mikroorganisme dalam suatu medium. Untuk menunjang keberhasilan dalam kultur mikroba diperlukan suatu kombinasi nutrien dan lingkungan fisik yang sesuai. Di dalam Madigan et al. (1997), faktor tumbuh adalah komponen organik seperti mikronutrien yang hanya dibutuhkan dalam jumlah sedikit, termasuk vitamin, asam amino, purin, dan pirimidin; kebanyakan mikroorganisme dapat mensintesis semua komponen-komponen tersebut walaupun ada satu atau lebih dapat mengambilnya dari alam. Menurut Filzahazny (2008) parameter lingkungan fisik yang mempengaruhi pertumbuhan mikroba adalah suhu, atmosfer gas, keasaman atau kebasaan (pH), cahaya dan tekanan osmotik.
Semua proses pertumbuhan bergantung pada reaksi kimiawi dan laju reaksi-reaksi ini dipengaruhi oleh suhu, sehingga pola pertumbuhan bakteri dapat sangat dipengaruhi oleh suhu. Suhu juga mempengaruhi laju pertumbuhan dan jumlah total pertumbuhan organisme. Keragaman suhu juga dapat proses-proses metabolik tertentu serta morfologi sel. Setiap spesies bakteri tumbuh pada suatu kisaran suhu tertentu. Atas dasar ini, maka bakteri dapat diklasifikasikan sebagai psikrofil, yang tumbuh pada 00C sampai 300C; mesofil yang tumbuh pada 250C sampai 400C; termofil tumbuh pada 500C atau lebih. Suhu inkubasi yang memungkinkan pertumbuhan tercepat selama periode waktu yang singkat (12 sampai 24 jam), dikenal sebagai suhu pertumbuhan optimum (Filzahazny, 2008).
respon terhadap oksigen bebas dan atas dasar ini maka mudah sekali untuk membagi mereka menjadi lima kelompok, yaitu aerobik (organisme yang membutuhkan oksigen), anaerobik fakultatif (tumbuh pada keadaan aerobik dan anaerobik), dan mikroaerofilik (tumbuh baik bila ada sedikit oksigen atmosfirik), aerob aerotoleran (tidak mati dengan adanya oksigen), aerob obligat (tumbuh subur apabila ada oksigen dalam jumlah besar). Beberapa bakteri tidak hanya anaerobik, tetapi juga sangat sensitif terhadap oksigen, yakni apabila terkena oksigen akan terbunuh (Filzahazny, 2008).
PH optimum pertumbuhan bagi kebanyakan bakteri terletak antara 6,5 dan 7,5. Namun, beberapa spesies dapat tumbuh dalam keadaan masam, atau sangat alkaline. Bagi kebanyakan spesies, nilai pH minimum dan maksimum antara 4 dan 9. Bila bakteri dikultivasi di dalam suatu medium yang mula-mula disesuaikan pH-nya misalnya 7, maka mungikn sekali pH ini akan berubah sebagai akibat adanya senyawa asam atau basa yang dihasilkan selama pertumbuhannya. Pergeseran pH ini dapat sedemikian besar sehingga dapat menghambat pertumbuhan selanjutnya organisme tersebut. Pergeseran pH dapat dicegah dengan menggunakan larutan penyangga dalam medium. Larutan penyangga adalah senyawa atau pasangan senyawa yang dapat menahan perubahan pH. Suatu kombinasi garam phospat, seperti KH2PO4 dan K2HPO4 digunakan secara luas dalam media bakteriologi untuk tujuan ini. Beberapa bahan nutrisi medium, seperti pepton juga mempunyai kapasitas penyangga. Perlu atau tidaknya suatu medium diberi larutan penyangga tergantung dari maksud penggunaanya dan dibatasi oleh kapasitas penyangga yang dimiliki senyawa-senyawa yang digunakan (Filzahazny, 2008).
Beberapa kelompok bakteri mempunyai persyaratan tambahan. Sebagai contoh, organisme fotoautotrofik (fotosintetik) harus diberi sumber pencahayaan, karena cahaya adalah sumber energinya (Filzahazny, 2008).
IV. KESIMPULAN DAN SARAN
4.1. Kesimpulan
Medium adalah suatu substrat untuk menumbuhkan mikroba, yang menjadi padat dan tetap tembus pandang pada suhu inkubasi yaitu suhu yang cocok bagi pertumbuhan mikroba. Bahan kompleks yang sering digunakan sebagai bahan medium adalah ekstrak daging sapi, pepton, agar, dan yeast ekstrak. Tumbuh kembang mikroorganisme memerlukan suatu kombinasi nutrien dan lingkungan fisik yang sesuai. seluruh praktikan dalam kelompok XI dapat dinyatakan bekerja secara aseptik saat pembuatan media agar pada cawan petri, hal ini dapat dilihat ketika pengamatan satu hari setelah praktikum medium yang dituang oleh tidak mengandung koloni bakteri.
4.2. Saran
DAFTAR PUSTAKA
Dwidjoseputro D. 1998. Dasar-dasar Mikrobiologi. Jakarta: Djambatan.
Filzahazny. 2008. P engantar Tentang Bakteri. http://filzahazny.wordpress.com. [24 September 2012].
Madigan MT, Martinko JM, Parker J.1997. Biology of Microorganisms. New Jersey: Prentice-Hall Inc.
Pelczar MJJr, Chan ECS. 1986. Dasar-dasar Mikrobiologi. Volume 1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI-Press. Terjemahan dari: Elements of Microbiology.
Acumedia. 2010. Tryptic Soy Agar (7100).
Praktikum ke-2 Tanggal : 26 September 2012 m.k. Mikrobiologi Akuakultur Kelompok : XI
Asisten : Rahman
Adni Zein
Dewi Nurhayati Firsty Rahmatia Titi Nur Cahyati Dendi Hidayatullah Wahyu Afrilasari Nurlita Christyaningsih
ISOLASI BAKTERI DAN FUNGI DARI LINGKUNGAN
AKUATIK
Disusun oleh: Darmawan Setia Budi
C151120151
MAYOR ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
I. PENDAHULUAN
1.1. Latar Belakang
Mikroorganisme (bakteri, fungi/cendawan, protozoa, dan mikroorganisme lain) yang terdapat di lingkungan budidaya umumnya terdapat dalam populasi campuran. Mikroorganisme yang ditemukan dalam habitatnya, perlu diisolasi dan ditumbuhkan menjadi biakan murni agar dapat digunakan dalam menelaah dan mengidentifikasi mikroorganisme. Untuk memperoleh biakan murni dari populasi digunakan metode cawan gores dan metode cawan tuang dengan prinsip yang sama, yaitu mengencerkan organisme sedemikian sehingga individu spesies dapat dipisahkan dari lainnya. Koloni terpisah yang tampak pada cawan petri setelah diinkubasi, dianggap berasal dari satu sel tunggal.
Keterampilan dalam mengisolasi bakteri dan fungi dari lingkungan budidaya sangat diperlukan untuk dapat memperoleh koloni tunggal dari bakteri atau fungi yang diisolasi, yang nantinya berguna dalam pembuatan biakan murni dari koloni tunggal mikroorganisme yang terbentuk. Sehingga hal ini akan berguna dalam menelaah dan mengidentifikasi mikroorganisme terebut.
1.2.Tujuan
II. METODOLOGI
2.1. Waktu dan Tempat
Praktikum ”Isolasi Bakteri dan Fungi dari Lingkungan Akuatik” ini dilaksanakan pada hari Rabu 26 September 2012 dan pengamatan pada hari Kamis 27 September 2012, bertempat di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
2.2. Alat dan Bahan
Alat-alat yang digunakan adalah lup inokulasi, cawan petri, bunsen, korek api, dan sprayer. Bahan-bahan yang digunakan adalah alkohol, SWC (Sea Water Complete), GYA (Glucose Yeast Agar), TSA (Trypticase Soy Agar), TCBS (Thiosulphate Citrate Bile-Salt Sucrose), air kolam, air sungai, dan air laut.
2.3. Prosedur Kerja
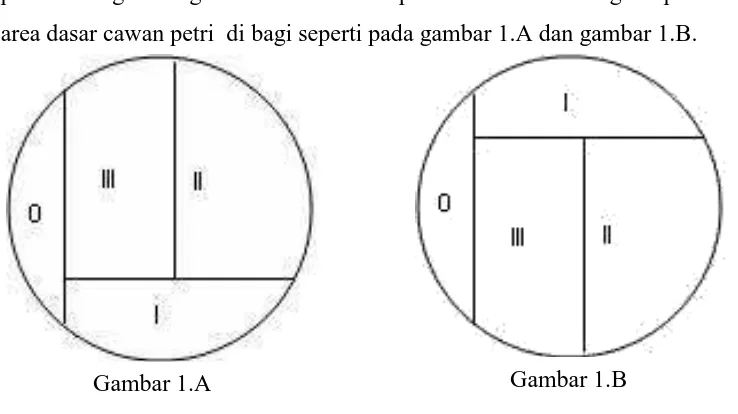
Pertama-tama nama/kelompok, media, dan air sampel ditulis pada cawan petri masing-masing. Kemudian cawan petri dibalik dan dengan spidol seluruh area dasar cawan petri di bagi seperti pada gambar 1.A dan gambar 1.B.
Keterangan :
(A) Pembagian sektor pada permukaan luar dasar cawan petri. (B) Pembagian sektor tampak melalui tutup cawan petri.
Tangan dan meja praktikum disterilkan dengan alkohol. Sebelum bakteri/fungi dipindahkan dengan lup inokulasi, lup inokulasi dibakar hingga
kawatnya berpijar. Dengan lup inokulasi, secara aseptik satu lup sampel air dipindahkan pada media dalam cawan petri.
Bakteri diisolasi dengan goresan zigzag pada media dalam cawan petri pada kuadran O hingga kuadran III. Lup digoreskan zig-zag pada kuadran O, setelah itu lup dibakar lagi. Kemudian, setelah lup dingin, lup digoreskan zigzag dengan mengambil sedikit isolat mikroba yang ada pada kuadran O dan diteruskan sampai kuadaran I tergores penuh. Penggoresan tidak bertumpang tindih. Langkah tersebut diulangi untuk pengenceran biakan dari kuadran I ke kuadran II dan kuadran III ke kuadran III. Untuk lebih jelasnya dapat dilihat pada gambar berikut ini.
Gambar 2.A
Kuadran O adalah tempat mula-mula diletakkannya inokulum dengan lup inokulasi
Gambar 2.B
Sektor I merupakan pengenceran pertama. Garis-garis goresan pada sektor I saling terpisah seseragam dengan menggunakan lup inokulasi.
Gambar 2.C
Sektor II adalah usaha pengenceran kedua.
Gambar 2.D
III. HASIL DAN PEMBAHASAN
3.1. Hasil
Berikut ini adalah hasil pengisolasian bakteri dan fungi yang diambil dari air sampel.
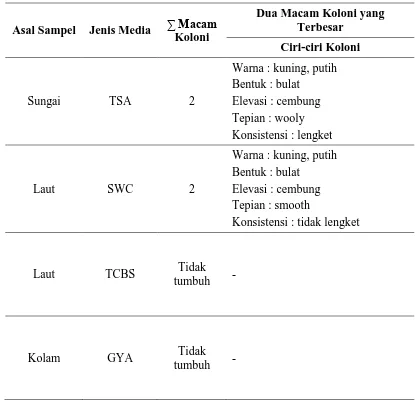
Tabel 1. Hasil pengamatan pertumbuhan koloni bakteri dan fungi dari lingkungan budidaya
Soy Agar) untuk menumbuhkan bakteri. Media GYA (Glucose Yeast Agar) untuk menumbuhkan fungi.
SWC (Sea Water Complete) adalah salah satu medium yang berfungsi menumbuhkan bakteri air laut. Komposisi bahan yang terkandung dalam SWC adalah bacto pepton, yeast ekstrak, gliserol bacto agar, air laut, dan akuades. Masing-masing bahan tersebut memiliki peranan penting dalam media tumbuh bakteri. Bacto pepton berfungsi sebagai sumber utama nitrogen organik, dapat mengandung vitamin dan kadang-kadang karbohidrat, dan bergantung pada jenis bahan berkandungan protein yang dicernakan. Yeast ekstrak merupakan sumber yang amat kaya akan vitamin B, juga mengandung nitrogen dan senyawa-senyawa karbon. Di dalam gliserol bacto agar terdapat agar yang merupakan suatu karbohidrat kompleks yang diperoleh dari alga laut tertentu, diolah untuk membuang substansi yang tidak dikehendaki. Peranan agar adalah sebagai bahan pemadat media, agar yang lebur dalam larutan cair akan membentuk gel bila suhu dikurangi sampai di bawah 45oC. Agar bukan sumber nutrien bagi bakteri (Pelczar & Chan, 1986). SWC digunakan untuk menumbuhkan bakteri air laut, sehingga dalam SWC terdapat harus terdapat air laut yang berfungsi untuk membentuk media tumbuh bakteri yang sesuai dengan habitat aslinya. Akuades dalam SWC berfungsi mengencerkan media dalam proses pembuatannya.
TCBS ((Thiosulphate Citrate Bile-Salt Sucrose) merupakan salah satu media selektif yang berfungsi dalam isolasi dan pemeliharaan bakteri jenis Vibrio. TSA (Trypticase Soy Agar) berfungsi untuk menumbuhkan bakteri air tawar. TSA mengandung soya peptone (soytone) sebagai sumber nitrogen, vitamin dan mineral, tryptone sebagai sumber asam amino untuk pertumbuhan, sodium cloride untuk menyeimbangkan tekanan osmotik, dan bacto agar.
GYA (Glucose Yeast Agar) untuk menumbuhkan fungi. GYA mengandung antibiotik yang berfungsi menghambat pertumbuhan mikroorganisme selain fungi yang ditumbuhkan. Antibiotika adalah segolongan senyawa, baik alami maupun sintetik, yang mempunyai efek menekan atau menghentikan suatu proses biokimia di dalam organisme (Wikipedia, 2008)
membran inti), berukuran kira-kira 0.5-1.0 x 2.0-5.0 µm (Pelczar & Chan, 1986). Berdasarkan bentuk morfologinya, maka bakteri dapat di bagi atas tiga golongan, yaitu golongan basil (silindris), golongan kokus (bola) dan golongan spiril (spiral) (Dwidjoseputro, 1978).
Bakteri yang diisolasi dalam praktikum ini adalah bakteri air tawar dan air laut. Mikroba air tawar yang berasal dari air kolam yang ditumbuhkan pada medium TSA menghasilkan dua jenis koloni. Ciri-ciri koloni ini yaitu warna kuning dan putih, bentuk bulat, elevasi cembung, tepian wooly, dan konsistensi lengket. Ada tiga koloni bakteri air laut yang tumbuh pada medium SWC, dua jenis koloni yang paling banyak memiliki ciri-ciri yaitu warna kuning dan putih, tepian smooth, elevasi cembung, dan tidak lengket. Bakteri yang diisolasi dari air laut tidak tumbuh pada media TCBS.
Selain bakteri, yang diisolasi dalam praktikum ini adalah cendawan/fungi. Tidak terdapat cendawan yang tumbuh pada medium GYA yang diisolasi dari air kolam. Fungi adalah nama regnum dari sekelompok besar makhluk hidup eukariotik heterotrof yang mencerna makanannya di luar tubuh lalu menyerap molekul nutrisi ke dalam sel-selnya. Fungi memiliki bermacam-macam bentuk. Orang awam mengenal sebagian besar anggota Fungi sebagai jamur, kapang, khamir, atau ragi, meskipun seringkali yang dimaksud adalah penampilan luar yang tampak, bukan spesiesnya sendiri. Kesulitan dalam mengenal fungi sedikit banyak disebabkan adanya pergiliran keturunan yang memiliki penampilan yang sama sekali berbeda. Fungi memperbanyak diri secara seksual dan aseksual (Wikipedia, 2008). Cendawan/fungi merupakan organisme heterotrof yang berfilamen, umunya bersifat saprofit, beberapa di antaranya bersifat parasit, bahkan ada yang bersifat parasit obligat
IV. KESIMPULAN DAN SARAN
4.1 Kesimpulan
Mikroba air tawar yang berasal dari air kolam yang ditumbuhkan pada medium TSA menghasilkan dua jenis koloni saja. Ciri-ciri koloni ini yaitu warna putih dan kuning, tepian wooly, elevasi cembung, dan konsistensi lengket. Ada dua jenis koloni bakteri air laut yang tumbuh pada medium SWC, memiliki ciri-ciri yaitu warna kuning dan putih, tepian smooth, elevasi cembung, dan konsistensi tidak lengket. Tidak terdapat koloni bakteri yang diisolasi dari air laut yang tumbuh pada media TCBS dan tidak terdapat cendawan yang tumbuh pada medium GYA yang diisolasi dari air kolam.
4.2 Saran
DAFTAR PUSTAKA
Dwidjoseputro D. 1987. Dasar-dasar Mikrobiologi. Jakarta: Djambatan.
Pelczar MJJr, Chan ECS. 1986. Dasar-dasar Mikrobiologi. Volume 1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI-Press. Terjemahan dari: Elements of Microbiology.
Prihartini, Tini. 2003. Identifikasi Cendawan pada Ikan Gurame (Osphronemus gouramy Lac.) dan Penggunaan Daun Kirinyuh (Chromolaena odorata) untuk Pengendaliannya (Pendekatan In Vitro) [Skripsi]. Bogor: Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor
Sari, Febianty BP. 2003. Identifikasi dan Uji Postulat Koch Cendawan Penyebab Penyakit pada Ikan Gurami [Skripsi]. Bogor: Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Praktikum ke-3 Tanggal : 3 Oktober 2012 m.k. Mikrobiologi Akuakultur Kelompok : XI
Asisten : Rahman
Adni Zein
Dewi Nurhayati Firsty Rahmatia Titi Nur Cahyati Dendi Hidayatullah Wahyu Afrilasari Nurlita Christyaningsih
PEWARNAAN GRAM
Disusun oleh: Darmawan Setia Budi
C151120151
MAYOR ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
I. PENDAHULUAN
1.1. Latar Belakang
Biakan murni bakteri hasil dari isolasi perlu diidentifikasi dengan menentukan morfologi sel, morfologi koloni, sifat biokimia (fisiologi), patogenisitas dan serologinya. Untuk mengidentifikasi beberapa bakteri tertentu terkadang tidak perlu dilakukan prosedur selengkap di atas.
Salah satu cara mengidentifikasi bakteri yang cukup sederhana adalah dengan pewarnaan gram. Dengan pewarnaan gram dapat diketahui morfologi sel bakteri antara lain sifat gram, bentuk sel, dan koloni sel. Dalam pewarnaan gram bakteri dibagi menjadi dua kelompok, yaitu bakteri gram positif dan gram negatif. Perbedaan ini didasari pada hasil akhir pewarnaan, bakteri gram positif berwarna ungu, sedangkan bakteri gram negatif berwarna merah muda.
Pewarnaan gram merupakan salah satu teknik pewarnaan diferensial yang paling penting dan paling luas digunakan untuk bakteri. Prosedur ini juga merupakan salah satu prosedur yang dapat mencirikan banyak bakteri. Oleh karena itu pemahaman dan keterampilan dalam pewarnaan gram sangat diperlukan untuk dapat mengidentifikasikan berbagai macam bakteri.
1.2. Tujuan
II. METODOLOGI
2.1. Waktu dan Tempat
Praktikum ”Pewarnaan Gram” ini dilaksanakan pada hari Rabu 3 Oktober 2012, bertempat di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
2.2. Alat dan Bahan
Alat-alat yang digunakan adalah jarum ose, gelas objek, botol semprot, mikroskop, stop watch, bunsen, dan korek api. Bahan-bahan yang digunakan adalah akuades steril, alkohol 70%, larutan Gram A (kristal violet, ethanol 95%, amonium oksalat, dan akuades), larutan Gram B (KI, I2, dan air), larutan Gram C (Etanol 95% dan Aseton 95%), dan larutan Gram D (Safranin, Etanol, dan Air).
2.3. Prosedur Kerja
Preparat olesan bakteri disiapkan dengan pengambilan bakteri pada tabung
III. HASIL DAN PEMBAHASAN
3.1. Hasil
Hasil pengamatan pewarnaan Gram disajikan melalui tabel di bawah ini. Tabel 1. Hasil pewarnaan Gram.
Kelompok Isolat Bentuk Gram Penataan Gambar
3.2. Pembahasan
Banyak senyawa organik berwarna yang digunakan untuk mewarnai mikroorganisme dalam proses pengidentifikasian mikroba dengan menggunakan mikroskop. Menurut Pelczar & Chan (1986), langkah-langkah utama dalam mempersiapkan spesimen mikroba yang diwarnai untuk pemeriksaan mikorskopik adalah penempatan olesan, atau lapisan tipis spesimen, pada kaca objek; fiksasi olesan itu pada kaca objek, biasanya dengan pemanasan yang menyebabkan mikroorganisme itu melekat pada kaca objek; dan aplikasi pewarna tunggal (pewarnaan sederhana) atau serangkaian larutan pewarna atau reagen (pewarnaan diferensial).
Pemberian warna pada bakteri atau jasad-jasad renik lain dengan menggunakan larutan tunggal suatu pewarna pada lapisan tipis, atau olesan yang sudah difiksasi, dinamakan pewarnaan sederhana. Sedangkan prosedur pewarnaan yang menampilkan perbedaan di antara sel-sel mikrobe atau bagian sel-sel mikrobe disebut teknik pewarnaan diferensial (Pelczar & Chan, 1986).
Teknik pewarnaan yang dilakukan pada praktikum ini adalah pewarnaan gram yang merupakan merupakan salah satu teknik pewarnaan diferensial yang paling penting dan paling luas digunakan untuk bakteri. Pewarnaan Gram atau metode Gram adalah suatu metode empiris untuk membedakan spesies bakteri menjadi dua kelompok besar, gram-positif dan gram-negatif, berdasarkan sifat kimia dan fisik dinding sel mereka. Metode ini diberi nama berdasarkan penemunya, ilmuwan Denmark Hans Christian Gram (1853–1938) yang mengembangkan teknik ini pada tahun 1884 untuk membedakan antara pneumokokus dan bakteri Klebsiella pneumoniae (Wikipedia, 2008).
Pada bakteri gram positif, larutan ungu kristal (UK) menyebabkan sel berwarna ungu. Pada saat penetesan larutan iodium (Y), kompleks ungu kristal-iodium (UK-Y) terbentuk di dalam sel dan sel tetap berwarna ungu. Penetesan alkohol mengakibatkan dinding sel mengalami dehidrasi, pori-pori menciut, daya rembes dinding sel dan membran menurun, UK-Y tidak dapat keluar dari sel, sehingga pada saat penetesan safranin sel tetap berwarna ungu (Pelczar & Chan, 1986).
Berbeda dengan bakteri gram positif, pada saat pemberian alkohol bakteri gram negatif mengalami ekstraksi lipid dari dinding sel, pori-pori mengembang, kompleks ungu kristal-iodium ke luar dari sel, dan sel menjadi tak berwarna. Pada penetesan safranin sel menyerap zat pewarna dan menjadi merah (Pelczar & Chan, 1986).
Faktor yang mempengaruhi kesuksesan atau kegagalan dalam pewarnaan gram adalah pelaksanaan fiksasi panas terhadap olesan, fiksasi panas yang berlebihan akan menyebabkan pecahnya dinding sel, sehingga bakteri gram positif akan melepaskan pewarna utama dan menyerap pewarna tandingan yaitu sfranin sehingga tampak seperti gram negatif. Selain itu, faktor yang lainnya adalah kerapatan olesan; konsentrasi dan umur reagen yang digunakan; sifat, konsentrasi, dan jumlah pencuci yang digunakan; serta sejarah (umur) biakan.
Isolat bakteri yang diamati pada praktikum ini adalah isolat A, B, C, D, E, G, H, dan I. Hasil pengamatan menunjukkan bahwa bakteri A berbentuk batang, gram (+) dengan penataan diplobasilus; bakteri B berbentuk batang, gram (+) dengan penataan monobasilus; bakteri C berbentuk batang koma (vibrio), gram (-) dengan penataan lapisan pagar; bakteri D berbentuk batang, gram (+) dengan penataan streptobasilus; bakteri E merupakan campuran antara bakteri berbentuk batang dan bulat, keduanya gram (+) dengan penataan monobasilus dan staphylicoccus; bakteri H merupakan campuran antara bakteri berbentuk batang dan bulat, keduanya gram (+) dengan penataan monobasilus dan staphylicoccus; bakteri I merupakan campuran antara bakteri berbentuk batang gram (+) dan bulat gram (-), dengan penataan monobasilus dan monococcus.
bakteri yaitu Aeromonas salmonicida, Renibacterium salmoninarum, Nocardia spp., Edwardsiella ictaluri, Pasteurella piscicida, Aerococcus viridans (var) homari, Mycobacterium spp., Edwardsiella tarda, Streptococus spp. dan Yersinia ruckeri. Beberapa jenis bakteri tersebut dilaporkan telah terdapat di Indonesia namun belum tersebar luas, yaitu Aeromonas salmonicida di Jawa,
Mycobacterium sp. di Jawa dan Sumatera, Edwardsiella tarda di Jawa serta
Streptococcus sp. di Sulawesi (DKP, 2004).
Termasuk dalam golongan bakteri gram positif adalah Streptoccocus sp.,
Yersinia ruckeri, Nocardia sp., Renibacterium salmoninarum, Mycobacterium sp., dan Aerococcus viridans.
Streptoccocus sp. berbentuk bulat atau oval, memanjang seperti rantai, bersifat gram positif, tidak bergerak, tidak membentuk spora atau kapsul dan bersifat fakultatif aerob. Diameter bakteri berukuran 0,7-1,4 µm. Bakteri ini dapat hidup di air tawar dan air laut dengan kisaran suhu bagi pertumbuhannya antara 10-45oC (DKP, 2004).
Yersinia ruckeri berbentuk batang, dengan ukuran 0,5-0,8 x 1,3 µm, bersifat gram positif, tidak membentuk spora atau kapsul, bergerak dengan flagella peritrichous pada suhu di bawah 30oC, sedangkan pada suhu 37oC tidak membentuk flagella. Bakteri ini dapat dijumpai di air dengan suhu optimal pertumbuhannya 22-25oC (DKP, 2004).
Nocardia sp. adalah bakteri yang bentuknya bervariasi yaitu bulat, oval dan batang berfilamen, dengan ukuran diameter 0,5-1,2 µm, bersifat gram positif, bergerak, tidak membentuk kapsul dan bersifat aerob. Bakteri ini tersebar di alam termasuk di air dan tanah. Suhu optimal bagi pertumbuhan Nocardia asteroides
antara 28-35oC, sedangkan N. kampachi tidak tumbuh pada suhu 10oC atau 37oC (DKP, 2004).
Mycobacterium sp. yang dikenal sebagai penyebab penyakit " tuberkulosis ikan" (Fish TB), adalah bakteri yang berbentuk batang, dengan ukuran 0.2-0.6 x 1.0-10 µm, bersifat gram positif lemah, tidak bergerak, tidak membentuk spora atau kapsul dan bersifat aerob. Bakteri ini banyak dijumpai di perairan tawar dan laut maupun tanah dengan suhu optimal pertumbuhannya 25-30oC. Tidak dapat tumbuh pada suhu 37oC kecuali M. marinum, M. fortuitum dan M. chelonei (DKP, 2004).
Aerococcus viridans (var.) homari adalah bakteri yang berbentuk bulat, ada yang berpasangan atau seperti rantai, bersifat gram positif, tidak bergerak dan tidak membentuk spora. Bakteri ini dapat ditemukan di air tawar atau juga air laut (DKP, 2004).
Termasuk dalam golongan bakteri gram negatif adalah Aeromonas salmonicida, Edwardsiella tarda dan E. Ictaluri, serta Pasteurella piscicida.
Aeromonas salmonicida adalah bakteri yang berbentuk batang pendek dengan ukuran 1.3-2.0 x 0.8-1.3 µm, bersifat gram negatif, tidak bergerak, tidak membentuk spora maupun kapsul, dan bersifat aerob. Bakteri ini tidak dapat hidup lama tanpa inangnya dan suhu optimal bagi pertumbuhannya antara 22-28oC, sedangkan pada suhu 35oC pertumbuhannya terhambat. Dapat dijumpai di lingkungan air tawar maupun air laut dan dikenal sebagai penyebab penyakit "furunculosis" (DKP, 2004).
Edwardsiella tarda dan E. Ictaluri berbentuk batang bengkok, dengan ukuran 1 x 2-3 µm, bersifat gram negatif bergerak dengan bantuan flagella, tidak membentuk spora atau kapsul dan bersifat fakultatif anaerob. Bakteri ini dapat dijumpai di lingkungan air tawar dan air laut, dengan suhu optimal bagi pertumbuhannya sekitar 35oC, sedangkan pada suhu di bawah 10oC atau di atas 45oC tidak dapat tumbuh (DKP, 2004).
IV. KESIMPULAN DAN SARAN
4.1. Kesimpulan
Pewarnaan Gram atau metode Gram adalah suatu metode empiris untuk membedakan spesies bakteri menjadi dua kelompok besar, positif dan gram-negatif, berdasarkan sifat kimia dan fisik dinding sel mereka. Olesan bakteri terfiksasi yang ditetesi dengan larutan ungu kristal (Gram A), iodium (Gram B), alkohol (Gram C) dan safranin (Gram D) secara berurutan, di mana setiap larutan yang diteteskan pada olesan bakteri memiliki fungsi dan peran masing-masing terutama dalam pengidentifikasian bakteri gram positif ataupun gram negatif. Setiap langkah yang dilakukan pada pewarnaan gram penting untuk dicermati dan dipahami agar diperoleh hasil pewarnaan yang tepat.
Hasil pengamatan pada praktikum ini menunjukkan bahwa bakteri A berbentuk batang, gram (+) dengan penataan diplobasilus; bakteri B berbentuk batang, gram (+) dengan penataan monobasilus; bakteri C berbentuk batang koma (vibrio), gram (-) dengan penataan lapisan pagar; bakteri D berbentuk batang, gram (+) dengan penataan streptobasilus; bakteri E merupakan campuran antara bakteri berbentuk batang dan bulat, keduanya gram (+) dengan penataan monobasilus dan staphylococcus; bakteri H merupakan campuran antara bakteri berbentuk batang dan bulat, keduanya gram (+) dengan penataan monobasilus dan staphylococcus; bakteri I merupakan campuran antara bakteri berbentuk batang gram (+) dan bulat gram (-), dengan penataan monobasilus dan monococcus.
4.2. Saran
DAFTAR PUSTAKA
Pelczar MJJr, Chan ECS. 1986. Dasar-dasar Mikrobiologi. Volume 1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI-Press. Terjemahan dari: Elements of Microbiology.
Wikipedia. 2008. Pewarnaan Gram. www.wikipedia.org. [25 Maret 2008].
DKP. 2004. Penyakit Ikan Karantina Golongan Bakteri. www. Dkp.go.id. [1 April 2008].
Praktikum ke-4 Tanggal : 10 Oktober 2012 m.k. Mikrobiologi Akuakultur Kelompok : XI
Asisten : Rahman
Adni Zein
Dewi Nurhayati Firsty Rahmatia Titi Nur Cahyati Dendi Hidayatullah Wahyu Afrilasari Nurlita Christyaningsih
KARAKTERISASI SIFAT BIOKIMIA
DAN FISIOLOGI BAKTERI
Disusun oleh: Darmawan Setia Budi
C151120151
MAYOR ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
I. PENDAHULUAN
1.1. Latar Belakang
Mikroorganisme bertahan agar tetap hidup melalui penyesuaian diri terhadap lingkungannya demi kelanjutan generasinya. Untuk itu, mikroorganisme mampu merombak dan menggunakan bahan-bahan kimia (dalam bentuk larutan) yang ada di lingkungannya sebagai sumber energi dan zat pembangun.
Semua kegiatan metabolisme mikroorganisme dilakukan oleh enzim, yaitu biokatalisator yang dapat mempercepat reaksi kimia sel. Proses metabolisme akan melibatkan tidak hanya satu jenis enzim, akan tetapi banyak enzim yang terkait yang masing-masing bekerja dengan cepat agar reaksi kimia yang bersifat komplek dapat berjalan. Kerja enzim bersifat spesifik yang berarti satu jenis enzim hanya akan bekerja pada satu jenis senyawa.
Hasil akhir dari proses enzimatis dan berkurangnya bahan atau zat di dalam media dapat dideteksi dan diukur. Seperti halnya kerja enzim yang spesifik, setiap jenis mikroorganisme mempunyai kemampuan beradaptasi yang berbeda-beda. Proses enzimatis pada berbagai jenis mikroorganisme berbeda-beda. Perbedaan ini dapat diketahui dengan uji sifat biokimia mikroorganisme, sehingga hasil dari uji ini dapat digunakan untuk identifikasi mikroorganisme baik genus ataupun spesiesnya.
1.2. Tujuan
II. METODOLOGI
2.1. Waktu dan Tempat
Praktikum ”Karakterisasi Sifat Biokimia dan Fisiologi Bakteri” ini dilaksanakan pada hari Rabu 10 Oktober 2012 dan pengamatan dilakukan pada hari Kamis 11 Oktober 2012, bertempat di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
2.2. Alat dan Bahan
Alat-alat yang digunakan dalam praktikum ini adalah rak tabung reaksi, tabung reaksi, sumbat kapas, sprayer, bunsen, pipet serologis, gelas arloji, pipet tetes, lup inokulan, bulb, ice bath, kertas tissue, dan kertas saring. Bahan-bahan yang digunakan adalah biakan bakteri A dan E, alkohol 70%, alkohol 90%, O/F media, parafin, media SIM (Sulfida Indol Motility), larutan p-aminodimethylaniline-oxalat 1%, larutan hidrogen peroksida, dan medium gelatin.
2.3. Prosedur Kerja
Uji yang digunakan untuk karakterisasi sifat biokimia dan fisiologi dalam praktikum ini adalah uji oksidatif/fermentatif, uji oksidase, uji katalase, uji motilitas, dan uji gelatin. Sebelum dilakukan masing-masing uji , tangan dan meja disemprot dengan alkohol 70% terlebih dahulu kemudian dilap dengan tissue. Sebelum lup inokulasi digunakan, dibakar di atas api bunsen terlebih dahulu supaya lup steril, setelah dibakar, dicelupkan ke dalam alkohol 90% kemudian dibakar lagi hingga siap digunakan.
Uji oksidase, p-aminodimethylaniline-oxalat 1% diteteskan pada kertas saring. Kemudian satu ose penuh biakan dari media padat diulaskan pada di atas tetesan p-aminodimethylalanine-oxalat. Bila koloni berubah warna menjadi merah berarti tes positif, dan bila berwarna ungu berarti tes negatif.
Uji katalase, sebagian koloni bakterio dari agar miring diambil dan diletakkan pada gelas objek, dan larutan hydrogen peroksida diberikan pada koloni tersebut. Reaksi positif ditunjukkan oleh adanya gelembung-gelembung.
Media SIM (Sulfida Indol Motility) digunakan dalam uji motilitas. Cara melakukan uji, koloni bakteri diambil dengan menggunakan jarum inokulum, diinhokulasi secara vertikal, dan diinkubasi selama 24 jam. Bakteri motil tumbuh pada permukaan medium, sedangkan bakteri non motil tumbuh di sepanjang tusukan.
III. HASIL DAN PEMBAHASAN
3.1. Hasil
Hasil dari uji-uji karakterisasi biokimia dan fisiologi bakteri yang telah dilakukan disajikan dalam tabel berikut ini.
Tabel 1. Hasil uji identifikasi bakteri
Sampel
Identifikasi bakteri dapat menggunakan cara karakterisasi sifat biokimia dan morfologi bakteri. Uji-uji yang dilakukan dalam mengkarakterisasi sifat biokimia dan morfologi bakteri menurut Sharpe (1980 dalam Malaka dan Laga, 2005) adalah sifat Gram, temperatur pertumbuhan, uji katalase, fermentasi karbohidrat, toleransi NaCl, uji pasteurisasi, kemampuan tumbuh pada pH basa, kemampuan tumbuh pada susu yang mengandung biru metilen, toleransi garam empedu, produksi asam laktat dalam susu, dan uji sensitifitas terhadap antibiotik. Dalam praktikum ini hanya dilakukan beberapa dari uji-uji tersebut, di antaranya adalah uji oksidatif/fermentatif, uji motilitas, uji oksidase, uji katalase, dan uji gelatin.
menutup permukaan media. Inkubasi dilakukan selama 24 jam pada praktikum
Uji katalase menggunakan hidogen peroksida dilakukan untuk mengetahui ada tidaknya enzim katalase. Katalase adalah enzim yang dapat menguraikan hidrogen peroksida yang tidak baik bagi tubuh makhluk hidup menjadi air dan oksigen yang sama sekali tidak berbahaya (Helianti, 2006). Menurut Lay (1994
dalam Misgiyarta & Widowati, 2002) uji katalase menggunakan larutan H2O2 3%, adanya gelembung udara menunjukkan uji katalase positif.
Uji Oksidase digunakan untuk melihat adanya aktivitas enzim dehidrogenase pada bakteri. Pengujian ini dikorelasikan dengan adanya sitokrom dalam kadar yang tinggi, yang dapat dipakai untuk mengenal bakteri tertentu yang termasuk
dalam genus Pseudomonas dan Neisseria. Oksidasi dari p-aminodimetilanilina
menjadi warna merah tua sampai hitam, dapat dipakai sebagai ukuran aktivitas
sitokrom. Bila koloni-koloni segera menjadi berwarna merah tua, menunjukkan
bahwa organisme itu diduga mengandung sitokrom-C. Dalam hal ini perlu
diperhatikan bahwa semua koloni dapat menjadi merah tua dengan reagen
oksidase, bila dibiarkan berada dalam cahaya. Karena itu hasil pengujian harus
segera diperiksa setelah reagen diberikan. Biakan tua tidak dapat memberikan
hasil yang akurat untuk pengujian ini (Sonic-stu, 2008).
Uji motilitas menggunakan media SIM (Sulfida Indol Motility) sehingga dapat digunakan untuk mengetahui kemampuan membentuk indol (produk hasil degradasi protein), ikatan sulfida, dan pergerakan bakteri. Indol dibentuk dari asam triptofan sebagai hasil aktivitas hidrolisis beberapa spesies bakteri
kedua bakteri menunjukkan uji motilitas positif yang ditandai dengan terbentuknya koloni bakteri di permukaan medium yang digunakan.
Uji gelatin dilakukan untuk mengetahui aktifitas enzim gelatinase (Susatyo & Dwi, 2007). Larutan gelatin bersifat cair pada suhu ruang dan padat di dalam lemari es. Gelatin yang telah dihidrolisa akan tetap cair meskipun berada di dalam lemari es.
Berdasarkan uji-uji yang telah dilakukan didapatkan sifat biokimia dan fisiologi dapat dilakukan identifikasi menggunakan tabel Cowan. Hasil identifikasi didapatkan 4 jenis bakteri dari genus Staphylococcus,
IV. KESIMPULAN DAN SARAN
4.1. Kesimpulan
Berdasarkan uji-uji yang telah dilakukan didapatkan sifat biokimia dan fisiologi dapat dilakukan identifikasi menggunakan tabel Cowan. Hasil identifikasi didapatkan 4 jenis bakteri dari genus Staphylococcus,
Corynebacterium, Listeria, dan Bacillus.
4.2. Saran
DAFTAR PUSTAKA
Feliatra et al. 2004. Isolasi dan Identifikasi Bakteri Probiotik dari Ikan Kerapu Macan (Ephinephelus fuscogatus) dalam Upaya Efisiensi Pakan Ikan. Jurnal Natur Indonesia.6(2): 75-80 (2004). ISSN 1410-9379.
Helianti, Is. 2006. Katalase Ultrastabil Untuk Penguraian Limbah Bleaching. http://www.beritaiptek.com. [20 April 2008].
Malaka R, Laga A. 2005. Isolasi dan Identifikasi Lactobacillus bulgaricus Strain Ropy dari Yoghurt Komersial. Jurnal Sains & Teknologi. Vol. 5 No. 1: 50 – 58.
Misgiyarta & Widowati, S. 2002. Seleksi dan Karakterisasi Bakteri Asam Laktat (BAL) Indigenus. Prosiding Seminar Hasil Penelitian Rintisan dan Bioteknologi Tanaman.
Pelczar MJJr, Chan ECS. 1986. Dasar-dasar Mikrobiologi. Volume 1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI-Press. Terjemahan dari: Elements of Microbiology.
Purnawati, Arika. 2008. Ketahanan Ubikayu (Manihot esculenta Crantz) Varietas Lokal Ketan dan Adira-4 Hasil Radiasi Terhadap Bakteri Xanthomonas campestris pv. manihotis Secara In Vitro. images.soemarno.multiply.com. [20 April 2008].
Sonic-stu. 2008. Mikrobiologi Menguak Dunia Mikroorganisme Jilid II. http://www.sonic-stu.com/images/Mikrobiologi.pdf. [20 April 2008]
Praktikum ke-5 Tanggal : 17 Oktober 2012 m.k. Mikrobiologi Akuakultur Kelompok : XI
Asisten : Rahman
Adni Zein
Dewi Nurhayati Firsty Rahmatia Titi Nur Cahyati Dendi Hidayatullah Wahyu Afrilasari Nurlita Christyaningsih
MORFOLOGI FUNGI
Disusun oleh: Darmawan Setia Budi
C151120151
MAYOR ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
I. PENDAHULUAN
1.1. Latar Belakang
Fungi dapat dibiakkan pada media buatan dengan formulasi nutrien tertentu sesuai dengan formulasi nutrien tertentu sesuai dengan sifat fisiologinya. Bentuk dan ciri pertumbuhan masing-masing jenis fungi berbeda satu sama lain. Bentuk dan ciri-ciri morfologis, terutama struktur-struktur yang berkaitan dengan reproduksi, yaitu spora aseksual dan seksual serta tubuh-tubuh buahnya. Pengamatan terhadap morfologi fungi sangat diperlukan dalam proses pengidentifikasian berbagai jenis fungi sehingga bisa diklasifikasikan.
1.2. Tujuan
II. METODOLOGI
2.1. Waktu dan Tempat
Praktikum ”Morfologi Fungi” ini dilaksanakan pada hari Rabu 17 Oktober 2012, bertempat di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
2.2. Alat dan Badan
Alat-alat yang digunakan adalah gelas objek, gelas penutup, cawan petri, tabung reaksi, sprayer, bunsen, pipet tetes, jarum inokulasi, dan mikroskop. Bahan-bahan yang digunakan adalah alkohol 70%, akuades steril, metilen blue, serta biakan murni fungi dari larva ikan dan tempe.
2.3. Prosedur Kerja
Gelas objek dan gelas penutup dibersihkan dengan alkohol. Akuades steril diteteskan pada bagian tengah gelas objek. Fungi yang akan diperiksa diletakkan dengan lup inokulasi kemudian ditutup dengan gelas penutup. Kelebihan air yang keluar dari gelas penutup dihisap dengan kertas penghisap agar mikroskop tidak basah. Koloni fungi diamati di bawah mikroskop dengan perbesaran 400 kali. Untuk melihat morfologi konidia atau spora, digunakan perbesaran 1000 kali.
III. PEMBAHASAN
3.1. Hasil
Hasil dari pengamatan yang telah dilakukan disajikan dalam tabel-tabel di bawah ini.
Tabel 1. Jumlah persentase khamir yang mati dan hidup pada biakan murni. Kel. Jenis
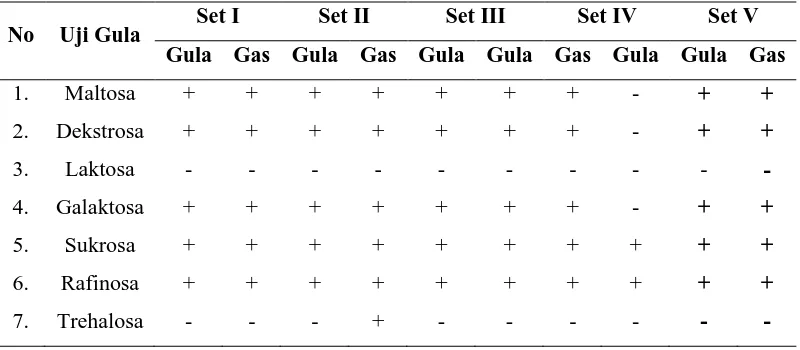
Tabel 2. Hasil uji khamir pada berbagai media gula
No Uji Gula Set I Set II Set III Set IV Set V
Klasifikasi cendawan terutama didasarkan pada ciri spora seksual dan tubuh yang ada selama tahap-tahap seksual dalam daur hidupnya. Namun jika tingkat seksual cendawan tidak diketahui maka klasifikasinya harus menggunakan ciri-ciri lain diluar tingkat seksual. Ciri-ciri-ciri itu mencakup morfologi spora aseksual dan miseliumnya. Oleh karena itu berdasarkan pada ciri dan morfologi reproduksinya terdapat empat kelas cendawan sejati atau berfilamen di dalam dunia fungi, yaitu Phycomycetes, Ascomycetes, Basidiomycetes, dan Deuteromycetes (Pelczar & Chan, 1986).
Khamir dan kapang adalah cendawan yang diamati dalam praktikum ini. Khamir termasuk dalam kelas Ascomycetes, sedangkan kapang termasuk ke dalam kelas Deuteromycetes. Perbedaan antara keduanya terletak pada tingkat seksualnya. Khamir sudah diketahui tingkat seksualnya sehingga disebut cendawan perfek/sempurna, sedangkan kapang belum diketahui tingkat seksualnya sehingga disebut cendawan imperfek. Selama belum diketahui tingkat seksualnya cendawan digolongkan pada kelas Deuteromycetes (Pelczar & Chan, 1986).
Banyak khamir tergolong kelas Ascomycetes karena membentuk askospora. Pola sederhana pembentukan askospora tampak pada daur hidup khamir yang umum, yaitu Schizosaccharomyces. Secara aseksual, genus khamir ini melalui pembelahan biner melintang. Khamir lain dalam kelas ini, seperti khamir dari
Saccharomyces cerevisiae (digunakan untuk membuat roti, anggur dan bir), memperbanyak diri secara aseksual dengan bertunas (Pelczar & Chan, 1986). Bentuk sel Saccharomyces yang diamati adalah bulat, elips sedangkan yeast yang diamati berbentuk bulat.
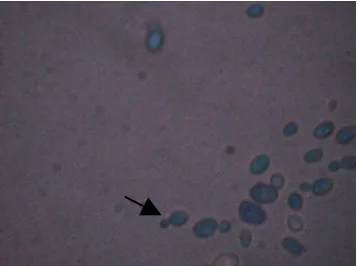
Gambar 2. Saccharomyces cerevisiae, tanda panah menunjuk tunas (Wikipedia, 2008)
Hasil pengamatan mortalitas khamir menunjukkan bahwa tingkat kematian khamir yang diberi metilen blue berkisar antara 15% sampai 26,14%. Khamir yang mati berwarna biru sedangkan khamir yang hidup berwarna bening (gambar 4).
Gambar 4. Khamir yang diberi MB, tanda panah menunjuk khamir hidup. Kapang lendir merupakan sekumpulan mikroorganisme yang heterogen, memiliki ciri-ciri hewan dan tumbuhan. Fase vegetatif atau somatik yang aselular dan merayap jelas mempunyai struktur dan fisiolog seperti binatang, struktur reproduksinya seperti tumbuhan, yaitu menghasilkan spora yang terbungkus dinding yang nyata. Gabungan fase seperti binatang dan tumbuhan dalam satu daur hidup merupakan ciri pembeda kapang lendir (Pelczar & Chan, 1986).
Tubuh atau talus suatu kapang pada dasarnya terdiri dari dua bagian yaitu miselium dan spora (sel resisten, istirahat atau dorman). Miselium merupakan kumpulan beberapa filamen yang dinamakan hifa. Setiap hifa lebarnya 5-10 µm, dibanding sel bakteri yang biasanya berdiameter 1 um. Ada tiga macam morfologi hifa, yaitu aseptat (tidak mempunyai dinding sekat atau septum), septat dengan sel-sel uninukleat, dan septat dengan sel-sel multi nukleat (Pelczar & Chan, 1986). Hasil pengamatan pada kapang menunjukkan bahwa kapang yang diamati memiliki tipe morfologi hifa aseptat.
Gambar 6. Tiga tipe hifa: A. Aseptat, B. Septat uninukleat, C. Septat multinukleat (Pelczar & Chan, 1986).
Beberapa cendawan hidup pada tubuh ikan. Salah satunya menjadi penyebab penyakit saprolegniasis pada ikan. Penyakit ini merupakan penyakit jamur pada ikan atau telur ikan yang disebabkan antara lain oleh jamur Achlya sp. dan
Gambar 7. Jamur Achlya sp. dan Saprolegnia sp. (Sucipto, 2008).
Penyakit lain pada yang disebabkan oleh fungi adalah Ichthyosporidosis. Penyakit ini disebabkan oleh jamur Ichthyos poridium sp (Ichthyophonus sp). Jamur ini berkembang mengikis jaringan luar bagian kepala dan menyebabkan luka yan dalam yang berwarna kemerah-merahan dan dapat masuk ke dalam sampai ke bagian tengkorak kepala ikan. Kadang-kadang juga ditemukan di bawah kulit dan jaringan epitel kulit dari jaringan organ yang penting misalnya insang, usus, hati dan jantung dalam bentuk gumpalan granula. Biasanya terdapat pada ikan kerapu dan berkembang lambat karena penyakit ini terutama teramati pada ikan-ikan atau ukuran pasar. Sampai saat ini belum ada pengobatan yang manjur terhadap penyakit ini. Beberapa jenis antibiotik yang biasa terdapat di pasaran kurang mempan menghadapi penyakit ini. Untuk itu dapat dihindari dengan jalan menjaga makanan dari ikan rucah yang diberikan agar bersih dan tidak ada gumpalan-gumpalan penyakit di bagian kulitnya atau di bagian lain (Tarwiyah, 2001).
VI. KESIMPULAN DAN SARAN
4.1. Kesimpulan
Bentuk sel Saccharomyces yang diamati adalah bulat, elips sedangkan yeast
yang diamati berbentuk bulat. Hasil pengamatan mortalitas khamir menunjukkan bahwa tingkat kematian khamir yang diberi metilen blue berkisar antara 15% sampai 26,14%. Khamir yang mati berwarna biru sedangkan khamir yang hidup berwarna bening. Kapang yang diamati memiliki tipe morfologi hifa aseptat. Reaksi yang dihasilkan oleh khamir terhadap tujuh jenis gula yang diujikan, pada gula jenis laktosa dan trehalosa terjadi reaksi negatif (warna tetap ungu), sedang pada maltose, dekstrosa, galaktosa, sukrosa, dan rafinosa terjadi reaksi oksidatif positif (warna berubah menjadi kuning).
4.2. Saran
DAFTAR PUSTAKA
Pelczar MJJr, Chan ECS. 1986. Dasar-dasar Mikrobiologi. Volume 1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI-Press. Terjemahan dari: Elements of Microbiology.
Sucipto, Adi. 2008. Penyakit pada Ikan. http://www.naksara.net [29 April 2008]. Tarwiyah. 2001. Pedoman Teknis Penanggulanga n Penyakit Ikan Budidaya Laut.
http://www.ristek.go.id [29 April 2008]
Praktikum ke-6 Tanggal : 31 Oktober 2012 m.k. Mikrobiologi Akuakultur Kelompok : XI
Asisten : Rahman
Adni Zein
Dewi Nurhayati Firsty Rahmatia Titi Nur Cahyati Dendi Hidayatullah Wahyu Afrilasari Nurlita Christyaningsih
PERHITUNGAN BAKTERI DENGAN METODE HITUNGAN
CAWAN
Disusun oleh: Darmawan Setia Budi
C151120151
MAYOR ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
I. PENDAHULUAN
1.1. Latar Belakang
Pengukuran kuantitatif populasi mikroba dalam suatu sampel dilakukan untuk mengetahui kualitas bahan dan tujuan lain berdasarkan jumlah mikroba yang ada dalam sampel tersebut. Ada berbagai cara untuk mengukur jumlah sel, antara lain dengan hitungan mikroskopis langsung (direct microscopiscount), dan hitungan tidak langsung (indirect count) dengan hitungan cawan, baik dengan metode penyebaran maupun metode penuangan. Keterampilan dalam penghitungan jumlah bakteri sangat untuk menghitung jumlah bakteri dalam suatu ukuran tertentu. Pengetahuan jumlah bakteri dapat memberikan informasi keadaan habitat asal bakteri tersebut.
1.2. Tujuan
II. METODOLOGI
2.1. Waktu dan Tempat
Praktikum ”Penghitungan Bakteri dengan Metode Hitungan Cawan” ini dilaksanakan pada hari Rabu 24 Oktober 2012 dan pengamatan pada hari Kamis 25 Oktober 2012 bertempat di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
2.2. Alat dan Bahan
Alat-alat yang digunakan adalah tabung reaksi, sumbat kapas, cawan petri, tabung reaksi, sprayer, bunsen, korek api, pipet 1 ml, rak tabung reaksi, dan batang penyebar. Bahan-bahan yang digunakan adalah alkohol 70%, suspensi bakteri Pseudo alteromonas, media SWC cair dengan suhu 50oC, dan larutan fisiologis (0,85%).
2.3. Prosedur Kerja
Tabung-tabung berisi garam fisiologis disiapkan dan disusun berderet. Sampel suspensi bakteri dikocok baik-baik sampai kekeruhannya rata. Pengenceran serial sampel suspensi bakteri dilakukan seperti pada gambar 1.
Satu ml suspensi bakteri diambil secara aseptik lalu dimasukkan ke tabung sebanyak 9 ml pertama (10-1), dikocok atau divortex agar homogen, lalu secara aseptik 1 ml sampel dari tabung pengencer pertama dipipet dan dimasukkan ke dalam tabung pengencer kedua (10-2), dan seterusnya untuk tabung-tabung pengencer selanjutnya.
dalam cawan cawan petri ini dibiarkan menjadi padat. Setelah itu diletakkan dalam posisi terbalik untuk diinkubasikan pada suhu kamar selama 24 jam. Jumlah koloni dihitung (30-300) dan dikalikan dengan faktor pengencernya.
III. HASIL DAN PEMBAHASAN
3.1. Hasil
Hasil dari penghitungan bakteri dengan metode hitungan cawan dapat dilihat pada tabel 1.
Tabel 1. Hasil penghitungan bakteri dengan metode hitungan cawan.
Kelompok Metode Jumlah Koloni
10-4 10-5 10-6
TBUD : Terlalu Banyak Untuk Dihitung
3.2. Pembahasan
Bakteri terdapat berkoloni di berbagai tempat. Dalam satu koloni bakteri terdapat sangat banyak sel bakteri. Untuk mengetahui jumlah bakteri pada suatu bahan maka dapat dilakukan penghitungan jumlah bakteri. Metode yang dapat digunakan untuk menentukan jumlah mikrobe di dalam bahan pangan terdiri terdiri metode hitungan cawan, Most Probable Number (MPN), dan metode hitungan mikroskopis langsung, serta metode turbidimetri (Hadioetomo, 1990). Dalam praktikum ini digunakan metode hitungan cawan.
dihitung, di mana jumlah yang terbaik adalah 30-300 koloni. Larutan yang digunakan untuk pengenceran dapat berupa larutan buffer fosfat, larutan garam fisiologi 0,85%, atau larutan Ringer (Hadioetomo, 1990). Larutan fisiologi yang digunakan dalam pengenceran pada praktikum ini adalah larutan garam fisiologi 0,85%.
Hadioetomo (1990) menyatakan bahwa metode hitungan cawan dapat dibedakan atas metode tuang (pour plate) dan metode permukaan (surface/spread plate). Kedua metode tersebut dilakukan dalam praktikum ini, namun istilah yang digunakan berbeda yaitu metode cawan tuang dan cawan sebar.
Menurut Hadioetomo (1990) prinsip dari metode hitungan cawan adalah jika sel mikroba yang masih hidup ditumbuhkan pada medium agar maka sel mikroba tersebut akan berkembang biak dan membentuk koloni yang dapat dilihat langsung dengan mata tanpa menggunakan mikroskop. Metode hitungan cawan merupakan cara yang paling sensitif untuk menentukan jumlah mikroba karena hanya sel yang masih hidup yang dihitung, beberapa jenis mikroba dapat dihitung sekaligus, dapat digunakan untuk isolasi dan identifikasi mikroba karena koloni yang terbentuk mungkin berasal dari satu sel mikroba dengan penampakan pertumbuhan yang spesifik.
Hasil praktikum dari masing-masing kelompok menunjukkan hasil yang bervariasi. Hampir semua kelompok mendapatkan hasil TBUD (Terlalu Banyak Untuk Dihitung). Metode hitungan cawan dapat dikatakan berhasil jika jumlah koloni bakteri yang diperoleh semakin kecil pada akhir pengenceran. Hal ini dapat terjadi akibat kesalahan prosedur pengenceran atau kerja yang tidak aseptik.
Prosedur pengenceran yang tidak tepat akan mengakibatkan bakteri yang diencerkan tidak tersebar merata, sehingga ketika pengenceran dilanjutkan bakteri yang terencerkan semakin sedikit. Akhirnya bakteri yang terhitung pada cawan tuang ataupun cawan gores menjadi kurang dari 30 koloni.
Metode hitungan cawan memiliki kelemahan-kelemahan antara lain, hasil perhitungan tidak menunjukkan jumlah sel mikroba yang sebenarnya karena beberapa sel yang berdekatan mungkin membentuk satu koloni, medium dan kondisi berbeda mungkin menghasilkan nilai yang berbeda, mikroba yang ditumbuhkan harus dapat tumbuh pada medium padat dan membentuk koloni yang jelas dan kompak serta tidak menyebar, memerlukan persiapan dan waktu inkubasi yang lama sehingga pertumbuhan koloni dapat dihitung (Hadioetomo, 1990).
Jumlah koloni pada pengenceran 10-4, 10-5, dan 10-6 seharusnya cenderung semakin sedikit. Hal ini sesuai dengan tujuan pengenceran, yaitu agar pada saat ditumbuhkan dalam cawan petri, koloni yang terbentuk jumlahnya dapat dihitung. Jumlah koloni yang lebih banyak pada pengenceran yang lebih besar mengindikasikan kesalahan prosedur baik dalam pengenceran maupun kerja yang aseptik. Menurut Hadioetomo (1990) ketelitian akan lebih tinggi jika digunakan dua cawan petri untuk setiap pengenceran.
Bakteri yang dipakai pada praktikum ini adalah Pseudoalteromonas sp..
Pseudoalteromonas sp. merupakan bakteri gram negatif yang berbentuk batang atau basilus. Habitat umumnya berada di perairan laut, terutama pada karang koral atau spons. Bakteri ini dapat mencegah biofouling, yaitu rusaknya karang akibat organisme yang menempel pada suatu karang melebihi daya tampung karang dan bermanfaat sebagai elemen daur ulang, detoxifikasi, dan sebagai bahan produksi apabila membentuk biofilm (Answer, 2007).
Berikut ini taksonomi dari bakteri Pseudoalteromonas sp. Kingdom : Bacteria
Phylum : Proteobacteria
Class : Gamma Proteobacteria Ordo : Alteromonadales Famili : Alteromonadaceae Genus : Pseudoalteromonas
IV. KESIMPULAN DAN SARAN
4.1. Kesimpulan
Hasil praktikum dari masing-masing kelompok menunjukkan hasil yang bervariasi. Hampir semua kelompok mendapatkan hasil TBUD (Terlalu Banyak Untuk Dihitung). Metode hitungan cawan dapat dikatakan berhasil jika jumlah koloni bakteri yang diperoleh semakin kecil pada akhir pengenceran. Hal ini dapat terjadi akibat kesalahan prosedur pengenceran atau kerja yang tidak aseptik.
4.2. Saran
DAFTAR PUSTAKA
Answer. 2007. Pseudoalteromonas. http://answer.com/topic/pseudoalteromonas. Ayuzar, Eva. 2008. Mekanisme Penghambatan Bakteri Probiotik Terhadap
Pertumbuhan Vibrio harveyi pada Larva Udang Windu (Penaeus monodon) [Tesis]. Bogor: Sekolah Pascasarjana. Institut pertanian Bogor.
Hadioetomo, Ratna. 1990. Mikrobiologi Dasar dalam Praktek. Jakarta: Gramedia Pustaka Utama.
Meha, Deliana. 2003. Patogenesitas Vibrio harveyi dengan Penanda Resistan Rifampisin (Rf-R) dan Green Fluorescent Protein (GFP) pada Larva Udang Windu (Penaeus monodon Fab.) [Skripsi]. Bogor: Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Rajab, Fahmi. 2006. Isolasi dan Seleksi Bakteri Probiotik dari Lingkungan
Praktikum ke-7 Tanggal : 7 November 2012 m.k. Mikrobiologi Akuakultur Kelompok : XI
Asisten : Rahman
Adni Zein
Dewi Nurhayati Firsty Rahmatia Titi Nur Cahyati Dendi Hidayatullah Wahyu Afrilasari Nurlita Christyaningsih
PENANDA ANTIBIOTIK RESISTEN
Disusun oleh: Darmawan Setia Budi
C151120151
MAYOR ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
I. PENDAHULUAN
1.1. Latar belakang
Penelitian terhadap keberadaan dan aktivitas suatu bakteri pada habitat (lingkungan) hidupnya memerlukan metode khusus. Metode yang digunakan harus dapat mengetahui secara pasti dan spesifik mengenai aktivitasdan keberadaannya. Oleh karena itu diperlukan suatu penanda yang dapat membedakan antara bakteri target dan bakteri lain sehingga keberadaan dan aktivitasnya dapat diamati dengan akurat. Salah satu cara untuk memonitor dan mengetahui suatu bakteri target adalah dengan menggunakan penanda antibiotik resisten.
Uji penanda resisten antibiotik terdiri dari uji sensitifitas untuk mengetahui apakah bakteri tersebut resisten atau sensitif dengan antibiotik tertentu dan uji mutasi spontan untuk mengetahui jumlah bakteri yang telah bermutasi menjadi resisten antibiotik tertentu.
1.2. Tujuan
II. METODOLOGI
2.1. Waktu dan Tempat
Praktikum dilaksanakan pada hari Rabu, tanggal 7 November 2012, bertempat di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
2.2. Alat dan Bahan
Alat-alat yang digunakan pada praktikum ini adalah cawan petri, batang penyebar, inkubator, pinset, mikropipet, bunsen, korek api, tabung eppendorf, dan tissue. Bahan-bahan yang digunakan adalah 3 isolat bakteri untuk uji sensitifitas, uji mutasi spontan dan kontrol, media SWC dalam cawan petri, media SWC bercampur antibiotik rifampisin dalam cawan petri, larutan fisiologis.
2.3. Prosedur Kerja
Uji sensitifitas antibiotik, media SWC bercampur antibiotik rifampisin dibagi menjadi 4 bagian. Masing-masing bagian digores dengan isolat bakteri yang berbeda. Selanjutnya diinkubasi dalam inkubator selama 24 jam dan diamati apakah ada koloni yang tumbuh atau tidak.
III. HASIL DAN PEMBAHASAN
3.1. Hasil
Hasil pengamatan praktikum pembuatan penanda resisten antibiotik dapat dilihat pada tabel 1.
Tabel 1. Pengamatan penanda resisten antibiotik.
Kelompok Media Hasil
7 Sensitivitas rifampisin Sensitif Mutasi spontan - 8 Sensitivitas rifampisin Sensitif
Mutasi spontan -
10
Uji sensitivitas Sensitif ( tidak tumbuh) Mutasi spontan Tidak mutasi
Kontrol 108
11
Uji sensitivitas Sensitif ( tidak tumbuh) Mutasi spontan Tidak mutasi
Pengujian keberadaan, sifat, dan aktivitas suatu bakteri pada habitat dan lingkungan hidupnya membutuhkan suatu metode khusus yang dapat mendeteksi kehadiran bakteri tersebut yang berasal dari isolate yang diujikan. Widanarni et al. (2004) menggunakan bakteri Vibrio harveyi berpenanda resisten antibiotik rifampisin untuk menguji sifat patogenisitasnya pada larva udang windu. Penanda resistensi terhadap antibiotik rifampisin (Rf) merupakan suatu pilihan karena bakteri asal laut pada umumnya sensitif terhadap rifampisin (Tjahjadi et al., 1994
dalam Widanarni et al.,2008).