2 TINJAUAN PUSTAKA
2.1 Teknologi Produksi Biodiesel
Lee et al. (2007) menyatakan salah satu sumber energi yang menjadi perhatian adalah bahan bakar fosil yang tidak dapat diperbaharui sehingga ketersediaannya yang semakin berkurang menjadi stimulus untuk mencari sumber-sumber energi terbarukan yang mempunyai kelebihan antara lain; tanpa emisi polutan, ketersediaan di alam dapat diperbaharui, sedikit limbah, tidak menyebabkan pemanasan global, harga stabil, dan menciptakan lapangan pekerjaan. Disebutkan dalam Demirbas (2005) biodiesel merupakan salah satu alternatif bahan bakar fosil yang dibuat dari sumber biologi terbarukan seperti lemak hewani dan minyak nabati, sehingga ketersediaannya di alam dapat diperbaharui, ramah lingkungan, dan dapat menciptakan lapangan pekerjaan baru.
Komponen utama dari minyak nabati dan lemak hewani adalah triasilgliserol (TAG) atau biasa disebut trigliserida. Secara kimiawi TAG termasuk ester yang tersusun dari fatty acids (FA) dengan gliserol. Biodiesel didapatkan dengan mereaksikan secara kimiawi minyak nabati dan lemak hewani dengan alkohol (biasanya metanol) sehingga terbentuk metil ester dan gliserol dengan reaksi transesterifikasi (Knothe et al. 2005). Biodiesel dapat diproduksi dengan bantuan katalis (katalitik) dan tanpa katalis (non-katalitik). Katalis yang biasa digunakan dalam reaksi dapat digolongkan kedalam tiga macam, yaitu katalis asam (H2SO4, H3PO4), katalis basa (NaOH, KOH), dan katalis enzim
(lipase). Penggunaan jenis katalis tergantung pada kandungan FFA (free fatty
acid) dalam minyak/lemak. Katalis basa digunakan untuk proses transesterifikasi,
sedangkan katalis asam untuk proses esterifikasi (Joelianingsih et al. 2007).
Reaksi kimia yang terjadi pada pembuatan biodiesel merupakan transesterifikasi dan esterifikasi. Reaksi transesterifikasi adalah proses yang mereaksikan trigliserida dalam minyak dengan alkohol (metanol) dan menghasilkan fatty acid metil ester (FAME) dan gliserol. Gambar 1 merupakan skema persamaan reaksi transesterifikasi, dimana R1, R2, R3 merupakan
hidrokarbon rantai panjang dari asam lemak. Sedangkan esterifikasi adalah proses yang mereaksikan asam lemak bebas dengan alkohol rantai pendek menghasilkan FAME dan air. Gambar 2 menunjukan skema reaksi esterifikasi.
Gambar 1 Persamaan reaksi transesterifikasi.
Gambar 2 Persamaan reaksi esterifikasi.
Metanol akan bereaksi dengan asam lemak dari trigliserida untuk membentuk FAME. Pertukaran ester dapat terjadi dengan atau tanpa katalis, tergantung suhu. Pada suhu 250oC atau lebih reaksi dapat terjadi tanpa katalis. Transesterifikasi membutuhkan kondisi yang bebas air karena adanya air dapat menyebabkan reaksi berubah menjadi hidrolisis (Joelianingsih et al. 2008a).
Kusdiana dan Saka (2001) menyatakan bahwa pembuatan biodiesel dengan katalis diawali dengan reaksi transesterifikasi, pengembalian metanol yang tidak bereaksi, pemurnian metil ester dari katalis, pemisahan gliserol yang merupakan produk samping, pemurnian menggunakan air (aquades) dengan cara pencucian berulang, sehingga proses ini lebih boros air. Reaksi pembuatan biodiesel dengan katalis mempunyai kelebihan yaitu reaksi dapat berjalan lebih cepat dan pada suhu yang rendah sedangkan kekurangannya adalah diperlukannya proses yang panjang untuk memurnikan produk dan perlu pengadukan yang kuat dalam reaksi karena metanol susah larut dalam minyak. Menurut Joelianingsih et al. (2007) proses pembuatan biodiesel secara non-katalitik mempunyai beberapa kelebihan diantaranya adalah tidak memerlukan penghilangan FFA dengan cara refining atau pra-esterifikasi. Reaksi esterifikasi dan transesterifikasi dapat berlangsung dalam satu reaktor sehingga minyak dengan kadar FFA tinggi dapat langsung digunakan. Selain itu, karena tanpa menggunakan katalis, proses pemisahan dan pemurnian produk menjadi lebih sederhana dan ramah lingkungan. Namun, proses non-katalitik biasanya menggunakan metanol sangat berlebih dengan suhu dan tekanan operasi lebih tinggi bila dibandingkan dengan proses katalitik.
O O ║ ║ H2C -O-C-R1 CH3 -O- C-R1 | O O CH2 -OH | ║ ║ | HC - O-C-R2 + 3 CH3OH → CH3 - O-C-R2 + CH - OH | O O | | ║ ║ CH2 -OH H2C- O-C-R3 CH3 –O-C-R3
TG 3 Metanol 3 FAME (ME) GL
R-COOH + CH3OH → R-COOCH3 + H2O
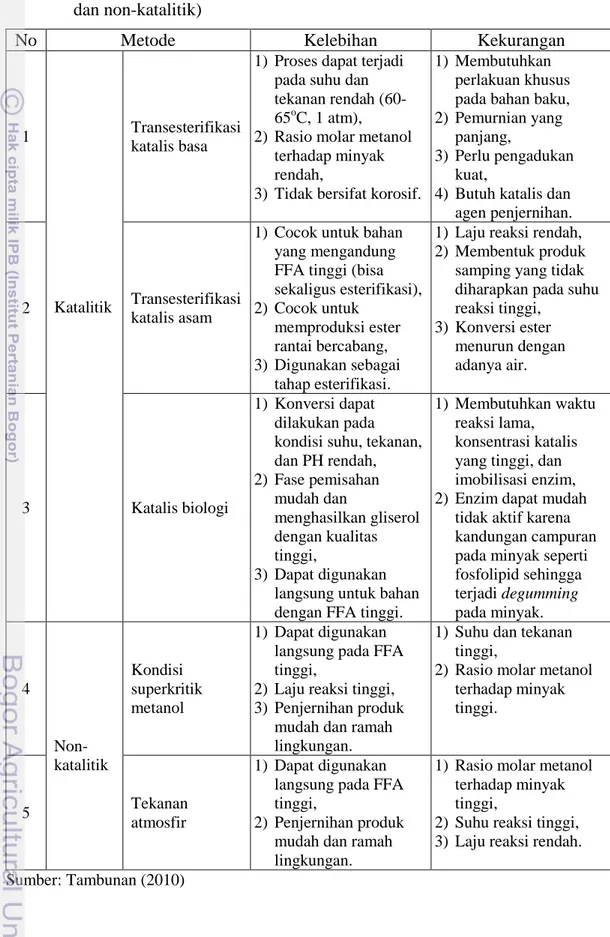
Perbandingan kelebihan dan kelemahan proses produksi katalitik dan non-katalitik dapat dilihat pada Tabel 2.
Tabel 2 Beberapa kelebihan dan kekurangan metode produksi biodiesel (katalitik dan non-katalitik)
No Metode Kelebihan Kekurangan
1
Katalitik
Transesterifikasi katalis basa
1) Proses dapat terjadi pada suhu dan tekanan rendah (60-65oC, 1 atm), 2) Rasio molar metanol
terhadap minyak rendah,
3) Tidak bersifat korosif.
1) Membutuhkan perlakuan khusus pada bahan baku, 2) Pemurnian yang
panjang,
3) Perlu pengadukan kuat,
4) Butuh katalis dan agen penjernihan.
2 Transesterifikasi katalis asam
1) Cocok untuk bahan yang mengandung FFA tinggi (bisa sekaligus esterifikasi), 2) Cocok untuk memproduksi ester rantai bercabang, 3) Digunakan sebagai tahap esterifikasi.
1) Laju reaksi rendah, 2) Membentuk produk
samping yang tidak diharapkan pada suhu reaksi tinggi, 3) Konversi ester menurun dengan adanya air. 3 Katalis biologi 1) Konversi dapat dilakukan pada kondisi suhu, tekanan, dan PH rendah, 2) Fase pemisahan mudah dan menghasilkan gliserol dengan kualitas tinggi, 3) Dapat digunakan langsung untuk bahan dengan FFA tinggi.
1) Membutuhkan waktu reaksi lama,
konsentrasi katalis yang tinggi, dan imobilisasi enzim, 2) Enzim dapat mudah
tidak aktif karena kandungan campuran pada minyak seperti fosfolipid sehingga terjadi degumming pada minyak. 4 Non-katalitik Kondisi superkritik metanol 1) Dapat digunakan langsung pada FFA tinggi,
2) Laju reaksi tinggi, 3) Penjernihan produk
mudah dan ramah lingkungan.
1) Suhu dan tekanan tinggi,
2) Rasio molar metanol terhadap minyak tinggi.
5 Tekanan
atmosfir
1) Dapat digunakan langsung pada FFA tinggi,
2) Penjernihan produk mudah dan ramah lingkungan.
1) Rasio molar metanol terhadap minyak tinggi,
2) Suhu reaksi tinggi, 3) Laju reaksi rendah. Sumber: Tambunan (2010)
Teknologi produksi biodiesel non-katalitik yang berkembang saat ini masih mengalami kendala terkait rasio energi dalam proses produksi karena nilainya masih lebih rendah dari produksi biodiesel secara katalitik. Oleh karena itu, diperlukan suatu terobosan teknologi yang dapat meningkatkan performansi dari sistem alat produksi biodiesel secara non-katalitik. Panas yang tidak termanfaatkan dalam sistem perlu didaur ulang, sehingga energi yang dipakai dapat lebih hemat. Perancangan alat penukar panas (APP) yang mampu meminimalisasi penggunaan energi pada sistem merupakan salah satu metode yang diharapkan mampu memecahkan persoalan itu.
2.2 Alat Penukar Panas
Alat penukar panas merupakan suatu perangkat yang digunakan untuk memudahkan perpindahan panas dalam satu atau lebih fluida. Perpindahan panas dari satu fluida ke lainnya terjadi melalui media padat yang memisahkan fluida tersebut (Suryanarayana dan Arici 2003).
Menurut Holman (1995) serta Suryanarayana dan Arici (2003) alat penukar panas dapat diklasifikasikan berdasarkan jenis aliran dan konstruksinya, yaitu:
1 Penukar panas pipa ganda. Terdiri dari dua pipa, satu fluida mengalir pada pipa dalam dan fluida lainnya mengalir melalui diantara pipa dalam dan pipa luar (annulus). Jika kedua fluida mengalir pada arah yang sama maka disebut alat penukar panas aliran paralel. Namun, jika berbeda arah maka disebut alat penukar panas aliran berlawanan.
2 Penukar panas cangkang-tabung. Terdiri dari cangkang (shell) dan tabung (tube). Suatu fluida mengalir dalam tabung, sedang fluida yang satu lagi dialirkan melalui selongsong melintasi luar tabung. Untuk menjamin bahwa fluida di selongsong mengalir melintasi tabung dan dengan demikian menyebabkan perpindahan kalor lebih tinggi, maka didalam selongsong itu dipasangkan sekat-sekat (baffles). Pada alat penukar panas ini dikenal aliran satu, dua, atau empat lintasan, tergantung kebutuhan.
3 Penukar panas aliran silang. Banyak dipakai dalam pemanasan dan pendinginan udara atau gas. Dalam penukar panas ini, fluida yang mengalir melintasi tabung disebut arus campur (mixed stream), sedang fluida dalam
tabung disebut arus tak campur (unmixed). Dikatakan bercampur karena dapat bergerak dengan bebas di dalam alat itu sambil menukar panas, fluida yang satu lagi terkurung di dalam tabung saluran penukar panas dan tidak dapat bercampur selama proses perpindahan panas.
4 Penukar panas lempeng. Terdiri dari satu set lempeng yang dipisahkan oleh sirip-sirip diantara lempeng.
5 Penukar panas kompak. Terutama digunakan dalam sistem aliran gas dimana koefisien perpindahan kalor menyeluruh adalah rendah dan memerlukan luas yang besar dalam volume kecil.
Tiap jenis penukar panas mempunyai fungsi dan efektifitas masing-masing. Namun, penggunaannya dapat disesuaikan dengan kondisi alat atau mesin yang akan dirangkai menjadi satu kesatuan kerja. Perancangan penukar panas pada alat produksi biodiesel non-katalitik bertujuan untuk mengefisienkan pemakaian energi dalam sistem produksi biodiesel sehingga lebih hemat energi dan biaya. Kelebihan dari sistem ini adalah mampu memanaskan metanol yang akan digunakan sehingga memperkecil adanya kehilangan panas dan penambahan daya listrik akibat pemanasan yang dimulai dari awal lagi. Prinsipnya suatu proses perancangan terdiri dari beberapa tahap atau proses sehingga menghasilkan suatu desain atau prototipe produk yang sesuai dengan kebutuhan.
2.3 Sifat Fisik dan Termal
Penentuan sifat fisik pada bahan yang akan digunakan dalam perancangan alat penukar panas mutlak dibutuhkan sehingga kebutuhan akan ukuran dan bentuk rancangan yang akan direalisasikan lebih tepat sehingga lebih efektif dan efisien. Beberapa sifat fisik dan termal yang penting untuk diketahui dari bahan yang akan dipakai (palm olein, metanol, maupun campuran keduanya) yaitu densitas, viskositas (dinamik dan kinematik), panas jenis, konduktivitas termal, bilangan Reynolds, bilangan Prandtl, bilangan Nusselt, dan koefisien pindah panas.
2.3.1 Densitas
Densitas atau rapat jenis (ρ) suatu zat adalah ukuran untuk konsentrasi zat tersebut dan dinyatakan dalam massa persatuan volume. Sifat ini ditentukan dengan cara menghitung rasio massa (m) zat yang terkandung dalam suatu bagian
tertentu terhadap volume (v) bagian tersebut, satuan yang digunakan adalah kg m-3. Sebagian besar minyak mempunyai densitas yang lebih kecil dari air. Pada umumnya densitas suatu minyak berbanding lurus dengan berat molekulnya dan berbanding terbalik dengan ketidakjenuhan dari minyak tersebut. Hal ini berarti semakin kecil nilai berat molekul suatu minyak maka semakin kecil nilai densitasnya, begitupun semakin tinggi tingkat ketidakjenuhan dari suatu minyak maka semakin rendah nilai densitas dari minyak tersebut. Nilai densitas juga dipengaruhi oleh suhu, semakin tinggi suhu maka densitas suatu fluida semakin kecil karena disebabkan gaya kohesi dari molekul-molekul fluida semakin berkurang (Coupland dan McClements 1997).
2.3.2 Viskositas
Coupland dan McClements (1997) menyatakan bahwa viskositas merupakan ukuran gesekan dalam suatu fluida, yang cenderung menghambat pergerakan dinamis dari suatu fluida. Sutiah (2008) membahasakan bahwa viskositas merupakan ukuran yang menyatakan kekentalan suatu cairan atau fluida. Kekentalan merupakan sifat cairan yang berhubungan erat dengan hambatan untuk mengalir. Beberapa cairan ada yang dapat mengalir cepat, sedangkan lainnya mengalir secara lambat.
Viskositas terbagi menjadi dua yaitu, viskositas kinematik dan dinamik. Viskositas dinamik untuk minyak dapat dicari menggunakan persamaan yang dibangun Ceirani dan Meirelles (2004) dalam Ceirani et al. (2007) sebagai berikut;
ln ηi = ∑ Nk k�A1k+BT1k− C1kln T − D1k� + �Mi∑ Nk k�A2k+BT2k− C2kln T −
D2k�� + Q (1)
Dimana Nk adalah jumlah grup dalam molekul i, M adalah berat molekul A,
B, C, dan D merupakan parameter yang telah ditentukan dari regresi data pengukuran, Q adalah angka koreksi yang didapat dari;
Q = ξ1q + ξ2 (2)
Dimana ξ1 dan ξ2 merupakan penghubung antara campuran, dan q
merupakan suatu fungsi suhu absolut;
α, β, γ, dan δ merupakan parameter yang telah ditentukan dari regresi data keseluruhan.
Efek fungsional group pada viskositas dinamik dikoreksi dengan Q menurut jumlah total atom karbon Nc pada molekul, seperti pada persamaan (4) ξ1
merupakan fungsi Nc yang diterapkan pada setiap campuran;
ξ1 = f0 + Ncf1 (4)
ξ2 menerangkan perbedaan antara tekanan uap isomer ester pada suhu yang
sama dan dihubungkan dengan nilai karbon fraksi pengganti (Ncs);
ξ2 = s0+ Ncss1 (5)
Dimana f0, f1, s0, dan s1 merupakan konstanta.
2.3.3 Panas Jenis
Panas jenis didefinisikan sebagai energi yang diperlukan untuk meningkatkan suhu satuan massa zat tertentu sebesar satu derajat. Pada umumnya energi akan tergantung pada bagaimana proses tersebut terjadi. Dalam termodinamika, terdapat dua macam panas jenis; panas jenis pada volume konstan Cv dan panas jenis pada tekanan konstan Cp. Panas jenis pada tekanan konstan Cp selalu lebih besar dari pada Cv, karena pada tekanan konstan, sistem mengalami ekspansi dan hal tersebut memerlukan energi (Coupland dan McClements 1997).
Nilai panas jenis untuk metanol (cair maupun gas) dihitung berdasarkan persamaan sebagai berikut;
Cp = A+BT+CT2+DT3+ET4 (6)
Dimana Cp merupakan fungsi dari suhu dan A, B, C, D, serta E merupakan ketetapan yang didapat dari Reklaitis (1983).
Nilai panas jenis untuk trigliserida, metil ester, dan gliserol dihitung menggunakan persamaan Rowlinson-Bondi dalam Morad (2000), yang mengestimasi menggunakan komponen murni asam lemak;
�Cp−Cpo�
R = 1.45 + 0.45(1 − Tr)−1+ 0.25ω�17.11 + 25.2(1 − Tr)1 3⁄ Tr−1+
1.742 (1 − Tr)−1� (7)
Dimana Cpo merupakan panas jenis pada gas ideal (kJ kg-1 oC-1), R adalah konstanta gas, Tr adalah suhu penurunan (K), dan ω merupakan faktor asentrik.
Cpo dapat dihitung menggunakan metode Joback (Lampiran 1) dengan
menghitung jumlah kontribusi atom atau molekul grup.
Cpo= �∑ nj j∆a− 37,93� + �∑ nj j∆b+ 0,210�T + �∑ nj j∆c− 3,91x10−4�T2+
�∑ nj j∆c− 2,06x10−7�T3 (8)
Sedangkan Tr dihitung menggunakan persamaan;
Tr = T/Tc (9)
Tc (K) dihitung menggunakan metode Fedors dalam Reid et al. (1988);
Tc = 535 log(∑ ∆T) (10)
Dimana ∆𝑇 merupakan suhu kritis kontribusi grup (K). Faktor asentrik 𝜔 dapat dihitung menggunakaan persamaan;
PcVc
RTc = 0.291 − 0.080ω (11)
Pc (bar) dan Vc (cm3 mol-1) dapat dihitung menggunakan metode Joback
dari persamaan dalam Reid et al. (1988) sebagai berikut;
Pc = (0.113 + 0.0032nA− ∑ ∆P)−2 (12)
Vc = 17.5 + ∑ ∆V (13)
nA merupakan nomor atom pada molekul, dan ∆P serta ∆V merupakan nilai
ketetapan yang sudah diberikan. 2.3.4 Konduktivitas Termal
Cengel (2003) menyatakan bahwa konduktivitas termal merupakan laju perpindahan panas melalui suatu lapisan bahan per unit area per unit perbedaan suhu, satuan W m-1 oC-1. Nilai konduktivitas termal menunjukan ukuran kemampuan suatu bahan untuk mengantarkan panas. Nilai konduktivitas termal pada metanol maupun minyak didapatkan dari regresi data pengukuran dalam Cengel (2003) dan Chempro (2010).
2.3.5 Bilangan Nusselt
Bilangan Nusselt termasuk kedalam salah satu bilangan parameter yang tak berdimensi. Didefinisikan sebagai perbandingan koefisien pindah panas konveksi dikali panjang karakteristik aliran dengan konduktivitas termal (Cengel 2003).
2.3.6 Bilangan Prandtl
Bilangan Prandtl menunjukan perbandingan difusivitas molekul dari momentum dan difusivitas molekul panas (Cengel 2003).
Pr = vα= µCpk (15)
2.3.7 Bilangan Reynolds
Bilangan Reynolds merupakan perbandingan antara gaya inersia dan viskositas dalam suatu fluida.
Re = (ρνd)µ (16)
Dimana 𝜈 merupakan kecepatan aliran. Bilangan Reynolds menunjukan suatu aliran bersifat turbulen atau laminar. Aliran bersifat turbulen terjadi jika gaya inersia yang merupakan kerapatan dan kecepatan fluida relatif lebih besar terhadap gaya viskos sehingga fluida cenderung acak dan berfluktuasi. Sedangkan aliran laminar terjadi jika gaya viskos cukup besar untuk mampu menahan gaya inersia yang terjadi dalam aliran fluida dan menjaga fluida untuk tetap berada pada garis aliran (Cengel 2003).
2.4 Energi, Entropi, dan Eksergi
Energi merupakan salah satu sumber kebutuhan mendasar bagi masyarakat, indeks kesejahteraan masyarakat suatu negara dapat diukur dari besarnya laju konsumsi energi. Hampir seluruh negara maju merupakan negara-negara yang mempunyai tingkat konsumsi energi paling tinggi. Oleh sebab itu, diperlukan sebuah terobosan untuk mampu menggunakan energi seefektif mungkin sehingga keberlanjutannya dapat dipertanggungjawabkan (Lee et al. 2007).
Energi merupakan konsep termodinamika yang fundamental dan merupakan salah satu aspek yang paling penting dalam suatu analisis keteknikan. Energi dapat terkandung dalam suatu sistem dengan berbagai bentuk makroskopik seperti energi kinetik, energi potensial, energi gravitasi, dan energi internal, yang dapat dikelompokkan sebagai inventory energy. Energi juga dapat diubah dari bentuk satu ke bentuk lainnya dan dapat dipindahkan diantara sistem atau biasa disebut sebagai transitory energy. Pada sistem tertutup dapat dipindahkan melalui bentuk kerja dan pindah panas (Bejan et al. 1996).
Dincer dan Cengel (2001) menjelaskan bahwa energi tidak dapat diciptakan dan dimusnahkan, hanya dapat berubah bentuk, pengertian ini disebut sebagai hukum termodinamika pertama. Hukum termodinamika pertama menerangkan mengenai energi internal dan pengembangan konservasi energi. Energi pada suatu sistem terbuka dapat berpindah dengan tiga bentuk: panas q, kerja W, dan aliran massa m. Interaksi energi dapat diketahui pada batasan suatu sistem apakah bertambah atau hilang dalam batasan sistem tersebut selama berlangsungnya proses. Persamaan umum untuk kesetimbangan energi atau hukum termodinamika pertama pada suatu proses dalam sistem adalah
Emasuk− Ekeluar
�����������
perpindahan energi dengan Q,W,dan m
= ∆E�����sistem
perubahan energi internal, kinetik,dan potensial
(17)
Hubungan ini dapat juga ditulis dalam bentuk per unit massa, diferensial, dan laju seperti;
emasuk− ekeluar= ∆esistem (18)
δEmasuk− δEkeluar= dEsistem (19)
Ėmasuk− Ėkeluar
�����������
laju perpindahan energi dengan Q,W,dan m
= ∆Ė�����sistem
laju perubahan energi internal, kinetik,dan potensial
(20)
Menurut Bejan et al. (1996) entropi merupakan bagian dari energi yang mengalami perubahan wujud dan tidak mampu melakukan kerja. Dincer dan Cengel (2001) menyatakan bahwa penjelasan mengenai perbedaan nyata antara proses reversible (mampu balik) dan irreversible (ketidakmampuan balik) dikenalkan pertama kali melalui konsep entropi. Dan hukum kedua termodinamika menyatakan bahwa setiap proses nyata berlangsung secara
irreversible. Ketika sebuah sistem terisolasi, peningkatan energi akan nol,
sehingga entropi akan naik dikarenakan proses irreversible dan kemungkinan akan mencapai nilai maksimumnya dan terjadi kesetimbangan termodinamika.
Perubahan yang terjadi pada sistem menyebabkan mutu dari energi yang dimanfaatkan pun naik-turun, perubahan mutu energi yang terjadi dapat diukur menggunakan konsep eksergi. Analisis eksergi digunakan untuk mencapai penggunaan sumber energi yang lebih efektif karena mampu menentukan kehilangan energi pada setiap posisi. Sehingga informasi tersebut dapat digunakan
untuk mendesain sistem baru yang lebih efisien energi ataupun untuk meningkatkan efisiensi pada sistem yang sudah ada (Bejan et al. 1996).
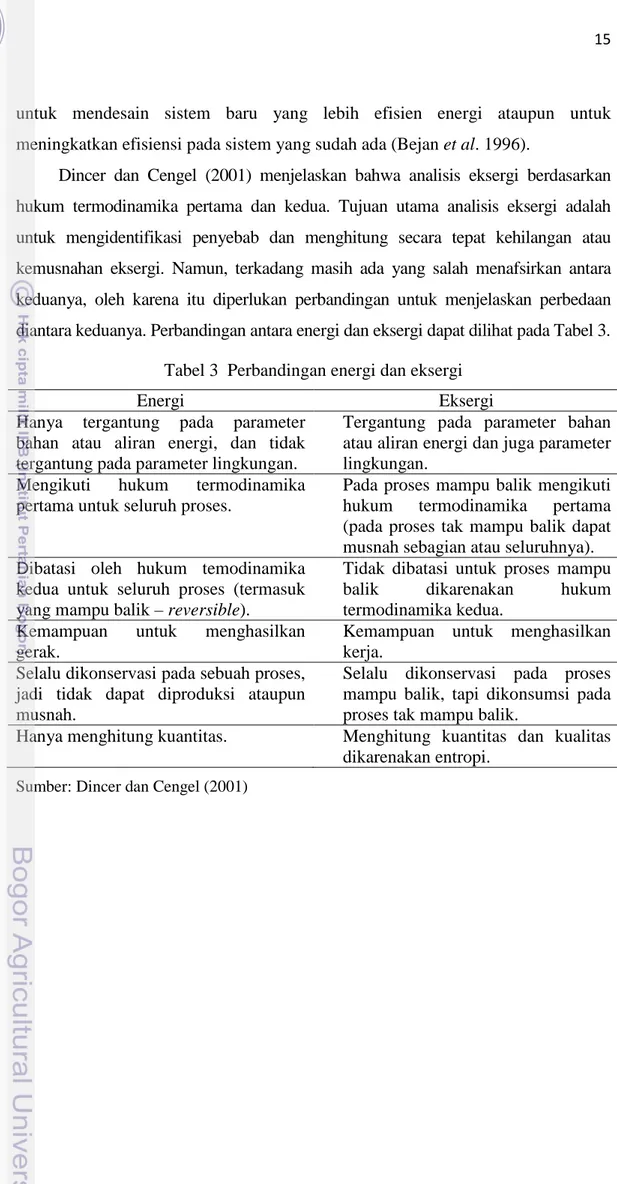
Dincer dan Cengel (2001) menjelaskan bahwa analisis eksergi berdasarkan hukum termodinamika pertama dan kedua. Tujuan utama analisis eksergi adalah untuk mengidentifikasi penyebab dan menghitung secara tepat kehilangan atau kemusnahan eksergi. Namun, terkadang masih ada yang salah menafsirkan antara keduanya, oleh karena itu diperlukan perbandingan untuk menjelaskan perbedaan diantara keduanya. Perbandingan antara energi dan eksergi dapat dilihat pada Tabel 3.
Tabel 3 Perbandingan energi dan eksergi
Energi Eksergi
Hanya tergantung pada parameter bahan atau aliran energi, dan tidak tergantung pada parameter lingkungan.
Tergantung pada parameter bahan atau aliran energi dan juga parameter lingkungan.
Mengikuti hukum termodinamika pertama untuk seluruh proses.
Pada proses mampu balik mengikuti hukum termodinamika pertama (pada proses tak mampu balik dapat musnah sebagian atau seluruhnya). Dibatasi oleh hukum temodinamika
kedua untuk seluruh proses (termasuk yang mampu balik – reversible).
Tidak dibatasi untuk proses mampu balik dikarenakan hukum termodinamika kedua.
Kemampuan untuk menghasilkan gerak.
Kemampuan untuk menghasilkan kerja.
Selalu dikonservasi pada sebuah proses, jadi tidak dapat diproduksi ataupun musnah.
Selalu dikonservasi pada proses mampu balik, tapi dikonsumsi pada proses tak mampu balik.
Hanya menghitung kuantitas. Menghitung kuantitas dan kualitas dikarenakan entropi.