PENGELOLAAN KUALITAS AIR PADA PEMBESARAN
UDANG VANAME (Litopenaeus vannamei)
DI TAMBAK INTENSIF
UD. SUKSES SEJAHTERA BALI
TUGAS AKHIR
NURAENI
1222020
JURUSAN BUDIDAYA PERIKANAN
POLITEKNIK PERTANIAN NEGERI PANGKAJENE DAN KEPULAUAN
PANGKEP
PENGELOLAAN KUALITAS AIR PADA PEMBESARAN UDANG
VANAME (Litopenaeus vannamei)
DI TAMBAK INTENSIF
UD. SUKSES SEJAHTERA BALI
TUGAS AKHIR
NURAENI
1222020
Sebagai Salah Satu Syarat untuk Menyelesaikan Studi pada Politeknik Pertanian Negeri Pangkajene dan Kepulauan
Telah Diperiksa dan Disetujui oleh Pembimbing:
Ir. Andi Yusuf Lingka, M.P. Ratnawati Rifai, S.Pi., M.Si. Ketua Anggota
Diketahui oleh :
Ir. Andi Asdar Jaya, M.Si. Ir. Rimal Hamal, M.P. Direktur Ketua Jurusan
KATA PENGANTAR
Puji syukur kehadirat Allah SWT, yang telah melimpahkan rahmat dan karunianya sehingga penulis dapat menyelesaikan laporan tugas akhir sebagai salah satu syarat menyelesaikan studi pada Politeknik Pertanian Negeri Pangkep, untuk itu patutlah penulis memanjatkan puja dan puji syukur kepada-Nya dan kepada beberapa pihak yang telah turut mendukung penyelesaian laporan tugas akhir ini. Oleh karena itu pada kesempatan ini saya hanturkan ucapan terima kasih kepada :
1. Ir. Andi Yusuf Lingka, M. P. selaku Pembimbing pertama dan Ratnawati Rifai, S. Pi., M. Si. selaku pembimbing anggota yang telah memberikan motivasi, arahan dan bimbingan mulai dari penyusunan proposal tugas akhir hingga penyelesaian laporan tugas akhir ini.
2. Arif Harianto, Edy Rosadi dan Supardi selaku Pembimbing Lapangan dan Manajer Teknis di UD. Sukses Sejahtera Bali
3. Indiarti Utami dan Ardiani selaku Analis Laboratorium UD. Sukses Sejahtera Bali
4. Ir. Rimal Hamal, M. P. selaku Ketua Jurusan Budidaya Perikanan
5. Ir. Andi Asdar Jaya, M. Si. selaku Direktur Politeknik Pertanian Negeri Pangkep.
Akhirnya dengan tulus penulis menghaturkan terima kasih kepada ayahanda tercinta Muh. Sabil dan ibunda tercinta Rohani serta paman Rimal Hamal dan tante Asma yang senantiasa memberikan support berupa moril, materil serta
dan teman-teman seangkatan di Jurusan Budidaya Perikanan atas keberadaan, pengorbanan, keikhlasan dan doamu menjadi motivasi saya untuk selalu semangat. Kepada, semua manajer teknis dan analis laboratorium UD. Sukses Sejahtera Bali, serta staf Laboran Politani yang tidak sempat disebut namanya, atas partisipasi dan bantuannya dalam penyelesaian studi ini.
Penulis menyadari bahwa penyusunan Laporan Tugas Akhir ini masih jauh dari kesempurnaan dan masih banyak terdapat kekurangan, untuk itu saran dan kritik yang sifatnya membangun penulis harapkan untuk memperbaiki ke depannya. Semoga tugas akhir ini bermanfaat bagi penulis dan para pembaca.
Aamiin .
Pangkep, Juni 2015
DAFTAR ISI
Halaman RINGKASAN i KATA PENGANTAR ii DAFTAR ISI iv DAFTAR TABEL viDAFTAR GAMBAR vii
DAFTAR LAMPIRAN viii
I PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan dan Kegunaan ... 2
II TINJAUAN PUSTAKA 2.1 Taksonomi dan Morfologi ... 3
2.2 Penyebaran dan Habitat ... 4
2.3 Parameter Kualitas Air Tambak ... 5
III METODE 3.1 Waktu dan Tempat ... 13
3.2 Alat dan Bahan ... 13
3.3 Metode Pengambilan Data ... 17
3.3.1 Data Primer ... 17
3.4.2 Pemeliharaan ... 20
3.4.3 Panen ... 26
3.5 Parameter yang Diamati dan Analisis Data ... 27
3.5.1 Parameter yang Diamati ... 27
3.5.2 Analisis Data ... 28
IV. HASIL DAN PEMBAHASAN 4.1 Kualitas Air ... 29
4.1.1 Parameter Fisika ... 29
4.1.2 Parameter Kimia ... 32
4.1.3 Parameter Biologi ... 41
4.2 Pertumbuhan dan Tingkat Kelangsungan Hidup (SR) ... 43
4.2.1 Pertumbuhan ... 43
4.2.2 Tingkat Kelangsungan Hidup (SR) ... 44
V. PENUTUP 5.1 Kesimpulan ... 46 5.2 Saran ... 46 DAFTAR PUSTAKA LAMPIRAN RIWAYAT HIDUP
DAFTAR TABEL
Halaman
1. Alat yang digunakan selama proses pengelolaan air budidaya
udang vaname ... 14
2. Bahan yang digunakan selama proses pengelolaan air budidaya udang vaname ... 15
3. Parameter fisika air budidaya udang vaname di tambak intensif ... 29
4. Parameter kimia air budidaya udang vaname di tambak intensif ... 32
5. Parameter biologi air budidaya udang vaname di tambak intensif ... 42
6. Jumlah tebar, hasil panen dan tingkat kelangsungan hidup (SR) pada pembesaran udang vaname... 45
DAFTAR GAMBAR
Halaman
1. Morfologi udang vaname ... 4
2. Posisi kincir ... 18
3. Hasil pengukuran salinitas ... 29
4. Hasil pengukuran alkalinitas ... 33
5. Hasil pengukuran ammonium (NH4) ... 34
6. Hasil pengukuran amoniak (NH3) ... 35
7. Hasil pengukuran bahan organik ... 37
8. Hasil engukuran oksigen terlarut ... 40
9. Hasil pengukuran pH ... 41
10. Hasil pengukuran vibrio sp. ... 43
DAFTAR LAMPIRAN
Halaman
1. Persentase Amoniak bebas (total amoniak at various temperature
and pH) ... 51 2. Hasil pengukuran alkalinitas, bahan organik, ammonium, amoniak, fofat
dan vibrio selama 111 hari ... 52 3. Hasil pengukuran pH dan salinitas selama 111 hari ... 57 4. Kegiatan persiapan lahan, pemeliharaan dan panen ... 61
RINGKASAN
NURAENI, 1222020. Pengelolaan Kualitas Air pada Pembesaran Udang
Vaname (Litopenaeus vannamei) di Tambak Intensif, UD Sukses Sejahtera Bali.
Dibimbing oleh Andi Yusuf Lingka dan Ratnawati Rifai.
Udang vaname (Litopenaeus vannamei) merupakan jenis udang introduksi. Habitat aslinya adalah dari Amerika Latin, tersebar mulai dari perairan Mexiko sampai Peru. Di daerah asalnya udang ini dibudidayakan secara semi intensif hingga intensif. Udang akan tumbuh dengan baik pada lingkungan budidaya yang kualitas airnya baik, kualitas air media budidaya berpengaruh langsung terhadap kehidupan udang yang dipelihara oleh karena itu pengelolaan kualitas air media sangat diperlukan untuk mendukung keberhasilan budidaya udang vaname.
Kegiatan ini bertujuan untuk meningkatkan pengetahuan, keterampilan dan pengalaman dalam pengelolaan kualitas air pada pembesaran udang vaname di tambak intensif. Hasil kegiatan ini diharapkan dapat menjadi salah satu bahan informasi yang bermanfaat mengenai teknik pengelolaan kualitas air pada pembesaran udang vaname di tambak intensif.
Metode pengumpulan data pada Tugas Akhir ini didasari oleh pelaksanaan Pengalaman Kerja Praktek Mahasiswa (PKPM) selama 3 bulan mulai dari 4 Februari sampai 4 Mei 2014. Data selama kegiatan diperoleh melalui pelaksanaan dan pengamatan secara langsung dari seluruh rangkaian kegiatan, hasil wawancara
dengan pembimbing lapangan, dosen pembimbing serta berbagai literatur
pendukung yang berkaitan dengan Tugas Akhir ini melalui penelusuran pustaka. Pelaksanaan kegiatan pengelolaan kualitas air budidaya udang vaname pada tambak intensif yang berlangsung di UD.Sukses Sejahtera Bali, dengan menggunakan tambak plastik dan pengelolaan air dengan pemberian bakteri menguntungkan untuk memperbaiki kualitas air serta megendalikan lingkungan tambak. Selama kegiatan budidaya berlangsung didapatkan kisaran parameter kualitas air sebagai berikut, kisaran parameter kualitas air pada saat pembesaran udang vaname adalah Oksigen Terlarut 4,49-7,05 ppm, Suhu 29,1-31,3 0C, pH 7,3-8,6, Salinitas 30-38 ppt. Bahan Organik 60,23-126,40 ppm, Alkalinitas 92-162 ppm, Ammonium 0,1-3 ppm, Nitrit 0-0,75 ppm, Nitrat 1-5 ppm, Fospat 0,25-1,7 ppm, Plankton 7.500-18.000 sel/ml, Vibrio 20-3660 sel/ml. Sedangkan hasil produksi yang didapat adalah 15.486,76 kg dengan size 28.
I PENDAHULUAN
1.1 Latar belakang
Tambak di Indonesia terdapat sekitar 419.282 Ha tambak air payau dan sekitar 913.000 Ha lahan lainnya yang potensial untuk budidaya. Hal ini dapat menjadi faktor pendukung dan pemicu perkembangan industri budidaya udang yang selaras dengan perkembangan ilmu pengetahuan baik di Indonesia, Asia bahkan masyarakat dunia secara umum.
Udang merupakan salah satu komoditi andalan ekspor non migas dari sub sektor perikanan yang memiliki nilai ekonomis tinggi, permintaan pasar yang sangat tinggi, baik lokal maupun pasar internasional seperti Singapura, USA dan Eropa. Permintaan udang dari tahun ketahun akan semakin meningkat sehingga usaha budidaya udang vaname di Indonesia cukup mendapat perhatian dari pihak pemerintah maupun swasta.
Udang vaname merupakan salah satu jenis udang yang tidak terlalu sulit untuk dibudidayakan baik di bak maupun di tambak. Untuk mendukung budidaya udang vaname, maka perlu diperhatikan berbagai faktor seperti pengelolaan kualitas air. Pengeloloaan air harus selalu memenuhi standar parameter kualitas air untuk budidaya udang vaname. Parameter kualitas air meliputi parameter fisika, kimia dan biologi. Kualitas air tambak merupakan salah satu faktor yang menentukan keberhasilan dan kegagalan budidaya udang vaname. Oleh karena itu kualitas air tambak, dalam budidaya udang vaname harus dikelola dengan baik.
1.2 Tujuan dan Manfaat
Tugas akhir ini bertujuan untuk menguraikan teknik pengelolaan kualitas air pada pembesaran udang vaname (Litopenaeus vannamei) di tambak intensif UD. Sukses Sejahtera Bali.
Manfaat tugas akhir ini yaitu untuk memperluas wawasan dan mengembangkan kompetensi keahlian mahasiswa dalam berkarya di masyarakat kelak khususnya mengenai pengelolaan kualitas air pada pembesaran udang vaname di tambak intensif.
II TINJAUAN PUSTAKA 2.1 Taksonomi dan Morfologi Udang Vaname
Menurut Haliman dan Adijaya (2005), taksonomi udang vaname adalah sebagai berikut :
Kingdom : Animalia
Sub Kingdom : Metazoa
Filum : Arthropoda
Sub Filum : Crustacea
Kelas : Malacostraca
Sub kelas : Eumalacostraca
Superordo : Eucarida
Ordo : Decapoda
Sub Ordo : Dendrobrachiata
Famili : Penaeidae
Genus : Litopenaeus
Species : Litopenaeus vannamei
Tubuh udang vaname dibentuk oleh dua cabang (biramous), yaitu exopodite dan endopodite. Vaname memiliki tubuh berbuku-buku dan aktivitas berganti kulit luar atau eksoskeleton secara periodic (moulting). Bagian tubuh udang vaname sudah mengalami modifikasi sehingga dapat digunakan untuk keperluan makan, bergerak, membenamkan diri ke dalam lumpur (burrowing), menopang ingsang karena struktur
insang udang mirip bulu unggas, serta sebagai organ sensor (Haliman dan Adijaya, 2005).
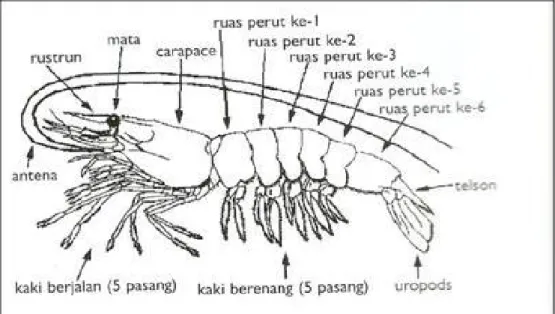
Bentuk morfologi udang vaname menurut Wyban dan Sweeney (1997) dapat dilihat pada Gambar 1.
Gambar 1. Morfologi udang vaname
2.2 Penyebaran dan Habitat
Udang vaname hidup di dua habitat dalam siklus hidupnya. Udang dewasa hidup dan bertelur di laut. Telur akan menetas menjadi nauplius, kemudian setelah 45-60 jam akan berkembang menjadi mysis setelah lima hari. Mysis berkembang menjadi post larva setelah empat atau lima hari. Mysis berkembang menjadi post larva setelah empat atau lima hari. Selama stadia nauplius sampai dengan post larva, hidupnya mengikuti gerakan air dan arus laut. Post larva yang hidup di pantai-pantai
Penyebaran udang vaname meliputi Amerika Latin seperti Meksiko, Nikaragua dan Puertorico. Udang ini kemudian diimpor oleh Negara-negara pembudidaya udang di Asia seperti China, India, Thailand, Bangladesh, Vietnam dan Malaysia. Dalam perkembangannya, Indonesia kemudian juga memasukkan udang vaname sebagai salah satu jenis udang budidaya tambak (Amri dan Iskandar, 2008).
2.3 Parameter Kualitas Air
Amri dan Iskandar (2008) menyatakan bahwa sebagai organisme hidup dan berkembang di dalam air, kelangsungan hidup udang vanamei dari saat ditebar sampai dipanen sangat dipengaruhi oleh kualitas air tempat udang tersebut dibudidayakan. Itu sebabnya, untuk menghindari kegagalan dalam budidaya udang vaname, pengelolaan kualitas air secara baik dan benar menjadi prioritas utama.
Kualitas air tambak berkaitan erat dengan kondisi kesehatan udang. Kualitas air
yang baik mampu mendukung pertumbuhan udang secara optimal. Hal ini
berhubungan dengan faktor stres udang akibat perubahan kualitas air di tambak. Beberapa parameter kualitas air yang harus selalu dipantau yaitu suhu, salinitas, pH air, kandungan oksigen terlarut (Dissolved oxygen) dan amonia. Parameter-parameter tersebut akan mempengaruhi proses metabolisme tubuh udang, seperti keaktifan mencari makan, proses pencernaan, dan pertumbuhan udang (Haliman dan Adijaya 2005).
2.3.1 Oksigen Terlarut
matinya organisme. Ketersediaan oksigen dalam air sangat menentukan kehidupan udang, baik untuk kelangsungan hidup maupun untuk pertumbuhannya. Rendahnya kandungan oksigen di tambak sering terjadi pada periode musim kemarau yang tidak berangin. Di samping itu, pada malam hari di mana suhu menjadi rendah yang diikuti dengan meningkatnya aktivitas fitoplankton, sering mengakibatkan turunnya kandungan oksigen (Amri dan Iskandar, 2008). Pada siang hari, tambak akan memiliki angka DO yang cenderung tinggi karena adanya proses fotosintesis plankton yang menghasilkan oksigen. Upaya untuk meningkatkan angka DO dilakukan dengan pemakaian kincir air. Oksigen terlarut yang baik berkisar 4 6 ppm (Haliman dan Adijaya 2005).
Oksigen sangat dipengaruhi oleh salinitas, suhu dan tekanan atmosfir. Selain itu oksigen sangat berpengaruh terhadap daya larut dan ketersediaan nutrien penting dalam air. Oksigen terlararut merupakan salah satu penyebab utama kematian dan keterlambatan pertumbuhan udang pada tambak semi intensif maupun intensif (Hudaya at al, 1993 dalam Patiroi, 2000)
2.3.2 Suhu
Menurut Amri dan Iskandar (2008), suhu merupakan salah satu faktor penentu bagi kehiduapan udang. Kisaran suhu air di tambak yang baik bagi kehidupan udang vaname adalah antara 26 0C - 30 0C . Guncangan suhu yang dapat ditoleransi adalah tidak lebih dari 20 C. Untuk itu harus dihindari perubahan suhu secara mendadak karena akan langsung berpengaruh pada kehidupan udang. Jika suhu air tambak turun
mengalami stres yang disebabkan oleh tingginya kebutuhan oksigen akibat cepatnya
metabolisme. Sementara bila suhu berada di bawah 140C maka dapat mengakibatkan
kematian udang vaname. Untuk menghindari kenaikan suhu terutama pada musim kemarau, umumnya dilakukan pendalaman atau upaya menaikkan permukaan air dengan memasukkan air baru yang suhunya lebih rendah.
Menurut Haliman dan Adijaya (2005), suhu air di bawah 250 C, umumnya terjadi saat masa masa peralihan musim antara Juni Agustus, udang sudah kurang aktif mencari pakan. Langkah pertama yang harus segera dilakukan yaitu mengurangi jumlah pakan yang diberikan untuk mencegah terjadinya overfeeding. Pada suhu di bawah 250 C, nafsu makan udang berkurang sehingga perlu diambil solusi supaya nafsu makannya kembali membaik dan ketahanan tubuhnya meningkat. Beberapa cara yang dapat diaplikasi yaitu penambahan antraktan (minyak ikan dan minyak cumi), imunostimulan (vitamin C dan peptidoglikan), serta pakan segar (cumi, kepiting dan rebon). Pemberian pakan segar perlu dicermati agar tidak merusak kualitas air tambak. Pemberian pakan tidak boleh berlebih karena pakan tidak terdekomposisi akan menimbulkan senyawa berbahaya bagi kehidupan udang, seperti amoniak dan nitrit.
2.3.3 pH
pH merupakan parameter air untuk mengetahui derajat keasaman suatu perairan.
Tingkat kemasaman atau pH pada hakekatnya adalah negatif dari logaritma
konsentrasi ion hidrogen (H+). Apabila konsentrasi ion H+ meningkat maka nilai pH menjadi rendah. Demikian sebaliknya, apabila konsentrasi ion H+ menurun, pH
menimbulkan gangguan fisiologis. Secara tidak langsung pH juga mempengaruhi kehidupan organisme kultivan melalui efeknya terhadap parameter lain seperti tingkat toksik amonia (Haliman dan Adijaya 2005).
Menurut Mujiman (2000), pH air tambak udang dapat berubah menjadi asam karena meningkatnya benda benda membusuk dari sisa-sisa pakan atau yang lain. Pada sore hari pH air biasanya lebih tinggi daripada di pagi hari penyebabnya adalah kegiatan fotosintesis fitoplankton dalam air yang menyerap CO2 sehingga menjadi
sedikit, sedangkan di pagi hari CO2 banyak sebagai hasil dari kegiatan pernapasan
binatang maupun fitoplankton dan juga pembusukan di dalam air.
Air tambak memiliki pH ideal antara 7,5 8,5. Umumnya perubahan pH air dipengaruhi oleh sifat tanahnya. Tanah yang mengandung pirit cenderung pH air
bersifat masam dan kisaran pH antara 3 4. Umumnya pH air tambak pada sore hari
lebih tinggi dari pada pagi hari. Penyebabnya yaitu adanya kegiatan fotosintesis oleh fitoplankton yang menyerap CO2. Sebaliknya pada pagi hari CO2 melimpah sebagai
hasil pernafasan udang (Haliman dan Adijaya 2005).
2.3.4 Salinitas
Salinitas merupakan kadar garam atau tingkat keasinan air. Secara ilmiah salinitas didefenisikan sebagai total padatan dalam air setelah semua karbonat dan senyawa organik dioksidasi, bromida dan iodida dianggap sebagai klorida. Besarnya salinitas dinyatakan dalam permil ( ) dan ada juga menyebutnya dalam gram per kilogram (ppt). Untuk mengukur salinitas air tambak secara praktis dapat digunakan
antara 10 35 . Pertumbuhan yang baik (optimal) diperoleh pada kisaran salinitas
15 20 (Amri dan Iskandar, 2008).
Salinitas sangat berpengaruh terhadap udang yaitu dalam proses osmoregulasi, dengan adanya salinitas udang juga dapat melakukan penyerapan dan pembuangan air secara terus-menerus hal ini dilakukan untuk mencegah kehilangan air dalam tubuhnya sehingga lama kelamaan terjadi pengerasan exoskeleton (kulit luar). Dalam keadaan seperti ini kondisi udang dapat menjadi stres karena banyak mengeluarkan energi untuk penyesuain terhadap kondisi lingkungan. Disamping itu juga menyebabkan nafsu makan berkurang, sehingga menghambat pertumbuhan. Untuk mengatasi ini, melakukan penggantian air lebih dari 20% perhari dan menaikkan tinggi air tambak mencapai 120 cm sehingga menjamin lingkungan yang baik yang dapat mendukung pertumbuhan udang pemeliharaan (Nasrullah, 2003).
2.3.5 Alkalinitas
Alkalinitas adalah salah satu parameter kimia air yang merupakan faktor kapasitas untuk menetralkan asam yang berfungsi sebagai buffer untuk menyangga perubahan pH. Standart alkalinitas dalam budidaya adalah diatas 90 ppm. Apabila air tambak mempunyai nilai alkalinitas di bawah standart maka dapat dilakukan adalah treatment kapur CaCO3. Alkalinitas yang terdapat dalam perairan secara langsung tidak mempengaruhi adanya organisme akuatik, karena alkalinitas dalam perairan berperan sebagai penetral keasamaan pH dalam perairan. Kemudian pH inilah yang mempengaruhi organisme akuatik. Alkalinitas merupakan faktor kapasitas untuk
banyak dibutuhkan untuk mencegah supaya air tidak menjadi asam (Lesmana, 2005
dalam Wahyuningsi, 2014)
Parameter ini secara tidak langsung menunjukkan tingkat kesuburan tambak karena kontribusinya dalam penyediaan CO2 untuk keperluan fotosintesis dan HCO3
dalam penyediaan unsur penyangga (buffer). Alkalinitas diukur dengan metode titrasi setiap 3 hari sekali. Nilai optimal alkalinitas dalam tambak adalah 90 150 ppm (Sulistinarto dan Adiwijaya, 2008).
2.3.6 Amoniak (NH3)
Amoniak merupakan senyawa yang juga sangat berpengaruh terhadap pertumbuhan udang. Penyebab timbulnya amonia di dalam tambak adalah akibat adanya sisa pakan yang tidak termakan, bangkai hewan dan tumbuhan, kotoran udang dan bahan organik lainnya (seperti ganggang) yang membusuk. Pada konsentrasi di atas 0,45 ppm amoniak dapat menghambat pertumbuhan udang sampai 50 %. Untuk menunjang pertumbuhan udang yang baik, amoniak yang terdapat dalam air tambak tidak boleh lebih dari 0,1 ppm (Amri dan Iskandar, 2008).
Sumber utama amoniak adalah hasil perombakan bahan organik yang terbesar berasal dari kotoran udang dan sisa-sisa pakan membusuk di dasar tambak. Selain itu, merupakan hasil dari aktivitas jasad renik dalam proses dekomposisi bahan organik yang kaya akan nitrogen. Bila kadar amoniak tinggi biasanya diikuti oleh naiknya nitrit karena nitrit merupakan hasil reaksi oksidasi amoniak oleh bakteri nitosomonas (Ramli, 2000)
2.3.7 Nitrit (NO2)
Senyawa ini juga merupakan hasil sampingan dari proses perombakan bahan organik. Dalam kondisi normal, konsentrasi nitrit sangat jarang mencapai konsentrasi mematikan udang. Bila kadar oksigen dalam air tinggi, senyawa ini akan teroksidasi menjadi nitrat (NO3) yang dapat dimanfaatkan oleh phytoplankton sebagai nutrien.
Senyawa ini diukur sebagai salah satu indikator kesuburan tambak, kekurangan unsur N ini dapat disuplai dengan pemupukan urea. Sama halnya dengan senyawa amoniak, pengukuran senyawa ini menggunakan spectrofotometer atau test nitrit kit air, kandungan nitrit yang baik yaitu < 0,5 ppm (Amri dan Iskandar, 2008).
Nitrit merupakan hasil reaksi oksidasi amoniak oleh bakteri nitrosomonas, naiknya kadar nitrit disebabkan oleh lambatnya perubahan dari nitrit ke nitrat oleh bakteri nitrobakter (Boyd, 1992 dalam Fajar, 2009).
2.3.8 Fosfat (PO4)
Menurut Sulistinarto dan Adiwijaya (2008), fosfat merupakan faktor pembatas produktivitas plankton. Oleh karena itu keberadaannya di dalam air tambak harus selalu dimonitor. Untuk menganalisanya diperlukan spectrofotometer, oleh sebab itu sampel air dibawa ke laboratorium. Analisa parameter ini dilakukan 3 hari sekali dan air contoh diambil dari kolom air, untuk keakuratan data maka pengukuran fosfat dilakukan bersamaan dengan pengukuran nitrat dan plankton.
Fosfat yang rendah dapat mengakibatkan pertumbuhan plankton terhambat dan sebaliknya kandungan yang tinggi akan mengakibatkan pertumbuhan plankton yang
kandungan fosfat rendah maka penumbuhan plankton akan rendah (Sulistinarto dan Adiwijaya, 2008).
2.3.9 Plankton
Plankton merupakan organisme pelagis yang mengapung atau bergerak mengikuti arus. Plankton terdiri dari dua tipe yaitu fitoplankton dan zooplankton keduanya mempunyai peran penting dalam ekosistem di perairan. Beberapa jenis plankton dari jenis diatom, chlorophyceaea, crustacea kecil dan zoobenthos merupakan makanan (alami) yang baik bagi udang. Namun demikian, banyak jenis cyanophyceae, dinophyceae serta protozoa tidak baik bahkan merugikan bagi udang. Oleh karena itu, keberadaannya harus selalu dimonitor. Pengamatan plankton dapat dilakukan seminggu sekali dan dilakukan pada jam serta titik yang sama setiap pengamatan. Untuk memudahkan membaca kemelimpahan plankton, maka pengukuran sebaiknya dilakukan bersamaan dengan pengukuran phospat dan nitrat (Sulistinarto dan Adiwijaya, 2008).
Plankton terbagi atas dua kelompok yaitu fitoplankton (plankton nabati) dan zooplankton (plankton hewani) merupakan komponen utama dalam rantai makanan ekosistem perairan. Fitoplankton sebagai tumbuhan yang mengandung pigmen klorofil mampu melaksanakan reaksi fotosintesis diimana air dan karbondioksida dengan adanya sinar surya dan garam-garam hara dapat menghasilkan senyawa organik seperti karbohidrat. Fitoplankton memberi kontribusi yang besar terhadap produktivitas primer di dalam air (Haryanto, 2013).
III METODE 3.1 Waktu dan Tempat
Tugas akhir ini disusun berdasarkan dari hasil kegiatan Pengalaman Kerja Praktik Mahasiswa (PKPM) yang dilaksanakan selama tiga bulan, mulai 4 Februari sampai 4 Mei 2015 di Tambak Udang Intensif UD. Sukses Sejahtera Bali, di Dusun Banjar Taman Desa Tuwed Kecamatan Melaya Kabupaten Jemberana Propinsi Bali.
3.2 Alat dan Bahan
Alat yang dipakai selama proses pengelolaan air pada budidaya udang vaname dapat di lihat pada Tabel 1.
Tabel 1. Alat yang dipakai selama proses pengelolaan air pada budidaya udang vaname
No Alat Spesifikasi Kegunaan
1. Aerasi Untuk mensuplai oksigen dalam
bak sebelum penebaran
2. Anco Untuk pemberian pakan
3. Bak 1000 L Wadah penampungan benih
sebelum ditebar
4. Baskom 50 L Sebagai tempat pakan, kaptan
dan probiotik
5. Blue tip 5 ml Untuk memindahkan sampel ke
dalam media kultur
6. Botol sampel 50 ml Digunakan untuk menyimpan
sampel dari petakan
7. Bunsen Membantu proses kultur bakteri
Lanjutan Tabel 1
No. Alat Spesifikasi Kegunaan
9. Cawan petri Wadah media kultur bakteri vibrio
10. Corong Untuk memindahkan larutan ke
wadah lain
11. DO Meter Alat untuk mengukur oksigen
terlarut dan suhu
12. Drum biru 200 L Wadah kultur probiotik
13. Drum putih 40 L Wadah kultur probiotik
14. Erlenmeyer 100 ml Wadah sampel untuk mengukur
parameter kualitas kimia air
15. Filler Untuk memindahkan cairan ke
wadah lain
16. Gayung 1 L Digunakan untuk mengambil pakan
17. Handrefraktometer
Alat untuk mengukur salinitas
18. Hockey stick Untuk meratakan sampel di
permukaan media kultur
19. Kincir 1 & 2 HP Untuk mengsuplai oksigen
20. Mikroskop Alat untuk melihat jumlah
plankton dalam air
21. Molen Alat untuk mencampur pakan
22. Papan Sebagai penutup pintu masuk dan
pengeluaran pada tambak
23. pH Pen Alat untuk mengukur pH air
Lanjutan Tabel 1
No. Alat Spesifikasi Kegunaan
24. Pipa spiral Alat yang digunakan dalam proses
penyiponan
25. Pipet Untuk memindahkan cairan
25. Pompa alkom 14 inchi Sebagai alat penyuplai air dari laut
26. Pompa celup 1 inchi Alat untuk memindahkan
probiotik yang telah dipanen
27. Spoit 5 ml Untuk mengambil sampel air
28. Tabung reaksi 5 & 10 ml Untuk wadah
29. Timbangan 60 kg Untuk menimbang pakan, kapur,
kaporit dan campuran pakan
Bahan yang digunakan selama proses pengelolaan air pada budidaya udang vaname dapat di lihat pada Tabel 2.
Tabel 2. Bahan yang dipakai selama proses pengelolaan air pada budidaya udang vaname
No Bahan Spesifikasi Kegunaan
1. Air Laut Cair Sebagai media budidaya
2. Air Tawar
Cair Untuk membersihkan alat-alat yang
telah digunakan
3. Alkohol Cair Sebagai bahan untuk menstrilkan
alat-alat di laboratorium
4. Akuadest Cair Untuk menetralkan
5. Azomite Bubuk Untuk campuran pakan
Lanjutan Tabel 2
No Bahan Spesifikasi Kegunaan
7. Bakteri Laktobacillus sp Cair Untuk menekan pertumbuhan bakteri
vibrio
8. Bestacin Bubuk Untuk sterilisasi air media
9. Detol Cair Sebagai bahan untuk mensterilkan
alat-alat
10. Dolomit Bubuk Untuk menumbuhkan plankton dan
mengubah warna air
11. HCL Cair Untuk membunuh kista dan plankton
merugikan
12. H2O2 Cair Desinfektan pada saat pengeringan
13. H2SO4 Cair Bahan yang digunakan pada pengukuran
alkalinitas
14. H2C2O4 Cair Bahan yang digunakan pada pengukuran
bahan organik
15. Indikator MO Cair Bahan yang digunakan pada pengukuran
alkalinitas
16. Indikator PP Cair Bahan yang digunakan pada pengukuran
alkalinitas
17. Kaptan Bubuk Untuk menetralkan pH di petakan
18. KMnO4 Cair Bahan yang digunakan pada pengukuran
bahan organik
19. Media TCBS Bubuk Untuk media menumbuhkan bakteri
20. Niclostop Cair Untuk sterilisasi air media
21. Nupro Bubuk Untuk campuran pakan
22. Pakan Irawan Padat Untuk makanan udang
23. Probiotik Cair Berfungsi untuk menguraikan bahan
organik dan menekan vibrio dan BGA
24. Progol Bubuk Campuran pakan
25. Triclore Bubuk Untuk sterilisasi air di tandon
26. Teskit Cair & bubuk Bahan untuk mengukur kandungan
3.3 Metode Pengumpulan Data 3.2.1 Data Primer
Data primer didapatkan dan disusun berdasarkan hasil kegiatan praktik selama pelaksanaan PKPM di Tambak Udang Intensif UD. Sukses Sejahtera Bali, di Dusun Banjar Taman Desa Tuwed Kecamatan Melaya, Kabupaten Jemberana, Bali.
3.2.2 Data Sekunder
Data sekunder didapatkan dan disusun berdasarkan dari hasil wawancara dengan pembimbing lapangan dan analis laboratorium serta penelusuran berbagai literatur pendukung yang berkaitan dengan tugas akhir melalui penelusuran pustaka.
3.4 Metode Pelaksanaan
3.4.1 Persiapan
A. Pengeringan
- Air yang ada dalam kolam dikeluarkan melalui pintu pengeluaran dan central drain - Tritip yang menempel pada dinding, kincir dan kabel dibersihkan menggunakan
besi pembersih tritip
- Tritip yang telah dibersihkan dari dinding, kincir dan kabel dikumpulkan dalam satu tempat kemudian dimasukkan ke dalam ember dan diangkat ke tanggul petakan - Tambak yang telah dibersihkan dibilas dengan cara penyemprotan menggunakan air
laut hingga dasar tambak benar-benar bersih dari kotoran.
- Tambak yang telah kering setelah pembilasan dan pemberian H2O2 dapat diberikan
desinfektan berupa larutan HCl dengan dosis 10 ppm yang mampu membunuh kista, plankton yang merugikan serta menurunkan pH.
C.Setting kincir
- Kincir disiapkan sesuai kebutuhan dengan penentuan jumlah 1 kincir untuk 200 m2 - Titik penentuan kincir ditentukan dan pemberat ditempatkan 4 titik untuk 1 kincir - Settingan kincir dipastikan dapat menyentralkan lumpur dan mensusplai oksigen
serta pemerataannya seperti pada Gambar 2.
Gambar 2. Posisi kincir
D. Penutupan Pintu dan Pemasukan Air
- Alat dan bahan disiapkan
- Selah-selah papan dilapisi terpal atau sak pakan kemudian diisi diberi tanah dan air serta diinjak-injak agar tanah rapat sehingga air tidak dapat keluar
- Tinggi pintu air disesuaikan dengan tinggi pematang
- Penutupan pintu selesai maka dapat dilanjutkan dengan pemasukan air
- Pompa air laut dinyalakan dan air dialirkan ke petakan hingga tinggi maksimal.
E. Sterilisasi Air
- Air yang telah dimasukkan ke dalam petakan dapat disterilkan dengan desinfektan berupa Niclostop dengan tujuan dapat membunuh jenis bibit tritip, tiram dan jenis keong dengan dosis 2 ppm
- Sehari setelah pemberian niclostop dapat diberi desinfektan berupa Bestacin dengan dosis 2 ppm dengan tujuan dapat membunuh jenis crustacean
- Hari berikutnya dapat diberi Triclore dengan dosis 30 ppm sebagai sterilisasi akhir.
F. Pembentukan Media
- Pemberian kapur dolomit dengan dosis 15 - 20 ppm yang berfungsi menumbuhkan plankton dan mengubah warna air
- Pemberian kapur dolomit dilakukan selama 3 hari sekali dalam 1 minggu
- Pemberian dolomit diselingi dengan probiotik yang diberikan setiap hari untuk membentuk kualitas air yang baik yang dimulai dari pembentukan media hingga akhir pemeliharaan.
3.4.2 Pemeliharaan
1. Pengukuran Paremeter Kualitas Air Media Budidaya
A. Pengukuran DO (Disolved Oksigen)
- DO meter disiapkan
- Tombol power ditekan untuk menghidupkan DO meter
- Elektroda dimasukkan ke media budidaya
- Nilai DO adalah disaat nilai DO pada layar stabil (berhenti) dan dicatat
- Tombol power ditekan untuk mematikan DO meter.
- Elektroda dibilas dengan akuades dan dilap dengan menggunakan tissue.
B. Pengukuran Suhu
- DO meter disiapkan
- Tombol power ditekan untuk menghidupkan DO meter
- Elektroda dimasukkan ke media budidaya
- Nilai suhu adalah disaat nilai suhu pada layar stabil (berhenti) dan dicatat - Tombol power ditekan untuk menghentikan operasional alat
- Elektroda dibilas dengan aquades dan dilap dengan menggunakan tissue.
C. Pengukuran pH
- pH pen disiapkan
- Tombol power pH pen ditekan untuk mengaktifkan pH pen
- Probe pH pen dibilas dengan akuades dan dilap dengan tissue.
D. Pengukurn Salinitas
- Handrefraktometer disiapkan
- Kaca prisma handrefraktometer dikalibrasi dengan akuadest sehingga nilai menunjukkan angka 0
- Air sampel dipipet dan diteteskan pada kaca prisma
- Handrefraktometer diterawang dengan mengarah ke cahaya yang terang untuk melihat nilai Salinitas
- Nilai salinitas dapat dicatat.
- Kaca prisma dibilas dengan menggunakan akuades dan dikeringkan dengan menggunakan tissue.
E. Pengukuran Alkalinitas
- Sampel air diambil sebanyak 50 ml menggunakan gelas ukur dan dimasukkan ke dalam erlenmeyer
- Ditambahkan 2 tetes indikator PP
- Ditambahkan 2 tetes indikator MO, digoyangkan agar homogen dan akan berwarna kuning muda.
- Dititrasai dengan H2SO4 0,02 N perubahan warna dari kuning akan berubah menjadi
orange
- Sampel air diambil sebanyak 5 ml dengan menggunakan spoit kemudian dimasukkan ke dalam tabung reaksi
- Ditambahkan 0,4 ml larutan NH4-1 kemudian ditambahkan 1 sendok NH4-2 lalu
dikocok hingga homogen dan didiamkan selama 5 menit
- Ditambahkan 4 tetes larutan NH4-3 kemudian dihomogenkan dan didiamkan selama 7
menit
- Nilai Ammonium dapat dilihat dengan mencocokkan dengan testkit dan angka yang tertera pada kertas testkit.
G. Pengukuran Amoniak (NH3)
- Nilai ammonium sebagai bahan untuk menentukan nilai amoniak
- Nilai ammonium dimasukkan ke dalam rumus penentuan amoniak, dengan melihat
tabel persentase amoniak bebas (total amonia at various temperature and pH) - Nilai dihitung dan dicatat.
H. Pengukuran Nitrat (NO3)
- Tabung reaksi di simpan di atas nampan
- Sampel air diambil sebanyak 5 ml dengan menggunakan spoit kemudian dimasukkan ke dalam tabung reaksi
- Ditambahkan 2 sendok NO3 -1 kemudian dihomogenkan dan didiamkan selama 5
menit
- Nilai Nitrat dapat dilihat dengan mencocokkan dengan testkit dan angka yang tertera pada kertas testkit.
I. Pengukuran Nitrit (NO2)
- Tabung reaksi disimpan di atas nampan
- Sampel air diambil sebanyak 5 ml dengan menggunakan spoit kemudian dimasukkan ke dalam tabung reaksi
- Ditambahkan 1 sendok NO2-1 kemudian dihomogenkan dan didiamkan selama 5
menit.
- Nilai Nitrit dapat dilihat dengan mencocokkan dengan testkit dan angka yang tertera pada kertas testkit.
J. Pengukuran Fosfat (PO4)
- Tabung reaksi disimpan di atas nampan
- Sampel air diambil sebanyak 5 ml dengan menggunakan spoit kemudian dimasukkan ke dalam tabung reaksi
- Ditambahkan 5 tetes larutan PO4-1 kemudian dihomogenkan
- Ditambahkan 1 sendok PO4-2 kemudian dihomogenkan dan didiamkan selama 2
menit
- Nilai Phospat dapat dilihat dengan mencocokkan dengan testkit dan angka yang tertera pada kertas testkit.
K. Pengukuran Total Organik Metter (TOM)
- Sampel air diambil sebanyak 25 ml dan 25 ml aquadest
- Ditambahkan KMNO4 10 ml
- Ditambahkan 5 ml H2SO4
- Dititrasi dengan KMNO4
- Hasil titrasi di hitung dan di catat
L. Penentuan Jumlah Vibrio
- Sampel air yang telah ditumbuhkan dalam cawan petri yang berisi media TCBS disimpan dalam inkubator selama 24 jam
- Sampel dihitung setelah 24 jam, dengan cara menghitung manual koloni yang muncul pada cawan petri.
2. Penanganan Kualitas Air A. Penggunaan Tandon
- Air dipompa dari laut dengan jarak 600 meter dari pantai - Air disaring dan dialirkan ke tandon
- Air diberi Triclore dengan dosis 30 ppm lalu didiamkan selama 24 jam sehingga terjadi pengendapan
- Air siap dialirkan ke semua petakan.
B. Pengapuran
- Kapur kaptan di tuang ke dalam baskom dengan dosis 10 15 ppm - Kapur kaptan dicairkan dengan menambahkan air petakan hingga mencair - Pencairan kaptan dalam baskom diaduk hingga rata
- Kaptan siap ditebar secara merata pada wadah budidaya dengan mengikuti feeding area menggunakan rakit.
C. Penyiponan
- Kincir central dimatikan
- Selang dimasukkan ke media budidaya kemudian salah satu ujung selang spiral dipasang pada central drain
- Pintu central dibuka dan ujung spiral yang lain diarahkan ke tempat berkumpulnya lumpur agar lumpur, sisa pakan dan feses tersedot keluar melalui pintu central drain - Penyiponan dapat diakhiri ketika dasar tambak sudah bersih
- Selang spiral dilepas pada central dan pintu central ditutup
- Selang spiral dapat diangkat naik dan kincir dapat dinyalakan kembali.
D. Kultur Probiotik Lactobacillus sp. dan Penebarannya
- Air dimasukkan ke dalam drum air kapasitas 200 liter yang diisi 1/2
- Ditambahkan Vitamin B Kompleks sebanyak 400 gram dan molase sebanyak 8 liter kemudian diaduk sampai rata
- Ditambahkan 4 liter AT-BAK (bakteri Lactobacillus sp.) - Probiotik dapat dipanen setelah 48 jam
- Probiotik ditebar secara merata pada media budidaya setiap hari menggunakan rakit dengan mengikuti feeding area.
F. Kultur probiotik Bacillus sp. dan penebarannya
- Drum kapasitas 40 liter dicuci dan diisi air tawar
- Bakteri Bacillus sp. (aquazime) dimasukkan ke dalam air sebanyak 200 gram - Ditambahkan tepung terigu sebanyak 200 gram
- Probiotik dapat ditebar ke wadah budidaya
- Penebaran probiotik menggunakan rakit dengan mengikuti feeding area.
3. Sampling
- Udang dijala mengguankan jala lempar yang berdiameter 4 meter dengan
mengambil satu titik.
- Udang yang telah dijala dimasukkan ke dalam baskom yang berisi air
- Udang dipindahkan pada keranjang sampling kemudian airnya ditiriskan
- Timbangan di nolkan dan udang dalam keranjang sampling ditimbang
- Udang yang telah ditimbang dihitung jumlahnya kemudian dimasukkan kembali ke
dalam tambak.
3.4.3 Panen 1. Panen Parsial
- Udang dijala dengan jala lempar, selanjutnya dimasukkan ke dalam baskom
- Udang dalam baskom ditumpahklan ke dalam basket yang telah dipasangi waring
- Udang dalam basket diangkut ke tempat sortir menggunakan mobil grandong
- Udang disortir dan ditimbang dalam basket dengan menggunakan timbangan
duduk.
- Udang yang telah ditimbang dimasukkan ke dalam box dalam mobil untuk diberi
es balok.
2. Panen Total
- Jaring panen yang telah dipasang pada pintu outlet ujungnya diikat agar udang yang keluar tidak lolos
- Udang yang terkumpul dalam jaring dipindahkan ke dalam basket dan diangkat
ke tempat sortir
- Udang dapat ditangkap dengan jari apabila air telah surut, karena udang tidak dapat lagi menuju jaring yang telah dipasang pada pintu outlet
- Udang dikumpulkan dan dimasukkan ke dalam basket lalu diangkut ke tempat
sortir
- Udang yang telah disortir ditimbang dan dimasukkan ke dalam mobil angkutan
udang serta diberi es balok.
3.5 Parameter yang Diamati dan Analisis Data
3.5.1 Parameter yang Diamati
Parameter yang diamati dalam budidaya udang vaname yaitu sebagai berikut :
- Kualitas air seperti suhu, salinitas, oksigen terlarut, pH, alkalinitas, ammonium (NH4), amoniak (NH3), nitrat (NO3), nitrit (NO2), phospat (PO4), bahan organik
dan vibrio.
- Bobot udang merupakan berat rata-rata udang per ekor.
- Biomassa udang merupakan berat keseluruhan udang yang dibudidayakan. - Populasi merupakan jumlah udang yang ada dalam petakan tambak.
- SR (Survival rite) merupakan indeks kelulushidupan udang dalam suatu proses budidaya dari mulai awal udang ditebar hingga udang dipanen.
3.5.2 Analisis Data
Metode analisis data yang digunakan adalah metode deskriptif yang bersumber
pada data primer dan data sekunder yang didapatkan selama kegiatan Pengalaman Kerja Praktik Mahasiswa (PKPM).
Rumus yang digunakan dalam analisis data adalah sebagai berikut : a. Analisa NH3 Amoniak (NH3)= b. Bobot udang Berat Rata-rata = c. Biomassa Udang Biomassa pemeliharaan =
Biomassa panen = berat total hasil panen d. Populasi
Populasi : Biomassa x Size
e. Tingkat Kelangsungan Hidup/Survival rite (SR)