MAKALAH KIMIA ORGANIK
“ Alkohol ”
OLEH
Arbhy Indera Ikhwansyah
1007113576
Kelas A
JURUSAN SARJANA TEKNIK KIMIA
FAKULTAS TEKNIK UNIVERSITAS RIAU
PEKANBARU
2011
KATA PENGANTAR
Pertama-tama kami mengucapkan puji dan syukur yang sedalam-dalamnya kepada ALLAH SWT atas segala rahmat dan karunia yang telah diberikan, sehingga akhirnya makalah ini dapat selesai dengan baik.
Kami sangat menyadari bahwa tanpa bantuan, bimbingan, dorongan dan pertolongan dari banyak pihak, pelaksanaan makalah ini tidak dapat berjalan dengan baik. Maka dari itu, kami ingin mengucapkan terima kasih atas dukungan dan motivasi baik secara langsung maupun tidak langsung dari keluarga dan teman-teman.
Didalam pembuatan makalah ini, kami menyadari betul bahwa kami belum berpengalaman dalam menulis makalah. Oleh karena itu, kami mohon maaf atas semua kesalahan dan kekurangan yang tedapat dalam makalah ini. Akhir kata kami berharap agar makalah ini dapat memberikan manfaat positif bagi kita semua.
Pekanbaru, Mei 2011
Penulis
Halaman Judul ………. i
Kata Pengantar ……… ii
Daftar isi ………. iii
Bab I Pendahuluan ………...1 1.1. Latar Belakang ……….. 1 1.2. Tujuan Penulisan ……….. 2 1.3. Manfaat Penulisan ……… 2 Bab II Isi ………. 3 2.1. Pengertian Alkohol ………. 3 2.2. Rumus Umum ……… 3 2.3. Sejarah Alkohol ………... 4
2.4. Tata Nama Alkohol ……… 7
2.5. Sifat-sifat Alkohol ………. 9
2.6. Jenis-jenis Alkohol ………14
2.7. Reaksi Pembuatan Alkohol Secara Umum………... 20
2.8. Reaksi Senyawa Alkohol ……….40
2.9. Kegunaan Alkohol ………47
2.10. Dampak Alkohol Bagi Tubuh ……….. 49
Bab III Penutup ……… 61
3.1. Kesimpulan ………... 61
BAB I
PENDAHULUAN
1.1 Latar Belakang.
Alkohol merupakan senyawa seperti air yang satu hidrogennya diganti oleh rantai atau cincin hidrokarbon. Sifat fisis alkohol, alkohol mempunyai titik didih yang tinggi dibandingkan alkana-alkana yang jumlah atom C nya sama. Hal ini disebabkan antara molekul alkohol membentuk ikatan hidrogen. Rumus umum alkohol R – OH, dengan R adalah suatu alkil baik alifatis maupun siklik. Dalam alkohol, semakin banyak cabang semakin rendah titik didihnya. Sedangkan dalam air, metanol, etanol, propanol mudah larut dan hanya butanol yang sedikit larut. Alkohol dapat berupa cairan encer dan mudah bercampur dengan air dalam segala perbandingan (Brady, 1999).
Berdasarkan jenisnya, alkohol ditentukan oleh posisi atau letak gugus OH pada rantai karbon utama. Ada tiga jenis alkohol antara lain alkohol primer, alkohol sekunder dan alkohol tersier. Alkohol primer yaitu alkohol yang gugus –OH nya terletak pada C primer yang terikat langsung pada satu atom karbon yang lain contohnya : CH3CH2CH2OH (C3H7O). Alkohol sekunder yaitu alkohol yang gugus -OH
nya terletak pada atom C sekunder yang terikat pada dua atom C yang lain. Alkohol tersier adalah alkohol yang gugus –OH nya terletak pada atom C tersier yang terikat langsung pada tiga atom C yang lain (Fessenden, 1997).
Alkohol alifatik merupakan cairan yang sifatnya sangat dipengaruhi oleh ikatan hidrogen. Dengan bertambah panjangnya rantai, pengaruh gugus hidroksil yang polar terhadap sifat molekul menurun.
Akibatnya alkohol dengan bobot molekul rendah cenderung larut dalam air, sedangkan alkohol berbobot molekul tinggi tidak demikian. Alkohol mendidih pada temperatur yang cukup tinggi. Sebagai suatu kelompok senyawa, fenol memiliki titik didih dan kelarutan yang sangat bervariasi, tergantung pada sifat subtituen yang menempel pada cincin benzena (Petrucci, 1987).
Reaksi-reaksi yang terjadi dalm alkohol antara lain reaksi substitusi, reaksi eliminasi, reaksi oksidasi dan esterifikasi. Dalam suatu alkohol, semakin panjang rantai hidrokarbon maka semakin rendah kelarutannya. Bahkan jika cukup panjang sifat
hidrofob ini mengalahkan sifat hidrofil dari gugus hidroksil. Banyaknya gugus hidroksil dapat memperbesar kelarutan dalam air (Hart, 1990).
Suatu alkohol primer dapat dioksidasi menjadi aldehid atau asam karboksilat. Alkohol sekunder dapat dioksidasi menjadi keton saja. Sedangkan pada alkohol tersier menolak oksidasi dengan larutan basa, dalam larutan asam, alkohol mengalami dehidrsi menghasilkan alkena yang kemudian dioksidasi (Fessenden, 1997).
Alkohol sering dipakai untuk menyebut etanol, yang juga disebut grain alcohol; dan kadang untuk minuman yang mengandung alkohol. Hal ini disebabkan karena memang etanol yang digunakan sebagai bahan dasar pada minuman tersebut, bukan metanol, atau grup alkohol lainnya. Begitu juga dengan alkohol yang digunakan dalam dunia famasi. Alkohol yang dimaksudkan adalah etanol.
Etanol dapat dibuat dari fermentasi buah atau gandum dengan ragi. Etanol sangat umum digunakan, dan telah dibuat oleh manusia selama ribuan tahun. Etanol adalah salah satu obat rekreasi (obat yang digunakan untuk bersenang-senang) yang paling tua dan paling banyak digunakan di dunia. Dengan meminum alkohol cukup banyak, orang bisa mabuk. Semua alkohol bersifat toksik (beracun), tetapi etanol tidak terlalu beracun karena tubuh dapat menguraikannya dengan cepat.
1.2 Tujuan Penulisan.
Adapun tujuan dari penulisan makalah ini adalah untuk memenuhi tugas kelompok yang diberikan oleh dosen. Selain itu, penulisan makalah ini juga bertujuan untuk memberikan penulis informasi mengenai senyawaan alkohol.
1.3 Manfaat Penulisan.
Adapun manfaat dari penulisan makalh ini yaitu : a. Untuk mengetahui definisi dari senyawa alkohol, b. Mengetahui manfaat dan dampak dari senyawa alkohol, c. Mengetahui reaksi-reaksi dalam pembuatan senyawa alkohol, d. Tata cara pemberian nama pada senyawa alkohol,
e. Mengetahui sifat-sifat dari senyawa alkohol, f. Jenis-jenis dari senyawa alkohol.
BAB II
PEMBAHASAN
2.1 Pengertian Alkohol
Alkohol adalah senyawa-senyawa dimana satu atau lebih atom hidrogen dalam sebuah alkana digantikan oleh sebuah gugus -OH. Alkohol memiliki ikatan yang mirip air. Alkohol terdiri dari molekul polar. Dalam senyawa alkohol, oksigen mengemban muatan negatif parsial.
Alkohol dalam ilmu kimia memiliki pengertian yang lebih luas lagi. Dalam kimia, alkohol atau alkanol adalah istilah yang umum untuk senyawa organik apa pun yang memiliki gugus hidroksil (-OH) yang terikat pada atom karbon, yang ia sendiri terikat pada atom hidrogen dan atau atom karbon lain.
Alkohol umum
isopropil alkohol (sec-propil alcohol, propan-2-ol, 2-propanol) H3
C-CH(OH)-CH3, atau alkohol gosok
etilena glikol (etana-1,2-diol) HO-CH2-CH2-OH, yang merupakan komponen
utama dalam antifreeze
gliserin (atau gliserol, propana-1,2,3-triol) HO-CH2-CH(OH)-CH2-OH yang
terikat dalam minyak dan lemak alami, yaitu trigliserida (triasilgliserol) Fenol adalah alkohol yang gugus hidroksilnya terikat pada cincin benzena Alkohol digunakan secara luas dalam industri dan sains sebagai pereaksi, pelarut, dan bahan bakar. Ada lagi alkohol yang digunakan secara bebas, yaitu yang dikenal di masyarakat sebagai spirtus. Awalnya alkohol digunakan secara bebas sebagai bahan bakar. Namun untuk mencegah penyalahgunaannya untuk makanan atau minuman, maka alkohol tersebut didenaturasi. denaturated alcohol disebut juga methylated spirit, karena itulah maka alkohol tersebut dikenal dengan nama spirtus
2.2 Rumus Umum
Senyawa alkohol atau alkanol dapat dikatakan senyawa alkana yang satu atom H–nya diganti dengan gugus –OH (hidroksil). Sehingga seperti terlihat pada tabel 4.1 rumus umum senyawa alkohol adalah R–OH dimana R adalah gugus alkil.
Tabel 2.1 Gugus Alkil dan Rumus Molekul Alkoholnya untuk nilai "n" R Rumus Molekul Alkohol
1 CH3 CH3-OH
2 C2H5 C2H5-OH
3 C3H7 C3H7-OH
Strukturnya serupa dengan air, tetapi satu hidrogennya diganti dengan satu gugus alkil. Gugus fungsi alcohol adalah gugus hidroksil. Untuk fenol mempunyai gugus yang sama dengan alcohol, tetapi gugus fungsinya melekat langsung pada cincin aromatic. Sedangkan tiol mempunyai struktur yang sama dengan alcohol, jika oksigennya digantikan oleh belerang.
H O H R O H Ar O H R S H Ar S H
air alkohol fenol tiol tiofenol
2.3 Sejarah
Alkohol telah digunakan oleh orang di seluruh dunia, dalam makanan standar, untuk higienis / alasan medis, untuk relaksan dan efek euforia, untuk tujuan rekreasi, untuk inspirasi artistik, sebagai aphrodisiacs, dan untuk alasan lain. Beberapa minuman telah diinvestasikan dengan makna simbolis atau agama mistis menyarankan penggunaan alkohol, misalnya dengan agama Yunani-Romawi di ekstatis ritual Dionysus (juga disebut Bacchus), dewa anggur dan pesta pora; dalam Kristen Ekaristi, dan pada Yahudi Sabat dan festival (terutama Paskah).
2.3.1 Fermentasi Minuman.
Analisis kimia jejak diserap dan disimpan dalam kendi tembikar dari Neolitikum desa Jiahu, di provinsi Henan, utara Cina, telah mengungkapkan bahwa minuman fermentasi campuran beras, madu, dan buah-buahan sedang diproduksi sejak 9.000 tahun yang lalu. Ini adalah kira-kira saat yang sama bir gandum dan anggur anggur mulai dibuat di Timur Tengah.
Resep telah ditemukan di lapangan tanah liat tablet dan seni di Mesopotamia yang menunjukkan individu menggunakan sedotan untuk minum bir dari tong-tong besar dan pot. dermawan baik menggambarkan penggunaan minuman beralkohol dan konsekuensi dari penyakit mabuk dan beralkohol.
Sebagian besar masyarakat di India dan Cina, telah melanjutkan, seluruh, memfermentasi sebagian hasil panen mereka dan memelihara diri dengan produk alkohol. Namun demikian, penganut taat agama Buddha, yang muncul di India pada abad 5 dan 6 SM dan menyebar di selatan dan timur Asia, berpantang sampai hari ini, seperti saleh Hindu dan Sikh. Di Mesopotamia dan Mesir, tempat kelahiran bir dan anggur, Islam adalah agama yang dominan sekarang, dan juga melarang minum dan bahkan penanganan minuman beralkohol.
Anggur yang dikonsumsi di Yunani klasik pada saat sarapan atau di simposium, dan pada abad ke-1 SM itu adalah bagian dari makanan yang paling Romawi warga. Namun, baik orang Yunani dan Romawi umumnya dikonsumsi diencerkan anggur (dengan kekuatan bervariasi dari 1 bagian anggur dan 1 bagian air untuk 1 bagian anggur dan 4 bagian air). Transformasi air menjadi anggur di perkawinan di Kana adalah yang pertama dari mukjizat Yesus dalam Perjanjian Baru, dan penggunaan anggur-Nya dalam Perjamuan Terakhir mengarah ke sana menjadi bagian penting dari Ekaristi ritual di sebagian besar Kristen tradisi ( lihat Kekristenan dan alkohol).
Di Eropa pada Abad Pertengahan, bir yang dikonsumsi oleh seluruh keluarga, berkat proses fermentasi triple-orang-orang yang paling kuat, lalu perempuan, kemudian anak-anak. Sebuah dokumen menyebutkan zaman biarawati memiliki uang saku enam pint bir sehari. Cider dan anggur pomace juga tersedia secara luas, sementara anggur anggur adalah hak prerogatif dari kelas yang lebih tinggi.
Pada saat orang-orang Eropa tiba di Amerika pada abad ke-15, beberapa asli peradaban telah mengembangkan minuman beralkohol. Menurut pasca-Penaklukan Aztek dokumen, konsumsi lokal "anggur" (pulque) pada umumnya terbatas pada upacara-upacara keagamaan, tetapi bebas diperbolehkan untuk yang di atas 70 tahun. Penduduk asli Amerika Selatan dibuat bir-seperti produk dari ubi kayu atau jagung (cauim, Chicha), yang harus dikunyah sebelum fermentasi
dalam rangka untuk mengubah pati menjadi gula. This chewing technique was also used in ancient Japan to make sake from rice and other Teknik mengunyah ini juga digunakan dalam kuno Jepang untuk membuat sake dari beras dan tepung lainnya tanaman.
Penggunaan obat alkohol disebutkan dalam teks-teks Sumeria dan Mesir tanggal dari 2100 SM atau lebih awal. Para Alkitab Ibrani merekomendasikan memberikan minuman beralkohol kepada orang-orang yang sekarat atau tertekan, sehingga mereka dapat melupakan penderitaan mereka (Amsal 31:6-7).
2.3.2 Suling Minuman.
Penyulingan alkohol dapat ditelusuri kembali ke Cina, Asia Tengah dan Timur Tengah. Secara khusus, kimiawan Muslim adalah yang pertama untuk menghasilkan alkohol sulingan sepenuhnya dimurnikan. ini kemudian menyebar ke Eropa pada pertengahan abad ke-12, dan pada awal abad ke-14 itu telah menyebar di seluruh benua. Hal ini juga menyebar ke timur, terutama disebabkan oleh Mongol, dan mulai di Cina tidak lebih dari abad ke-14. Paracelsus alkohol memberikan nama modern, mengambil dari kata Arab yang berarti "halus dibagi", sebuah referensi untuk penyulingan.
2.3.3 Minuman Berakohol dalam Sejarah Amerika.
Pada awal abad ke-19, Amerika telah mewarisi tradisi minum yang hangat. Banyak jenis minuman beralkohol yang dikonsumsi. Salah satu alasan berat ini minum adalah suatu hal meluap-luap dari jagung pada sebelah barat perbatasan. Hal meluap-luap ini mendorong produksi luas wiski murah. Pada saat itulah minuman beralkohol menjadi bagian penting dari diet Amerika. Pada pertengahan 1820-an, Amerika minum alkohol tujuh galon per kapita per tahun.
Selama abad ke-19, Amerika minum alkohol yang berlimpah dan meminumnya dalam dua cara yang berbeda. Satu cara adalah untuk minum sehari-hari jumlah kecil dan secara teratur, biasanya di rumah atau sendirian. Cara lain terdiri dari binges komunal. Kelompok-kelompok orang-orang akan berkumpul di tempat umum untuk pemilihan, sidang pengadilan, milisi musters,
perayaan hari libur, atau tetangga perayaan. Peserta akan biasanya minum sampai mereka menjadi mabuk.
2.4 Tata Nama Alkohol
Penemaan senyawa alkohol dapat dilakukan dengan dua cara, yaitu berdasarkan aturan IUPAc dan cara Trivial.
2.4.1 Tata Nama Alkohol secara IUPAC.
1. Rantai karbon terpanjang yang mengandung gugus –OH ditentukan terlebih dahulu. OH C2H5 CH3 ׀ ׀ ׀ CH3 – C – CH2 – CH – CH3 CH3 – C – CH2 – C – CH3 – OH ׀ ׀ ׀ CH3 CH3 CH3
2, 4 dimetil 2 pentanol 2,2,4 trimetil heksanol
Selanjutnya, rantai karbon terpanjang diberi nama sesuai dengan nama rantai alkananya, tetapi akhir huruf a diganti dengan ol.
Contohnya, pentana menjadi pentanol dan heksana menjadi heksanol.
2. Penomoran dimulai dari atom C ujung yang terdekat dengan gugus –OH. CH3
1 2 3 ׀ 4
CH3 – CH – C – CH3 Penomoran dilakukan dari arah kiri
׀ ׀ OH CH3
3,3 dimetil 2 butanol CH3
4 3 2 ׀ 1
CH3 – CH – C – CH3 Penamaan dilakukan dari arah kanan
׀ ׀
3. Senyawa alkohol yang memiliki gugus alkil dan rantai terpanjangnya ekuivalen dari kedua ujungnya terhadap gugus –OH, gugus alil tersebut harus memperoleh nomor yang lebih kecil.
5 4 3 2 1
CH3 – CH2 – CH – CH – CH3 Penomoran dilakukan dari kanan
׀ ׀ OH CH3
2 metil 3 pentanol
Jika pada suatu rantai alkohol terdapat labih dari satu gugus alkil yang berbeda dan gugus –OH terikat pada atom C dengan posisi yang ekuivalen dari kedua ujung rantai terpanjang, penomoran dilakukan dengan menempatkan gugus alkil yang lebih besar pada atom C dengan nomor yang lebih kecil.
1 2 3 4 5 6 7
CH3 – CH2 – CH – CH – CH – CH2 – CH3 Penomran dilakukan dari kiri
׀ ׀ ׀ C2H5 OH CH3
3 etil 5 metil 4 heptanol
4. Urutan penulisan cabang alkil dilakukan sesuai dengan ururtan abjad.
2.1.1 Tata Nama Alkohol secara Trivial.
Pada tata nama alkohol cara trivial ini, urutan penulisan cabang alkil dilakukan dengan urutan panjang rantai alkil (metil, etil, propil dan seterusnya). Perhatikan contoooh berikut :
CH3 – CH – CH – CH – CH – CH – CH2 – OH
׀ ׀ ׀ ׀ ׀ CH3 C2H5 C3H7 C2H5 CH3
2,6-dimetil-3,5-dietil-4-propil-1-heptanol
Contoh Penamaan Alkohol
Rumus Molekul Nama IUPAC Nama Trivial
CH3-OH Metanol Metil Alkohol
C2H5-OH Etanol Etil Alkohol
C3H7-OH Propanol Propil Alkohol
C4H9-OH Butanol Butil Alkohol
2.5 Sifat-Sifat Alkohol
1) Mudah terbakar
2) Mudah bercampur dengan air 3) Bentuk fasa pada suhu ruang :
– dengan C 1 s/d 4 berupa gas atau cair
– dengan C 5 s/d 9 berupa cairan kental seperti minyak – dengan C 10 atau lebih berupa zat padat
4) Pada umumnya alkohol mempunyai titik didih yang cukup tinggi dibandingkan alkananya. Hal ini disebabkan adanya ikatan hidrogen atas molekulnya.
Titik Didih.
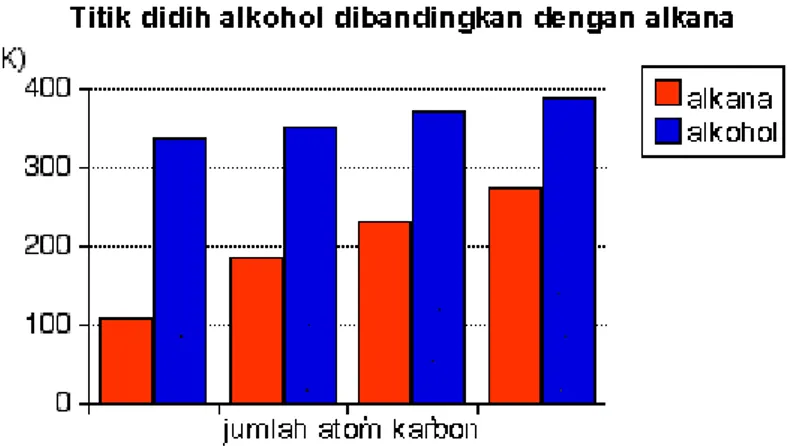
Grafik berikut ini menunjukan titik didih dari beberapa alkohol primer sederhana yang memiliki sampai 4 atom karbon.
Yakni:
Alkohol-alkohol primer ini dibandingkan dengan alkana yang setara (metana sampai butana) yang memiliki jumlah atom karbon yang sama.
Gambar 1. Perbandingan titik didih alkohol dan alkana
Dari grafik di atas dapat diamati bahwa:
Titik didih sebuah alkohol selalu jauh lebih tinggi dibanding alkana yang memiliki jumlah atom karbon sama.
Titik didih alkohol meningkat seiring dengan meningkatnya jumlah atom karbon.Pola-pola titik didih mencerminkan pola-pola gaya tarik antar-molekul. Ikatan hidrogen
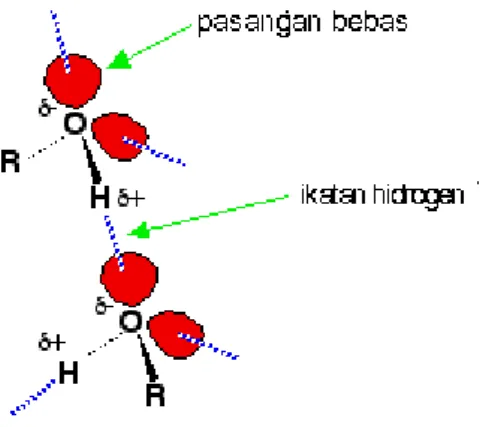
Ikatan hidrogen terjadi antara molekul-molekul dimana sebuah atom hidrogen terikat pada salah satu dari unsur yang sangat elektronegatif – fluorin, oksigen atau nitrogen.
Untuk alkohol, terdapat ikatan hidrogen antara atom-atom hidrogen yang sedikit bermuatan positif dengan pasangan elektron bebas pada oksigen dalam molekul-molekul lain.
Gambar 2. Ikatan hidrogen.
Atom-atom hidrogen sedikit bermuatan positif karena elektron-elektron ikatan tertarik menjauh dari hidrogen menuju ke atom-atom oksigen yang sangat elektronegatif.
Pada alkana, satu-satunya gaya antar-molekul yang ada adalah gaya dispersi van der Waals. Ikatan-ikatan hidrogen jauh lebih kuat dibanding gaya-gaya tersebut sehingga dibutuhkan lebih banyak energi untuk memisahkan molekul-molekul alkohol dibanding untuk memisahkan molekul-molekul alkana. Inilah sebab utama mengapa titik didih alkohol lebih tinggi dari alkana.
Pengaruh gaya van der Waals
Pengaruh terhadap titik didih alcohol yakni ikatan hidrogen bukan satu-satunya gaya antar-molekul dalam alkohol. Dalam alkohol ditemukan juga gaya-gaya dispersi van der Waals dan interaksi dipol-dipol. Ikatan hidrogen dan
interaksi dipol-dipol hampir sama untuk semua alkohol, tapi gaya dispersi akan meningkat apabila alkohol menjadi lebih besar.
Gaya-gaya tarik ini menjadi lebih kuat jika molekul lebih panjang dan memiliki lebih banyak elektron. Ini meningkatkan besarnya dipol-dipol temporer yang terbentuk. Inilah yang menjadi penyebab mengapa titik didih meningkat apabila jumlah atom karbon dalam rantai meningkat. Diperlukan lebih banyak energi untuk menghilangkan gaya-gaya dispersi, sehingga titik didih meningkat.
Pengaruh terhadap perbandingan antara alkana dan alkohol:
Bahkan jika tidak ada ikatan hidrogen atau interaksi dipol-dipol, titik didih alkohol tetap lebih tinggi dibanding alkana sebanding yang memiliki jumlah atom karbon sama.
Bandingkan antara etana dan etanol:
Etena Etanol
Gambar 3. Perbandingan etena dan etanol.
Etanol memiliki molekul yang lebih panjang, dan oksigen yang terdapat dalam molekulnya memberikan 8 elektron tambahan. Struktur yang lebih panjang dan adanya atom oksigen akan meningkatkan besarnya gaya dispersi van der Waals, demikian juga titik didihnya.
Jika kita hendak membuat perbandingan yang cermat untuk mengamati efek ikatan hidrogen terhadap titik didih, maka akan lebih baik jika kita membandingkan etanol dengan propana bukan dengan etana. Propana memiliki panjang molekul yang kurang lebih sama dengan etanol, dan jumlah elektronnya tepat sama.
Kelarutan alkohol dalam air
Alkohol-alkohol yang kecil larut sempurna dalam air. Bagaimanapun perbandingan volume yang kita buat, campurannya akan tetap menjadi satu larutan. Akan tetapi, kelarutan berkurang seiring dengan bertambahnya panjang rantai hidrokarbon dalam alkohol. Apabila atom karbonnya mencapai empat atau
lebih, penurunan kelarutannya sangat jelas terlihat, dan campuran kemungkinan tidak menyatu.
Kelarutan alkohol-alkohol kecil di dalam air
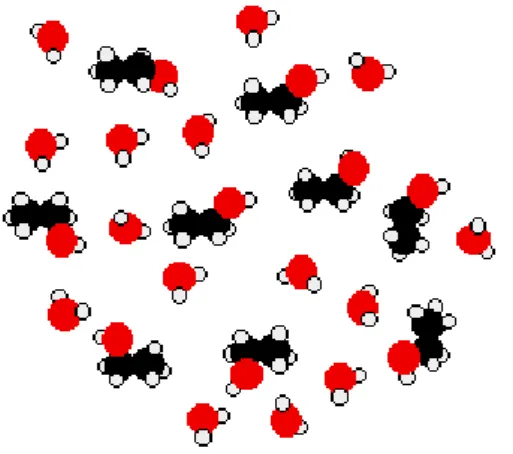
Perhatikan etanol sebagai sebuah alkohol kecil sederhana. Pada etanol murni dan air murni yang akan dicampur, gaya tarik antar-molekul utama yang ada adalah ikatan hidrogen.
Gambar 4. Ikatan Hidrogen didua jenis molekul.
Untuk bisa mencampur kedua larutan ini, ikatan hidrogen antara molekul-molekul air dan ikatan hidrogen antara molekul-molekul-molekul-molekul etanol harus diputus. Pemutusan ikatan hidrogen ini memerlukan energi.
Akan tetapi, jika molekul-molekul telah bercampur, ikatan-ikatan hidrogen yang baru akan terbentuk antara molekul air dengan molekul etanol.
Gambar 5. Ikatan Hidrogen pada etanol dan air.
Energi yang dilepaskan pada saat ikatan-ikatan hidrogen yang baru ini terbentuk kurang lebih dapat mengimbangi energi yang diperlukan untuk
memutus ikatan-ikatan sebelumnya. Disamping itu, gangguan dalam sistem mengalami peningkatan, yakni entropi meningkat. Ini merupakan faktor lain yang menentukan apakah penyatuan larutan akan terjadi atau tidak.
Kelarutan yang lebih rendah dari molekul-molekul yang lebih besar.
Bayangkan apa yang akan terjadi jika ada, katakanlah, 5 atom karbon dalam masing-masing molekul alkohol.
Gambar 6. Ikatan Hidrogen alkohol di air.
Rantai-rantai hidrokarbon menekan diantara molekul-molekul air sehingga memutus ikatan-ikatan hidrogen antara molekul-molekul air tersebut. Ujung -OH dari molekul alkohol bisa membentuk ikatan-ikatan hidrogen baru dengan molekul-molekul air, tetapi "ekor-ekor" hidrogen tidak membentuk ikatan-ikatan hidrogen. Ini berarti bahwa cukup banyak ikatan hidrogen awal yang putus tidak diganti oleh ikatan hidrogen yang baru.
Yang menggantikan ikatan-ikatan hidrogen awal tersebut adalah gaya-gaya dispersi van der Waals antara air dan "ekor-ekor" hidrokarbon. Gaya-gaya-gaya tarik ini jauh lebih lemah. Itu berarti bahwa energi yang terbentuk kembali tidak cukup untuk mengimbangi ikatan-ikatan hidrogen yang telah terputus. Walaupun terjadi peningkatan entropi, proses pelarutan tetap kecil kemungkinannya untuk berlangsung. Apabila panjang alkohol meningkat, maka situasi ini semakin buruk, dan kelarutan akan semakin berkurang.
Berdasarkan jenis atom C yang mengikat gugus –OH, alkohol dibedakan atas alkohol primer, alkohol sekunder, dan alkohol tersier. Agen pengoksidasi yang digunakan pada reaksi-reaksi ini biasanya adalah sebuah larutan natrium atau kalium dikromat(V)) yang diasamkan dengan asam sulfat encer. Jika oksidasi terjadi, larutan orange yang mengandung ion-ion dikromat(VI) direduksi menjadi sebuah larutan hijau yang mengandung ion-ion kromium(III).
Persamaan setengah-reaksi untuk reaksi ini adalah
2.6.1 Alkohol Primer.
Alkohol primer bisa dioksidasi baik menjadi aldehid maupun asam karboksilat tergantung pada kondisi-kondisi reaksi. Untuk pembentukan asam karboksisat, alkohol pertama-tama dioksidasi menjadi sebuah aldehid yang selanjutnya dioksidasi lebih lanjut menjadi asam.
Oksidasi parsial menjadi aldehid
Oksidasi alkohol akan menghasilkan aldehid jika digunakan alkohol yang berlebihan, dan aldehid bisa dipisahkan melalui distilasi sesaat setelah terbentuk. Alkohol yang berlebih berarti bahwa tidak ada agen pengoksidasi yang cukup untuk melakukan tahap oksidasi kedua. Pemisahan aldehid sesegera mungkin setelah terbentuk berarti bahwa tidak tinggal menunggu untuk dioksidasi kembali.
Jika digunakan etanol sebagai sebuah alkohol primer sederhana, maka akan dihasilkan aldehid etanal, CH3CHO. Persamaan lengkap untuk reaksi ini
agak rumit, dan kita perlu memahami tentang persamaan setengah-reaksi untuk menyelesaikannya.
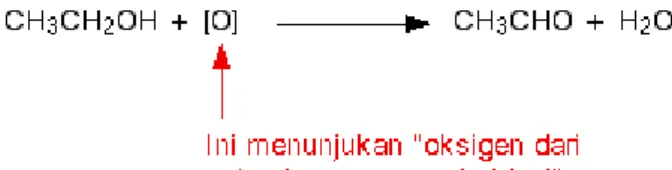
Dalam kimia organik, versi-versi sederhana dari reaksi ini sering digunakan dengan berfokus pada apa yang terjadi terhadap zat-zat organik yang terbentuk. Untuk melakukan ini, oksigen dari sebuah agen pengoksidasi
dinyatakan sebagai [O]. Penulisan ini dapat menghasilkan persamaan reaksi yang lebih sederhana:
Gambar 7. Oksigen sebagai pengoksidasi.
Penulisan ini juga dapat membantu dalam mengingat apa yang terjadi selama reaksi berlangsung. Kita bisa membuat sebuah struktur sederhana yang menunjukkan hubungan antara alkohol primer dengan aldehid yang terbentuk.
Gambar 8. Reaksi alkohol primer menjadi aldehid.
Oksidasi sempurna menjadi asam karboksilat
Untuk melangsungkan oksidasi sempurna, kita perlu menggunakan agen pengoksidasi yang berlebih dan memastikan agar aldehid yang terbentuk pada saat produk setengah-jalan tetap berada dalam campuran.
Alkohol dipanaskan dibawah refluks dengan agen pengoksidasi berlebih. Jika reaksi telah selesai, asam karboksilat bisa dipisahkan dengan distilasi.
Persamaan reaksi sempurna untuk oksidasi etanol menjadi asam etanoat adalah sebagai berikut:
Atau, kita bisa menuliskan persamaan terpisah untuk dua tahapan reaksi, yakni pembentukan etanal dan selanjutnya oksidasinya.
Reaksi yang terjadi pada tahap kedua adalah:
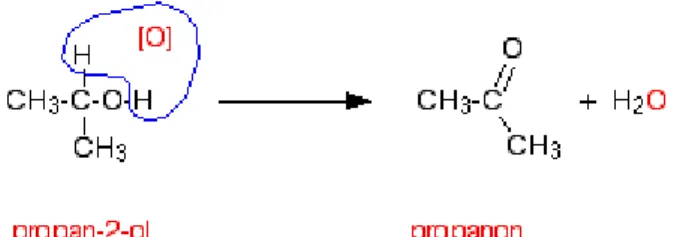
2.6.2 Alkohol Sekunder.
Alkohol sekunder dioksidasi menjadi keton. Sebagai contoh, jika alkohol sekunder, propan-2-ol, dipanaskan dengan larutan natrium atau kalium dikromat(VI) yang diasamkan dengan asam sulfat encer, maka akan terbentuk propanon. Perubahan-perubahan pada kondisi reaksi tidak akan dapat merubah produk yang terbentuk.
Dengan menggunakan persamaan reaksi yang sederhana, yang menunjukkan hubungan antara struktur, dapat dituliskan sebagai berikut:
Gambar 9. Bentuk alkohol sekunder.
Jika anda melihat kembali tahap kedua reaksi alkohol primer, anda akan melihat bahwa ada sebuah atom oksigen yang "disisipkan" antara atom karbon dan atom hidrogen dalam gugus aldehid untuk menghasilkan asam karboksilat.
Untuk alkohol sekunder, tidak ada atom hidrogen semacam ini, sehingga reaksi berlangsung lebih cepat.
2.6.3 Alkohol Tersier.
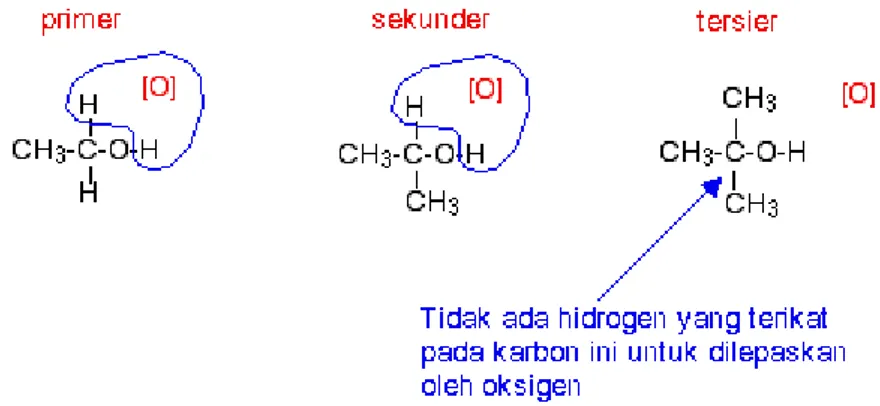
Alkohol-alkohol tersier tidak dapat dioksidasi oleh natrium atau kalium dikromat(VI). Bahkan tidak ada reaksi yang terjadi. Jika anda memperhatikan apa yang terjadi dengan alkohol primer dan sekunder, anda akan melibat bahwa agen pengoksidasi melepaskan hidrogen dari gugus -OH, dan sebuah atom hidrogen dari atom karbon terikat pada gugus -OH. Alkohol tersier tidak memiliki sebuah atom hidrogen yang terikat pada atom karbon tersebut.
Anda perlu melepaskan kedua atom hidrogen khusus tersebut untuk membentuk ikatan rangkap C=O.
Gambar 10. Perbedaan struktur alkohol primer, sekunder, dan tersier.
2.6.4 Uji Alkohol
Pertama-tama harus dipastikan bahwa larutan yang akan di uji benar-benar alkohol dengan cara menguji keberadaan gugus -OH di dalam larutan. Juga perlu menentukan bahwa cairan tersebut adalah cairan netral, bebas dari air sehingga bereaksi dengan fosfor(V) klorida menghasilkan asap-asap hidrogen klorida yang mengandung air.
Selanjutnya tambahkan beberapa tetes alkohol ke dalam sebuah tabung uji yang mengandung larutan kalium dikromat (VI) yang telah diasamkan dengan asam sulfat encer. Tabung tersebut akan dipanaskan di sebuah penangas air panas.
Alkohol tersier
Untuk alkohol primer atau sekunder, warna orange larutan akan berubah menjadi hijau. Sedangkan untuk alkohol tersier tidak ada perubahan warna.
Setelah pemanasan:
Membedakan alkohol primer dan alkohol sekunder
Diperlukan aldehid (melalui oksidasi alkohol primer) atau keton (melalui oksidasi alkohol sekunder) untuk bisa membedakan antara alkohol primer dan alkohol sekunder. Ada beberapa hal yang dapat dilakukan oleh aldehid sedangkan keton tidak dapat melakukannya. Antara lain reaksi dengan pereaksi Tollens, laruan Fehling dan larutan Benedict, dan lain-lain yang akan dibahas di halaman lain.
Menurut pengalaman, uji-uji ini sedikit sulit dilakukan dan hasilnya tidak selamanya jelas seperti yang disebutkan dalam literatur. Sebuah uji yang jauh lebih sederhana namun cukup terpercaya adalah dengan menggunakan pereaksi Schiff
Pereaksi Schiff merupakan sebuah zat warna Fuchsin yang berubah warna jika sulfur oksida dilewatkan kedalamnya. Jika terdapat sedikit aldehid, warnanya akan berubah mejadi merah keungu-unguan yang terang.
Akan tetapi, pereaksi ini harus digunakan dalam keadaan dingin, karena keton bisa bereaksi dengan pereaksi ini sangat lambat menghasilkan warna yang sama. Jika dipanaskan, maka reaksi dengan keton akan lebih cepat, sehingga berpotensi memberikan hasil yang membingungkan.
Sambil dipanaskan, campuran reaksi dalam penangas air panas, bisa dilewatkan uap yang dihasilkan melalui beberapa pereaksi Schiff.
Jika pereaksi Schiff cepat berubah warna menjadi merah keungu-unguan, maka dihasilkan aldeih dari sebuah alkohol primer.
Jika tidak ada perubahan warna dalam pereaksi Schiff, atau hanya sedikit warna pink yang terbentuk dalam beberapa menit, maka tidak dihasilkan aldehid, sehingga tidak ada alkohol primer.
Karena terjadi perubahan warna pada larutan kalium dikromat(VI) yang bersifat asam, maka harus terdapat lakohol sekunder.
Harus diperiksa hasil uji sesegera mungkin setelah larutan kalium dikromat(VI) berubah menjadi hijau – jika anda membiarkannya terlalu lama, maka pereaksi Schiff bisa berubah warna kembali (untuk alkohol sekunder).
2.7
Reaksi Pembuatan Alkohol Secara Umum
2.7.1 Oxymercuration – demercurationCH
2= CH
2+ Hg (OAc)
2+
H
2O
→
CH
2OH – CH
2HgOAc +
NaBH
4→
CH
2OH + CH
3(mengikuti Markovnikov) CH3 – C(CH3)2 – CH = CH2 + Hg (OAc)2 + H2O + NaBH4
→
CH3 – C(CH3)2 – CH – CH3(3,3-dimetil-2-butanol)
2.7.2 Hydroboration – Oxidation. C = C + (BH3)2 + H2O2 + OH
→
CH2OH + CH3 (anti Markovnikov) CH3 – C(CH3)2 – CH = CH2 + (BH3)2 + H2O2 + OH→
CH3 – C(CH3)2 – CH2 – CH2OH (3,3-dimetil-1-butanol) 2.7.3 Grignard synthesis. R R CH2 = O + R – MgX→
H – C – OMgX + H2O→
H – C – OH H H OH R R CH = O + R – MgX→
H – C – OMgX + H2O→
H – C – OH H H (formaldehid) (Alk 1º) O H2 – C --- C – H2 + R –MgX→
R – CH2 –CH2 –OMgX + H2O (ethyleneoxide)→
R – CH2 –CH2 –OH(Alk 1º, dengan + 2 atom C)
OH R R C = O + R‘ – MgX
→
H – C – OMgX + H2O→
H – C – OHR R‘ R‘ (aldehid) (Alk 2º)
R‘ R‘ R – COOR‘‘ + 2R‘ – MgX
→
R – C – OMgX + H2O→
R – C – OH R‘‘ R‘‘ (ester) (Alk 3º) 2.7.4 Hydrolysis of arylhalides. Ar – X + H2O + OH → Ar – OHCH2Cl + H2O + OH –
→
CH2OH(benzilkhlorida) (benzil alkohol)
2.7.5 Reduction of aldehydes, ketones.
H C = O + NaBH4 + H+
→
R – CH2 – OH R (aldehid)O
OH
H
NaBH4 + H+
→
+
H
(sinamaldehid) (sinamil alkohol) 2.7.6 Reduction of esther.
(ester)
CH3 (CH2)14 – COOC2H5 + LiAlH4 (etilpalmitat) CH3 (CH2)14 – CH2-OH + HO - C2H5 (1-heksadekanol) (etanol) 2.7.7 Hydroxylation of alkenes.
HC2 = CH2 + KMnO4 + H2O
→
– CH2 – CH2(etilen) OH OH 2.7.8 Aldol Condensation.
CH3 – COH + CH3 – COH
→
CH3 – CH(OH) – CH2 – COH→
H2O(etanal) (etanal)
CH3 – CH = CH– COH + H2
→
CH3 - CH2 - CH2 - CH2OH(butanol)
( 2 atom C aldehid + 2 atom C aldehid
→
4 atom C alkohol )2.7.9 Tambahan Pembuatan Etanol dari Etena
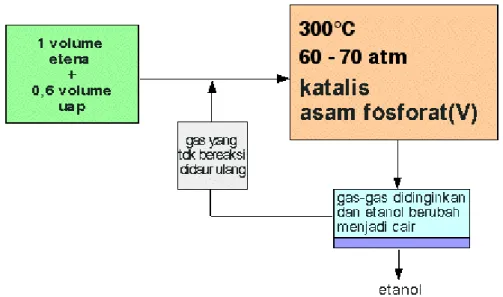
Etanol dibuat dalam skala produksi dengan mereaksikan etena dengan uap. Katalis yang digunakan adalah silikon dioksida padat yang dilapisi dengan asam fosfat(V). Reaksi yang terjadi dapat balik (reversibel).
Hanya 5% dari etena yang diubah menjadi etanol pada setiap kali pemasukan ke dalam reaktor. Dengan mengeluarkan etanol dari campuran kesetimbangan dan mendaur-ulang etena, maka pengubahan etena menjadi etanol secara keseluruhan dapat mencapai 95%.
Diagram alir untuk reaksi yang terjadi dapat digambarkan sebagai berikut:
Diagram 1. Diagram alir Pembuatan Etanol dari Etena
Pembuatan Alkohol-alkohol Lain dari Alkena
Beberapa alkohol lain (meski tidak semua) bisa dibuat dengan reaksi-reaksi yang serupa. Katalis yang digunakan dan kondisi-kondisi reaksi akan berbeda-beda dari alkohol yang satu ke alkohol yang lain. Pada pembahasan tingkat dasar ini, kondisi-kondisi yang perlu diketahui adalah kondisi-kondisi-kondisi-kondisi yang diberikan untuk pembuatan etanol di atas.
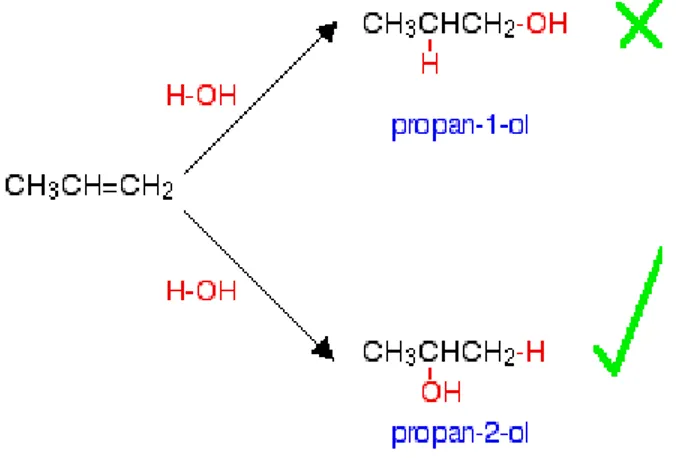
Alasan mengapa ada sebuah masalah yang ditemukan pada beberapa alkohol dapat ditunjukkan dalam pembuatan alkohol dari propena,CH3CH=CH2.
Gambar 13. Pembuatan Alkohol-alkohol Lain dari Alkena.
Hasil yang diperoleh bisa berupa propan-1-ol atau propan-2-ol tergantung pada bagaimana molekul air diadisi ke ikatan rangkap. Akan tetapi, pada kenyataannya, hasil yang diperoleh adalah propan-2-ol.
Jika sebuah molekul H-X diadisi ke sebuah ikatan rangkap C=C, maka atom H hampir selalu terikat pada atom karbon yang memiliki paling banyak atom hidrogen terikat padanya – untuk contoh di atas atom H terikat pada CH2 bukan pada CH.
Pengaruh yang ditimbulkan oleh kecenderungan ini yakni ada beberapa alkohol yang tidak mungkin dibuat dengan cara mereaksikan alkena dengan uap karena adisi akan terjadi dengan arah yang berlawanan dari yang diperkirakan.
Membuat etanol melalui fermentasi
Metode ini hanya berlaku bagi etanol. Alkohol selain etanol tidak bisa dibuat dengan cara ini.
Proses
Bahan baku untuk proses ini sangat bervariasi, tapi biasanya adalah beberapa bentuk material tanaman yang mengandung pati (starch) seperti jagung, gandum, beras atau kentang.
Pati (Starch) merupakan sebuah karbohidrat kompleks, dan karbohidrat yang lain juga bisa digunakan – misalnya, sukrosa (gula) biasanya digunakan untuk membuat etanol. Dalam skala industri, sukrosa tidak mungkin bisa digunakan sebagai bahan baku. Penghalusan glukosa memerlukan waktu yang lama jika hanya untuk digunakan dalam
fermentasi. Meski demikian tidak ada salahnya untuk menjadikan gula tebu asli sebagai bahan baku dalam proses fermentasi.
Tahap pertama dalam proses fermentasi adalah penguraian karbohidrat kompleks menjadi karbohidrat yang lebih sederhana. Sebagai contoh, jika bahan baku yang digunakanan adalah pati dalam biji-bijian seperti gandum atau beras, maka bahan baku ini dipanaskan dengan air panas untuk mengekstrak pati dan selanjutnya dipanaskan dengan malat. Malat adalah beras berkecambah yang mengandung enzim yang dapat menguraikan pati menjadi karbohidrat yang lebih sederhana, yang disebut sebagai maltosa, C12H22O11.
Maltosa memiliki rumus molekul yang sama seperti sukrosa tetapi mengandung dua unit glukosa yang saling mengikat, sedangkan sukrosa mengandung satu unit glukosa dan satu unit fruktosa.
Ragi kemudian dimasukkan dan campuran dibiarkan hangat (sekitar 35°C) selama beberapa hari sampai fermentasi berlangsung sempurna. Udara tidak dibiarkan masuk ke dalam campuran untuk mencegah terjadinya oksidasi etanol yang dihasilkan menjadi asam etanoat (asam cuka).
Enzim-enzim dalam ragi pertama-tama mengubah karbohidrat seperti maltosa atau sukrosa menjadi karbohidrat yang lebih sederhana seperti glukosa dan fruktosa, keduanya C6H12O6, dan kemudian mengubah karbohidrat sederhana tersebut
menjadi etanol dan karbon dioksida.
Perubahan ini bisa ditunjukkan sebagai persamaan-persamaan reaksi kimia sederhana, meski aspek biokimia dari reaksi-reaksi ini jauh lebih rumit.
Ragi dimatikan oleh etanol dengan konsentrasi berlebih sekiar 15%, dan ini membatasi kemurnian etanol yang bisa dihasilkan. Etanol dipisahkan dari campuran dengan metode distilasi fraksional untuk menghasilkan 96% etanol murni.
Secara teori, 4% air yang terakhir tersisa tidak bisa dihilangkan dengan metode distilasi fraksional.
Metanol
Metanol, juga dikenal sebagai metil alkohol, wood alcohol atau spiritus, adalah senyawa kimia dengan rumus kimia CH3OH. Ia merupakan bentuk alkohol
paling sederhana. Pada "keadaan atmosfer" ia berbentuk cairan yang ringan, mudah menguap, tidak berwarna, mudah terbakar, dan beracun dengan bau yang khas (berbau lebih ringan daripada etanol). Ia digunakan sebagai bahan pendingin anti beku, pelarut, bahan bakar dan sebagai bahan additif bagi etanol industri.
Metanol diproduksi secara alami oleh metabolisme anaerobik oleh bakteri. Hasil proses tersebut adalah uap metanol (dalam jumlah kecil) di udara. Setelah beberapa hari, uap metanol tersebut akan teroksidasi oleh oksigen dengan bantuan sinar matahari menjadi karbon dioksida dan air.
Reaksi kimia metanol yang terbakar di udara dan membentuk karbon dioksida dan air adalah sebagai berikut:
2 CH3OH + 3 O2 → 2 CO2 + 4 H2O
Api dari metanol biasanya tidak berwarna. Oleh karena itu, kita harus berhati-hati bila berada dekat metanol yang terbakar untuk mencegah cedera akibat api yang tak terlihat.
Karena sifatnya yang beracun, metanol sering digunakan sebagai bahan additif bagi pembuatan alkohol untuk penggunaan industri; Penambahan "racun" ini akan menghindarkan industri dari pajak yang dapat dikenakan karena etanol merupakan bahan utama untuk minuman keras (minuman beralkohol). Metanol kadang juga disebut sebagai wood alcohol karena ia dahulu merupakan produk samping dari distilasi kayu. Saat ini metanol dihasilkan melului proses multi tahap. Secara singkat, gas alam dan uap air dibakar dalam tungku untuk membentuk gas hidrogen dan karbon monoksida; kemudian, gas hidrogen dan karbon monoksida ini bereaksi dalam tekanan tinggi dengan bantuan katalis untuk menghasilkan metanol. Tahap pembentukannya adalah endotermik dan tahap sintesisnya adalah eksotermik.
Sejarah Metanol
Dalam proses pengawetan mayat, orang Mesir kuno menggunakan berbagai macam campuran, termasuk di dalamnya metanol, yang mereka peroleh dari pirolisis kayu. Methanol murni, pertama kali berhasil diisolasi tahun 1661 oleh Robert Boyle,
yang menamakannya spirit of box, karena ia menghasilkannya melalui distilasi kotak kayu. Nama itu kemudian lebih dikenal sebagai pyroxylic spirit (spiritus). Pada tahun 1834, ahli kimia Perancis Jean-Baptiste Dumas dan Eugene Peligot menentukan komposisi kimianya. Mereka juga memperkenalkan nama methylene untuk kimia organik, yang diambil dari bahasa Yunani methy = "anggur") + hŷlē = kayu (bagian dari pohon). Kata itu semula dimaksudkan untuk menyatakan "alkohol dari (bahan) kayu", tetapi mereka melakukan kesalahan.
Kata methyl pada tahun 1840 diambil dari methylene, dan kemudian digunakan untuk mendeskripsikan "metil alkohol". Nama ini kemudian disingkat menjadi "metanol" tahun 1892 oleh International Conference on Chemical Nomenclature. Suffiks [-yl] (indonesia {il}) yang digunakan dalam kimia organik untuk membentuk nama radikal-radikal, diambil dari kata "methyl".
Pada tahun 1923, ahli kimia Jerman, Matthias Pier, yang bekerja untuk BASF mengembangkan cara mengubah gas sintesis (syngas / campuran dari karbon dioksida and hidrogen) menjadi metanol. Proses ini menggunakan katalis zinc chromate (seng kromat), dan memerlukan kondisi ekstrim —tekanan sekitar 30–100 MPa (300– 1000 atm), dan temperatur sekitar 400 °C. Produksi metanol modern telah lebih effisien dengan menggunakan katalis tembaga yang mampu beroperasi pada tekanan relatif lebih rendah.
Penggunaan metanol sebagai bahan bakar mulai mendapat perhatian ketika krisis minyak bumi terjadi di tahun 1970-an karena ia mudah tersedia dan murah. Masalah timbul pada pengembangan awalnya untuk campuran metanol-bensin. Untuk menghasilkan harga yang lebih murah, beberapa produsen cenderung mencampur metanol lebih banyak.
Produsen lainnya menggunakan teknik pencampuran dan penanganan yang tidak tepat. Akibatnya, hal ini menurunkan mutu bahan bakar yang dihasilkan. Akan tetapi, metanol masih menarik utuk digunakan sebagai bahan bakar bersih. Mobil-mobil dengan bahan bakar fleksibel yang dikeluarkan oleh General Motors, Ford dan Chrysler dapat beroperasi dengan setiap kombinasi etanol, metanol dan/atau bensin.
Produksi Metanol
Saat ini, gas sintesis umumnya dihasilkan dari metana yang merupakan komponen dari gas alam. Terdapat tiga proses yang dipraktekkan secara komersial.
Pada tekanan sedang 1 hingga 2 MPa (10–20 atm) dan temperatur tinggi (sekitar 850 °C), metana bereaksi dengan uap air (steam) dengan katalis nikel untuk menghasilkan gas sintesis menurut reaksi kimia berikut:
CH4 + H2O → CO + 3 H2
Reaksi ini, umumnya dinamakan steam-methane reforming atau SMR, merupakan reaksi endotermik dan limitasi perpindahan panasnya menjadi batasan dari ukuran reaktor katalitik yang digunakan.
Metana juga dapat mengalami oksidasi parsial dengan molekul oksigen untuk menghasilkan gas sintesis melalui reaksi kimia berikut:
2 CH4 + O2 → 2 CO + 4 H2
Reaksi ini adalah eksotermik dan panas yang dihasilkan dapat digunakan secara in-situ untuk menggerakkan reaksi steam-methane reforming. Ketika dua proses tersebut dikombinasikan, proses ini disebut sebagai autothermal reforming. Rasio CO and H2 dapat diatur dengan menggunakan reaksi perpindahan air-gas (the water-gas
shift reaction):
CO + H2O → CO2 + H2
Untuk menghasilkan stoikiometri yang sesuai dalam sintesis metanol. Karbon monoksida dan hidrogen kemudian bereaksi dengan katalis kedua untuk menghasilkan metanol. Saat ini, katalis yang umum digunakan adalah campuran tembaga, seng oksida, dan alumina, yang pertama kali digunakan oleh ICI di tahun 1966. Pada 5–10 MPa (50– 100 atm) dan 250 °C, ia dapat mengkatalisis produksi metanol dari karbon monoksida dan hidrogen dengan selektifitas yang tinggi:
CO + 2 H2 → CH3OH
Sangat perlu diperhatikan bahwa setiap produksi gas sintesis dari metana menghasilkan 3 mol hidrogen untuk setiap mol karbon monoksida, sedangkan sintesis
metanol hanya memerlukan 2 mol hidrogen untuk setiap mol karbon monoksida. Salah satu cara mengatasi kelebihan hidrogen ini adalah dengan menginjeksikan karbon dioksida ke dalam reaktor sintesis metanol, dimana ia akan bereaksi membentuk metanol sesuai dengan reaksi kimia berikut:
CO2 + 3 H2 → CH3OH + H2O
Walaupun gas alam merupakan bahan yang paling ekonomis dan umum digunakan untuk menghasilkan metanol, bahan baku lain juga dapat digunakan. Ketika tidak terdapat gas alam, produk petroleum ringan juga dapat digunakan. Di Afrika Selatan, sebuah perusahaan (Sasol) menghasilkan metanol dengan menggunakan gas sintesis dari batu bara.
Kegunaan Metanol
Metanol digunakan secara terbatas dalam mesin pembakaran dalam, dikarenakan metanol tidak mudah terbakar dibandingkan dengan bensin. Metanol campuran merupakan bahan bakar dalam model radio kontrol.
Salah satu kelemahan metanol sebagai bahan bakar adalah sifat korosi terhadap beberapa logam, termasuk aluminium. Metanol, merupakan asam lemah, menyerang lapisan oksida yang biasanya melindungi aluminium dari korosi:
6 CH3OH + Al2O3 → 2 Al(OCH3)3 + 3 H2O
Ketika diproduksi dari kayu atau bahan oganik lainnya, metanol organik tersebut merupakan bahan bakar terbarui yang dapat menggantikan hidrokarbon. Namun mobil modern pun masih tidak bisa menggunakan BA100 (100% bioalkohol) sebagai bahan bakar tanpa modifikasi. Metanol juga digunakan sebagai solven dan sebagai
antifreeze, dan fluida pencuci kaca depan mobil.
Penggunaan metanol terbanyak adalah sebagai bahan pembuat bahan kimia lainnya. Sekitar 40% metanol diubah menjadi formaldehyde, dan dari sana menjadi berbagai macam produk seperti plastik, plywood, cat, peledak, dan tekstil.
Dalam beberapa pabrik pengolahan air limbah, sejumlah kecil metanol digunakan ke air limbah sebagai bahan makanan karbon untuk denitrifikasi bakteri, yang mengubah nitrat menjadi nitrogen.
Bahan bakar direct-metanol unik karena suhunya yang rendah, operasi pada tekanan atmofser, mengijinkan mereka dibuat kecil. Ditambah lagi dengan penyimpanan dan penanganan yang mudah dan aman membuat metanol dapat digunakan dalam perlengkapan elektronik.
Etanol
Etanol, disebut juga etil alkohol, alkohol murni, alkohol absolut, atau alkohol saja, adalah sejenis cairan yang mudah menguap, mudah terbakar, tak berwarna,
dan merupakan alkohol yang paling sering digunakan dalam kehidupan sehari-hari. Senyawa ini merupakan obat psikoaktif dan dapat ditemukan pada minuman beralkohol dan termometer modern. Etanol adalah salah satu obat rekreasi yang paling tua.
Etanol termasuk ke dalam alkohol rantai tunggal, dengan rumus kimia C2H5OH dan rumus empiris C2H6O. Ia merupakan isomer konstitusional dari dimetil
eter. Etanol sering disingkat menjadi EtOH, dengan "Et" merupakan singkatan dari gugus etil (C2H5).
Fermentasi gula menjadi etanol merupakan salah satu reaksi organik paling awal yang pernah dilakukan manusia. Efek dari konsumsi etanol yang memabukkan juga telah diketahui sejak dulu. Pada zaman modern, etanol yang ditujukan untuk kegunaan industri dihasilkan dari produk sampingan pengilangan minyak bumi.
Etanol banyak digunakan sebagai pelarut berbagai bahan-bahan kimia yang ditujukan untuk konsumsi dan kegunaan manusia. Contohnya adalah pada parfum, perasa, pewarna makanan, dan obat-obatan. Dalam kimia, etanol adalah pelarut yang penting sekaligus sebagai stok umpan untuk sintesis senyawa kimia lainnya. Dalam sejarahnya etanol telah lama digunakan sebagai bahan bakar.
Sejarah Etanol
Etanol telah digunakan manusia sejak zaman prasejarah sebagai bahan pemabuk dalam minuman beralkohol. Residu yang ditemukan pada peninggalan
keramik yang berumur 9000 tahun dari Cina bagian utara menunjukkan bahwa minuman beralkohol telah digunakan oleh manusia prasejarah dari masa Neolitik.
Etanol dan alkohol membentuk larutan azeotrop. Karena itu pemurnian etanol yang mengandung air dengan cara penyulingan biasa hanya mampu menghasilkan etanol dengan kemurnian 96%. Etanol murni (absolut) dihasilkan pertama kali pada tahun 1796 oleh Johan Tobias Lowitz yaitu dengan cara menyaring alkohol hasil distilasi melalui arang.
Lavoisier menggambarkan bahwa etanol adalah senyawa yang terbentuk dari karbon, hidrogen dan oksigen. Pada tahun 1808 Saussure berhasil menentukan rumus kimia etanol. Lima puluh tahun kemudian (1858), Couper mempublikasikan rumus kimia etanol. Dengan demikian etanol adalah salah satu senyawa kimia yang pertama kali ditemukan rumus kimianya.
Etanol pertama kali dibuat secara sintetik pada tahun 1826 secara terpisah oleh Henry Hennel dari Britania Raya dan S.G. Sérullas dari Perancis. Pada tahun 1828, Michael Faraday berhasil membuat etanol dari hidrasi etilena yang dikatalisis oleh asam. Proses ini mirip dengan proses sintesis etanol industri modern.
Etanol telah digunakan sebagai bahan bakar lampu di Amerika Serikat sejak tahun 1840, namun pajak yang dikenakan pada alkohol industri semasa Perang Saudara Amerika membuat penggunaannya tidak ekonomis. Pajak ini dihapuskan pada tahun 1906, dan sejak tahun 1908 otomobil Ford Model T telah dapat dijalankan menggunakan etanol.
Namun, dengan adanya pelarangan minuman beralkohol pada tahun 1920, para penjual bahan bakar etanol dituduh berkomplot dengan penghasil minuman alkohol ilegal, dan bahan bakar etanol kemudian ditinggalkan penggunaannya sampai dengan akhir abad ke-20.
Grafik 1. Volume berlebih campuran etanol dengan air (kontraksi volume)
Grafik 4. Volume Kesetimbangan uap-cair campuran etanol dengan air (termasuk pula azeotrop)
Grafik 5. Volume Celah ketercampuran (miscibility gap) pada campuran dodekana dan etanol
Etanol adalah cairan tak berwarna yang mudah menguap dengan aroma yang khas. Ia terbakar tanpa asap dengan lidah api berwarna biru yang kadang-kadang tidak dapat terlihat pada cahaya biasa.
Sifat-sifat fisika etanol utamanya dipengaruhi oleh keberadaan gugus hidroksil dan pendeknya rantai karbon etanol. Gugus hidroksil dapat berpartisipasi ke dalam ikatan hidrogen, sehingga membuatnya cair dan lebih sulit menguap dari pada senyawa organik lainnya dengan massa molekul yang sama.
Etanol adalah pelarut yang serbaguna, larut dalam air dan pelarut organik lainnya, meliputi asam asetat, aseton, benzena, karbon tetraklorida, kloroform, dietil
eter, etilena glikol, gliserol, nitrometana, piridina, dan toluena. Ia juga larut dalam hidrokarbon alifatik yang ringan, seperti pentana dan heksana, dan juga larut dalam senyawa klorida alifatik seperti trikloroetana dan tetrakloroetilena.
Campuran etanol-air memiliki volume yang lebih kecil daripada jumlah kedua cairan tersebut secara terpisah. Campuran etanal dan air dengan volume yang sama akan menghasilkan campuran yang volumenya hanya 1,92 kali jumlah volume awal.[7][9] Pencampuran etanol dan air bersifat eksotermik dengan energi sekitar 777 J/mol dibebaskan pada 298 K.
Campuran etanol dan air akan membentuk azeotrop dengan perbandingkan kira-kira 89 mol% etanol dan 11 mol% air. Perbandingan ini juga dapat dinyatakan sebagai 96% volume etanol dan 4% volume air pada tekanan normal dan T = 351 K. Komposisi azeotropik ini sangat tergantung pada suhu dan tekanan. Ia akan menghilang pada temperatur di bawah 303 K.
Gambar 14. Ikatan hidrogen pada etanol padat pada −186 °C
Ikatan hidrogen menyebabkan etanol murni sangat hidroskopis, sedemikiannya ia akan menyerap air dari udara. Sifat gugus hidroksil yang polar menyebabkannya dapat larut dalam banyak senyawa ion, utamanya natrium hidroksida, kalium hidroksida, magnesium klorida, kalsium klorida, amonium klorida, amonium bromida, dan natrium bromida.
Natrium klorida dan kalium klorida sedikit larut dalam etanol. Oleh karena etanol juga memiliki rantai karbon nonpolar, ia juga larut dalam senyawa nonpolar, meliput kebanyakan minyak atsiridan banyak perasa, pewarna, dan obat.
Penambahan beberapa persen etanol dalam air akan menurunkan tegangan permukaan air secara drastis. Campuran etanol dengan air yang lebih dari 50% etanol bersifat mudah terbakar dan mudah menyala. Campuran yang kurang dari 50% etanol juga dapat menyala apabila larutan tersebut dipanaskan terlebih dahulu.
Indeks refraksi etanol adalah 1,36242 (pada λ=589,3 nm dan 18,35 °C). Sifat-sifat Kimia Etanol
Etanol termasuk dalam alkohol primer, yang berarti bahwa karbon yang berikatan dengan gugus hidroksil paling tidak memiliki dua hidrogen atom yang terikat dengannya juga. Reaksi kimia yang dijalankan oleh etanol kebanyakan berkutat pada gugus hidroksilnya.
Reaksi asam-basa Etanol
Gugus hidroksil etanol membuat molekul ini sedikit basa. Ia hampir netral dalam air, dengan pH 100% etanol adalah 7,33, berbanding dengan pH air murni yang sebesar 7,00. Etanol dapat diubah menjadi konjugat basanya, ion etoksida (CH3CH2O−),
dengan mereaksikannya dengan logam alkali seperti natrium:
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
ataupun dengan basa kuat seperti natrium hidrida:
CH3CH2OH + NaH → CH3CH2ONa + H2.
Reaksi seperti ini tidak dapat dilakukan dalam larutan akuatik, karena air lebih asam daripada etanol, sehingga pembentukan hidroksida lebih difavoritkan daripada pembentuk etoksida.
Halogenasi Etanol
Etanol bereaksi dengan hidrogen halida dan menghasilkan etil halida seperti etil klorida dan etil bromida:
CH3CH2OH + HCl → CH3CH2Cl + H2O
Reaksi dengan HCl memerlukan katalis seperti seng klorida. Hidrogen klorida dengan keberadaan seng klorida dikenal sebagai reagen Lucas.
CH3CH2OH + HBr → CH3CH2Br + H2O
Reaksi dengan HBr memerlukan proses refluks dengan katalis asam sulfat.
Etil halida juga dapat dihasilkan dengan mereaksikan alkohol dengan agen halogenasi yang khusus, seperti tionil klorida untuk pembuatan etil klorida, ataupun fosforus tribromida untuk pembuatan etil bromida.
CH3CH2OH + SOCl2 → CH3CH2Cl + SO2 + HCl
Dehidrasi Etanol
Asam kuat yang sangat higroskopis seperti asam sulfat akan menyebabkan dehidrasi etanol dan menghasilkan etilena maupun dietil eter:
2 CH3CH2OH → CH3CH2OCH2CH3 + H2O (pada 120'C)
CH3CH2OH → H2C=CH2 + H2O (pada 180'C)
Oksidasi Etanol
Etanol dapat dioksidasi menjadi asetaldehida, yang kemudian dapat dioksidasi lebih lanjut menjadi asam asetat. Dalam tubuh manusia, reaksi oksidasi ini dikatalisis oleh enzim tubuh. Pada laboratorium, larutan akuatik oksidator seperti asam kromat ataupun kalium permanganat digunakan untuk mengoksidasi etanol menjadi asam asetat. Proses ini akan sangat sulit menghasilkan asetaldehida oleh karena terjadinya overoksidasi.
Etanol dapat dioksidasi menjadi asetaldehida tanpa oksidasi lebih lanjut menjadi asam asetat menggunakan piridinium kloro kromat (Pyridinium chloro
C2H5OH + 2[O] → CH3COOH + H2O
Produk oksidasi etanol, asam asetat, digunakan sebagai nutrien oleh tubuh manusia sebagai asetil-koA.
Pembuatan Etanol
Etanol dapat diproduksi secara petrokimia melalui hidrasi etilena ataupun secara biologis melalaui fermentasi gula dengan ragi.
a. Hidrasi etilena
Etanol yang digunakan untuk kebutuhan industri sering kali dibuat dari senyawa petrokimia, utamanya adalah melalui hidrasi etilena:
C2H4(g) + H2O(g) → CH3CH2OH(l).
Katalisa yang digunakan umumnya adalah asam fosfat. Katalis ini digunakan pertama kali untuk produksi skala besar etanol oleh Shell Oil Company pada tahun 1947. Reaksi ini dijalankan dengan tekanan uap berlebih pada suhu 300°C.
Proses lama yang pernah digunakan pada tahun 1930 oleh Union Carbide[20] adalah dengan menghidrasi etilena secara tidak langsung dengan mereaksikannya dengan asam sulfat pekat untuk mendapatkan etil sulfat. Etil sulfat kemudian dihidrolisis dan menghasilkan etanol:
C2H4 + H2SO4 → CH3CH2SO4H
CH3CH2SO4H + H2O → CH3CH2OH + H2SO4
b. Fermentasi
Etanol untuk kegunaan konsumsi manusia (seperti minuman beralkohol) dan kegunaan bahan bakar diproduksi dengan cara fermentasi. Spesiesragi tertentu (misalnya Saccharomyces cerevisiae) mencerna gula dan menghasilkan etanol dan karbon dioksida:
C6H12O6 → 2 CH3CH2OH + 2 CO2
Proses membiakkan ragi untuk mendapatkan alkohol disebut sebagai fermentasi. Konsentrasi etanol yang tinggi akan beracun bagi ragi. Pada jenis ragi yang paling toleran terhadap etanol, ragi tersebut hanya dapat bertahan pada lingkungan 15% etanol berdasarkan volume.
Untuk menghasilkan etanol dari bahan-bahan pati, misalnya serealia, pati tersebut harulah diubah terlebih dahulu menjadi gula. Dalam pembuatan bir, ini dapat dilakukan dengan merendam biji gandum dalam air dan membiarkannya berkecambah. Biji gandum yang beru berkecambah tersebut akan menghasilkan enzim amilase. Biji kecambah gandum ditumbuk, dan amilase yang ada akan mengubah pati menjadi gula.
Untuk etanol bahan bakar, hidrolisis pati menjadi glukosa dapat dilakukan dengan lebih cepat menggunakan asam sulfat encer, menambahkan fungi penghasil amilase, atapun kombinasi dua cara tersebut.
Fenol
Sekelompok senyawa Organik yang gugus hidroksilnya (-OH) langsung melekat pada karbon cincin benzene dinamakan Fenol (Wilbraham, 1992).
Aktivator kuat dalam reaksi substitusi aromatik elektrofilik terletak pada gugus OH-nya, karena ikatan karbon sp2 lebih kuat dari pada ikatan oleh karbon sp3 maka ikatan C-O dari suatu fenol tidak mudah terputuskan. Fenol sendiri bertahan terhadap oksidasi karena pembentukan suatu gugus karbonil akan mengakibatkan dikorbankannya penstabilan aromatik.
Amina dapat dikelompokkan sebagai primer, sekunder, atau tersier, menurut banyaknya substituen alkil atau aril yang terikat pada nitrogen. Suatu nitrogen amina dapat memiliki empat gugus atau atom yang terikat padanya, dalam hal ini nitrogen itu merupakan bagian dari suatu ion positif. Senyawa-senyawa ion-ion ini terbagi dalam dua kategori. Jika salah satu terikat ialah H, maka senyawa itu disebut garam amina Pada esterifikasi fenol tidak melibatkan pemaksapisahan ikatan C-O yang kuat dari fenol itu, tetapi bergantung pada pemaksapisahan ikatan OH. Oleh karena itu , ester
fenol dapat disentesis dengan reaksi-reaksi yang sama yang menghasilkan ester alkil (Fessenden and Fessenden, 1991).
Anilin dapat dibuat dengan menggunakan reduksi dari Nitrobenzen, Nitrobenzen di reaksikan dengan amoniak menggunakan katalis alkohol, serta dengan mereaksikan Monoklor Benzen dengan Amoniak dengan katalis Cu2O pada suhu 200 0C
(Anonim, 2002).
Anilin (fenilamin) termasuk dalam amin aromatik, sedangkan turunan dari amin aromatik dalam bidang farmasi adalah Aetanilida yang berfungsi sebagai antifebri, Ephedrin sebagai vasodilatasi serta Phenaetin sebagai antipiretika (Anonim, 2002).
Garam amina merupakan hasil dari reaksi suatu amina dengan suatu asam mineral atau suatu asam, karena kemampuannya membentuk garam, suatu amina yang tak larut dalam air dapat larut dalam asam encer (Fessenden and Fessenden, 1991).
2.8 Reaksi Senyawaan Alkohol
Reaksi –reaksi pada alkohol dapat digunakan sebagai pengenal alkohol atau untuk mengidentifikasi jenis-jenis alkohol.
2.8.1 Reaksi Identifikasi Alkohol Menggunakan Logam Natrium
Alkohol bereaksi dengan natrium menghasilkan gas hidrogen sesuai dengan persamaan reaksi berikut :
2R – OH + 2Na → 2R – ONa + H2 (g)
Contoh :
2CH3 – CH2 – OH + 2Na → 2CH3 – CH2 – ONa + H2 (g)
Etanol Natrium etoksida
Reaksi ini merupakan reaksi yang paling umum dan mudah dilakukan, serta diamati. Reaksi ini digunakan untuk membedakan alkohol dengan eter karena eter tidak bereaksi dengan logam natrium
2.8.2 Reaksi Identifikasi Alkohol Menggunakan Fosfor Trihalida Reaksi alkohol dengan fosfor trihalida menghasilkan alkil halida.
3R – OH + P3 → 3R – X + H3PO3 X = unsur halogen Contoh : 3CH3 – CH2 – CH – CH2 – OH + PBr3 2-metil-1-butanol ׀ CH3 → 3CH3 – CH2 – CH – CH2 – Br + H3PO3 2-metil-1-bromobutana 2.8.3 Deprotonasi
Alkohol dapat berperilaku sebagai asam lemah,
menjalani deprotonasi. Reaksi yang deprotonasi untuk
menghasilkan alkoksida garam baik dilakukan dengan dasar yang kuat seperti natrium hidrida atau n-butyllithium, atau dengan logam natrium atau kalium.
2 R-OH + 2 NAH → 2 RO - Na + + 2 H 2 ↑
2 R-OH + 2 Na → 2R-O - Na + H 2
Misalnya : 2 CH 3 CH 2-OH + 2 Na → 2 CH 3-CH 2-O- Na + H 2
Air mirip pKa untuk banyak alkohol, sehingga dengan natrium
hidroksida ada keseimbangan mendirikan yang biasanya terletak di kiri:
R-OH + NaOH <=> RO - Na + + H 2 O (kesetimbangan ke kiri)
Perlu dicatat, meskipun, bahwa digunakan untuk basa kuat deprotonate alkohol sendiri. Dasar yang digunakan dan diciptakan alkoxides kelembaban keduanya sangat sensitif reagen kimia.
Keasaman alkohol juga dipengaruhi oleh stabilitas keseluruhan alkoksida ion. Elektron-kelompok menarik yang terikat pada karbon yang mengandung gugus hidroksil akan berfungsi untuk menstabilkan alkoksida ketika dibentuk, sehingga mengakibatkan keasaman yang lebih besar. Di sisi lain, kehadiran kelompok penyumbang elektron akan menghasilkan ion alkoksida kurang stabil terbentuk. Ini akan menghasilkan sebuah skenario di mana tidak stabil ion alkoksida terbentuk akan cenderung menerima proton untuk
mereformasi alkohol asli. Dengan alkil halida alkoxides
menimbulkan eter dalam sintesis eter Williamson.
2.8.4 Substitusi nukleofilik
OH tidak baik kelompok meninggalkan di substitusi nukleofilik reaksi, sehingga tidak netral alkohol bereaksi dalam reaksi tersebut. Namun, jika oksigen terprotonasi pertama untuk memberikan R-OH 2+, kelompok yang
meninggalkan (air) jauh lebih stabil, dan substitusi nukleofilik dapat terjadi. Sebagai contoh, alkohol tersier bereaksi dengan asam klorida untuk menghasilkan tersier alkil halida,di mana gugus hidroksil diganti oleh klorin atom oleh unimolecular substitusi nukleofilik. Jika alkohol primer atau sekunder harus bereaksi dengan asam klorida, seorang penggerak seperti seng kloridayang dibutuhkan. Atau, konversi dapat dilakukan secara langsung menggunakan thionyl klorida.
Gambar 11. Reaksi subtitusi nukleofilik.
Alkohol dapat juga dikonversi menjadi alkil bromida menggunakan asam bromida atau fosfor tribromide, misalnya:
Dalam Barton-McCombie deoxygenation alkohol adalah terdeoksigenasi ke alkana dengan tributyltin hidrida atau trimethylborane kompleks air dalam substitusi radikal reaksi.
2.8.5 Dehidrasi.
Alkohol itu sendiri nukleofilik, jadi R-OH 2+ dapat bereaksi dengan ROH
untuk menghasilkan eter dan air dalam reaksi dehidrasi, meskipun reaksi ini jarang digunakan kecuali dalam pembuatan dietil eter.
Lebih berguna adalah E1 reaksi eliminasi alkohol untuk menghasilkan alkena. Reaksi umumnya mematuhi Zaitsev's Rule, yang menyatakan bahwa yang paling stabil (biasanya yang paling diganti) alkena terbentuk. Menghilangkan alkohol tersier dengan mudah pada suhu kamar tepat di atas, tetapi alkohol primer memerlukan temperatur yang lebih tinggi.
Ini adalah diagram dikatalisis asam dehidrasi etanol untuk menghasilkan etena:
Gambar 12. dehidrasi etanol untuk menghasilkan etena.
Lebih terkontrol adalah reaksi eliminasi Eliminasi Chugaev dengan karbon disulfida dan iodometana.
2.8.6 Esterifikasi.
Untuk membentuk sebuah ester dari alkohol dan asam karboksilat reaksi, yang dikenal sebagai esterifikasi Fischer, biasanya dilakukan pada refluks dengan katalis asam sulfat pekat:
Dalam rangka mendorong kesetimbangan ke kanan dan menghasilkan yang baik hasil dari ester, air biasanya dihapus, baik dengan kelebihan H 2 SO 4 atau dengan menggunakan Dekan-Stark aparat.Ester juga mungkin
disiapkan oleh reaksi alkohol dengan asam klorida dalam kehadiran dasar seperti piridina. Jenis ester siap sama-misalnya tosyl (tosylate) ester dibuat oleh reaksi alkohol dengan p-toluenesulfonyl klorida dalam piridina.
2.8.7
Raksi dengan Hidrogen Halida R – OH + H – X→
R – X + H2OReactivity ; H – X
→
HI > HBr > HClR – OH
→
allyl > benzyl > 3o > 2o > 1o .CH3 – CH(OH) – CH3 + H – Br
→
CH3 – CH(Br) – CH3 + H2O2.8.8 Reaksi dengan wiphosphorous trihalides R – OH + P – X3
→
R – X + H3PO3Oksidasi alkohol menjadi aldehid atau keton, dan reduksi sebaliknya, banyak terjadi dalam proses metabolisme tubuh. Oksidator penting dalam tubuh adalah NAD (nikotinamida adenin dinukleotida).
O O
CH
3–CH
2–OH + NH
2+ enzym CH
3–COH + NH
2(etanol) (NAD+) (aldehid)
(NADH)
[O]
CO
2+ H
2O
[O]CH
3– COOH (asam etanoat)
Reaksi ini terjadi dihati, tahap penting bagi tubuh untuk membuang alkohol, karena alkohol, aldehid adalah racun, senyawa ini harus dioksidasi menjadi asam asetat, dan terus dioksiasi lagi menjadi CO2 + H2O .
NAD juga terlibat dalam oksidasi asam laktat menjadi asam piruvat, satu tahap penting dalam metabolisme karbohidrat.
OH O
CH
3– CH– COOH + NAD+ CH
3– C –COOH + NADH
(asam laktat) (asam piruvat)
Selama aktivitas otot yang hebat, glukosa digunakan untuk menghasilkan enersi, dinamakan glikolisis, dimana glukosa di ubah menjadi piruvat, kemudian direduksi oleh NADH menjadi asam laktat. Laktat adalah jalan buntu dalam metabolisme, jika konsentrasinya dalam otot meningkat maka seseorang menjadi lelah. Untuk penyembuhannya, laktat berdifusi keluar otot menuju hati melalui saluran darah. Dihati, asam laktat dioksidasi kembali oleh NAD+ menjadi piruvat, yang kemudian diubah menjadi glukosa melalui proses glukoneogenesis, dan diangkut lagi keotot, dan dapat digunakan lagi, demikian daurnya.
Alkohol dengan 2, 3 gugus –OH.
OH OH OH OH OH OH OH OH OH OH OH (1,2-etanadiol) (1,2,3-propanatriol) (1,2,3,4,5,6-heksanaheksaol) (etilenglikol) (gliserol) (sarbitol)
(td = 198 oC) ( td = 290 oC) ( tl = 110 – 112 oC) Etilenglikol : sebagai anti beku dalam radiator mobil,
pembuatan dacron,
bercampur sempurna dengan air.
Gliserol : cairan kental, tdk berwarna, rasa manis, larut baik dalam air. sebagai pemghalus pada krim cukur, sabun.
obat batuk, sirup.
CH
2– CH - CH
2+ HNO
3CH
2– CH - CH
2+ H
2O
OH OH OH
ONO
2ONO
2ONO
2(gliserolnitrat / nitrogliserin) Nitrogliserin adalah bahan peledeak yang peka getaran.
Alfred Nobel (1866), menemukan dinamit dari nitrogliserin, yang dikendali kan melalui penyerapan pada bahan berpori dan lembam. Sekarang dinamit dibuat dengan 15% nitrogliserin, amoniumnitrat 55%, natriumnitrat dan pulp kayu 15%.
Sarbitol, larut dalam air, rasa manis seperti gula tebu, pengganti gula bagi penderita diabetes.
2.9 Kegunaan Alkohol.
2.9.1 Kegunaan EtanolAlkohol yang sering dijumpai dalam kehidupan sehari-hari adalah etanol. Etanol berkadar 70% digunakan sebagai zat antiseptik, pembersih luka, serta pensteril alat-alat kedokteran dan industri.
Etanol berkadar 95%-96% digunakan sebagai pelarut dalam industri parfum, bat-obatan, zat warna dan kosmetik. Etanol 95%-96% ini dihasilkan melalui proses distilasi sehingga masih mengandung 4%-5% air. Hal ini terjadi karena campuran air dan alkohol membentuk campuran azeotrop, yaitu campuran zat cair yang terdiri atas dua atau lebih senyawa yang bersifat seperti satu senyawa.