INDUKSI HAPLOID Dianthus chinensis MELALUI
ANDROGENESIS SECARA IN VITRO
Abstrak
Komposisi media mempengaruhi kemampuan antera membentuk kalus dan/atau embrio serta regenerasi tanaman. Pada tanaman Dianthus sp. media padat lebih sesuai untuk induksi kalus antera dibandingkan dengan media cair. Tujuan penelitian ialah mendapatkan media yang sesuai untuk pembentukan kalus dan mendapatkan media regenerasi yang sesuai untuk pertumbuhan kalus androgenik serta mendapatkan tanaman haploid melalui androgenesis. Induksi kalus androgenik dilakukan pada empat jenis media yang mengandung media dasar WT yang berbeda rasio auksin:sitokinin. Delapan jenis media regenerasi diseleksi untuk mendapatkan media yang sesuai untuk regenerasi. Hasil penelitian menunjukkan bahwa media padat AD4 (WT + 9,04 µM 2,4-D+ 5,71 µM NAA + 2,27 µM TDZ) merupakan media yang paling baik untuk induksi kalus pada kultur antera, dengan persentase pembentukan kalus 17,5 %. Media R7 (WT + 2,22 µM BAP) merupakan media yang sesuai untuk regenerasi kalus hasil kultur antera Dchi-13 (37,5%) sedang media R11 (WT + 2,22 µM BA + 0,285 µM NAA) merupakan media yang sesuai untuk regenerasi kalus hasil kultur antera Dchi-11 (66,6%). Analisis ploidi hasil kultur antera menunjukkan bahwa regeneran adalah diploid. Dari hasil penelitian ini dapat disimpulkan bahwa pembentukan kalus pada kultur antera memerlukan auksin (2,4-D) yang lebih tinggi dibanding sitokinin, sebaliknya regenerasi kalus hasil kultur antera memerlukan sitokinin (BAP) yang lebih tinggi dibanding auksin.
HAPLOID INDUCTION OF Dianthus chinensis
BY IN VITRO ANDROGENESIS
Abstract
Induction of anther callus and regeneration depend on media composition and physical state. Solid media was preferred for induction anther callus of Dianthus sp. than liquid medium. The aim of ther research was to obtain suitable media for callus induction and to obtain suitable regeneration media for androgenic callus growth and to obtain haploid plants by androgenesis. Androgenic callus induction was observed in four medium containing WT basic media supplemented with different auxin : cytokinin ratio. Eight regeneration media was selected to obtain appropriate medium for regeneration. The result showed that solid media of AD4 (WT + 9,04 µM 2,4-D+ 5,71 µM NAA + 2,27 µM TDZ) was the best medium for callusing in anther culture, with 17,5% callus formation. R7 media (WT + 2,22 µM BAP) was suitable media for callus regeneration (37,5%) resulted from Dchi-13 anther culture. R11 media (WT + 2,22 µM BAP + 0,285 µM NAA) was suitable media for callus regeneration (66,6%) resulted from Dchi-11 anther culture. Ploidy analysis of anther culture showed that regenerant was diploid. In conclusion, callus formation of anther culture need auxin (2,4-D) higher than cytokinin, on the contrary callus regeneration need cytokinin (BAP) higher than auxin.
Pendahuluan
Dianthus chinensis atau lebih dikenal dengan nama Chinese pink, Indian pink, Japanese pink, Rainbow pink merupakan kerabat Dianthus caryophyllus yang telah digunakan sebagai materi pemuliaan untuk karakter-karakter unik seperti ketahanan terhadap penyakit, laju pertumbuhan yang cepat, adaptasi luas, dan hasil yang tinggi (Tejaswini 2002). Kondisi tanaman hias yang pada umumnya diperbanyak secara vegetatif dengan konstitusi genetik yang heterosigot menyulitkan untuk memprediksi hasil persilangan dengan karakter yang diinginkan. Pembentukan tanaman homosigot pada tanaman yang diperbanyak secara vegetatif memiliki keuntungan dari segi pemuliaan dan perbenihan. Dari segi pemuliaan, diperoleh hibrida F1 dengan karakter sesuai dengan yang diinginkan dan dapat juga diperbanyak secara vegetatif. Dari segi perbenihan, perdagangan benih dalam bentuk biji hibrida F1 lebih efisien dibandingkan bentuk stek.
Untuk mendapatkan tanaman homosigot dapat diperoleh melalui kultur antera yang dikenal dengan androgenesis. Androgenesis merupakan pertumbuhan sporofitik sel gamet jantan yang terinduksi untuk membentuk embrio. Perkembangan sel gamet jantan yang normal menghasilkan serbuk sari (gametofitik) yang mengandung dua sel yaitu sel generatif dan sel vegetatif. Selanjutnya sel generatif menghasilkan dua sel gamet selama pemasakan serbuk sari atau selama perkecambahan serbuk sari dalam stigma.
Induksi perkembangan sporofitik hanya mungkin terjadi pada tahap awal perkembangan ketika sel gamet menunjukkan totipotensinya (Touraev et al. 2001). Androgenesis terjadi jika serbuk sari atau polen diinduksi untuk mengubah dari lintasan gametofitik menjadi lintasan sporofitik sehingga membentuk embrio. Perubahan yang terjadi ditujukan pada pembelahan mikrospora (premitotik) yang membentuk binukleat atau setelah mitosis mikospora (postmitotik), di mana sel vegetatif atau generatif (atau keduanya) membelah untuk melakukan androgenesis (Jacquard et al. 2003; Custers et al. 1994).
Banyak faktor mempengaruhi respon androgenik tanaman. Di antara faktor endogen yang mempengaruhi embriogenesis, selain genotipe ialah tahap perkembangan serbuk sari yang menentukan keberhasilan androgenesis. Faktor lain adalah berkaitan dengan kondisi fisiologis selama perkembangan tanaman donor maupun kondisi pertumbuhan in vitro setiap tahap proses.
Respon androgenik dapat dimodifikasi melalui perlakuan pada tanaman donor. Praperlakuan pada antera merupakan tahap yang penting. Praperlakuan ini diberikan dengan menciptakan kondisi stress. Kondisi stress diperlukan untuk mengubah program gametofitik serbuk sari ke lintasan perkembangan sporofitik, melalui suatu sinyal, menghasilkan embrio haploid. Reorientasi serbuk sari ini sering dihasilkan dengan memberikan sinyal dalam bentuk stress seperti suhu rendah, stress osmotik, pengurangan nutrient (pelaparan atau starvasi), heat-shock, kombinasi dari berbagai macam stres ini (Asakaviciute 2008).
Suhu rendah merupakan praperlakuan yang paling sering digunakan untuk androgenesis. Inkubasi suhu rendah pada donor antera dalam kultur menghasilkan efek rangkap dengan memberikan gangguan mitosis pada serbuk sari untuk membentuk embrio dan memberikan waktu yang cukup untuk serbuk sari dapat dilepaskan oleh antera (Mejza et al. 1993). Pada tanaman barley perlakuan yang umum diberikan ialah penyimpanan tangkai bunga pada 4oC selama 28 hari, pada kelembaban relatif yang tinggi dalam kondisi gelap (Huang dan Sunderland 1982). Namun menurut Powel (1988) durasi optimum untuk perlakuan suhu rendah tergantung pada genotipe. Hasil penelitian Fu et al. (2008) pada Dianthus chinensis perlakuan suhu rendah memberikan hasil terbentuknya kalus tertinggi untuk kultivar “Splendor”. Dari beberapa media yang digunakan media MS dengan rasio auksin : sitokinin tinggi mampu menginduksi kalus androgenik dan media regenerasi dengan rasio auksin:sitokinin rendah dapat meningkatkan regenerasi kalus. Media yang dengan penambahan 2,4-Dmenghambat diferensiasi tunas, sedang penambahan TDZ menyebabkan tunas mengalami vitrifikasi. Media dengan penambahan BA dan NAA merupakan media terbaik untuk regenerasi kalus menjadi tunas. Tujuan penelitian adalah mendapatkan media yang sesuai untuk pembentukan kalus dan mendapatkan media regenerasi yang sesuai untuk pertumbuhan kalus androgenik serta mendapatkan tanaman haploid melalui androgenesis.
Bahan dan Metode
Penelitian dilakukan di Laboratorium Kultur Jaringan Balai Penelitian Tanaman Hias dan Laboratorium terkait, pada bulan Maret 2011 - Maret 2012. Bahan yang digunakan Dianthus chinensis “Dchi-11” dan “Dchi-13” pada tahap perkembangan kuncup bunga T2 (ukuran 1,31 cm -1,5 cm, warna antera putih, umur 5 hari setelah inisiasi kuncup) koleksi Balai Penelitian Tanaman Hias.
Dianthus chinensis “Dchi-11” dan “Dchi-13” dipilih karena memiliki viabilitas serbuk sari tertinggi dari lima tanaman donor lain. Tiga genotipe lain seperti D. barbatus, D. chinensis “Dchi-12 dan Dchi-15 digunakan untuk verifikasi media yang telah dihasilkan. Tanaman ditanam di pot ukuran 17 cm dengan media tanaman campuran humus daun bambu:arang sekam: pupuk kandang = 2:1:1. Penelitian dibagi dalam dua seri percobaan yaitu (1) induksi kalus androgenik dan (2) pertumbuhan dan regenerasi kalus.
Prosedur Pelaksanaan
Percobaan 1. Induksi Kalus Androgenik Dianthus chinensis
Media yang digunakan ialah media dasar WT (Winarto et al. 2009, Winarto et al. 2011) (Lampiran 2). Komposisi media tersebut ialah AD1 = WT + 1,13 µM 2,4-D+ 2,85 µM NAA + 4,54 µM TDZ + 2,22 µM BAP, AD2 = WT + 2,26 µM 2,4-D+ 5,71 µM NAA + 4,54 µM TDZ + 2,22 µM BAP, AD3 = WT + 4,52 µM 2,4-D+ 5,71 µM NAA + 2,27 µM TDZ + 2,22 µM BAP dan AD4 = WT + 9,04 µM 2,4-D+ 5,71 µM NAA + 2,27 µM TDZ
Bahan pemadat menggunakan Phytagel sebanyak 2,8 g L-1dan sukrosa 30 g/l dengan pH 5,8. Percobaan disusun secara faktorial diulang 3 kali. Faktor pertama ialah dua genotipe Dchi-11 dan Dchi-13, dan faktor kedua ialah komposisi media. Sebelum ditanam kuncup bunga disimpan pada suhu 4 oC selama 1 hari. Jumlah antera setiap botol kultur adalah 5. Kultur diinkubasi pada kondisi gelap suhu 4 oC selama 7 hari dilanjutkan dengan suhu 25 oC selama 4 minggu. Setelah itu kultur dipindahkan pada inkubasi terang dengan lama penyinaran 16 jam di bawah lampu fluoresen (13 µmol.m-2.s-1) hingga kalus terbentuk. Pembentukan kalus diamati setelah 1 – 2 bulan. Peubah yang diamati ialah (1) jumlah antera membentuk kalus atau embrio dan (2) tipe kalus. Media yang terbaik kemudian dilakukan verifikasi menggunakan genotipe lain yaitu Dianthus barbatus, Dianthus chinensis Dchi-12 dan Dianthus chinensis Dchi-15.
Analisis data
Data pengamatan dianalisis menggunakan analisis varian (ANOVA) dengan program SAS Release window 9.1. Jika terdapat pengaruh nyata dari perlakuan maka dilakukan uji lanjut menggunakan uji jarak berganda Duncan pada taraf kepercayaan 5%.
Percobaan 2. Pertumbuhan dan regenerasi kalus hasil kultur antera
Dianthus chinensis
Penggunaan berbagai media regenerasi yang diaplikasikan pada kalus hasil percobaan 1. Media regenerasi yang diaplikasikan menggunakan media dasar WT dengan 8 macam kombinasi, yaitu: R6 = WT + 1,11 µM BAP; R7 = WT + 2,22 µM BAP; R8 = WT + 0,444 µM BAP; R9 = WT + 0,222 µM BAP; R10 = WT + 1,11 µM BAP + 0,285 µM NAA; R11 = WT + 2,22 µM BAP + 0,285 µM NAA; R12 = WT + 0,444 µM BAP + 0,285 µM NAA dan R13 = WT + 0,222 µM BAP + 0,285 µM NAA dengan penambahan 30 g L-1 sukrosa pada pH 5,8. Peubah yang diamati ialah (1) jumlah kalus yang beregenerasi, dan (2) saat/lama regenerasi.
Analisis ploidi
Bahan yang digunakan dalam analisis ploidi adalah hasil regenerasi percobaan 2. Analisis ini dilakukan di Pusat Penelitian Biologi LIPI, Cibinong menggunakan alat CyFlow® space (Partec GmbH) yang dilengkapi dengan diode pumped solid-state laser (20 mW) pada panjang gelombang 488 nm and laser diode pada panjang gelombang 638 nm (25 mW). Potongan daun (0.5 cm2) dicacah menggunakan silet di dalam cawan petri yang berisi 500 µl buffer ekstraksi. Setelah 30 – 90 detik buffer ekstraksi disaring menggunakan Partec 50 µl CellTrics filter. Pewarnaan menggunakan PI (Propidium Iodide) dan Rnase (2 ml), selanjutnya diinkubasi selama 30 – 60 menit sebelum dianalisis dalam flow cytometry. Sebagai kontrol (diploid) digunakan daun muda dari Dianthus chinensis Dchi-11.
Hasil
Percobaan 1. Induksi kalus androgenik Dianthus chinensis
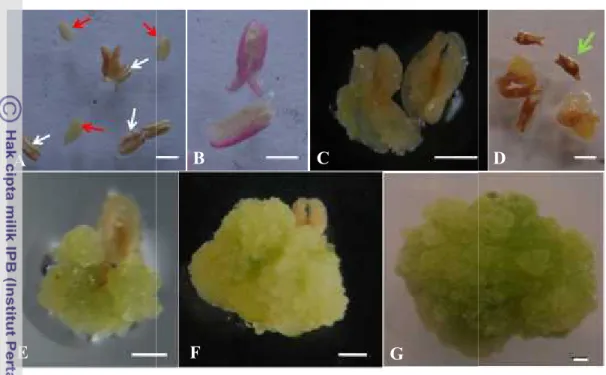
Pembentukan kalus pada antera dimulai dengan membesarnya ukuran antera, diikuti dengan pecahnya kotak antera di daerah stomium (Gambar 11). Selain itu juga terjadi perubahan warna antera menjadi coklat (Gambar 11A) atau ungu (Gambar 11B). Pada kondisi antera berada pada jalur terbentuknya polen yang masak, pada umumnya berubah menjadi warna ungu. Perubahan warna antera diduga karena aktifitas etilen. Selanjutnya pada stomium akan terjadi
diferensiasi akibat respon terhadap komponen media dan hormon (Gambar 11C). Sel kompeten ini akan berubah menjadi meristematik yang aktif membelah. Antera yang tidak mampu membelah akan berwarna coklat tua sampai kehitaman (Gambar 11D).
Gambar 11. Perkembangan pembentukan kalus pada antera Dianthus chinensis. (A) Antera membesar dan dinding antera merekah, (B) dinding antera warna ungu yang merekah, (C) rekahan dinding antera mulai membentuk kalus pada minggu ke 3, (D) antera yang tidak responsif akan kisut berwarna coklat kehitaman, (E) kalus 30 hari setelah inisiasi, (F) kalus 45 hari setelah inisiasi, (G) kalus 3 bulan setelah inisiasi. Panah merah = antera yang tidak respon, panah putih = antera yang merekah, panah hijau = antera mati berwarna coklat kehitaman. Bar = 1 mm
Komposisi media dan genotipe memberikan pengaruh yang sangat nyata terhadap pertumbuhan antera, namun interaksi antara media dan genotipe tidak berpengaruh nyata. Respon pertumbuhan yang baik umumnya ditandai dengan kondisi antera yang tetap segar dan inisiasi kalus pada daerah belahan antera, meskipun sebagian besar mati akibat pencoklatan (Gambar 10D). Antera yang tetap segar memiliki peluang terinduksi membentuk kalus, meskipun tidak setiap antera yang segar dapat membentuk kalus. Kalus terus tumbuh dan berkembang dan terlihat jelas 1 bulan setelah inisiasi (Gambar 10E) dan 3 bulan setelah inisiasi (Gambar 10G).
Hasil analisis data tidak terdapat interaksi antara genotipe dengan media. Persentase pembentukan kalus genotipe Dchi-13 lebih tinggi, tetapi lebih lambat dalam membentuk kalus dibandingkan genotipe Dchi-11 (Tabel 6). Dchi-13
A B C D
G F
E
diferensiasi akibat respon terhadap komponen media dan hormon (Gambar 11C). Sel kompeten ini akan berubah menjadi meristematik yang aktif membelah. Antera yang tidak mampu membelah akan berwarna coklat tua sampai kehitaman (Gambar 11D).
Gambar 11. Perkembangan pembentukan kalus pada antera Dianthus chinensis. (A) Antera membesar dan dinding antera merekah, (B) dinding antera warna ungu yang merekah, (C) rekahan dinding antera mulai membentuk kalus pada minggu ke 3, (D) antera yang tidak responsif akan kisut berwarna coklat kehitaman, (E) kalus 30 hari setelah inisiasi, (F) kalus 45 hari setelah inisiasi, (G) kalus 3 bulan setelah inisiasi. Panah merah = antera yang tidak respon, panah putih = antera yang merekah, panah hijau = antera mati berwarna coklat kehitaman. Bar = 1 mm
Komposisi media dan genotipe memberikan pengaruh yang sangat nyata terhadap pertumbuhan antera, namun interaksi antara media dan genotipe tidak berpengaruh nyata. Respon pertumbuhan yang baik umumnya ditandai dengan kondisi antera yang tetap segar dan inisiasi kalus pada daerah belahan antera, meskipun sebagian besar mati akibat pencoklatan (Gambar 10D). Antera yang tetap segar memiliki peluang terinduksi membentuk kalus, meskipun tidak setiap antera yang segar dapat membentuk kalus. Kalus terus tumbuh dan berkembang dan terlihat jelas 1 bulan setelah inisiasi (Gambar 10E) dan 3 bulan setelah inisiasi (Gambar 10G).
Hasil analisis data tidak terdapat interaksi antara genotipe dengan media. Persentase pembentukan kalus genotipe Dchi-13 lebih tinggi, tetapi lebih lambat dalam membentuk kalus dibandingkan genotipe Dchi-11 (Tabel 6). Dchi-13
A B C D
G F
E
diferensiasi akibat respon terhadap komponen media dan hormon (Gambar 11C). Sel kompeten ini akan berubah menjadi meristematik yang aktif membelah. Antera yang tidak mampu membelah akan berwarna coklat tua sampai kehitaman (Gambar 11D).
Gambar 11. Perkembangan pembentukan kalus pada antera Dianthus chinensis. (A) Antera membesar dan dinding antera merekah, (B) dinding antera warna ungu yang merekah, (C) rekahan dinding antera mulai membentuk kalus pada minggu ke 3, (D) antera yang tidak responsif akan kisut berwarna coklat kehitaman, (E) kalus 30 hari setelah inisiasi, (F) kalus 45 hari setelah inisiasi, (G) kalus 3 bulan setelah inisiasi. Panah merah = antera yang tidak respon, panah putih = antera yang merekah, panah hijau = antera mati berwarna coklat kehitaman. Bar = 1 mm
Komposisi media dan genotipe memberikan pengaruh yang sangat nyata terhadap pertumbuhan antera, namun interaksi antara media dan genotipe tidak berpengaruh nyata. Respon pertumbuhan yang baik umumnya ditandai dengan kondisi antera yang tetap segar dan inisiasi kalus pada daerah belahan antera, meskipun sebagian besar mati akibat pencoklatan (Gambar 10D). Antera yang tetap segar memiliki peluang terinduksi membentuk kalus, meskipun tidak setiap antera yang segar dapat membentuk kalus. Kalus terus tumbuh dan berkembang dan terlihat jelas 1 bulan setelah inisiasi (Gambar 10E) dan 3 bulan setelah inisiasi (Gambar 10G).
Hasil analisis data tidak terdapat interaksi antara genotipe dengan media. Persentase pembentukan kalus genotipe Dchi-13 lebih tinggi, tetapi lebih lambat dalam membentuk kalus dibandingkan genotipe Dchi-11 (Tabel 6). Dchi-13
A B C D
G F
menghasilkan kalus lebih banyak dan berbeda secara signifikan (P<0.05) dibandingkan dengan Dchi-11. Dari Tabel 7 tersebut jelas terlihat bahwa genotipe donor merupakan faktor kunci keberhasilan pembentukan kalus.
Table 7. Respon dua genotipe D. chinensis (rataan persentase terbentuknya kalus dan waktu terbentuknya kalus) pada media induksi kalus
Genotipe Persentase antera
membentuk kalus (%) Waktu terbentuknyakalus (hari)
Dchi-11 2,50 b 19,50
Dchi-13 18,75 a 31,88
Keterangan: Angka rataan yang diikuti oleh huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan uji wilayah berganda Duncan pada taraf kepercayaan 5%.
Media AD4 merupakan media dasar yang paling potensial untuk kultur antera Dianthus chinensis. Komposisi media tersebut mampu menginduksi persentase antera tertinggi membentuk kalus (17,50%) dibandingkan media yang lain walaupun dengan media AD1 dan AD3 tidak berbeda nyata (Tabel 8). Kesesuaian kombinasi dan konsentrasi hormon diduga juga mempengaruhi komposisi media dasar dalam pembentukan kalus. Kombinasi antara 9,04 µM 2,4-D+ 2,27 µM TDZ + 5,71 µM NAA pada media dasar WT (AD4) sesuai untuk pembentukan kalus D. chinensis. Kombinasi antara 2,26 µM 2,4-D+ 4,54 µM TDZ + 2,22 µM BAP + 5,71 µM NAA pada media dasar WT (AD2) paling sedikit membentuk kalus.
Tabel 8. Pengaruh media terhadap persentase antera membentuk kalus dan waktu terbentuknya kalus pada genotype D. chinensis
Media Persentase antera
membentuk kalus (%) terbentuknya kalus (hari)Waktu mulai
AD1 10,0 ab 36,0
AD2 5,0 b 38,0
AD3 10,0 ab 25,0
AD4 17,5 a 28,5
Keterangan: Angka rataan yang diikuti oleh huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan uji wilayah berganda Duncan pada taraf kepercayaan 5%. AD1 = WT + 1,13 µM 2,4-D+ 2,85 µM NAA + 4,54 µM TDZ + 2,22 µM BAP, AD2 = WT + 2,26 µM 2,4-D+ 5,71 µM NAA + 4,54 µM TDZ + 2,22 µM BAP, AD3 = WT + 4,52 µM 2,4-D+ 5,71 µM NAA + 2,27 µM TDZ + 2,22 µM BAP dan AD4 = WT + 9,04 µM 2,4-D+ 5,71 µM NAA + 2,27 µM TDZ
Waktu mulai terbentuknya kalus pada semua media berkisar antara 25 sampai 38 hari setelah induksi (Tabel 7). Waktu terbentuknya kalus tercepat adalah genotipe yang di tanaman pada media AD4 yaitu 25 hari setelah induksi.
Media AD4 yang merupakan media terbaik selanjutnya digunakan untuk verifikasi dan diaplikasikan pada genotipe lain (Dianthus barbatus, Dianthus chinensis Dchi-12 dan Dchi-15). Verifikasi media dilakukan pada genotipe-genotipe ini karena pada saat perlakuan genotipe-genotipe-genotipe-genotipe ini belum berbunga. Hasil yang diperoleh hanya genotipe Dchi-12 dan Dchi-15 yang dapat membentuk kalus (Gambar 12). Hasil ini menunjukkan bahwa setiap genotipe membutuhkan media yang spesifik. Pada umumnya kalus terbentuk 3 - 4 minggu setelah kultur.
Gambar 12. Verifikasi media AD4 kultur antera (A) Dianthus barbatus, (B) Dianthus chinensis Dchi-12 dan (C) Dianthus chinensis Dchi-15. Bar = 1 mm
Percobaan 2. Pertumbuhan dan regenerasi kalus hasil kultur antera
Dianthus sp.
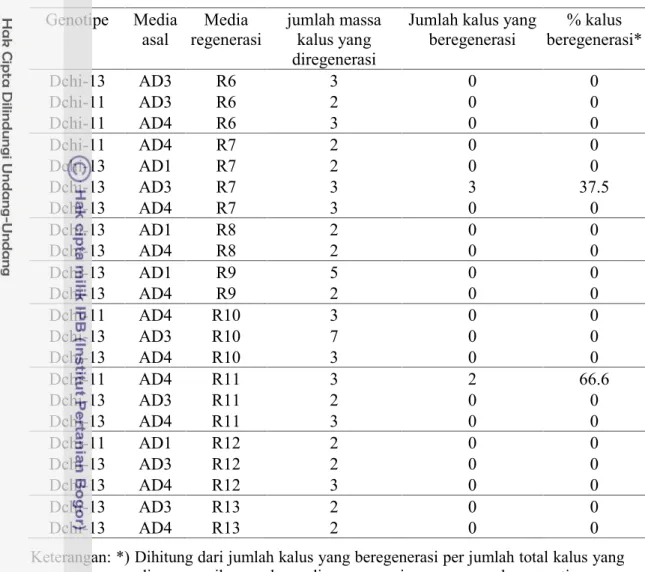
Regenerasi kalus menggunakan media dasar yang sama dengan media induksi kalus, tetapi dengan mengurangi konsentrasi auksin dan sitokinin. Dari delapan media regenerasi yang diuji hanya media R7 dan R11 yang sesuai untuk regenerasi (Tabel 9). Eksplan Dchi-13-148-3 dengan media induksi awal AD3 (Gambar 13A), eksplan mampu beregenerasi pada media R7, sedangkan eksplan Dchi-11-171-4 dengan media induksi awal AD4 (Gambar 13B), eksplan mampu beregenerasi pada media R11. Pada pembentukan kalus dan regenerasi genotipe Dchi-13 lebih tinggi dibandingkan dengan Dchi-11. Media regenerasi lain seperti R6, R8, R9, R10, R12 dan R13 menghambat diferensiasi tunas (Gambar 13C). Pemberian 0,285 µM NAA dan 2,22 µM BAP pada media R11 mampu meningkatkan persentase kalus yang beregenerasi dibandingkan media R7 yang hanya berisi 2,22 µM BAP.
Kalus yang mampu beregenerasi, satu bulan berikutnya disubkultur ke media MS tanpa zat pengatur tumbuh. Pertumbuhan selanjutnya regeneran mampu memperbanyak diri pada media tersebut, tetapi semua kalus terinduksi bunga prematur. Bentuk kuncup bunga juga tidak normal, petal tidak berkembang, tanpa daun, dan ukuran kecil (1 – 1,5 cm) (Gambar 13D dan E).
A B C
Media AD4 yang merupakan media terbaik selanjutnya digunakan untuk verifikasi dan diaplikasikan pada genotipe lain (Dianthus barbatus, Dianthus chinensis Dchi-12 dan Dchi-15). Verifikasi media dilakukan pada genotipe-genotipe ini karena pada saat perlakuan genotipe-genotipe-genotipe-genotipe ini belum berbunga. Hasil yang diperoleh hanya genotipe Dchi-12 dan Dchi-15 yang dapat membentuk kalus (Gambar 12). Hasil ini menunjukkan bahwa setiap genotipe membutuhkan media yang spesifik. Pada umumnya kalus terbentuk 3 - 4 minggu setelah kultur.
Gambar 12. Verifikasi media AD4 kultur antera (A) Dianthus barbatus, (B) Dianthus chinensis Dchi-12 dan (C) Dianthus chinensis Dchi-15. Bar = 1 mm
Percobaan 2. Pertumbuhan dan regenerasi kalus hasil kultur antera
Dianthus sp.
Regenerasi kalus menggunakan media dasar yang sama dengan media induksi kalus, tetapi dengan mengurangi konsentrasi auksin dan sitokinin. Dari delapan media regenerasi yang diuji hanya media R7 dan R11 yang sesuai untuk regenerasi (Tabel 9). Eksplan Dchi-13-148-3 dengan media induksi awal AD3 (Gambar 13A), eksplan mampu beregenerasi pada media R7, sedangkan eksplan Dchi-11-171-4 dengan media induksi awal AD4 (Gambar 13B), eksplan mampu beregenerasi pada media R11. Pada pembentukan kalus dan regenerasi genotipe Dchi-13 lebih tinggi dibandingkan dengan Dchi-11. Media regenerasi lain seperti R6, R8, R9, R10, R12 dan R13 menghambat diferensiasi tunas (Gambar 13C). Pemberian 0,285 µM NAA dan 2,22 µM BAP pada media R11 mampu meningkatkan persentase kalus yang beregenerasi dibandingkan media R7 yang hanya berisi 2,22 µM BAP.
Kalus yang mampu beregenerasi, satu bulan berikutnya disubkultur ke media MS tanpa zat pengatur tumbuh. Pertumbuhan selanjutnya regeneran mampu memperbanyak diri pada media tersebut, tetapi semua kalus terinduksi bunga prematur. Bentuk kuncup bunga juga tidak normal, petal tidak berkembang, tanpa daun, dan ukuran kecil (1 – 1,5 cm) (Gambar 13D dan E).
A B C
Media AD4 yang merupakan media terbaik selanjutnya digunakan untuk verifikasi dan diaplikasikan pada genotipe lain (Dianthus barbatus, Dianthus chinensis Dchi-12 dan Dchi-15). Verifikasi media dilakukan pada genotipe-genotipe ini karena pada saat perlakuan genotipe-genotipe-genotipe-genotipe ini belum berbunga. Hasil yang diperoleh hanya genotipe Dchi-12 dan Dchi-15 yang dapat membentuk kalus (Gambar 12). Hasil ini menunjukkan bahwa setiap genotipe membutuhkan media yang spesifik. Pada umumnya kalus terbentuk 3 - 4 minggu setelah kultur.
Gambar 12. Verifikasi media AD4 kultur antera (A) Dianthus barbatus, (B) Dianthus chinensis Dchi-12 dan (C) Dianthus chinensis Dchi-15. Bar = 1 mm
Percobaan 2. Pertumbuhan dan regenerasi kalus hasil kultur antera
Dianthus sp.
Regenerasi kalus menggunakan media dasar yang sama dengan media induksi kalus, tetapi dengan mengurangi konsentrasi auksin dan sitokinin. Dari delapan media regenerasi yang diuji hanya media R7 dan R11 yang sesuai untuk regenerasi (Tabel 9). Eksplan Dchi-13-148-3 dengan media induksi awal AD3 (Gambar 13A), eksplan mampu beregenerasi pada media R7, sedangkan eksplan Dchi-11-171-4 dengan media induksi awal AD4 (Gambar 13B), eksplan mampu beregenerasi pada media R11. Pada pembentukan kalus dan regenerasi genotipe Dchi-13 lebih tinggi dibandingkan dengan Dchi-11. Media regenerasi lain seperti R6, R8, R9, R10, R12 dan R13 menghambat diferensiasi tunas (Gambar 13C). Pemberian 0,285 µM NAA dan 2,22 µM BAP pada media R11 mampu meningkatkan persentase kalus yang beregenerasi dibandingkan media R7 yang hanya berisi 2,22 µM BAP.
Kalus yang mampu beregenerasi, satu bulan berikutnya disubkultur ke media MS tanpa zat pengatur tumbuh. Pertumbuhan selanjutnya regeneran mampu memperbanyak diri pada media tersebut, tetapi semua kalus terinduksi bunga prematur. Bentuk kuncup bunga juga tidak normal, petal tidak berkembang, tanpa daun, dan ukuran kecil (1 – 1,5 cm) (Gambar 13D dan E).
Tabel 9. Jumlah massa kalus yang diregenerasi, jumlah kalus dan persen kalus yang beregenerasi pada dua genotype, berdasarkan media asal dan media regenerasi
Genotipe Media
asal regenerasiMedia jumlah massakalus yang diregenerasi
Jumlah kalus yang
beregenerasi beregenerasi*% kalus
Dchi-13 AD3 R6 3 0 0 Dchi-11 AD3 R6 2 0 0 Dchi-11 AD4 R6 3 0 0 Dchi-11 AD4 R7 2 0 0 Dchi-13 AD1 R7 2 0 0 Dchi-13 AD3 R7 3 3 37.5 Dchi-13 AD4 R7 3 0 0 Dchi-13 AD1 R8 2 0 0 Dchi-13 AD4 R8 2 0 0 Dchi-13 AD1 R9 5 0 0 Dchi-13 AD4 R9 2 0 0 Dchi-11 AD4 R10 3 0 0 Dchi-13 AD3 R10 7 0 0 Dchi-13 AD4 R10 3 0 0 Dchi-11 AD4 R11 3 2 66.6 Dchi-13 AD3 R11 2 0 0 Dchi-13 AD4 R11 3 0 0 Dchi-11 AD1 R12 2 0 0 Dchi-13 AD3 R12 2 0 0 Dchi-13 AD4 R12 3 0 0 Dchi-13 AD3 R13 2 0 0 Dchi-13 AD4 R13 2 0 0
Keterangan: *) Dihitung dari jumlah kalus yang beregenerasi per jumlah total kalus yang diregenerasikan pada media regenerasi yang sama, dan genotipe yang sama. AD1 = WT + 1,13 µM 2,4-D+ 2,85 µM NAA + 4,54 µM TDZ + 2,22 µM BAP, AD3 = WT + 4,52 µM 2,4-D+ 5,71 µM NAA + 2,27 µM TDZ + 2,22 µM BAP dan AD4 = WT + 9,04 µM 2,4-D+ 5,71 µM NAA + 2,27 µM TDZ.
Gambar 13. Regenerasi kalus hasil kultur antera. (A) Genotipe Dchi-13-148-3, (B) Genotipe Dchi-11-171-4, (C) Genotipe Dchi-13-186-3, (D dan E) Regenerasi kalus menjadi kuncup bunga prematur (tanda panah). Bar = 0,5 cm
A B C
D E
A
Tabel 9. Jumlah massa kalus yang diregenerasi, jumlah kalus dan persen kalus yang beregenerasi pada dua genotype, berdasarkan media asal dan media regenerasi
Genotipe Media
asal regenerasiMedia jumlah massakalus yang diregenerasi
Jumlah kalus yang
beregenerasi beregenerasi*% kalus
Dchi-13 AD3 R6 3 0 0 Dchi-11 AD3 R6 2 0 0 Dchi-11 AD4 R6 3 0 0 Dchi-11 AD4 R7 2 0 0 Dchi-13 AD1 R7 2 0 0 Dchi-13 AD3 R7 3 3 37.5 Dchi-13 AD4 R7 3 0 0 Dchi-13 AD1 R8 2 0 0 Dchi-13 AD4 R8 2 0 0 Dchi-13 AD1 R9 5 0 0 Dchi-13 AD4 R9 2 0 0 Dchi-11 AD4 R10 3 0 0 Dchi-13 AD3 R10 7 0 0 Dchi-13 AD4 R10 3 0 0 Dchi-11 AD4 R11 3 2 66.6 Dchi-13 AD3 R11 2 0 0 Dchi-13 AD4 R11 3 0 0 Dchi-11 AD1 R12 2 0 0 Dchi-13 AD3 R12 2 0 0 Dchi-13 AD4 R12 3 0 0 Dchi-13 AD3 R13 2 0 0 Dchi-13 AD4 R13 2 0 0
Keterangan: *) Dihitung dari jumlah kalus yang beregenerasi per jumlah total kalus yang diregenerasikan pada media regenerasi yang sama, dan genotipe yang sama. AD1 = WT + 1,13 µM 2,4-D+ 2,85 µM NAA + 4,54 µM TDZ + 2,22 µM BAP, AD3 = WT + 4,52 µM 2,4-D+ 5,71 µM NAA + 2,27 µM TDZ + 2,22 µM BAP dan AD4 = WT + 9,04 µM 2,4-D+ 5,71 µM NAA + 2,27 µM TDZ.
Gambar 13. Regenerasi kalus hasil kultur antera. (A) Genotipe Dchi-13-148-3, (B) Genotipe Dchi-11-171-4, (C) Genotipe Dchi-13-186-3, (D dan E) Regenerasi kalus menjadi kuncup bunga prematur (tanda panah). Bar = 0,5 cm
A B C
D E
A
Tabel 9. Jumlah massa kalus yang diregenerasi, jumlah kalus dan persen kalus yang beregenerasi pada dua genotype, berdasarkan media asal dan media regenerasi
Genotipe Media
asal regenerasiMedia jumlah massakalus yang diregenerasi
Jumlah kalus yang
beregenerasi beregenerasi*% kalus
Dchi-13 AD3 R6 3 0 0 Dchi-11 AD3 R6 2 0 0 Dchi-11 AD4 R6 3 0 0 Dchi-11 AD4 R7 2 0 0 Dchi-13 AD1 R7 2 0 0 Dchi-13 AD3 R7 3 3 37.5 Dchi-13 AD4 R7 3 0 0 Dchi-13 AD1 R8 2 0 0 Dchi-13 AD4 R8 2 0 0 Dchi-13 AD1 R9 5 0 0 Dchi-13 AD4 R9 2 0 0 Dchi-11 AD4 R10 3 0 0 Dchi-13 AD3 R10 7 0 0 Dchi-13 AD4 R10 3 0 0 Dchi-11 AD4 R11 3 2 66.6 Dchi-13 AD3 R11 2 0 0 Dchi-13 AD4 R11 3 0 0 Dchi-11 AD1 R12 2 0 0 Dchi-13 AD3 R12 2 0 0 Dchi-13 AD4 R12 3 0 0 Dchi-13 AD3 R13 2 0 0 Dchi-13 AD4 R13 2 0 0
Keterangan: *) Dihitung dari jumlah kalus yang beregenerasi per jumlah total kalus yang diregenerasikan pada media regenerasi yang sama, dan genotipe yang sama. AD1 = WT + 1,13 µM 2,4-D+ 2,85 µM NAA + 4,54 µM TDZ + 2,22 µM BAP, AD3 = WT + 4,52 µM 2,4-D+ 5,71 µM NAA + 2,27 µM TDZ + 2,22 µM BAP dan AD4 = WT + 9,04 µM 2,4-D+ 5,71 µM NAA + 2,27 µM TDZ.
Gambar 13. Regenerasi kalus hasil kultur antera. (A) Genotipe Dchi-13-148-3, (B) Genotipe Dchi-11-171-4, (C) Genotipe Dchi-13-186-3, (D dan E) Regenerasi kalus menjadi kuncup bunga prematur (tanda panah). Bar = 0,5 cm
A B C
D E
Analisis ploidi
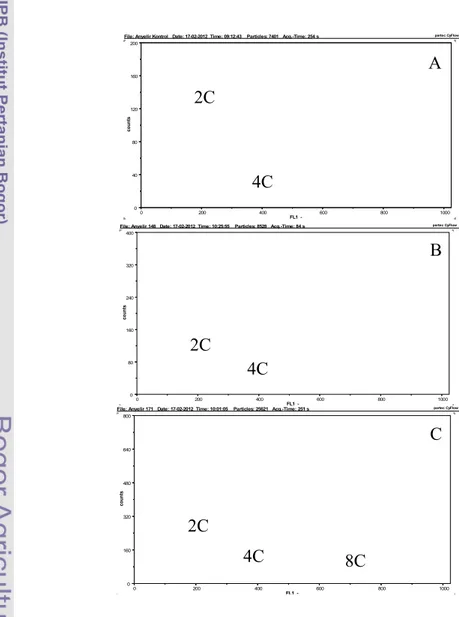
Analisis ploidi dilakukan pada sampel kalus yang telah beregenerasi, karena kondisi regeneran tidak mampu untuk mendapatkan planlet normal. Tanaman kontrol diploid untuk analisis ploidi dengan flow cytometer berasal dari Dchi-11. Sebagian kalus dari tanaman donor dan daun dari tanaman kontrol diploid diambil sampelnya kemudian dianalisis dengan flow cytometer. Hasil analisis dengan flow cytometer diperoleh bahwa dua regeneran (Dchi-13-148-3 dan Dchi-11-171-4) tersebut memiliki level ploidi sama dengan tanaman kontrol (Gambar 14). Kalus dari tanaman donor disajikan dalam bentuk puncak DNA G1 pada channel 200 (Gambar 14A), yang ditetapkan sebagai standar 2C untuk sel diploid bersama dengan puncak kecil pada channel 400 sebagai karakteristik dari puncak G2.
Gambar 14. Histogram DNA hasil analisis flow cytometer: (A) Tanaman kontrol diploid D-chi11/Dchi-11; (B) Regeneran hasil kultur antera Dchi-13-148-3 dan (C) Regeneran hasil kultur antera Dchi-11-171-4.
File: Anyelir Kontrol Date: 17-02-2012 Time: 09:12:43 Particles: 7401 Acq.-Time: 254 s
0 200 400 600 800 1000 0 40 80 120 160 200 FL1 -co un ts 0 200 400 600 800 1000 0 40 80 120 160 200 FL1 -co un ts partec CyFlow
File: Anyelir 148 Date: 17-02-2012 Time: 10:25:55 Particles: 8528 Acq.-Time: 84 s
0 200 400 600 800 1000 0 80 160 240 320 400 FL1 -co un ts 0 200 400 600 800 1000 0 80 160 240 320 400 FL1 -co un ts partec CyFlow
File: Anyelir 171 Date: 17-02-2012 Time: 10:01:05 Particles: 25621 Acq.-Time: 251 s
0 200 400 600 800 1000 0 160 320 480 640 800 FL1 -co un ts 0 200 400 600 800 1000 0 160 320 480 640 800 FL1 -co un ts partec CyFlow A B C 2C 2C 2C 4C 4C 4C 8C
Analisis ploidi tanaman donor ini hanya dilakukan satu sampel saja. Sampel yang akurat biasanya menggunakan daun. Pada umumnya apabila kalus digunakan sebagai sampel, akan terdapat kemungkinan bentuk mixoploid akan muncul. Walaupun terdapat kemungkinan mixoploid (Gambar 14C), tetapi pada umumnya sampel kalus akan berada pada channel 200 (fase G1) dan 400 (fase G2) atau bentuk diploid. Analisis ploidi dilakukan menggunakan sampel kalus karena eksplan mengalami perubahan fase generatif prematur. Analisis sitologi dengan melihat jumlah kromosom sulit dilakukan karena sel terlalu kecil untuk dideteksi jumlah kromosomnya.
Pembahasan
Percobaan 1. Induksi kalus androgenik Dianthus chinensis
Penggunaan media dasar WT dipilih berdasarkan hasil uji pendahuluan setelah penggunaan media dasar MS tidak menghasilkan kalus. Media dasar WT yang merupakan modifikasi media MMS yang memiliki komposisi elemen makro dan mikro yang lebih kecil konsentrasinya dibandingkan media dasar MS. Media ini merupakan media kultur antera Anthurium sp. yang paling baik untuk pembentukan kalus (Winarto 2009). Komposisi media dasar WT terdapat penambahan unsur NaH2PO4.H2O dan rasio NH4+: NO3-= 1: 2,21. Vitamin hanya terdiri atas myo-inositol dan thiamin, di mana myo-inositol lebih tinggi dari MS dan thiamin setengah dari media MS. Kombinasi komposisi media dan konsentrasi hormon yang sesuai diduga juga mempengaruhi komposisi media dasar dalam pembentukan kalus antera Dianthus chinensis.
Media AD1 memiliki rasio auksin:sitokinin 0,6:1, AD2 memiliki rasio auksin:sitokinin 1,18:1 lebih tinggi dari AD1. Media AD3 memiliki rasio auksin:sitokinin 2,28:1 dan AD4 memiliki rasio auksin:sitokinin tertinggi yaitu 6,5:1. Media AD4 menambah konsentrasi 2,4-D dua kali lipat, tetapi mengurangi hormon BAP. Ekplan yang ditanam pada media dasar WT yang mengandung 9,04 µM 2,4-D, 5,71 µM NAA, dan 2,27 µM TDZ (media AD4) menghasilkan persentase terbentuknya kalus tertinggi. Hasil ini menunjukkan bahwa induksi kalus Dianthus chinensis memerlukan rasio auksin:sitokinin yang tinggi. Hasil yang sama juga terjadi pada penelitian Fu et al. (2008) dan Pareek dan Kothari (2003) pada 3 species Dianthus sp. yaitu D. caryophyllus, barbatus dan chienesis, di mana rasio auksin:sitokinin yang tinggi (10,3:1) diperlukan dalam
pembentukan kalus yang embriogenik. Hasil yang sama juga diperoleh Ammirato (1997) dan Frey et al. (1992), yang menggunakan 2,4-D untuk menginduksi kalus embriogenik pada anyelir. 2,4-D merupakan zat pengatur tumbuh kelompok auksin yang umum digunakan untuk menginduksi kalus dalam kondisi gelap. 2,4-D mudah diserap sel tanaman, tidak mudah terurai, berfungsi sebagai auksin yang kuat dan mampu mendorong aktivitas morfogenesis (Terzi &Loschiavo 1990).
Percobaan 2. Pertumbuhan dan regenerasi kalus hasil kultur antera
Dianthus chinensis.
Dchi-13 dapat membentuk kalus pada media WT + 4,52 µM 2,4-D+ 5,71 µM NAA + 2,27 µM TDZ + 2,22 µM BAP dan beregenerasi pada media WT + 2,22 µM BAP, sedangkan Dchi-11 dapat membentuk kalus pada media WT + 9,04 µM 2,4-D+ 5,71 µM NAA + 2,27 µM TDZ dan beregenerasi pada media WT + 2,22 µM BAP + 0,285 µM NAA. Aplikasi ZPT ke dalam media kultur berperan dalam pembentukan, pertumbuhan dan regenerasi kalus. Pemberian konsentrasi ZPT yang tinggi umumnya diperlukan untuk proses morfogenesis awal dan digunakan untuk dediferensiasi serta pembentukan sel-sel meristematik. Peran ZPT akan menurun setelah sel aktif membelah. Pada tahap ini kalus akan teregenerasi menjadi dua kelompok sel yaitu sel meristematik dan non meristematik sel (George et al. 2007).
Waktu regenerasi dua kalus Dchi-13-148-3 dan Dchi-11-171-4 sama yaitu 8 minggu setelah sub kultur pada media regenerasi. Saat pembentukan kalus rasio auksin lebih tinggi (>2,28:1 ) pada media induksi kalus AD3 dan AD4, sebaliknya pada saat regenerasi, media regenerasi yang memiliki rasio auksin:sitokinin rendah (0,13:1) pada media regenerasi R11 memberikan respon yang positif. Rasio auksin:sitokinin rendah inilah yang diduga berpengaruh terhadap aktivitas pembelahan sel, pertumbuhan dan perkembangan tunas. Media regenerasi R11 menghasilkan persen regenerasi kalus yang lebih tinggi dibandingkan dengan R7 pada genotipe yang sama (Tabel 8). Media regenerasi R11 sesuai untuk genotipe Dchi-11 dan media regenerasi R7 sesuai untuk genotipe Dchi-13. Media regenerasi R7 hanya mengandung zat pengatur tumbuh sitokinin saja yaitu 22,2 µM BAP, sementara media regenerasi R11 mengandung sitokinin 22,2 µM BAP dan auksin 0,285 µM NAA. Ini berarti kehadiran sedikit auksin dalam media akan memberikan hasil yang maksimal. Hasil ini sama dengan yang diperoleh Fu et al. (2008) yang hanya menggunakan BAP dan NAA untuk diferensiasi menjadi
tunas. Penggunaan 2,4-Datau TDZ pada kalus hasil kultur antera Dianthus chinensis akan menghambat diferensiasi kalus menjadi tunas.
Analisis ploidi
Analisis ploidi menggunakan flow cytometer merupakan metode yang sesuai apabila analisis ploidi dengan penghitungan kromosom sulit dilakukan. Pada penelitian ini masing-masing regeneran hanya diambil satu sampel kultur untuk analisis, sehingga hasil akhir yang diperoleh belum mewakili kondisi keseluruhan yang sebenarnya. Sampai saat ini regenerasi kalus menjadi tanaman normal belum dapat diperoleh, karena kalus beregenerasi menjadi bunga prematur.
Simpulan
Hasil penelitian ini dapat disimpulkan bahwa pembentukan kalus pada kultur antera memerlukan auksin (2.4-D) yang lebih tinggi dari sitokinin, sebaliknya regenerasi kalus hasil kultur antera memerlukan sitokinin (BAP) yang lebih tinggi dari auksin.
Saran
Pada penelitian selanjutnya perlu dicari perlakuan cekaman yang mampu memecah kotak antera pada minggu ke 2 sampai ke 4 (sebelum antera mengalami degenerasi).