1
LAPORAN PRAKTIKUM ASPIRIN
I. Tujuan Praktikum
1. Melakukan sintesis aspirin dari asam salisilat dan asam asetat anhibrida 2. Menjelaskan prinsip asetilasi
II. Landasan Teoritis
Reaksi asam salisilat (asam o-hidroksibenzoat) dengan anhidrida asetat digunakan untuk menyintesis aspirin. Dalam reaksi ini, gugus hidroksil fenolik diasetilasi (dikonversi menjadi ester asetat). Asetilasi adalah penggantian atom H dari asam salisilat dengan gugus asetil dari anhidrida asetat.
Gambar II.1. Reaksi asam salisilat dengan asam asetat anhidrida
Ester dapat terbentuk salah satunya dengan cara mereaksikan alkohol dengan anhidrida asam. Dalam hal ini asam salisilat berperan sebagai alkohol karena mempunyai gugus –OH , sedangkan anhidrida asam asetat tentu saja sebagai anhidrida asam. Ester yang terbentuk adalah asam asetil salisilat (aspirin). Gugus asetil (CH3CO-) berasal dari anhidrida asam asetat, sedangkan gugus R-nya berasal
dari asam salisilat (pada gambar di atas gugus R ada di dalam kotak). Hasil samping reaksi ini adalah asam asetat.
Gambar II.2. Reaksi pembentukan asam asetil salisilat
Tetapi harus diperhatikan bahwa sebelum dipanaskan, reaksi tidak benar-benar terjadi. Reaksi baru akan berlangsung dengan baik pada suhu 50-60°C. Juga pada
2
percobaan ini baru terbentuk endapan putih (aspirin) setelah dipanaskan. Kemudian endapan tersebut dilarutkan dalam air dan disaring untuk memisahkan aspirin dari pengotornya. Tetapi tentu saja dengan penyaringan ini aspirin yang dihasilkan belum benar-benar murni.
Gambar. II.3 Reaksi pemebentukan natrium asetil salisilat
Asam asetil salisilat dapat bereaksi dengan NaHCO3 membentuk garam natrium yang larut dalam air, sedang hasil samping yang merupakan polimer, tidak larut dalam bikarbonat. Perbedaan sifat ini akan digunakan untuk pemurnian aspirin.
Sifat-Sifat Aspirin: Formula : C9H8O4 BM : 180,2 Titik didih : 140 0C Titik lebur : 138 0C – 140 0C Berat jenis : 1.40 g/cm³
Sinonim : 2-acetyloxybenzoic acid 2-(acetyloxy)benzoic acid Acetylsalicylate
acetylsalicylic acid
O-acetylsalicylic acid Kelarutan dalam air : 10 mg/mL (20°C)
Asetosal mengandung tidak kurang dari 99,5% dan tidak lebih dari 100,5% C9H8O4 dihitung terhadap zat yang telah dikeringkan
3
Asam sulfat memiliki rumus kimia H2SO4. memiliki titik leleh 10˚C. dan titik didih 290˚C. asam sulfat banyak digunakan dalam industri. Berupa cairan kental dan amat korosif. Bereaksi dengan jaringan tubuh. Bereaksi hebat dengan air dan mengeluarka panas, bereaksi pula dengan logam, kayu, pakaian dan zat organik. Pada sintesis aspirin asam sulfat berfungsi sebagai katalis yang mempercepat proses reaksi. Kegunaan dari aspirin:
sebagai analgesik (obat yang dapat mengurangi atau menghilangkan rasa nyeri dan akhirnya akan memberikan rasa nyaman pada orang yang menderita) sebagai antipirentik (obat yang dapat menurunkan demam (suhu tubuh yang
tinggi)
sebagai antiinflamasi
III. Alat dan Bahan Alat a. Waterbath b. Timbangan c. Gelas ukur d. Beker Glass e. Glass arloji f. Pengaduk kaca g. Statif dan Klem h. Saringan Penghisap i. Termometer
j. Pipet Ukur k. Kertas saring l. Oven
4 Bahan
a. Asam Salisilat (3 gram)
b. Asam asetat anhidrida (8 ml) c. Asam sulfat pekat (5 tetes)
d. Akuades (100 ml)
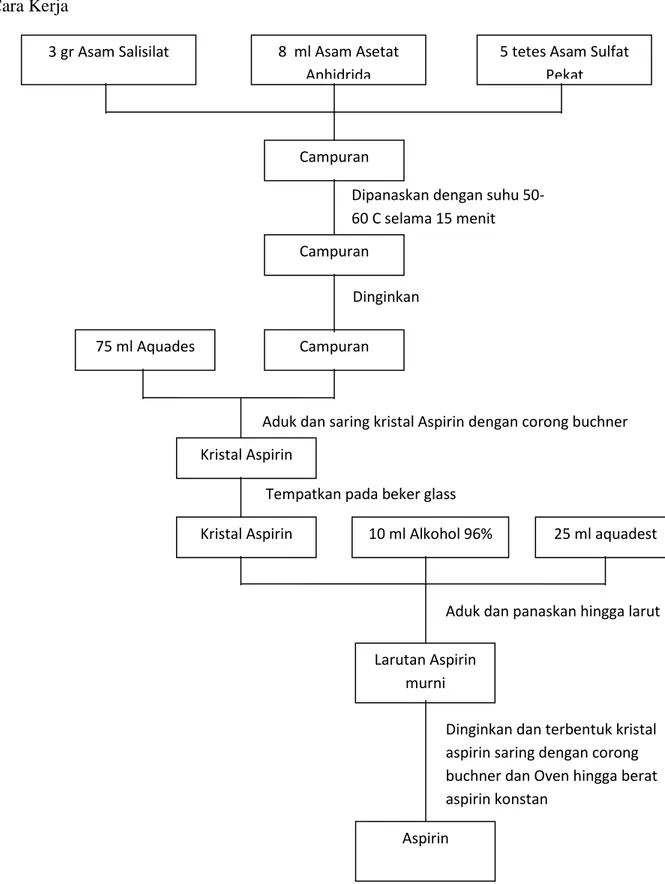
5 IV. Cara Kerja
Gambar IV.1. Skema Kerja Pembuatan Aspirin 3 gr Asam Salisilat 8 ml Asam Asetat
Anhidrida
5 tetes Asam Sulfat Pekat
Campuran
Campuran Campuran
Dipanaskan dengan suhu 50-60 C selama 15 menit
Dinginkan 75 ml Aquades
Kristal Aspirin
Aduk dan saring kristal Aspirin dengan corong buchner
Kristal Aspirin 10 ml Alkohol 96% 25 ml aquadest Tempatkan pada beker glass
Aduk dan panaskan hingga larut Larutan Aspirin
murni
Dinginkan dan terbentuk kristal aspirin saring dengan corong buchner dan Oven hingga berat aspirin konstan
6 V. Data pengamatan
NO Perlakuan Pengamatan
1 3 gr asam salisilat + 8 ml asam asetat anhibrida (+) 5 tetes asam sulfat pekat
- cairan jernih
- endapan putih, putih keruh
2 Campuran dipanaskan dengan suhu 50-60oC selama 15 menit
Cairan putih keruh
3 Didinginkan dan ditambah 75 ml aquadest Terdapat endapan putih
4 Saring dengan corong Buchner Kristal aspirin kotor
5 Kristal aspirin kotor ditambah dengan 10 ml alkohol 96% dan 25 ml aquadest, dan panaskan hingga larut
Kristal aspirin kotor
6 Saring dengan corong buchner Kristal aspirin murni
7 Dioven hingga berat aspirin konstan Kristal Aspiin murni Berat 1 : 4,15 gram Berat 2 : 2,37 gram Berat 3 : 2,37 gram Gambar V.I. Data Pengamatan
VI. Analisis Data dan Pembahasan 1. Analisis Data
Perhitungan aspirin teoritis
Diket : gram asam salisilat = 3 gram BM asam salisilat = 138,12 BM Aspirin = 180,2 Dit : berat teoritis aspirin
Jawab :
Mol aspirin = Mol asam salisilat Mol asam salisilat
Berat Aspirin Teoritis = Mol Aspirin x BM Aspirin = 0,021 mol x 180,2
= 3,91 gram
Asam Salisilat + Asam asetat anhidrida Aspirin + Asam asetat M
R
0,021 mol
0,021 mol 0,021 mol 0,021 mol 0,021 mol
7
Perhitungan Rendemen aspirin yang dihasilkan : 2. Pembahasan
Dasar dari pembuatan aspirin adalah asetilasi antara asam salisilat dengan asam asetat anhidrida. Penggunaan asam asetat anhidrida bertujuan agar reaksi yang terjadi lebih maksimal dan irreversibal, sehingga aspirin yang dapat juga maksimal.
pada praktikum pembuatan aspirin, langkah pertama adalah melarutkan 3 gram asam salisilat pada 8 ml asam asetat anhidrida, larutan yang di dapat berwarna putih keruh. Kemudian larutan ditetesi dengan asam sulfat pekat sebagai katalis dalam reaksi asetilasi. Penghidrasi juga untuk menghindari terjadinya air kristal pada akhir raksi. Larutan yang telah ditambah asam sulfat pekat dipanaskan pada waterbath selama 15 menit pada suhu 50-60˚C kemudian di dinginkan sambil diaduk sesekali. Langksah selanjutnya adalah penambahan 75ml akuades sambil diaduk, pada tahap ini kristal aspirin mulai terbentuk. Selanjutnya krista aspirin kotor dipisahkan dengan cairannya dengan menggunakan corong buchner.
Pemurnian aspirin dilakukan dengan cara menambahkan 10ml alkohol96% dan 25 ml akuades pada kristal aspirin kotor. Pada tahap ini telah terbentuk kristal aspirin murni. Kristal aspirin murni dipisahkan dari cairannya menggunakan corong buchner. Tahap terakhir adalah pengovenan kristal aspirin murni agar didapat massa yang konstan dengan suhu 100-110˚C karena aspirin meleleh pada suhu 140˚C.
Rendemen aspirin tidak 100% dikarenakan faktor teknis yaitu ketidaksempurnaan pada waktu penyaringan sehingga aspirin masih tertinggal pada kertas saring, dan faktor non-teknis yaitu pada saat rekristalisasi dengan air dan alkohol 96% di lakukan pada waktu yang lama sehingga kristal aspirin murni yang terbentuk dapat lebih banyak.
8 VII. Kesimpulan dan Saran
1. Kesimpulan
a. Berat Aspirin secara teoritis adalah 3,91 gram
b. Berat aspirin yang didapat dari praktikum adalah 2,37 gram c. % rendemen adalah 60,61%
2. Saran
a. berhati-hatilah dengan bahan yang digunakan terutama asam sulfat pekat yang merupakan asam kuat
b. Pembagian tugas saat praktikum mutlak diperlukan agar lebih efektif dan efisien terhadap waktu.
VIII. Daftar Pustaka
Anwar, C., Purwono, B., Pranowo, H.D Wahyuningsih, T.D., 1994. Pengantar Praktikum Kimia Organik, FMIPA UGM Yogyakarta
Pavia, D.L., Lampman, G.M., Kriz G.S., 1976, Introduction to Organic Laboratory Technique, Washington: WB Savaders Company
Suminar,S.A., 2003, Kimia Organik: suatu kuliah singkat, Ed.11 Jakarta: Erlangga Tim Dosen Pembimbing , 2003, Buku Petunjuk Praktikum Kimia Organik Preparatif-Kuantitatif, Laboratorium Kimia Organik, Jurusan Teknik Kimia Fakultas Teknik, Undip, Semarang
Tim Dosen Praktikum Kimia Organik, 2007, Petunjuk Praktikum Kimia Organik II, Labolatorium Kimia Organik, Jurusan Kimia FMIPA UNNES
Anonim, 2003, Encyclopedia Aspirin,
http://www.statemaster.com/encyclopedia/Aspirin, (diakses tanggal 5 mei 20010 ). Kusuma, Ersanghono, 2003, Sintesis Organik, Jurusan Kimia FMIPA UNNES : Semarang.
9 Mengetahui
Dosen Praktikum