LAPORAN PRAKTIKUM PTK III
PEMBUATAN ACETANILIDE
DISUSUN OLEH
NAMA : KHAIRUN NISA
NIM : 1513064
TEKNIK KIMIA POLIMER
POLITEKNIK STMI JAKARTA
d.h. SEKOLAH TINGGI MANAJEMEN INDUSTRI
ACETANILIDE
A. Prinsip Percobaan
Reaksi asetilasi yaitu proses penggantian atom H pada pada NH2 dengan
gugus asetil yang berasal dari senyawa anhidrida asam asetat.
B. Reaksi
C6H5NH2 + (CH3CO)2O → C6H5NHCOCH3 + CH3COOH
C. Maksud dan Tujuan 1. Secara Umum
a. Mempelajari pembuatan acetanilide
b. Mengetahui sifat-sifat dan kegunaan dari acetanilide
2. Secara Khusus
a. Untuk mengetahui cara pembuatan acetanilide dari anhidrida asam dan
aniline
b. Untuk mengetahui proses kristalisasi dan herkristalisasi
c. Untuk mengetahui sifat fisika dan kimia dari acetalnilide
D. Teori
Asetanilida merupakan senyawa turunan asetil amina aromatis yang
digolongkan sebagai amida primer, dimana satu atom hidrogen pada anilin
digantikan dengan satu gugus asetil. Asetanilida dapat diperoleh dari asetilasi
anilin. Amina aromatis primer dapat bereaksi dengan anhidrida asetat
membentuk larutan monoasetil. Bila pemanasan selama reaksi diperpanjang
dan kelebihan anhidrida asetat, maka akan menghasilkan bentuk / turunan
diasetil. Umumnya bentuk diasetil tidak stabil dalam air dan mengalami
hidrolisis menjadi bentuk monoasetil.
Asetanilida dapat dibuat dari anilin dan anhidrida asetat. Mekanisme
reaksinya menyangkut serangan nukleofil oleh anilin pada karbon karbonil
dari suatu turunan asam. Anilin adalah benzena tersubstitusi yang bereaksi
lebih mudah daripada benzenanya sendiri. Jadi anilin bereaksi substitusi
mempunyai gugus NH2 yang merupakan gugus aktivasi. Adanya gugus ini
menyebabkan cincin lebih terbuka terhadap subsitusi lebih lanjut. Sedangkan
reaksi dengan nukleofil terhadap anhidrida lebih reaktif.
1. Bahan Baku Utama a. Aniline (C6H5NH2)
Aniline merupakan senyawa turunan benzene yang dihasilkan
dari reduksi nitrobenzene berupa cairan jernih dengan rumus molekul
C6H5NH2, berat molekul 93,12 g/mol, titik didih normal: 184,4 oC.
Sifat kimia dari anilin yaitu Halogenasi senyawa anilin dengan brom
dalam larutan sangat encer menghasilkan endapan 2, 4, 6 tribromo
anilin. Anilin memiliki rumus molekul C6H5NH2 dengan rumus
bangun:
Proses pembuatan anilin dapat dilakukan melalui berbagai
macam proses antara lain:
1) Aminasi Chlorobenzen
Pada proses aminasi chlorobenzen menggunakan zat pereaksi
amoniak cair, dalam fasa cair dengan katalis Tembaga Oxide
dipanaskan akan menghasilkan 85 - 90 % anilin. Sedangkan katalis
yang aktif untuk reaksi ini adalah Tembaga Khlorid yang terbentuk
dari hasil reaksi samping ammonium khlorid dengan Tembaga
Oxide. Mula - mula amoniak cair dimasukkan ke dalam mixer dan
pada saat bersamaan chlorobenzen dimasukkan pula, tekanan di
dalam mixer adalah 200 atm. Dari mixer campuran chlorobenzen
dengan amoniak dilewatkan ke preheater kemudian masuk ke
reaktor dengan suhu reaksi 235 °C dan tekanan 200 atm. Pada
reaksi ini ammonia cair yang digunakan adalah berlebihan. Dengan
menggunakan katalis tertentu, reaksi yang terjadi adalah sebagai
C6H5Cl + 2 NH3 C6H5NH2+ NH4Cl
Pada proses aminasi chlorobenzen, hasil yang diperoleh
berupa nitro anilin dengan yield yang dihasilkan adalah 96%.
2) Reduksi Nitrobenzen
Aniline dapat dibuat dengan cara mereduksi Nitrobenzene
dengan campuran Fe dan HCl, menurut reaksi sebagai berikut :
+ 6H+ Fe + HCl + 2H2O
Sifat Fisis Anilin
1) Berat molekul 93,128 g/mol
2) Temperatur kritis 699 K
3) Tekanan kritis 53,09 bar
4) Volume kritis 270 cm3/mol
5) Titik lebur 267,13 K
6) Titik didih 457,6 K
7) Panas penguapan 41,84 kJ/mol
8) Speciific gravity 60 F 1,023553
9) Berupa zat cair seperti minyak
10)Sukar larut dalam air
11)Indeks bias 1.58
Sifat Kimia Anilin
1) Larut pada pelarut organik dengan baik, larut pada air dengan
tingkat kelarutan 3,5 % pada 25 C
2) Anilin adalah basa lemah (Kb = 3,8 x 10^ -10)
3) Halogenasi senyawa anilin dengan brom dalam larutan sangat
encer menghasilkan endapan 2, 4, 6 tribromo anilin.
NO2
nitrobenzene
NH2
4) Pemanasan anilin hipoklorid dengan senyawa anilin sedikit
berlebih pada tekanan sampai 6 atm menghasilkan senyawa
diphenilamine.
5) Hidrogenasi katalitik pada fase cair pada suhu 135 – 170oC dan tekanan 50 – 500 atm menghasilkan 80% cyclohexamine (C6H11NH2). Sedangkan hidrogenasi anilin pada fase uap dengan
menggunakan katalis nikel menghasilkan 95% cyclohexamine.
6) Nitrasi anilin dengan asam nitrat pada sushu -20oC menghasilkan
mononitroanilin, dan nitrasi anilin dengan nitrogen oksida cair
pada suhu 0oC menghasilkan 2, 4 dinitrophenol.
Kegunaan Anilin
1) Bahan bakar roket.
2) Pembuatan zat warna diazo.
3) Obat-obatan
4) Bahan peledak
5) Sebagai bahan plastic
6) Sebagai bahan pembuat cat
b. Anhidrida asam asetat
Anhidrida asam asetat, adalah salah satu anhidrida asam paling
sederhana. Rumus kimianya adalah (CH3CO)2O. Anhidrida asetat
merupakan senyawa yang tidak berwarna, berbentuk
cair. Massa jenisnya 1,081 gram/mL; titik lebur -73ºC ; titik
didih 140 ºC; berat molekul 102,09 gram/mol. B i l a dilarutkan
dalam air akan langsung bereaksi membentuk asam asetat, dan sangat
larut dalam alkohol dan eter. Merupakan asam yang kuat,
sehingga uapnya menyebabkan iri tasi pada mata apabila
terhirup akan menyebabkan iritasi pada saluran pernafasan. Mudah
terbakar pada Flash pt. –54ºC . Senyawa ini tidak berwarna dan berbau cuka karena reaksinya dengan kelembapan di udara membentuk asam
asetat.Selain itu, anhidrida asetat juga dihasilkan melalui reaksi asetil
klorida dengan natrium asetat.
Anhidrida asetat dihasilkan melalui reaksi kondensasi asam
asetat, sesuai persamaan reaksi
25% asam asetat dunia digunakan untuk proses ini. Selain itu,
anhidrida asetat juga dihasilkan melalui reaksi asetil
klorida dengan natrium asetat.
Sifat Fisis Anhidrida Asam Asetat
1) Cairan tidak berwarna (bening)
2) Mudah menguap
3) Berat jenis : 1,08 gr/Ml
4) Memiliki titik didih : 139,6oC
5) Memiliki titik leleh : -73oC
6) Memiliki bau yang khas
Sifat Kimia Anhidrida Asam Asetat
1) Mudah larut dalam air
2) Hidrolisis anhidrida asam asetat menghasilkan asam karboksilat
CH3CO)2O + H2O → CH3COOH + CH3COOH 3) Bereaksi dengan alcohol dan fenol membentuk ester
(CH3CO)2O + CH3OH → (CH3)2CO + CH3COOH (CH3CO)2O + OH → C6H5COOCH3 + CH3COOH
Kegunaan Anhidrida Asam Asetat
1) Sebagai pelarut
2) Untuk membuat selulose asetat
3) Untuk membuat berbagai macam ester dan zat warna
2. Bahan Tambahan
a. Benzene (sebagai katalis)
Benzena merupakan senyawa aromatis yang paling sederhana.
Rumus umun benzene adalah C6H6.
Sifat Fisik Benzena
1) Zat cair tidak berwarna
2) Memiliki bau yang khas
3) Mudah menguap
4) Tidak larut dalam pelarut polar seperti air air, tetapi larut dalam
pelarut organikseperti eter dan tetraklorometana
5) Titik Leleh : 5,5 derajat Celsius
6) Titik didih : 80,1derajat Celsius
7) Densitas : 0,837
Sifat Kimia Benzena
1) Bersifat kasinogenik (racun)
2) Merupakan senyawa nonpolar
3) Tidak begitu reaktif, tapi mudah terbakar dengan menghasilkan
banyak jelaga
4) Lebih mudah mengalami reaksi substitusi dari pada adisi.
(untuk mengetahui beberapa reaksi subtitusi pada benzene)
5) Sukar Mengalami Adisi
Benzena bila direaksikan dengan gas hidrogen akan
mengalami reaksi adisi tetapi reaksi akan berjalan lambat walaupun
dilakukan pada suhu tinggi dan katalis Ni.
H2
C
H2 – C C –H2 + 3 H2
Ni
H2 – C C – H2 C
6) Mudah Tersubtitusi
a) Halogenasi : C6H6 + Cl2 C6H5C l + HCl
b) Akilasi dengan katalis FeCl3 : C6H6 + R-Cl C6H5R +
HCl
c) Nitrasi : C6H6 + HNO3 H2SO4 C6H5NO2 + H2O
d) Asilasi: C6H6 + CH3 C Cl AlCl3 C6H5COCH3 + HCl
O 80C
Kegunaan Benzena
1) Benzena digunakan sebagai pelarut.
2) Benzena juga digunakan sebagai prekursor dalam pembuatan obat,
plastik, karet buatan dan pewarna.
3) Benzena digunakan untuk menaikkan angka oktana bensin.
4) Benzena digunakan sebagai pelarut untuk berbagai jenis zat. Selain
itu benzena juga digunakan sebagai bahan dasar membuat stirena
(bahan membuat sejenis karet sintetis) dan nilon–66.
3. Produk
Acetanilide merupakan senyawa turunan asetil amina aromatis yang
digolongkan sebagai amida primer, dimana satu atom hidrogen pada anilin
digantikan dengan satu gugus asetil. Asetinilida berbentuk butiran
berwarna putih tidak larut dalam minyak parafin dan larut dalam air
dengan bantuan kloral anhidrat.
Acetanilide atau sering disebut phenilasetamida mempunyai rumus
molekul C6H5NHCOCH3 dan berat molekul 135,16. Acetalnilide didapat
dari reaksi antara aniline dengan anhidrida asam asetat kemudian
dikristalisasi lalu diherkristalisasi. Acetalnilide merupakan senyawa yang
mempunyai rumus molekul C6H9NO yang digunakan pada pembuatan zat
celup.
Acetalnilide mempuyai rumus bangun :
NH C CH3
Sifat Fisik Acetanilide
a. Rumus molekul : C6H5NHCOCH3
b. Berat molekul : 135,16 g/gmol
c. Titik didih normal : 305 oC
d. Titik leleh : 114,16 oC
e. Berat jenis : 1,21 gr/ml
f. Suhu kritis : 843,5oC
g. Titik beku : 114 oC
h. Wujud : padat
i. Warna : putih
j. Bentuk : butiran / Kristal
Sifat Kimia Acetanilide
a. Larut dalam pelarut organic
b. Mudah menguap
c. Pirolysis dari asetanilida menghasilkan N-diphenil urea, anilin,
benzena dan hydrocyanic acid.
d. Asetanilida merupakan bahan ringan yang stabil dibawah kondisi
biasa, hydrolisa dengan alkali cair atau dengan larutan asam mineral
cair dalam kedaan panas akan kembali ke bentuk semula.
e. Adisi sodium dalam larutan panas Asetanilida didalam xilena
menghasilkan N-Sodium derivative.
C6H5NHCOCH3 + HOH C6H5NH2 + CH3COOH
f. Bila dipanaskan dengan phospor pentasulfida menghasilka Thio
Asetanilida ( C6H5NHC5CH3 ).
g. Bila di treatmen dengan HCl, Asetanilida dalam larutan asam asetat
menghasilkan 2 garam ( 2 C6H5NHCOCH3 ).
h. Dalam larutan yang memgandung pottasium bicarbonat menghasilkan
N- bromo asetanilida.
i. Nitrasi asetanilida dalam larutan asam asetat menghasilkan p-nitro
Kegunaan Produk Acetalnilide
a. Sebagai bahan baku pembuatan obat – obatan b. Sebagai zat awal penbuatan penicilium
c. Bahan pembantu dalam industri cat dan karet
d. Bahan intermediet pada sulfon dan asetilklorida
e. Sebagai penstabil peroksida
4. Metode Proses
a. Pembuatan asetanilida dari asam asetat anhidrid dan aniline
Larutan benzen dalam satu bagian anilin dan 1,4 bagian asam
asetat anhidrat direfluks dalam sebuah kolom yang dilengkapi dengan
pelindung sampai tidak ada anilin yang tersisa.
2 C6H5NH2 + ( CH2CO )2O → 2C6H5NHCOCH3 + H2O
Campuran reaksi disaring, kemudian kristal dipisahkan dari air
panasnya dengan pendinginan, sedangkan filtratnya direcycle kembali.
Pemakaian asam asetatanhidrad dapat diganti dengan asetil klorida.
b. Pembuatan asetanilida dari asam asetat dan anilin
Metode ini merupakan metode awal yang masih digunakan
karena lebih ekonomis. Anilin dan asam asetat berlebih 100 %
direaksikan dalam sebuah tangki yang dilengkapi dengan pengaduk.
C6H5NH2 + CH3COOH → C6H5NHCOCH3 + H2O Reaksi berlangsung selama 6 jam pada suhu 150oC – 160oC. Produk dalam keadaan panas dikristalisasi dengan menggunakan
kristalizer.
c. Pembuatan asetanilida dari ketene dan anilin
Ketene ( gas ) dicampur kedalam anilin di bawah kondisi yang
diperkenankan akan menghasilkan asetanilida.
C6H5NH2 + H2C=C=O C6H5NHCOCH3
d. Pembuatan asetanilida dari asam thioasetat dan aniline
Asam thioasetat direaksikan dengan anilin dalam keadaan dingin
akan menghasilkan asetanilida dengan membebaskan H2S.
5. Operasi Pemisahan Pada Pembuatan Acetanilide
Pada pembuatan acetanilide operasi pemisahan dilakukan dengan
kristalisasi. Kristalisasi adalah proses pemisahan zat dari campurannya
berdasarkan pembentukan bahan padat (kristal). Kristal adalah bahan padat
dengan susunan molekul tersebut.
a. Mekanisme Pembentukkan Kristal
1) Pembentukan Inti
Inti kristal adalah partikel-partikel kecil bahkan sangat kecil
yang dapat terbentuk secara cara memperkecil kristal-kristal yang
ada dalam alat kristalisasi atau dengan menambahkan benih kristal
ke dalam larutan lewat jenuh.
2) Pertumbuhan Kristal
Pertumbuhan kristal merupakan gabungan dari dua proses yaitu :
a) Transportasi molekul-molekul atau (ion-ion dari bahan yang
akan di kristalisasikan) dalam larutan kepermukaan kristal
dengan cara difusi. Proses ini berlangsung semakin cepat jika
derajat lewat jenuh dalam larutan semakin besar.
b) Penempatan molekul-molekul atau ion-ion pada kisi kristal.
Semakin luas total permukaan kristal, semakin banyak bahan
yang di tempatkan pada kisi kristal persatuan waktu.
b. Syarat-syarat Kristalisasi
1) Larutan harus jenuh
Larutan yang mengandung jumlah zat berlarut berlebihan
pada suhu tertentu, sehingga kelebihan itu tidak melarut lagi. Jenuh
berarti pelarut telah seimbang zat terlarut atau jika larutan tidak
dapat lagi melarutkan zat terlarut, artinya konsentrasinya telah
maksimal kalau larutan jenuh suatu zat padat didinginkan
perlahan-lahan, sebagian zat terlarut akan mengkristal, dalam arti diperoleh
2) Larutan harus homogeny
Partikel-partikel yang sangat kecil tetap tersebar merata
biarpun didiamkan dalam waktu lama.
3) Adanya perubahan suhu
Penurunan suhu secara dratis atau kenaikan suhu secara dratis
tergantung dari bentuk kristal yang didinginkan.
c. Metode-metode Kristalisasi
1) Pendinginan
Untuk bahan-bahan yang kelarutannya berkurang dratis
dengan menurunnya temperatur, kondisi lewat jenuh dapat dicapai
dengan pendinginan larutan panas yang jenuh.
2) Pemanasan
Untuk bahan-bahan yang kelarutannya berkurang sedikit
dengan menurunnya suhu. Kondisi lewat jenuh dapat dicapai
dengan penguapan sebagian pelarut.
3) Pemanasan dan Pendinginan
Metode ini merupakan gabunga dari dua metode diatas.
Larutan panas yang Jenuh dialirkan kedalam sebuah ruangan yang
divakumkan. Sebagian pelarut menguap, panas penguapan diambil
dari larutan itu sendiri, sehingga larutan menjadi dingin dan lewat
jenuh. Metode ini disebut kristalisasi vakum.
4) Penambahan bahan (zat) lain.
Untuk pemisahan bahan organic dari larutan seringkali
ditambahkan suatu garam. Garam ini larut lebih baik daripada
bahan padat yang dinginkan sehinga terjadi desakan dan membuat
baha padat menjadi terkristalisasi.
d. Proses Kristalisasi Pada Pembekuan (Fase Cair-Padat)
1) Dalam keadaan cair atom-atom tidak memiliki susunan teratur dan
selalu mudah bergerak, temperaturnya relative lebih tinggi dan
2) Dengan turunnya temperatur maka energi atom aka semakin
rendah, makin sulit bergerak dan mulai mengatur kedudukannya
relatif terhadap atom lain, mulai membentuk inti kristal pada
tempat yang relative leih tinggi.
3) Inti akan menjadi pusat kristalisasi, dengan makin turun
temperature makin banyak atom yang ikut bergabung dengan inti
yang sudah ada atau membentuk inti baru.
e. Ukuran Kristal
Ukuran kristal tergantung dari kecepatan pembentukkan inti
kristal (partikel kristal yang amat kecil, yang terbentuk secara spontan
akibat dari keadaan larutan yang lewat jenuh) dan pertumbuhan kristal,
artinya tergantung pada kondisi kristalisasi.
f. Herkristalisasi
Herkristalisasi adalah pemurnian suatu zat padat dari
campuran/pengotornya dengan cara mengkristalkan kembali zat
tersebut setelah dilarutkan dalam pelarut yang cocok. Prinsip
herkristalisasi adalah perbedaan kelarutan antara zat yang akan
dimurnikan dengan kelarutan zat pencampur/pencemarnya. Larutan
yang terjadi dipisahkan satu sama lain, kemudian larutan zat yang
diinginkan dikristalkan dengan cara menjenuhkannya.
g. Langkah-langkah Kristalisasi
1) Larutan sample zat padat dilarutkan dalam pelarut panas.
2) Bubuhkan sedikit norit.
3) Larutan tersebut dijenuhkan kembali.
4) Saring kembali dengan pemanas air.
5) Didinginkan larutan tersebut hingga es mencair.
h. Prinsip Kristalisasi dapat dianalisa melalui sudut pandang yaitu:
1) Kemurnian hasil
Sebagian besar cairan induk yan terkandung terpisah
(dipisahkan) dari kristal dengan cara filtrasi dan sentry fungsi,
sedang sisanya dikeluarkan dengan mencucinya dengan pelarut
encer. Efekifitas langkah pemurnian tergantung pada ukuran dan
keseragaman kristal.
2) Perolehan
Pada kebanyakan proses kristalisasi , kristal dan cairan induk
berada pada waktu yang cukup lama sehingga mencapai
keseimbangan, dan cairan induk itu jenuh pada suhu akhir proses
itu. Perolehan dari proses itu dapat dihitung dari konsentrasi
larutan awal dan kelarutan pada suhu akhir. Selama proses itu
terjadi penguapan yang cukp besar, kuantitasnya harus diketahui
atau dapat diperkirakan, oleh karena kuantitas yang terakhir ini
tetap berada dalam fase zat cair selama berlangsungnya kristalisasi.
3) Laju nukleasi
Adalah banyaknya partikel baru yang terbentuk persatuan
waktu persatuan volume magma atau larutan induk bebas zat padat.
Nukleasi digolongkan menjadi 3 kelompok yaitu nukleasi palsu,
nukleasi primer, dan nukleasi sekunder.
4) Laju pertumbuhan
Adalah suatu proses difusi, yang dimofikasi oleh pengaruh
permukaan padat pada tempat pertumbuhan itu berlangsung.
Molekul-molekul atau ion-ion zat terlarut mencapai muka kristal
yang tumbuh itu dengan cara difusi melalui fase zat cair.
6. Kelebihan dan Kekurangan Metode Proses a. Kelebihan
1) Reaksinya sederhana
2) Proses reaksi berlangsung cepat karena menggunakan katalis yaitu
b. Kekurangan
1) Hasil yang didapat atau bubuk acetalnilide yang didapatkan dari
praktikum lebih sedikit
2) Biayanya lebih mahal karena menggunakan katalis
7. Diagram Alir Proses
E. Alat dan Bahan 1. Alat
a. Statif h. Pemanas listrik (hitter)
b. Labu didih i. Klem
c. Thermometer j. Cooler
d. Selang k. Saringan pemanas
e. Corong l. Bunzen
f. Beaker glass m. Spatel
g. Pengaduk n. Erlenmeyer
Bahan
a. Aniline (sebagai bahan baku)
c. Anhidrida asam asetat (sebagai bahan baku)
d. Es batu
F. Prosedur
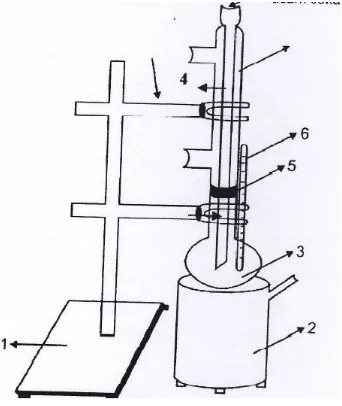
1. 5 gram anilin dicampurkan dengan 20cm3 benzene.
2. Campuran dimasukkan ke dalam labu alas bulat yang memiliki pendingin
tegak.
3. Campuran dalam labu alas bulat dipanaskan di atas pemanas listrik sampai
mendidih.
4. Larutan anhidrida asam asetat sebanyak 6 gram dimasukkan ke dalam
cairan yang mendidih sedikit demi sedikit melalui dinding pendingin.
5. Reaksi eksoterm, maka akan terlihat mendidih lebih keras.
6. Jika cairan mendidih terlalu keras, sebaiknya pemanasan dikurangi.
7. Campuran dipanaskan kembali selama 30 menit setelah anhidrida asam
asetat telah dibubuhkan semua.
8. Cairan yang masih panas dituangkan ke dalam beaker glass yang berisi es
batu.
9. Kristal yang terbentuk diherkristalisasi dengan karbon aktif.
10.Dihitung rendemen teoritis dari hasil yang didapatkan
G. Rangkaian Alat
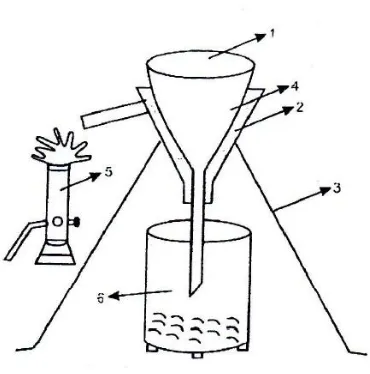
Gambar : Penyaringan dan saringan pemanas
H. Data Pengamatan 1. Anilin
m = 5 gram
ρ = 1.02 gr/ml
v = ρ =
= 4,90 ml
n =
=
= 0,054 mol
2. Anhidrida Asam Asetat
m = 6 gram
ρ = 1.08 gr/ml
v = ρ =
= 5,55 ml
n =
=
= 0,059 mol
3. Benzena
4. Reaksi pembentukan acetanilide
C6H5NH2 + (CH3CO)2O → C6H5NHCOCH3 + CH3COOH M 0,054 0,059
R 0.054 0.054 0.054 0,054
S -- 0,005 0,054 → mol teoritis
Mol Acetanilide teoritis = 0.054 x Mr
= 0.054 x 135 gr/mol
= 7.29 gram
P = (Berat cawan+berat kertas saring+kristal acetanilide) - (berat cawan
kosong+berat kertas saring)
= 110,93 gr – 106,805 gr = 4,125 gr
Mol Acetanilide randemen =
× 100%
=
× 100%
= 56,58%
I. Pembahasan
Asetilasi didalam praktikum ini merupakan proses substitusi gugs
atom H dan NH2 pada anilin dengan gugus asetil yang berasal dari gugus
anhibrida.bahan baku yang digunakan adalah aniline (sebagai katalis tipe
homogen karena fasenya sama-sama cair yang memberikan reaksi
alternatif untuk mendapatkan jalan reaksi dengan energi aktivasi yang
lebih rendah).
Sintesis asetanilida dilakukan dengan mencampurkan 5gr/5ml
aniline, 6 gr / 5,55 ml asetat anhidrida, 20 ml benzene kedalam labu alas
bulat 500 ml yang dilengkapi dengan pendingin.
Proses selanjutnya yaitu campuran tersebut direfluks selama 30
karena adanya proses pemanasan,pemanasan akan meningkatkan suhu
dalam sistem sehingga tumbukan antara molekul akan lebih banyak dan
cepat yang menyebabkan reaksi berlangsung cepat. Fungsi yang kedua
yaitu untuk menyempurnakan reaksi. Pada saat pelarut yang digunakan
mulai menguap maka konsentrasi larutan dalam labu akan meningkat.
Setelah proses refluks selesai tuangkan larutan sambil diaduk secara
cepat kedalam beaker glass yang berisi es agar diperoleh kristal
asetanilida. Tujuan pendinginan dengan air ini agar diperoleh padatan
kristal asetanilida. Pada proses ini diperoleh kristal berwarna
kekuning-kuningan yang mengindikasikan adanya pengotor didalamnya, yaitu sisa
reaktan ataupun hasil samping reaksi.asetanilida yang telah larut kemudian
ditambahkan karbon aktif. Kemudian larutan dijenuhkan dengan cara
dipanaskan diatas pemanas kaki tiga. Larutan ini dijenuhkan agar
memenuhi syarat kristalisasi.lalu setelah jenuh larutan dipisahkan pada
saat penyaringan panas menggunakan corong yang telah dipanaskan dan
dilengkapi kertas saring.
Rekristalisasi dilakukan untuk memurnikan zat yang telah
didapatkan dimana asetanilida yang diperoleh masih mengandung
pengotor. Pada proses rekristalisasi kelarutan pengotor lebih kecil daripada
senyawa yang dimurnikan sehinnga pengotor dapat dipisahkan dengan
kertas saring pada penyaring panas. Penyaringan dilakukan pada kondisi
panas agar produk hasil sintestis yang berupa kristal tidak ikut tersaring
karena larut pada suhu tersebut sehingga hanya tersisa pengotor pada
kertas saring. Filtrat yang diperoleh kemudian didinginkan dengan
pelan-pelan dan dimasukan kedalam beaker glass berisi es. Bila selama
pendinginan selama 25 menit tidak muncul kristal, maka gores-goreskan
dinding erlenmeyer untuk merangsang terbentuknya kristal.
Kristal yang terlah terbentuk disaring menggunakan corong gelas
dilengkapi kertas saring. Kristal yang diperoleh selanjutnya dikeringkan
dengan oven pada suhu 1000C selama 5-10 menit untuk menghilangkan
uap air yang masih terkandung dalam kristal. Kristal asetanilida yang telah
asetanilida sebesar 4,125 gram sempel yang diperoleh berupa kristal
berwarna putih salju yang menandakan asetanilida yang diperoleh murni.
J. Kesimpulan
1. Acetanilide pada praktikum ini dibuat dari reaksi antara anilin dengan
asam asetat anhidrat dan (benzene sebagai katalis). Produknya berupa
kristal yang dimurnikan dengan kristalisasi.
2. Asetilasi merupakan proses substitusi gugus atom H dari NH2 pada
aniline dengan gugus asetil yang berasal dari gugus anhibrida.
3. Pemurnian kristal asetanilid dilakukan dengan proses herkristalisasi
dan menggunakan karbon aktif atau norit sebagai pengikat kotoran.
4. Kristal asetanilid yang didapat berwarna putih agak kekuningan, hal ini
kemungkinan disebabkan oleh adanya pengotor didalam bahan baku
dan peralatan yang digunakan. Atau proses penyerapan kotoran yang
kurang sempurna pada saat herkristalisasi.
5. Penggunaan karbon aktif (norit) harus secara tepat dan dalam jumlah
yang sesuai agar dapat bekerja optimum untuk menarik zat warna dan
kotoran yang tercampur dalam larutan.
6. Pada penggunaan corong panas , corong harus dalam kondisi yang
benar-benar panas agar kotoran dan zat warna dapat disaring dengan
sempurna dan kristal tidak tertinggal di dalam corong.
7. Pemasangan dan penggunaan alat harus secara tepat agar didapat hasil
yang baik.
8. Hasil rendemen yang diperoleh adalah 56,58 % dimana dihasilkan
sebanyak 4,125 gram Kristal acetanilide secara praktis dan 7,29 gram
secara teoritis.
9. Asetanilida yang dihasilkan murni karena berwarna putih. Asetanilida
K. Tugas
1. Analisa 5 (lima) kesalahan?
a. Pada saat penambahan anhidrida asam asetat, campuran mendidih
terlalu keras.
b. Pada saat pemanasan jangan sampai terlalu jenuh, karena Kristal
asetanilide akan larut dalam keadaan panas sehingga akan berakibat
kristal yg di dapat menjadi sedikit.
c. Kristal yang didapat masih terdapat kotoran hal ini disebabkan
kurangnya penambahan norit pada saat sebelum pemanasan sehingga
kotoran-kotoran yang terkandung dalam larutan tidak terikat sempurna
oleh norit.
d. Pada saat penyaringan kristal masih banyak kristal yang tertinggal di
erlenmeyer plastik.
e. Pada saat pemanasan di oven terlalu lama sehingga banyak kristal yang
hilang.
2. Fungsi masing-masing bahan? a. Anilin
1) Bahan bakar roket.
2) Pembuatan zat warna diazo.
3) Obat-obatan
4) Bahan peledak
5) Sebagai bahan plastic
6) Sebagai bahan pembuat cat
b. Benzene
1) Benzena digunakan sebagai pelarut.
2) Benzena juga digunakan sebagai prekursor dalam pembuatan obat,
plastik, karet buatan dan pewarna.
3) Benzena digunakan untuk menaikkan angka oktana bensin.
4) Benzena digunakan sebagai pelarut untuk berbagai jenis zat. Selain
itu benzena juga digunakan sebagai bahan dasar membuat stirena
c. Anhidrida asam asetat
1) Sebagai pelarut
2) Untuk membuat selulose asetat
3) Untuk membuat berbagai macam ester dan zat warna
4) Digunakan sebagai zat pengasetilasi
3. Mekanisme reaksi pembentukan?
Mekanisme reaksi pembuatan Asetanilida disebut juga dengan reaksi
asilasi amida yang diberikan oleh Fessenden. Mula – mula anilin bereaksi dengan asam asetat membentuk suatu amida dalam keadaan transisi,
kemudian diikuti dengan reduksi H2O membentuk asetanilida.
4. Mengapa digunakan pendingin tegak? (3 alasan)
a. karena uap yang terbentuk akan mengembun kembali sehingga akan
mengalir ke labu alas bulat sehingga mengurangi konsentrasi senyawa
yang menghilang akibat pemanasan.
b. agar reaksi berjalan sempurna
c. karena untuk meminimalis senyawa yang hilang dan diperoleh hasil
yang maksimal.
5. Apa fungsi corong pemanas & corong biasa?
Untuk memisahkan campuran larutan yang memiliki kelarutan yang
berbeda. Biasanya digunakan dalam proses ekstraksi. Bedanya: corong
panas terbuat dari kaca yang tahan terhadap panas, corong biasa tidak
tahan terhadap panas.
6. Apa perbedaan asam asetat anhidrida dengan asam asetat glacial?
Asam asetat sangat berbeda dengan asetat anhidrida baik dari sifat
fisik dan kimia, namun keduanya sama-sama dari golongan karboksilat
hanya saja asetat anhidrida memiliki golongan lebih spesifik lagi yakni
Asetat anhidrida merupakan golongan anhidrida yakni mempunyai
rumus R-CO-O-CO-R’ ,pada asetat anhidrida R dan R’ adalah CH3 (metil).
7. Dapatkah asam asetat anhidrida diganti dengan asam asetat glacial?
Asam asetat anhidrida diganti dengan asam asetat glacial. Selain
dengan asam asetat anhidrida, acetanilide dapat juga didapatkan dengan
mereaksikan aniline dengan asam asetat glacial.
8. Sebutkan dan jelaskan pembuatan acetanilide dari bahan-bahan lain?
a. Pembuatan asetanilida dari asam asetat anhidrid dan aniline
Larutan benzene dalam satu bagian anilin dan 1,4 bagian asam
asetat anhidrad direfluk dalam sebuah kolom yang dilengkapi dengan
jaket sampai tidak ada anilin yang tersisa.
2 C6H5NH2 + (CH2CO)2O 2C6H5NHCOCH3 + H2O
Campuran reaksi disaring, kemudian kristal dipisahkan dari
air panasnya dengan pendinginan, sedangkan filtratnya direcycle
kembali. Pemakaian asam asetat anhidrad dapat diganti dengan asetil
klorida.
b. Pembuatan asetanilida dari asam asetat dan aniline
Metode ini merupakan metode awal yang masih digunakan
karena lebih ekonomis. Anilin dan asam asetat berlebih 100 %
direaksikan dalam sebuah tangki yang dilengkapi dengan pengaduk.
C6H5NH2 + CH3COOH C6H5NHCOCH3 + H2O
Reaksi berlangsung selama 6 jam pada suhu 150oC – 160oC. Produk dalam keadaan panas dikristalisasi dengan menggunakan
c. Pembuatan asetanilida dari ketene dan aniline
Ketene (gas) dicampur kedalam anilin di bawah kondisi yang
diperkenankan akan menghasilkan asetanilida.
C6H5NH2 + H2C=C=O C6H5NHCOCH3
d. Pembuatan asetanilida dari asam thioasetat dan aniline
Asam thioasetat direaksikan dengan anilin dalam keadaan dingin
akan menghasilkan asetanilida dengan membebaskan H2S.
C6H5NH2 + CH3COSH C6H5NHCOCH3 + H2S
L. Daftar Pustaka
Fessenden and Fessenden. 1987. Kimia Organik Jilid II, edisi IV. Jakarta;
Erlangga.
http://repository.usu.ac.id/bitstream/123456789/27003/4/Chapter%20II.pdf
http://www.academia.edu/4880656/ASETILASI_PEMBUATAN_ASETALIN
IDA
hhtp://www. Asetanilida « Kimiadotcom’s Weblog.htm
www.wikipedia.org/wiki/Acetanilide
Dr.Ir. Lienda Handojo, M.Eng. “Teknologi Kimia”. Pt.Pradnya
Paramitha,Jakarta.