BAB 2
TINJAUAN PUSTAKA
2.1 Teori Dasar Desalinasi
Air asin merupakan larutan yang mengandung beberapa jenis zat terlarut
seperti garam-garam, yang jumlahnya rata-rata 3 sampai 4,5 % (sedang air payau
dibawah 3% diatas 0,05%). Dengan desalinasi maka air tawar dipisahkan dari air
asin. Karena "desalinasi adalah proses pemisahan yang digunakan untuk
mengurangi kandungan garam terlarut dari air asin dan juga air payau hingga level
tertentu sehingga air dapat digunakan sebagai air bersih". Proses desalinasi
melibatkan tiga aliran cairan, yaitu umpan berupa air asin (misalnya air laut)
ataupun air payau, produk bersalinitas rendah, dan konsentrat bersalinitas tinggi.
Produk proses desalinasi umumnya merupakan air dengan kandungan garam
terlarut kurang dari 500 mg/l, yang dapat digunakan untuk keperluan industri,
pertanian, dan domestik (kebutuhan air yang digunakan pada tempat-tempat
hunian pribadi untuk memenuhi keperluan sehari-hari). Hasil sampingan dari
proses desalinasi adalah brine. Brine adalah larutan garam berkonsentrasi tinggi
(lebih dari 35000 mg/l garam terlarut). Metoda yang digunakan pada proses
pengolahan air ini disebut desalinasi air asin.
Terdapat beberapa cara dan metode desalinasi diantaranya yang tradisonal
adalah dengan menggunakan metode vacuum distillation. Prinsipnya yaitu dengan
memanaskan air laut untuk menghasilkan uap air, yang selanjutnya dikondensasi
untuk menghasilkan air bersih. Cara yang paling umum adalah menggunakan
metode osmosis terbalik (reverse osmosis atau RO). Osmosis terbalik dianggap
yang paling efektif dalam melakukan desalinasi dalam skala besar. Prinsip kerja
metode ini adalah dengan mendesak air laut melewati membran-membran
semi-permeabel untuk menyaring kandungan garamnya.
Proses desalinasi yang akan penulis bahas pada penelitian ini adalah solar
desalinasi sistem vakum. Sistem vakum yang dimaksud adalah sistem pembuatan
kondisi vakum pada peralatan yang digunakan untuk keperluan efisiensi seperti
penurunan titik didih, titik uap, pengembunan, pemisahan fase dan penurunan
Sistem vakum disini dimaksudkan untuk menurunkan titik penguapan sehingga
air laut menguap pada temperatur yang lebih rendah dan hasil distilasi yang
didapat lebih banyak dengan energi panas yang lebih sedikit (lebih efisien) serta
untuk menarik lebih cepat (flowrate meningkat) dari wadah air laut ke dalam sisi
ruang pemanas atau ruang evaporator sistem desalinasi.
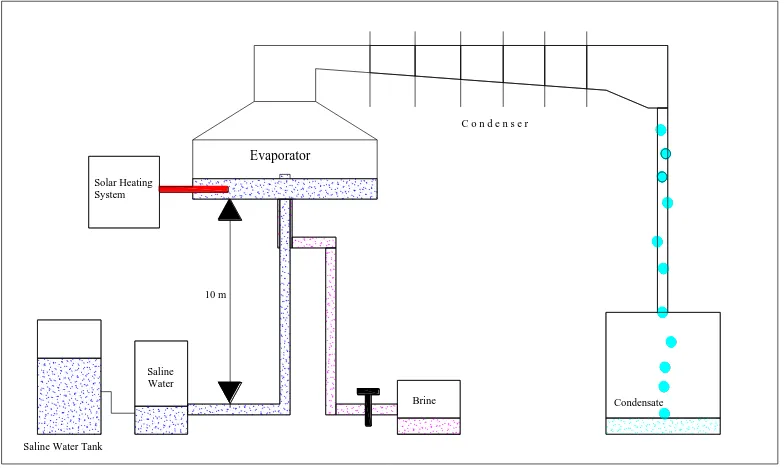
Konsep dari sistem ini adalah memanfaatkan ruang vakum yang dibentuk
secara alami untuk dapat mengevaporasikan sejumlah air laut pada tekanan yang
lebih rendah dengan suplai energi panas yang lebih sedikit dibanding dengan
teknik konvensional. Tekanan atmosfer akan sama dengan tekanan hidrostatis
yang dibentuk dengan pipa air setinggi 10 meter. Jadi, jika ketinggian pipa lebih
dari 10 meter dan ditutup dari bagian atas dengan air, dan air dibiarkan jatuh
kebawah akibat gravitasi, air akan jatuh pada ketinggian sekitar 10 meter, dan
membentuk ruang vakum diatasnya. Gambar 2.1 menunjukkan desalinasi sistem
vakum. Selain desalinasi sistem vakum, masih banyak jenis lain sistem desalinasi
bertenaga surya. (Ketut,dkk.2011)
Gambar 2.1. Desalinasi Sistem Vakum Natural
2.2 Korosi
Korosi adalah proses natural yang terjadi pada setiap logam yang dimana
logam tersebut akan cenderung kembali ke keadaan oksida-nya yang lebih stabil,
antara logam dengan lingkungannya. Atom logam yang berada di alam ditemukan
dalam bentuk mineral yang merupakan gabungan dari beberapa zat – zat kimia.
Jumlah energi yang sama untuk mendapatkan logam dari mineral dikeluarkan
kembali dalam reaksi kimiawi dalam pembentukan korosi. Korosi akan
mengembalikan logam ke keadaan mineral yang mirip atau bahkan sama dengan
keadaan ketika mineral logam ditambang, sehingga korosi sendiri juga dapat
diartikan sebagai proses kebalikan dari extractive metallurgy (J.H.Payer, W.K
Boyd, D.B. Dippold, dan W.H Fisher. Mater, P erform)
Banyak material non-logam, seperti keramik, terdiri atas logam yang
reakrivitas kimia-nya telah terpenuhi dari formasi ikatan – ikatan atom dengan ion
lain contohnya seperti ion oksida dengan silika. Oleh karena itu, material tersebut
tidak akan bereaksi dan lebih cenderung mengalami degradasi dengan faktor
kekuatan mekanikal maupun temperatur daripada korosi. Material lain seperti
polimer dan gelas, cenderung tidak mengalami reaksi kimia dengan
lingkungannya, dan istilah korosi lebih mengarah ke degradasi, namun
penggunaan polymer sebagai pelapis material logam yang kemudian mengalami
kegagalan melalui degradasi digolongkan sebagai pengaruh korosi.
Korosi dapat menyebabkan adanya retakan maupun lubang dalam suatu
permukaan logam, oleh karena korosi merupakan proses difusi yang
mempengaruhi permukaan, metode pencegahan adalah dengan menggunakan
pasivitas ataupun pelapisan yang tergantung pada kondisi lingkungan
pengoperasian sebuah sistem.
2.2.1 Proses Terjadinya Korosi
Hampir semua proses korosi logam meliputi perpindahan muatan elektron
dalam fasa aqueous. Sehingga, perlunya pembahasan tentang sifat
electrochemical untuk memahami proses terjadinya korosi.
2.2.1.1 Reaksi Elektrochemical
Berikut akan diberikan contoh korosi antara logam zinc dengan asam
klorida yang dituliskan reaksinya sebagai berikut:
Zinc akan bereaksi dengan asam klorida dan membentuk larutan zinc klorida dan
mengeluarkan hidrogen pada permukaannya, bentuk ion dari persamaan diatas
adalah sebagai berikut:
Zn + 2H+ + 2Cl- ======> Zn2+ + 2Cl- +H2 (2)
Dengan mengeliminasi Cl dari kedua sisi akan didapatkan:
Zn + 2H+ ========> Zn2+ + H2 (3)
Sehingga, reaksi korosi yang sama akan muncul pada asam klorida dan reaksi (2)
dapat dipisahkan sebagai berikut:
Zn =====> Zn2+ + 2e- reaksi anoda (3)
2H+ ======> 2e- + H2 reaksi katoda (4)
Reaksi (3) didefinisikan sebagai reaksi anoda, merupakan reaksi
oksidasi dimana elektron valensi zinc bertambah dari 0 menjadi +2. Melepaskan
elektron, e, sedangkan reaksi (4), didefinisikan sebagai reaksi katoda, adalah
reaksi reduksi dimana kondisi oksidasi hidrogen berkurang dari +1 menjadi 0,
mengabsorbsi sebuah elektron.
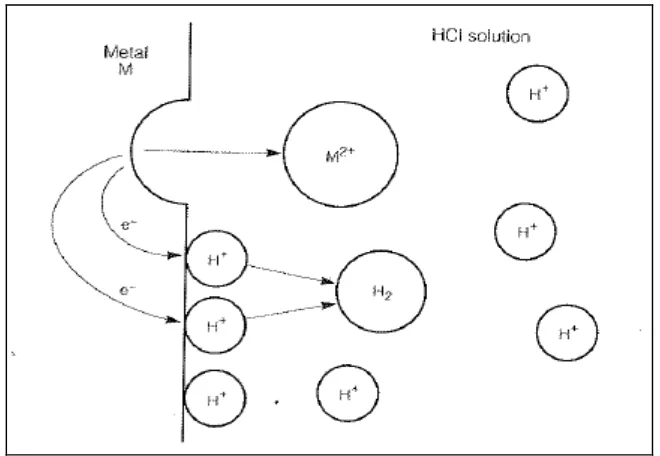
Reaksi komposit yang melibatkan pertukaran muatan atau
pertukarn elektron akan ditunjukkan pada gambar 2.2. Logam yang larut dalam
reaksi (3) akan melepaskan elektron kedalam kumpulan logam yang akan
bermigrasi ke permukaan yang kemudian bereaksi dengan H+ dalam larutan untuk
membentuk H2 dalam reaksi (4). Air diperlukan sebagai pengangkut ion seperti
Zn2+ dan H+ yang dinamakan elektrolit.
Ketika kelebihan elektron dipasok kedalam logam di gambar 2.2,
selalu menunjukkan bahwa laju korosi yang dialami oleh reaksi anoda (3) berjalan
lebih lambat daripada reaksi katoda (4). Semua reaksi korosi dalam air selalu
melibatkan reaksi anoda seperti reaksi (3) sehingga aplikasi dari potensial negatif
dari kehadiran kelebihan elektron akan selalu memperlambat laju korosi.
Pembahasan mengenai laju korosi yang merupakan pemusatan penelitian akan
Gambar 2.2 Diagram skematis dari kelarutan logam Mg (Principles and Prevention of Corrotion, 2nd ed., halaman 6)
Inilah yang menjadi basis untuk menggunakan proteksi katoda sebagai
perlindungan pada korosi jalur pipa, pengeboran minyak laut lepas, sampai pada
logam yang digunakan pada evaporator.
2.2.1.2 Polarisasi
Reaksi electrochemical seperti yang terjadi pada (3) dan (4) hanya terjadi
pada tingkatan tetap (taraf reaksi tetap). Jika elektron pada reaksi (4)
diberlakukan, maka potensial pada permukaan akan menjadi lebih negatif,
menunjukkan bahwa kelebihan elektron dengan muatan negatif berakumulasi
pada permukaan logam/larutan menunggu untuk terjadinya reaksi sebagai hasil
dari reaksi yang tidak mampu mengakomodasikan seluruh elektron. Perubahan
potensial negatif ini dinamakan sebagai polarisasi katoda, begitu pula yang terjadi
pada reaksi (3) ketika kehilangan efisiensi elektron pada logam dilepaskan pada
permukaan yang akan menghasilkan perubahan potensial positif yang dinamakan
polarisasi anoda. Ketika defisiensi menjadi lebih besar, polarisasi anoda akan
berperan sebagai gaya penggerak terjadinya korosi oleh reaksi anoda (3).
Dalam kondisi larutan elektrolit aqueous, permukaan logam akan
kecepatan dimana elektron dapat bertukar dari reaksi katoda dan anoda yang ada.
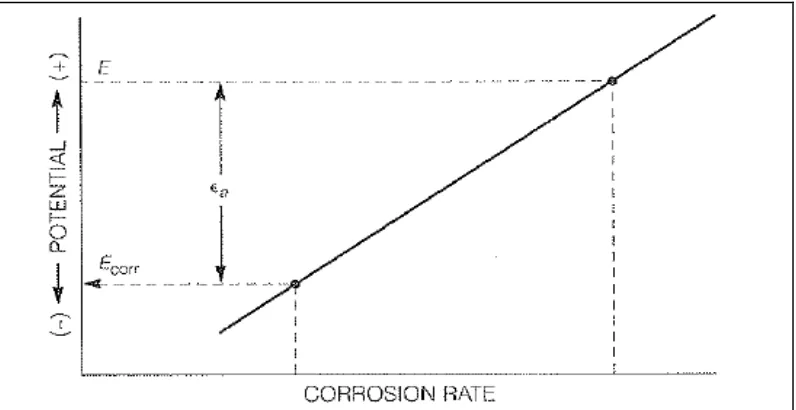
Ketika potensial permukaan meningkat dari Ecorr menuju E, maka laju reaksi
anoda atau laju korosi akan meningkat, seperti yang ditunjukkan gambar 2.3.
Polarisasi anoda didefinisikan sebagai εa = E – Ecorr. Tanpa adanya polarisasi,
reaksi akan menimbulkan laju korosi yang sangat tinggi.
Gambar 2.3 Skema Pertambahan Laju Korosi pada Polarisasi (Principles and
Prevention of Corrotion, 2nd ed., halaman 8)
2.2.1.3 Pasivitas
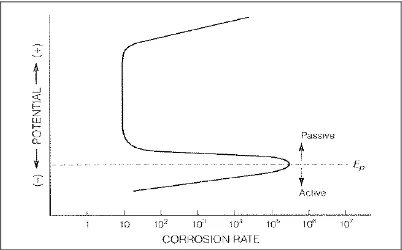
Untuk kebanyakan logam , termasuk kobalt, besi, nikel, krom,stainless
steel dan titanium, laju korosi akan menurun setelah melewati potensial batas, εp,
seperti ditunjukkan pada gambar 2.4. Ketahanan korosi diatas batas ini, meskipun
adanya gaya korosi yang tinggi (polarisasi anoda yang tinggi) disebut dengan
pasivitas. Dibawah εp laju korosi logam kembali meningkat dengan perbedaan
laju korosi antara batas dapat mencapai 103 sampai 106 kali. Pasivitas terjadi
karena adanya pembentukan lapisan tipis oksida hidrasi, yang bertindak sebagai
pelindung untuk reaksi pelarutan anoda. Kebanyakan logam memiliki range
pasivitas tersendiri, sebagai contohnya stainless-steel type 304 akan memiliki
pasivitas pada air laut aerasi namun tidak di air laut yang tidak ber-aerasi.
Mayoritas penggunaan logam untuk konstruksi maupun mesin
mengandalkan pasivitas sebagai tindakan pencegahan korosi, contohnya seperti
stainless-steel. Akan tetapi, pasivitas bukanlah tanpa masalah, lapisan yang
diciptakan oleh pasivitas cenderung tipis (berkisar 10μm) sehingga apabila lapisan
tersebut mengalami breakdown maka pembentukan korosi berupa pitting, crevice
sampai cracking dapat terjadi tanpa dapat terdeteksi. (Jones, Denny A. Principles
and Prevention of Corrotion. 2nd Ed. 1992)
Gambar 2.4 Pasivitas pada Potensial Oxidasi Diatas εp (Principles and Prevention
of Corrotion, 2nd ed., halaman 10)
2.2.1.4 Korosi Dalam Kajian Mekanikal
Dari segi perubahan fisik yang dialami material ketika mengalami
korosi, kebanyakan mekanisme korosi telah memiliki kaidah/karakteristik masing
– masing yang telah ditetapkan, contohnya reaksi batangan besi (Fe) dengan gas
oksigen (O2) serta air (H2O) yang paling umum dijumpai dalam kehidupan sehari
– hari akan menghasilkan karat besi (Fe2O3), hal ini telah ditetapkan bentuk –
bentuk fasa korosi melalui kecendrungan ikatan – ikatan atom yang merupakan
sifat kimiawi suatu bahan, bukanlah dari sifat mekanis suatu bahan.
Namun kajian mekanikal dapat terlihat dan dihubungkan dalam segi perubahan energi dalam proses terbentuknya korosi, Gejala korosi timbul secara
alami, dimana pengaruhnya dialami oleh hampir semua zat dan diatur oleh
perubahan-perubahan energi. Sesuai dengan hukum thermodinamika yaitu:
- Keseimbangan Termodinamika Pertama: Energi tidak dapat diciptakan dan
dimusnahkan.
- Keseimbangan Ternodinamika Kedua: Semua perubahan spontan terjadi disertai
pelepasan energi bebas dari sistem ke lingkungan sekitar pada temperatur dan
tekanan konstan.
Hukum thermodinamika ke – 0 merupakan prinsip dasar untuk
pengukuran temperatur. Hukum thermodinamika ke – 0 dapat terpenuhi apabila
terjadi tiga keseimbangan sekaligus yaitu :
- Keseimbangan Termal : setelah semua suhu sama pada setiap titik.
- Keseimbangan Mekanik : setelah tidak ada lagi gerakan, ekspansi atau
kontraksi.
- Keseimbangan Kimia : setelah semua reaksi kimia berlangsung.
Pernyataan pertama atau hukum pertama thermodinamika sangat penting
dalam pengkajian perubahan-perubahan yang terjadi ketika logam mengalami
korosi. Pernyataan kedua atau hukum kedua thermodinamika menyatakan ketika
korosi berlangsung secara alami, proses yang terjadi bersifat spontan dan disertai
pelepasan energi bebas. Dalam keadaan yang sebebas-bebasnya, alam akan
meminimumkan energi, dan dengan korosilah alam meminimumkan energi
logam-logam.
Bentuk energi sangat banyak tetapi gaya penggerak yang menimbulkan
korosi berasal dari energi kimia. Energi ini antara lain diturunkan dari energi yang
tersimpan dalam ikatan-ikatan kimia zat yang disebut energi dalam (internal
Sebuah konsep yang menjelaskan laju reaksi-reaksi korosi adalah teori
keadaan peralihan (Transition State Theory), yang persamaannya :
A + B = C + D
Persamaan diatas merupakan bentuk ringkasan pernyataan, ‘Dua zat A dan
B, yang dikenal sebagai reaktan, saling berinteraksi sedemikian rupa untuk
membentuk dua zat baru yaitu C dan D yang merupakan hasil reaksi’. Agar dapat menghasilkan zat-zat baru A dan B bukan hanya harus saling sentuh melainkan
juga harus terpadu secara fisik, untuk membentuk suatu zat antara AB. Hal ini
terjadi dalam waktu yang singkat dan jika reaktan-reaktan memiliki energi cukup
dan orientasi keduanya untuk berpadu tepat. AB merupakan keadaan peralihan,
dimana reorganisasi keadaan peralihan ini yang kemudian secara langsung
menghasilkan C dan D.
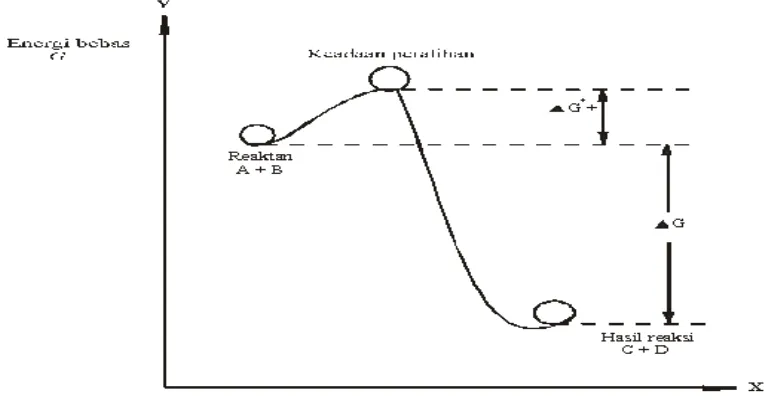
Profil energi merupakan sebuah diagram yang berguna untuk
menggambarkan perubahan-perubahan energi bebas yang berlangsung selama
reaksi (gambar 2.5). Sumbu Y dalam diagram merupakan energi bebas, perubahan
energi ditulis dengan ∆G, dengan kesepakatan bahwa huruf delta capital (∆)
menyatakan ‘perubahan’. Sumbu X digunakan untuk koordinat reaksi dan dapat
dianggap menyatakan kearah mana proses bergerak maju.
Gambar 2.5. Diagram Profil Perubahan Energi Reaksi Korosi
Dari gambar di atas menyatakan bahwa keadaan peralihan harus
mempunyai energi bebas lebih tinggi dibanding jumlah energi-energi bebas pada
masing-masing zat asal, yaitu A dan B. Pada umumnya, jumlah ini dinyatakan
dengan simbol ∆G+. Karena gambar diatas merupakan reaksi spontan maka energi-energi hasil reaksi, C dan D harus lebih rendah dari energi-energi reaktan,
A dan B, dengan selisih sebesar ∆G. Begitu terbentuk, keadaan peralihan dapat
berubah kembali menjadi reaktan atau terus berubah menjadi hasil reaksi.
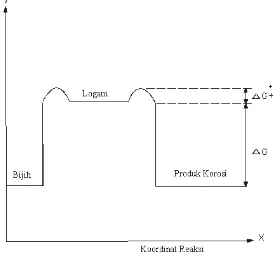
Logam-logam dalam keadaan tidak bergabung dengan bahan lainnya,
biasanya memiliki tingkat energi tinggi. Hal ini dijelaskan pada gambar 2.6
menggunakan profil energi untuk menggambarkan perubahan-perubahan
thermodinamika yang dialami suatu atom logam, logam bila berdiri sendiri
disebut atom logam, dan sesudah bergabung lagi disebut hasil korosi.
Gambar 2.6. Profil Energi Termodinamika untuk Logam dan Senyawanya
(http://ismantoalpha.blogspot.co.id/2009/12/macam-macam-korosi.html)
Hukum thermodinamika mengungkapkan kecenderungan keadaan energi
tinggi untuk merubah keadaan energi rendah. Kecenderungan inilah yang
membuat logam-logam bergabung kembali yang akhirnya membentuk gejala yang
Terakhir, pembahasan terbentuknya melalui gaya – gaya mekanis (seperti gaya tensile maupun gaya kompresi) tidak memiliki pengaruh yang signifikan
atau bahkan tidak berpengaruh pada korosi dari material. Gaya kompresi tidak
menyebabkan keretakan, dan pada kenyataannya gaya kompresi melalui teknik
shot-peening digunakan untuk menurunkan kemungkinan material logam
mengalami fatik, keretakan dari pengaruh Stress-Corrosion-Cracking (SCC).
Akan tetapi gabungan dari gaya tensile dan pengaruh lingkungan korosi yang
spesifik dapat menyebabkan kegagalan tiba-tiba melalui cracking pada struktur
logam.
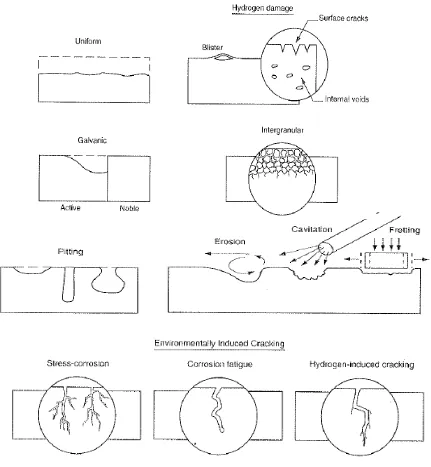
2.2.2 Jenis – Jenis Korosi pada Material Logam
Terdapat beberapa bentuk korosi yang ditunjukkan secara skematis di
gambar 2.7 dan diurutkan sebagai berikut, yang selanjutnya akan dibahas satu
persatu secara singkat:
A. Korosi yang dapat terlihat dan diidentifikasi secara langsung, meliputi
1. Uniform Corrosion
2. Galvanic Corrosion
3. Crevice Corrosion
4. Pitting Corrosion
5. Hydrogen Damage
B. Korosi yang memerlukan identifikasi tambahan atau alat Bantu, meliputi
6. Erosion Corrosion
7. Cavitation
8. Fretting Corrosion
9. Intergranullar Corrosion
C. Korosi yang memerlukan mikroskopi untuk identifikasinya, meliputi
10. Exfolation
11. Dealloying
12. Corrosion Fatigue
Uniform Corrosion merupakan korosi umum yang dialami sebagian besar logam. Namun dampaknya bentuk korosi lainnya bersifat lebih berpusat, lebih
susah dideteksi dan lebih merusak meskipun tidak menkomsumsi/mengenai
seluruh material. Hydrogen damage lebih mengacu pada hasil metalurgi, tetapi
tetap dibahas akibat frekuensi kejadiannya (Chattoraj, Indrianil.Jurnal
Fundamentals of Corrosion & Its Prevention.)
Gambar 2.7 Rangkuman Skema Jenis – Jenis Bentuk Korosi (Principles and
2.2.2.1 Uniform Corrosion
Apabila kerusakan permukaan logam bersifat merata/sejajar maka
kerusakan dapat digolongkan kedalam uniform corrosion. Untuk dapat terjadinya
uniform corrosion, lingkungan korosif / reaksi harus dapat terjadi / bereaksi dengan keseluruhan bagian dalam permukaan logam, ditambah logam itu sendiri
harus merata baik secara metalurginya maupun komposisinya. Contoh yang paling
mendasar dari korosi jenis ini adalah korosi yang disebabkan oleh atmosfer,
contoh lainnya seperti korosi yang terjadi pada baja yang dicelupkan dalam
larutan asam. Korosi jenis ini lebih dipilih dalam pandangan teknis apabila
dibandingkan dengan korosi lokal/pemusatan lainnya karena dapat diprediksi
sehingga dapat dijadikan sebuah faktor dalam perencanaan. Gambar 2.8
menunjukkan permukaan struktur baja bangunan yang telah mengalami uniform
corrosion.
Gambar 2.8 Uniform Corrosion pada Struktur Baja (corrosion.ksc.nasa.gov)
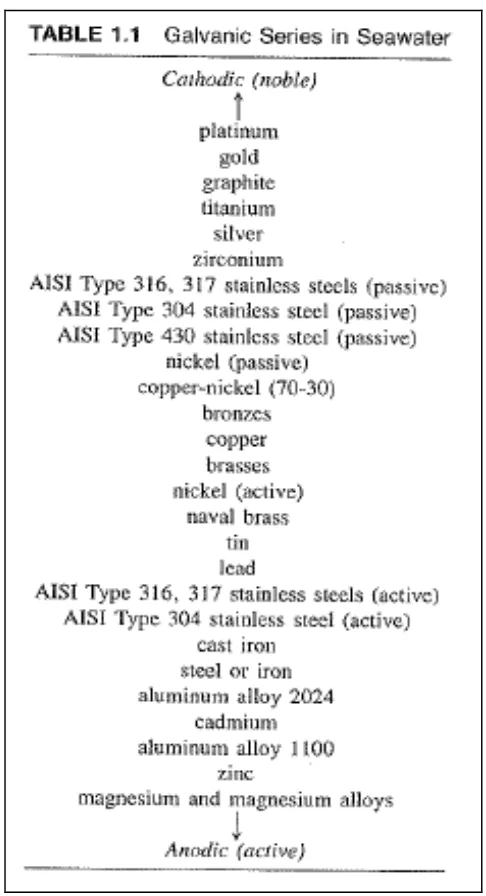
2.2.2.2 Galvanic Corrosion
Ketika dua logam didekatkan/dipasang dengan kehadiran elektrolit
korosif, salah satu diantara logam tersebut akan mengalami korosi dan yang lain
akan terlindung dari korosi itu sendiri. Ketika dua logam yang memiliki potensial
korosi, Ecorr, berbeda maka salah satu logam dengan muatan positif atau muatan
yang lebih mulia akan terlindung sedangkan logam yang lainnya akan mengalami
campuran seperti stainless steel maupun nikel berada dalam kondisi pasivitas aktif
(diatas εp).
Gambar 2.9 akan menunjukkan contoh galvanic corrosion diantara logam
baja karbon yang dilas dengan sebuah stainless steel. Flens dari pipa baja tersebut
akan mengalami korosi di sekitar sambungan las. Semakin menjauh dari las, maka
korosi semakin susah terjadi akibat adanya resistensi pada jalur elektrolit,
sehingga konduktivitas elektrolit hanya terjadi pada daerah keci di sambungan.
Tabel 2.1 Tabel Seri Galvanic Dalam Air Laut (Principles and Prevention of
Gambar 2.9 Proses Galvanisasi Stainless Steel dan Baja Karbon
(engineering.stackexchange.com)
2.2.2.3 Crevice Corrosion
Crevice corrosion adalah korosi berpusat yang terjadi dalam tempat tertutup (crevice, lubang), yang dimana akses dari fluida yang bekerja dari
lingkungan sangatlah terbatas. Formasi dari sel aerasi yang berbeda akan
menimbulkan korosi didalam lubang tersebut. Contoh dari crevice sendiri adalah
jarak antara bagian, bagian bawah dari gasket atau seal, didalam retakan, atau
ruang yang dipenuhi dengan kotoran maupun sludge.
Korosi ini dipengaruhi oleh jenis crevice (metal atau
metal-nonmetal), geometri crevice (bentuk, ukuran permukaan) dan faktor metalurgi
serta lingkungan. Pemaparan suatu logam terhadap korosi ini telah ditentukan
melalui prosedur standard ASTM dengan acuan temperatur batas crevice
corrosion sebagai indikator pengurutan ketahanan material. Korosi stainless-steel
dalam larutan aerasi garam telah menjadi fenomena umum crevice corrosion,
campuran Fe,Cr dan Ni sebagai penyusun utama stainless steel akan berakumulais
di crevicedan membentuk larutan asam yang sangat tinggi sehingga laju korosi di
daerah tersebut juga mengalami peningkatan signifikan. Gambar 2.10
menunjukkan crevice corrosion yang terjadi pada sisi pipa APK dengan material
Gambar 2.10 Crevice Corrosion pada Stainless Steel 316 di APK Sistem
Desalinasi Air Laut (Crevice Corrosion .Corrosionclinic.com. 2012)
2.2.2.4. Pitting Corrosion
Kondisi tertentu, seperti konsentrasi oksigen yang rendah atau konsentrasi
kloridayang akan membentuk anion, dapat mempengaruhi kemampuan sebuah
logam untuk membentuk kembali lapisan pasivitasnya. Pada kasus terparah,
keseluruhan permukaan akan tetap terlindungi namun fluktuasi terpusat pada
sebuah titik akan mengalami degradasi lapisan oksida hingga mencapai titk batas,
korosi pada kondisi berikut dapat menyebabkan munculnya lubang korosi
(corrosion pits), Meskipun lubang korosi hanya terbentuk pada keadaan yang ekstrim, mereka dapat terus menerus berlanjut bahkan ketika kondisi konsentrasi
telah kembali normal, hal ini dikarenakan interior dari lubang korosi memiliki pH
yang terus menurun (semakin asam) dan kadar oksigen yang semakin menipis
sehingga proses autokatalis terjadi dan mempercepat laju korosi. Dalam kasus –
kasus ekstrim lubang yang terlihat kecil dapat menjalar kedalam material sehingga
menghasilkan konsentrasi tekanan yang cukup untuk merusak logam yang
tangguh, kondisi ini sangatlah berbahaya dikarenakan deteksi serta identifikasi
baru dapat dilakukan setelah terjadi kegagalan, dimana terlihat bahwa lubang yang
berukuran jauh lebih besar. Korosi jenis ini umum dijumpai pada logam passivasi,
dan dapat dicegah dengan pengendalian lingkungan disekitar logam. Gambar 2.11
menunjukkan lubang (pit) yang dihasilkan akibat pitting corrosion dan Gambar
2.12 menunjukkan bentuk lubang (pit) yang mungkin terbentuk dalam pitting
corrosion.
Gambar 2.11 Pitting dan Crevice Corrosion dalam Material Stainless Steel yang
Terpapar Larutan Besi Klorida (www.nap.edu)
Gambar 2.12 Skema Penjalaran Lubang (Pit) pada Pitting Corrosion
(Wikipedia.org)
2.2.2.5 Environmental Induced Corrosion
Korosi yang disebabkan oleh faktor lingkungan ini meliputi tiga jenis
korosi, yaitu Stress Corrosion Cracking (SCC), Corrosion Fatigue Cracking
(CFC), dan Hidrogen-Induced Cracking (HIC).
SCC terjadi pada logam dengan tegangan tensil dalam kondisi lingkungan
tertentu. Logam murni cenderung memiliki ketahanan terhadap SCC ini. Sebuah
lapisan permukaan pasif dibawah kondisi oksidasi harus hadir dan laju korosi
klorida panas. kuningan terhadap larutan ammonia, dan baja karbon terhadap
nitrat dimana hal tersebut ditunjukkan oleh gambar 2.13.
CFC terjadi dalam siklus tekanan dalam lingkungan korosif. Kerentanan
terhadap dan laju korosi dari keretakan fatik tanpa korosi biasanya bertambah
karena adanya kehadiran lingkungan korosif. Baik logam maupun paduan dapat
terpapar oleh korosi jenis ini, tanpa adanya lingkungan spesifik. Beach marks
secara makroskopis biasanya dapat disaksikan ketika produk korosi
diakumulasikan pada jalur keretakan. Akan tetapi, beach marks juga dapat terjadi
apabila terdapat perbedaan pada deformasi mikroplastik ketika penjalaran
keretakan terganggu, dan beach marks (yang ditunjukkan gambar 2.14) yang
muncul dengan indikasi korosi yang sedikit atau tidak ada sama sekali.
HIC yang menyebabkan keretakan terjadi ketika difusi hidrogen dalam
lattice logam mengalami evolusi hidrogen yang memproduksi atom hidrogen pada
permukaan selama korosi electroplating, pembersihan atau proteksi katoda.
Keretakan HIC diakselarasi oleh polarisasi katoda.HIC cenderung bersifat lebih
dominan dibandingkan SCC pada karbon, logam baja paduan rendah, stainless
steels, paduan aluminium, dan paduan titanium. HIC juga berkontribusi terhadap
hilangnya umur fatik pada paduan logam kekuatan tinggi, dimana biasanya
dipakai dalam pesawat terbang.
Gambar 2.13 Stress Corrosion Cracking pada Stainless Steel
Gambar 2.14 Beach Marks dalam Corrosion Fatigue Cracking (Principles and Prevention of Corrotion, 2nd ed., halaman 18)
2.2.2.6 Hydrogen Damage
Serangan hidrogen adalah reaksi dari hidrogen dengan karbida dalam baja
yang membentuk metana, sehingga menyebabkan dekarburisasi, kehampaan,
dan tonjolan permukaan. Tonjolan hidrogen yang ditunjukkan oleh gambar 2.15
atau keretakan hidrogen yang lebih kecil dapat terlihat ketika kekosongan yang
berisi hidrogen meledakpada permukaan material. Kekosongan terjadi ketika atom
hidrogen berpindah dari permukaan material menuju ke bagian dalam material
dimana kemudian hidrogen berkumpuldan membentuk tekanan internal untuk
merobek dan mendeformasi logam secara lokal.
Formasi hidrat merapuhkan logam reaktif seperti titanium, zink,
magnesium, tantalum, niobium, vanadium, uranium dan thorium.
Gambar 2.15 Tonjolan Hidrogen dalam Baja Karbon AISI 1020 (Principles and
2.2.2.7 Intergranullar Corrosion
Ketidak murnian reaktif dapat memisahkan atom logam atau elemen yang
mengalami pasivitas seperti kromium dapat habis ketika berada dalam batas grain
(grain boundaries). Sebagai hasilnya, batas grain atau tempat yang bersangkutan
biasanya memiliki tingkat ketahanan korosi yang lebih rendah, korosi yang terjadi
pada batas grain dapat menjadi lebih parah sehingga dapat mengakibatkan grain
terjatuh dari permukaan, hal inilah yang disebut dengan intergranullar corrosion
(IGC) yang biasanya juga banyak dijumpai pada sistem logam paduan.
Contoh bentuk IGC yang terjadi pada stainless steel jenis austenitik
(ditunjukkan oleh gambar 2.16) dimana perlakuan panas akan menghabiskan batas
grain kromium oleh reaksi metalurgi dengan karbon. Dimana struktru akan rentan
terhadap korosi IGC, pada range temperatur 425 sampai 815oC (800 sampai
1500oF), kromium karbida (Cr23C6) akan menguap pada batas grain dan
menghabiskan jumlah kromium pada daerah disekitar struktur.
Gambar 2.16 Intergranullar Corrosion pada Permukaan Stainless Steel Austentik
yang Dilihat Menggunakan Mikroskopi (Principles and Prevention of Corrotion,
2nd ed., halaman 21)
2.2.2.8 Dealloying dan Dezincification
Sebuah elemen logam paduan yang aktif (bernilai negatif secara
electrochemical) yang mengalami pemecahan element secara luas cenderung
dengan dezincification, adalah contoh yang umum dijumpai. Zinc lebih aktif daripada tembaga dalam tabel galvanisasi dan siap meluluhkan kuningan,
meninggalkan hasil korosi tembaga yang memiliki sifat mekanikal yang lemah.
Dezincification dapat secara mudah dikenali dengan warna merah dan cenderung muncul dan terjadi dibawah lapisan dan kerusakan yang terjadi cenderung
tiba-tiba dan tidak dapat diprediksi seperti yang ditunjukkan oleh gambar 2.17.
Masalah umum lainnya yang dijumpai adalah penggunaan tembaga sebagai
komponen umum dalam suatu bangunan/struktru yang memiliki sifat lebih mulia
apabila dibandingkan dengan material lain seperti nikel, silicon, dan aluminium
yang kemudian luluh akibat korosi dezincification.
Gambar 2.17 Proses Dezincification dalam Kuningan (met-tech.com)
2.2.2.9 Erosion-Corrosion dan Fretting
Kombinasi dari fluida korosif dan kecepatan aliran yang tinggi akan
menghasilkan korosi erosion-corrosion. Fluida yang stagnant atau berjalan-lambat
akan menyebabkan laju korosi yang rendah sampai menengah, akan tetapi gerakan
fluida yang cepat akan secara fisik mengkorosi dan menghilangkan lapisan
protektif korosi, sehingga akan menunjukkan logam reaktif dibagian bawah
lapisan. Pasir dan kotoran tambahan akan mempercepat korosi dan mempercepat
serangan erosion-corrosion. Logam paduan yang memiliki kekuatan rendah dan
bergantung pada lapsisan pelindung biasanya mengalami korosi jenis ini.
Serangan korosi biasanya mengikuti arah dari aliran dan turbulensi disekitar
permukaan logam. Erosion – corrosion merupakan jenis korosi yang umum
Kavitasi merupakan kasus khusus dari erosion-corrosion. Ini terjadi ketika kecepatan fluida sangat tinggi dan reduksi tekanan dalam aliran cukup untuk
menguapkan air menjadi gelembung yang kemudian akan meledak pada
permukaan logam. Ledakan tersebut akan memproduksi tekanan ekstrim yang
menganggu permukaan lapisan dan bahkan dapat memecahkan partikel logam itu
sendiri. Bentuk dari serangan ini berupa lubang kasar yang pada akhirnya
berujung pada penetrasi logam itu sendiri. Kavitasi biasanya terjadi pada blade
turbin, impeller pompa, propeller kapal dan pipa air dimana perubahan tekanan
secara besar berada. Gambar 2.18 menunjukkan deformasi akibat
erosion-corrosion yang terjadi pada joint pipa kapal.
Fretting merupakan bentuk lain dari korosi erosion-corrosion, akan tetapi terjadi pada fasa uap. Erosi terjadi akibat gerakan kecil, biasanya dari vibrasi,
diantara logam yang berkorosi dan permukaan padat dibawah tekanan. Gerakan
tersebut akan menyebabkan lapisan oksida di permukaan terlepas, dan kembali
menunjukkan logam reaktif sama seperti jenis erosion-corrosion lainnya. Fretting
biasanya ditunjukkan dengan warna merah dari besi oksida yang diproduksi pada
permukaan baja seperti yang ditunjukkan oleh gambar 2.19.(Jones, Denny A.
Principles and Prevention of Corrotion. 2nd Ed. 1992)
Gambar 2.18 Erosion-Corrosion dan Kavitasi yang Terjadi pada Elbow Joint Pipa
Gambar 2.19 Fretting Corrosion pada Baja (www.pbclinear.com)
2.2.3 Jenis – Jenis Korosi pada Material Non – Logam
Korosi juga dapat terjadi pada material non-logam seperti keramik ataupun
polimer meskipun dalam konteks material berikut, istilah degradasi lebih umum
dipakai. Kebanyakan material keramik hampir seluruhnya imun terhadap korosi.
Ikatan kimia kuat yang menghubungkan keduanya hanya meninggalkan energi
kimiawi bebas yang sangat sedikit pada struktur sehingga dapat langsung
dikategorikan sebagai korosi. Ketika korosi terjadi proses tersebut hanya
melibatkan degradasi sederhana dari suatu material atau reaksi kimia melainkan
sebuah proses electrochemical. Sebuah contoh proteksi korosi yang palimg umum
adalah penambahan kalsium oksida pada gelas, hal ini bertujuan untuk mereduksi
kelarutan material dalam air. Meskipun tidak memiliki sifat selarut sodium silikat
pada air, gelas normal akan membentuk kekurangan mikroskopis ketika
dipaparkan pada lingkungan lembab. Dikarenakan sifat kerapuhannya,
kekurangan demikian akan membuat kekuatan gelas berkurang drastis pada
temperatur kamar selama beberapa jam. Dari kesimpulan diatas maka korosi pada
material non-logam dapat dibagi menjadi 2 yaitu:
2.2.3.1 Korosi pada Polimer
Degradasi polimer mengandung beberapa proses kompleks reaksi
physiochemical yang sering sekali disalah pahami. Proses ini sangatlah berbeda
dengan proses lainnya sehingga istilah ‘korosi’ hanya dipakai sebagai acuan kata.
diperoleh dari pencampuran polimer dengan substansi lain. sehingga membuat
mereka pada umumnya sangat susah larut. Ketika kelarutan merupakan sebuah
masalah pada beberapa aplikasi polimer, hal ini sangatlah mudah diatasi dari segi
desain. Masalah yang lebih umum dan yang lebih berhubungan adalah swelling
(pembengkakan), dimana molekul kecil memasuki struktur, mengurangi kekuatan,
kekakuan dan perubahan volume bahan. Namun banyak polimer (contoh
umumnya terlihat pada vinyl) yang secara sengaja dibengkakan dengan
plasticizers, yang dimana struktur tersebut dapat menyebabkan kerapuhan atau beberapa perubahan lainnya.
Bentuk paling umum dari degradasi adalah pengurangan pada panjang
rantai polimer. Mekanisme yang memutuskan rantai polimer dapat dikenali para
ilmuwan dikarenakan efek mereka yang sama pada rantai DNA yaitu radiasi ion
(pada umumnya dijumpai pada cahaya ultraviolet), radikal bebas, dan
pengoksidasi seperti oksigen, ozon, dan klorin. Keretakan yang disebabkan ozon
(Ozone Cracking) adalah masalah yang umumnya diketahui pada karet alami yang ditunjukkan oleh gambar 2.20. Zat aditif dapat melambatkan proses tersebut
secara efektif dan dapat berfungsi sebagai pigmen penyerap UV (contoh zat aditif
yaitu titanium oksida atau karbon hitam). Plastik belanja tidak menggunakan
aditif ini sehingga mereka dapat terurai lebih cepat sebagai sampah. (D.E. Clark,
B.K. Zoitos. Corrosion of Glass, Ceramics and Ceramic Superconductors, William (1992) ISBN 081551283)
2.2.3.2 Korosi pada Gelas
Glass disease adalah korosi dari gelas silikat dalam larutan cairan (aqueous). Hal tersebut diatur dalam dua mekanisme: pergantian ion (pengendalian difusi) dan pelarutan hidrogen dari struktur gelas. Kedua
mekanisme tersebut sangat berpengaruh terhadap pH (keasaman) dari larutan yang
bersentuhan dengan material kaca. Kecepatan pergantian ion berkurang dengan
pH larutan dibawah 10-0.5pH dimana kecepatan pelarutan hidrogen bertambah
dengan pH diatas 100.5pH. Korosi pada gelas akan menyebabkan gelas terlihat
mengalami kerutan atau garis-garis halus pada permukaan kaca yang bersentuhan
dengan larutan yang memiliki pH tinggi. Fenomena glass disease dapat dilihat
pada gambar 2.21. (M.I. Ojovan, W.E. Lee. New Developments in Glassy Nuclear
Wasteforms. New York (2007) ISBN 1600217834)
2.3 Perhitungan Laju Korosi
Metode dari perhitungan laju korosi menjadi asas/dasar dari corrosion
engineering. Ini menitikberatkan pada perhitungan laju uniform corrosion dengan metode kehilangan berat dari sebuah spesimen. Akan tetapi metode perhitungan
kehilangan berat ini juga dapat dipakai pada beberapa serangan korosi terpusat
(pitting, crevice, galvanic corrosion, dll) dengan modifikasi spesimen dan metode evaluasinya. Perhitungan laju korosi memiliki satu atau beberapa tujuan, yaitu:
1. Untuk menentukan logam/logam paduan yang paling baik digunakan untuk
aplikasi sebuah sistem
2. Untuk menentukan waktu pemakaian dari sebuah peralatan atau produk
3. Untuk mengevaluasi dan melakukan uji pada logam paduan baru atau sebuah
produk
4. Untuk membantu pengembangan dari logam paduan baru yang tahan terhadap
korosi
5. Untuk memverifikasi suatu logam yang digunakan telah mencapai spesifikasi
quality control telah mencukupi atau tidak
6. Untuk mengevaluasi keadaan lingkungan sistem dan kontrol dari lingkungan
7. Untuk menentukan langkah pencegahan yang paling tepat dalam menghadapi
korosi
8. Untuk pembelajaran mekanisme korosi lebih lanjut.
Tes dapat dilakukan dalam kondisi laboratorium maupun dalam lapangan.
Tes dalam laboratorum akan memberikan hasil yang lebih flexibel. murah, dan
dapat memodifikasi objektif maupun parameter lain, namun hampir tidak
mungkin untuk mensimulasikan kondisi sebenarnya (dalam lapangan) secara
persis dengan keadaan laboratorium. Pengaruh lingkungan dalam lapangan,
kenaikan temperatur sampai pada faktor lain yang mempercepat korosi seringkali
diabaikan dalam kondisi percobaan di laboratorium.
2.3.1 Metode Weight Loss
Metode ini merupakan metode paling mendasar dan paling umum dipakai
perhitungan ini dapat dipakai untuk semua jenis kondisi korosi baik untuk logam
murni maupun logam paduan dan dalam kondisi dan jenis korosi apapun.
Kekurangan dari metode ini adalah kita sering kali tidak dapat mengukur faktor
real yang terjadi dalam lapangan untuk sebuah spesimen yang besar, contohnya
boiler, dikarenakan tidak adanya alat pengukur berat untuk spesimen yang
terlampau besar maupun berat, sehingga pengujian yang memberikan hasil actual
sesuai dengan keadaan lapangan hanya dapat diperoleh dari spesimen yang ukuran
dan beratnya tidak terlalu besar dan untuk spesimen yang terlalu besar, maka
kondisi pengujian harus dilakukan di dalam kondisi laboratorium dengan cara
melakukan tes pada potongan/preparat spesimen tanpa menguji keseluruhan
spesimen.
Laju korosi memiliki satuan mils penetration per year (MPY) dimana 1
mil = 0.001 inchi, dan dapat ditulis sebagai persamaan berikut
[1]
Dimana:
W adalah Weight loss (kehilangan berat) dalam milligram
D adalah Density (massa jenis) dalam gram/cm3
A adalah Area (luas) dari spesimen yang terpapar dengan faktor korosi dalam
inchi2
T adalah Time (waktu) terpaparnya spesimen dengan faktor korosi dalam jam
Persamaan berikut dapat diturunkan untuk mendapatkan satuan/dimensi
yang lain dengan pengubahan W, D, A, T yang akan merubah konstanta 534
sesuai dengan dimensi yang diinginkan. Selain perhitungan laju korosi per tahun,
para engineer juga sering menghitung kehilangan berat dalam suatu luas per
waktu dalam satuan desimeter kuadrat per waktu (mdd), untuk konversinya 1
MPY = 1.44 (mdd)/nilai spesisfik gravitasi. Satuan MPY terus digunakan sebagai
satuan laju korosi yang paling popular digunakan di Amerika Serikat. Konversi ke
Generasi engineer berikutnya akan lebih menggunakan satuan metrik
terutama satuan mm/tahun dan μm/tahun untuk laju korosi cepat dan laju korosi
lambat. Penurunan dari persamaan [1] akan mendapatkan nilai laju korosi dalam
satuan metrik tersebut, yang dituliskan sebagai berikut:
[2]
Dan
[3]
Dimana satuan W, D, T memiliki satuan yang sama dengan persamaan [1]
dengan pengubahan satuan A menjadi cm2. Berikut akan diberikan tabel
perbandingan satuan laju korosi dan nilai batas masing – masing satuan untuk
menentukan resistensi dari korosinya. Tabel 2.2 dibawah menunjukkan
perbandingan satuan laju korosi dengan nilai laju korosinya. (Jones, Denny A.
Principles and Prevention of Corrotion. 2nd ed. 1992).
Tabel 2.2 Perbandingan Satuan Laju Korosi dengan Nilai Resistensi Korosi
2.3.2 Metode Polarisasi
Metode ini dapat dipakai untuk pengujian spesimen dalam keadaan
lapangan dimana pengaplikasian metode weight loss tidak dapat digunakan,
dengan menggunakan perhitungan polarisasi serta reaksi electrochemical untuk
mendapatkan data dari spesimen melalui penerapan hukum Faraday maka metode
ini dapat digunakan untuk menghitung laju korosi sesuai dengan ketentuan ASTM
G1-90, namun metode ini harus menggunakan instrumen potensiometer untuk
menentukan faktor arus daya yang dihasilkan oleh elemen/faktor korosi (seperti
air laut), persamaan metode ditunjukkan sebagai berikut: (M.K, Satria Nova dan
Nisbah, Nurul M. Jurnal Teknik ITS : Analisis Pengaruh Salinitas dan Suhu Air Laut Terhadap Laju Korosi Baja A36 pada Pengelasan SMAW)
[4]
Dimana:
Laju Korosi dalam mm/tahun atau mmpy
a adalah berat atom logam yang terkorosi dalam gram/mol
I atau ikorr, adalah nilai yang didapatkan melalui potensiometer adalah kerapatan
arus dalam μA/cm2
k adalah konstanta yang bernilai 0.129 dalam satuan mpy atau 0.00327 dalam
satuan mmpy
n adalah jumlah elektron yang dilepas pada logam terkorosi
D adalah massa jenis logam terkorosi dalam gram/cm3
2.4 Pengendalian Korosi dan Tindakan Pencegahan
Pengendalian dari korosi serta tindakan pencegahan perlu diaplikasi
sesegera mungkin dikarenakan apabila material telah terkena korosi, maka
material tidak dapat dikembalikan ke kondisi semula tanpa membuang
(menghapus) permukaan material melalui polishing ataupun pembersihan
menggunakan bahan kimiawi yang akan menimbulkan efek samping pada
Pengendalian dan tindakan pencegahan untuk menghilangkan atau
meminimalisir efek korosi dapat digolongkan kedalam 4 jenis yang kemudian
akan dibahas satu persatu secara singkat, keempat metode tersebut yaitu sebagai
berikut:
1. Pemilihan material
2. Perencanaan (design) dari sistem itu sendiri
3. Pembersihan
4. Metode khusus
2.4.1 Pemilihan Material
Pemilihan material yang sesuai merupakan langkah pertama dan langkah
yang paling penting dalam tindakan pencegahan korosi dan akan berdampak pada
tindakan pengendalian selanjutnya. Aspek stabilitas mekanis, kimiawi, temperatur
operasi, ketersediaan dan biaya menjadi aspek yang perlu diperhitungkan.
Pengendalian dengan coating, cladding, proteksi katoda dapat digunakan dan
pemanfaatan pengendalian dengan metode galvanic memerlukan perhatian khusus
dalam pengaplikasiannya. Berikut akan diberikan penjelasan singkat mengenai
beberapa material yang umum digunakan pada dunia keteknikan maupun
konstruksi.
A. Baja
Baja merupakan material yang paling umum digunakan. Baja dapat
mengalami karat dengan mudah, penggunaan besi stabil di lingkungan aqueous
alkali, kecuali di alkali kuat.
B. Stainless Steel
Logam paduan ini hadir dalam beberapa jenis, umumnya stabil dalam
lingkungan alkali, neutral, dan asam. Stabilitas ini terbentuk karena adanya
lapisan pasivitas dari kromium dan nikel oxide pada permukaannya. Akan tetapi
lapisan ini mudah dihancurkan oleh kehadiran klorida, flour, dan ion besi pada pH
yang asam, sehingga akan menyebabkan pitting corrosion. Jika stainless steel
jenis nikel seperti Inconel, Hastelloy dan Incoloy dapat digunakan. Penggunaan
teknologi las untuk kepentingan maintenance sistem juga perlu diperhatikan,
pemilihan bahan las yang dipadukan dengan temperatur tinggi proses pengelasan
akan membuat galvanic corrosion terjadi dan keretakan dapat terjadi setelahnya
terutama dalam paduan karbon yang tinggi. Dikarenakan banyak pandangan
umum yang melihat stainless steel sebagai paduan yang tahan korosi, kejadian dan
identifikasi terkadang dilupakan sehingga membuat kegagalan terjadi secara
tiba-tiba dan tak terduga.
C. Aluminium
Aluminum cocok dipakai pada berbagai jenis reaksi kimia organik, namun
akan bereaksi secara cepat dengan air.
D. Zinc dan Baja Galvanisasi
Material logam ini cocok digunakan untuk proteksi terhadap korosi
atmosfer kecuali keadaan atmosfer memiliki tingkat keasaman dan temperatur
yang tinggi.
E. Graphite
Material ini bersifat stabil terhadap kebanyakan cairan dan bahan kimia
non oksidan.
F. Ceramic
Termasuk juga kaca, ceramic juga sering digunakan sebagai material
konstruksi. Rentan terhadap serangan alkalin kuat dan asam hidroflorik
G. Polimer
Yang termasuk di dalamnya natural rubber, butyl rubber, chloropene
rubber, fluourinated rubber, polyethylene (PE), polypropylene (PP), polyvinylideneflouride (PVDF), Glass-fiber-reinforced-polyster (GF-UP).Polimer memiliki sifat yang sangat spesifik terhadap ketahanan korosi yang disebabkan
perekat dan degradasi kimiawi adalah faktor yang perlu diperhatikan dalam
penggunaan material ini.
H. Karet dan Elastromer Sintetis
Karet alami adalah material yang telah dipakai selama beberapa abad
sebelum penggunaan material logam. Karet alami memiliki ketahanan yang bagus
terhadap berbagai jenis bahan kimia. Akan tetapi rentan terhadap reaksi oli
mineral, larutan klorin dan elemen oksidasi. Karet juga tidak tahan terhadap
pemaparan temperatur ringgi dengan campuran karet halus berkisar antara 140oF
(60oC) dan untuk karet kasar berkisar antara 180oF (82oC). Penambahan campuran
penahan panas dapat dilakukan untuk meningkatkan ketahan terhadap penggunaan
karet dalam suatu sistem. Penggunaan material karet biasanya digunakan untuk
melapisi permukaan logam yang akan menghapus kerentanan material logam
terhadap reaksi kimiawi.
Penggunaan karet telah digunakan sejak perang dunia I dimana pelapisan
tangki penyimpanan berbahan baja dengan karet diaplikasikan, pengaplikasian
berikut bukan saja memberikan perlindungan terhadap reaksi baja dengan bahan
kimia namun juga ikatan diantara kedaua bahan akan mengubah sifat logam
menjadi tahan terhadap korosi.
Berikut akan diberikan tabel yang memberikan indikator yang
berhubungan dengan kecocokan dan stabilitas material dalam kondisi lingkungan
tertentu, tabel ini menunjukkan pengujian material dalam kondisi laboratorium
dan dapat memberikan hasil yang jauh berbeda dalam pengaplikasian kondisi
Tabel 2.3. Tabel Stabilitas dan Kecocokan Material Terhadap Faktor Lingkungan
(Bardoliwala, Denny dan Wittel, Klaus. Maintenance Engineering Handbook. 6th
2.4.2 Perencanaan (Design)
Perencanaan harus diperhitungkan dalam pemilihan material yang berbeda
akibat akan terjadinya galvanic corrosion.Perencanaan juga harus melihat aspek
perawatan agar perawatan mudah dilakukan, design sendiri juga harus dapat
mencegah korosi yang disebabkan perbedaan aspek aerasi, yang akan
menghasilkan crevice corrosion. Contoh dari kesalahan perencanna dapat dilihat
pada gambar 2.22 di bawah. Material yang memiliki ketahanan dan sifat
pencegahan korosi tetap dapat terkena crevice corrosion akibat kesalahan design,
seperti design o-rings dan washers.
Gambar 2.22 Contoh dari Design untuk Mencegah Kejadian Crevice Corrosion
(Maintenance Engineering Handbook. 6th Edition.Halaman 1247)
2.4.3 Pembersihan
Perawatan pembersihan sering dilakukan untuk menghilangkan korosi
pada material. Peristiwa pembersihan penyumbatan pada APK atau nosel adalah
contoh umum tindakan pembersihan korosi.Sisa kotoran juga dapat menyebabkan
korosi, baik itu crevice corrosion yang disebabkan perbedaan aerasi atau
bakteri.Namun perlu diingat tumpukan kotoran yang tidak terlalu berlebihan
mampu memperlambat laju korosi karena menyediakan lapisan tambahan yang
memperlambat reaksi korosi.
Pembersihan kotoran maupun noda sering dilakukan dengan menggunakan
bahan kimia seperti asam , tabel 2.2 harus diperhatikan sebelum menggunakan
proses pembersihan selesai dilakukan, perawatan tambahan seperti penambahan
oli anti-korosi pada baja perlu diaplikasikan kembali untuk menghilangkan sisa
zat-zat pembersih.
2.4.4 Metode Khusus
Seringkali perawatan memerlukan metode khusus, yang akan secara
langsung mengubah sistem yang mengalami korosi, beberapa metode tersebut
adalah:
A. Permukaan Baru
Pelapisan permukaan material yang mengalami korosi akan mengubah
performanis laju korosi. Pelapisan biasanya menggunakan material oli, lemak,
wax, material konversi inorganic, dan lapisan logam lainnya yang dikerjakan
dalam proses electroplating, pengecatan, pelapisan dengan plastik atau karet, atau
kombinasi proses diatas.
B. Pelapisan (plating)
Pelapisan dilakukan dengan menggabungkan sifat dari logam dasar, yang
biasanya memiliki kestabilan mekanis dan biaya rendah, dengan salah satu logam
pelapis yang memiliki sifat tahan korosiatau stabilitas abrasi. Pelapisan dengan
zinc, kromium, atau nikel adalah salah satu metode umum yang dipakai. Pelapisan
sendiri harus memperhatikan galvanic corrosion, yang dapat terjadi pada
sambungan pelapis dan logam dasar, dimana logam pelapis harus bersifat lebih
anoda dibandingkan logam dasarnya.
C. Conversion Coatings
Pada dasarnya terdapat 4 tipe conversion coatings yaitu besi fosfat, zinc
fosfat, mangan fosfat dan krom, ketiga pelapis pertama umumnya dipakai pada
baja sedangkan yang terakhir dipakai pada pelapisan aluminium, logam paduan
aluminium, magnesium dan zinc. Pelapis ini akan menghasilkan permukaan yang
baik untuk adhesi cat sehingga gabungan pelapis dengan cat akan menghasilkan
Metode untuk menghasilkan pelapis fosfat akan melibatkan pemaparan
permukaan logam kepada larutan asam fosfat. Serangan yang dilakukan oleh asam
akan melarutkan bagian dari logam dan nilai pH akan meningkat pada lapisan
batas antara logam yang bereaksi dengan larutan fosfat itu sendiri. Sebagai
hasilnya, fosfat zinc, besi atau mangan yang tidak dapat larut akan menyatu pada
larutan kimiawi, sehingga akhirnya seluruh permukaan logam akan tertutup secara
merata dan serangan akan dihentikan dikarenakan larutan kimia yang bereaksi
membentuk lapisan pelindung yang mengikat pada permukaan logam yang
bersinggungan.
D. Pelapisan Katoda
Akibat dari galvanic corrosion dapat digunakan sebagai keuntungan
dengan menghubungkan logam yang kurang mulia dan gampang mengalami
korosi secara elektrik yang akan menghasilkan substansi pelindung. Peluluhan
anoda dalam logam yang kurang mulia tersebut akan terjadi, dan logam yang lain
akan berperan sebagai katoda, sehingga pelapisan katoda dapat terjadi dan
material pencegahan korosi dapat tercapai. Jenis perawatan ini banyak dipakai
untuk memproteksi pipa, tangki penyimpanan, propeller kapal, dan kasus lainnya
dengan menghubungkan mereka menggunakan elektroda sebagai pengorbanan
yang biasanya terbuat dari logam paduan zinc atau magnesium. Gambar 2.23
berikut akan menggambarkan skema proses pelapisan katoda.
Gambar 2.23 Proteksi Katoda dengan (A) Pengorbanan Anoda (B) Penghambatan
E. Inhibitor (Penghambat)
Penggunaan inhibitor merupakan salah satu metode yang paling umum
dalam pencegahan korosi. Inhibitor adalah bahan kimia yang bersinggungan
(tetapi tidak bereaksi) dengan logam maupun campurannya. Tipe inhibitor
beragam tergantung dari logam dan fungsi dari campuran atau lingkungan yang
bersinggungan. Inhibitor berperan sebagai penghambat dalam reaksi anoda
(pelarutan logam) atau reaksi katoda (reduksi oksigen). Sehingga inhibitor dapat
diklasifikasikan sebagai anoda, katoda maupun campuran keduanya.
Inhibitor bertindak dengan absorpsi dan dengan reaksi permukaan logam. Jika konsentrasi dari larutan inhibitor tidak cukup untuk menjangkau keseluruhan
permukaan logam, dan jika inhibitor bersifat anoda, maka korosi terpusat dapat
terjadi. Sehingga seringkali inhibitor jenis anoda dapat dikatakan inhibitor
"berbahaya" dan inhibitor jenis katoda dikatakan inhibitor "aman". Sebagai
konsekuensi atau penanggulangan dari kasus diatas, tindakan perawatan berupa
penambahan oli maupun air untuk menggantikan kehilangan cairan akibat
evaporasi. (Bardoliwala, Denny dan Wittel, Klaus. Maintenance Engineering
Handbook. 6th Edition)
2.5 Contoh Penelitian Mengenai Laju Korosi
Pada bagian berikut akan diberikan contoh penelitian yang telah dilakukan
oleh mahasiswa Universitas Hasanuddin dan Institut Teknologi Sepuluh
November (ITS) mengenai laju korosi dengan menggunakan kedua metode yang
telah dijelaskan diatas yaitu metode weight loss dan metode polarisasi.
2.5.1 Penelitian dengan Metode Weight Loss
Penelitian ini dilakukan oleh mahasiswa Jurusan Teknik Mesin Fakultas
Teknik Universitas Hasanuddin dengan judul jurnal "ANALISIS LAJU KOROSI
MATERIAL PENUKAR MESIN KAPAL DALAM LINGKUNGAN AIR LAUT
SINTETIK DAN AIR TAWAR" oleh Johannes Leonard.
Dalam penelitiannya, penulis menggunakan spesimen berupa material
jenis C71500 dengan campuran 70/30 Cu-Ni yang biasa dipakai pada alat penukar
sintetik yang mendekati air laut perairan Indonesia dan dibuat sesuai standar
ASTM(3) dan air tawar yang diambil dari PDAM kota Makassar.
Proses pengujian cukup sederhana, yaitu dengan merendam spesimen
selama 10 minggu dengan interval pengambilan data setiap 2 minggu, kedua
media korosif diperbarui setiap seminggu sekali dan dilakukan sterilisasi sebelum
dilakukan pengujian.
Langkah-langkah penelitian yang dilakukan adalah sebagai berikut:
sebelum direndam, permukaan spesimen dibersihkan terlebih dahulu dengan
kertas ampelas kemudian ditimbang berat awalnya sebelum direndam. Setelah
ditimbang, spesimen kemudian direndam ke dalam instalasi pengujian yang berisi
media korosif. Kedua media korosif ini disterilkan di otoklaf pada suhu 1210C
selama 15 menit. Spesimen disterilkan dengan pemijaran di atas lampu spiritus
yang sebelumnya direndam dengan alkohol 70%. Setelah 2 minggu spesimen I
diangkat kemudian dibersihkan dan dikeringkan, setelah itu ditimbang berat
akhirnya dan dilakukan pemeriksaan visual untuk melihat bentuk korosi yang ada.
Hal yang sama dillakukan pada spesimen II setelah waktu pengujian 4 minggu
dan seterusnya untuk masing-masing media korosif hingga 10 minggu berakhir.
Perhitungan laju korosi menggunakan metode weight-loss dengan
persamaan:
Dimana:
I adalah Kecepatan korosi (mills/year)
Pe adalah Daya efektif (kW)
K adalah Konstanta Korosi = 3,45x106
W adalah Kehilangan Berat (gr)
A adalah Luas permukaan spesimen (cm2)
Dari hasil pengujian diketahui besarnya kehilangan berat dari benda uji
sebagaimana terliaht pada tabel 1 dan besarnya laju korosi yang terjadi pada
benda uji dapat dilihat pada tabel 2.
Sehingga dapat dibuat grafik laju korosi kedua medium yang berdasarkan
kehilangan berat dapat ditunjukkan sebagai berikut:
Dari hasil penelitian yang telah dilakukan, maka dapat diambil kesimpulan
- Kecenderungan secara umum laju korosi pada material penukar panas dengan
lingkungan yang terdapat air laut adalah lebih besar dibandingkan dengan laju
korosi yang terjadi dalam air tawar. Laju korosi maksimum pada material dengan
disertai pertumbuhan bakteri adalah 0,15593 mils per year. Dalam lingkungan air
tawar mencapai 0,04382 mils per year.
- Pengaruh khlor berperan besar dalam meningkatkan laju korosi serta lapisan
film oksida dari material penukar panas.
- Laju korosi material penukar panas kapal ini belum mencapai hasil yang
konstan, sehingga memerlukan waktu yang lebih lama untuk perendaman.
2.5.2 Penelitian dengan Metode Polarisasi
Penelitian ini dilakukan oleh mahasiswa Jurusan Teknik Perkapalan,
Fakultas Teknologi Kelautan Institut Teknologi Sepuluh November dengan judul
jurnal "Analisis Pengaruh Salinitas dan Suhu Air Laut Terhadap Laju Korosi Baja
A36 pada Pengelasan SMAW" oleh Satria Nova M.K., dan M. Nuruh Hisbah.
Pada penelitian ini bahan-bahan dan peralatan yang dibutuhkan
diantaranya: Baja A36 yang dilas menggunakan elektroda AWS A5.1 E6013,
larutan NaCl dan seperangkat alat sel tiga elektroda yang digunakan untuk
pengujian korosi. Pengelasan dilakukan dengan mengikuti WPS (Welding
Procedure Specification) yang telah dibuat menggunakan proses pengelasan SMAW. Material uji dipotong pada daerah
las-lasan untuk kemudian diuji dan dihitung sesuai ASTM G-102. Pengujian
menggunakan sel tiga elektroda dengan bantuan alat autolab potensiostat dan
software NOVA[7]. Variasi salinitas yang digunakan adalah 320/00, 350/00 dan
380/00.
Sedangkan variasi suhu yang digunakan adalah 70C, 170C, 270C. Pembuatan
larutan dengan salinitas yang berbeda-beda dilakukan dengan mencampurkan
NaCl dalam air. Misalnya, untuk membuat larutan dengan salinitas 350/00 bisa
dilakukan
dengan mencampur 35 gram NaCl dalam 1 kg air.
Dari hasil pengujian diperoleh grafik tafel yang akan menunjukkan nilai
laju korosi sesuai ketentuan ASTM G1-90 yang didasarkan pada rumus hukum
Faraday sebagai berikut.
Dimana:
Laju korosi adalah satuan mm/year atau mmpy
a adalah berat atom logam yang terkorosi (gram/mol)
i atau ikor adalah kerapatan arus (μA/cm2)
k adalah konstanta (0.129 untuk satuan mpy dan 0.00327 untuk satuan mmpy)
n adalah jumlah elektron yang dilepas pada logam terkorosi
D adalah massa jenis logam terkorosi (gram/cm3)
Hasil yang didapat dari pengujian sel tiga elektroda adalah grafik tafel. Grafik
inilah yang nantinya digunakan sebagai acuan untuk mengitung laju korosi.
Gambar diatas menunjukkan grafik tafel yang terbentuk setelah dilakukan
NOVA. Dari grafik tersebut didapatkan nilai rapat arus korosi (ikor) yang
kemudian dimasukkan ke dalam persamaan 1 untuk mengetahui nilai laju
korosinya. Hasil perhitungan disajikan dalam tabel berikut:
Untuk menjelaskan pengaruh kadar salinitas dan suhu air laut terhadap laju
korosi maka dilakukan analisa lebih lanjut dari tabel nilai laju korosi yang telah
didapat. Gambar berikut menyajikan grafik laju korosi berdasarkan kadar salinitas
air laut.
Dari gambar diatas dapat diketahui jika kadar salinitas laut berpengaruh
laju korosinya. Korosi merupakan proses oksidasi sebuah logam dengan udara
atau elektrolit lainnya, dimana udara atau elektrolit akan mengami reduksi.
Senyawa di alam ini yang termasuk larutan elektrolit adalah air hujan yang
bersifat asam atau air laut yang mengandung garam. Garam sendiri merupakan
senyawa kimia yang bersifat pengoksida ataupun bersifat pereduksi, sehingga
otomatis tingkatan kadar garamnya jika semakin besar akan mempercepat laju
korosi. Namun demikian, berdasarkan teori pasivitas, pada kadar garam tertentu
yaitu dengan kadar garam yang tinggi laju korosi akan menurun. Pasivitas adalah
proses pengurangan daya reaktivitas suatu elemen korosi atau dapat juga disebut
sebagai contoh logam terhadap kondisi lingkungan tertentu.Kondisi dimana laju
korosi menurun pada kadar garam tertentu dinamakan kondisi pasif sehingga
larutan garam selain bisa bersifat sebagai katalisator (pemicu/pemercepat) juga
bisa bersifat sebagai inhibitor.
Namun, untuk ukuran perairan di dunia, secara umum dapat disimpulkan
jika semakin besar kadar salinitas air laut semakin besar pula laju korosinya. Hal
ini karena kadar salinitas di perairan di dunia, yang umumnya dilalui kapal
memiliki kadar garam sekitar 3% - 4%.Jika dikonversikan dalam kondisi
sebenarnya, maka perairan yang memiliki kadar salinitas lebih tinggi bisa
menyebabkan korosi yang lebih besar pada kapal berbahan dasar baja A36 yang
berlayar di sana. Untuk itu, ada baiknya memperhitungkan ketebalan plat lambung
yang akan digunakan dengan melihat salinitas air laut di daerah yang nantinya
akan menjadi rute pelayaran kapal yang akan dibangun.Dalam penelitian ini dapat
diketahui untuk setiap penambahan salinitas sebesar 30/00 maka laju korosi
Peristiwa korosi sendiri merupakan proses elektrokimia, yaitu proses
(perubahan/reaksi kimia) yang melibatkan adanya aliran listrik. Logam besi
tidaklah murni, melainkan mengandung campuran karbon yang menyebar secara
tidak merata dalam logam tersebut. Akibatnya menimbulkan perbedaan potensial
listrik antara atom logam dengan atom karbon (C). Atom logam besi (Fe)
bertindak sebagai anode dan atom C sebagai katode. Oksigen dari udara yang
larut dalam air akan tereduksi, sedangkan air sendiri berfungsi sebagai media
tempat berlangsungnya reaksi redoks pada peristiwa korosi. Elektron mengalir
dari anoda ke katoda, sehingga terjadilah peristiwa korosi.
Penelitian ini berhasil mengkonfirmasi dan membuktikan pengaruh kadar
salinitas dan suhu air laut terhadap laju korosi. Semakin tinggi salinitas maupun
suhu, semakin tinggi juga laju korosinya. Korosi tertinggi terjadi pada salinitas
380/00 dengan suhu 270C sebesar 0,5616 mmpy. Untuk setiap penambahan
salinitas sebesar 30/00 maka laju korosi rata-rata bertambah sebesar 0,0415
mmpy. Sedangkan untuk penambahan suhu sebesar 100C maka laju korosi