commit to user
UJI DIAGNOSTIK PLATELET LYMPHOCYTE RATIO DAN FIBRINOGEN PADA DIAGNOSIS TUMOR PADAT GANAS
Siahaan Endang, Salimo Harsono, Pramudianti MID
ABSTRAK
Tujuan: untuk mengetahui apakah platelet lymphocyte ratio (PLR) dan
fibrinogen memiliki nilai diagnostik dalam mendiagnosis keganasan pada pasien tumor padat
Metoda: Dari data rekam medis dicatat data pasien tumor padat sebelum
menjalani operasi di RSDM Surakarta mengenai hasil pemeriksaan biopsi/PA, fibrinogen, CRP dan darah lengkap. Dilakukan penghitungan titik potong nilai PLR dan fibrinogen untuk mendiagnosis tumor padat ganas, kemudian dilakukan uji diagnostik.
Hasil: Sejumlah 60 orang pasien tumor padat terlibat dalam penelitian ini. Kadar
fibrinogen 345 mg/dL memiliki nilai diagnostik yang lebih baik dibandingkan PLR senilai 155. Area under curve (AUC), sensitivitas, spesifisitas, NDP, NKN, RKP dan RKN PLR untuk mendiagnosis tumor padat ganas adalah 0,69, 70%, 63%, 63%, 66%, 1,89 dan 0,48; sedangkan fibrinogen adalah 0,93, 87%, 83%, 84%, 86%, 5,12 dan 0,16. Pada kombinasi nilai PLR dan fibrinogen pada analisis multivariat, nilai diagnostik PLR meningkat menjadi 0,92 namun masih rendah dibandingkan fibrinogen sendiri.
Simpulan: PLR memiliki nilai diagnostik yang lemah sedangkan fibrinogen
sangat baik untuk mendiagnosis tumor padat ganas.
commit to user Pendahuluan
Prevalensi kanker terbanyak di Eropa menurut data statistik kanker tahun 2012 adalah kanker tumor padat dengan jenis kanker paru sebanyak 13% dan
kanker payudara sebesar 11,9% (Ferlay et al., 2012). Prevalensi kanker di Indonesia sendiri adalah 1,4 dari 1.000 penduduk (Riskesdas, 2013). Kanker merupakan penyakit yang memiliki hubungan erat dengan proses inflamasi kronis
(Morgan et al., 2004). Pertumbuhan kanker pada tumor padat berkaitan erat dengan proses inflamasi sejak ditemukannya infiltrasi leukosit ke dalam jaringan
tumor oleh Rudolf Virchow (Balkwill dan Mantovani, 2001).
Inflamasi kronis karena proses infeksi maupun non-infeksi diperkirakan berhubungan dengan 15% dari seluruh kasus keganasan (Jankowski, 2011).
Respon inflamasi yang terjadi dapat menyebabkan sel tumbuh dan berkembang ke arah keganasan akibat adanya mutasi deoxyribonucleic acid (DNA), proliferasi sel
yang abnormal, angiogenesis dan metastasis (Morgan et al., 2004; Colotta, 2009). Respon inflamasi dapat dinilai dengan penanda hematologi rutin seperti jumlah leukosit, netrofil, limfosit, trombosit, neutrophil lymphocyte ratio (NLR) dan
platelet lymphocyte ratio (PLR) atau dengan penanda lain seperti C-reactive
protein (CRP), fibrinogen dan sitokin-sitokin pro inflamasi.
Respon inflamasi pada tumor padat dapat menyebabkan peningkatan jumlah trombosit, penurunan jumlah limfosit dan peningkatan fibrinogen. Perbandingan antara jumlah trombosit dengan jumlah absolut dari limfosit disebut sebagai
platelet lymphocyte ratio. Pada penelitian sebelumnya, penilaian PLR seringkali
commit to user
dapat digunakan untuk menilai prognostik dan merupakan penanda yang sensitif pada kasus tumor padat seperti kanker payudara dan kanker ovarium
(Raungkaewmanee et al., 2012; Azab et al., 2013).
Nilai PLR pre-operatif memiliki sensitifitas dan spesifisitas sebesar 81% dan
38% untuk menilai stadium tumor periampular adenokarsinoma (Smith et al., 2008); serta Area Under Curve (AUC), sensitifitas dan spesifisitas berturut-turut sebesar 0,66, 59% dan 72,9% untuk menilai stadium dan prognosis pada tumor
ovarium (Raungkaewmanee et al., 2012). Nilai PLR juga memiliki akurasi yang hampir sama dengan tumor marker CA19-9 yaitu sebesar 68,89% untuk
mendiagnosis keganasan pada penderita tumor pankreas (Miglani et al., 2013). Respon inflamasi juga dapat menyebabkan peningkatan kadar fibrinogen. Fibrinogen merupakan protein plasma yang memiliki peran penting dalam proses
hemostasis. Fibrinogen dengan dimediasi aktivitas enzimatik dari trombin dan faktor XIIIa, bersama dengan trombosit teraktivasi akan membentuk klot fibrin
(Greer et al., 2013). Deposit fibrin pada jaringan stroma tumor memiliki peranan penting dalam progresifitas tumor untuk tumbuh dan metastasis (Simpson-Haidaris dan Rybarczyk, 2001). Pada penderita kanker payudara didapatkan kadar
fibrinogen secara signifikan lebih tinggi dibandingkan dengan kontrol dan memiliki korelasi dengan ukuran tumor (Blann et al., 2001). Pada penderita
commit to user
Sepengetahuan penulis, belum ada penelitian sebelumnya, khususnya di Indonesia dan Surakarta, yang menguji nilai diagnostik PLR dan fibrinogen pada
diagnosis tumor padat ganas. Penelitian ini akan dilakukan untuk mengetahui nilai diagnostik PLR dan fibrinogen terhadap biopsi sebagai baku emas dalam
mendiagnosis keganasan pada penderita tumor padat. Uji diagnostik yang dilakukan akan mendapatkan hasil berupa titik potong (cut off), AUC, sensitifitas, spesifisitas, nilai duga positif (NDP), nilai duga negatif (NDN), rasio
kemungkinan positif (RKP), dan rasio kemungkinan negatif (RKN).
Bahan dan Metoda
Pasien
Data penelitian diambil dari rekam medis RSDM Surakarta pada bulan Februari 2013 – April 2013. Pemilihan subyek penelitian dilakukan secara consecutive
sampling (berurutan). Semua penderita tumor padat yang berusia 18-60 tahun
pre-operasi dan biopsi di Intalasi Bedah Onkologi dan Laboratorium Patologi
Anatomi dan melakukan pemeriksaan darah di Laboratorium Patologi Klinik akan disertakan dalam penelitian. Pasien dengan: (1) Penyakit infeksi/inflamasi akut
lainnya (ditandai dengan adanya peningkatan kadar leukosit >11.500/μL dan
kadar CRP >10mg /L), (2) riwayat penyakit infeksi/inflamasi kronis lainnya
seperti rheumatoid artritis, penyakit paru obstruktif kronik (PPOK), asma, infark miokard dan stroke iskemik (ishemia reperfusion injury), (3) riwayat penggunaan
commit to user
Pengukuran variabel
Sebelum operasi atau biopsi, pasien diambil darah vena sebanyak 2cc darah
dengan antikoagulan Ethylene Diamine Tetra Acetic (EDTA) untuk penilaian PLR, 2cc darah dengan antikoagulan sitras untuk pemeriksaan fibrinogen plasma
dan 2cc darah tanpa antikoagulan untuk pemeriksaan kadar serum CRP. Hasil biopsi akan dicatat sebagai tumor padat ganas jika ditemukan sel-sel ganas sedangkan jika tidak ditemukan dianggap sebagai tumor padat jinak.
Perbandingan antara jumlah trombosit dengan jumlah absolut limfosit diukur sebagai PLR. Jumlah trombosit dan limfosit diukur menggunakan metode flow
cytometry dengan alat Advia 120 Hematology Analyzer. Kadar fibrinogen diukur
secara otomatis menggunakan metode Clauss Clotting dengan alat STA Compact. Nilai PLR dan fibrinogen akan dicari titik potong optimalnya, kemudian pasien
akan dikelompokkan menjadi 2 kelompok. Kelompok positif jika memiliki nilai PLR atau fibrinogen di atas atau sama dengan titik potong, sedangkan kelompok
PLR negatif bila nilai PLR atau fibrinogen kurang dari titik potong. Analisis statistik
Data karakteristik subyek penelitian disajikan dalam bentuk deskriptif. Untuk
mengetahui pola distribusi data digunakan uji statistik Kolmogorov Smirnov. Titik potong nilai PLR dan kadar fibrinogen akan dinilai dengan menggunakan kurva
commit to user
untuk masing-masing nilai PLR dan kadar fibrinogen terhadap baku emas biopsi jaringan. Analisis statistik diolah menggunakan program komputer.
Hasil
Karakteristik pasien
Subyek penelitian yang berjumlah 60 orang, dengan pria sejumlah 17 orang
(28%) dan wanita sejumlah 43 orang (72%) memiliki rata-rata usia 46,98 ± 13,64
tahun. Usia minimum pasien pada penelitian ini adalah 22 tahun dan maksimum adalah 83 tahun. Data dari 60 orang subyek penelitian kemudian dikelompokkan
berdasarkan jenis tumornya, yaitu tumor padat ganas dan tumor padat jinak. Pada tabel 2 dapat dilihat distribusi nilai rerata kadar trombosit, limfosit, fibrinogen dan
nilai PLR berdasarkan hasil pemeriksaan biopsi, dimana biopsi positif mengandung sel ganas sedangkan pada biopsi negatif tidak ditemukan sel ganas. Tabel 1. Data karakteristik subyek penelitian
Parameter N % Rerata Minimum Maksimum
Jenis kelamin - Pria - Wanita 17 43 28 72
Umur (th) 46,98 ± 13,64 22 83
Trombosit (103/μL) 332,77 ± 75,84 218 580
Limfosit (103/μL) 2,10 ± 0,53 0,92 3,37
PLR 155,96 83,52 552,38
Fibrinogen (mg/dL) 378,60 ± 107,66 205 582
Tabel 2. Nilai rerata trombosit, limfosit, PLR dan fibrinogen berdasarkan hasil pemeriksaan biopsi
Parameter POSITIF
(tumor padat ganas)
NEGATIF
(tumor padat jinak) P
Trombosit (103/μL) 361,67 ± 80,34 303,78 ± 59,33 0,002*
Limfosit (103/μL) 2,03 ± 0,53 2,17 ± 0,52 0,319*
PLR 170,51 143,06 0,01**
Fibrinogen (mg/dL) 457,90 ± 88,31 299,30 ± 52,62 <0,001*
Ket: * uji T
commit to user
Dari hasil penelitian didapatkan bahwa kadar trombosit signifikan lebih tinggi pada pasien yang ditemukan sel ganas pada hasil biopsinya dibandingkan
dengan yang negatif (361,67 ± 80,34 x103/μL dan 303,78 ± 59,33 x103/μL; p=0,002). Kadar limfosit pada pasien tumor ganas memiliki nilai yang lebih
rendah jika dibandingkan dengan tumor padat jinak, tetapi perbedaan ini tidak signifikan (2,03 ± 0,53 x103/μL dan 2,17 ± 0,52 x103/μL; p=0,319).
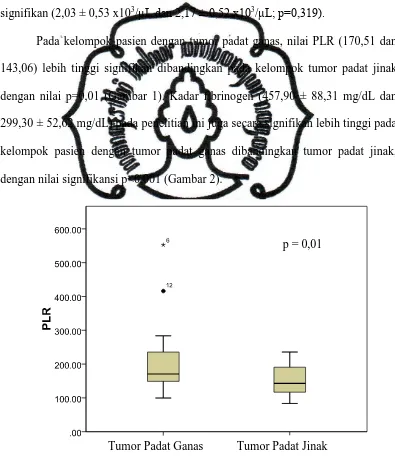
Pada kelompok pasien dengan tumor padat ganas, nilai PLR (170,51 dan
143,06) lebih tinggi signifikan dibandingkan pada kelompok tumor padat jinak dengan nilai p=0,01 (Gambar 1). Kadar fibrinogen (457,90 ± 88,31 mg/dL dan
299,30 ± 52,62 mg/dL) pada penelitian ini juga secara signifikan lebih tinggi pada kelompok pasien dengan tumor padat ganas dibandingkan tumor padat jinak, dengan nilai signifikansi p<0,001 (Gambar 2).
Gambar 1. Boxplot perbedaan nilai PLR antara tumor padat ganas dan jinak Tumor Padat Ganas Tumor Padat Jinak
commit to user
Gambar 2. Boxplot perbedaan kadar fibrinogen antara tumor padat ganas dan jinak
Uji diagnostik nilai PLR terhadap hasil pemeriksaan biopsi
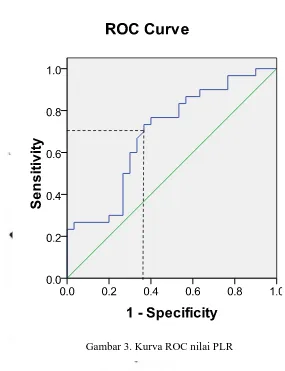
Dari kurva ROC didapatkan bahwa titik potong untuk nilai PLR adalah
155 dengan nilai AUC 0,69 (Gambar 3). Tabel uji diagnostik dengan menggunakan nilai potong 155 untuk PLR ditampilkan pada tabel 3. Nilai di atas
155 dianggap positif, sedangkan untuk nilai di bawah 155 dianggap negatif.
Tabel 3. Tabel uji diagnostik nilai PLR dan kelompok tumor padat berdasarkan hasil biopsi jaringan
Nilai PLR
Pemeriksaan biopsi jaringan
Jumlah POSITIF (N dan %)
(tumor padat ganas)
NEGATIF (N dan %) (tumor padat jinak)
>155 (POSITIF) 21 (70,0%) 11 (36,7%) 32 (53,3%)
< 155 (NEGATIF) 9 (30%) 19 (63,3%) 28 (46,7%)
Jumlah 30 (50%) 30 (50%) 60 (100%)
Tumor Padat Ganas Tumor Padat Jinak
Fib
rin
oge
n (mg/
d
L)
commit to user
Dari tabel uji diagnostik didapatkan bahwa sebanyak 32 orang dari 60 pasien memiliki nilai PLR > 155. Pada kelompok pasien yang positif tumor ganas,
sebanyak 21 (70%) orang pasien memiliki nilai PLR > 155. Dari sisa 28 orang yang memiliki PLR < 155, sebanyak 9 orang (30%) positif mengandung sel ganas pada hasil pemeriksaan biopsinya. Uji diagnostik kemudian dilakukan
menggunakan titik potong 155 untuk menilai sensitivitas, spesifisitas, NDP, NKN, RKP dan RKN. Hasil perhitungan uji diangostik dengan menggunakan titik
commit to user
Uji diagnostik kadar fibrinogen terhadap hasil pemeriksaan biopsi
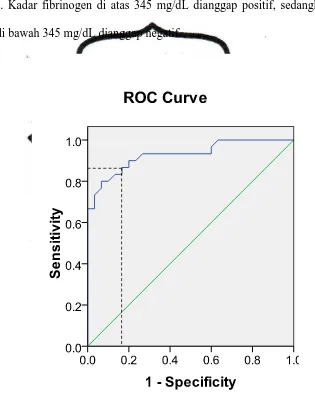
Dari kurva ROC didapatkan bahwa titik potong untuk kadar fibrinogen
adalah 345 mg/dL dengan nilai AUC 0,93 (Gambar 4) . Tabel uji diagnostik dengan menggunakan nilai potong 345 mg/dL untuk fibrinogen ditampilkan pada
tabel 8. Kadar fibrinogen di atas 345 mg/dL dianggap positif, sedangkan untuk kadar di bawah 345 mg/dL dianggap negatif.
Dari tabel uji diagnostik (tabel 4) didapatkan bahwa sebanyak 31 orang
dari 60 pasien memiliki kadar fibrinogen > 345 mg/dL. Pada kelompok pasien yang positif tumor ganas, sebanyak 26 (86,7%) orang pasien memiliki kadar
commit to user
fibrinogen > 345 mg/dL. Dari sisa 29 orang yang memiliki kadar fibrinogen < 345 mg/dL, sebanyak 4 orang (13,3%) positif mengandung sel ganas pada hasil
pemeriksaan biopsinya.
Tabel 4. Tabel uji diagnostik nilai PLR dan hasil pemeriksaan biopsi
Kadar fibrinogen
Pemeriksaan biopsi jaringan
Jumlah POSITIF (N dan %)
(tumor padat ganas)
NEGATIF (N dan %) (tumor padat jinak)
>345 mg/dL (POSITIF) 26 (86,7%) 5 (16,7%) 31 (51,7%)
< 345 mg/dL (NEGATIF) 4 (13,3%) 25 (83,3%) 29 (48,3%)
Jumlah 30 (50%) 30 (50%) 60 (100%)
Uji diagnostik kemudian dilakukan menggunakan titik potong 345 untuk menilai sensitivitas, spesifisitas, NDP, NKN, RKP dan RKN. Hasil perhitungan
uji diangostik fibrinogen dengan menggunakan titik potong 345 mg/dL adalah sebagai berikut: 87%, 83%, 84%, 86%, dan 0,16.
Analisis bertingkat PLR dan fibrinogen
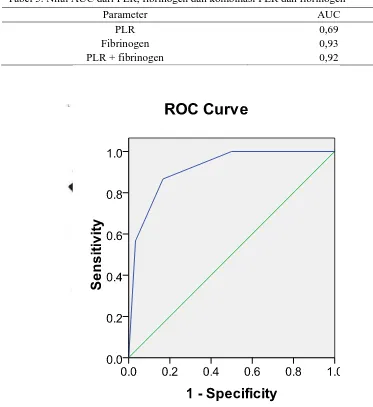
Analisis bertingkat dilakukan untuk mengetahui apakah nilai diagnostik PLR akan meningkat jika dikombinasikan dengan fibrinogen. Pada analisis kurva
ROC (gambar 5) didapatkan bahwa jika nilai PLR dikombinasikan dengan kadar fibrinogen, maka nilai diagnostik PLR akan meningkat dari lemah (AUC = 0,69)
menjadi menjadi sangat baik (AUC = 0,92).
Pada tabel 5 ditunjukkan nilai-nilai AUC untuk masing-masing parameter dan kombinasinya. Pada penelitian ini, meskipun nilai diagnostik PLR meningkat
jika dikombinasikan dengan pemeriksaan fibrinogen, dari hasil analisis menunjukkan bahwa nilai AUC kombinasi PLR dan fibrinogen tidak lebih baik
commit to user
sebagai marker tunggal memiliki nilai AUC paling tinggi jika dibandingkan PLR maupun PLR setelah dikombinasikan dengan fibrinogen.
Tabel 5. Nilai AUC dari PLR, fibrinogen dan kombinasi PLR dan fibrinogen
Parameter AUC
PLR 0,69
Fibrinogen 0,93
PLR + fibrinogen 0,92
Diskusi
Tumor padat tersusun atas sel tumor dan jaringan stroma yang mengalami
pertumbuhan abnormal, perubahan struktur atau proliferasi abnormal menjadi sel tumor ganas (Sarjadi, 1994; Acton, 2013). Pertumbuhan kanker pada tumor padat
commit to user
(Balkwill dan Mantovani, 2001; Morgan et al., 2004). Respon inflamasi yang terjadi dapat menyebabkan sel tumbuh dan berkembang ke arah keganasan
(Morgan et al., 2004; Colotta, 2009).
Respon inflamasi pada tumor padat dapat menyebabkan peningkatan jumlah
trombosit, penurunan jumlah limfosit dan peningkatan fibrinogen sehingga dapat menjadi penanda untuk respon inflamasi pada tumor padat ganas. Perbandingan antara jumlah trombosit dengan jumlah absolut dari limfosit disebut sebagai
platelet lymphocyte ratio.
Subyek penelitian yang berjumlah 60 orang, dengan pria sejumlah 17
orang (28%) dan wanita sejumlah 43 orang (72%) memiliki rata-rata usia 46,98 ±
13,64 tahun. Usia minimum pasien pada penelitian ini adalah 22 tahun dan maksimum adalah 83 tahun. Ferlah et al. (2012) menyebutkan bahwa insiden kanker 80-90% terjadi pada usia lebih dari 40 tahun, dimana rata-rata usia saat
kanker terdeteksi pertama kali adalah 65 tahun. Ferlay (2013) juga menyebutkan bahwa insiden kanker terjadi lebih tinggi pada pria dibandingkan wanita. Pada
penelitian ini, didapatkan bahwa kejadian kanker lebih banyak pada wanita kemungkinan dikarenakan populasi penderita tumor padat yang datang berobat ke RSDM adalah kebanyakan wanita dibandingkan pria.
Jumlah rerata trombosit pada seluruh pasien tumor padat masih dalam
batas normal, yaitu 332,77 ± 75,84 x103/μL, namun pada kelompok pasien tumor
padat ganas, jumlah trombosit lebih tinggi signifikan (p = 0,002) dibandingkan kelompok pasien tumor padat jinak (361,67 ± 80,34 x103/μL dan 303,78 ± 59,33
commit to user
Trombosit yang teraktivasi akan melepaskan TPO yang akan menstimulasi megakariosit di sumsum tulang untuk membentuk trombosit sehingga jumlah
trombosit akan meningkat. Folman et al. (2000) menyebutkan bahwa pada tumor padat, microenvironment tumor akan menyebabkan peningkatan respon inflamasi
sehingga trombosit yang teraktivasi semakin banyak, akibatnya jumlah TPO yang dilepas lebih tinggi sehingga dapat terjadi trombositosis.
Pada penelitian ini juga didapatkan jumlah rerata limfosit absolut adalah
2,10 ± 0,53 x103/μL, jumlah ini masih dalam batas nilai range normal (1,4 – 4
x103/μL). Jumlah rerata limfosit yang lebih rendah pada pasien tumor padat ganas jika dibandingkan dengan tumor padat jinak (2,03 ± 0,53 x103/μL dan 2,17 ± 0,52
x103/μL), meskipun tidak signifikan (p=0,319) sesuai dengan penelitian yang pernah dilakukan sebelumnya oleh Milne et al. (2012).
Rerata nilai PLR pada penelitian ini adalah 155,96. Penelitian sebelumnya
menyebutkan bahwa pada kasus keganasan, nilai PLR meningkat lebih dari 200 (Ghanim et al., 2014 ; Raungkaewmanee et al., 2012). Rerata kadar fibrinogen
pada penelitian ini masih dalam batas normal, yaitu 378,60 ± 107,66 mg/dL.
Nilai PLR merupakan penanda respon inflamasi yang mudah dan dapat
dinilai dari parameter pemeriksaan hematologi rutin (Yavuscan et al., 2013). Pada penelitian sebelumnya, PLR memiliki nilai prognostik dan merupakan penanda
yang sensitif pada kasus tumor padat seperti kanker payudara dan kanker ovarium (Raungkaewmanee et al., 2012; Azab et al., 2013). Pada penelitian ini, nilai PLR secara signifikan lebih tinggi pada kelompok pasien tumor padat ganas
commit to user
Nilai PLR dengan titik potong 155 memiliki nilai prognostik dengan sensitivitas sebesar 70%, spesifisitas sebesar 63% dan nilai AUC sebesar 0,693.
Nilai sensitivitas dan AUC pada penelitian ini lebih baik dibandingkan penelitian Raungkaewmanee et al. (2012) pada tumor ovarium, dimana nilai PLR hanya
memiliki sensitivitas dan AUC sebesar 59% dan 0,66. Meskipun demikian, sensitivitas PLR pada penelitian ini masih lebih rendah dibandingkan pada penelitian yang dilakukan Smith et al. (2008) yaitu sebesar 81%.
Pada penelitian ini, kadar fibrinogen juga lebih tinggi signifikan pada kelompok tumor padat ganas dibandingkan dengan kelompok tumor padat jinak
(457,90 ± 88,31 mg/dL dan 299,30 ± 52,62 mg/dL, p<0,001). Pada tumor padat ganas, sebagai respon terhadap inflamasi, terjadi peningkatan aktivitas proses koagulasi, sehingga pembentukan fibrin akan meningkat.
Kadar fibrinogen pada penelitian ini lebih tinggi signifikan pada kelompok pasien tumor padat ganas dibandingkan jinak. Hasil ini sesuai dengan penelitian
yang dilakukan oleh Blann et al. (2001) yang menyebutkan bahwa kadar fibrinogen signifikan lebih tinggi pada pasien tumor padat ganas payudara dibandingkan dengan kontrol. Menggunakan titik potong kadar fibrinogen sebesar
345 mg/dL, didapatkan pada hasil penelitian ini sensitivitas, spesifisitas dan nilai AUC sebesar 87%, 83% dan 0,93.
Keterbatasan dalam penelitian ini adalah kurang homogennya subyek penelitian. Ada banyak jenis tumor pada tumor padat, dan kemungkinan tiap tipe tumor memiliki karakteristik yang berbeda dalam menilai peran PLR dan
commit to user
dengan sampel yang lebih homogen dan karakteristik yang lebih spesifik untuk lebih dapat menilai peran PLR dan fibrinogen dalam mendiagnosis tumor padat
ganas.
Simpulan
Platelet lymphocyte ratio pada titik potong 155 memiliki nilai diagnostik yang
lemah untuk mendiagnosis tumor padat ganas sedangkan fibrinogen pada titik potong 345 mg/dL memiliki nilai diagnostik yang sangat baik. Nilai diagnostik
PLR meningkat dari lemah (AUC 0,69) menjadi sangat baik (AUC 0,92) jika dikombinasikan dengan fibrinogen dalam mendiagnosis keganasan pada pasien
tumor padat. Meskipun demikian, nilai kombinasi ini masih lebih kecil dibandingkan dengan pemeriksaan fibrinogen sebagai marker tunggal.
Daftar Pustaka
Acton QA. 2013. Solid Cancer: New Insight for the Healthcare Professional. Atlanta: Scholarly Editions. 1-37.
Aggarwal BB, Vijayalekshmi RV, Sung B. 2009. Targeting inflammatory pathways for prevention and therapy of cancer: short-term friend, long-term foe. Clin Cancer Res. 15:425–430.
Azab B, Shah N, Radbel J, Tan P, Bhatt V, Vonfrolio S. 2013. Pretreatment neutrophil/lymphocyte ratio is superior to platelet/lymphocyte ratio as a predictor of long-term mortality in breast cancer patients. Med Oncol. 30: 432. Balducci L, Lyman GH, Ershler WB, Extemann M. 2004. Physiological Basics of Aging
and Geriatrics. United Kingdom: Taylor & Francis. 237-239.
Balkwill F, Mantovani A. 2001. Inflammation and cancer: back to Virchow? Lancet. 357(9255):539-45.
Ben-Neriah Y, Karin M. 2011. Inflammation meets cancer, with NF- κB as the matchmaker. Nat Immunol. 12:715 – 723.
Blann AD, Gurney D, Wadley M, Bareford D, Stonelake P, Lip GY. 2001. Increased soluble P-selectin in patients with haematological and breast cancer: a comparison with fibrinogen, plasminogen activator inhibitor and von Willebrand factor. Blood
Coagul Fibrinolysis. 12:43-50.
Budiarto E. 2002. Metodologi Penelitian Kedokteran: Sebuah Pengantar. Jakarta: EGC. 184-195.
Chaurasia R, Jain A. Tumour Self Assessment & Review. New Delhi: Shri Bhupesh Arora. 1-28.
commit to user
Compton CC, Byrd DR, Aguilar JG. 2012. Cancer Staging Atlas: A Companion to the
Seventh Editions of the AJCC Cancer Staging Manual and Handbook. London:
Springer. 3-22.
Condeelis J, Pollard JW. 2006. Macrophages: obligate partners for tumor cell migration, invasion, and metastasis. Cell. 124:263–266.
Coussens ML, Aitvogel L, Palucka AK. 2013. Neutralizing tumor-promoting chronic inflammation: a magic bullet? Science. 339:286 – 291.
Erpenbeck L, Schön MP. 2010. Deadly allies: the fatal interplay between platelets and metastasizing cancer cells. Blood. 115(17):3436 – 3427.
Ferlah U, Soerjomataram I, Ervik M, Dikshit R, Eser S. 2012. Cancer Incidence and
Mortality Worldwide. Available at:
Ferlay J, Foucher ES, Tieulent JL, Rosso S, Coebergh JWW, Comber H, Forman D. 2013. Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012. European Journal of Cancer. 49:1374-1403.
Folman CC, Linthorst GE, van Mourik J, van Willigen G, de Jonge E, Levi M, de Haas M, et al.. 2000. Platelets release thrombopoietin (Tpo) upon activation: another regulatory loop in thrombocytopoiesis? Thromb. Haemost. 83: 923–930.
Gahvane YN, Shete AS, Bhagat AK, Shinde VR, Bhong KK, Khairnar GA, Yadav AV. 2011. Solid tumors: facts, challenges and solution. Int J of Pharma Sciences and
Research. 2(1):1-12.
Ghanim B, Hoda MA, Klikovits T, Winter MP, Grusch M, Dome B, Arns M, et al. 2014. Circulating fibrinogen is a prognostic and predictive biomarker in malignant pleural mesothelioma. British Journal of Cancer. 110:984-990.
Greer JP, Arber DA, Glader N, List AF, Means RT, Paraskevas F, Rodgers GM. 2013.
Wintrobe’s Clinical Hematology 13th edition. Philadelphia: Lippincott Williams &
Wilkins. 1161-1162.
Grivennikov SI, Greten FR, Karin M. 2010. Immunity, inflammation and cancer. Cell. 140(6):883 – 899.
http://www.wcrf.org/cancer_statistics/world_cancer_statistics.php. (Diunduh 26 Maret 2014.
Jain SK, Stoker DL. 2013. Basic Surgical Skills and Techniques. New Delhi: Jaypee Brothers Medical Publishers. 90-95.
Jankowski JAZ. 2011. Inflammation and Gastrointestinal Cancer. New York: Springer Verlag. 2-18.
Labelle M, Begum S, Hynes RO. 2011. Direct Signaling between Platelets and Cancer Cells Induces an Epithelial-Mesenchymal-Like Transition and Promotes Metastasis.
Cancer Cell. 20:576–590.
Lee S, Oh SY, Kim SH, Lee JH, Kim MC. 2013. Prognostic significance of neutrophil lymphocyte ratio and platelet lymphocyte ratio in advanced gastric cancer patients treated with FOLFOX chemotherapy. Cancer. 13:350 – 361.
Li XJ, Wu QF, He DL, Fu JK, Jin X. 2014. Proteomic profiling of serum from stage I lung squamous cell carcinoma patients. Asian Pacific J Cancer Prev. 14(4):2273-2276.
Mantovani A, Allavena P, Sica A, Balkwill F. 2008. Cancer-related inflammation.
Nature. 454:436–444.
Manuaba TW. 2010. Panduan Penatalaksanaan Kanker Solid PERABOI 2010. Jakarta: CV Sagung Seto. 3-13.
commit to user
Morgan DW, Forrsmann UJ, Nakada MT. 2004. Cancer and Inflammation. Switzerland: Birkhäuser Verlag. 1-19.
Polanski M, Anderson NL. 2006. A list of candidate cancer biomarkers for targeted proteomics. Biomarkers Insights. 2:1-48.
Porth CM. 2011. Essentials of Pathophysiology: Concepts of Altered Health States. Philadelphia: Lippincot Williams & Wilkins. 61-66.
Raungkaewmanee S, Tangjitgamol S, Manusirivithaya S, Srijaipracharoen S, Thavaramara T. 2012. Platelet to lymphocyte ratio as a prognostic factor for epithelial ovarian cancer. J Gynecol Oncol. 23: 265-273.
Riskesdas. 2013. Riset Kesehatan Dasar 2013. Available at:
http://depkes.go.id/downloads/riskesdas2013/Hasil%20Riskesdas%202013.pdf (Diunduh 15 April 2014).
Sarjadi. 1994. Patologi Umum dan Sistemik. Jakarta. Penerbit Buku Kedokteran EGC. 260 – 267.
Scheel C, Onder T, Karnoub A, Weinberg RA. 2007. Adaptation versus selection: the origins of metastatic behavior. Cancer Res. 67, 11476–11479, discussion 11479– 11480.
Serhan CN, Ward PA, Gilroy DW. 2010. Fundamentals of Inflammation. New york: Cambridge University Press. 1-28.
Simpson-Haidaris PJ, Rybarczyk B. 2001. Tumors and fibrinogen. The role of fibrinogen as an extracellular matrix protein. Ann NY Acad Sci. 936:406-25.
Smith RA, Bosonnet L, Raraty M, Sutton R, Neoptolemos JP, Campbell F, Ghaneh P. 2009. Preoperative platelet-lymphocyte ratio is an independent significant prognostic marker in resected pancreatic ductal adenocarcinoma. Am J Surg. 197(4):466 – 472. Solinas G, Germano G, Mantovani A, Allavena P. 2009. Tumor-associated macrophages
(TAM) as major players of the cancer-related inflammation. J Leukoc Biol. 86:1065 – 1073.
Tranum BL, Haut A. 1974. Thrombocytosis: platelet kinetics in neoplasia. J Lab Clin
Med. 84(5): 615-619.
Verheul HM, Hoekman K, Lupu F, Broxterman HJ, van der V, Kakkar A K, Pinedo HM. 2000. Platelet and coagulation activation with vascular endothelial growth factor generation in soft tissue sarcomas. Clin. Cancer Res. 6: 166 –171.
Yavuzcan A, Çağlar M,Üstün Y, Dilbaz S, Özdemir I, Yıldız E, Özkara A, Kumru S.
2013. Evaluation of mean platelet volume, neutrophil/lymphocyte ratio and platelet/lymphocyte ratio in advanced stage endometriosis with endometrioma. J
Turkish-German Gynecol Assoc. 14: 210-5.