S K R I P S I
ENY NURYANI
PENUMBUHAN KALUS OlOSCOREA PENTAPHYLLA L. DAN
KALUS AGAVE AMANlENStS TREL.& NOWELL PADA MEDIA CAIR
DAN DETEKS1 STEROIQNYA
M I L I K
P L R P U S i A K A A N U N I V t i * u l A S A l K L A N G w v ’
b L K B \ Y A
r f wr/ft
i/ltA
FAKULTAS FARMASI UNIVERSITAS AIRLAMGGA
S U R A B A Y A
SKRIPSI
DIBUAK UNTUK MEMENUHI TUGAS AKHTH? MENO'APAI GELAR SAltJANA PARMASI
PADA I^AKULTAS PARMASI ONIVEESITAS' AIRLANGCT
SURABAYA
1991
oleh
ENY NURYANI
RATA PENGANTAR
Segala puji dan syukur saya panjatkan pada Allah swt yang telah melimpahkan rahmatHya, sehingga saya da- pat menyelesaikan tugas raenyusun skripsi ini sebagai salah satu syarat mencapai gelar sarjana pada Fakultas Farmasi Universitas Airlangga.
Hasil yang diperoleh dari skripsi ini sangat seder- hana dan jauh dari sempuma* Tetapi saya berharap hasil yang sederhana ini dapat bermanfaat bagi penelitian- penelitian selanjutnye. dan bagi pihak-pihak yang membu- tuhkan.
Untuk itu perkenankanlah pada kesempatan ini saya mengucapkan rasa terima kasih yang tulus dan sedalam- dalamnya kepada Almamater Fakultas Farmasi Universitas Airlangga yang telah memberi kesempatan belajar dan mendidik saya selama ini*
Terima kasih saya sampaikan pula kepada Bapak DR* G-unawan Xndrayanto, Ibu Dra. Wahyu Utami, MS sebagai pembimbing, yang telah banyak raeluangkan waktu untuk membimbing, memberi saran, pengarahan serta dorongan moral yang sangat berharga selama saya nelakukan pene- litian hingga selesainya penulisan skripsi ini.
Kepada Dekan Fakultas Matematika dan Ilmu Pengeta- huan Alam Universitas Airlangga, Ketua Jurusan Biologi
laboratorium.
Ketua Jurusan Biologi Farmasi dan Laboratorium Bio teknologi Fakultaa Farmasi TJniversitas Airlangga yang telah menyediakan fasilitas selama penelitian.
Tidak lupa kepada Bapak dan Ibu Dosen, rekan-rekan mahasiswa dan semua pihak yang telah memberi dorongan moral dan bantuan, saya sampaikan rasa terima kasih yang
setulus-tulusnya. Semoga segala amal baik yang telah di berikan mendapat balasan yang melimpah dari ALLAH SWT. Amin.
Surabaya, Agustus 1991 Penyusun
DAFTAR ISI
KATA PENGANTAR ...ii
BAFTAR ISI ... ... .iv
DAFTAR TABEL ...viii
DAFTAR GAMBAR ...ix
DAFTAR LAMPIRAN ...xi
BAB I PENDAHULTJAN ... .1
BAB II TIKJAUAN PTJSTAKA ... .6
I.'Kultur jaringan tanaman ... . 6
II. Faktor-faktor yang mempengaruhi pertumbuhan kultur jaringan
II.1.4. Agar-agar yang dipergunakan .... 11
11.2..Kondisi lingkungan ... . 11
11.2.1. pH media ... . 11
11.2.2. Teraperatur dan cahaya 12
11.2.3. Kecepatan agitasi untuk kultur suspensi ... .13
11.2.4. Tek3tur kalus 14 Halaman
IV. Tinjauan tentang Agave
ama-nienais Trel.& Nowell ... ... 16
V* Deteksi steroid ... ... 17
BAB III. METODOLOGI PENELITIAN ... ... 18
I. Alat yang dipergunakan .... ... 18
II. Bahan ... ... 18
11.1. Bahan kiraia yang dipergunakan .. 18
11.2. Bahan percobaan ... ... 19
III. Tahapan kerja ... ... 20
111.1.1. Pembuatan media padat ... 21
111.1.2. Pembuatan media kultur permukaan ... ... 21
111.1.3. Pembuatan media kultur "pilter paper Bridge t! Technique 22 111.1.4. Pembuatan media kultur suspensi ... . 22
III.2* Memperbanyak kalus ... . 23
III.3.1. Peraindahan kalus kedalam media kultur permukaan .... 23
111.3*2. Pemindahan kalus pada rt
kultur Filter Paper Bridge I!
Technique ... 24
III.3.3. Pemindahan kalus pada
media kultur suspensi ... 24
III.4. pemeriksaan kalus ... . 25
III-4.1. Pemeriksaan kalus secara
visual ... 25
111.4.2. Penghitungan indeks per
tumbuhan kultur permukaan .... 25
111.4.3. Penghitungan indeks per-n
tumbuhan kultur Filter
Paper Bridge Technique" ... 26
111.4.4. Penghitungan indeks per
tumbuhan kultur suspensi ... 26
III.5. Deteksi steroid dari kalus
secara KLT ... 27
BAB XV HASIL PENELITIAN ... 28
1. Pemeriksaan kalus secara visual .... 28
2. Penghitungan indeks pertumbuhan
kalus ... ... 33
3. Deteksi steroid pada kalus ... 35
1.1. Perlakuan pada kultur permukaan .. 51
ti 1.2. Perlakuan pada kultur Filter paper Bridge Technique ....•••• 52
1.3. Perlakuan pada kultur suspensi .. 53
2. Deteksi steroid dalam kalus ...54
BAB VI KESIMPULAN ... .55
BAB VII SARAN - SARAN ... .56
BAB VIII RINGKASAN ... .57
BAB IX KEPUSTAKAAN ... .58
DAFTAR TABEL
1* Pemeriksaan kalus secara visual ... 28
2. Data makroskopis kalus Diosoorea
pentaphylla L ... . 29
3. Data makroskopis kalus Agave
ama-nlensis Trel.& Nowell ... 30
4. Indeks Pertumbuhan kalus Diosoorea
pentaphylla L . •... 33
5* Indeks Pertumbuhan kalus Agave
amaniensis Trel.& Nowell ... 34
6. Hasil KLT ekstrak chloroform kalus
Diosoorea pentaphylla L ... ... . 44
7. Hasil KLT ekstrak chloroform kalus Dios
corea pentaphylla L sesudah dihidrolisa •. 46
8. Hasil KLT ekstrak chloroform kalus
Agave amaniensis .. ... *. 47
9# Hasil KLT ekstrak chloroform kalus
Agave amaniensis Trel.& Nowell se
sudah dihidrolisa ... 49
TABEL Halaman
1. Kalus Dioscorea pentaphylla L
berumur 8 minggu ... 31
2. Kalus Agave amaniensis Trel.& Nowell
berumur 4 minggu ... ... 32
3* Kromatogram ekstrak chloroform kalus
Dioscorea pentaphylla L* Fase gerak
n-heksan : etyl asetat = 4 : 1 ... 36
4* Kromatogram ekstrak chloroform kalus
Dioscorea pentaphylla L. Fase gerak
chloroform : etyl asetat = 9 : 1 ... 37
5. Kromatogram ekstrak chloroform kalus
Dioscorea pentaphylla L sesudah dihi- drolisa. Fase gerak n-heksan ; etyl
asetat = 4 : 1 ... ... . 38
6. Kromatogram ekstrak chloroform kalus
Dioscorea pentaphylla L sesudah dihi- drolisa. Fase gerak chloroform : etyl
asetat = 9 : 1 ... ... 39
7* Kromatogram ekstrak chloroform kalus
Agave amaniensis Trel.& Nowell. Fase
gerak n-heksan : etyl asetat = 4 : 1 .... 40
GAMBAR Halaman
8* Kromatogram ekstrak chloroform kalus
Agave amaniensis Trel.& Nowell. Fase
gerak chloroform : etyl asetat « 9 : 1 .. 41
9* Kromatogram ekstrak chloroform kalus
Agave amaniensis Trel.& Nowell
sesudah dihidrolisa. Pase gerak n-heksan
: etyl asetat = 4 : 1 ... . 42
10. Kromatogram ekstrak chloroform kalus Agave amaniensis Trel.& Nowell sesu
dah dihidrolisa. Pase gerak chloroform
etyl asetat = 9 : 1 ... ... 43
1. Koraposisi kimiawi media MS ... 61 2* Komposisi penampak noda anisaldehida
sulfat ... ... 62
3* Perbandingan antara IP rata-rata kultur padat dengan IP rata-rata kultur per
mukaan (agar-agar 0,3 %) dari kalus
Dioscorea pentaphylla L ... 63
4- Perbandingan antara IP rata-rata kultur padat dengan IP rata-rata kultur per
mukaan (agar-agar 0,4 %) dari kalus
Dioscorea pentaphylla L ... 66
5. Perbandingan antara IP rata-rata kultur padat dengan IP rata-rata kultur per
mukaan (agar-agar 0,5 %) dari kalus
Dioscorea pentaphylla L ... 69
6. Perbandingan antara IP rata-rata kultur padat dengan IP rata-rata kultur Filter
t t
Paper Bridge Technique dari kalus Dios
corea pentaphylla L ... ... 72
7. Perbandingan antara IP rata-rata kultur padat dengan IP rata-rata
kultur permukaan (agar-agar 0,3 %) dari
kalus Agave amaniensis Trel.& Nowell .... 75
8. Perbandingan antara IP rata-rata kultur padat dengan IP rata-rata
kultur permukaan (agar-agar 0,4 %) dari
kalus Agave amaniensis Trel.& Nowell .... 78
9. Perbandingan antara IP rata-rata kultur padat dengan IP rata-rata
kultur permukaan (agar-agar 0,5 %) dari
kalus Agave amaniensi3 Trel.& Nowell .... 81
10. Perbandingan antara IP rata-rata kultur padat dengan IP rata-rata
f t M
kultur Filter Paper Bridge Technique dari kalus Agave amaniensis Trel.& No
well ... ... 84
11. Tabel nilai t ... 87
LAMPIRAH Halaman
1. Latar belakang.
Dewasa ini istilah bioteknologi sangat ramai di-
perbincangkan, baik dal am bentuk seminar maupun da-
lam bentuk media masa.
Secara etimologi, dapat dikatakan bahwa bioteknologi adalah ilmu rekayasa makhluk/jasad hidup. Sehingga secara umum dapat dibedakan atas bioteknologi hewan dan bioteknologi tanaman*
Bioteknologi tanaman telah berkembang wawasannya bukan hanya untuk mendapatkan tanaman yang toleran terhadap lingkungan, tanah, iklim serta resisten terhadap hama dan penyakit, tetapi juga bertujuan menaikkan produksi metabolit sekunder*(1)
Berbagai teknik dikembangkan untuk mencapai tujuan tersebut. Satu diantaranya dengan teknik kul tur jaringan*
Kultur jaringan tanaman didasarkan pada konsep yang dikemukakan oleh Schleiden dan Schwann (1838) yang menyatakan bahwa organisme terdiri dari sel.
Sel sebagai kesatuan biologis terkecil yang mampu mengadakan segala aktifitas yang berhubungan dengan hidup seperti metabolisme, reproduksi dan tumbuh.
2
Julius Sachs (1865) mengemukakan bahwa proses per tumbuhan terjadi pada sel-sel maristimatis yang be- lum terdiferensiasi. Didaerah meristem ini pertumbuh an berlangsung karena pembelahan sel, pertambahan plasma, pembesaran atau perpanjangan sel.
Diluar daerah meristem baru terjadi diferensiasi. Pada tahap ini akan terjadi berbagai macam bentuk dan ukuran sel yang sesuai dengan fungsinya. Selan- jutnya akan terbentuk individu baru yang sempurna. Kemampuan regenerasi dari tumbuhan ini yang oleh Haberlandt (1902) dan kemudian oleh Sinnott (1950)
disebut totipotent.(2)
Haberlandt dengan penelitiannya yang berjudul "Expe riments on the culture of isolated plant cells" te lah berhasil menanam sel yang diisolasi dari jaring an tanaman pada medium yang mengandung suatu nutrien
(secara in vitro).(3)
Secara umum pertumbuhan kultur jaringan tanaman dipengaruhi oleh 2 faktor, yaitu : (4)
- Kondisi lingkungan kultur jaringan selama inku basi.
- Media kultur jaringan.
Sedangkan media kultur jaringan tanaman, pada dasar- nya terdiri dari senyawa kimia yang secara alami di- butuhkan oleh sel untuk kelangsungan hidupnya.
Umumnya digunakan media Murashige-Skoog dengan penam- bahan agar-agar untuk membuat media berbentuk gel. Tetapi pemakaian agar-agar dengan konsentrasi yang tinggi dapat mempengaruhi difusi nutrien dan gas yang akhirnya dapat menghambat pertumbuhan kultur jaringan tanaman.(5)
Maka perlu dicoba berbagai alternatif penanaman ja ringan tanaman, baik pada media MS dengan konsentrasi agar-agar yang lebih rendah maupun tanpa penambahan agar-agar, antara lain :
1. Penanaman pada kultur permukaan.
2. Penanaman dengan cara filter Paper Bridge
tr
Technique .
3* Penanaman pada kultur suspensi.
Kultur permukaan merupakan cara penanaman pada
media dengan konsentrasi agar-agar 0,2 - 0,5 %•
Dengan konsistensi media yang lunak, difusi nutrien oleh sel akan lebih mudah.
4
oleh sel jaringan tanaman tersebut. Heller memper-kenalkan metode ini. Phillips dan Dodds memperguna-kannya setelah kertas saring diimpregnasi dengan
nu-n f t
tnsi. Mereka menyebutnya Nurse culture •
Goodwin (1966) mempergunakan metode tersebut untuk isolasi kultur meristem pucuk dari Solanum tuberosum dan menamakannya sebagai "Filter Paper Bridge Tech nique". (3)
Bila kultur jaringan tanaman ditumbuhkan pada media cair, misalnya dalam erlenmeyer dan diagitasi
dengan kecepatan pemutaran tertentu maka akan dipe- roleh kultur suspensi.
Jika keadaan sesuai dengan yang dibutuhkan, maka
agregat dari sel dapat pecah menjadi sel tunggal yang disebut kultur sel.
Seperti halnya mikro-organisme maka kultur sel dapat ditumbuhkan pada fermentor/bioreaktor dari liter sampai puluhan liter pada skala industri.
Sedangkan untuk skala laboratoris, kultur suspensi dapat dilakukan pada erlenmeyer, dan diagitasi meng- gunakan shaker.(4)
Secara umum penanaman kalus pada media cair
2. Permasalahan.
Berubahnya lingkungan dan komposiai media dapat mempengaruhi kecepatan pertumbuhan dan kandungan me- tabolit kultur jaringan tanaman.
Maka dengan mencoba mengubah-ubah konsistensi media diharapkan dapat pula mengubah kecepatan pertumbuhan kalus Dioscorea pentaphylla L dan kalus Agave amani
ensis Trel.& Nowell yang telah dikembangkan pada La- boratorium Bioteknologi Universitas Airlangga yang selama ini lambat pertumbuhannya.
Walaupun dalam penelitian sebelumnya telah diketahui bahwa dalam kultur kalus tersebut mengandung steroid, namun adanya steroid pada kultur cair masih harus di- teliti kembali.
3. Tujuan.
BAB II TINJAUAN PUSTAKA
I. Kultur jaringan tanaman.
Metode kultur jaringan tanaman adalah metode iso Iasi dan pemeliharaan sel, jaringan atau organ tanam an yang dipisahkan dari lingkungan alamiahnya dan di
tanam pada media yang sesuai dal am keadaan steril,
sehingga sel-sel tersebut mampu mengadakan pembelah- an dan pertambahan plasma.(6,7)
Pembelahan sel ini menghasilkan sekelompok sel yang tidak terdiferensiasi yang disebut kalus.
Bila kalus tersebut dipindahkan kedalam media yang baru dengan komposisi yang cocok dan dengan pe- nambahan hormon pertumbuhan yang sesuai, maka akan
terjadi diferensiasi, yang selanjutnya akan terben- tuk individu baru seperti tanaman induknya.
Kultivasi kalus pada media cair menghasilkan kul tur cair, yang dapat dilakukan pada bermacam-raacam metode, diantaranya :
- Kultur permukaan.
- Kultur "Filter Paper Bridge Technique".(3)
- Kultur suspensi, Yang dapat dibedakan atas ska la pembuatannya, yaitu :(4,5)
- Skala laboratoris pada erlenmeyer. - Skala industri pada fermentor.
jaringan pada kultur cair, khususnya kultur suspensi lebih baik dari pada pertumbuhan pada media padat* Hal ini disebabkan adanya faktor s
- permukaan sel jaringan yang kontak dengan me dia cair lebih luas jika dibandingkan pada media padat.
- Adanya pengadukan pada kultur suspensi akan mempermudah transport massa dan oksigen keda lam sel.
II. Faktor-faktor yang mempengaruhi pertumbuhan kultur jaringan tanaman.
1. Media kultur jaringan : 1.1. Komposisi media. 1.2. Sumber glukosa. 1*3* Hormon pertumbuhan.
1*4. Agar-agar yang dipergunakan.
2. Kondisi lingkungan kultur jaringan selama inku- basi.
2.1. pH media.
2.2. Temperatur dan cahaya.
8
11.1. Media kultur jaringan.
Untuk pertumbuhan kultur jaringan diperlukan media yang tepat dan harus memenuhi kebutuhan per tumbuhan,proliferasi dan biosintesanya.
Untuk itu dalam pembuatannya harus memenuhi unsur unsur hara yang lengkap.
11.1.1. Komposisi media.
Komposisl normal media menurut kebutuhan nutrisi kultur jaringan tanaman adalah sebagai berikut :(6)
- Sumber karbon :
- Makro elemen an-organik s
- Mikro elemen an-organik :
- Vitamin
- Fitohormon
sukrosa, glukosa, fruktosa, laktosa. N03 , NH4 , K # Ca Mg , S04.
bermacam-macam lo- gam berat, misalnya Co, Cu, Mo dan lain - lain.
tiamin, piridoksin, m-inositol, nikoti- namid.
Pada tanaman yang autotrop, sumber energi didapat dari hasil fotosintesis dari karbon. Pada kultur jaringan tanaman selnya tidak menga lami proses autotropi yang dapat menghasilkan karbon, maka dalam kultur jaringan diperlukan sumber karbon pengganti yang sesuai untuk sum- ber energi.
Sumber karbon yang biasa dipakai ialah su-
krosa dengan konsentrasi 2-5 %* Glukosa dan fruk
tosa juga sering dipakai pada beberapa kultur. Penelitian yang dilakukan oleh Rokem dkk. menun
jukkan bahwa pemakaian sukrosa pada berbagai media dan konsentrasi ternyata mempengaruhi
tingkat pertumbuhan dan produksi diosgenin pada kultur suspensi Dioscorea deltoidea, dimana di- dapatkan hasil yang maksimum pada media Murashi ge dan Skoog dengan pemakaian sukrosa 30 gram/ liter.(8)
11.1.3. Hormon pertumbuhan.
10
n n
sitokinin, giberelin, abscisic acid dan ethy- len. Dari komponen-komponen tersebut, auksin dan sitokinin diketahui mempunyai peranan yang lebih besar pada tanaman,(5)
Sel-sel atau jaringan tertentu pada tanaman mampu memproduksi auksin dan sitokinin, yang ke mudian dibawa ke "site of action” untuk mengon- trol pertumbuhan tanaman* Tetapi tidak semua sel mampu memproduksi komponen tersebut.(5) Hal ini disebabkan walaupun sel tanaman mempu nyai informasi genetik untuk mensintesa auksin dan sitokinin, tapi tidak semua sel mampu meng- ekspresikan informasi untuk mensintesa komponen tersebut.Oleh sebab itu sebagian besar sel ta naman yang ditanam pada kultur jaringan tanaman memerlukan penambahan auksin dan sitokinin dari luar untuk mengontrol pertumbuhan dan pembelah- an sel.(5)
Kinetin (furfuryl amino purine) merupakan hor- mon golongan sitokinin yang mempunyai peranan menginduksi pembelahan sel. Sedangkan IAA (in dole 3 acetic acid), NAA (naphtalene acetic a- cid) dan 2,4-D (dichloro-phenoxy acetic acid) merupakan hormon golongan auksin yang banyak menimbulkan aktifitas fisiologis seperti merang
II*1.4* Agar-agar yang dipergunakan.
Agar-agar merupakan substansi koloid yang bersifat hidrofilik. Diekstraksi dari Gelidium cartilagenum (Gelidiaceae), Gracilaria confer- voides (Phaerococaceae) dan alga lain yang ter- masuk dalam Rhodophyceae.(9)
Pada pembuatan media kultur jaringan tanam an, agar-agar dipergunakan sebagai bahan pemben tuk gel* Konsentrasi yang sering dipergunakan
adalah 1 % b/v.
Naraun pada konsentrasi yang tinggi agar- agar mempengaruhi difusi nitrisi dan gas yang akhimya akan menghambat pertumbuhan kultur ja ringan itu sendiri.(3,5)
II.2* Kondisi lingkungan. II.2*1. pH media.
IV*. A L- 1 PtUi'Uii A.vAAW
" U N I V f c K a l ' i A S A I K l A N G O A -
S U R A B A Y A
Pada beberapa media kultur jaringan tanam an ditambah dengan dapar phosphat untuk mence- gah adanya perubahan pH, baik selama proses sterilisasi maupun dalam pertumbuhan.
11.2*2. Temperatur dan cahaya.
Kultur jaringan tanaman akan tumbuh dengan baik pada suhu antara 20 - 28°C dengan suhu op timum 27°C. Sedangkan untuk kultur suspensi su hu optimalnya berkisar antara 23 - 28°C.(10)
Cahaya dapat memberikan efek yang bermacam- macam pada kultur jaringan. Pada umumnya kultur jaringan tanaman memerlukan pencahayaan yang merata, seperti yang dilaporkan oleh Blakerly
11.2,3. Kecepatan agitasi untuk kultur suspensi.
Seperti halnya mikro-organisme, sel tanaman dapat ditumbuhkan pada media cair yang disertai dengan pengadukan. Namun hal ini tidaklah mudah, karena ada perbedaan antara sel mikro-organisme
dengan sel tanaman,
Sifat sel tanaman yang menghambat aplikasi kultur jaringan tanaman untuk kultivasi secara besar-besaran pada skala industri adalah waktu duplikasi yang lama, sel dalam bentuk agregat dan sifat sel tanaman yang sensitif terhadap gaya geser,(4)
Untuk menghindari gaya geser yang besar, para peneliti menganjurkan penggunaan "Air Lift FermentorT. Namun disisi lain kerugian penggu naan sistem ini adalah sukar untuk mendapatkan pengadukan yang homogen bila jumlah sel sangat besar. Hal ini dapat mengganggu transport masa dan oksigen kedalam sel.(4)
Rokem dkk. melaporkan bahwa kultur suspensi Dioscorea deltoidea memerlukan aerasi yang ren- dah, tidak tumbuh jika digunakan fermentor yang diagitasi dengan stirer.(8)
14
volume juga merapengaruhi besarnya oksigen yang terlarut pada medianya.
II.2.4* Tekstur kalus.
Keberhasilan pembuatan kultur suspensi juga tergantung dari tekstur kalus yang dimasukkan kedalam media, Makin kompak atau keras kalus maka makin sukar untuk mendapatkan kultur sus pensi. Seperti yang dilaporkan oleh Sato dan Yamada bahwa produksi berberine yang tinggi ter nyata dihasilkan oleh agregat sel yang kecil dari kultur sel Coptis japonica.(11)
Hal ini mungkin ada hubungannya dengan ke- adaan sel tanaman yang berbentuk agregat yang dapat menyebabkan pengadukan menjadi tidak homo gen. Pengadukan yang tidak homogen akan mengham bat transport massa dan oksigen kedalam sel.
III. Tinjauan tentang Diosoorea pentaphylla L dan meta- bolit sekundernya.
Tanaman Dioscorea dibeberapa negara dikenal
h n
dengan nama Yam . Merupakan sumber yang penting untuk pembuatan hormon, misalnya hormon corti- son. (12)
Kandungan tanaman Dioscorea sangat bervari- si, tergantung spesiesnya. Umumnya mengandung glikosida saponin, sterol, tanin, trigliserida dan komponen yang lain.
Sedangkan kedudukan sistematis tanaman ini
adalah :(13,14)
16
IV, Tinjauan tentang Agave amaniensis Trel.& Nowell.
Tanaman Agave amaniensis Trel.& Nowell me- rupakan tanaman yang tahan terhadap kekering- an. Dapat tumbuh dengan baik didaerah tropis maupun subtropis, Mempunyai nilai ekonomi un
tuk diambil seratnya. Sedangkan di Indonesia jenis ini ditanam sebagai tanaman hias.
Agave amaniensis Trel.& Nowell mengandung senyawa sterol, hekogenin, diosgenin dan se- nyawa lain yang belum diketahui.
Klasifikasi tanaman Agave amaniensis Trel.fc Nowell adalah sebagai berikut : (13,14)
Divisi
V, Deteksi steroid.
Sterol yang terdapat pada kultur jaringan tanaman dikenal sebagai phytosterol (sitoste rol, stigraasterol dan kampesterol). Tetapi yang
terbanyak diketemukan adalah sitosterol dan stigmasterol, Pada tanaman, sterol dapat menga- lami transformasi menjadi saponin steroid,(5)
Adanya sterol bebas dalam kalus dapat dide teksi secara KLT dari ekstrak chloroform, se- dangkan sterol yang berasal dari hidrolisa gli- kosida steroid dideteksi dari ekstrak chloro
FAB III
METODOLOC-I PENELITIAN
I. Alat yang dipergunakan :
- Laminar air flow cabinet. - Timbangan.
- pH meter. - Autoclave.
- Shaking incubator. - Erlenmeyer 250 ml. - Botol kultur.
- Fermentor buatan sendiri. - Kiselgel 60 F 254.
II. Bahan.
II.1. Bahan kiroia yang dipergunakan.
Media yang dipergunakan adalah media Murashige & Skoog (MS) (1974).
Semua bahan kimia yang dipergunakan adalah produksi E Merck Damstadt dengan derajat
N _ _ . t !
Pro Analisa .
Hormon pertumbuhan yang dipergunakan ada lah Kinetin (Fluka) dan hormon 2,4-D (Sig ma) .
Konsentrasi hormon kinetin yang dipergunakan untuk pertumbuhan kultur Diosoorea centa- phylla L adalah 2 ppm, sedangkan untuk kul-
tur Agave amaniensis Trel.& Nowell adalah 5 ppm.
Konsentrasi hormon 2,4-D yang dipergunakan untuk pertumbuhan kultur Diosoorea rentaphy- la L adalah 2 ppm, dan untuk kultur Agave amaniensis Trel.& Nowell 1 ppm.
Agar yang dipergunakan adalah produk3i E
n ,tt
Merck Damstadt dengan derajat Pro Analisa •
IX.2. Bahan percobaan.
Kalus berasal dari kalus Dioscorea pentaphylla L dan kalus Agave amaniensis Trel.& Nowell yang diperoleh dari Labora torium Bioteknologi Jurusan Biologi Far- masi Universitas Airlangga.
20
III. Tahapan kerja.
1. Perabuatan media. 1.1. Media padat.
1.2. Media kultur permukaan.
1.3. Media kultur "Filter Paper Bridge
t t
Technique .
1.4. Media kultur suspensi.
2. Memperbanyak kalus untuk stok selama perco baan.
3- Pemindahan kalus.
3.1. Pemindahan kalus ke media kultur per mukaan.
3.2. Pemindahan kalus ke media kultur
n ti
Filter Paper Bridge Technique .
3.3. Pemindahan kalus kedalam media kultur suspensi.
4.Pemeriksaan kalus.
4.1. Pemeriksaan kalus yang terjadi seca ra visual.
4.2. Penghitungan Indeks Pertumbuhan kul tur permukaan.
4.3. Penghitungan Indeks pertumbuhan
kul-n n
tur Filter Paper Bridge Technique . 4.4. Penghitungan Indeks pertumbuhan kul
Media yang dipakai adalah media MS. Masing- masing komponen dibuat larutan stok. Dengan mencampur larutan stok akan diperoleh media MS. Hormon pertumbuhan ditambahkan menurut komposi-
si, selanjutnya ditambah air suling sampai vo lume mendekati 1 liter.
pH diatur 5,7 dengan penambahan HaOH 0,1N atau HC1 0,1N. Ditambah agar-agar dengan konsentra
si 1% b/v. Ditambah air suling sampai volume
tepat 1 liter. Dipanaskan dengan api kecil sam pai diperoleh larutan yang jernih.
Dituang kedalam botol kultur lebih kurang 25 ml
dan ditutup dengan aluminium foil.
Disterilkan dalam autoclave dengan temperatur 121°C selama 20 menit.(3)
Selanjutnya disimpan diruang kultur dengan tem peratur sekitar 27°CT sampai saat untuk dipergu nakan.
III.1.2. Pembuatan media kultur permukaan.
Pada dasamya sama dengan pembuatan media untuk kultur pada media padat. Tetapi disini
dipakai agar-agar dengan konsentrasi 0,2 - 0,5
22
ft
III.1.3* Pembuatan media kultur Filter Paper bridge >t
Technique ,
Setelah larutan stok dicampur, hormon di- tambahkan menurut komposisi, ditambah air su- ling sampai volume hampir mendekati 1 liter, pH diatur 5,7 dengan penambahan NaOH 0,1N atau HC1 0,1N. Ditambah kembali dengan air suling sampai volume 1 liter.
media dituang kedalam erlenmeyer sebanyak 150 ml, ditutup rapat dengan aluminium foil, kemu
dian disterilkan dalam autoclave 121°C selama 20 menit.(3)
III.1.4* Pembuatan media kultur suspensi,
Pembuatan media untuk kultur suspensi sama dengan pembuatan media ^Filter Paper Bridge
tt
Technique • Setelah diperoleh media dengan vo lume 1 liter, media dituang kedalam fermentor
atau erlenmeyer sampai volumenya 20 % dari vo
Kalus yang merupakan bibit diambil dari bo- tolnya menggunakan skalpel steril. Dipindahkan kedalam media padat. Kemudian ditutup rapat de ngan aluminium foil (dilakukan dalam "laminar air flow cabinet") dan disimpan diruang kultur dengan temperatur sekitar 27°C.
Kalus diperbanyak pada media yang sama dan pada umur yang sama pula. Kalus ini dipergunakan
sebagai stok selama penelitian berlangsung. Ka lus Diosoorea pentaphylla L dipergunakan pada umur 8 minggu, sedangkan kalus Agave amaniensis Trel.& Howell pada umur 4 minggu.
III.3.1. Pemindahan kalus kedalam media kultur permuka an.
Pemindahan dilakukan secara aseptis dengan alat-alat dan media yang telah disterilkan ter lebih dahulu. Kalus diambil dari botol kalus dengan skalpel steril, dipindahkan kedalam me dia kultur permukaan yang telah disterilkan. Kemudian ditutup rapat (dilakukan dalam "lami nar air flow cabinet'). Disimpan dalam ruang kultur selama 8 minggu untuk kalus Dioscorea pentaphylla L dan 4 minggu untuk kalus Agave amaniensis Trel.& Nowell.
M J'.
"UN I V ER SE AS A^JuAf t •' |
24
ti
111.3.2. Pemindahan kalus kedalam media Filter Paper n
Bridge Technique .
Media untuk lcultur ter3ebut dituang keda- Xam botol kultur yang telah berisi botol kecil yang dilapisi kertas saring dan telah disteril kan lebih dahulu. Media dituang sampai volume hampir mencapai permukaan kertas saring.
Kalus diambil dari botol kalus dan diletak kan diatas kertas saring. Kemudian ditutup ra-pat dengan aluminium foil. Semua ini dilakukan
i t t t
dalam laminar air flow cabinet . Disimpan da-lam ruang kultur seda-lama 8 minggu untuk kalus Dioscorea pentaphylla L dan 4 minggu untuk ka lus Agave amaniensis Tre.& Nowell. Selanjutnya diperiksa kecepatan perturnbuhannya.
111.3.3. Pemindahan kalus kedalam media kultur suspensi. Kalus diambil dari botol kalus, dipilih tekstur yang lunak/rapuh. Diambil lebih kurang
1 gram kalus dan dimasukkan kedalam fermentor/ erlenmeyer, kemudian ditutup rapat. Semua ini
it ti
dilakukan dalam Laminar air Flow cabinet .
ii u
Erlenmeyer diletakkan pada incubator shaker
dengan kecepatan pemutaran 100 - 130 rpm.(3)
ka-nya diperikaa kecepatan pertumbuhanka-nya.
III.4. Pemeriksaan kalua.
III.4.1. Pemerikaaan kalua yang terjadi 3ecara visual. Meliputi : - Warna.
- Tekatur.
- Terjadinya diferenaiasi ael. Pemeriksaan ini dilakukan pada :
- Minggu ke 8 untuk Dioacorea pentaphylla L - Minggu ke 4 untuk Agave amanienaia Trel.
& Nowell*
III.4.2. Penghitungan Indeks Pertumbuhan kultur permu- kaan.
parameter perturnbuhan dinyatakan dengan Indeks Pertumbuhan yang didefinisikan sebagai berikut :
IP 3 Berat baaah kalua akhir ^
Berat baaah kalua awal
Berat baaah kalua ditentukan dengan cara kalua dikeluarkan dari botol kalua, kemudian ditimbang. Sedangkan berat awal kalus dipero- leh dengan cara :
26
t i
III.4*3. Penghitungan Indeks Pertumbuhan kalus Filter it
Paper Bridge Technique .
Sama seperti pada penetapan kecepatan per tumbuhan pada kultur permukaan, maka penetapan kecepatan pertumbuhan pada media dengan sistem tersebut juga dinyatakan dengan parameter in deks pertumbuhan.
III.4.4. Penghitungan Indeks Pertumbuhan kultur suspen- si.
Kecepatan pertumbuhan kultur suspensi di nyatakan dengan parameter PCV (Packed Cell Vo lume). Mulut fermentor/erlenmeyer dibakar de ngan pemanas splritus, dikocok dengan hati-ha ti agar homogen dan dibuka tutupnya.
Dituang kedalam gelas ukur dengan volume ter- tentu. Didiamkan dan dicatat volume endapan sel. Maka PCV pada waktu tertentu dapat diten tukan dengan : (15)
Volume endapan sel
________________________________ %
III.5* Deteksi steroid dari kalus secara KLT.
Kalus dipisahkan dari media, dikeringkan da- lam lemari pengering pada suhu 40 - 60°C» kemu- dian diserbuk dan dihomogenkan.
Ditimbang 1 gram serbuk kalus dan dikocok menggu
n tt
nakan vorteks 2 X dengan 10 ml chloroform sela 5 menit. Kemudian disaring, filtrat dipisahkan dan diuapkan untuk dianalisa.
Residu ditambah 20 ml HC1 2N, dikocok dengan
ti n
vorteks 1X selama 5 menit. Dinetralkan dengan NaOH, kemudian diekstraksi dengan 10 ml Chloro form. Fase chloroform dipisahkan, diuapkan dan dianalisa dengan KLT.
Ekstrak yang didapat ditotolkan pada lempeng Kieselgel 60 P 254. Dielusi dengan n-heksan :
etilasetat = 4 : 1 atau dengan chloroform : etil- asetat = 9 : 1 * Sebagai penampak noda digunakan anisaldehida sulfat.
BAB IV HASIL PENELITIAN
1, pemeriksaan kalus secara fisual*
Setelah kalus ditanam pada berbagai metode kultur cair, maka keberhasilannya dapat dilihat pada tabel berikut :
Tabel 1 * Pemeriksaan kalus yang terjadi.
Metode Dioscorea Agave
amanien-pentaphylla L sis Trel & Nowell
- Kultur permukaan s
- Agar-agar 0,2 % -
-- Agar--agar 0,3 % + +
- Agar-agar 0,4 % + +
- Agar-agar 0,5 % + +
- Kultur ” Filter Paper
Bridge Technique + +
- Kultur suspensi dengan
fermentor -
-- Kultur suspensi dengan
Incubator Shaker -
-Keterangan : - : raati + ; tumbuh.
Pemeriksaan kalus meliputi warna, tekstur dan adanya diferensiasi.
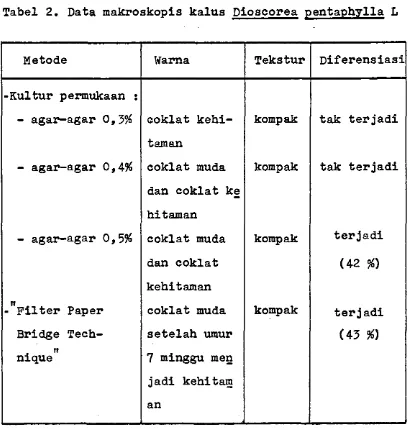
Tabel 2. Data makroskopis kalus Dioscorea pentaphylla L
Metode Warna Tekstur Diferensiasi
-Kultur permukaan :
- agar-agar 0,3% coklat kehi-
taraan
kompak tak terjadi
- agar-agar 0,4% coklat muda
dan coklat ke hitaman
kompak tak terjadi
- agar-agar 0,5% coklat muda
dan coklat kehitaman
kompak terjadi
(42 %)
-"Filter Paper coklat muda kompak ter j adi
Bridge Tech setelah umur (43 %)
nique” 7 minggu men
30
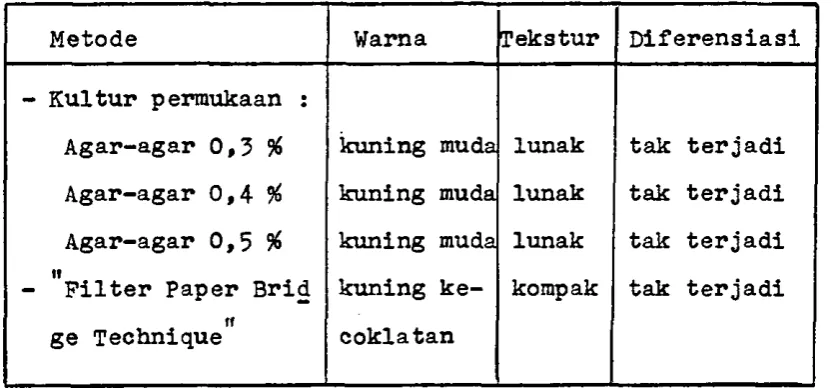
Tabel 3* Data makroskopis kalus Agave amaniensis Trel.& Nowell.
Metode Warna Tekstur Diferensiasi
- Kultur perraukaan :
Agar-agar 0,3 %
Agar-agar 0,4 %
Agar-agar 0,5 %
ti
Gambar 1 • Kalus Dioscorea pentaphylla L berumur 8 ming-gu :
A. Pada media padat (dengan penambahan agar-agar 1%).
B. Pada kultur "Filter Paper Bridge Tech-ft
32
Gambar 2. Kalus Agave amanienaia Trel.& Nowell berumur 4 minggu.
A. Pada media padat (dengan penambahan agar-
agar 1 %)
2# Penghitungan indeks pertumbuhan kalus.
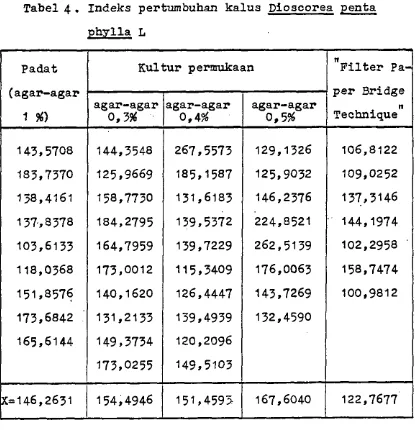
Penetapan kecepatan pertumbuhan kalus Dioscorea pentaphylla L dilakukan pada minggu ke 8 dengan pa rameter indeks pertumbuhan yang dapat dilihat pada tabel berikut :
Tabel 4. Indeks pertumbuhan kalus Dioscorea penta phylla L
Padat (agar-agar
1 %)
Kultur perarukaan "Filter Pa
agar-agar
143,5708 144,3548 267,5573 129,1326 106,8122
133,7370 125,9669 185,1587 125,9032 109,0252
138,4161 158,7730 131,6183 146,2376 137,3146
137,8378 184,2795 139,5372 224,8521 ' 144,1974
103,6133 164,7959 139,7229 262,5139 102,2958
118,0368 173,0 0 12 115,3409 176,0063 158,7474
151,3576 140,1620 126,4447 143,7269 100,9812
173,6842
x=146,2631 154,4946 151,459> 167,6040 122,7677
Keterangan :
34
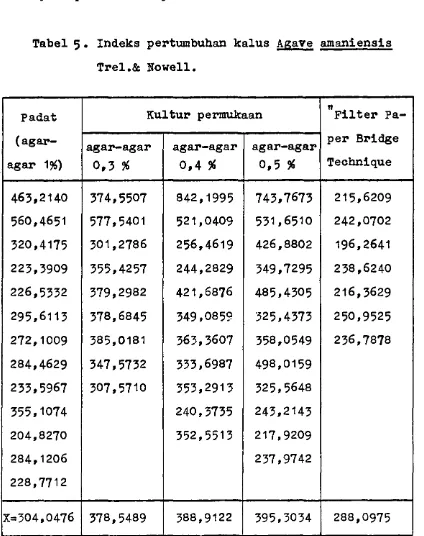
Untuk kalus Agave amaniensis Trel.& Nowell , pene- tapan kecepatan pertumbuhan dilakukan pada minggu
ke 4 dengan parameter indeks pertumbuhan. Hasil-
nya dapat dilihat pada tabel berikut :
Tabel 5. Indeks pertumbuhan kalus Agave amaniensis
Trel.& Nowell.
Padat (agar-
agar 1#)
Kultur permukaan ”pilter Pa
per Bridge
463,2140 374,5507 842,1995 743,7673 215,6209
560,4651 577,5401 521,0409 531,6510 242,0702
320,4175 301,2786 256,4619 426,8802 196,2641
223,3909 355,4257 244,2829 349,7295 238,6240
226,5332 379,2982 421,6876 485,4305 216,3629
295,6113 378,6845 349,0859 325,4373 250,9525
272,1009 385,0181 363,3607 358,0549 236,7878
284,4629 347,5732 333,6987 498,0159
233,5967 307,5710 353,2913 325,5648
355,1074 240,3735 243,2143
204,8270 352,5513 217,9209
284,1206 237,9742
228,7712
Dari tabel diatas dapat dilihat adanya pe- ningkatan kecepatan pertumbuhan dengan bertambah nya konsentrasi agar-agar. Namun karena adanya variasi nllai indeks pertumbuhan yang besar di- antara kultur perlakuan, maka perlu dilakukan uji perbandingan antara nilai IP rata-rata kul
tur padat dengan IP rata-rata kultur perlakuan, Hal ini untuk mengetahui apakah ada perbedaan nilai IP yang bermakna antara kultur padat dengan kultur perlakuan.(17)
Perhitungannya dapat dilihat pada lampiran 3-10. Hasil perhitungan uji perbandingan tersebut menunjukkan bahwa tidak ada perbedaan antara IP rata-rata kultur padat dengan IP rata-rata kultur perlakuan. Yang berarti bahwa kecepatan pertumbuh an kultur padat sama dengan kecepatan pertumbuhan semua kultur perlakuan.
3. Deteksi steroid pada kalus.
36
Gambar 3* Kromatogram ekstrak chloroform kalus Dioscorea pentaphylla L
Pase gerak n-heksan : etyl asetat » 4 : 1. Keterangan :
D = Pembanding diosgenin. H = Pembanding hekogenin. S = Pembanding sitosterol.
P a Ekstrak kalus dari kultur padat (agar-agar 1#) P « Ekstrak kalus kultur "Filter Paper Bridge
Tech-n
nique .
A = Ekstrak kalus kultur perraukaan (agar-agar 0,3%)
B =* Ekstrak kalus kultur permukaan (agar-agar 0,4%)
Gambar 4* Kromatogram ekstrak chloroform kalus Dlosco-rea pentaphylla L.
Fase gerak chloroform ; etyl asetat = 9 : 1 . Keterangan :
D = Pembanding diosgenin. H = Pembanding hekogenin. S « Pembanding sitosterol.
p a Ekstrak kalus dari kultur padat (agar-agar 1$) F a Ekstrak kalus kultur "Filter Paper Bridge Tech-
n
nique •
Gambar 5* Kromatogram ekstrak chloroform kalus Dioscorea pentaphylla L sesudah dihidrolisa*
Fase gerak n-heksan : etyl asetat a 4 : 1* Keterangan :
D » Pembandlng diosgenin. H » Pembandlng hekogenin. S o Pembandlng sitosterol.
P e Ekstrak kalus dari kultur padat (agar-agar 1?6) F a Ekstrak kalus kultur "Filter Paper Bridge
Tech-n nique .
A =* Ekstrak kalus kultur permukaan (agar-agar 0,3%)
B = Ekstrak kalus kultur permukaan (agar-agar 0,4/0
Gambar 6. Kromatogram ekstrak chloroform kalus Dloscorea pentaphylla L sesudah dihidrolisa.
Pase gerak chloroform : etyl asetat = 9 s 1. Keterangan :
D = Pembanding diosgenin. H = Pembanding hekogenin. S » Pembanding sitosterol.
P = Ekstrak kalus dari kultur padat (agar-agar 1#) P = Ekstrak kalus kultur "Filter Paper Bridge Tech
nique •
A = Ekstrak kalus kultur permukaan (agar-agar 0,3%)
B s Ekstrak kalus kultur permukaan (agar-agar 0,4%)
40
• • f • •
• • • • •
c t 1 * • o
1
1
(
1
8
ffambar 7* Kromatogram ekstrak chlorofonn kalus Agave
Keterangan :
D = Pembanding diosgenin. H * Pembanding hekogenin. S = Pembanding sitosterol.
p » Ekstrak kalus dari kultur padat (agar-agar 1%) p ■ Ekstrak kalus kultur "pilter Paper Bridge Tech
nique •
A * Ekstrak kalus kultur permukaan (agar-agar 0,3%) B = Ekstrak kalus kultur permukaan (agar-agar 0,4%)
C = Ekstrak kalus kultur permukaan (agar-agar 0,5%)
amaniensis Trel.& Nowell.
pase gerak n-heksan : etyl asetat > 4 : 1
i i i 1 1
i
Gambar 8. Kromatogram ekstrak chloroform kalus Agave
Keterangan :
D * Pembandlng diosgenin, 5 * Pembanding hekogenin, S * Pembanding sitosterol,
P = Ekstrak kalus kultur padat (agar-agar 1&)
P * Ekstrak kalus kultur "Filter Paper Bridge Tech nique •
A * Ekstrak kalus kultur permukaan (agar-agar 0,396) B « Ekstrak kalus kultur permukaan (agar-agar 0,4%) C =* Ekstrak kalus kultur permukaan (agar-agar 0,5#)
araaniensis Trel.& Nowell
42
A M A *
1
ft
Gambar 9. Kromatogram ekstrak chloroform kalus Agave amaniensis Trel.& Nowell sesudah dihidrolisa. Fase gerak n-heksan : etyl asetat » 4 : 1* Keterangan :
D * Pembanding diosgenin* H » Pembanding hekogenin. S =» Pembanding sitosterol.
p » Ekstrak kalus dari kultur padat (agar-agar 196) F ■ Ekstrak kalus kultur filter paper Bridge
Tech-rt nique .
Gambar 10* Kromatogram ekstrak chloroform kalus Agave amaniensis Trel.& Nowell sesudah dihidrolisa. Fase gerak chloroform : etyl asetat a 9 : 1. Keterangan •
D = Pembanding diosgenin. H =* Pembanding hekogenin. S = Pembanding sitosterol.
P a Ekstrak kalus dari kultur padat (agar-agar 1%) F » Ekstrak kalus kultur Filter Paper Bridge
Tech-n nique .
44
Tabel 6. Hasil KLT ekstrak chloroform kalus Dioscorea pentaphylla L.
Zat Fase gerak 1 Fase gerak 2
Warna noda Rf Warna noda Rf
- Diosgenin kuning hijau 0,16 kuning hijau
kuning hijau
- Sitosterol ungu 0,22 ungu 0,48
- Ekstrak kultur ungu muda 0,06 ungu 0,35
padat (agar- ungu 0,22 ungu 0,47
agar 1 %) kuning 0,31 kuning 0,64
ungu muda 0,70 ungu 0,83
- Ekstrak kultur ungu muda 0,06 ungu 0,35
f!
Filter Paper ungu 0,22 ungu 0,47
Bridge Tech- kuning 0,31 kuning 0,64
n
nique ungu muda 0,71 ungu 0,82
- Ekstrak kultur ungu muda 0,06 ungu 0,35
permukaan ungu 0,22 ungu 0,47
(agar-agar kuning 0,31 kuning 0,64
0,3%) ungu muda 0,71 ungu 0,82
- Ekstrak kultur ungu muda 0,07 ungu 0,36
permukaan ungu 0,22 ungu 0,48
(agar -agar kuning 0,31 kuning. 0,64
- Ekstrak kultur ungu muda 0,05 ungu 0,36
permukaan ungu 0,23 ungu 0,48
(agar - agar kuning 0,33 kuning 0,64
46
Tabel 7. Hasil KLT ekstrak chloroform kalus Dioscorea pentaphylla L sesudah dihidrolisa.
Zat
Fase gerak 1 Fase gerak 2
tfarna noda Rf tfarna noda Rf
- Diosgenin kuning hijau 0,17 kuning hijau 0,45
-Hekogenin kuning
kuning
0,04
0 ,16
kuning 0,35
- Sitosterol ungu 0,23 ungu 0,47
-Ekstrak kultur ungu 0,23 ungu 0,46
padat ungu 0,65 ungu 0,77
- Ekstrak kultur ungu 0,23 ungu 0,46
rt
Filter Paper ungu 0,64 ungu 0,78
Bridge Tech-tr
nique
- Ekstrak kultur ungu 0,23 ungu 0,46
permukaan ungu 0,66 ungu 0,76
(agar-agar 0,3%)
- Ekstrak kultur ungu 0,22 ungu 0,46
permukaan ungu 0,64 ungu 0,78
(agar-agarO, 4/6)
- Ekstrak kultur ungu 0,22 ungu 0,46
permukaan ungu 0,63 ungu 0,78
Tabel 8* Hasil KLT ekstrak chloroform kalus Agave ama- niensis Trel*& Nowell.
Zat Fase gerak 1 Fase gerak 2
Warna noda Rf Warna noda Rf
-Diosgenin kuning hijau 0,16 kuning hijau 0,46
-Hekogenin kuning
kuning
0,04 0,16
kuning 0,35
-Sitosterol ungu 0,21 ungu 0,47
-Ekstrak kultur biru ungu 0,06 biru ungu 0,03
padat (agar- ungu 0,21 ungu muda 0,06
agar 1 % ) ungu muda 0,27 ungu muda 0,20
kuning 0,31 ungu 0,38
ungu muda 0,34 ungu 0,47
ungu muda 0,46 kuning 0,66
ungu 0,63 ungu 0,84
ungu 0,70
-Ekstrak kultur biru ungu 0,06 biru ungu 0,03
it
Filter Paper ungu 0,21 ungu muda 0,05
Bridge Tech- ungu muda 0,26 ungu muda 0 ,19
mque kuning 0,30 ungu 0,36
ungu muda 0,34 ungu 0,46
ungu muda 0,45 kuning 0,64
ungu 0,63 ungu 0,83
48
-Ekstrak kultur biru ungu 0,06 biru ungu 0,03
permukaan ungu 0,21 ungu muda 0,06
(agar -agar ungu muda 0,26 ungu muda 0,19
0,3 % ) kuning 0,31 ungu 0,36
ungu muda 0,34 ungu 0,46
ungu muda 0,45 kuning 0,64
ungu 0,63 ungu 0,82
ungu 0,69
-Ekstrak kultur biru ungu 0,06 biru ungu 0,03
permukaan ungu 0,21 ungu muda 0,06
(agar -agar ungu muda 0,28 ungu muda 0,19
0,4 % ) kuning 0,31 ungu 0,36
ungu muda 0,34 ungu 0,46
ungu muda 0,46 kuning 0,64
ungu 0,62 ungu 0,81
ungu 0,70
-Ekstrak kultur biru ungu 0,06 biru ungu 0,03
permukaan ungu 0,21 ungu muda 0,05
(agar .agar ungu muda 0,28 ungu muda 0,18
0,5 % ) kuning 0,31 ungu 0,36
ungu muda 0,34 ungu 0,46
ungu muda 0,46 kuning 0,63
ungu 0,63 ungu 0,81
Tabel 9* Hasil KLT ekstrak chloroform kalus Agave ama- niensis Trel.& Nowell sesudah dihidrolisa.
Fase gerak ' Fase gerak 2
Zat Warna noda Rf Warna noda Rf
-Diosgenin kuning hijau 0,17 kuning hijau 0,48
-Hekogenin kuning
kuning
0,05 0,16
kuning 0,39
-Sitosterol ungu 0,22 ungu 0,49
•Ekstrak kultur ungu 0,06 ungu 0,05
padat (agar- ungu 0,12 ungu 0,35
agar 1 % ) ungu 0,21 ungu 0,44
ungu 0,58 ungu 0,71
•Ekstrak kultur ungu 0,06 ungu 0,06
it
Filter Paper ungu 0,12 ungu 0,35
Bridge Tech- ungu 0,21 ungu 0,43
n
nique ungu 0,58 ungu 0,68
-Ekstrak kultur ungu 0,06 ungu 0,05
permukaan ungu 0,12 ungu 0,34
(agar-agar 0,390 ungu 0,21 ungu 0,42
ungu 0,56 ungu 0,66
-Ekstrak kultur ungu 0,06 ungu 0,06
permukaan ungu 0,12 ungu 0,34
(agar-agar 0,4%) ungu 0,20 ungu 0,42
50
-Ekstrak kultur ungu 0,06 ungu 0,05
permukaan ungu 0,12 ungu 0,33
(agar-agar 0,5#) ungu 0,20 ungu 0,43
ungu 0,56 ungu 0,66
Keterangan •
1. Penumbuhan kalus pada kultur cair. 1.1* Perlakuan pada kultur permukaan*
Untuk pertama kali kalus ditanam pada kultur
permukaan dengan konsentrasi agar-agar 0,2 %. Sete
lah 3-4 hari ternyata kalus tenggelam dan selanjut nya tidak menunjukkan pertumbuhan*
Pada media dengan penambahan 0,3-0,5% agar-agar
kalus tumbuh dengan baik. Namun tergantung pada spesies yang ditanam. Kalus Agave amaniensis Trel* & Nowell berubah menjadi lebih kuning dan terang. Sedangkan kalus Dioscorea pentaphylla L sangat dipengaruhi kalus yang ditanam. Ada 2 macam kalus yang terjadi yaitu kalus yang berwarna coklat ke- hitaman dan coklat muda. Jika yang ditanam coklat muda maka indeks pertumbuhan akan tinggi, hal se- baliknya terjadi jika yang ditanam kalus yang ber- waraa coklat kehitaman*
Walaupun harga indeks pertumbuhan rata-rata kedua kalus diatas lebih besar dari pada indeks pertumbuhan rata-rata kalus pada kultur padat, da
ri analisa statistik menunjukkan tidak ada perbeda an diantara keduanya*
52
Hal ini disebabkan adanya variasi yang besar di- antara harga indeks pertumbuhan raasing-masing kul tur. Dengan deraikian tidak dapat dikatakan bahwa pertumbuhan pada kultur permukaan lebih baik dari pada pertumbuhan pada kultur padat.
1.2. Perlakuan pada kultur "Filter Paper Bridge Techni t»
que
Pertumbuhan kalus pada metode ini menunjukkan gejala yang hampir sama. Pada 2 minggu pertama se telah penanaman, kalus tidak menunjukkan perubah- an. Pada minggu berikutnya warna kalus perlahan- lahan berubah menjadi lebih tua dan tekstur lebih kompak. Hal ini mungkin disebabkan karena permuka an sel tidak kontak langsung dengan media, atau karena difusi nutrien pada kertas saring yang ku- rang baik, sehingga menyulitkan sel menyerap nu trien dari medianya.
Seperti pada kultur sebelumnya, indeks pertum
n f t
buhan dari kultur Filter Paper Bridge Technique juga menunjukkan variasi yang besar. Sehingga de ngan perhitungan statistik tidak ditemukan adanya perbedaan dengan kultur padat.
!
M I L I k
P E R P U S T A K A A N
1*3* Perlakuan pada kultur suspensi.
Penumbuhan kalus pada kultur suspensi dilaku
kan dengan 2 cara, yaitu pada erlenmeyer dan pada
fermentor.
Untuk kultur suspensi pada fermentor, agitasi
dilakukan dengan meniupkan udara steril kedalam
medianya. Tetapi ternyata tidak dihasilkan aerasi
yang baik, sehingga kultur suspensi pada fermentor
tidak dapat ditumbuhksn.
Sedangkan ‘kultur suspensi pada erlenmeyer, agi >i
tasi dilakukan dengan menggunakan incubator sha f t
ker • Setelah kalus dimasukkan kedalam erlenmeyer
diinkubasi pada temperatur 27°C dan kecepatan pe-
mutaran 100 - 130 rpm. Kultur diambil, diukur vo
lume endapannya kemudian disaring untuk ditimbang berat basahnya. Ternyata tidak terdapat pertambah an volume endapan maupun berat basahnya, Hal ini menunjukkan bahwa sel-sel dalam media tersebut mati. Mungkin disebabkan karena benturan antara dinding sel dengan erlenmeyer atau benturan sesa- ma sel jaringan tanaman itu sendiri. Hal ini dise babkan adanya gerak resiproc dari incubator sha
l l
54
Dari uraian diatas jelas bahwa pemakaian
agar-agar perlu dipertimbangkan. Karena pada
konsentrasi yang tinggi agar-agar dapat mempe- ngaruhi difusi nutrien dan gas kedalam sel. Sekret dari metabolisme sel juga akan terakumu- lasi pada matriks agar-agar. Sebagai contoh, ka lus Dioscorea pentaphylla L mengeluarkan senyawa fenolik kedalam medianya, sehingga media selalu mengalami pencoklatan selama pertumbuhan kalus.
2. Deteksi steroid dalam kalus.
Dari hasil penelitian dapat disiinpulkan bahwa :
1. Kalus Dioscorea pentaphylla L dan kalus Agave ainaniensis Trel«& Nowell yang ditanara pada
kul-rr
tur permukaan dan pada kultur Filter Paper Brid ge Technique" tumbuh dengan baik, walaupun mem- punyai kecepatan pertumbuhan yang sama dengan kultur pada media padat (agar-agar 1%).
2. Dengan analisa yang digunakan, pada kalus Dios corea pentaphylla L dan kalus Agave amaniensia Trel.& Nowell, steroid yang terdeteksi dengan KLT adalah sterol*
SARAN - SAHAIT
BAB VII
1* Untuk memperoleh pertumbuhan kalus Diosoorea penta
phylla L dan kalus Agave amaniensis Trel*& Nowell
yang cepat, perlu dicoba kembali menumbuhkan kalus
tersebut pada kultur suspensi yang diagitasi menggu-
nakan orbital shaker*
2. Perlu dilakukan penelitian untuk raengetahui jenis
sterol yang terdapat dalam kalus Diosoorea pentaphy
lla L.
3. Mempertimbangkan kembali penggunaan agar-agar yang
berlebihan pada pembuatan media kultur jaringan ta-
naman.
Berkurangnya viskositas media kultur Jaringan yang disebabkan karena turunnya konsentrasi agar-agar, seca-ra teoritis dapat meseca-rapermudah difusi nutrien kedalam sel, Dengan demikian diharapkan adanya kenaikan kecepat an pertumbuhan bila kultur jaringan ditanam pada media dengan konsentrasi agar-agar yang rendah.
Penanaman sel jaringan tanaman pada kultur permukaan memberi gambaran yang sama dengan pendapat tersebut* Namun indeks pertumbuhan yang didapat pada percobaan ini mempunyai variasi yang besar, aehingga dengan ana-lisa statistik tidak dapat disirapulkan adanya perbedaan antara kecepatan pertumbuhan kultur padat dengan kultur permukaan* percobaan penanaman sel jaringan tanaman pa
ir n
da kultur Filter paper Bridge Technique memberi kesia pulan yang sama,
Deteksi steroid pada percobaan ini dilakukan baik
i t
pada kultur padat, kultur permukaan maupun kultur Fil-it
ter Paper Bridge Technique . Hal ini dimaksudkan untuk mengetahui apakah masing-masing kultur perlakuan raengan
dung steroid.
KEPUSTAKAAN BAB XX
1. Umboh, MIJ* 1990. Bioteknologi Tanaman : Aplikasi Dan Pengembangannya. Seminaire du Samedi 16 Juin 19 90 Paculte de Medicine-Veterinaire. L*Universite Airlangga . Surabaya. 1-16.
2. Noerhadi, E. 1974. Kultur Jaringan Tumbuhan Sebagai Bahan penyelidikan Dan Potensinya Didalam Pembangun- an Negara. Pidato pada peneriraaan jabatan Guru Besar Ilmu Botani pada Institut Teknologi Bandung. Pener-
bit TJniversitas ITB. Bandung. 1-14.
3. Dodds, JS., Robert, LW. 1982. Experiment in Plant Tissue Culture. Cambridge University Press. London, New York. 1-6, 11-13, 21-28, 50-62.
4. Indrayanto, G. 1987. Produksi Metabolit Sekunder Dengan Teknik Kultur Jaringan Tanaman. Seminar Nasio nal Hetabolit Sekunder. PAU Bioteknologi Universitas Gajah Mada. Yogyakarta. 1-13.
5. Staba, EJ, Ph.D. 1980. Plant Tissue Culture as a Source of Biochemicals. CRC Press, Inc. Boca Raton, Florida. 2-17, 22-48.
6. Indrayanto, G. 1986. Prospek Kultur Jaringan Tanaman Pada Bidang Fannaai. Bulletin ISFI Jatim. 17(1). 12-
7. Isnaeni. 1986, Optimasi pertumbuhan Kalus Solanum
mammosum L dan Identifikasi Senyawa Steroidnya, Tesis. Universitas Airlangga, Surabaya.
1—13-8. Rokem, JS,, Tal.B., Golberg, I. 1985. Methods for Increasing Diosgenin production by Dioscorea Cell in Suspension Culture, Journal of Natural Products,
48(2) . 210-222.
9. Martindale. 1982. The Extra pharmacopoeia. Twenty- eighth Edition. The Pharmaceutical Press, London,
949.
10. Puhan, Z., Martin, SM. 1971. The Industrial Poten- sial of Plant Cell Culture. Nasional Research Coun cil Canada. 11595. 14-36.
11. Sato, F., Yamada, Y. 1984. Hight Berberine in Pro
ducing Coptis japonica Cell. Phytochemistry. 23
(20), 281-185.
12. Albert, F. Hill. 1952. Economic Botany, a Textbook of Useful Plant Product. Second Edition. Tata Me Graw Hill Publishing Compagny LTD. Bombay-New Delhi.
37.
60
14. Backer, CA. 1968. Flora of Java. Vol III. Wolter
Noor Choff. NV Groningen - The Nederlands. 154-157.
15. Street, HE. 1972. Plant Tissue And Cell Culture.
Cambridge University Press. London. 89-91.
16. Robert G.D.Steel, James H* Torrie, 1989- Prinsip
Dan Prosedur Statistika Suatu Pendekatan Biometrik*
Komposisi kimiawi media MS.
Komponen Jumlah (mg/1)
n h4n o5 1650
kiio3 1900
CaCl2.,2 H20 400
MgS04. 7 H20 370
k h2p o4 170
KI 0,83
h3b o3 6,2
KnSO 4• 4 H20 22,3
ZnSO^. 7 H20 8,6
Na2Mo04. 2 H20 0,25
CuSO^. 5 H20 0,025
CoCl2. 6 H20 0,025
PeS04. 7 H20 27,8
Ka2 .EDTA.2 H20 37,3
Mio-inositol 100
Asam nikotinat 0,50
Piridokain HC1 0,50
Tiamin HCl 0 ,10
Glisin 2
62
Lampiran 2*
Komposisi penampak noda Anisaldehida sulfat.(7)
Anisaldehida 0,5 ml
Asara asetat glasial 15,0 ml
Asam sulfat pekat 5,0 ml
Perbandingan antara IPrata-rata kultur padat dengan
IP rata-rata kultur permukaan (agar-agar 0,390 dari
kalus Diosoorea pentaphylla L.
(padat)
Y2( agar-agar 0,3%)
144,3548
Hipotesis tandingan s H1 >
64
2 5317,5199 + 3387,7645
17
34,1271 a - 0,2412,
- To - *4 1 * *( .025 ) SY 1 - Y2± t
« 8,2315 + 72,0082
x1 « 80,239681.
x2 =. - 63,7767.
Kesimpulan : HQ diterima -- ►
66
Y1(padat) Y2(agar-agar 0,4%)
143,5708 267,5573
183,7370 185,1587
138,4161 131,6133
137,8378 139,5372
103,6133 139,7229
113,0368 115,3409
151,8576 126,4447
173,6842 139,4939
165,6144 120,2096
__________ • 149,5103
.aiapiran 4*
Perbandingan antara IP rata-rata kultur padat dengan
I?- rata-rata kultur permukaan (agar-agar 0,4#) dari
9 ( I r l5 1732824; 711 - Z Y 7 - -197853,5989 -- —
----n 1 9
■ -5317,5199.
9 (IY25 2293994,379
- iri - ----:— - 247741,16 ---- --- —
293,8076 - 17,1408
- t
90
r1:~T2 146,2631 -151,4594
53
Xeaisipulan : HQ diterima -- ^ yu^ = /ig
I? rata-rata kultur padat (agar-agar 1%)
sama dengan IPrata-rata kultur perrau-
Perbandingan antara IP rata-rata kultur padat dengan
IP rata-rata kultur permukaan (agar -agar Q,5%) dari
70
2 5317,5199 + 17836,6481
- f2 - 51 + t(.025)'SY1 - Y2 ■ 21»3409 ± 2»131. 17,2148
= 21,3409 + 38,2148
Kesimpulan : HQ diterima -- ► = /U2 •
IPrata-rata kultur padat ( agar-agar 1%)
dengan IP rata-rata kultur permukaan
Lampiran 6
Perbandingan antara IP rata-rata kultur padat dengan rt
IP rata-rata kultur sistem Filter Paper Bridge
t t
Technique dari kalus Dioscorea pentaphylla L«
Y2(Filter Paper Bridge
Perhitungan :
9 (IT.)2 1732824,711
2y; = 197853,5989
---n1 9
= 5317,5199
P ( 2Y?)2 738523,3281
- I Y p --- -— = 108805,9003
---n2 7
* 3302,56772
7 5317,5199 + 3302,56772
- S =
---8 + 6
8 6 2 0 , 0 8 7 6 2
14
= 615,7205. - d b = 3 + 6 = 1 4 .
2 (n1+n2) \ (9+7)
Sy . y = / — -— — = / 615,7205
----*2 V n.no '12 V 9x7
9851,528
63
74
Y. - Y- 146,2631 - 122,7677
23,4954
* * 1,8789
12,5049
- Y 2 - Y 1 + t (#Q25) ; Sj - f 2 s 25»4954 + 2,145 . 12,504<
=* 23,4954 + 26,8230
x1 « 50,3184 x2 * - 3,3276
Keaimpulan : HQ £iteriraa — * /11 = yu2
Perbandingan antara IP rata-rata kultur padat (agar-agar
1%) dengan IP rata-rata kultur permukaan (agar-agar 0,3%)
i
dari kalus Agave amaniensls Trel.& Nowell.
Y1(padat) Z2(agar-agar 0,3%)
463,2140 374,5507
560,4651 577,5401
320,4175 301,2786
223,3909 355,4257
226,5332 379,2982
295,6113 378,6845
272,1009 385,0181
284,4629 347,5732
233,5967 307,5710
355,1074 _______ „
2 Y 1 = 3952,6187
III = 1330604,14
T1 = 304,0476
n1 = 13
204,8270 IY2 = 3406,9401
284,1206 = 1341852,079
228,7712 Y2 = 378,5489
76
Uji hipotesis nol : Hq : = /ig-
Hipotesis tandingan : <
/U2-Perhitungan s
,, 128819,941 + 52158,6519
- ^2 - + t(>025). _ 22
= 7 4 , 5 0 1 3 + 2 , 0 8 6 . 4 1 , 2 4 9 3
= 7 4 , 5 0 1 3 + 8 6 , 0 4 6 0
x 1 = 1 6 0 , 5 4 7 3
x 2
= - 1 1 , 5 4 4 7Kesirapulan : H0 diterima -- ► /U2
IP rata-rata kultur padat sama de ngan IP rata-rata kultur permukaan
78
Perbandingan antara IP rata-rata kultur padat (agar-agar
1%) dengan IP rata-rata kultur permukaan (agar-agar 0,4%)
Uji hipotesis nol : HQ : = yu2*
2 128819,941 + 292404,565
80
- 8 4 , 8 6 4 6
= = - 1 , 4 9 7 1 . 5 6 , 6 8 6 9
■
V
M
*
(
.
025)
*
S
Y
1
-
Y
2
= 84,8646 + 2 , 0 7 4 . 5 6 , 6 8 6 9
= 84,8646 + 117,56 8 6
x 1 - 2 0 2 , 4 3 3 2 .
x 2
= - 3 2 , 7 0 4 .Kesimpulan : HQ diterima — ► 3
/u^-IP rata-rata kultur padat sama de ngan IP rata-rata kultur permukaan
Perbandingan antara IP rata-rata kultur padat (agar-agar
1#) dengan IP rata-rata kultur permukaan (agar-agar o,5#)
dari kalus Agave amanlensis Trel.& Nowell.
82
9 128819,941 + 252244,901
“ *2 “ *1 ± t (.025)# Sr 1 - T 2
= 9 1 , 2 5 5 8 + 2 , 0 6 9 . 5 1 , 5 2 8 0
= 9 1 , 2 5 5 8 + 1 0 6 , 6 1 1 4
X l = 1 9 7 , 8 6 7 2
x 2 = - 1 5 , 3 5 5 6
Kesimpulan : H Q diterima — ► /U^ * /u2 .
IP rata-rata kultur padat sama
dengan IP rata-rata kultur permu
84
Perbandingan antara IP rata-rata kultur padat (agar-agar t*
1%) dengan IF rata-rata kultur Filter Paper Bridge
Technique " dari kalus Agave amaniensis Trel.& Nowell. Lampiran 10*
Y1(padat) Ygf Filter Paper
Bridge Technique)
233,5967 2Y2 = 1596,6824
355,1074 = 366409,8886
204,8270 Y2 = 228,0975
Uji hipotesis nol : HQ : = >u2
Hipotesis tandingan : > /*2
perhitungan •
„ 128819,941 + 2210,6477
86
7 5 , 9 5 0 1
=> --- - 1,8988.
3 9 , 9 9 8 6
" V M t ( . 0 2 5 ) • S Y 1 - Y 2
« 7 5 , 9 5 0 1 + 2 , 1 0 1 . 3 9 , 9 9 8 6
= 7 5 , 9 5 0 1 + 8 4 , 0 5 7 1
x 1 « 1 5 9 , 9 8 7 2
x 2 * - 8 , 0 8 7
Kesimpulan : HQ diterima — ► =* .
IP rata-rata kultur padat sama dengan IP rata-rata kultur " Filter Paper