BAB I
PENDAHULUAN
1.1 Tujuan Percobaan
Dapat menimnbang dengan menggunakan timbangan biasa dan neraca digital dan membedakannya.
Dapat membedakan larutan standar primer dan larutan standar sekunder. Dapat membuat larutan NaOH dan Asam Oksalat.
Dapat melakukan standarisasi larutan.
Menentukan kadar asam asetat yang terdapat dalam asam cuka yang beredar di pasaran.
1.2 Dasar Teori
1.2.1 Pengertian Asam Asetat
Asam asetat adalah salah satu contoh dari asam karboksilat yang mempunyai gugus fungsi –COOH yang disebut gugus karboksil. Karena merupakan gugus dari gugus karbonil (-CO-) dan gugus hidroksil (-OH). Aam asetat juga disebut sebagai senyawa kimia asam organik yang dikenal sebagai pemberi rasa asam dan aroma dalam makanan asam cuka memiliki rumus Emoiris C2H4O2. Rumus ini sering kali ditulis dalam bentuk CH3COOH atau
CH3CO2H. Asam Asetat murni (disebut asam asetat glasial) adalah cairan
higroskopis tak berwarna, dan memiliki titik beku 16,6oC
Asam Asetat merupakan salah satu asam karboksilat paling sederhana. Setelah asam format. Larutan asam asetat dalam air meruakan sebuah asam lemah, artinya hanya terdisosiasi sebagian menjadi ion H+ dan CH
3COO- Asam
Asetat merupakan pereaksi kimia dan bahan baku industri yang penting Berdasarkan BSN, kadar asam asetat yang baik untuk dikonsumsi tubuh adalah 3% maksimum 60 mg/kg.
Asam asetat terdapat dalam cuka makan memiliki kadar sekitar 20 – 25 %. Asam asetat murni disebut asam asetat glasial merupakan campuran bening tidak berwarna, berbau sangat tajam dan membeku pada 16,6 membentuk kristal yang menyerupai es atau gelas. Selain itu asam asetat digunkan sebagai pereaksi kimia yang dapat menghasilkan berbagai senyawa kimia lain. Sebagian 40 – 45 % dari asam asetat di dunia digunkan sebagai bahan untuk memproduksi monomer vinil asetat (vinyl actate monomer). Asam asetat juga digunakan dalam produksi anhidrida asetat dan ester. Berdasarkan BSN, kadar asam asetat yang baik untuk dikonsumsi tubuh adalah 3% maksimum 60 mg/kg.
Sifat – sifat Kimia Asam Asetat a.Keasaman
Atom hidrogen (H) pada gugus karboksil (−COOH) dalam asam karboksilat seperti asam asetat dapat dilepaskan sebagai ion H+ (proton),
sehingga memberikan sifat asam. Asam asetat adalah asam lemah monoprotik
dengan nilai pKa=4.8. Basa konjugasinya adalah asetat (CH3COO−). Sebuah
larutan 1.0 M asam asetat (kira-kira sama dengan konsentrasi pada cuka rumah) memiliki pH sekitar 2,4.
Dimer siklis dari asam asetat, garis putus-putus melambangkan ikatan hidrogen.
Struktur kristal asam asetat menunjukkan bahwa molekul-molekul asam asetat berpasangan membentuk dimer yang dihubungkan oleh ikatan hidrogen. Dimer juga dapat dideteksi pada uap bersuhu 120 °C. Dimer juga terjadi pada larutan encer di dalam pelarut tak-berikatan-hidrogen, dan kadang-kadang pada cairan asam asetat murni. Dimer dirusak dengan adanya pelarut berikatan hidrogen (misalnya air). Entalpi disosiasi dimer tersebut diperkirakan 65.0–66.0 kJ/mol, entropi disosiasi sekitar 154–157 J mol–1 K–1.
Sifat dimerisasi ini juga dimiliki oleh asam karboksilat sederhana lainnya. b. Sebagai Pelarut
Asam asetat cair adalah pelarut protik hidrofilik (polar), mirip seperti air
dan etanol. Asam asetat memiliki konstanta dielektrik yang sedang yaitu 6.2, sehingga ia bisa melarutkan baik senyawa polar seperi garam anorganik dan
gula maupun senyawa non-polar seperti minyak dan unsur-unsur seperti sulfur
dan iodin. Asam asetat bercambur dengan mudah dengan pelarut polar atau nonpolar lainnya seperti air, kloroform dan heksana. Sifat kelarutan dan kemudahan bercampur dari asam asetat ini membuatnya digunakan secara luas dalam industri kimia.
c.Reaksi-reaksi kimia
Asam asetat bersifat korosif terhadap banyak logam seperti besi,
magnesium, dan seng, membentuk gas hidrogen dan garam-garam asetat (disebut logam asetat). Logam asetat juga dapat diperoleh dengan reaksi asam asetat dengan suatu basa yang cocok. Contoh yang terkenal adalah reaksi soda kue (Natrium bikarbonat) bereaksi dengan cuka. Hapir semua garam asetat
larut dengan baik dalam air. Salah satu pengecualian adalah kromium (II) asetat. Contoh reaksi pembentukan garam asetat:
Mg(s) + 2 CH3COOH(aq) → (CH3COO)2Mg(aq) + H2(g)
NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + CO2(g) + H2O(l)
Aluminium merupakan logam yang tahan terhadap korosi karena dapat membentuk lapisan aluminium oksida yang melindungi permukaannya. Karena itu, biasanya asam asetat diangkut dengan tangki-tangki aluminium.
Dua reaksi organik tipikal dari asam asetat
Asam asetat mengalami reaksi-reaksi asam karboksilat, misalnya menghasilkan garam asetat bila bereaksi dengan alkali, menghasilkan logam etanoat bila bereaksi dengan logam, dan menghasilkan logam etanoat, air dan karbondioksida bila bereaksi dengan garam karbonat atau bikarbonat. Reaksi organik yang paling terkenal dari asam asetat adalah pembentukan etanol
melalui reduksi, pembentukan turunan asam karboksilat seperti asetil klorida
atau anhidrida asetat melalui substitusi nukleofilik. Anhidrida asetat dibentuk melalui kondensasi dua molekul asam asetat. Ester dari asam asetat dapat diperoleh melalui reaksi esterifikasi Fischer, dan juga pembentukan amida. Pada suhu 440 °C, asam asetat terurai menjadi metana dan karbon dioksida, atau ketena dan air.
Asam asetat dapat dikenali dengan baunya yang khas. Selain itu, garam-garam dari asam asetat bereaksi dengan larutan besi(III) klorida, yang menghasilkan warna merah pekat yang hilang bila larutan diasamkan. Garam-garam asetat bila dipanaskan dengan arsenik trioksida (AsO3) membentuk
kakodil oksida ((CH3)2As-O-As(CH3)2), yang mudah dikenali dengan baunya
yang tidak menyenangkan.
Asam asetat digunakan sebagai pereaksi kimia untuk menghasilkan berbagai senyawa kimia. Sebagian besar (40-45%) dari asam asetat dunia digunakan sebagai bahan untuk memproduksi monomer vinil asetat (vinyl acetate monomer, VAM). Selain itu asam asetat juga digunakan dalam produksi anhidrida asetat dan juga ester. Penggunaan asam asetat lainnya, termasuk penggunaan dalam cuka relatif kecil.
Asam asetat pekat bersifat korosif dan karena itu harus digunakan dengan penuh hati-hati. Asam asetat dapat menyebabkan luka bakar, kerusakan mata permanen, serta iritasi pada membran mukosa. Luka bakar atau lepuhan bisa jadi tidak terlihat hingga beberapa jam setelah kontak. Sarung tangan latex tidak melindungi dari asam asetat, sehingga dalam menangani senyawa ini perlu digunakan sarung tangan berbahan karet nitril. Asam asetat pekat juga dapat terbakar di laboratorium, namun dengan sulit. Ia menjadi mudah terbakar jika suhu ruang melebihi 39 °C (102 °F), dan dapat membentuk campuran yang mudah meledak di udara (ambang ledakan: 5.4%-16%).
Larutan asam asetat dengan konsentrasi lebih dari 25% harus ditangani di sungkup asap (fume hood) karena uapnya yang korosif dan berbau. Asam asetat encer, seperti pada cuka, tidak berbahaya. Namun konsumsi asam asetat yang lebih pekat adalah berbahaya bagi manusia maupun hewan. Hal itu dapat menyebabkan kerusakan pada sistem pencernaan, dan perubahan yang mematikan pada keasaman darah
1.2.2 Larutan standar
Larutan standar adalah larutan yang konsentrasinya diketahui secara pasti atau dapat pula diartikan sebagai bahan kimia yang digunakan untuk menetapkan konsentrasi larutan standar sekunder atau larutan yang harga konsentrasinya masih dapat berubah karena pengaruh lingkungan.
Dengan demikian, maka dikenal ada dua jenis larutan, yaitu larutan standar primer dan larutan standar sekunder. Sedangkan proses penetapan konsentraasinya (biasanya dalam sistem kenormalan). Larutan standar sekunder dengan menggunakan larutan standar primer disebut standarisasi.
Reaksi antara titran dengan zat yang dipilih sebagai standar primer harus memenuhi syarat untuk analisa titrasi volumetri, yaitu :
1. Harus mudah diperoleh dalam bentuk murni atau dalam keadaan kemurnian yang konsentrasinya diketahui dengan harga yang wajar. 2. Zat itu harus tetap, harus mudah dikeringkan dan tidak terlalu
hidrokospis, tidak berkurang beratnya jika terkena udara, garam hidratnya biasanya tidak dipergunakan dengan standar primer.
3. Mempunyai bobot ekuivalen tinggi agar dapat mengurangi konsentrasi kesalahan pada penimbangan.
Terdapat bermacam-macam larutan standar, antara lain sebagai berikut: 1. Standar primer asam
KHC8H4O4 (kalium hydrogen phatalat)
C8H8COOH (asam benzoat)
NH4.SO3H (asam sulfamat)
H2C2O4.2H2O (asam oksalat)
2. Standar primer basa
NaCO3 (natrium karbonat)
Na2B4O7.10H20 (boraks)
1.2.3 Dasar Volumetri dan Titik Ekuivalen
Volumetri atau titrimetri adalah analisis jumlah berdasarkan pada pengukuran volume larutan pereaksi (larutan penitar/titran/larutan baku) yang direaksikan dengan larutan contoh/sampel yang ditentukan kadarnya (titrit). Pelaksanaan pengukuran volume ini disebut titrasi atau penitraan, yaitu larutan penitar ditambahkan sedikit demi sedikit ke dalam larutan contoh atau sampel sampai terjadi titik akhir titrasi yang secara kimia jumlah titrit dan jumlah titrit ekuivalen. Namun, tidak semua larutan dapat digunakan sebagai titran.
Titik ekuivalen adalah titik akhir titrasi, yaitu dimana suatu titrasi akan dihentikan karena telah mencapai suatu kesetaraan. Untuk mengetahui kapan suatu titrasi dikatakan setara ialah bila pada larutan titrit telah terjadi perubahan warna. Hal ini disebabkan karena penambahan indikator sebagai larutan petunjuk. Namun, tidak semua larutan dapat digunakan sebagai titran. Untuk itu, pereaksi harus memenuhi syarat-syarat sebagai berikut :
Berlangsung sempurna, tunggal dan menurut persamaan yang jelas (dasar teoritis)
Ada petunjuk akhir titrasi
Larutan baku yang digunakan harus stabil sehingga konsentrasinya tidak mudah berubah bila disimpan
1.2.4 Indikator PP
Indikator PP adalah asam dwiprotik yang tak berwarna. Mula-mula zat ini berdiososiasi menjadi suatu bentuk tak berwarna dan kemudian dengan kehilangan proton kedua, menjadi ion dengan sistem konjugasi maka timbulah warna merah. Untuk asam lemah, PH titik kesetaraan diatas 7 dan biasanya dipilih phenoptalein. Untuk basa lemah, dimana PH titik kesetaraan dibaawah 7, biasanya digunakan metil merah atau metil jingga. Untuk asam kuat dan basa kuat biasanya dipilih metil merah, bromo timol biru, dan phenolptalein. 2 Titrasi Asam – Basa (Asidimetri – Alkaimetri)
Reaksi dasar dari titrasi asam basa yaitu penetralan atau netralisasi yang menghasilkan garam dan air. Misalnya reaksi antara natrium hidroksida dan asam klorida
NaOH + CH3COOH → CH3COONa + H2O
Bila diukur berapa ml larutan asam dengan titar tertentu diperlukan untuk menetralkan suatu larutan basa, kadarnya atau titarnya asam maka pekerjaan itu disebut asidimetri sedangkan penitarnya sebaliknya, asam dengan basa yang titarnya diketahui disebut alkalimetri. Ternyata ion OH
-setara dengan 1 ion H+, maka dapat disimpulkan bahwa 1 gram setara asam
atau basa adalah jumlah asam yang mengandung ion H+ atau 1 gram ion OH-,
dengan kata lain 1 gram setara (gram ekuivalen) asam atau basa yang berkedudukan n adalah 1/n gram mol zat terlarut.
BAB II METODOLOGI II.1 Alat Dan Bahan
II.1.1 Alat yang digunakan : Labu ukur 100 ml Erlenmeyer 250 ml Buret Pipet ukur 10 ml Pipet volume 25 ml Gelas kimia 250 ml Piknometer Kaca arloji Bulp Corong Neraca digital Spatula Batang pengaduk Statif
II.1.2 Bahan yang digunakan : Padatan NaOH
Padatan Asam Oksalat Indikator PP
Sampel Cuka (Dixi, tujuh sembilan, indomaret) Aquadest
II.2 Prosedur Kerja
II.2.1 Pembuatan larutan NaOH 0,1 N dan larutan asam oksalat 0,1 N II.2.1.1 Pembuatan larutan NaOH 0,1 N
Menimbang sebanyak 0,4 gram NaOH dengan neraca digital Memasukan ke dalam labu ukur 100 ml lalu menambahkan
aquadest sampai tanda batas
II.2.1.2 Pembuatan larutan asam oksalat 0,1 N
Menimbangan sebanyak 0,9 gram asam oksalat dengan neraca digital
Memasukan ke dalam gelas kimia lalu menambahkan sedikit aquadest, kemudian mengaduk hingga padatannya larut Memasukan ke dalam labu ukur 100 ml lalu menambahkan
aquadest hingga tanda batas
II.2.2 Standarisasi NaOH 0,1 N dengan asam oksalat
1. Memipet 10 ml NaOH 0,1 N dengan menggunkan pipet ukur dan menambahkan 3 tetes indikator PP
2. Menitrasi dengan menggunkan penitrat asam oksalat 0,1 N hingga terjadi perubahan warna larutan menjadi merah muda
3. Mencatat volume penitrat yang digunakan 4. Melakukan percobaan secara duplo
5. Menentukan konsentrasi NaOH dengan rumus : V1 x N1 = V2 x N2
II.2.3 Penentuan kadar asam asetat dalam cuka perdagangan
1. Memipet 10 ml larutan cuka perdagangan dengan pipet ukur dan memasukkan ke dalam labu ukur 100 ml kemudian menambahkan aquadest hingga tanda batas.
2. Memipet 10 ml larutan tersebut dengan pipet ukur, dan memasukkan ke dalam erlenmeyer 250 ml, kemudian menambahkan 3 tetes indikator PP.
3. Menitrasi dengan NaOH yang telah distandarisasi hingga terjadi perubahan warna larutan menjadi merah muda.
4. Melakukan percobaan pada masing-masing sampel secara duplo. 5. Menghitung kadar asam asetat dalam asam cuka.
6. Dengan rumus :
BAB III
HASIL DAN PEMBAHASAN
III.1 Data Pengamatan
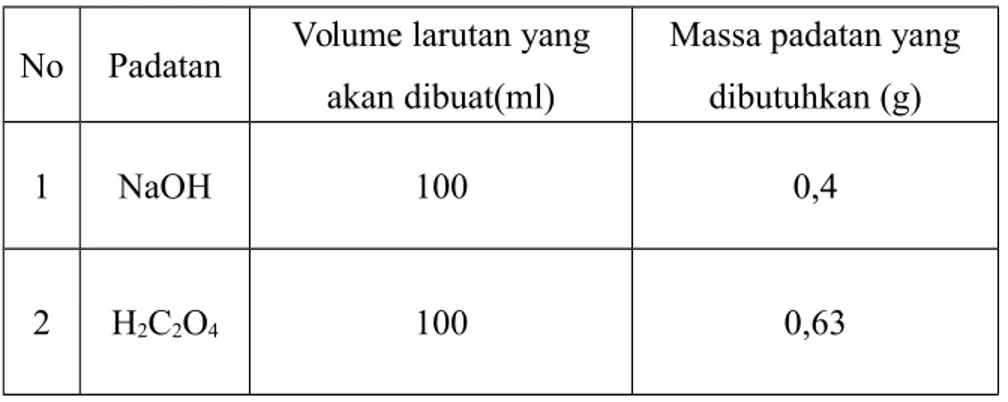
III.1.1 Pembuatan Larutan Tabel 1. Pembuatan Larutan
No Padatan Volume larutan yang akan dibuat(ml)
Massa padatan yang dibutuhkan (g)
1 NaOH 100 0,4
2 H2C2O4 100 0,63
III.1.2 Standarisasi NaOH 0,1 N dengan Asam Oksalat a. NaOH I
Tabel 2. Standarisasi NaOH I
Titrasi Volume NaOH (ml) Volume Asam Oksalat (ml) Perubahan Warna
1 10 7,6 Merah muda - putih
2 10 7,8 Merah muda - putih
3 10 7,9 Merah muda - putih
Rata-Rata 7,76
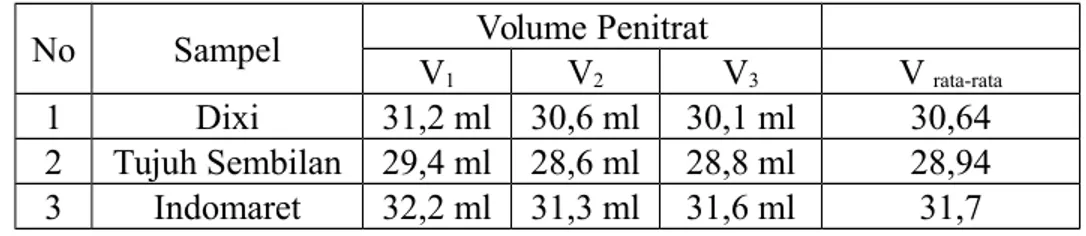
III.1.3 Penentuan Kadar Asam Asetat dalam Cuka Perdagangan Tabel 3. Kadar Asam Asetat dalam Cuka Perdagangan
No Sampel Volume Penitrat
V1 V2 V3 V rata-rata
1 Dixi 31,2 ml 30,6 ml 30,1 ml 30,64 2 Tujuh Sembilan 29,4 ml 28,6 ml 28,8 ml 28,94 3 Indomaret 32,2 ml 31,3 ml 31,6 ml 31,7 III.2 Hasil Perhitungan
Tabel 4. Tabel Hasil Perhitungan
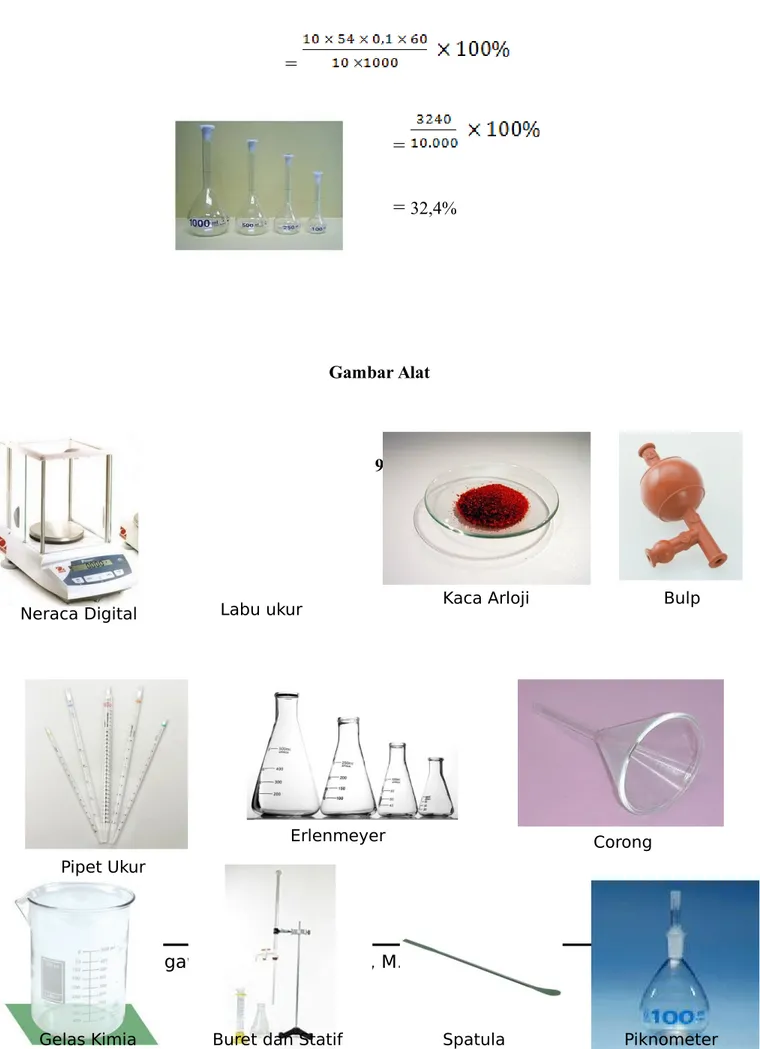
No Sampel FP (ml) BM N.NaoH (N) V.NaoH (ml) Berat Sampel (ml) % FFA 1 Dixi 10 60 0,1 45 10 27% 2 Tujuh Sembilan 10 60 0,1 16,15 10 9,69% 3 Indomaret 10 60 0,1 54 10 32,4% III.3 Pembahasan
Praktikum ini memiliki beberapa tujuan, yang pertama adalah mengetahui perbedaan timbangan biasa dan neraca digital. Perbedaan nya adalah timbangan biasa yaitu jenis timbangan yang bekerja secara mekanis dengan sistem pegas. Biasanya menggunakan indikator berupa jarum sebagai petunjuk ukuran masa yang telah berskala. Sedangkan, neraca digital yaitu jenis timbangan yang bekerja secara elektronis dengan tenaga listrik. Umumnya menggunakan indikator berupa angka digital pada layar bacaan. Neraca digital memiliki pengukuran berat yang lebih teliti dibandingkan dengan timbangan biasa karena berat sampel akan langsun muncul pada layar bacaan.
Tujuan yang lain adalah dapat membedakan larutan standar primer dan larutan standar sekunder. Perbedaannya adalah larutan standar primer yaitu larutan yang mengandung zat padat murni yang konsentrasi larutannya diketahui secara pasti
berasal dari zat yang tidak pernah murni. Konsentrasi larutan ini ditentukan dengan melakukan standarisasi menggunakan larutan standar primer, biasanya melalui metode titrimetri.
Praktikum ini juga bertujuan untuk mengetahui kadar asam asetat yang terdapat dalam asam cuka perdagangan yang beredar dipasaran. Praktikum ini melibatkan beberapa proses, seperti pengenceran, titrasi dan standarisasi larutan. Pengenceran dilakukan untuk memperkecil kesalahan pada saat titrasi, karena semakin encer asam cukanya, maka hasilnya pun akan semakin teliti. Pengenceran juga bermanfaat untuk menghemat bahan kimia yang digunakan untuk titrasi.
Titrasi asam basa sering disebut dengan titrasi netralisasi. Dalam titrasi ini, kita dapat menggunakan laritan standar asam dan larutan standar basa. Reaksi netralisasi terjadi antara ion hidrogen sebagai asam dengan ion hidroksida sebagai basa dan membentuk air yang bersifat netral.
Berdasarkan konsep lain, reaksi netralisasi dapat juga dikatakan sebagai reaksi antara donor proton (asam) dengan penerima proton (basa). Dalam melakukan titrasi netralisasi kita perlu mengamati secara cermat perubahan pH, khususnya pada saat akan mencapai titik akhir titrasi. Hal ini dilakukan untuk mengurangi kesalahan dimana akan terjadi perubahan warna dari indikator.
Untuk menentukan kadar asam asetat dalam cuka perdagangan. Penitar yang digunakan adalah NaOH yang telah distandarisasi. Dan sampel cuka yang digunkan adalah cuka merk dixi, tujuh sembilan, dan indomaret. Pada cuka merk dixi volume penitar yang diperoleh sebesar 45 ml. Sehingga diperolah hasil untuk kadar asam asetat yang terdapat pada cuka merk dixi sebesar 27%. Pada cuka merk tujuh sembilan diperoleh volume penitar sebesar 16,15 ml. Sehingga hasil untuk kadar asam asetat pada cuka merk tujuh sembilan sebesar 9,69%. Pada cuka merk indomaret diperoleh volume penitar sebesar 54 ml. Sehingga hasil untuk kadar asam asetat pada cuka merk indomaret adalah sebesar 32,4%
Dapat dilihat bahwa kadar CH3COOH cuka tersebut adalah tinggi dan melebihi
dikonsumsi oleh konsumen.. Kadar CH3COOH dapat diketahui dengan menitrasi
menggunakan NaOH 0,1 N, (menambahkan indicator PP sebanyak 3 tetes) dan titrasi dihentikan ketika warna dari sampel telah berubah warna menjadi merah muda.
BAB IV PENUTUP
Konsentrasi NaOH setelah distandarisasi adalah 0,1N Kadar asam asetat pada cuka merk Dixi sebesar 27%
Kadar asam asetat pada cuka merk Tujuh Sembilan sebesar 9,69% Kadar asam asetat pada cuka merk Indomaret sebesar 32,4% IV.2 Saran
Sarannya adalah harus lebih teliti dalam melakukan titrasi. Seingga volume penitar yang digunakan tepat.
DAFTAR PUSTAKA
http://www.chem-is-try.org/materi_kimia/Instrumen_analisis/idiometri/analisis-kuantitatif-secara-volumetri/
http://dedyanwarkimiaanalisa.blogspot.com/2009/11/asidi-alkalimetri.html Tim Laboratorium Kimia Dasar,2010,”penuntun Praktikum dasar Proses
PERHITUNGAN 1. Penentuan Massa Padatan NaOH dan Asam Oksalat
a. NaOH Diket : N NaOH = 0,1 N V Larutan = 100ml Mr CH3COOH = 40 Valensi NaOH = 1 Dit : m NaOH…..??? Jawab : N = 0,1 = 0,1 = m = 0,4 gram b. Asam Oksalat
Diket : N asam oksalat = 0,1M
V Larutan = 100ml
Dit : Massa Asam oksalat…..??? Jawab : N = 0,1 = 0,1 = m = 0,63 gram
2. Standarisasi NaOH dengan Asam Oksalat a. Larutan NaOH
Diket : V rata-rata asam oksalat = 7,76 ml
V NaOH = 10 ml
N asam oksalat = 0,1N Dit : N NaOH……???
Jawab :
NaoH = Asam Oksalat N1 . V1 = V2 . N2
N1 .10 = 7,76 . 0,1
N1 = 0,0776 N
3. Penentuan kadar Asam asetat a. Cuka merk Dixi
Diket : Faktor pengali (Fp) = 10 BM Asam asetat = 60
N NaOH = 0,1 N
V NaOH = 45 ml
Berat sampel = 10 ml Dit : % Asam asetat……??? Jawab :
% asam asetat =
=
=
= 27%
b. Cuka merk Tujuh Sembilan
V NaOH =16,15 ml Berat sampel = 10 ml
Dit : % Asam asetat……???
Jawab :
% asam asetat =
=
=
= 9,69%
c. Cuka merk Indomaret
Diket : Faktor pengali (Fp) = 10
BM Asam asetat = 60
N NaOH = 0,1 N
V NaOH = 54 ml
Berat sampel = 10 ml Dit : % Asam asetat……??? Jawab :
=
=
= 32,4%
Gambar Alat
9
Neraca Digital Labu ukur Kaca Arloji Bulp
Pipet Ukur