BAB II
TINJAUAN PUSTAKA
2.1 Sejarah Asam Asetat
Nama asam asetat berasal dari kata Latin asetum, “vinegar”. Asam asetat,
asam etanoat atau asam cuka adalah senyawa kimia asam organik yang
merupakan asam karboksilat yang paling penting di perdagangan, industri, dan
laboraturium dan dikenal sebagai pemberi rasa asam dan aroma dalam makanan.
Asam cuka memiliki rumus kimia CH3-COOH, CH3COOH, atau CH3CO2H.
Struktur Asam Asetat : H O
H C C
H O H
Bentuk murni dari asam asetat ialah asam asetat glacial. Asam asetat glasial
mempunyai ciri-ciri tidak berwarna, mudah terbakar (titik beku 17°C dan titik
didih 118°C) dengan bau menyengat, dapat bercampur dengan air dan banyak
pelarut organik. Dalam bentuk cair atau uap, asam asetat glacial sangat korosif
terhadap kulit dan jaringan lain suatu molekul asam asetat mengandung gugus – OH dan dengan sendirinya dapat membentuk ikatan hidrogen dengan air. Karena
adanya ikatan hidrogen ini, maka asam asetat yang mengandung atom karbon satu
Asam asetat merupakan asam lemah yang terionisasi sebagian dalam air,
walaupun demikian, keasaman asam asetat tetap lebih tinggi dibanding dengan
keasaman air (Kohar, 2004).
2.2. Pengertian Asam Asetat
Asam asetat atau lebih di kenal sebagai asam cuka (CH3COOH) adalah suatu
senyawa berbentuk cairan, tak berwarna, berbau menyengat, memiliki rasa asam
yang tajam dan larut di dalam air, alkohol, gliserol, dan eter. Pada tekanan
asmosferik, titik didihnya 118,1 oC. Asam asetat mempunyai aplikasi yang sangat
luas di bidang industri dan pangan. Di Indonesia, kebutuhan asam asetat masih
harus di import, sehingga perlu di usahakan kemandirian dalam penyediaan
bahan (Hardoyono, 2007).
Asam asetat merupakan salah satu produk industri yang banyak dibutuhkan
di Indonesia. Saat ini di Indonesia harus mengimpor asam asetat dalam jumlah
yang besar, pada tahun 1993 jumlah impornya sebesar 31.613.115,200 M ton
dengan nilai $ 14.945.208,41 (Anonim, 1994).
2.2.1. Sifat Kimia
Beberapa anggota awal dari deret asam karboksilat yakni asam asetat
berwujud cairan tidak berwarna dengan bau tajam. Asam asetat yang menyusun
sekitar 4-5% cuka, memberi ciri bau dan cita rasanya. Asam karboksilat tergolong
polar dan dapat membentuk ikatan hidrogen dengan sesamanya atau dengan
molekul 5 lain. Jadi asam karboksilat seperti asam asetat memiliki titik didih
tinggi untuk bobot molekulnya.Asam karboksilat seperti asam asetat mengurai di
pada gugus karboksil (−COOH) dalam asam karboksilat seperti asam asetat dapat
dilepaskan sebagai ion H+ (proton), sehingga memberikan sifat asam. Asam asetat
adalah asam lemah monoprotik basa konjugasinya adalah asetat (CH3COO−).
Asam asetat adalah pelarut protik hidrofilik (polar), mirip seperti air dan etanol.
Asam asetat bercampur dengan mudah dengan pelarut polar atau nonpolar lainnya
seperti air, kloroform dan heksana. Sifat kelarutan dan kemudahan bercampur dari
asam asetat ini membuatnya digunakan secara luas dalam industri kimia dan
laboratorium ( Hart, 2003).
Asam asetat mudah menguap di udara terbuka, mudah terbakar, dan dapat
menyebabkan korosif pada logam. Asam asetat jika di reaksikan dengan karbonat
akan menghasilkan karbon dioksida. Penetapan kadar asam asetat biasanya
menggunakan basa natrium hidroksida, dimana 1 ml natrium hidroksida 1 N
setara dengan 60,05 mg CH3COOH (Depkes RI,1995).
2.2.2. Sifat Fisika
Sifat fisika dari asam asetat adalah bentuk cairan jernih, tidak berwarna,
berbau menyengat, pH asam, memiliki rasa asam yang sangat tajam,mempunyai
titik beku 16,6 oC, titik didih 118,1 oC dan larut dalam air, alkohol, dan eter.
Asam asetat di buat dengan fermentasi alkohol oleh bakteri Acetobacter.
Pembuatan dengan cara ini bisa digunakan dalam pembuatan cuka. Asam asetat
mempunyai rumus molekul CH3COOH dan bobot molekul 60,05 (Depkes RI,
2.3. Pembuatan Asam Asetat
Asam asetat dapat dibuat dari substrat yang mengandung etanol, yang dapat
diperoleh dari berbagai macam bahan seperti buah-buahan,kulit nanas, pulp kopi,
dan air kelapa. Tersedianya air kelapa dalam jumlah besar di Indonesia, yaitu dari
900 juta liter per tahun merupakan potensi yang belum dimanfaatkan secara
maksimal. Saat ini pemanfaatan air kelap belum optimal, selain sebagai bahan
baku nata de coco, air kelapa dapat dibuat cuka secara tradisional oleh
masyarakat. Pembuatan asam asetat dapat dilakukan dengan dua cara, yaitu
secara sintesis atau khemis dan secar mikrobiologis atau fermentasi, namun
demikian cara fermentasi lebih disukai, karena lebih murah, lebih praktis dan
resiko kegagalan relatif lebih kecil. Pada fermentasi asam asetat dari substrat cair
umumnya hanya dilakukan dua tahap fermentasi yaitu fermentasi alkohol dan
fermentasi asam asetat. Fermentasi alkohol dilakukan jika bahan yang digunakan
kaya akan gula namun tidak mengandung alkohol. Pada bahan yang miskin gula
maka penambahan alkohol secar langsung dianggap lebih efektif daripada
menambahkan gula untuk diubah menjadi alkohol. Penggunaan teknik kolom
bio-oksidasi dalam upaya meningkatkan efisiensi produksi asam asetat dengan bahan
baku air kelapa, dan mengetahui pengaruh kecepatan aerasi dan tinggi partikel
dalam kolom berikut interaksinya terhadap pembentukan asan asetat. Kolom
bio-oksidasi diisi dengan kerikil atau partikel yang dapat menyangga kehidupan
mikrobia. Udara masuk dari dasar fermentor sehingga mikrobia dapat
menggunakan substrat secara effisien. Untuk mendapatkan hasil (kadar asam
sinambung). Bertujuan untuk mengetahui kondisi yang optimum produksi asam
asetat dari air kelapa secara fermentasi kontinyu dengan menggunakan kolom
biooksidasi. Asam Asetat dengan oksidasi alkohol dibuat dengan pengaruh
bakteri asetobacter dan dibuat dengan bantuan udara pada suhu 35 oC.
Reaksinya :
C2H5OH + O2 Asetobacter (3 c) CH3COOH + H2O
Alkohol Asam asetat
Pada proses fermentasi alkohol ini, asam asetat didapat dari bahan yang
kaya gula seperti anggur, apel, malt, gula, dan sebagainya (A.O.A.C, 1970).
Asam asetat termasuk asam organik yang dapat dibuat dengan banyak cara, empat
diantaranya yaitu: oksidasi alkohol primer atau aldehid, oksidasi rantai samping
alkil pada cincin aromatik, dengan karbon dioksida, dan hidrolisis alkil sianida
(nitril) ( Hart, 2003).
Asam asetat glasial komersial dibuat dengan mereaksikan methanol dan
karbon monoksida atau oksida etilen. Bahan asal dari reaksi ini di sintesa dari gas
alam, minyak bumi, atau batu bara (Fessenden, 1997).
2.3.1. Penyimpanan Asam Asetat
Asam asetat mudah menguap sehingga penyimpanannya harus dengan
wadah yang tertutup rapat, diletakkan di tempat yang terhindar dari sinar
matahari lansung dan pada suhu ruangan atau tidak lebih dari 40oC (Depkes RI,
2.4. Kegunaan Asam Asetat
Asam asetat merupakan pereaksi kimia dan bahan baku industri yang penting
untuk menghasilkan berbagai senyawa kimia. Asam asetat digunakan dalam
produksi polimer seperti polietilena tereftalat, selulosa asetat, dan polivinil asetat,
maupun berbagai macam serat dan kain. Asam asetat digunakan sebagai pengatur
keasaman dalam industri makanan. Asam asetat encer juga sering digunakan
sebagai pelunak air di rumah tangga. Penggunaan asam asetat lainnya, termasuk
penggunaan dalam cuka relatif kecil (Setiawan, 2007).
Asam asetat digunakan untuk rumah tangga, industri dan kesehatan yaitu
sebagai berikut :
a. Bahan penyedap rasa pada makanan
b. Bahan pengawet untuk beberapa jenis makanan dan merupakan pengawet
makanan secara tradisional. Daya pengawet disebabkan karena kandungan
asam asetatnya sebanyak 0,1 % asam asetat dapat menghambat
pertumbuhan bakteri spora penyebab keracunan makanan.
c. Pembuatan obat-obatan (Aspirin).
d. Bahan dasar pembuatan anhidrida asam asetat yang sangat penting
diperlukan untuk asetilasi terutama di dalam pembuatan selulosa asetat.
e. Bahan dasar untuk pembuatan banyak persenyawaan lain seperti asetil
klorida.
f. Di bidang industri karet (menggumpalkan karet).
g. 0,3 % asam asetat dapat mencegah pertumbuhan kapang penghasil
2.4.1. Dampak dari Asam Asetat
Asam asetat pekat bersifat korosif, sehingga harus digunakan dengan penuh
hati-hati. Asam asetat dapat menyebabkan luka bakar, kerusakan mata permanen,
serta iritasi pada membran mukosa (Setiawan, 2007).
Asam asetat encer, seperti pada cuka, tidak berbahaya, namun konsumsi
asam asetat yang lebih pekat adalah berbahaya bagi manusia maupun hewan,
karena dapat menyebabkan kerusakan pada sistem pencernaan, dan perubahan
yang mematikan pada keasaman darah. Asam asetat dalam cuka secukupnya
dilarutan sehingga tidak korosif, walaupun demikian, jika terus menerus makan
makanan yang mengandung cuka akan dapat merusak email gigi (Hewitt, 2003).
2.4.2. Persyaratan penggunaan Asam Asetat
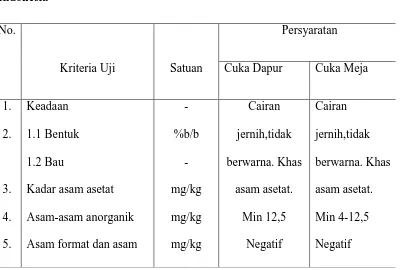
Table 2.4.2. Persyaratan penggunaan asam asetat Standar Nasional Indonesia
No.
Kriteria Uji Satuan
Persyaratan
Cuka Dapur Cuka Meja
1. 2. 3. 4. 5. Keadaan 1.1Bentuk 1.2Bau
Kadar asam asetat
Asam-asam anorganik
Asam format dan asam
2.5.Titrimetri
Titrimetri atau volumetri adalah salah satu cara pemeriksaan jumlah zat kimia
yang luas pemakaiannya. Hal ini disebabkan karena beberapa alasan. Pada satu
segi, cara ini menguntungkan karena pelaksanaannya mudah dan cepat, ketelitian
dan ketepatannya cukup tinggi. Pada segi lain, cara ini menguntungkan karena
dapat digunakan untuk menentukan kadar berbagai zat yang mempunyai sifat
yang berbeda-beda.
Dalam proses bagian demi bagian pentiter ditambahkan ke dalam larutan zat
yang akan ditentukan dengan bantuan alat yang disebut buret sampai tercapai titik
kesetaraan. Titik kesetaraan adalah titik pada saat pereaksi dan zat yang
ditentukan bereaksi sempurna secara stoikiometri. Titrasi harus dihentikan pada
dekat titik kesetaraan . Jumlah volume pentiter yang terpakai untuk mencapai titik
kesetaraan ini disebut volume kesetaraan. Dengan mengetahui volume kesetaraan,
kadar pentiter dan faktor stoikiometri, maka jumlah zat yang ditentukan dapat
dihitung dengan mudah ( Harrizul. R, 1995). oksalat
Cemaran logam
4.1 Pb
4.2 Besi (Fe)
Cemaran arsen (As)
Maks.2
Maks.0,5
Maks.0,8
Maks.1
Maks.0,3
2.6. Teori Asam Basa
Titrasi asam-basa studi kuantitatif mengenai reaksi penetralan asam-basa
paling nyaman apabila dilakukan dengan menggunakan prosedur yang disebut
titrasi (titration). Dalam percobaan titrasi, suatu larutan yang konsentrasinya
diketahui secara pasti, disebut sebagai larutan standar (standar solution),
ditambahkan secara bertahap ke larutan lain yang konsentrasinya tidak
diketahui,sampai reaksi kimia antara kedua larutan tersebut berlangsung sempurna
(Raymond. C, 2004).
Menurut Arrhenius :
Asam ialah zat yang melarutkan ke dalam air untuk memberikan ion-ion H+,
dan basa ialah zat yang melarutkan ke dalam air untuk memberikan ion-ion H-.
Contoh :
Asam Basa
Hidrogen klorida (HCL) Natrium Hidroksida (NaOH)
Hidrogen nitrat (HNO3) Kalium hidroksida (KOH)
Hidrogen sulfat (H2SO4) Kalsium Hidroksida Ca(OH)2
Asam asetat (HC2H3O2) Amonia (NH3)
Menurut Bronsted Lowry :
Asam sebagai suatu donor proton dan basa sebagai penerima proton.Bila
suatau asam menyumbangkan sebuah proton, asam ini akan menjadi basa
konjugatnya sendiri, yang dapat menerima proton. Bila suatu basa menerima
menyumbangkan sebuah proton. Pasangan spesi disebut pasangan asam-basa
konjugat.
Menurut Lewis :
Asam adalah penerima pasangan elektron dan basa adalah donor pasangan
elektron (Charles, 1996).
Contoh Reaksi :
Menurut Arrhenius :
Asam : HA + aq H+ (aq) + A- (aq)
Basa : BOH + aq B+ (aq) + OH- (aq)
(Syukri.S, 1999).
Menurut BronstedLowry :
Reaksidasarasammenghasilkanasamdan basalain. Reaksi berikutdengan
demikianreaksiasam-basamenurutBronsted:
HC2H2O2 + H2O C2H3O2- + H3O+
asam basa basa asam
Menurut Lewis :
Tabel 2.6. Asam Lemah dan Asam Kuat
No. Asam Lemah Asam Kuat
1.
2.
3.
4.
5.
Asam Formiat
Asam Karbonat
Asam Oksalat
Asam Etanoat
Asam Sitrat
Asam Klorida
Asam Sulfat
Asam Nitrat
Asam Fossfat
Asam Perklorat
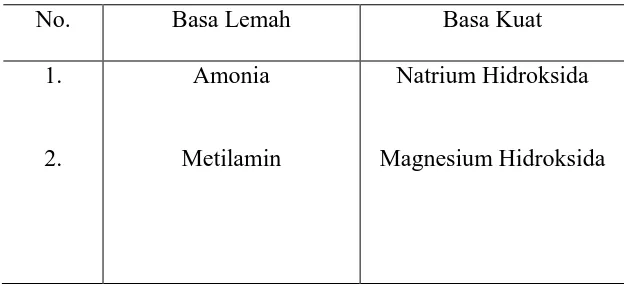
Tabel 2.6. Basa Lemah dan Basa Kuat
No. Basa Lemah Basa Kuat
1.
2.
Amonia
Metilamin
Natrium Hidroksida
Magnesium Hidroksida
Asam lemah dan basa lemah yang ada dalam produk makanan dan
minuman, sabun, detergen, larutan pembersih dan obat-obatan mungkin aman
untuk tubuh manusia. Oleh karena itu, mungkin kamu bisa mengetahui secara
langsung sifat asam dan basa yang terkandung di dalamnya. Tetapi tidak demikian
dengan asam kuat dan basa kuat karena jika terkena kontak langsung dengan
mengetahui sifat asam dan basa yaitu dengan menggunakan indikator asam basa
(Hewitt, 2003).
2.6.1. Indikator Asam Basa
Indikator asam-basa adalah senyawa organik yang berubah warnanya dalam
larutan sesuai dengan pH larutan. Contohnya adalah lakmus yang berwarna merah
dalam larutan bersifat asam dan berwarna biru dalam larutan yang bersifat basa.
Indikator asam-basa biasanya merupakan asam atau basa lemah, atau secara
umum dapat dikatakan protolit lemah. Kesetimbangan asam-basa indikator yang
berupa asam lemah dalam air dirumuskan sebagai berikut :
Hin + H2O ↔ H3O+ + In-
warna asam warna basa
Disini In menunjukkan basa pasangan dari HIn (indikator asam lemah). Seperti
terlihat dari persamaan diatas, asam dan basa pasangannya mempunyai warna
yang berbeda. Itulah sebabnya warna larutan berubah dengan berubahnya pH
larutan. Dalam larutan yang bersifat asam, bentuk yang banyak jumlahnya adalah
bentuk yang terikat proton HIn, sedangkan dalam larutan yang bersifat basa
bentuk yang bentuk yang tidak berproton In- ( Harrizul. R, 1995).
Indikator asam basa adalah alat yang digunakan untuk mengetahui sifat
asam dan basa dari suatu larutan. Ada beberapa jenis indikator yang dapat
digunakan untuk membedakan sifat asam basa, antara lain kertas lakmus, pH
a. Kertas Lakmus
Ada dua jenis kertas lakmus, yaitu kertas lakmus merah dan lakmus biru.
Dalam larutan yang bersifat asam, warna kertas lakmus biru akan menjadi merah,
sedangkan kertas lakmus merah tetap. Dalam larutan basa, warna kertas lakmus
merah akan menjadi biru sedangkan kertas lakmus biru tetap. Jika tidak terjadi
perubahan pada warna kedua kertas lakmus tersebut berarti larutan tersebut
bersifat netral. Kelemahan dari kertas lakmus adalah kurang praktis dan tidak
dapat menunjukkan nilai pH larutan secara teliti.
b. Indikator universal atau pH Stick
Indikator universal hampir sama dengan kertas lakmus. Kelebihan indikator
universal adalah mampu mengukur pH suatu larutan. Penggunaannya dengan
mencelupkan indikator universal kedalam larutan yang akan diukur. Setelah
itu cocokkan warna dengan tabel warna yang telah disediakan. Dengan demikian
kamu dapat mengetahui pH dari larutan yang sudah kamu ukur.
c. Indikator Alami
Indikator alami dapat diperoleh dari beberapa jenis tumbuhan. Namun sebelum
digunakan tumbuhan tersebut harus diambil ekstraknya dengan cara dihaluskan
dan ditambahkan sedikit air. Ekstrak dari tumbuhan seperti kunyit, mahkota bunga
sepatu, kol merah akan berubah warna dalam lingkungan asam atau basa.
Perubahan warnanya tergantung pada warna masing-masing ekstrak tumbuhan
d. Larutan Indikator Universal
Indikator universal adalah gabungan dari beberapa indikator. Larutan Indikator
universal yang biasa digunakan dalam laboratorium terdiri dari metil
jingga(trayek : 2,9-4,0), metil merah (trayek :4,2-6,3), bromtimol biru (trayek :
6,0-7,6), dan fenolftalein (trayek : 8,3-10,0). Indikator-indikator itu memberi
warna yang berbeda tergantung pada pH larutan. Salah satu indicator yang
memiliki tingkat kepercayaan yang baik adalah indikator universal. Indikator
universal adalah indicator yang terdiri atas berbagai macam indikator yang
memiliki warna berbeda untuk setiap nilai pH 1-14. Indikator universal ada yang
berupa larutan dan ada juga yang berupa kertas.
Paket indikator universal tersebut selalu dilengkapidengan warna standar untuk
pH 1-14.
Cara menggunakan indikator universal adalah sebagai berikut :
1. Celupkan kertas indicator universal pada larutan yang akan diselidiki nilai
pH-nya atau meneteskan indicator universal pada larutan yang diselidiki.
2. Amati perubahan warna yang terjadi
2.6.2. Tabel Trayek pH
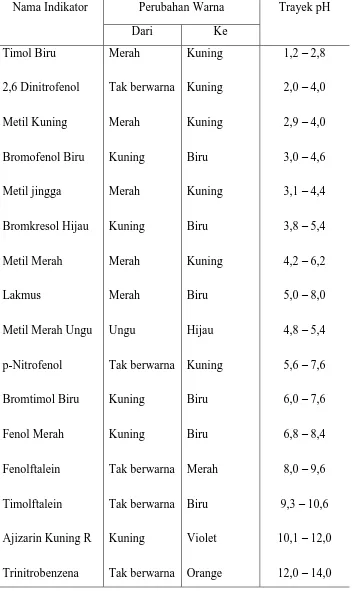
Tabel 2.6.2. Trayek pH pada berbagai larutan indikator asam basa
Nama Indikator Perubahan Warna Trayek pH
Dari Ke
Timol Biru 2,6 Dinitrofenol Metil Kuning Bromofenol Biru Metil jingga Bromkresol Hijau Metil Merah Lakmus
Metil Merah Ungu
p-Nitrofenol
Bromtimol Biru
Fenol Merah
Fenolftalein
Timolftalein
Ajizarin Kuning R
Trinitrobenzena Merah Tak berwarna Merah Kuning Merah Kuning Merah Merah Ungu Tak berwarna Kuning Kuning Tak berwarna Tak berwarna Kuning Tak berwarna Kuning Kuning Kuning Biru Kuning Biru Kuning Biru Hijau Kuning Biru Biru Merah Biru Violet Orange
1,2 – 2,8
2,0 – 4,0
2,9 – 4,0
3,0 – 4,6
3,1 – 4,4
3,8 – 5,4
4,2 – 6,2
5,0 – 8,0
4,8 – 5,4
5,6 – 7,6
6,0 – 7,6
6,8 – 8,4
8,0 – 9,6
9,3 – 10,6
10,1 – 12,0
2.7. Alat ukur pH Meter
pH Meter adalah jenis alat ukur unruk mengukur derajat keasaman atau kebasaan suatu cairan, pada pH Meter ada elektroda khusus yang berfungsi untuk
mengukur pH bahan-bahan semi padat, elktroda (probe pengukur) terhubung
sebuah alat elektronik yang mengukur dan menampilkan nilai pH. Probe adalah
bagian yang sangat penting dari pH Meter,itu adalahbatangseperti
strukturbiasanya terdiri darikaca. Di bagian bawahprobeadabola lampu, bola
lampuadalah bagiansensitifdariprobeyang berisisensor. Jangan pernah
menyentuhboladengan tangandan bersihkan denganbantuan sebuahkertas
tisupenyerapdengan tangansangat lembut, berhati-hati untuk tidak
menggosokjaringanterhadapbola kacauntuk menghindarimenciptakanstatis. Untuk
mengukurpHlarutan, probedicelupkanke dalam larutan. Probedipasang
dilengandikenal sebagaiprobelengan.Untuk mengetahui sifat asam basa suatu
larutan atau zat kita dapat menggunakan indikator asam basa. Tetapi indikator
asam basa kurang efektif dalam mengukur nilai pH dari suatu larutan. Sebelum
melakukan pengukuran pH meter harus dikalibrasi untuk mendapatkan hasil
pengukuran yang tepat, kalibrasi ini dalukukan setiap pengukuran. Untuk
penggunaan normal kalibrasi harus dilakukan pada awal setiap hari . Alasan untuk
ini adalah bahwa elektroda kaca tidak memberikan gagal direproduksi selama
periode waktu yang lebih lama . Kalibrasi harus dilakukan dengan setidaknya dua
larutan buffer standar yang mencakup rentang nilai pH yang akan diukur . Untuk
penggunaannya sangat praktis dan nilai pH dari larutan yang diukur pun langsung