PENETAPAN KADAR ASAM ASETAT DALAM LARUTAN
CUKA MAKANAN DENGAN METODE TITRIMETRI
DI BALAI BESAR PENGAWAS OBAT
DAN MAKANAN MEDAN
TUGAS AKHIR
MAHARANI HASIBUAN
122401079
PROGRAM STUDI D-3 KIMIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENETAPAN KADAR ASAM ASETAT DALAM LARUTAN
CUKA MAKANAN DENGAN METODE TITRIMETRI
DI BALAI BESAR PENGAWAS OBAT
DAN MAKANAN MEDAN
TUGAS AKHIR
Diajukan untuk melengkapi tugas dan memenuhi syarat memperoleh gelar Ahli Madya
MAHARANI HASIBUAN
122401079
PROGRAM STUDI D-3 KIMIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Penentuan Kadar Asam Asetat Dalam
Larutan Cuka Makanan Dengan Metode Titrimetri Di Balai Besar Pengawas Obat Dan Makanan Medan
Kategori : Tugas Akhir
Nama : Maharani Hasibuan
Nomor Induk Mahasiswa : 122401079
Program studi : Diploma Tiga (D-3) Kimia
Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui Oleh Medan, Juli 2015
Program Studi D-3 Kimia FMIPA USU Pembimbing, Ketua,
Dra. Emma Zaidar Nst, M.Si Dr. Rumondang Bulan, MS NIP : 195509181987012001 NIP :195408301985032001
Disetujui Oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENETAPAN KADAR ASAM ASETAT DALAM LARUTAN CUKA MAKANAN DENGAN METODE TITRIMETRI DI BALAI BESAR
PENGAWAS OBAT DAN MAKANAN MEDAN
TUGAS AKHIR
Saya mengakui bahwa tugas akhir ini adalah hasil karya saya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juli 2015
PENGHARGAAN
Puji dan syukur penulis sampaikan kehadirat Allah SWT atas segala rahmat dan hidayahnya yang telah diberikan kepada penulis, sehingga penulis dapat menyelesaikan tugas akhir ini tepat pada waktunya. Tugas Akhir ini disusun sebagai persyaratan untukmenyelesaikanpendidikan Program Studi D-3 Kimia IndustriFakultasMatematikadanIlmuPengetahuanAlam, Universitas Sumatera Utara dengan judul ” Penetapan Kadar Asam Asetat Dalam Larutan Cuka Makanan Dengan MetodeTitrimetri Di Balai Besar Pengawas Obat Dan Makanan Medan ”.
Dalampenyusunan tugas akhir ini penulis banyak menemukan kendala. Namun berkat bantuan, bimbingan dan dukungan dari berbagai pihak, akhirnya penulis dapat mengatasi berbagai kendala tersebut dengan baik.Atasbantuan, bimbingandandukungandariberbagaipihakmakapada kesempatan ini dengan segala ketulusan dan kerendahan hati, penulis mengucapkan terima kasih kepada :
1. Kedua orang tua tercinta, Ayahanda Alm. Pardamean Hasibuan dan Ibunda Tina Sahara Nasution serta, kakakFuji Namora Hasibuan S.Kep, abang Aswan Syahmuda Zakaria Hasibuan S.S dan abang Zulfikar Hasibuan S.E yang telah memberikan bantuan moril dan materil serta doa restu demi kesuksesan penulis.
2.Bapak Dr. Sutarman, M.Sc selaku Dekan FMIPA USU.
3. Ibu Dr. Rumondang Bulan, MS selaku Ketua Departemen Kimia FMIPA
meluangkan waktu, tenaga, dan pikiran dalam membantu penulisan tugas akhir ini.
6. Bapak Drs. M.Ali Bata Harahap, Apt,
M.KesselakuKepalaBesarBalaiBesarPengawasObatdanMakanan yang telah memberikan tempat untuk melaksanakan PKL.
7. BapakBernardus L. Tobing, SE selaku kepala Sub Bagian Tata Usaha BalaiBesarPengawasObatdanMakananMedan yang telah memberikan pengarahan kepada penulis pada saat PKL.
8. IbuLambokOktavia SR, M kes, Apt selakuKoordinatorpembimbingyang telah memberikan pengarahan dan membimbing penulis selama pelaksanaan PKL diBalaiBesarPengawasObatdanMakanan.
9. IbuLusi
yangtelahmemberikanpengarahankepadapenulispadasaatPKLdiBalaiBesarPen gawasObatdanMakanan.
11. Abangda Mahatir Muhammad D3 Analis Farmasi Angkatan 2010 yang telah membantu kami selama melaksakan PKL.
12. Teman-teman seperjuangan D-3 Kimia stambuk 2012 dan seluruh pihak yang tidak dapat penulis sebutkan satu persatu yang turut andil dalam membantu penulis sehingga selesainya tugas akhir ini.
PenulismenyadaribahwaTugasAkhirinimasihjauhdarikesempurnaan.Olehkarenaitu
penulissangatmengharapkankritikdan saran yang
bersifatmembangundariparapembacauntukkesempurnaanTugasAkhirini.Segalaben
tukmasukan yang
diberikanakanpenulisterimadengansenanghatidanpenulisucapkanterimakasih.Hara panpenulis,
semogaTugasAkhirinidapatbermanfaatbagiparapembacaumumnyadanbagipenulis khususnya.
Medan,Mei 2015
PENETAPAN KADAR ASAM ASETAT DALAM LARUTAN CUKA MAKANAN DENGAN METODETITRIMETRI DI BALAI BESAR
PENGAWAS OBAT DAN MAKANAN MEDAN
ABSTRAK
DETERMINATION OFACETIC ACIDLEVELSIN
VINEGARFOODSOLUTIONSWITHMETHODTITRIMETRY IN THECENTERSUPERVISOR OFDRUGANDFOOD MEDAN
ABSTRACT
Acetic acid is a one of industrial product that large consumed in Indonesia. Acetic acid can make from a substrate, which consist of ethanol. It could make from many kind of material such asfruits, pine aplle leather, coffe pulp, and coconut water.Donewithmethod titrimetry of determination of acetic acid levels in vinegar food solutions. The results obtained acetic acid levelsin the solution ofvinegar
Mis25.91% and theconcentrationof aceticacidin thevinegarsolutionvinegar
Vis6.54%.IndonesianNational Standardaceticacidinthe vinegarsolution
DAFTAR ISI
2.4.2. Persyaratan penggunaan Asam Asetat 10
3.5.1. Pembuatan Pereaksi 20 3.5.1.1. Pembuatan Natrium Hidroksida 0,1 N 20 3.5.1.2. Pembuatan Larutan Baku NaOH 0,1 N 20 3.5.1.3. Pembuatan Fenolftalein 0,1 % 21 3.5.2. Penentuan Kadar Asam Asetat 21 Bab 4. Hasil dan Pembahasan
4.1. Hasil Data Pengamatan 22
4.2. Perhitungan 23
4.3. Reaksi 24
4.4. Pembahasan 24
Bab 5. Kesimpulan dan Saran
5.1. Kesimpulan 26
5.2. Saran 26
Daftar Pustaka 27
DAFTAR TABEL
Nomor
Tabel Judul Halaman
2.4.2. Persyaratan Asam Asetat Standar Nasional Indonesia 10
2.6. Asam Basa lemah dan Kuat 13
2.6.1. TrayekpH 17
4.1. Penetapan Kadar Asam Asetat 22
4.2. Penetapan Kadar AsamAsetat 22
DAFTAR GAMBAR
Nomor
Gambar Judul Halaman
2.1. Struktur Asam Asetat 4
2.3. Reaksi Asam Asetat dengan Bakteri Asetobacter 7
2.6. Reaksi Asam Basa 12
DAFTAR LAMPIRAN
Nomor Lampiran
Judul Halaman
1. Kurva Titrasi Asam Basa 28
2.
Gambar Pereaksi Indikator Fenolftalein 0,1%, NaOH
0,1 N, Sampel Asam Cuka M, dan Asam Cuka V 28 3.
Gambar Penetapan Kadar Asam Asetat dengan
PENETAPAN KADAR ASAM ASETAT DALAM LARUTAN CUKA MAKANAN DENGAN METODETITRIMETRI DI BALAI BESAR
PENGAWAS OBAT DAN MAKANAN MEDAN
ABSTRAK
DETERMINATION OFACETIC ACIDLEVELSIN
VINEGARFOODSOLUTIONSWITHMETHODTITRIMETRY IN THECENTERSUPERVISOR OFDRUGANDFOOD MEDAN
ABSTRACT
Acetic acid is a one of industrial product that large consumed in Indonesia. Acetic acid can make from a substrate, which consist of ethanol. It could make from many kind of material such asfruits, pine aplle leather, coffe pulp, and coconut water.Donewithmethod titrimetry of determination of acetic acid levels in vinegar food solutions. The results obtained acetic acid levelsin the solution ofvinegar
Mis25.91% and theconcentrationof aceticacidin thevinegarsolutionvinegar
Vis6.54%.IndonesianNational Standardaceticacidinthe vinegarsolution
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Asam asetat merupakan salah satu produk industri yang banyak dibutuhkan di Indonesia. Saat ini di Indonesia harus mengimpor asam asetat dalam jumlah yang besar, pada tahun 1993 jumlah impornya sebesar 31.613.115,200 M ton dengan nilai $ 14.945.208,41 (Anonim, 1994).
maka penambahan alkohol secara langsung dianggap lebih efektif daripada menambahkan gula untuk diubah menjadi alkohol. Teknik kolom bio-oksidasi dalam upaya meningkatkan efisiensi produksi asam asetat dengan bahan baku air kelapa, dan mengetahui pengaruh kecepatan aerasi dan tinggi partikel dalam kolom berikut interaksinya terhadap pembentukan asan asetat (A.O.A.C, 1970).
1.2.Perumusan Permasalahan
Permasalahanyang akan di bahas dalampenetapan kadar asam asetatdalam larutan cuka makananadalah apakah kadar pemakaian asam asetat berpengaruhdengan pereaksi indikator fenolftalein dan NaOH dalam menentukan Standar Nasional Indonesia.
1.3.Tujuan
Untuk mengetahui pengaruh penetapan kadar asam asetat dalam larutan cuka makanan terhadap pereaksi indikator fenolftalein dan NaOHdalam menentukan Standar Nasional Indonesia.
1.4.Manfaat
BAB II
TINJAUAN PUSTAKA
2.1 Sejarah Asam Asetat
Nama asam asetat berasal dari kata Latin asetum, “vinegar”. Asam asetat, asam etanoat atau asam cuka adalah senyawa kimia asam organik yang merupakan asam karboksilat yang paling penting di perdagangan, industri, dan laboraturium dan dikenal sebagai pemberi rasa asam dan aroma dalam makanan. Asam cuka memiliki rumus kimia CH3-COOH, CH3COOH, atau CH3CO2H. Struktur Asam Asetat : H O
H C C
H O H
Asam asetat merupakan asam lemah yang terionisasi sebagian dalam air, walaupun demikian, keasaman asam asetat tetap lebih tinggi dibanding dengan keasaman air (Kohar, 2004).
2.2. Pengertian Asam Asetat
Asam asetat atau lebih di kenal sebagai asam cuka (CH3COOH) adalah suatu
senyawa berbentuk cairan, tak berwarna, berbau menyengat, memiliki rasa asam yang tajam dan larut di dalam air, alkohol, gliserol, dan eter. Pada tekanan asmosferik, titik didihnya 118,1 oC. Asam asetat mempunyai aplikasi yang sangat luas di bidang industri dan pangan. Di Indonesia, kebutuhan asam asetat masih harus di import, sehingga perlu di usahakan kemandirian dalam penyediaan bahan (Hardoyono, 2007).
Asam asetat merupakan salah satu produk industri yang banyak dibutuhkan di Indonesia. Saat ini di Indonesia harus mengimpor asam asetat dalam jumlah yang besar, pada tahun 1993 jumlah impornya sebesar 31.613.115,200 M ton dengan nilai $ 14.945.208,41 (Anonim, 1994).
2.2.1. Sifat Kimia
pada gugus karboksil (−COOH) dalam asam karboksilat seperti asam asetat dapat
dilepaskan sebagai ion H+ (proton), sehingga memberikan sifat asam. Asam asetat adalah asam lemah monoprotik basa konjugasinya adalah asetat (CH3COO−).
Asam asetat adalah pelarut protik hidrofilik (polar), mirip seperti air dan etanol. Asam asetat bercampur dengan mudah dengan pelarut polar atau nonpolar lainnya seperti air, kloroform dan heksana. Sifat kelarutan dan kemudahan bercampur dari asam asetat ini membuatnya digunakan secara luas dalam industri kimia dan laboratorium ( Hart, 2003).
Asam asetat mudah menguap di udara terbuka, mudah terbakar, dan dapat menyebabkan korosif pada logam. Asam asetat jika di reaksikan dengan karbonat akan menghasilkan karbon dioksida. Penetapan kadar asam asetat biasanya menggunakan basa natrium hidroksida, dimana 1 ml natrium hidroksida 1 N setara dengan 60,05 mg CH3COOH (Depkes RI,1995).
2.2.2. Sifat Fisika
Sifat fisika dari asam asetat adalah bentuk cairan jernih, tidak berwarna, berbau menyengat, pH asam, memiliki rasa asam yang sangat tajam,mempunyai titik beku 16,6 oC, titik didih 118,1 oC dan larut dalam air, alkohol, dan eter. Asam asetat di buat dengan fermentasi alkohol oleh bakteri Acetobacter. Pembuatan dengan cara ini bisa digunakan dalam pembuatan cuka. Asam asetat mempunyai rumus molekul CH3COOH dan bobot molekul 60,05 (Depkes RI,
2.3. Pembuatan Asam Asetat
sinambung). Bertujuan untuk mengetahui kondisi yang optimum produksi asam asetat dari air kelapa secara fermentasi kontinyu dengan menggunakan kolom biooksidasi. Asam Asetat dengan oksidasi alkohol dibuat dengan pengaruh bakteri asetobacter dan dibuat dengan bantuan udara pada suhu 35 oC.
Reaksinya :
C2H5OH + O2 Asetobacter (3 c) CH3COOH + H2O
Alkohol Asam asetat
Pada proses fermentasi alkohol ini, asam asetat didapat dari bahan yang kaya gula seperti anggur, apel, malt, gula, dan sebagainya (A.O.A.C, 1970).
Asam asetat termasuk asam organik yang dapat dibuat dengan banyak cara, empat diantaranya yaitu: oksidasi alkohol primer atau aldehid, oksidasi rantai samping alkil pada cincin aromatik, dengan karbon dioksida, dan hidrolisis alkil sianida (nitril) ( Hart, 2003).
Asam asetat glasial komersial dibuat dengan mereaksikan methanol dan karbon monoksida atau oksida etilen. Bahan asal dari reaksi ini di sintesa dari gas alam, minyak bumi, atau batu bara (Fessenden, 1997).
2.3.1. Penyimpanan Asam Asetat
2.4. Kegunaan Asam Asetat
Asam asetat merupakan pereaksi kimia dan bahan baku industri yang penting untuk menghasilkan berbagai senyawa kimia. Asam asetat digunakan dalam produksi polimer seperti polietilena tereftalat, selulosa asetat, dan polivinil asetat, maupun berbagai macam serat dan kain. Asam asetat digunakan sebagai pengatur keasaman dalam industri makanan. Asam asetat encer juga sering digunakan sebagai pelunak air di rumah tangga. Penggunaan asam asetat lainnya, termasuk penggunaan dalam cuka relatif kecil (Setiawan, 2007).
Asam asetat digunakan untuk rumah tangga, industri dan kesehatan yaitu sebagai berikut :
a. Bahan penyedap rasa pada makanan
b. Bahan pengawet untuk beberapa jenis makanan dan merupakan pengawet makanan secara tradisional. Daya pengawet disebabkan karena kandungan asam asetatnya sebanyak 0,1 % asam asetat dapat menghambat pertumbuhan bakteri spora penyebab keracunan makanan.
c. Pembuatan obat-obatan (Aspirin).
d. Bahan dasar pembuatan anhidrida asam asetat yang sangat penting diperlukan untuk asetilasi terutama di dalam pembuatan selulosa asetat. e. Bahan dasar untuk pembuatan banyak persenyawaan lain seperti asetil
klorida.
f. Di bidang industri karet (menggumpalkan karet).
2.4.1. Dampak dari Asam Asetat
Asam asetat pekat bersifat korosif, sehingga harus digunakan dengan penuh hati-hati. Asam asetat dapat menyebabkan luka bakar, kerusakan mata permanen, serta iritasi pada membran mukosa (Setiawan, 2007).
Asam asetat encer, seperti pada cuka, tidak berbahaya, namun konsumsi asam asetat yang lebih pekat adalah berbahaya bagi manusia maupun hewan, karena dapat menyebabkan kerusakan pada sistem pencernaan, dan perubahan yang mematikan pada keasaman darah. Asam asetat dalam cuka secukupnya dilarutan sehingga tidak korosif, walaupun demikian, jika terus menerus makan makanan yang mengandung cuka akan dapat merusak email gigi (Hewitt, 2003).
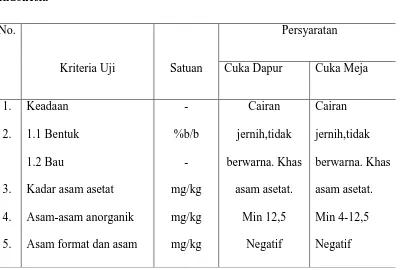
2.4.2. Persyaratan penggunaan Asam Asetat
Table 2.4.2. Persyaratan penggunaan asam asetat Standar Nasional
2.5.Titrimetri
Titrimetri atau volumetri adalah salah satu cara pemeriksaan jumlah zat kimia yang luas pemakaiannya. Hal ini disebabkan karena beberapa alasan. Pada satu segi, cara ini menguntungkan karena pelaksanaannya mudah dan cepat, ketelitian dan ketepatannya cukup tinggi. Pada segi lain, cara ini menguntungkan karena dapat digunakan untuk menentukan kadar berbagai zat yang mempunyai sifat yang berbeda-beda.
Dalam proses bagian demi bagian pentiter ditambahkan ke dalam larutan zat yang akan ditentukan dengan bantuan alat yang disebut buret sampai tercapai titik kesetaraan. Titik kesetaraan adalah titik pada saat pereaksi dan zat yang ditentukan bereaksi sempurna secara stoikiometri. Titrasi harus dihentikan pada dekat titik kesetaraan . Jumlah volume pentiter yang terpakai untuk mencapai titik kesetaraan ini disebut volume kesetaraan. Dengan mengetahui volume kesetaraan, kadar pentiter dan faktor stoikiometri, maka jumlah zat yang ditentukan dapat dihitung dengan mudah ( Harrizul. R, 1995).
2.6. Teori Asam Basa
Titrasi asam-basa studi kuantitatif mengenai reaksi penetralan asam-basa paling nyaman apabila dilakukan dengan menggunakan prosedur yang disebut titrasi (titration). Dalam percobaan titrasi, suatu larutan yang konsentrasinya diketahui secara pasti, disebut sebagai larutan standar (standar solution), ditambahkan secara bertahap ke larutan lain yang konsentrasinya tidak diketahui,sampai reaksi kimia antara kedua larutan tersebut berlangsung sempurna (Raymond. C, 2004).
Menurut Arrhenius :
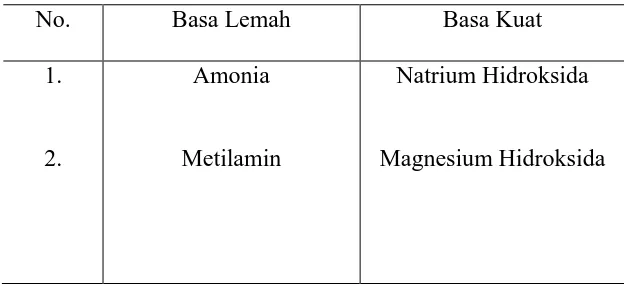
Asam ialah zat yang melarutkan ke dalam air untuk memberikan ion-ion H+, dan basa ialah zat yang melarutkan ke dalam air untuk memberikan ion-ion H-. Contoh :
Asam Basa
Hidrogen klorida (HCL) Natrium Hidroksida (NaOH) Hidrogen nitrat (HNO3) Kalium hidroksida (KOH)
Hidrogen sulfat (H2SO4) Kalsium Hidroksida Ca(OH)2
Asam asetat (HC2H3O2) Amonia (NH3)
Menurut Bronsted Lowry :
menyumbangkan sebuah proton. Pasangan spesi disebut pasangan asam-basa konjugat.
Menurut Lewis :
Asam adalah penerima pasangan elektron dan basa adalah donor pasangan elektron (Charles, 1996).
Contoh Reaksi : Menurut Arrhenius :
Asam : HA + aq H+ (aq) + A- (aq) Basa : BOH + aq B+ (aq) + OH- (aq) (Syukri.S, 1999).
Menurut BronstedLowry :
Reaksidasarasammenghasilkanasamdan basalain. Reaksi berikutdengan
demikianreaksiasam-basamenurutBronsted:
HC2H2O2 + H2O C2H3O2- + H3O+ asam basa basa asam
Menurut Lewis :
Tabel 2.6. Asam Lemah dan Asam Kuat
Tabel 2.6. Basa Lemah dan Basa Kuat
mengetahui sifat asam dan basa yaitu dengan menggunakan indikator asam basa (Hewitt, 2003).
2.6.1. Indikator Asam Basa
Indikator asam-basa adalah senyawa organik yang berubah warnanya dalam larutan sesuai dengan pH larutan. Contohnya adalah lakmus yang berwarna merah dalam larutan bersifat asam dan berwarna biru dalam larutan yang bersifat basa. Indikator asam-basa biasanya merupakan asam atau basa lemah, atau secara umum dapat dikatakan protolit lemah. Kesetimbangan asam-basa indikator yang berupa asam lemah dalam air dirumuskan sebagai berikut :
Hin + H2O ↔ H3O+ + In- warna asam warna basa
Disini In menunjukkan basa pasangan dari HIn (indikator asam lemah). Seperti terlihat dari persamaan diatas, asam dan basa pasangannya mempunyai warna yang berbeda. Itulah sebabnya warna larutan berubah dengan berubahnya pH larutan. Dalam larutan yang bersifat asam, bentuk yang banyak jumlahnya adalah bentuk yang terikat proton HIn, sedangkan dalam larutan yang bersifat basa bentuk yang bentuk yang tidak berproton In- ( Harrizul. R, 1995).
a. Kertas Lakmus
Ada dua jenis kertas lakmus, yaitu kertas lakmus merah dan lakmus biru. Dalam larutan yang bersifat asam, warna kertas lakmus biru akan menjadi merah, sedangkan kertas lakmus merah tetap. Dalam larutan basa, warna kertas lakmus merah akan menjadi biru sedangkan kertas lakmus biru tetap. Jika tidak terjadi perubahan pada warna kedua kertas lakmus tersebut berarti larutan tersebut bersifat netral. Kelemahan dari kertas lakmus adalah kurang praktis dan tidak dapat menunjukkan nilai pH larutan secara teliti.
b. Indikator universal atau pH Stick
Indikator universal hampir sama dengan kertas lakmus. Kelebihan indikator universal adalah mampu mengukur pH suatu larutan. Penggunaannya dengan mencelupkan indikator universal kedalam larutan yang akan diukur. Setelah itu cocokkan warna dengan tabel warna yang telah disediakan. Dengan demikian kamu dapat mengetahui pH dari larutan yang sudah kamu ukur.
c. Indikator Alami
d. Larutan Indikator Universal
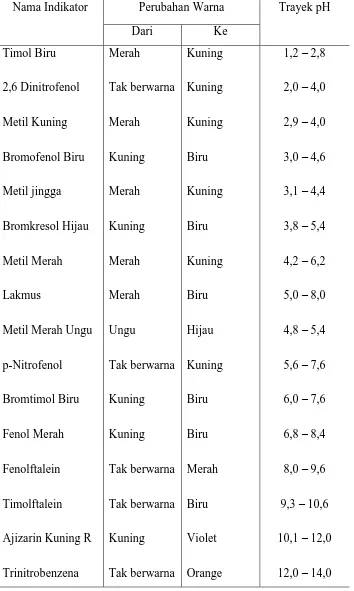
Indikator universal adalah gabungan dari beberapa indikator. Larutan Indikator universal yang biasa digunakan dalam laboratorium terdiri dari metil jingga(trayek : 2,9-4,0), metil merah (trayek :4,2-6,3), bromtimol biru (trayek : 6,0-7,6), dan fenolftalein (trayek : 8,3-10,0). Indikator-indikator itu memberi warna yang berbeda tergantung pada pH larutan. Salah satu indicator yang memiliki tingkat kepercayaan yang baik adalah indikator universal. Indikator universal adalah indicator yang terdiri atas berbagai macam indikator yang memiliki warna berbeda untuk setiap nilai pH 1-14. Indikator universal ada yang berupa larutan dan ada juga yang berupa kertas.
Paket indikator universal tersebut selalu dilengkapidengan warna standar untuk pH 1-14.
Cara menggunakan indikator universal adalah sebagai berikut :
1. Celupkan kertas indicator universal pada larutan yang akan diselidiki nilai pH-nya atau meneteskan indicator universal pada larutan yang diselidiki.
2. Amati perubahan warna yang terjadi
2.6.2. Tabel Trayek pH
Tabel 2.6.2. Trayek pH pada berbagai larutan indikator asam basa
Nama Indikator Perubahan Warna Trayek pH
2.7. Alat ukur pH Meter
BAB III
METODOLOGI PENELITIAN
3.1. Alat dan Bahan
3.1.1. Alat
Nama Alat Ukuran Merk
Erlenmeyer 250 ml Pyrex
Gelas ukur 100 ml Pyrex
Labu ukur 250 ml Pyrex
Buret 10 ml Pyrex
Pipet volume 25 ml Pyrex
Pipet tetes - -
Statif dan klem - -
3.2. Bahan-bahan
Asam cuka M
Asam cuka V
3.3.Pereaksi
Indikator Fenolftalein 0,1 % NaOH 0,1 N
Sampel yang digunakan pada pengujian ini adalah sampel yang diperoleh dari Balai Besar Pengawas Obat dan Makanan di Medan tahun anggaran 2015.
Berikut data lengkap mengenai sampel : Nama Sampel I : Asam cuka M Wadah Kemasan : Plastik
Pabrik : PT. Inkenas Agung Jakarta Komposisi : Air dan asam asetat glasial
Nama Sampel II : Asam cuka V Wadah Kemasan : Botol Kaca
Pabrik : PT. Kunci Kencan Jakarta Komposisi : Beras dan Air
3.5. Prosedur Penelitian
3.5.1. Pembuatan Pereaksi
3.5.1.1. Pembuatan Natrium Hidroksida 0,1N
Ditimbang Kristal NaOH 0,1 N sebanyak 3,999 gram .
3.5.1.2. Pembuatan Larutan Baku NaOH 0,1 N
Ditimbang 0,4 gram K-Biftalat (P) yang telah dikeringkan 120oC selama
2jam.
Dilarutkan ke dalam labu ukur 75 ml aquades bebas CO₂.
Dititrasi dengan NaOH 0,1 N menggunakan indikator fenolftalein sampai
terjadi perubahan warna merah jambu.
3.5.1.3. Pembuatan Fenolftalein 0,1%
Ditimbang 0,1 gram fenolftalein.
Dimasukkan ke dalam labu ukur 100 ml. Ditambahkan etanol, diaduk hingga larut.
Diencerkan dengan etanol sampai garis tanda.
3.5.2. Penentuan Kadar Asam Asetat
Ditimbang 5 gram sampel.
Dimasukkan ke dalam labu ukur 250 ml dan tambahkan air aquades sampai
garis tanda.
Dipipetkan 25 ml larutan ke dalam Erlenmeyer 250 ml.
Ditambahkan 5 ml (1 ml ± 20 tetes) indikator fenolftalein.
BAB IV
Tabel 4.1. Penetapan kadar asam asetat dalam larutan cuka makanan (M)
Sampel I (M) Berat Wadah (g) BW + ISI (g) Volume Titrasi
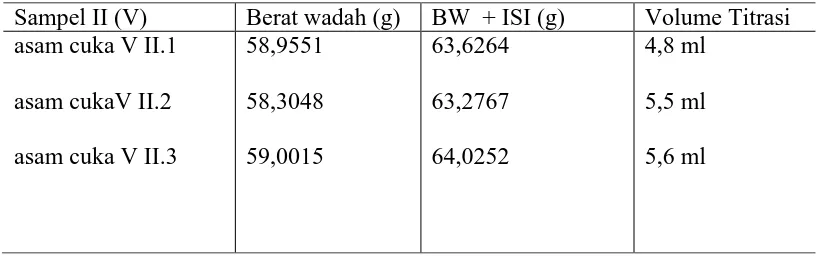
Tabel 4.2. Penetapan kadar asam asetat dalam larutan cuka makanan (V)
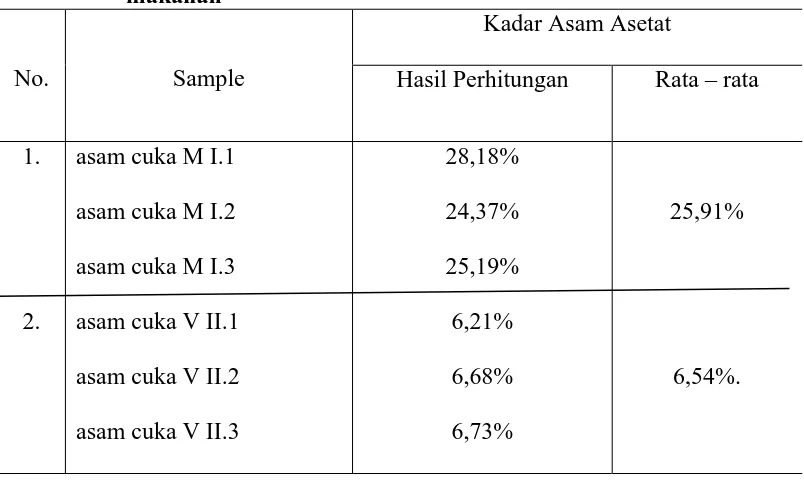
Berdasarkan hasil rata-rata yang di peroleh dari penetapan kadar asam asetat dalam asam cuka M adalah 25,91% dan kadar asam asetat dalam asam cuka V adalah 6,54%. Dapat di lihat di tabel berikut ini :
Tabel 4.3. Hasil rata-rata penetapan kadar asam asetat dalam larutan cuka makanan
Sampel Asam cuka M tidak memenuhi syarat.Sampel Asam cuka V memenuhi syarat.
Persyaratan kadar asam asetat Standar Nasional Indonesia dalam larutan cuka makanan dengan metode titrimetri adalah 4-12%.
Untuk perhitungan asam cuka M I.2, I.3, dan asam cuka V II.1, II.2, II.3 dihitung seperti cara diatas.
4.3. Reaksi
Fenolftalein + NaOH
OH OH ONa O
C + 2 NaOH C + 2H2O
O
C C ONa
O O
Bening Merah Lembayung
4.4. Pembahasan
Titrasi titrimetri atau analisis volumetri adalah salah satu cara pemeriksaan jumlah zat kimia yang luas pemakaiannya. Hal ini disebabkan karena beberapa alasan. Pada satu segi, cara ini mengguntungkan karena pelaksanaanya mudah dan cepat, ketelitian dan ketepatannya cukup tinggi (Harrizul, R. 1995).
Disamping itu, pada pengujian dilakukan dengan metode titrimetri karena acuan dari Laboratorium Pangan dan Bahan Berbahaya Balai Besar POM di Medan adalah SNI 01-3711-1995, yang menyebutkanbahwapenentuan kadar asam
o o
O
o
asetat dilakukan dengan metodetitrimetri.Penetuan kadar asam asetat dalam larutan cuka makanan menggunakan pereaksi indikator fenolftalein 0,1% dan NaOH 0,1 N. Hasil kadar asam cukaM I.1adalah 28,18%, hasil kadar asam cuka M I.2adalah 24,37%, hasil kadar asam cuka M I.3 adalah 25,19%. Dan hasil kadar asam cuka V II.1 adalah 6,21%, hasil kadar asam cuka V II.2 adalah 6,68%, dan hasil kadar asam cuka V II.3 adalah 6,73%.
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Pemakaianpereaksi indikator fenolftalein dan NaOHyang diperlukan pada penetapan kadar asam asetat dalam larutan cuka makanandan untuk mutu lebih bagus digunakan indikator fenolftalein 0,1% dan NaOH 0,1 N karena sudah tercapai untuk menghasilkan mutu untuk penetapan kadar asam asetat dalam menentukan Standar Nasional Indonesia.
5.2.Saran
DAFTAR PUSTAKA
Anonim, 1994. Statistik Indonesia. Biro Pusat Statistik. Jakarta.
A.O.A.C. 1970. Official Methodes of Analysis of the Analytical Chemistry. Washington. D.C.
Charles, W. 1996. Ilmu Kimia Untuk Universitas. Penerbit Erlangga. Jakarta. David, E. 1959. Theory and Problems of Beginning Chemistry. Third Edition.
Mcgraw Hill. New York.
Fessenden, R.J. dan Fessenden, J.S. 1997. Dasar-Dasar Kimia Organik. BinarupaAksara. Jakarta.
Hardoyo, A.E.T. 2007. Kondisi Optimum Fermentasi Asam Asetat Menggunakan Acetobacter aceti. Jakarta.
Harrizul, R. 1995. Asas Pemeriksa Kimia. Penerbit UI-press. Jakarta.
Hart, H dan Craine, L. 2003. Kimia Organik. Edisi II. Penerbit Erlangga. Jakarta. Hewitt, P.G. 2003. Conseptual Integrated Science Chemistry. San Fransisco:
Pearson Education, Inc.
James, T. And Robert, M.H. 2000. The Science an Integrated Approach Chemistry. New York : John Willey and Sons. Inc.
Kohar, H.J. dan Agustanti. 2004. Daun Kangkung (Ipomoea Reptans) Yang
Syukri, S. 1999. Kimia Dasar. Penerbit ITB. Padang.
Tillery, E. and Ross. 2007. Integrated Science. Mcgraw Hill Company. New York.