xviii INTISARI
Antioksidan merupakan suatu senyawa yang dapat menyumbangkan elektronya pada radikal bebas. Cabai rawit merah mengandung kapsaisin yang dapat digunakan sebagai antioksidan.
Penelitian ini bertujuan untuk menentukan aktivitas antioksidan dan kadar kapsaisin dalam ekstrak etanolik buah cabai rawit merah. Ekstrak etanolik buah cabai rawit merah diuji aktivitas antioksidan dengan metode 1,1-difenil-2-pikril-hidrazil (DPPH), yang dinyatakan dalam IC50. IC50 adalah konsentrasi ekstrak yang dapat mengikat DPPH sebanyak 50%. Adanya senyawa antioksidan yang mengikat radikal bebas akan ditunjukkan dengan adanya pemudaran warna ungu DPPH. Absorbansi DPPH diukur dengan menggunakan spektrofotometer visibel pada panjang gelombang maksimum 517,5 nm. Penetapan kadar kapsaisin dalam ekstrak etanolik buah cabai rawit merah dilakukan dengan metode KLT Densitometri. Fase gerak yang digunakan adalah toluen : kloroform : aseton (45:25:30) dan fase diam yang digunakan adalah silka gel 60 F254
Hasil penelitian menunjukkan IC50 dari kapsaisin sebesar 15,99 ± 4,18 µg/ml
dan ekstrak etanolik buah cabai rawit merah sebesar 107,75 ± 12,25 µg/ml, yang didapatkan dengan ekstrapolasi. Serta kadar kapsaisin yang diperoleh sebesar 0,135 ± 0,002 % b/b, dengan catatan metode analisis kuantitatif belum tervalidasi.
Kata kunci : cabai rawit merah (Capsicum frutescens L.), DPPH, aktivitas antioksidan, kapsaisin, KLT Densitometri.
xix ABSTRACT
Antioxidants are substance that donate electrons to the free radical. Red chili pepper (Capsicum frutescens) contain capsaicin compound that can be used as antioxidant.
This research was conducted to determine antioxidant activity and capsaicin concentration in red chili pepper ethanolic extract. The antioxidant activity of red chili pepper ethanolic extract is tested with 1,1-diphenyl-2-picrylhydrazyl (DPPH) method, that is expressed as IC50. IC50 is concentration that can scavange 50% of free
radical. The presence of antioxidant compounds that scavenge free radicals is indicated by DPPH discoloration. Absorbance of DPPH is measured by spectrophotometer visible at maximum wavelength of 517,5 nm. Assay of capsaicin is performed by thin layer chromatography (TLC) densitometry method. The mobile phase used is toluene : chloroform : acetone (45:25:30) and the stationary phase used is silica gel 60 F254.
The result showed that IC50 of capsaicin is 15,99 ± 4,18 µg/ml and red chili
pepper ethanolic extract is 107,75 ± 12,25 µg/ml, that obatained by extrapolating and the capsaicin content is 0,135 ± 0,002 % b/b, with record of quantitative analysis method has not been validated.
i
UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOLIK BUAH CABAI RAWIT MERAH (Capsicum frutescens L.) DENGAN METODE DPPH (1,1– difenil-2-pikrilhidrazil) DAN PENETAPAN KADAR KAPSAISIN SECARA
KROMATOGRAFI LAPIS TIPIS (KLT) – DENSITOMETRI SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Christina
NIM : 098114089
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
v
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini
tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan
dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Apabila di kemudian hari ditemukan indikasi plagiarism dalam naskah ini,
maka saya bersedia menanggung segala sanksi sesuai peraturan perundang-undangan
yang berlaku.
Yogyakarta, 18 Maret 2013
Penulis
vi
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma :
Nama : Christina Nomor mahasiswa : 098114089
Demi pengembangan ilmu pengetahuan, saya memberikan kepada perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOLIK BUAH CABAI RAWIT MERAH (Capsicum frutescens L.) DENGAN METODE DPPH (1,1– difenil-2-pikrilhidrazil) DAN PENETAPAN KADAR KAPSAISIN SECARA KROMATOGRAFI LAPIS TIPIS (KLT) – DENSITOMETRI
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di Yogyakarta Pada tanggal :
Yang Menyatakan
vii PRAKATA
Puji syukur kepada Tuhan atas berkat rahmat dan anugerah-Nya, sehingga
penulis dapat menyelesaikan skripsi yang berjudul “Uji Aktivitas Antioksidan
Ekstrak Etanolik Buah Cabai Rawit Merah (Capsicum frutescens L.) dengan Metode DPPH (1,1–difenil-2-pikrilhidrazil) dan Penetapan Kadar Kapsaisin secara Kromatografi Lapis Tipis (KLT) – Densitometri”. Skripsi ini disusun untuk memenuhi salah satu syarat untuk memperoleh gelar Sarjana Farmasi
Universitas Sanata Dharma.
Penulisan skripsi yang dilakukan oleh penulis dapat terselesaikan dengan
baik atas bimbingan, bantuan, dukungan, dan doa dari berbagai pihak. Pada
kesempatan in penulis ingin mengucapkan terima kasih kepada :
1. Bapak Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
2. Bapak Prof. Dr. C.J. Soegihardjo, Apt., selaku Dosen Pembimbing yang telah
banyak membantu serta memberikan bimbingan kepada Penulis mulai pada
saat penyusunan proposal, penelitian hingga penyelesaian skripsi ini.
3. Bapak Yohanes Dwiatmaka, M.Si., selaku Dosen Penguji yang telah bersedia
menguji skripsi ini, serta memberikan pengarahan dan saran.
4. Ibu Lucia Wiwid Wijayanti, M.Si., selaku Dosen Penguji yang telah bersedia
viii
5. Ibu Agustina Setiawati, S. Farm, Apt, M.Sc., selaku dosen pembimbing
akademik yang telah memberikan bimbingan.
6. Segenap laboran, Mas Wagiran, Mas Bimo, Mas Kayat, Pak Parlan atas
segala bantuan selama penulis melakukan penelitian di laboratorium.
7. Kakakku, Sony Wibowo atas doa dan dukungan yang diberikan selama ini.
8. Sahabat-sahabat seperjuanganku, Vanny Christy dan Yenny atas
kebersamaan, keceriaan dan bantuan selama penyelesaian skripsi ini.
9. Teman sepermainanku tercinta Kak Umi, Kak Nina, Adel, Riza, Evy untuk
setiap dukungan dan semangat yang diberikan.
10.Sahabat LC JOY, yang telah mendukung dalam doa selama ini.
11.Teman-teman kelas B 2009, kelompok praktikum B, dan seluruh angkatan
2009 yang lain, terima kasih untuk kebersamaan, keceriaan, keseruan yang
telah dilalui selama ini.
12.Semua pihak yang tidak dapat Penulis sebutkan satu persatu yang telah
memberikan dukungan dan bantuan sehingga skripsi ini dapat terselesaikan.
Penulis menyadari masih adanya kekurangan dalam penyusunan skripsi ini
karena keterbatasan penulis. Oleh karena itu, penulis mengharapkan kritik dan saran
yang membangun dari semua pihak. Penulis berharap skripsi ini dapat memberikan
manfaat dan sumbangan dalam perkembangan ilmu pengetahuan.
ix DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAAN KARYA ... v
HALAMAN PERSETUJUAN PUBLIKASI ... vi
PRAKATA ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
INTISARI ... xviii
ABSTRACT ... xix
BAB I PENGANTAR ... 1
A. Latar belakang ... 1
1. Permasalahan... 3
2. Keaslian penelitian ... 3
3. Manfaat penelitian ... 4
B. Tujuan ... 5
x
A. Cabai rawit ... 6
1. Klasifikasi tanaman ... 6
2. Nama tanaman ... 6
3. Morfologi tanaman ... 7
4. Kegunaan dan kandungan kimia ... 7
B. Kapsaisin ... 8
C. Radikal bebas ... 9
D. Antioksidan ... 10
E. DPPH ... 11
F. Ekstraksi ... 12
G. Validasi metode ... 15
H. Spektrofotometri visible ... 17
I. KLT Densitometri ... 18
J. Landasan teori ... 20
K. Hipotesis ... 21
BAB III METODE PENELITIAN... 22
A. Rancangan penelitian ... 22
B. Variabel penelitian ... 22
C. Definisi operasional ... 22
D. Bahan dan alat penelitian ... 23
E. Tata cara penelitian ... 24
xi
2. Pengumpulan bahan ... 24
3. Pembuatan ekstrak cabai rawit merah ... 24
4. Pengujian aktivitas antioksidan ... 24
a. Pembuatan larutan DPPH ... 24
b. Pembuatan larutan stok kapsaisin ... 25
c. Pembuatan larutan pembanding ... 25
d. Pembuatan larutan uji ... 25
e. Uji pendahuluan ... 25
f. Penentuan panjang gelombang maksimum ... 25
g. Penentuan OT ... 26
h. Uji aktivitas antioksidan ... 26
i. Validasi metode ... 27
j. Estimasi aktivitas antioksidan ... 27
5. Penetapan kadar kapsaisin... 27
a. Pembuatan fase gerak ... 27
b. Pembuatan larutan stok kapsaisin ... 27
c. Pembuatan seri jumlah baku kapsaisin ... 27
d. Pembuatan larutan uji ... 27
e. Pembuatan kurva baku ... 27
f. Penentuan kadar kapsaisin dalam ekstrak etanolik ... 28
F. Analisis hasil ... 28
xii
2. Penetapan kadar kapsaisin... 29
BAB IV HASIL DAN PEMBAHASAN ... 30
A. Hasil determinasi tanaman ... 30
B. Hasil pengumpulan bahan ... 31
C. Hasil preparasi sampel ... 31
D. Hasil uji pendahuluan ... 33
E. Hasil optimasi metode uji aktivitas antioksidan ... 34
1. Penentuan panjang gelombang maksimum ... 34
2. Penentuan Operating time ... 35
F. Hasil validasi metode uji aktivitas antioksidan ... 36
1. Linieritas ... 38
2. Akurasi ... 39
3. Presisi ... 42
4. Spesifitas ... 43
G. Hasil estimasi aktivitas antioksidan ... 43
H. Penetapan kadar kapsaisin... 47
1. Analisis kualitatif ... 48
2. Analisis kuantitatif ... 49
I. Hasil analisis statistik ... 51
BAB V KESIMPULAN DAN SARAN ... 53
A. Kesimpulan ... 53
xiii
DAFTAR PUSTAKA ... 54
LAMPIRAN ... 58
xiv
DAFTAR TABEL
Halaman Tabel I. Kriteria akurasi yang dapat diterima ... 15
Tabel II. Nilai presisi yang dapat diterima ... 16
Tabel III. Hasil scanning panjang gelombang maksimum
DPPH ... 35
Tabel IV. Hasil pengukuran %IC seri baku kapsaisin ... 37
Tabel V. Hasil pengukuran %IC seri larutan ekstrak etanolik
cabai rawit merah ... 37
Tabel VI. Hasil perolehan kembali uji aktivitas antioksidan
kapsaisin ... 40
Tabel VII. Hasil perolehan kembali uji aktivitas antioksidan
ekstrak etanolik buah cabai rawit merah ... 41
Tabel VIII. Nilai CV uji aktivitas antioksidan kapsaisin ... 42
Tabel IX. Nilai CV uji aktivitas antioksidan ekstrak etanolik
cabai rawit merah ... 42
Tabel X. Nilai IC50 kapsaisin dan ekstrak etanolik buah cabai
rawit merah ... 46
Tabel XI. Hasil penetapan kadar kapsaisin dalam ekstrak
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Tanaman cabai rawit ... 7
Gambar 2. Struktur kapsaisin ... 9
Gambar 3. Reaksi penangkapan hidrogen oleh DPPH ... 12
Gambar 4. TLC scanner ... 20
Gambar 5. Varietas buah cabai rawit ... 30
Gambar 6. Alat soxhlet ... 32
Gambar 7. Hasil uji pendahuluan ... 34
Gambar 8. Operating time kapsaisin... 36
Gambar 9. Kurva persamaan regresi linier aktivitas antioksidan kapsaisin ... 39
Gambar 10. Kurva persamaan regresi linier aktivitas antioksidan ekstrak etanolik buah cabai rawit merah ... 39
Gambar 11. Gugus kromofor dan auksokrom DPPH ... 44
Gambar 12. Reaksi DPPH dengan antioksidan ... 44
Gambar 13. Mekanisme penghambatan radikal bebas DPPH oleh kapsaisin ... 45
Gambar 14. Interaksi kapsaisin dengan fase diam ... 48
Gambar 15. Interaksi kapsaisin dengan fase gerak ... 49
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Sertifikat analisis kapsaisin ... 59
Lampiran 2. Foto buah cabai rawit merah ... 60
Lampiran 3. Perhitungan rendemen ekstrak etanol ... 61
Lampiran 4. Data penimbangan pengujian aktivitas
antioksidan ... 61
Lampiran 5. Perhitungan konsentrasi bahan pengujian
aktivitas antioksidan ... 62
Lampiran 6. Hasil scanning larutan pengoreksi untuk pengujian
aktivitas antioksidan ... 67
Lampiran 7. Optimasi metode uji aktivitas antioksidan... 69
Lampiran 8. Uji aktivitas antioksidan dengan
menggunakkan DPPH... 74
Lampiran 9. Perhitungan %recovery, CV uji aktivitas
antioksidan ... 77
Lampiran 10. Perhitungan IC50 kapsaisin dan ekstrak
etanolik cabai rawit merah ... 78
Lampiran 11. Perhitungan jumlah kapsaisin untuk kurva baku ... 79
Lampiran 12. Hasil kromatogram untuk penetapan
kadar kapsaisin ... 80
xvii
Lampiran 14. Perhitungan kadar kapsaisin dalam ekstrak
etanolik buah cabai rawit merah ... 82
xviii INTISARI
Antioksidan merupakan suatu senyawa yang dapat menyumbangkan elektronya pada radikal bebas. Cabai rawit merah mengandung kapsaisin yang dapat digunakan sebagai antioksidan.
Penelitian ini bertujuan untuk menentukan aktivitas antioksidan dan kadar kapsaisin dalam ekstrak etanolik buah cabai rawit merah. Ekstrak etanolik buah cabai rawit merah diuji aktivitas antioksidan dengan metode 1,1-difenil-2-pikril-hidrazil (DPPH), yang dinyatakan dalam IC50. IC50 adalah konsentrasi ekstrak yang dapat mengikat DPPH sebanyak 50%. Adanya senyawa antioksidan yang mengikat radikal bebas akan ditunjukkan dengan adanya pemudaran warna ungu DPPH. Absorbansi DPPH diukur dengan menggunakan spektrofotometer visibel pada panjang gelombang maksimum 517,5 nm. Penetapan kadar kapsaisin dalam ekstrak etanolik buah cabai rawit merah dilakukan dengan metode KLT Densitometri. Fase gerak yang digunakan adalah toluen : kloroform : aseton (45:25:30) dan fase diam yang digunakan adalah silka gel 60 F254
Hasil penelitian menunjukkan IC50 dari kapsaisin sebesar 15,99 ± 4,18 µg/ml
dan ekstrak etanolik buah cabai rawit merah sebesar 107,75 ± 12,25 µg/ml, yang didapatkan dengan ekstrapolasi. Serta kadar kapsaisin yang diperoleh sebesar 0,135 ± 0,002 % b/b, dengan catatan metode analisis kuantitatif belum tervalidasi.
Kata kunci : cabai rawit merah (Capsicum frutescens L.), DPPH, aktivitas antioksidan, kapsaisin, KLT Densitometri.
xix ABSTRACT
Antioxidants are substance that donate electrons to the free radical. Red chili pepper (Capsicum frutescens) contain capsaicin compound that can be used as antioxidant.
This research was conducted to determine antioxidant activity and capsaicin concentration in red chili pepper ethanolic extract. The antioxidant activity of red chili pepper ethanolic extract is tested with 1,1-diphenyl-2-picrylhydrazyl (DPPH) method, that is expressed as IC50. IC50 is concentration that can scavange 50% of free
radical. The presence of antioxidant compounds that scavenge free radicals is indicated by DPPH discoloration. Absorbance of DPPH is measured by spectrophotometer visible at maximum wavelength of 517,5 nm. Assay of capsaicin is performed by thin layer chromatography (TLC) densitometry method. The mobile phase used is toluene : chloroform : acetone (45:25:30) and the stationary phase used is silica gel 60 F254.
The result showed that IC50 of capsaicin is 15,99 ± 4,18 µg/ml and red chili
pepper ethanolic extract is 107,75 ± 12,25 µg/ml, that obatained by extrapolating and the capsaicin content is 0,135 ± 0,002 % b/b, with record of quantitative analysis method has not been validated.
1
BAB I PENGANTAR
A. Latar Belakang
Banyak faktor yang dapat menyebabkan terganggunya kesehatan
sehingga memicu timbulnya penyakit, seperti ketidakseimbangan gizi. Selain
faktor gizi, faktor lingkungan juga dapat menjadi faktor yang dapat menggangu
kesehatan seperti paparan asap rokok dan kendaraan, radiasi, poluasi udara dan
bahan kimia toksik. Salah satu hal yang menyebabkan faktor lingkungan dapat
mengganggu kesehatan dan menimbulkan penyakit, yaitu adanya radikal bebas.
Beberapa penyakit degeneratif seperti penyakit jantung, tekanan darah tinggi,
kanker, diabetes melitus, dan serosis hati disebabkan oleh adanya radikal bebas
(Simanjuntak, 2007).
Radikal bebas dibentuk ketika oksigen dimaetabolisme di dalam tubuh.
Radikal bebas merupakan molekul yang memiliki elektron tidak berpasangan
pada kulit terluar molekul, dan menjadi tidak stabil. Radikal bebas bersifat reaktif
sehingga akan cepat bereaksi dengan molekul di dalam tubuh seperti karbohidrat,
protein, lipid, dan DNA sehingga menyebabkan stres oksidatif (Badarinath,
Mallikarjuna, Chetty, Ramkanth, Rajan, Gnanaprakash, 2010). Stres oksidatif
merupakan salah satu yang menjadi penyebab penyakit degeneratif (Rohdiana,
2001). Stres oksidatif dapat terjadi ketika konsentrasi radikal bebas lebih tinggi
dari konsentrasi sistem antioksidan (Simanjuntak, 2007).
Penggunaan antioksidan semakin pesat dikarenakan semakin luasnya
degeneratif seperti penyakit jantung dan kanker (Boer, 2000). Antioksidan
merupakan senyawa yang dapat menghambat reaksi oksidasi dari molekul lain.
Tubuh telah memiliki sistem pertahanan antioksidatif, tetapi ketika konsentrasi
radikal bebas itu berlebihan, diperlukan adanya antioksidan eksogen (Rohdiana,
2001). Antioksidan yang diproduksi dalam tubuh antara lain Reduced Glutathione
(GSH), Superoxide Dismutase (SOD), Catalase and Glutathione Peroxidase
(GPx) (Musa, 2008). Antioksidan sintetik yang banyak digunakan dalam produksi
makanan, seperti BHA (Butil Hidroksi Anisol), BHT (Butil Hidroksi Toluen), dan
TBHQ (tert-butil Hidrokuinon), tetapi antioksidan tersebut dapat menjadi karsinogenik sehingga penggunaan antioksidan alami mulai meningkat
(Amarowicz, Naczk, and Shahidi, 2000). Antioksidan alami dapat ditemukan pada
tanaman. Antioksidan eksogen dari tanaman lebih aman dibandingkan dengan
antioksidan sintetik (Musa, 2008).
Penggunaan cabai rawit di masyarakat biasanya sebagai sayuran dan
obat tradisional. Cabai rawit memiliki khasiat antara lain sebagai stimulan,
antireumatik, antikoagulan, antitrombosis, stomakikum, antihaemoroidal, dan
antiseptik. Khasiat yang ditimbulkan tersebut sebagian besar karena kandungan
kapsaisin dalam cabai rawit (0,1-1,5%) (Widianti dan Suhardjono, 2010).
Kapsaisin merupakan senyawa yang menyebabkan rasa pedas pada
cabai. Kapsaisin juga dapat memiliki aktivitas antioksidan karena adanya gugus
fenol pada strukturnya, seperti yang ditemukan pada antioksidan sintetik BHT
(Handerson dan Slickman, 1999). Adanya gugus fenol dapat menyumbangkan
tersebut. Banyak bahan alam dapat memberikan aktivitas antioksidan karena
adanya kandungan senyawa fenolik.
Pada penelitian ini uji aktivitas antioksidan akan dilakukan dengan
metode DPPH. Metode ini mengukur kemampuan suatu senyawa antioksidan
dalam menangkap radikal bebas. Jika suatu senyawa antioksidan bereaksi dengan
radikal bebas DPPH, maka senyawa tersebut akan menetralkan radikal bebas dari
DPPH. Senyawa dapat menetralkan radikal bebas, secara kualitatif akan terlihat
adanya pemudaran warna DPPH dari ungu menjadi kuning (Merck, 2012). Pada
penetapan kadar kapsaisin akan dilakukan dengan metode KLT-Densitometri.
1. Permasalahan
a. Berapakah nilai aktivitas antioksidan ekstrak etanolik buah cabai rawit
merah dengan menggunakan metode DPPH yang dinyatakan dengan
IC50?
b. Berapakah kadar kapsaisin dalam ekstrak etanolik buah cabai rawit merah
dengan menggunakan metode KLT-Densitometri?
2. Keaslian penelitian
Penelitian tentang aktivitas antioksidan cabai rawit dan penetapan
kadar kapsaisin yang pernah dilakukan, antara lain :
a. Penelitian yang dilakukan oleh Talcott, Brenes, dan Villalon (2000)
mengenai aktivitas antioksidan pada berbagai spesies Capsicum
b. Penelitian dari Sukrasno dan Kusmardiyani (1997) meneliti
kandungan kapsaisin pada berbagai buah Capsicum menggunakan metode KCKT.
c. Penelitian oleh Henderson dan Slickman (1999) tentang Quantitative HPLC Determination of the Antioxidant Activity of Capsaicin on the Formation of Lipid Hydroperoxides of Linoleic Acid: A Comparative Study against BHT and Melatonin.
Perbedaan penelitian ini dengan penelitian yang telah dilakukan, yaitu
pada penelitian ini melakukan uji aktivitas antioksidan pada cabai rawit merah
(Capsicum frutescens L.) dengan menggunakan DPPH dan penetapan kadar kapsaisin dilakukan dengan metode Kromatografi Lapis Tipis (KLT) –
Densitometri. Sejauh penelusuran peneliti, penelitian ini belum pernah
dilakukan.
3. Manfaat penelitian
a. Manfaat teoritis : Penelitian ini diharapkan dapat menambah
pengetahuan tentang aktivitas antioksidan dalam ekstrak etanolik buah
cabai rawit merah dengan menggunakan metode DPPH yang dinyatakan
dengan IC50.
b. Manfaat praktis : Penelitian ini diharapkan dapat memberikan informasi
tentang aktivitas antioksidan ekstrak etanolik buah cabai rawit merah
sehingga dapat dimanfaatkan menjadi suatu bentuk sediaan farmasi
B. Tujuan
1. Tujuan umum
Mengetahui aktivitas antioksidan ekstrak etanolik buah cabai rawit merah
dengan metode DPPH.
2. Tujuan khusus
a. Mengetahui nilai aktivitas antioksidan ekstrak etanolik buah cabai rawit
merah dengan metode DPPH yang dinyatakan dengan IC50.
b. Mengetahui kadar kapsaisin dalam ekstrak etanolik buah cabai rawit
6
BAB II
PENELAAHAN PUSTAKA
A. Cabai Rawit
1. Klasifikasi tanaman
Klasiafikasi tanaman cabai rawit sebagai berikut
Kingdom : Plantae (tumbuhan)
Subkingdom : Tracheobionta (tumbuhan berpembuluh)
Super Divisi : Spermatophyta (tumbuhan berbiji)
Divisi : Magnoliophyta (biji berkeping dua)
Kelas : Magnoliopsida
Sub kelas : Asteridae
Ordo : Solanales
Famili : Solanaceae (suku terung-terungan)
Genus : Capsicum
Spesies : Capsicum frutescens L. (Plantamor, 2008).
2. Nama tanaman
Indonesia : cabai rawit, cabe rawit, lombok rawit, cengek (Sunda)
(Plantamor, 2008). Nama daerah : lada limi (Nias), cabhi letek (Madura), tabia
krinyi (Bali), malita diti (Gorontalo), lombok jempling, lombok jemprit,
Gambar 1. Tanaman cabai rawit (Jurnalkesehatan, 2011)
3. Morfologi tanaman
Cabai rawit merupakan tanaman perdu tahunan. Tinggi batang 50-100
cm. berbuku-buku, bagian atasnya bersudut, dan percabangan banyak. Daun
tunggal, berbentuk bulat telur, bertangkai, letak tumbuhnya berseling, ujung
meruncing, dan pangkal menyempit (Agromedia, 2008).
Bunga tunggal, terdiri dari 2-3 bunga, panjang 1-3 cm, dan lebar 2,5-12
cm. bunga berwarna putih, putih kehijauan, atau kadang-kadang ungu.
Mahkota bunga berbentuk bintrang. Buah buni berbenruk bulat telur, ujung
meruncing, bertangkai panjang, muncul tegak. Buah muda berwarna hijau tua,
putih kehijauan, atau putih (Agromedia, 2008).
4. Kegunaan dan kandungan kimia
Kandungan dalam buah cabai rawit antara lain kapsaisin, kapsantin,
karotenoid, alkaloid asiri, resin, minyak menguap, vitamin (A dan C).
Kapsaisin merupakan senyawa yang memberikan rasa pedas pada cabai, yang
cabai rawit mengandung alkaloid, antara lain solanina, solamidina,
solamargina, solasodina, solasomina, dan steroid saponin (kapsisidin).
Kapsisidin dapat berkhasiat sebagai antibiotik (Ipteknet, 2008).
Buah Capsicum frutescens memiliki manfaat antara lain efek tonik, stimulan kuat untuk jantung dan aliran darah, antirheumatik, antikoagulan,
antitrombosis, stomakikum, rubefacient (mengakibatkan inflamasi dan kemerahan pada kulit sehingga sering digunakan sebagai campuran obat
gosok), anastetik, antihaemorroidal, dan antiseptik. Efek tersebut sebagian
besar disebabkan oleh kapsaisin yang terkandung di dalam buah Capsicum frutescens (0,1- 1,5%) (Widianti dan Suhardjono, 2010).
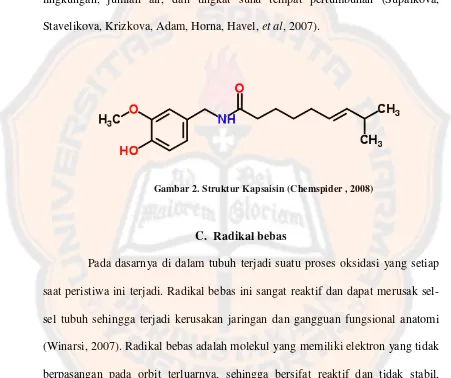
B. Kapsaisin
Kapsaisinoid merupakan senyawa yang memberikan rasa pedas pada
cabai. Kandungan utama dalam kapsaisinoid adalah kapsaisin, kemudian
dihidrokapsaisin, nordihidrokapsaisin, homodihidrokapsaisin, dan homokapsaisin.
Kapsaisin dan dihidrokapsaisin terkadung sebanyak 90% dari kapsaisinoid pada
cabai (Reyes, Escodigo, Gonzalez, Mondragon, Vazquez, Tzompantzi, 2011).
Kapsaisin (8-methyl–N–vanillyl–6-nonenamida) merupakan suatu alkaloid lipofilik, tidak berwarna, tidak berbau dengan bobot molekul 305,40
g/mol. Kapsaisin memiliki kelarutan dalam lemak, alkohol, dan minyak (Reyes,
Escodigo, Gonzalez, Mondragon, Vazquez, Tzompantzi, 2011). Kapsaisin
merupakan komponen aktif yang menghasilkan rasa panas dalam cabai. Kapsaisin
pada jaringan manapun yang tersentuh. Kapsaisin dan senyawa-senyawa lain yang
terkait strukturnya disebut dengan kapsaisinoid, diproduksi sebagai metabolit
sekunder dari cabai. Tingkatan rasa panas suatu cabe bergantung pada dua faktor,
yaitu genetika tumbuhan dan lingkungan pertumbuhannya, yang meliputi kondisi
lingkungan, jumlah air, dan tingkat suhu tempat pertumbuhan (Supalkova,
Stavelikova, Krizkova, Adam, Horna, Havel, et al, 2007).
Gambar 2. Struktur Kapsaisin (Chemspider , 2008)
C. Radikal bebas
Pada dasarnya di dalam tubuh terjadi suatu proses oksidasi yang setiap
saat peristiwa ini terjadi. Radikal bebas ini sangat reaktif dan dapat merusak
sel-sel tubuh sehingga terjadi kerusakan jaringan dan gangguan fungsional anatomi
(Winarsi, 2007). Radikal bebas adalah molekul yang memiliki elektron yang tidak
berpasangan pada orbit terluarnya, sehingga bersifat reaktif dan tidak stabil,
sehingga cenderung untuk berikatan dengan senyawa lain untuk membentuk
molekul yang stabil (Setiati, 2003).
Radikal bebas dapat dihasilkan dari dalam tubuh (endogen) dan juga dari
luar tubuh (eksogen). Radikal bebas endogen merupakan radikal yang dihasilkan
oksidase, mikrosom, membran inti sel dan peroksisom, sedangkan radikal bebas
eksogen adalah radikal yang dihasilkan dari lingkungan luar seperti, asap rokok,
radiasi UV, bahan kimia toksik (Setiati, 2003).
Autooksidasi lipid merupakan proses radikal yang terlibat dalam reaksi
berantai, termasuk didalamnya terdapat tiga tahap, yaitu induksi, propagasi, dan
terminasi. Tahap induksi merupakan tahap pembentukan radikal alkil dan
peroksil. Pada tahap propagasi terbentuk hidroperoksid (ROOH). Tahap terakhir,
yaitu terminasi yang merupakan proses penggabungan dua radikal untuk
membentuk produk yang stabil (Bondet, Williams-Brand, Berset, 1997).
Radikal bebas merupakan salah satu faktor penyebab timbulnya suatu
penyakit. Radikal bebas dapat dihasilkan melalui metabolisme makanan dan juga
faktor lingkungan luar. Penyakit degeneratif yang disebabkan oleh radikal bebas
antara lain penyakit kardiovaskular, tekanan darah tinggi, diabetes mellitus, dan kanker. Radikal bebas dapat merusak makromolekul seperti merusak lipid
membran sel, DNA, protein yang menyebabkan stres oksidatif sel (Simanjuntak,
2007).
Keadaan stres oksidatif dapat terjadi jika jumlah radikal bebas dalam
tubuh lebih tinggi dari jumlah sistem antioksidan. Stres oksidatif yang
ditimbulkan oleh radikal bebas dapat ditentukan dengan mengukur salah satu
parameter berupa malondialdehid (MDA). Bila kadar MDA tinggi di dalam
plasma, maka dapat dipastikan sel mengalami stres oksidatif (Simanjuntak, 2007).
D. Antioksidan
Antioksidan merupakan senyawa pemberi elektron atau reduktan.
Senyawa antioksidan dapat menginaktivasi berkembangnya reaksi oksidasi,
dengan cara mencegah terbentuknya radikal bebas. Selain itu, antioksidan juga
menghambat reaksi oksidasi dengan mengikat radikal bebas dan molekul yang
sangat reaktif, sehingga kerusakan sel dapat dihambat. Antioksidan dapat berupa
enzim (misalnya superoksida dismutase (SOD), katalase, dan glutation
peroksidase), vitamin (vitamin E, A, C, dan B karoten), dan senyawa lain
(flavonoid, albumin, bilirubin, dll) (Winarsi, 2007).
Antioksidan enzimatis merupakan sistem pertahanan utama (primer)
terhadap kondisi stres oksidatif. Enzim-enzim tersebut merupakan suatu
metaloenzim sehingga aktivitasnya tergantung pada adanya ion logam. Enzim ini
bekerja dengan menghambat terbentuknya radikal bebas baru. Jenis antioksidan
lain, yaitu antioksidan non enzimatis atau antioksidan sekunder karena diperoleh
dari asupan makanan seperti vitamin C, E, A, dan beta karoten. Senyawa ini
menangkap senyawa oksidan serta mencegah terjadinya reaksi berantai (Winarsi,
2007).
E. DPPH
Molekul 1,1-diphenyl-2-picryl-hydrazyl (DPPH) merupakan suatu radikal bebas yang stabil dengan adanya delokalisasi elektron bebas pada molekul
tersebut. Delokalisasi ini menyebabkan peningkatan warna violet, yang
517 nm. Saat larutan DPPH dicampurkan dengan substansi yang dapat
memberikan hidrogen radikal, akan menyebabkan terjadinya bentuk tereduksi
dengan pemudaran warna violet (Molyneux, 2003).
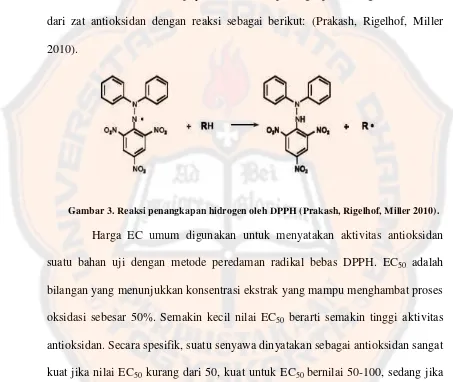
Metode DPPH menggunakan 1,1-diphenyl-2-picryl-hydrazyl sebagai sumber radikal bebas. Prinsipnya adalah reaksi penangkapan hidrogen oleh DPPH
dari zat antioksidan dengan reaksi sebagai berikut: (Prakash, Rigelhof, Miller
2010).
Gambar 3. Reaksi penangkapan hidrogen oleh DPPH (Prakash, Rigelhof, Miller 2010).
Harga EC umum digunakan untuk menyatakan aktivitas antioksidan
suatu bahan uji dengan metode peredaman radikal bebas DPPH. EC50 adalah
bilangan yang menunjukkan konsentrasi ekstrak yang mampu menghambat proses
oksidasi sebesar 50%. Semakin kecil nilai EC50 berarti semakin tinggi aktivitas
antioksidan. Secara spesifik, suatu senyawa dinyatakan sebagai antioksidan sangat
kuat jika nilai EC50 kurang dari 50, kuat untuk EC50 bernilai 50-100, sedang jika
EC50 bernilai 100-150, dan lemah jika EC50 bernilai 151-200 (Mardawati, 2008).
F. Ekstraksi
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat
kemudian semua atau hampir semua pelarut diuapkan, massa atau serbuk yang
tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan
(Depkes RI, 1995).
Ekstraksi merupakan penarikan kandungan kimia yang dapat larut dalam
pelarut cair sehingga terpisah dari bahan yang tidak dapat larut. Senyawa aktif
yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam minyak atsiri,
alkaloid, flavonoid dan lain-lain. Struktur kimia yang berbeda-beda akan
mempengaruhi kelarutan serta stabilitas senyawa-senyawa tersebut terhadap
pemanasan, udara, cahaya, logam berat, dan derajat keasaman (Depkes RI, 2000).
Macam-macam metode ekstraksi antara lain :
1. Maserasi
Proses yang dilakukan dengan cara direndam sampai meresap dan
melunakkan susunan sel, sehingga zat-zat yang mudah larut dapat melarut.
Maserasi dilakukan dengan menggunakan wadah bermulut lebar, dan dilakukan
pengocokan berulang-ulang yang lamanya berkisar 2-14 hari. Pengocokan
memungkinkan pelarut untuk masuk ke seluruh permukaan obat yang sudah
halus. Ekstrak dipisahkan dari ampasnya dengan cara menyaring seluruh ekstrak
(Ansel, 1989).
2. Perkolasi
Obat dimampatkan dalam alat ekstraksi khusus yang disebut dengan
perkolator, dengan ekstrak yang telah dikumpulkan disebut perkolat (Ansel,
1989). Cairan pengekstraksi yang dimasukkan secara kontinyu akan mengalir
ekstraksi sempurna tidak dapat terjadi karena ada suatu keseimbangan konsentrasi
antara larutan dalam sel dan cairan disekelilingnya dapat diatur, maka pada
perkolasi melalui pemasukan bahan pealrut yang baru dan dengan demikian suatu
ekstraksi total adalah mungkin karena perbedaan konsentrasi pada posisi yang
baru (Voigt, 1994).
3. Penyarian dengan alat Soxhlet
Soxhletasi adalah ekstraksi dengan menggunakan alat khusus yang mana
pelarut yang digunakan untuk menyari selalu baru sehingga ekstraksi yang
kontinyu dapat terjadi. Pelarut yang selalu baru tersebut didapat dengan
menguapkan pelarut yang ada dan diembunkan kembali oleh pendingin balik
(Depkes RI, 2000).
Bahan yang akan diekstraksi dimasukkan dalam sebuah kantung
ekstraksi di dalam sebuah alat ekstraksi dari gelas yang bekerja secara kontinyu.
wadah gelas yang berisi kantung diletakkan diantara labu suling dan suatu
pendingin balik yang dihubungkan melalui pipa pipet. Labu tersebut berisi bahan
pelarut yang akan menguap dan mencapai kedalam pendingin balik melalui pipa,
dan berkondensasi didalamnya kemudian akan menetes kedalam bahan yang
diekstraksi. Pelarut akan berkumpul dalam wadah gelas dan setelah mecapai
tinggi maksimal, pelarut akan ditarik kembali kedalam labu, dengan demikian zat
yang terekstraksi tertimbun melalui penguapan yang kontinyu dari bahan pelarut
G. Validasi metode analisis
Validasi metode analisis merupakan suatu tidakan penilaian terhadap
parameter tertentu, berdasarkan percobaan laboratorium untuk membuktikan
parameter tersebut memenuhi persyaratan (Harmita, 2004). Validasi metode
menurut United States Pharmacopeia (USP) dilakukan untuk menjamin bahwa suatu metode bersifat akurat, spesifik, reprodusibel, dan tahan pada kisaran analit
yang dianalisis. Tujuan utama validasi metode adalah untuk menghasilkan hasil
analisis yang paling baik. Untuk memperoleh hasil tersebut, semua variabel terkait
harus dipertimbangkan meliputi prosedur pengambilan sampel, tahap penyiapan
sampel, jenis fase diam, fase gerak, dan sistem deteksi (Rohman, 2009).
Parameter validasi metode analisis antara lain adalah akurasi, presisi,
dan linearitas. Akurasi merupakan keterdekatan nilai pengukuran dengan nilai
sebenarnya dari analit dalam sampel (Mulja dan Hanwar, 2003). Akurasi
dinyatakan dalam persen perolehan kembali (recovery) analit yang ditambnahkan. Kriteria akurasi tergantung pada konsentrasi analit dalam matriks sampel dan pada
keseksamaan metode (RSD). Vanderwielen, dkk menyatakan bahwa selisih kadar
pada berbagai penentuan (Xd) harus 5% atau kurang pada setiap konsentrasi analit
(Harmita, 2004).
Tabel I. Kriteria Akurasi yang Dapat Diterima (Harmita, 2004)
0,001 90-107 0,0001 (1 ppm) 80-110 0,00001 (100 ppb) 80-110 0,000001 (10 ppb) 60-115 0,0000001 (1 ppb) 40-120
Presisi merupakan sejumlah ukuran hasil yang diperoleh dari
analisis yang dilakukan berulangkali pada suatu sampel homogen. Presisi
dinyatakan dalam standar deviasi atau koefisien variasi (Mulja dan Hanwar,
2003).
Tabel II. Nilai presisi yang dapat diterima (APVMA, 2004)
Kadar analit (%) Presisi (%)
≥ 10 ≤ 2
1 - 10 ≤ 5
0,1 - 1 ≤ 10
< 0,1 ≤ 20
Linieritas pada suatu metode analisis merupakan kemampuannya untuk
mendapatkan hasil uji yang secara langsung proporsional dengan konsentrasi
analit di dalam sampel. Persyaratan data linieritas yang bisa diterima dengan nilai
koefisien korelasi (r) > 0,999. Spesifisitas merupakan kemampuan suatu metode
untuk mengukur dengan akurat respon analit diantara seluruh komponen sampel
potensial yang mungkin ada dalam matriks sampel (Mulja dan Hanwar, 2003).
H. Spektrofotometri visibel
Spektrofotometer merupakan alat yang terdiri dari spektrometer dan
gelombang tertentu sedangkan fotometer merupakan alat yang mengukur
intensitas cahaya yang ditransmisikan atau diabsorpsi (Khopkar, 1990). Spektrum
visibel merupakan korelasi absorban dan panjang gelombang tidak merupakan
garis spektrum, akan tetapi terjadinya eksitasi elektronik lebih dari satu macam
pada gugus molekul yang kompleks. Spektrum ini dapat dibaca dengan alat
spektrofotometer UV-Vis dengan menggunakan sumber radiasi elektromagnetik
antara 380 nm – 780 nm. Daerah ini disebut visibel karena merupakan daerah
nampak, daerah pada panjang gelombang tersebut akan nampak berwarna
terhadap pandangan mata manusia (Mulya, 1995).
Dasar dari spektrofotometer visible ini adalah serapan oleh senyawa
yang tergantung pada struktur senyawa elektronik dari molekul. Spektra visibel
dari senyawa organik berkaitan dengan transisi di antara tingkatan-tingkatan
tenaga elektronik (Sastrohamidjojo, 2001). Bagian-bagian dalam
spektrofotometer, yaitu :
1. Sumber. Sumber cahaya yang biasa digunakan pad spektroskopi absorbsi
adalah lampu wolfarm. Pada daerah UV digunakan lampu deuterium atau
lampu hidrogen sebagai sumber. Kelebihan dari lampu wolfarm adalah energi
yang dihasilkan tidak bervariasi pada berbagai panjang gelombang.
2. Monokromator untuk mendapatkan sinar monokromatis. Alatnya berupa
prisma dan untuk mengarahkan sinar monokromayis yang diinginkan dapat
digunakan celah. Jika celah pada posisi tetap maka prisma dirotasikan untuk
3. Sel absorpsi. Pada penggunaan sinar tampak dapat digunakan kuvet kaca
tetapi pada sinar UV digunakan kuarsa karena gelas tidak tembus cahaya pada
daerah ini.
4. Detektor, digunakan untuk memberikan respon terhadap cahaya pada berbagai
panjang gelombang (Khopkar, 1990).
Bila cahaya UV-Vis dikenakan pada senyawa maka sebagian cahaya
akan diserap molekul yang mempunyai tingkatan energi yang spesifik. Sinar yang
diserap akan menaikkan elektron ikatan tingkat energi eksitasi dari ground state. Panjang gelombang utnuk transisi elektronik adalah spesifik yang disebut dengan
maks. Panjang gelombang maksimum merupakan panjang gelombang yang
akan memberikan absorbansi maksimum dan dasar dari analisa kuantitatif yang
ditentukan dengan membuat kurva antara A lawan (Sitorus, 2009).
I. KLT Densitometri
KLT (Kromatografi Lapis Tipis) merupakan suatu metode analisis
pemisahan senyawa campuran. Sistem yang digunakan merupakan sistem
kapilaritas, jadi suatu sorben atau fase diam diletakkan dalam suatu lempengan,
yang kemudian senyawa yang akan dipisahkan diteteskan pada batas tertentu.
Senyawa ini akan terpisahkan berdasarkan kesamaan karakteristik dengan fase
geraknya. Fase gerak akan membawa senyawa melalui proses kapilaritas dan akan
terpisah membentuk bercak-bercak. Terdapat 25 jenis material berbeda yang dapat
digunakan sebagai sorben. Untuk mendapatkan hasil yang baik pemisahannya
karakteristik dari senyawa seperti polaritas, kelarutan, ionisasi, ukuran, bentuk
partikel, dan berat molekul analit sehingga dapat ditentukan tipe sorben untuk
mendapatkan hasil yang maksimal dan optimum (Wall, 2005).
KLT dapat digunakan untuk analisis kualitatif, kuantitatif, dan
preparatif. Pada analisis kualitatif, parameter yang digunakan adalah nilai Rf. Jika
dua senyawa memiliki nilai Rf yang sama pada kondisi KLT yang sama, maka
dapat dikatakan kedua senyawa tersebut identik. Pada analisis kuantitatif terdapat
dua cara, yaitu dengan mengukur bercak langsung pada lempeng dengan ukuran
luas atau dengan teknik densitometri. Cara lain dengan mengerok bercak
kemudian dianalisis dengan metode lain, misalnya spektrofotometri. Analisis
preparatif bertujuan untuk memisahkan analit dalam jumlah banyak kemudian
senyawa yang telah dipisahkan, dianalisis lebih lanjut (Rohman, 2007).
Fase diam yang digunakan dalam KLT merupakan penjerap yang
berukuran kecil dengan diameter partikel antara 10-30 µm. Penjerap yang paling
sering digunakan antara lain silika, serbuk selulosa, sementara mekanisme sorpsi
yang utama adalah partisi dan adsorbsi. Fase gerak pada KLT sering dikenal
sebagai pelarut pengembang yang akan bergerak sepanjang fase diam karena
Gambar 4. TLC scanner (Abo, 2010)
Densitometri merupakan metode analisis instrumental yang
mendasarkan interaksi radiasi elektromagnetik dengan analit yang merupakan
bercak pada KLT. Evaluasi bercak KLT dilakukan dengan scanning dengan sinar dalam bentuk celah yang dapat dipilih baik panjangnya atau lebarnya. Sinar yang
dipantulkan diukur dengan sensor cahaya. Perbedaan signal optik daerah yang
tidak mengandung bercak dengan yang mengandung bercak dihubungkan dengan
banyaknya analit yang ada melalui kurva kalibrasi yang telah disiapkan dalam
lempeng yang sama (Rohman, 2009).
J. Landasan Teori
Radikal bebas merupakan suatu molekul yang memiliki elektron tidak
berpasangan, bersifat sangat reaktif, dan tidak stabil. Radikal bebas dapat merusak
sel dan jaringan, sehingga radikal bebas dapat menyebabkan berbagai penyakit
degenaratif antara lain jantung, tekanan darah tinggi, dan kanker. Adanya radikal
bebas dapat menyebabkan stres oksidatif, maka diperlukan suatu antioksidan.
Antioksidan merupakan senyawa yang dapat menghambat terjadinya oksidasi
dapat dihambat. Cabai rawit merah merupakan tanaman yang mengandung
senyawa yang disebut kapsaisin. Kapsaisin dapat berfungsi sebagai antioksidan,
maka dilakukan pengujian aktivitas antioksidan pada cabai rawit merah dengan
menggunakan metode DPPH.
Metode DPPH merupakan salah satu metode untuk menguji aktivitas
suatu antioksidan. DPPH merupakan suatu radikal bebas yang berwana violet,
dengan adanya antioksidan yang akan menyumbangkan hidrogen, maka akan
terjadi pemudaran warna violet. Pengukuran pemudaran warna yang terjadi
dilakukan dengan spektrofotometri visibel, yang dinyatakan dalam suatu
absorbansi. Aktivitas antioksidan dengan metode DPPH dinyatakan dengan harga
IC (Inhibition Concentration). Konsentrasi ekstrak yang dapat menghambat proses oksidasi sebesar 50%, dinyatakan dengan IC50. Harga yang semakin kecil
menujukkan semakin besarnya aktivitas antioksidan. Kadar kapsaisin akan
ditentukan dengan metode KLT Densitometri. Hasil analisis kualitatif dinyatakan
dalam Rf dan untuk analisis kuantitatif dinyatakan dalam AUC. Pemisahan dapat
terjadi karena adanya interaksi senyawa dengan fase gerak dan fase diam.
K. Hipotesis
Ekstrak etanolik buah cabai rawit merah memiliki aktivitas antioksidan
yang dinyatakan sebagai IC50 dan memiliki kandungan kapsaisin yang
mempengaruhi aktivitas antioksidan sehingga ditetapkan kadarnya secara KLT
22
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan penelitian
Penelitian yang berjudul uji aktivitas antioksidan pada cabai rawit
merah (Capsicum frutescens L.) dengan metode DPPH dan penetapan kadar kapsaisin secara kromatografi lapis tipis (KLT) – densitometri merupakan jenis
penelitian eksperimental murni.
B. Variabel penelitian
1. Variabel bebas : konsentrasi ekstrak etanolik buah cabai rawit merah.
2. Variabel tergantung : %IC, kadar kapsaisin.
3. Variabel pengacau adalah sebagai berikut
a. Variabel pengacau terkendali : tempat tumbuh, umur tanaman, cara
pemanenan, waktu pemanenan, lokasi pengambilan sampel, bobot sampel.
b. Variabel pengacau tak terkendali : suhu, kelembaban, cuaca.
C. Definisi operasional
1. Cabai rawit merah merupakan buah yang sudah matang dari tanaman cabai
rawit yang diperoleh dari Pasar Beringharjo, Yogyakarta.
2. Ekstrak etanolik buah cabai rawit merah adalah ekstrak kental yang diperoleh
3. IC50 (Inhibition Concentration 50) adalah nilai konsentrasi ekstrak etanolik buah cabai rawit merah yang menghasilkan penangkapan 50% radikal DPPH.
4. Persen inhibition concentration (%IC) adalah persen yang menyatakan kemampuan ekstrak etanolik buah cabai rawit merah untuk menangkap radikal
DPPH.
D. Bahan dan Alat Penelitian 1. Bahan penelitian
Sampel yang digunakan pada penelitian ini buah cabai rawit merah
(Capsicum frutescens L.) yang berasal dari Pasar Bringharjo, Yogyakarta. Bahan kima kualitas farmasetis berupa akuades. Bahan kimia kualitas pro analitik
meliputi etanol 96% (E.Merck), kloroform, toluena, aseton, kapsaisin (Sigma),
DPPH, silikagel 60 F254. Bahan kualitas teknis, yaitu aluminium foil, kertas saring, etanol 96%.
2. Alat penelitian
Alat-alat yang digunakan dalam penelitian ini berupa vortex (Vortex-2
Genie), spektrofotometer UV-VIS (UVmini-1240 Shimadzu), blender, oven, mikropipet 10-1000 µL, neraca analitik (Ohaus), vacuum rotary evaporator
(Junke & Kunkel), waterbath, alat Soxhlet, KLT Densitometer, bejana kromatografi, tabung reaksi bertutup, dan alat-alat gelas yang lazim digunakan di
E. Tata Cara Penelitian 1. Determinasi tanaman
Determinasi buah cabai rawit merah dilakukan menurut Bosland,
Bailey, and Iglesias-Olivas (1996) dengan melakukan pengamatan morfologi.
2. Pengumpulan bahan
Cabai rawit merah diperoleh dari Pasar Bringharjo, Yogyakarta.
3. Pembuatan ekstrak etanolik buah cabai rawit merah
Cabai rawit merah sebanyak 1 kg yang masih segar dibersihkan, dicuci
kemudian dibuang tangkainya. Cabai rawit merah dikeringkan menggunakan oven
pada suhu 50ºC kemudian dihaluskan menggunakan blender. Serbuk yang
diperoleh ditimbang sebanyak 25 gram dan dibungkus menggunakan kertas
saring. Simplisia yang telah dibungkus dimasukkan dalam alat soxhlet kemudian
tambahkan etanol 96% sebanyak 350 ml. Soxhletasi dilakukan pada suhu 70ºC,
sampai larutan jernih, selama 8 jam. Filtrat hasil ekstraksi dipekatkan dengan
menggunakan vacuum rotary evaporator.
4. Pengujian aktivitas antioksidan ekstrak etanolik buah cabai rawit merah
a. Pembuatan larutan DPPH, sejumlah 15,8 mg serbuk DPPH dilarutkan ke
dalam etanol p.a sampai 100 ml, sehingga diperoleh larutan DPPH dengan
konsentrasi 0,4 mM. Larutan tersebut ditutup dengan alumunium foil dan
selalu dibuat baru.
b. Pembuatan larutan stok kapsaisin, sebanyak 2,5 mg kapsaisin dilarutkan
c. Pembuatan larutan pembanding, diambil sebanyak 1,0; 2,0; 3,0; 4,0; dan
5,0 mL larutan stok kapsaisin, kemudian ditambahkan etanol p.a sampai
10,0 mL, sehingga diperoleh konsentrasi larutan standar kapsaisin sebesar
25,0; 50,0; 75,0; 100; dan 125 g/mL.
d. Pembuatan larutan uji, sejumlah 25 mg ekstrak ditimbang dan
ditambahkan etanol p.a sampai 25,0 mL. Diambil sebanyak 1,0; 2,0; 3,0;
4,0; dan 5,0 mL larutan tersebut, kemudian ditambahkan etanol p.a
sampai 10,0 mL, sehingga diperoleh konsentrasi larutan uji sebesar 100;
200; 300; 400; 500 g/mL.
e. Uji pendahuluan, sebanyak 1 mL larutan DPPH dimasukan ke dalam
masing-masing tiga tabung reaksi. Ditambahkan masing-masing dengan 1
mL etanol p.a, larutan pembanding kapsaisin 75 g/mL, dan larutan uji
120,0 g/mL. Selanjutnya, larutan tersebut ditambahkan dengan 3 mL
etanol p.a. Larutan tersebut kemudian divortex selama 30 detik. Setelah 30
menit, amati perubahan warna yang terjadi pada larutan tersebut.
f. Penentuan panjang gelombang maksimum, pada 3 labu ukur 10 mL,
dimasukan masing-masing 0,5; 1,0; 1,5 mL larutan DPPH. Ditambahkan
larutan tersebut dengan etanol p.a hingga tanda batas sehingga konsentrasi
DPPH menjadi 0,020; 0,040; dan 0,080 mM. Larutan tersebut kemudian
divortex selama 30 detik. Lalu dilakukan scanning panjang gelombang
serapan maksimum dengan spektrofotometer visibel pada panjang
g. Penentuan OT, sebanyak 1 mL larutan DPPH dimasukan kedalam
masing-masing tiga labu ukur 5 mL, ditambahkan masing-masing-masing-masing dengan 1 mL
larutan pembanding kapsaisin 25,0; 75,0; 125 g/mL. Selanjutnya larutan
tersebut ditambahkan dengan etanol p.a hingga tanda batas. Larutan
tersebut kemudian divortex selama 30 detik. Setelah itu dibaca
absorbansinya dengan spektrofotometer visibel pada panjang gelombang
maksimum setiap 5 menit selama 1 jam.
h. Uji aktivitas antioksidan
i) Pengukuran absorbansi larutan DPPH (kontrol), pada labu
ukur 5 mL, dimasukan sebanyak 1 mL larutan DPPH. Ditambahan larutan
tersebut dengan etanol p.a hingga tanda batas. Kemudian larutan tersebut
dibaca absorbansinya pada saat OT dan panjang gelombang maksimum.
Pengerjaan dilakukan sebanyak tiga kali. Larutan ini digunakan sebagai
kontrol untuk menguji larutan pembanding dan uji.
ii) Pengukuran absorbansi larutan pembanding dan uji ,
sebanyak 1 mL larutan DPPH dimasukkan ke dalam tabung reaksi 5 ml
bertutup kemudian ditambah dengan 1 mL larutan pembanding dan uji
pada berbagai seri konsentrasi telah dibuat. Selanjutnya larutan tersebut
ditambah dengan etanol p.a hingga tanda batas. Larutan tersebut kemudian
divortex selama 30 detik dan diamkan selama OT. Larutan dibaca
absorbansinya dengan spektrofotometer visibel pada panjang gelombang
i. Validasi metode uji aktivitas antioksidan, hasil dari prosedur 4h i dan ii,
divalidasi akurasi (% recovery), presisi (%CV) spesifisitas (spektra
kontrol), dan linearitas (nilai r).
konsentrasi standar kapsaisin terukurkonsentrasi standar kapsaisin teoritis 100
Standar eviasi S konsentrasi kapsaisin terukurrata rata konsentrasi kapsaisin terukur 100
j. Estimasi aktivitas antioksidan, hasil dari prosedur 4h i dan ii dihitung nilai
% IC dan IC50 untuk kapsaisin ekstrak etanolik buah cabai rawit merah.
5. Penetapan kadar kapsisin dengan KLT Densitometri
a. Pembuatan fase gerak, fase gerak yang digunakan, yaitu campuran toluena
– kloroform – aseton (45 : 25 : 30), v/v.
b. Pembuatan larutan stok kapsaisin, ditimbang kapsaisin sebanyak 5,2 mg
kemudian dilarutkan dalam metanol sampai 10 ml.
c. Pembuatan larutan uji, sejumlah 60 mg ekstrak etanolik buah cabai rawit
merah ditimbang kemudian ditambahkan methanol sebanyak 500 µl,
kemudian divortex selama 30 detik. Larutan uji dibuat replikasi sebanyak
3 kali.
d. Pembuatan kurva baku kapsaisin, larutan baku kapsaisin dengan kadar 520
µg/ml ditotolkan pada lempeng silika gel 60 F254 dengan jarak totolan 1
cm sejumlah 1; 2; 4 dan 8 L sehingga diperoleh seri jumlah 0,52; 1,04;
2,08; dan 4,16 µg, kemudian segera dikembangkan dalam bejana
kromatografi yang telah dijenuhkan dengan fase gerak. Pengembangan
dan dikeringkan setelah pengembangan selesai, kemudian discanning pada
panjang gelombang 228 nm dengan densitometri.
e. Penentuan kadar kapsaisin dalam ekstrak etanolik, sebanyak 10,0 L
larutan ekstrak ditotolkan pada lempeng silika gel 60 F254, replikasi
sebnyak tiga kali kemudian dikembangkan dalam bejana kromatografi
yang telah dijenuhkan dengan fase gerak. Pengembangan dilakukan
setinggi 10 cm. lempeng silika kemudian dikeluarkan, dikeringkan, dan
discanning pada panjang gelombang 228 nm dengan densitometri.
F. Analisis Hasil 1. Uji aktivitas antioksidan
Aktivitas penangkapan radikal (%) dapat dihitung dengan
menggunakan rumus :
Absorbansilarutan kontrol – Absorbansilarutan baku/uji
Absorbansilarutan kontrol 100
Data aktivitas tersebut dianalisis dan dihitung nilai IC50 menggunakan
persamaan regresi linear dengan sumbu x adalah konsentrasi larutan uji maupun
larutan baku kapsaisin, sedangkan sumbu y adalah % IC, Lalu dianalisis secara statistik Mann-Whitney untuk menentukan ada atau tidak adanya perbedaan
bermakna antara IC50 larutan baku kapsaisin dan larutan uji.
2. Penetapan kadar kapsaisin
Analisis kualitatif dilakukan dengan membandingkan Rf larutan uji
penetapan kadar kapsaisin berdasarkan AUC dari baku sehingga diperoleh
persamaan regresi linier y = bx + a, yang merupakan hubungan antara kadar
dengan luas area yang dihasilkan. Data AUC larutan uji kemudian dimasukkan
dalam persamaan regresi masing-masing baku sebagai y sehingga diperoleh kadar
kapsaisin dalam %b/b.
Parameter yang digunakan untuk melihat reprodusibilitas kadar dalam
ekstrak etanolik buah cabai rawit merah adalah nilai CV. Nilai CV dapat dihitung
dengan cara :
30
BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Buah
Pada penelitian dengan menggunakan sampel berupa buah maka sampel
yang akan digunakan terlebih dahulu dilakukan determinasi. Determinasi
bertujuan untuk memastikan kebenaran identitas buah serta menghindari
terjadinya kesalahan dalam pengambilan sampel pada suatu penelitian.
Determinasi buah cabai rawit merah dilakukan dengan acuan Bosland,
Bailey, and Iglesias-Olivas (1996) dengan melakukan pengamatan morfologi dan
didapatkan hasil, yaitu panjang 2,5 - 3 cm, lebar kurang lebih 1 cm, bentuk tegak
lurus, dan warna merah ketika masak. Morfologi sampel dibandingkan terhadap
gambar 5, sehingga diperoleh bahwa sampel yang digunakan merupakan Tabasco
(Capsicum frutescens).
Gambar 5. Varietas buah cabai rawit
B. Hasil Pengumpulan Bahan
Buah cabai rawit merah diperoleh dari pasar Bringharjo, Yogyakarta
pada bulan September 2012. Pengumpulan bahan dilakukan pada satu tempat
dengan tujuan untuk mengurangi variasi waktu pemanenan yang dapat
menyebabkan variasi kandungan senyawa aktif dalam buah. Pemanenan
dilakukan umumnya pada umur 2,5 - 4 bulan setelah ditanam. Buah yang dipilih
untuk digunakan sebagai sampel adalah buah yang sudah masak, masih segar dan
berwarna merah cerah pada seluruh bagian buah. Pemilihan berdasarkan kriteria
tersebut dimaksudkan untuk mendapatkan sampel yang baik untuk penelitian.
Pengambilan sampel dilakukan pada pagi hari dan dipilih yang baru diperoleh dari
perkebunan sehingga diperoleh buah yang masih segar.
C. Hasil Preparasi Sampel
Sampel berupa buah cabai rawit merah diekstraksi dengan etanol 96%
menggunakan alat Soxhlet untuk mendapatkan senyawa kapsaisin yang diduga
memiliki aktivitas antioksidan. Sampel yang akan diekstraksi terlebih dahulu
dikeringkan dengan menggunakan oven pada suhu 50°C, tidak digunakan siar
matahari karena adanya UV dapat mengurangi efektifitas antioksidan sampel.
Kemudian setelah kering, sampel dihaluskan dengan diblender untuk
memperkecil ukuran sehingga kontak dengan cairan penyari semakin banyak, zat
yang tersari juga semakin banyak dan diayak agar didapatkan derajat kehalusan
Kapsaisin diekstraksi dengan menggunakan etanol 96% karena kapsaisin
dapat terlarut dalam etanol. Kapsaisin dapat larut dalam pelarut alkohol,
digunakan etanol karena lebih aman dan memiliki efek toksik yang lebih rendah
dibandingkan dengan metanol. Proses ekstrasi dilakukan dengan membungkus
serbuk simplisia dalam kertas saring kemudian dimasukkan kedalam alat Soxhlet,
selanjutnya etanol dituang kedalamnya, yang kemudian pelarut akan turun
kedalam labu alas bulat, setelah itu diberikan pemanasan pada suhu 70°C.
Pemanasan ini berfungsi untuk menguapkan pelarut dalam labu, kemudian pelarut
akan diembunkan kembali dengan pendingin balik, dan akan menetes kemabali
kedalam bagian Soxhlet yang berisi simplisia sehingga ekstraksi dilakukan
dengan pelarut yang selalu baru. Adanya pelarut yang selalu baru akan
memberikan ekstraksi yang sempurna karena tidak terjadi suatu kesetimbangan
konsentrasi antara cairan dalam sel dengan cairan luar sel.
Proses ekstraksi dilakukan selama sekitar 8 jam, sampai cairan dalam
tabung yang berisi simplisia berwarna bening, yang menunjukkan bahwa senyawa
telah terekstraksi. Hasil ekstraksi yang didapatkan berupa larutan berwarna merah.
Larutan tersebut kemudian dibuat menjadi ekstrak kental. Pemekatan ekstrak
dilakukan dengan menguapkan pelarut dalam ekstrak. Pengupan pelarut dilakukan
dengan menggunakan Vacuum Rotary Evaporator pada suhu 60°C. Prinsip dari alat tersebut adalah penguapan dengan mengurangi tekanan udara sehingga akan
menurunkan titik didihnya. Penurunan titik didih akan mepercepat penguapan
etanol karena pelarut akan mendidih dibawah titik didih normal (78,5°C). Adanya
rotary, yaitu pemutar labu alas bulat yang berisi ekstrak, akan memperluas luas permukaan ekstrak, sehingga proses penguapan akan menjadi lebih cepat.
Bobot ekstrak yang diperoleh sebesar 4,5926 g, sehingga didapatkan
rendemen sebesar 15,3%.
D. Hasil Uji Pendahuluan
Uji pendahuluan merupakan pengujian untuk mengetahui aktivitas
antioksidan secara kualitatif. Pengujian ini hanya untuk mengetahui ada atau
tidaknya aktivitas antioksidan dari ekstrak, yang dibandingkan dengan kontrol.
Uji ini dilakukan dengan mereaksikan radikal bebas DPPH dengan senyawa uji.
Adanya aktivitas antioksidan pada senyawa uji akan ditunjukkan dengan
pemudaran warna ungu, yang merupakan warna DPPH (Molyneux, 2003).
Pemudaran terjadi karena adanya penangkapan elektron radikal bebas oleh
Uji pendahuluan dilakukan dengan menggunakan kontrol negatif berupa
larutan DPPH, kontrol positif berupa kapsaisin, dan ektrak etanolik buah cabai
rawit merah. Kontrol positif dan ekstrak ditambahkan larutan DPPH yang
kemudian didiamkan selama 30 menit, yang merupakan OT teoritis. Hasil
pengujian menunjukkan hasil positif karena adanya pemudaran warna ungu,
dibandingkan terhadap larutan kontrol. Hal ini menujukkan bahwa ekstrak
etanolik buah cabai rawit merah memiliki aktivitas antioksidan melalui
penangkapan radikal bebas DPPH.
Gambar 7. Hasil uji pendahuluan (Ekstrak etanolik buah cabai rawit merah (A), Blangko
(B), Kapsaisin (C))
E. Hasil Optimasi Metode Uji Aktivitas Antioksidan
1. Penentuan panjang gelombang maksimum
Pententuan panjang gelombang maksimum DPPH bertujuan agar
didapatkan absorbansi maksimal dan kepekaan analisis yang maksimal, dimana
adanya perubahan konsentrasi akan memberikan perubahan absorbansi yang besar
nm (Molyneux, 2003). DPPH dapat memberikan serapan karena memiliki
kromofor dan auksokrom, serta adanya delokalisasi elektron pada DPPH sehingga
memberikan warna ungu.
Scanning panjang gelombang dilakukan pada kisaran panjang gelombang 400-600 nm pada larutan kontrol DPPH dengan tiga konsentrasi.
Tabel III. Hasil scanning panjang gelombang maksimum DPPH
Konsentrasi DPPH (mM)
maksimum hasil scanning
(nm) Rata-rata maksimum
0,02 517,5
517,5 nm 0,04 517,0
0,08 518,0
Dari hasil scanning 3 konsentrasi, didapatkan rata-rata panjang gelombang maksimum DPPH 517,5 nm. Pajang gelombang ini yang akan
digunakan untuk pengukuran selanjutnya.
2. Penentuan Operating Time
Operting time (OT) merupakan waktu yang diperlukan agar senyawa
dapat bereaksi secara optimal sehingga dapat memberikan absorbansi yang stabil.
Penentuan operating time dilakukan pada larutan baku kapsaisin konsentrasi 25,
75, dan 125 µg/ml. Pengukuran dilakukan tiap 5 menit selama 60 menit dengan
menggunakan spektrofotometer visibel. Pengukuran dilakukan pada panjang
gelombang maksimal yang telah ditentukan, yaitu 517,5 nm. Hasil pengukuran
tidak didapatkan absorbansi yang stabil atau tetap karean terjadi penurunan terus
menerus. Oleh karena itu, penentuan dilakukan dengan melihat selisih absorbansi
absorbansi yang lebih kecil. Penurunan absorbansi kemudian dibuat dalam suatu
grafik sehingga dapat diketahui waktu dimana absorbansi mendekati stabil.
Gambar 8. Operating Time Kapsaisin
Pada grafik diatas menunjukkan penurunan yang cukup besar, jika
dilihat dari selisihnya, dari menit 0 – 30. Mulai dari menit ke-30 ke bawah terlihat
absorbansi yang mulai stabil, sehingga OT ditentukan pada menit ke-30.
F. Hasil Validasi Metode Uji Aktivitas Antioksidan
Validasi metode perlu dilakukan untuk menilai suatu metode atau
parameter yang digunakan memenuhi persyaratan untuk pengujian tersebut
(Harmita, 2004). Parameter validasi yang digunakan dalam pengujian ini, yaitu
akurasi, presisi, linieritas, dan spesifisitas.
Pengujian validasi metode dilakukan dengan menggunakan baku
kapsaisin dan ektrask etanolik cabai rawit merah, masing-masing sebanyak tiga
kali replikasi. Hasil pengujian akan didapatkan tiga persamaan regresi linier
antara konsentrasi larutan baku kapsaisin dan larutan uji dengan %IC. Dari ketiga
0
Penentuan
Operating Time
Baku
Kapsaisin
25 µg/mL
75 µg/mL
replikasi akan dipilih nilai linearitas (r) yang paling baik, yaitu yang mendekati 1
atau -1, untuk digunakan dalam menghitung CV dan recovery. Tabel IV. Hasil pengukuran %IC seri baku kapsaisin
Replikasi Konsentrasi
(µg/ml) %IC Persamaan regresi linier
I
Tabel V Hasil pengukuran %IC seri larutan ektrak etanolik cabai rawit merah
Replikasi Konsentrasi
(µg/ml) %IC Persamaan regresi linier
II
Linieritas merupakan kemampuan suatu metode untuk dapat
memberikan hasil uji yang secara langsung proporsional dengan konsentrasi analit
di dalam sampel. Menurut Mulja dan Hanwar (2003), data linieritas yang bisa
diterima, yaitu dengan nilai koefisien korelasi (r) > 0,999. Hasil pengujian
linearitas untuk larutan baku kapsaisin, untuk ketiga replikasi telah memiliki
linearitas yang baik sesuai dengan persyaratan tersebut. Linearitas yang paling
baik didapatkan pada replikasi pertama, yaitu 0,9999. Oleh karena itu, metode ini
dikatakan dapat memberikan linieritas yang baik untuk pengujian larutan baku
kapsaisin dengan DPPH.
Pada pengujian ektrak etanolik cabai rawit merah, ketiga replikasi juga
telah memenuhi persyaratan linearitas yang dapat diterima menurut Mulja dan
Hanwar (2003), dimana nilai koefisien korelasi paling baik diperoleh pada
replikasi kedua, yaitu 0,9999. Pada pengujian ektrak etanolik cabai rawit merah,
2. Akurasi
Akurasi menujukkan kedekatan antara kadar analit hasil analisis dengan
kadar analit sebenarnya. Kadar analit sebenarnya dihitung dengan menggunakan
regresi linier yang paling baik diantara tiga replikasi.
Gambar 9. Kurva persamaan regresi linier aktivitas antioksidan kapsaisin
Gambar 10. Kurva regresi linier aktivitas antioksidan ekstrak etanolik buah cabai rawit merah
Kurva persamaan regresi linier aktivitas
antioksidan ekstrak etanolik cabai rawit merah
Akurasi dinyatakan dalam bentuk persen perolehan kembali (recovery) (Harmita, 2004). Persen recovery yang dapat diterima untuk analit dengan kadar 0,01%, sebesar 90-107% (Harmita, 2004).
Tabel VI. Hasil perolehan kembali uji aktivitas antioksidan kapsaisin
Replikasi
Berdasarkan data pada Tabel VI, menunjukkan bahwa nilai recovery
untuk kapsaisin berkisar antara 93,68% - 105,03%, yang telah memenuhi syarat
Tabel VII. Hasil perolehan kembali uji aktivitas antioksidan ekstrak etanolik buah
Pada ekstrak etanolik buah cabai rawit merah diperoleh recovery sekitar 81,33 – 107,82%. Nilai recovery tersebut telah memenuhi syarat untuk kadar
analait sebesar 0,1 %, yaitu 80 – 120% (APVMA, 2004). Oleh karena itu, dapat
dikatakan bahwa metode ini memiliki akurasi yang baik untuk uji aktivitas