Laporan
2011
Praktikum Laboratorium
Lingkungan
Kelompok :
Annis Rachmawati
083050010
Sufiana Solihat
083050016
Deri Baehakhi
083050005
2
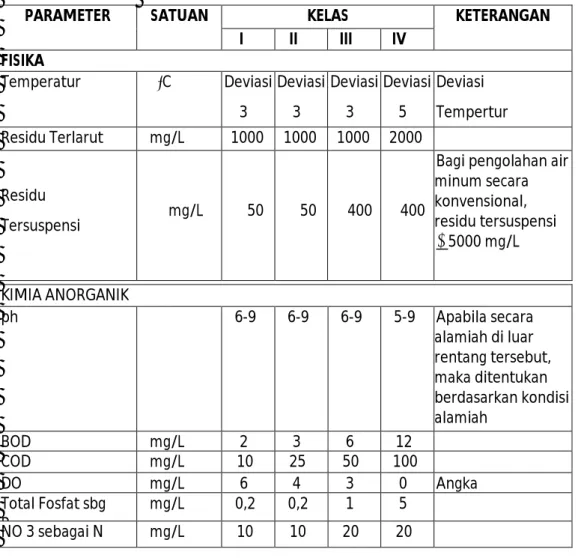
Laporan Laboratorium Lingkungan Tahun Ajaran 2011PARAMETER SATUAN KELAS KETERANGAN
I II III IV FISIKA Temperatur ᵒC Deviasi 3 Deviasi 3 Deviasi 3 Deviasi 5 Deviasi Tempertur Residu Terlarut mg/L 1000 1000 1000 2000 Residu Tersuspensi mg/L 50 50 400 400
Bagi pengolahan air minum secara konvensional, residu tersuspensi ≤ 5000 mg/L KIMIA ANORGANIK ph 6-9 6-9 6-9 5-9 Apabila secara alamiah di luar rentang tersebut, maka ditentukan berdasarkan kondisi alamiah BOD mg/L 2 3 6 12 COD mg/L 10 25 50 100 DO mg/L 6 4 3 0 Angka Total Fosfat sbg P mg/L 0,2 0,2 1 5 NO 3 sebagai N mg/L 10 10 20 20
BAB I
PENDAHULUAN
Kualitas sumber air dari sungai-sungai penting di Indonesia umumnya tercemar amat sangat berat oleh limbah organik yang berasal dari limbah penduduk, industri dan lainnya. Sungai mempunyai fungsi yang strategis dalam menunjang pengembangan suatu daerah, yaitu seringnya mempunyai multi fungsi yang sangat vital diantaranya sebagai sumber air minum, industri dan pertanian atau juga pusat listrik tenaga air serta mungkin juga sebagai sarana rekreasi air
Berdasarkan klasifikasi dan kriteria mutu air dalam PP No.82 tahun 2001 tentang Pengelolaan Kualitas dan Pengendalian Pencemaran Air, air sungai masuk pada kelas 1, yaitu air yang peruntukkannya dapat digunakan untuk air baku air minum, dan atau peruntukan lain yang mempersyaratkan mutu air yang sama dengan kegunaan tersebut.
3
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 NH3-N mg/L 0,5 (-) (-) (-) Bagi perikanan, kandungan amonia bebas untuk ikan yang peka ≤ 0,02 mg/L sebagai NH3 Arsen mg/L 0,05 1 1 1 Kobalt mg/L 0,2 0,2 0,2 0,2 Barium mg/L 1 (-) (-) (-) Boron mg/L 1 1 1 1 Selenium mg/L 0,01 0,05 0,05 0,05 Kadmium mg/L 0,01 0,01 0,01 0,01 Khrom (VI) mg/L 0,05 0,05 0,05 0,01Tembaga mg/L 0,02 0,02 0,02 0,2 Bagi pengolahan air minum secara konvension al, Cu ≤ 1 mg/L Besi mg/L 0,3 (-) (-) (-) Bagi pengolahan air minum secara koncension al, Fe ≤ 5 mg/L Timbal mg/L 0,03 0,03 0,03 1 Bagi pengolahan air minum secara konvension al, Pb ≤ 0,1 mg/L Mangan mg/L 1 (-) (-) (-) Air Raksa mg/L 0,001 0,002 0,002 0,005 Seng mg/L 0,05 0,05 0,05 2 Bagi pengolahan air minum secara konvension al, Zn≤ 5 mg/L Khlorida mg/L 1 (-) (-) (-) Sianida mg/L 0,02 0,02 0,02 (-) Fluorida mg/L 0,5 1,5 1,5 (-) Lanjutan Tabel 1.1
4
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Nitrit sebagai N mg/L 0,06 0,06 0,06 (-) Bagi pengolahan air minum secara konvension al, NO2_N ≤ 1 mg/L Sulfat mg/L 400 (-) (-) (-) Khlorin bebas mg/L 0,03 0,03 0,03 (-) Bagi ABAM tidak dipersyarat kan Belerang sebagai H2S mg/L 0,002 0,002 0,002 (-) MIKROBIOLOGI Fecal coliform jml/100 ml 100 1000 2000 2000Bagi pengolahan air minum secara konvensional, fecal Coliform ≤ 2000 jml/ 100 ml dan Total coliform ≤ 10000 jml/100ml Total coliform jml/100 ml 1000 5000 10000 10000 RADIOAKTIVITAS Gross - A bg/L 0,1 0,1 0,1 0,1 Gross - B bg/L 1 1 1 1 KIMIA ORGANIK Minyak dan Lemak ug/L 1000 1000 1000 (-) Detergen sebagai MBAS ug/L 200 200 200 (-)
Senyawa Fenol ug/L 1 1 1 (-)
Sebagai Fenol ug/L
BHC ug/L 210 210 210 (-) Aldrin/Dieldrin ug/L 17 (-) (-) (-) Chlordane ug/L 3 (-) (-) (-) DDT ug/L 2 2 2 2 Heptachlor dan Heptachlor ug/L 18 (-) (-) (-) Heptachlor dan Heptachlor epoxide ug/L Lindane ug/L 56 (-) (-) (-) Methoxyctor ug/L 35 (-) (-) (-) Endrin ug/L 1 4 4 (-) Toxaphan ug/L 5 (-) (-) (-) Lanjutan Tabel 1.1
5
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Keterangan : mg = miligram ug = mikrogram ml = militer L = liter Bq = BequerelMBAS = Methylene Blue Active Substance ABAM = Air Baku untuk Air Minum
Logam berat merupakan logam terlarut
Nilai di atas merupakan batas maksimum, kecuali untuk pH dan DO.
Bagi pH merupakan nilai rentang yang tidak boleh kurang atau lebih dari nilai yang tercantum. Nilai DO merupakan batas minimum.
Arti (-) di atas menyatakan bahwa untuk kelas termasuk, parameter tersebut tidak dipersyaratkan
Tanda £ adalah lebih kecil atau sama dengan Tanda < adalah lebih kecil
6
Laporan Laboratorium Lingkungan Tahun Ajaran 2011BAB II
PERCOBAAN DAN PEMBAHASAN
2.1 Pengawetan Sampel
Pengawetan sampel air adalah usaha untuk menghambat perubahan komposisi zat-zat tertentu yg ada didalam suatu contoh. Oleh karena itu meski contoh sudah diawetkan, pengujian terhadap parameter harus segera dilakukan agar hasil mencerminkan keadaan contoh pada waktu diambil.
Tabel 2.1 Cara Pengawetan Sampel
No. Parameter pemeriksaan Volume
sample Pengawetan
Waktu maks. pengawetan
1. Suhu 100 Analisa segera 0 2. Warna 500 Didinginkan 2 hari 3. Zat tersuspensi 200 Didinginkan 7-14 hari 4. Kekeruhan 100 Disimpan di tempat gelap 1-2 hari 5. Daya Hantar Listrik 500 Didinginkan 28 hari 6. pH 100 Analisa segera 2 jam 7. Alkliniti 200 Didinginkan 1-14 hari 8. BOD 1000 Didinginkan 6 jam – 14 hari 9. CO2 10 Dianalisa segera 0
10. COD 100 Diasamkan (pH < 2) dengan H2SO4 7-28 hari
11. Phosfat 100 Penyaringan segera kemudian
dibekukan -100C 2 hari
12. Kesadahan Mg2+ + Ca2+ 100 Diasamkan (pH < 2) dengan HNO3 6 bulan
13. Klor, Cl2 500 Dianalisa segera 0.5-2 jam
14. Logam - Penyaringan segera; Diasamkan (pH < 2) dengan HNO3
6 bulan
15. Ammonium 50 Dianalisa segera; Diasamkan (pH < 2) dengan H2SO4
7-28 hari 16. Nitrat 100 Diasamkan (pH < 2) dengan H2SO4 2 hari
17. Nitrat – nitrit 200 Dianalisa segera atau dibekukan -200C 0-28 hari
18. Nitrit 100 Dianalisa segera atau dibekukan -200C 0-2 hari
19. N Kjeldahl 500 Didinginkan atau Diasamkan (pH < 2) dengan H2SO4
7
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Lanjutan Tabel 2.120 Oksigen 300
- Cara elektroda khusus: Analisa segera - Cara titrasi winkler: Diasamkan (pH < 2) dengan H2SO4
0.5-1 jam
8 jam Sumber: Modul Praktikum Laboratorium Lingkungan, 2011
2.2 Parameter yang dianalisa 2.2.1 Warna
Meskipun murni, air selalu dikatakan berwarna biru-hijau apabila volume air cukup banyak. Suatu hal yang penting untuk membedakan antara warna asli air (true colour) dan warna semu (apparent colour) .
Warna air adalah sifat fisik air yang disebabkan oleh karakteristik zat-zat yang terdapat di dalam air, bukan disebabkan oleh molekul-molekul itu sendiri, karena air murni itu tidak berwarna.
Warna dalam air alam dibedakan atas :
a. Warna sejati, yaitu warna di dalam air yang disebabkan oleh adanya senyawa organik yang larut, seperti pelapukan dedaunan atau ranting pohon
b. Warna semu, yaitu warna di dalam air yang disebabkan oleh zat-zat tersuspensi (kekeruhan). Disebut warna semu karena sifat warna tersebut akan hilang apabila air tersebut disaring atau disentrifuge.
Metode
Metode yang dilakukan dalam percobaan warna ini adalah metode Colorimetri. Colorimetric merupakan salah satu metoda pengukuran konsentrasi suatu zat secara kuantitatif dengan melihat karakter warna yang proporsional terhadap konsentrasi zat yang diukur.
Prinsip percobaan
Warna air dibandingkan dengan standar yang terbuat dari K2PtCl6 dan Cobalt.
Pereaksi
Larutan stock standar warna Pt-Co
Larutkan 1.246 gr K2PtCl6 atau 0.5 g Pt dan 1.0 CoCl2 dengan aquadest. Tambahkan 100
ml HCL pekat, kemudian encerkan dengan aquadest sampai volume 1 liter. Larutkan standar ini mengandung 500 unit Pt-Co.
8
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Larutan standar warna Pt-CoBuat sederatan larutan standar warna Pt-Co dalam tabung nestler dengan cara mengencerkan stock standar warna Pt-Co, yang akan dilihat pada tabel dibawah ini.
Tabel 2.2 parameter Larutan standar warna Pt-Co
No. Larutan stock (ml) Aquadest (ml) Unit Pt-Co
1. 0.50 49.5 5 2. 1.0 49 10 3. 2.0 48 20 4. 3.0 47 30 5. 4.0 46 40 6. 5.0 45 50
Sumber: Modul Praktikum Laboratorium Lingkungan, 2011
Cara Kerja
Pengukuran warna sejati (true color)
Pisahkan zat tersuspensi dari sample air dengan cara disentrifuge atau disaring Masukan sampel yang terlah dicentrifuge ke dalam tabung nessler 50 ml sampai
tanda batas
Bandingkan warna dengan contoh air tersebut dengan larutan – larutan baku (standar) yang tersedia dengan cara melihatnya dari bagian atas cairan dengan alas putih
Catat unit warna larutan baku yang sesuai dengan contoh air
Pengukuran warna semu (apparent color) Kocok sampel air dengan sempurna
Masukan sampel air tersebut ke dalam tabung nessler 50 ml yang lainnya sampai tanda batas
Bandingkan dengan warna-warna contoh air tersebut dengan larutan-larutan baku yang tersedia
Cata unit warna larutan baku yang sesuai dengan contoh air.
Hasil analisa
Dikarenakan dengan kurangnya fasilitas untuk ketersediaan bahan, maka pada pengamatan warna ini tidak dilakukan, sehingga tidak ada hasil yang diperoleh.
9
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 2.2.2 KekeruhanKekeruhan dalam air tanah biasanya disebakan karena adanya zat padat yang tersuspensi yang bersifat anorganik dan organic sedangkan zat organic. Kekeruhan dalam air disebabkan oleh zat-zat yang tersuspensi (tidak larut).
Sumber kekeruhan dalam air dapat berasal dari berbagai kegiatan manusia, seperti kegiatan pertanian, pertambangan terbuka, sehingga banyak tanah yang terbawa oleh aliran air hujan.
Partikel-partikel yang tersuspensi tersebut dapat berupa senyawa organic yang berasal dari pelapukan tanaman atau hewan dan zat anorganik yang biasanya berasal dari lapisan batuan ataupun logam, yang dapat menimbulkan efek terhadap kesehatan, estetika dan proses desinfeksi.
Untuk pengukuran kekeruhan dalam air, selain menggunkan alat turbidimeter helliege dapat juga dengan alat-alat spesifik lainnya. Untuk setiap alat turbidimeter selalu dilengkapi dengan cara penggunaannya. Satuan kekeruhan dalam air dapat dinyatakan dengan satuan mg/l SiO2, NTU (Nephelometric Turbidity Units), FTU (Formazin Turbidity Units), JTU (Jackson Turbidity Units). Untuk setiap alat turbidimeter harus dilengkapi dengan standar kekeruhan.
Batas waktu pengukuran yang masih direkomendasi adalah 24 jam dengan penyimpanan dalam ruang gelap dan dingin. Jika contoh air terlalu lama makan akan terjadi perubahan kekruhan dalam air akibat sedimentasi dan sebagainya.
Metode
Turbidimetri dengan alat Turbidi meter Helliege
Prinsip
Pengukuran kekeruhan dalam air berdasarkan pengukuran intensitas cahaya yang dipendarkan oleh zat-zat tersuspensi dalam air.
Cara kerja
Masukkan contoh air yang telah dikocok kedalam tabung turbidimeter 50 mm sampai tanda batas dan tutup (jangan sampai ada gelembung udara)
Masukkan kedalam alat turbidimeter dengan posisi cermin terbuka dan gunkan filter dark Tutup pintu turbidimeter dan nyalakan lampunya
Putar skala pembacaan sambil dilihat dari atas sehingga kekeruha air tersebut sesuai dcengan standar
10
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Baca skala pembacaan dan masukkan ke dalam grafik standar kekeruhan sehingga didapat nilai kekeruhannya.
Jika skala pembacaan melebihi btas grafik standar kekeruhan, maka filternya diganti dengan ururtan sebagai berikut:
1. Filter dark, cermin tertutup dan ukuran tabung 50 mm, 2. Filter light, cermin tertutup dan ukuran tabung 50 mm, 3. Filter none, cermin tertutup dan ukuran tabung 50 mm, 4. Filter none, cermin tertutup dan ukuran tabung 20 mm,
Hasil analisa
Hasil yang didapat untuk sampel air yang diamati menggunakan turbidimeter ialah 49 dengan skala filter none, cermin tertutup.
2.2.3 Daya Hantar Listrik
DHL adalah kemampuan air untuk menghantarkan arus listrik, hal ini disebabkan karena adanya mineral yang terlarut dalam air yang terionisasi. Ion –ion tersebut di dalam air berkemapuan untuk menghantarkan arus listrik.
Tujuan dari pengukuran konduktivitas adalah untuk mengetahui banyak ion – ion yang terlarut dalam air atau banyak mineral yang terlarut.
Parameter ini penting untuk memprediksikan kandungan mineralnya, semakin tinggi kandungannya, maka akan semakin tinggi nilai DHL-nya. Batas waktu maksimum pengukuran yang direkomendasikan adalah 28 hari.
Metode
Metode yang dapat digunakan dalam percobaan ini adalah Conductivimetri.
Prinsip
Pengukuran daya hantar listrik berdasarkan kemampuan kation dananion untuk menghantarkan arus listrik yang dialirkan ke dalam air.
Cara kerja
Kalibrasi conductivity meter:
11
Laporan Laboratorium Lingkungan Tahun Ajaran 2011- Larutan standar KCl 0.0100 M disimpan dalam pemanas aie sehingga temperature larutan standar tersebut mencapai 25ᵒC
- Celupkan elektroda kedalam larutan standar KCl 0.0100 M - Putar pengatur suhu alat sehingga menunjukan temperature 25ᵒC
- Putar pengatur kalibrasi sehingga alat tersebut memberikan pambacaan 1413 mikromhos/cm.
- Cuci elektroda dengan aquadest dan keringkan
- Kalibrasi apat dilakukan terhadap larutan standar KCl pada berbagai konsentrasi dan akan memberikan pembacaan.
Pengukuran daya hantar listrik - Ukur temperratur sampel air
- Putar pengukur temperature sesuai dengan temperature sampel air
- Celupkan elektroda ke dalam sampela air dan alat tersebut akan memrikan nilai daya hantar listrik untuk contoh air tersebut.
Hasil pengamatan
Hasil yang didapat untuk DHL dari sampel air sungai Cikalimati adalah sebesar 498 ms/cm
2.2.4 pH
pH (Puissance d’Hydrogen Scale) merupakan parameter untuk menyatakan suatu keasaman air, untuk menyatakan banyaknya ion H+ di dalam air, semakin banyak ion H+ dalam air,
semakin rendah pH air. Data pH sangat diperlukan untuk mengetahui apakah air tersebut memenuhi persyaratan tertentu, misalnya untuk air minum dipersyaratkan pH antara pH 6,5 – 8,5.
Metode
Metode yang umum dipakai dalam penentuan pH suatu larutan adalah Electrode – Potensiometri
Prinsip
Eletroda gelas mempunyai kemampuan untuk mengukur konsentrasi H+ dalam air secara
12
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Cara kerjaSetiap pH meter yang akan digunakan untuk mengukur pH air harus dikalibrasi terlebih dahulu dengan larutan buffer pH 4.0; pH 7.0; pH 9.0
Pada alat pH meter, umumnya dilengkapi dengan: - read out untuk pH
- pengatur suhu - pengatur kalibrasi - elektroda
kalibrasi pH meter
- cuci elektroda dengan aquadest, kemudian keringkan dengan kertas penghisap. - Celupkan eletroda ke dalam larutan buffer 4,0
- Setelah pH meter dinyalakan, atur pengatur suhu sesuai dengan suhu larutan buffer - Putar pengatur pH sehingga pembacaan menunjukkan nilai pH yang sesuai dengan
larutan buffer
- Teruskan kalibrasi dengan buffer pH 7 dan pH 9
Pengukuran pH contoh air
- Masukkan kira-kira 150 ml sampel air ke dalam gelas kimia 250 ml
- Ukur suhu sampel dengan thermometer, kemuian celupkan elektroda yang telah dibersihkan ke dalam sampel
- Putar pengatur suhu sesuai dengan suhu sampel,
- Nyalakan pH meter, read out. pH meter akan menunjukan nilai pH sampel air tersebut - Selama pemgukuran sampel air dikocok dengan menggunakan magnetic stirrer.
- Setelah selesai pengukuran, matikan pH meter, kemudian bilas elektroda dengan aquadest dan simpan dalam keadaan tercelup di dalam aquadest.
Hasil pengamatan
nilai pH yang didapat dari sampel air Sungai Cikalimati sebesar 7,04.
2.2.5 Asiditas – Alkalinitas
Asiditas adalah kemampuan air untuk menetralkan larutan basa, sedangkan alkalinitas adalah kemampuan air untuk menetralkan larutan asam. Penyebab asidi alkalinitas dalam air adalah H+, CO
13
Laporan Laboratorium Lingkungan Tahun Ajaran 2011Pengukuran asid-alkalinitas harus dilakukan sesegera mungkin dan biasanya dilakukan ditempat pengambilan contoh (analisa setempat). Batas waktu pengukuran yang masih direkomendasikan adalah 14 hari, kecuali untuk gas CO2, harus dilakukan pada saat sampling,
Karena gas CO2 mudah berubah. Satuan yang digunakan adalah mg/l atau mg/l CaCO3 sering
digunakan untuk menyatakan konsentrasi asiditas dan alkalinitas dalam air.
Metode
Metode yang dapat digunakan dalam mengukur asiditas-alkalinitas adalah Titrasi asam – basa.
Prinsip
Asiditas atau alkalinitas dalam air dinetralkan dengan basa NaOH atau asam HCl menggunakan indicator fenolftalin dan metal orange.
Cara kerja
Masukkan 100 ml sampel air kedalam Erlenmeyer, lalu tambahkan 20 tetes indicator fenolftalin 0.035%, amati perubahan warna yang terjadi.
Jika tidak terjadi perubahan warna (larutan tetap tidak berwarna), lakukan cara kerja untuk asidias (cara kerja A)
Jika cairan berubah warna menjadi merah (merah muda), lakukan cara kerja untuk alkalinitas (cara kerja B)
Ternyata setelah dilakukan penambahan fenolftalin, tidak terjadi perubahan warna dan larutan tetap tidak berwarna. Oleh karena itu, dilakukan cara kerja untuk Asiditas sebagai berikut:
a. Titrasi dengan larutan NaOH 0.1 N sampai cairan berwarna merah muda. Catat banyaknya larutan NaOH 0.1 N yang digunakan (ml)
b. Tambahkan 3-5 tetes indicator metyl orange 0.1%
c. Lanjutkan titrasi dengan larutan HCl 0.1 N sampai cairan berubah warna dari kunig menjadi orange (jingga). Catat banyak larutanHCl 0.1 N yang digunakan.
Hasil pengamatan
volume titrasi yang didapat: NaOH = 1 ml
14
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Perhitungan1 ml < 57.3 ml → Ρ < m, maka: Air mengandung CO2 dan HCO3-
Mg/l CO2 =
2 CO2
= 2 0.09954 22 = 43.78 mg/l CO2
Jadi, nilai CO2 yang terkandung didalam sampel air yang telah diamati adalah 43.78 mg/l
CO2
Mg/l HCO3- =
[( ) − ( )] HCO3 = [(57.3 0.013) − (1 0.0995)] 61
= 299.32 mg/l HCO3-
Jadi, setelah dilakukan sampling terhadap sampel air, maka didapat angka 299.32 mg/l HCO3
-2.2.6 CO2 Agresif
Metode
Metode yang dapat digunakan untuk mengukur CO2 Agresif adalah berdasarkan kepada grafik Mundlein Frankfurt.
Parameter yang Harus Diketahui
Paremater-parameter yang harus diketauhui dalam perhitungan ini adalah: CO2 bebas
CO2 bebas ditetapkan sesuai dengan prosedur penetapan asidi-alkalinitas.
HCO3- atau kesadahan sementara
HCO3- ditetapkan dengan prosedur penetapan asidi-alkalinitas.
Perhitungan
Diketahui nilai CO2 bebas sebesar 43,78 mg/l CO2, dan nilai HCO3- sebesar 299.32 mg/l
HCO3- dari percobaan sebelumnya. Kemudian diplot ke dalam Grafik Frankfurt tersebut, maka
didapat pertemuan garis tersebut pada titik A. Lalu digeser sampai memotong Garis Kesadahan, didapat nilai B dengan nilai CO2 sebesar 42,5 mg/L.
Maka, = 43,78 − 42,5 = 1,28
15
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 2.2.7 KesadahanKesadahan air didefinisikan sebagai kemampuan air untuk mengendapkan sabun, sehingga keaktifan/ daya bersih sabun menjadi berkurang atau hilang sama sekali. Sabun adalah zat aktif permukaan yang berfungsi menurunkan tegangan permukaan air, sehingga air sabun dapat berbusa. Air sabun akan membentuk emulsi atau sistem koloid dengan zat pengotor yang melekat dalam benda yang hendak dibersihkan.
Kesadahan terutama disebabkan oleh keberadaan ion-ion kalsium (Ca2+) dan magnesium
(Mg2+) di dalam air. Keberadaannya di dalam air mengakibatkan sabun akan mengendap sebagai
garam kalsium dan magnesium, sehingga tidak dapat membentuk emulsi secara efektif. Kation-kation polivalen lainnya juga dapat mengendapkan sabun, tetapi karena Kation-kation polivalen umumnya berada dalam bentuk kompleks yang lebih stabil dengan zat organik yang ada, maka peran kesadahannya dapat diabaikan. Oleh karena itu penetapan kesadahan hanya diarahkan pada penentuan kadar Ca2+ dan Mg2+. Kesadahan total didefinisikan sebagai jumlah miliekivalen (mek)
ion Ca2+ dan Mg2+ tiap liter sampel air (Anonim, 2008).
Kesadahan atau hardness adalah salah satu sifat kimia yang dimiliki oleh air. Penyebab air menjadi sadah adalah karena adanya ion-ion Ca2+, Mg2+. Atau dapat juga disebabkan karena
adanya ion-ion lain dari polyvalent metal (logam bervalensi banyak) seperti Al, Fe, Mn, Sr dan Zn dalam bentuk garam sulfat, klorida dan bikarbonat dalam jumlah kecil.
Air yang banyak mengandung mineral kalsium dan magnesium dikenal sebagai “air sadah”, atau air yang sukar untuk dipakai mencuci. Senyawa kalsium dan magnesium bereaksi dengan sabun membentuk endapan dan mencegah terjadinya busa dalam air. Oleh karena senyawa-senyawa kalsium dan magnesium relatif sukar larut dalam air, maka senyawa-senyawa-senyawa-senyawa itu cenderung untuk memisah dari larutan dalam bentuk endapan atau presipitat yang akhirnya menjadi kerak.
Pengertian kesadahan air adalah kemampuan air mengendapkan sabun, di mana sabun ini diendapkan oleh ion-ion yang saya sebutkan diatas. Karena penyebab dominan/utama kesadahan adalah Ca2+ dan Mg2+, khususnya Ca2+, maka arti dari kesadahan dibatasi sebagai sifat /
karakteristik air yang menggambarkan konsentrasi jumlah dari ion Ca2+ dan Mg2+, yang dinyatakan
sebagai CaCO3. Kesadahan ada dua jenis, yaitu (Giwangkara, 2008) :
1. Kesadahan sementara
Adalah kesadahan yang disebabkan oleh adanya garam-garam bikarbonat, seperti Ca(HCO3)2,
Mg(HCO3)2. Kesadahan sementara ini dapat / mudah dieliminir dengan pemanasan (pendidihan),
16
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Reaksinya:Ca(HCO3)2 → dipanaskan → CO2 (gas) + H2O (cair) + CaCO3 (endapan)
Mg(HCO3)2 → dipanaskan → CO2 (gas) + H2O (cair) + MgCO3 (endapan)
2. Kesadahan tetap
Adalah kesadahan yang disebabkan oleh adanya garam-garam klorida, sulfat dan karbonat, misal CaSO4, MgSO4, CaCl2, MgCl2. Kesadahan tetap dapat dikurangi dengan penambahan larutan
soda–kapur (terdiri dari larutan natrium karbonat dan magnesium hidroksida) sehingga terbentuk endapan kaslium karbonat (padatan/endapan) dan magnesium hidroksida (padatan/endapan) dalam air.
Reaksinya:
CaCl2 + Na2CO3 → CaCO3 (padatan/endapan) + 2NaCl (larut)
CaSO4 + Na2CO3 → CaCO3 (padatan/endapan) + Na2SO4 (larut)
MgCl2 + Ca(OH)2 → Mg(OH)2 (padatan/endapan) + CaCl2 (larut)
MgSO4 + Ca(OH)2 → Mg(OH)2 (padatan/endapan) + CaSO4 (larut)
Ketika kesadahan kadarnya adalah lebih besar dibandingkan penjumlahan dari kadar alkali karbonat dan bikarbonat, yang kadar kesadahannya eqivalen dengan total kadar alkali disebut “ kesadahan karbonat; apabila kadar kesadahan lebih dari ini disebut “kesadahan non-karbonat”. Ketika kesadahan kadarnya sama atau kurang dari penjumlahan dari kadar alkali karbonat dan bikarbonat, semua kesadahan adalah kesadahan karbonat dan kesadahan noncarbonate tidak ada. Kesadahan mungkin terbentang dari nol ke ratusan miligram per liter, bergantung kepada sumber dan perlakuan dimana air telah subjeknya
Metode
Metode yang dapat digunakan dalam pengukuran kesadahan adalah dengan Titrasi kompleksometri dengan EDTA.
Kesadahan total yaitu ion Ca2+ dan Mg2+ dapat ditentukan melalui titrasi dengan EDTA
sebagai titran dan menggunakan indikator yang peka terhadap semua kation tersebut. Kejadian total tersebut dapat dianalisis secara terpisah misalnya dengan metode AAS (Automic Absorption
Spectrophotometry) (Abert dan Santika, 1984).
Asam Ethylenediaminetetraacetic dan garam sodium ini (singkatan EDTA) bentuk satu kompleks kelat yang dapat larut ketika ditambahkan ke suatu larutan yang mengandung kation logam tertentu. Jika sejumlah kecil Eriochrome Hitam T atau Calmagite ditambahkan ke suatu larutan mengandung kalsium dan ion-ion magnesium pada satu pH dari 10,0 ± 0,1, larutan menjadi berwarna merah muda. Jika EDTA ditambahkan sebagai satu titran, kalsium dan magnesium akan
17
Laporan Laboratorium Lingkungan Tahun Ajaran 2011menjadi suatu kompleks, dan ketika semua magnesium dan kalsium telah manjadi kompleks, larutan akan berubah dari berwarna merah muda menjadi berwarna biru yang menandakan titik akhir dari titrasi. Ion magnesium harus muncul untuk menghasilkan suatu titik akhir dari titrasi. Untuk mememastikankan ini, kompleks garam magnesium netral dari EDTA ditambahkan ke larutan buffer.
Penentuan Ca dan Mg dalam air sudah dilakukan dengan titrasi EDTA. pH untuk titrasi adalah 10 dengan indikator Eriochrom Black T (EBT). Pada pH lebih tinggi, 12, Mg(OH)2 akan
mengendap, sehingga EDTA dapat dikonsumsi hanya oleh Ca2+ dengan indikator murexide.
Adanya gangguan Cu bebas dari pipa-pipa saluran air dapat di masking dengan H2S. EBT yang
dihaluskan bersama NaCl padat kadangkala juga digunakan sebagai indikator untuk penentuan Ca ataupun hidroksinaftol. Seharusnya Ca tidak ikut terkopresitasi dengan Mg, oleh karena itu EDTA direkomendasikan.
Kejelasan dari titik- akhir banyak dengan pH peningkatan. Bagaimanapun, pH tidak dapat ditingkat dengan tak terbatas karena akibat bahaya dengan kalsium karbonat mengendap, CaCO3,
atau hidroksida magnesium, Mg(OH)2 , dan karena perubahan celup warnai di ketinggian pH
hargai. Ditetapkan pH dari 10,0 ± 0,1 adalah satu berkompromi kepuasan. Satu pembatas dari 5 min disetel untuk jangka waktu titrasi untuk memperkecil kecenderungan ke arah CaCO3 pengendapan.
Prinsip
Kalsium dan magnesium dalam air dapat membentuk senyawa komplek dengan Etilen Diamine Tetra Asetat (EDTA) pada suatu pH tertentu. Untuk mengetahui titik akhir titrasi digunkan indicator logam yaitu indicator EBT dan Murexida.
Cara kerja
Kesadahan total
- Masukkan 100 ml sampel air ke dalam Erlenmeyer,
- Tambahkan 5 ml larutan buffer pH 10, jika cairan menjadi keruh, tambahkan 1 ml KCN 10% Kemudian ditambah 50 mg indicator EBT
- Titrasi dengan larutan EDTA 1/28 N sampai cairan berubah warna menjadi biru laut. - Catat banyaknya larutan EDTA yang digunakan.
Kesadahan kalsium
18
Laporan Laboratorium Lingkungan Tahun Ajaran 2011- Tambahkan 5 ml larutan buffer pH 12, jika cairan menjadi keruh, tambahkan 1 ml KCN 10% Kemudian ditambah 50 mg indicator murexida
- Titrasi dengan larutan EDTA 1/28 N sampai cairan berubah warna dari merah anggur menjadi ungu
- Catat banyaknya larutan EDTA yang digunakan.
Hasil pengamatan kesadahan total
volume titrasi yang didapat: EDTA 14,2 ml Perhitungan Kesadahan total = = 14.2 0.9785 = 13.9 ᵒG
Jadi, kadar kesadahan total pada sampel air sungai Cikalimati yang telah diteliti sebesar 13.9 ᵒG
Kesadahan Ca
volume titrasi yang didapat: EDTA 4 ml Perhitungan Kesadahan Ca = = 4 0.9818 = 3.93 ᵒG
Dari hasil pengamatan terhadap sampel air sungai Cikalimati didapat kadar kesadahan Ca sebesar 3.93 ᵒG
Kesadahan magnesium Perhitungan
Kesadahan Mg = kesadahan total – kesadahan Ca = 13.9 ᵒG - 3.93 ᵒG
= 9.97 ᵒG
19
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 2.2.8 SulfatSulfat (SO42-)merupakan anion yang banyak terdapat dalam air di alam. Kandungan sulfat
dalam air minum < 250 mg/l. Selain itu, sulfat yang ada pada limbah industry dapat menyebabkan kerak pada ketel uap dan heat exchange.
Seringkali kehadiran SO42- menimbulkan bau dan korosi pada pipa. Bila O2 dan NO3 dalam
air tidak ada, SO42- akan bertindak sebagai sumber oksigen/penerima electron pada oksidasi
biokimia bakteri anaerob. Ion sulfat adalah salah satu anion yang banyak terjadi pada air alam. Ia merupakan sesuatu yang penting dalam penyediaan air untuk umum karena pengaruh pencucian perut yang cukup besar. Sulfat penting dalam penyediaan air untuk umum maupun untuk industri, karena kecenderungan air untuk mengandungnya dalam jumlah yang cukup besar untuk membentuk kerak air yang keras pada ketel dan alat pengubah panas.
Sulfat merupakan suatu bahan yang perlu dipertimbangkan, sebab secara langsung merupakan “penanggung jawab” dalam dua problem yang serius yang sering dihubungkan dengan penanganan dan pengolahan air bekas. Masalah ini berupa masalah bau dan masalah korosi pada perpipaan yang diakibatkan dari reduksi sulfat menjadi hidrogen sulfida dalam kondisi anaerobik. Efek laksatif pada sulfat ditimbulkan pada konsentrasi 600-1000 mg/l, apabila Mg+ dan Na+ merupakan kation yang bergabung dengan SO4, yang akan menimbulkan rasa mual dan ingin muntah.
Metode
Metode yang umum digunakan dalam mengukur kadar sulfat dalam susatu sampel adalah dengan Turbidimetri.
Analisis secara turbidimetri merupakan analisis berdasarkan pengukuran turbiditas (S) atau kekeruhan dari suatu suspensi. Kekeruhan dapat disebabkan oleh bahan-bahan tersuspensi yang bervarisasi dari ukuran koloidal sampai dispersi kasar, tergantung dari derajad turbulensinya. Pengukuran intensitas cahaya yang ditransmisi sebagai fungsi dari konsentrasi fase terdispersi adalah dasar dari analisis turbidimetri.
Dalam membuat kurva kalibrasi dianjurkan dalam penerapan turbidimetri karena hubungan antara sifat-sifat optis suspensi dan konsentrasi fase terdispersinya paling jauh adalah semi empiris. Agar kekeruhan (turbidity) itu dapat diulang penyiapannya haruslah seseksama mungkin, endapan harus sangat halus. Intensitas cahaya bergantung pada banyaknya dan ukuran partikel dalam suspensi sehingga aplikasi analitik dapat dimungkinkan. Prinsip spektroskopi absorbsi dapat digunakan pada turbidimeter, dan nefelometer. Untuk turbidimeter, absorpsi akibat partikel yang tersuspensi diukur sedangkan pada nefelometer, hamburan cahaya oleh suspensilah yang diukur.
20
Laporan Laboratorium Lingkungan Tahun Ajaran 2011Meskipun presisi metode ini tidak tinggi tetapi mempunyai kegunaan praktis, sedang akurasi pengukuran tergantung pada ukuran dan bentuk partikel. Setiap instrument spektroskopi absorpsi dapat digunakan untuk turbidimeter, sedangkan nefelometer memerlukan resptor pada sudut 90oC terhadap lintasan cahaya. Aplikasi teknik turbidimeter cukup luas, misalkan dalam studi pencemaran air, jumlah sulfat dalam air dapat diukur dengan turbidimeter. Penentuan sulfat dalam air laut, dapat dilakukan dengan mengubah sulfat menjadi suatu partikel yang tersuspensi dalam air laut tersebut, sehingga memungkinkan dilakukannya analisa secara turbidimetri
Prinsip
Ion sulfat dalam air dengan penambahan Kristal BaCl2 dan buffer salt acid akan membentuk koloid tersuspensi (kekeruhan). Semakin tinggi konsentrasi sulfat semakin keruh cairan. Kekeruhan yang terjadi diukur dengan alat tubidimeter.
Cara kerja
- Saring sampel air jika keruh
- Masukkan 50 ml sampel kedalam Erlenmeyer
- Tambahkan 10 ml larutan salt acid dan 50 mg Kristal BaCl2 - Kosok dan biarkan selama 5 menit
- Kekeruhan yang terjadi diukur dengan spektrofotometer pada λ 420 mm
- Dari hasil pembacaan, masukkan ke dalam kurva kalibrasi sehingga didapat konsentrasi sulfat dalam mg/l sampel.
Hasil pengamatan
abs blanko = 0.30 abs sample = 0.38
Y = abs sample - abs blanko = 0.38 – 0.30 = 0.08 Perhitungan Y = 0.0125 x + 0.0001 0.08 = 0.0125 x + 0.0001 X = . – . . X = 6,392 mg/l SO42-
21
Laporan Laboratorium Lingkungan Tahun Ajaran 2011Jadi, kandungan sulfat dari sampel air yang telah diperiksa menunjukan hasil sebesar 6,392 mg/l SO4
2-2.2.9 Zat Organik
Zat organik sering juga disebut angka permanganate, merupakan pengukuran angka permanganate atau pengukuran zat organic dalam air, dimana zat organic di dalam air dioksidasi oleh oksidator kuat KMnO4 pada temperatur mendidih (100oC) selama 10 menit.
Kelemahan metode ini adalah untuk jenis senyawa organic yang mudah menguap, tidak akan terukur karena akan menguap pada pemanasan di dalam labu Erlenmeyer yang terbuka. Prinsip pengukuran, zat organic dalam air dioksidasi oleh KMnO4 berlebih dalam suasana asam dan panas. Kelebihan KMnO4 direduksi oleh asam oksalat berlebih. Kelebihan asam oksalat dititrasi kembali oleh larutan KMnO4.
Metode
Metode yang biasa dipakai dalam penentuan kadar zat organik yang terkandung dalam suatu sampel adalah metode Titrasi permanganometri.
Prinsip
Zat organik dioksidasi oleh KMnO4 berlebih dalam suasana asam san panas. Kelebihan KMnO4 direduksi oleh asam oksalat berlebih. Kelebihan asam oxalate di titrasi kembali oleh larutan KMnO4.
Cara kerja
Pembebasan labu Erlenmeyer dari zat organik
- Masukkan 100 ml air kran ke dalam labu Erlenmeyer - Tambahkan beberapa buah batu didih
- Tambahkan 5 ml H2SO4 4N bebeas organic dan tetes demi tetes larutan KMnO4 0.01 N sampai cairan berwarna merah muda (ros)
- Panaskan di atas api atau hot palte dan biarkan mendidih selama 10 menit, jika selama pendidihan warna merah muda hilang, tambahkan lagi larutan KMnO4 0.01 N sampai merah muda tidak hilang
- Setelah selesai, buang cairan dalam Erlenmeyer dan gunakan untuk penentuan zat organic dalam sampel tanpa dicuci.
22
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Pemeriksaan zat oraganik- Masukkan sampel air kedalam Erlenmeyer bebas organic
- Tambahkan 5 ml H2SO4 4N bebas organic dan tetes demi tetes larutan KMnO4 0.01 N
sampai cairan berwarna merah muda (ros). Hitung penambahan KMnO4
- Panaskan di atas api atau hot palte dan biarkan mendidih selama 10 menit, jika selama pendidihan warna merah muda hilang, tambahkan lagi larutan KMnO4 0.01 N sampai merah muda tidak hilang. Hitung kembali penggunaan KMnO4
- Setelah hamper mendidih, tambhakan 10 ml larutan KMnO4 0.01 N, pemanasan diteruskan selama 10 menit tepat. Jika selama pemanasan warna KMnO4 hilang, tambahkan lagi 10 ml KMnO4 0.01N, penambahan diteruskan sampai cairan tetap berwarna merah
Mencari factor ketelitian KMnO4
- Masukkan 10 ml asam oxalate 0.01 N ke dalam labu Erlenmeyer yang telah bebas organic
- Tambahkan 5 ml H2SO4 4N bebas organic - Panaskan sampai hamper mendidih (70ᵒC)
- Titrasi dengan larutan KMnO4 0.01N sampai cairan berwarna merah muda (ros) - Catat banyaknya larutan KMnO4 yang digunakan
Factor ketelitian =
Hasil pengamatan - Volume titrasi = 6.5 ml
- Faktor ketelitian KMnO4 (f) = 1.02
Perhitungan: = 1000 × (10 + ) × f − 10) × 31,6 × 0,01 =1000 100 × (10 + 6,5) × 1,02 − 10) × 31,6 × 0,01 = 21,58 mg L Jadi diperoleh kadar zat organic dalam sampel air Sungai Cikalimati sebesar 21,58 mg/L
2.2.10 Klorida
Klorida banyak ditemukan di alam, hal ini di karenakan sifatnya yang mudah larut. Kandungan klorida di alam berkisar < 1 mg/l sampai dengan beberapa ribu mg/l di dalam air laut.
23
Laporan Laboratorium Lingkungan Tahun Ajaran 2011Air buangan industri kebanyakan menaikkan kandungan klorida demikian juga manusia dan hewan membuang material klorida dan nitrogen yang tinggi.
Kadar Cl- dalam air dibatasi oleh standar untuk berbagai pemanfaatan yaitu air minum,
irigasi dan konstruksi. Konsentrasi 250 mg/l unsure ini dalam air merupakan batas maksimal konsentrasi yang dapat mengakibatkan timbulnya rasa asin. Konsentrasi klorida dalam air dapat meningkat dengan tiba-tiba dengan adanya kontak dengan air bekas. Klorida mencapai air alam dengan banyak cara. Kotoran manusia khususnya urine, mengandung klorida dalam jumlah yang kira sama dengan klorida yang dikonsumsi lewat makanan dan air. Jumlah ini rata-rata kira-kira 6 gr klorida perorangan perhari dan menambah jumlah Cl dalam air bekas kira-kira-kira-kira 15 mg/l di atas konsentrasi di dalam air yang membawanya, disamping itu banyak air buangan dari industri yang mengandung klorida dalam jumlah yang cukup besar.
Klorida dalam konsentrasi yang layak adalah tidak berbahaya bagi manusia. Klorida dalam jumlah kecil dibutuhkan untuk desinfectan. Unsur ini apabila berikatan dengan ion Na+dapat menyebabkan rasa asin, dan dapat merusak pipa-pipa air.
Metode
Metode yang umum digunakan dalam menentukan kadar Klorida yang terkandung dalam suatu sampel adalah dengan cara Tirasi argentometri cara Mohr.
Prinsip
Klorida dalam suasana netral diendapkan dengan AgNO3, membentuk AgCl . Kelebihan sedikit Ag+ dengan adanya indicator K2CrO4, akan terbentuk endapan merah bata pada titik titrasi.
Cara kerja
Masukkan 100 ml sampel kedalam labu Erlenmeyer. Tambahkan 2 tetes HNO3 pekat dan 3-5 tetes K2CrO4 10%
Tambahkan sedikit demi sedikit serbuk ZnO atau MgO sambil dikocok sampai cairan berwarna kuning kehijauan
Titrasi dengan Larutan AgNO3 1/35 45 N sampai terjadi endapan merah bata Catat banyaknya Larutan AgNO3 1/35 45 N yang digunakan
Hasil pengamatan
Volume titrasi Larutan AgNO3 1/35 45 N = 4.8 ml Factor ketelitian AgNO3 (F) = 1.0217
24
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Perhitungan mg/L klorida = ( AgNO3 − 0.3) . 35.45 = (4.8 − 0.3 ) 1.0217 . 35.45 = 45,8 mg/l ClSetelah dilakukan pengamatan hasil yang dapat untuk kandungan klorida dalam sample air sebesar 45,8 mg/l Cl
-2.2.11 Besi
Adanya besi dalam air akan mengganggu dalam penggunaan air, misalnya jika digunakan untuk mencuci pakaian, maka akan terjadi noda-noda dipermukaan kain dari endapan besi. Metode yang biasa digunakan untuk analisa besi di laboratorium adalah metode AAS dan metode phenantroline-spektrofotometri.
Prinsip pengukuran besi berdasarkan metode phenantroline adalah metode spektrofotometri, yaitu besi di dalam air direduksi dengan hidroksil amin membentuk Fe2+. Selanjutnya ion Ferro tersebut direaksikan dengan phenantroline membentuk senyawa komplek yang berwarna merah. Warna merah tersebut diukur intensitasnya dengan menggunakan spektro pada panjang gelombang 515 nm.
Metode
Metode yang dapat digunakan dalam percobaan penentuan kadar besi dalam suatu sampel air adalah metode Colorimetric – visual.
Prinsip
Fe didalam air terdiri dari Fe2+ dan Fe3+. Fe2+ dioksidasi oleh air brom (Br
2) dalam suasana
asam dan apanas membentuk Fe3+. Dengan penambahan KCNS, Fe3+ akan membentuk senyawa
Fe(CNS)3, yang berwarna merah yang terjadi dibandingkan dengan standar.
Cara kerja
Masukkan 50 ml sampel ke dalam Erlenmeyer Tambahkan 2.5 ml H2SO4 4N dan 3-5 tetes air brom Didihkan sampai bau brom hilang, kemudian dinginkan Setelah dingin, masukkan ke dalam tabung nessler Tambahkan 2.5 ml larutan KCNS 20%, kemudian kocok Warna merah yang terjadi dibandingkan dengan larutan standar
25
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Hasil pengamatan abs blanko = 0.07 abs sample = 0.19
Y = abs sample - abs blanko = 0.19 – 0.07 = 0.12 Perhitungan y = 0,3281 x – 0,0049 0,12 = 0,3281 x – 0,0049 = , , , = 0,3807
Jadi, kandungan besi dalam sampel air sebesar 0,3807 mg/L Fe, setelah dilakukan pengamatan.
2.2.12 Ammonium
Ammonia adalah bahan kimia dengan formula kimia NH3. Yang mempunyai bentuk segi tiga. Titik leburnya ialah -75 °C dan titikdidihnya ialah -33.7 °C. Pada suhu dan tekanan yang tinggi, ammonia adalah gas yang tidak mempunyai warna dan lebih ringan daripada udara. 10% larutan ammonia dalam airmempunyai pH 12.
Ammonia cair terkenal dengan sifat mudah larut. Ia dapat melarutkan logam alkali dengan mudah untuk membentuk larutan yang berwarna dan dapat mengalirkan elektrik dengan baik. Ammonia dapat larut dalam air. Larutan ammonia dengan air mengandung sedikit ammonium hidroksida (NH4OH). Ammonia tidak menyebabkan kebakaran, dan tidak akan terbakar kecuali dicampur dengan oksigen. Nyala ammonia apabila terbakar adalah hijau kekuningan. Dan meletup apabila dicampur dengan udara.
Ammonia dapat digunakan untuk pembersih, pemutih dan mengurangi bau busuk. Larutan pembersih yang dijual kepada konsumen menggunakan larutan ammonia hidroksida cair sebagai pembersih utama. Tetapi, dalam penggunaanya haruslah berhati-hati karena penggunaan untuk jangka waktu yang lama dapat mengganggu pernafasan.
Amonia umumnya bersifat basa (pKb=4.75), namun dapat juga bertindak sebagai asam yang amat lemah (pKa=9.25)
26
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 MetodeMetode yang dapat digunakan dalam pengukuran kadar Ammonium adalah Spektofotometri.
Prinsip
NH4+ dalam suasana basa dengan pereaksi nessler membentuk senyawa komples yang
berwarna kuning sampai coklat. Intensitas warna yang diukur absorbansnya pada panjang gelombang tertentu.
Cara kerja
Pipet 25 ml sampel air
Tambahkan 1-2 tetes pereaksi garam seignette dan 1.0ml pereaksi nessler, kocok dan biarkan selama 10 menit
Warna kuning yang terjadi diukur absorbansinya dengan spektrofotometer pada panjang gelombang maksimum
Hitung konsentrasi sampel dari absorban yang didapat dengan menggunakan kurva kalibrasi
Hasil pengamatan dan Perhitungan % T sampel = 38 % T blanko = 108 Abs sampel Y = 2 – log % T = 2 – log 38 = 0,4202 Abs blanko Y = 2 – log % T = 2 – log 108 = -0,0334
Y = abs sampel – abs blanko = 0.4202 – (-0.0334) = 0.4536
27
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Perhitungan y = 0.1013 x – 0.0012 0.4536 = 0.1013 x – 0.0012 =0,4536 + 0,0012 0,1013 = 4,49Jadi kadar Ammonium yang terkandung dalam sampel air Sungai Cikalimati sebesar 4,49 mg/L NH4+.
2.2.13 Nitrit
Di perairan, Nitrit (NO2) biasanya ditemukan dalam jumlah yang sangat sedikit lebih sedikit
daripada Nitrat, karena tidak stabil dengan keberadaan Oksigen. Nitrit biasanya tidak bertahan lama dan merupakan keadaan sementara proses oksidasi antara ammonia dan Nitrat yang dapat terjadi dalam air sungai, sistem drainase, instalasi air buangan dan sebagainya. Proses nitrifikasi ditunjukkan dalam persamaan reaksi berikut :
N organik + O2 → NH3-N + O2 → NO2-N + O2 → NO3-N
Sumber Nitrit dapat berupa limbah industri dan limbah domestik. Garam-garam Nitrit digunakan sebagai penghambat terjadinya proses korosi pada industri. Pada manusia, keberadaan nitrit dalam jumlah tertentu dapat membahayakan kesehatan karena dapat bereaksi dengan haemoglobin dalam darah, hingga darah tidak dapat mengangkut oksigen lagi. Ikatan Nitrit dengan hemoglobin, disebut Methemoglobin, mengakibatkan hemoglobin tidak mampu mengikat oksigen. Jika jumlah Methemoglobin mencapai > 15% dari total hemoglobin, maka akan terjadi keadaan yang disebut Sianosis, yaitu suatu keadaan dimana seluruh jaringan tubuh manusia kekurangan oksigen. Dengan dosis yang lebih kecil akan dapat membahayakan bayi yang berusia 28 hari karena belum lengkapnya pembentukan dan regenerasi hemoglobin di dalam tubuh mereka. Kebanyakan kasus membuktikan bahwa bayi yang berusia 28 hari langsung mengalami methemoglobinemia setelah minum air formula yang tinggi kadar nitrit. Jika hal ini terjadi pada bayi dikenal dengan nama ”Blue Baby”.
Nitrit juga dapat mengakibatkan penurunan tekanan darah karena efek vasodilatasinya. Gejala klinis yang timbul dapat berupa mual, muntah, sakit perut, sakit kepala, penurunan tekanan darah dan denyut nadi lebih cepat (takikardi), selain itu sianosis dapat muncul dalam jangka waktu beberapa menit sampai 45 menit. Pada kasus yang ringan, gejala hanya tampak di sekitar bibir dan membran mukosa. Adanya sianosis sangat tergantung dari jumlah total hemoglobin dalam darah, saturasi oksigen, pigmentasi kulit dan pencahayaan saat pemeriksaan. Bila mengalami keracunan yang berat, korban dapat tidak sadar seperti, berkurangnya kesadaran (stupor) koma atau kejang sebagai akibat turunnya konsentrasi oksigen dalam darah arteri (hipoksia).
28
Laporan Laboratorium Lingkungan Tahun Ajaran 2011Mula-mula timbul gangguan pelebaran saluran cerna (gastrointestinal) dan sianosis tanpa sebab akan sering dijumpai. Pada kasus yang berat, koma dan kematian dapat terjadi dalam satu jam pertama akibat timbulnya hipoksia dan kegagalan sirkulasi. Akibatnya, terjadi penurunan aliran darah ke sel atau organ sehingga berkurangnya fungsi pemeliharaan organ (iskemia) terutama organ-organ vital.
Metode
Metode yang biasa digunakan dalam mementukan kadar Nitrit dalam air adalah Reaksi Diazotasi-Spetrofotometri.
Prinsip
Prinsip dari percobaan ini yaitu: Nitrit dengan asam sulfanilat dan N-(1-Napthyl Ethylene Diamin)-Dihidroklorida dalam suasana asam (pH 2,0 - 2,5) membentuk senyawa kompleks yang berwarna ungu. Warna ungu yang terbentuk diukur absorbansinya pada panjang gelombang tertentu dengan spektrofotometer.
Percobaan:
Sampel Air Sungai Cikalimati diambil sampelnya untuk diperiksa kadar Nitrit yang terkandung di dalamnya menggunakan metode Spektrofotometri .
25 mL sampel air ditambah 1 mL pereaksi pewarna, Kemudian dikocok, dan didiamkan selama 10 menit.
Karena didapat warna ungu yang cukup pekat dan dikhawatirkan sampel itu tidak akan terbaca oleh spektrofotometer, maka percobaan diulangi dengan pengenceran sampel 50 kali.
Lalu dari hasil pengenceran sampel itu, diambil 25 mL dan ditambahkan 1 mL pereaksi pewarna.
Kemudian dikocok dan didiamkan 10 menit.
Setelah 10 menit, sampel itu diukur % Transmitannya pada panjang gelombang 520 nm. Hasil pengukuran menunjukkan angka %T sebesar 37.
Dilakukan pula pengukuran untuk blanko dengan cara yang sama, didapat nilai %T sebesar 94,4.
Perhitungan : Sampel :
29
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Blanko :%T = 94,4 → Abs = y = 2 – Log 94,4% = 0,025 Jadi, didapat nilai Absorbansi:
Abs = y = Abs Sampel – Abs Blanko = 0,432 – 0,025 = 0,407 Rumus untuk Konsentrasi Nitrit :
y = 0,8238 x – 0,0007 0,407 = 0,8238 x – 0,0007
=0,407 + 0,0007
0,8232 = 0,495
Karena sampel diencerkan sebanyak 50 kali, maka : 0,496 x 50 = 24,75
Jadi, kadar Nitrit yang ada dalam sampel air Sungai Cikalimati tersebut sebesar 24,75 mg/L NO2.
2.2.14 Nitrat
Nitrat dibentuk dari Asam Nitrit yang berasal dari ammonia melalui proses oksidasi katalitik. Nitrat adalah bentuk senyawa yang stabil dan keberadaannya berasaldari buangan pertanian, pupuk, kotoran hewan dan manusia dan sebagainya.
Dosis letal dari Nitrat pada orang dewasa adalah sekitar 4 sampai 30 g (atau sekitar 40 sampai 300 mg NO3-kg). Dosis antara 2 sampai 9 gram NO3- dapat mengakibatkan
methemoglobinemia. Nilai ini setara dengan 33 to 150 mg NO3-/kg. Nitrat yang masuk ke dalam
saluran pencernaan melalui makanan atau air minum, tetapi yang terbanyak adalah melalui air minum. Belum ada laporan yang jelas mengenai efek racun dari Nitrat. Selama ini yang diketahui efek racunnya adalah konversi dari nitrit.
Nitrat pada konsentrasi tinggi dapat menstimulasi pertumbuhan ganggang yang tak terbatas, sehingga air kekurangan oksigen terlarut yang bias menyebabkan kematian ikan. Nitrat yang berlebih dari sisa pemupukan akan mengalir bersama air menuju sungai atau meresap ke dalam air tanah. Nitrat yang berlebih akan terakumulasi di dalam tanah.
Metode
Metode yang umum digunakan dalam penentuan kadar Nitrat adalah metode Brucin-Spektrofotometri.
30
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 PrinsipPrinsip dari metode tersebut yaitu : Nitrat dalam suasana asam dengan Brusin Sulfat dan Asam Sulfanilat membentuk senyawa kompleks yang berwarna kuning. Warna kuning yang terjadi diukur intensitasnya dengan spektrofotometer pada panjang gelombang tertentu.
Tidak dilakukan pengujian Nitrat pada sampel air Sungai Cikalimati. Namun prosedur kerja yang dapat dilakukan dalam pengujian Nitrat adalah sebagai berikut :
Pipet 10 mL contoh air yang telah jernih (contoh air yang keruh harus disaring terlebih dahulu).
Tambahkan 2 mL larutan NaCl, 10 mL larutan H2SO4 4:1, dan 0,5 mL larutan Brusin
Sulfanilat. Setiap penambahan pereaksi harus dikocok.
Panaskan di atas penangas air (95°C) selama 20 menit di ruang asam.
Setelah dingin, tambahkan aquadest hingga volumenya 25 mL dan ukur intensitasnya dengan spectrophotometer pada panjang gelombang maksimum.
2.2.15 Orthophosphat
Dalam kimia, Orthophosphat atau sering disebut gugus phosphate adalah sebuah ion poliatomik atau radikal terdiri dari 1 atom phosphorus dan 4 oksigen. Setiap senyawa phosphate terdapat dalam bentuk terlarut, tersuspensi atau terikat di dalam sel organism dalam air. Di daerah pertanian, Orthophosphat berasal dari bahan pupuk yang masuk ke dalam sungai melalui drainase dan aliran air hujan.
Keberadaan Phosphat dalam air sangat berpengaruh terhadap keseimbangan ekosistem perairan. Bila kadar Phosphat dalam air rendah, seperti alir alam (<0,01 mg P/L), pertumbuhan ganggang akan terhalang. Keadaan ini disebut oligotrop. Sebaliknya bila kadar Phosphat dalam air tinggi, pertumbuhan tanaman dan ganggang tidak terbatas lagi (keadaan eutrop), sehingga dapat mengurangi jumlah oksigen terlarut air. Hal ini tentu sangat berbayaha bagi kelestarian ekosistem perairan.
Metode
Metode yang biasa digunakan dalam menguji kadar Orthophosphat dalam air adalah Stannous Chlorida-Spektrofotometri.
31
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 PrinsipPrinsip dari metode ini adalah sebagai berikut : Orthophosphat dengan Ammonium Molibdat membentuk senyawa kompleks yang berwarna kuning. Dengan penambahan reduktor SnCl2 akan
tereduksi membentuk senyawa kompleks yang berwarna biru. Intensitas warna biru yang terjadi diukur dengan alat spektrofotometer pada panjang gelombang tertentu.
Percobaan:
Sampel Air Sungai Cikalimati diambil sampelnya untuk diperiksa kadar Orthophosphat yang terkandung di dalamnya menggunakan metode Spektrofotometri .
Air sampel dipipet sebanyak 25 mL.
Ditambahkan 1 mL larutan Ammonium Molibdate, dan 0,15 mL SnCl2 (3 tetes).
Lalu dikocok dan dibiarkan selama 10 menit.
Karena didapat warna biru yang cukup pekat dan dikhawatirkan sampel itu tidak akan terbaca oleh spektrofotometer, maka percobaan diulangi dengan pengenceran sampel 10 kali.
Lalu dari hasil pengenceran sampel itu, diambil 25 mL dan ditambahkan 1 mL larutan Ammonium Molibdate dan 3 tetes SnCl2.
Dikocok, lalu didiamkan 10 menit.
Setelah 10 menit, sampel itu diukur absorbansinya menggunakan spektrofotometer dengan panjang gelombang 660 nm.
Hasil pengukuran menunjukkan angka Abs sebesar 0,35.
Dilakukan pula pengukuran untuk blanko dengan cara yang sama, didapat nilai %T sebesar 0,26. Perhitungan : Sampel : Abs = 0,35 Blanko : Abs = 0,26
Jadi, didapat nilai Absorbansi:
Abs = y = Abs Sampel – Abs Blanko = 0,35 – 0,26 = 0,09 Rumus untuk Konsentrasi Orthophosphat :
y = 0,0818 x + 0,0006 0,09 = 0,0818 x + 0,0006
=0,09 − 0,0006
32
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Karena sampel diencerkan sebanyak 10 kali, maka :1,093 x 10 = 10,93
Jadi, kadar Orthophosphat yang ada dalam sampel air Sungai Cikalimati tersebut sebesar 10,93 mg/L PO43-.
2.2.16 Percobaan Koagulasi
Koagulasi adalah proses penggumpalan partikel koloid karena penambahan bahan kimia sehingga partikel-partikel tersebut bersifat netral dan membentuk endapan karena adanya gaya gravitasi. Secara garis besar, mekanisme koagulasi adalah destabilisasi muatan negatif partikel oleh muatan positif dari koagulan, tumbukan antar partikel, dan adsorpsi.
Faktor-faktor yang mempengaruhi koagulasi diantaranya pemilihan bahan kimia, penentuan dosis optimum koagulan, dan penentuan pH optimum. Apabila muatan koloid dihilangkan, maka kestabilan koloid akan berkurang dan dapat menyebabkan koagulasi atau penggumpalan. Penghilangan muatan koloid dapat terjadi pada sel elektroforesis atau jika elektrolit ditambahkan ke dalam sistem koloid. Apabila arus listrik dialirkan cukup lama ke dalam sel elektrolisis maka partikel koloid akan digumpalkan ketika mencapai electrode. Jadi, koloid yang bermuatan negatif akan digumpalkan di anode, sedangkan koloid yang bermuatan positif digumpalkan di katode.
Koagulan yang paling banyak digunakan dalam praktek di lapangan adalah Alumunium Sulfat [Al2(SO4)3], karena mudah diperoleh dan harganya relatif lebih murah dibandingkan dengan
jenis koagulan yang lain.
Metode
Metode yang umum digunakan dalam percobaan koagulasi adalah Jar-Test.
Prinsip
Kekeruhan dalam air disebabkan oleh zat-zat tersuspensi dalam bentuk lumpur kasar, lumpur halus dan koloid. Pada permukaan koloid bermuatan listrik sehingga koloid dalam keadaan stabil, akibatnya koloid sulit untuk mengendap. Senyawa koagulan (seperti Tawas Alumunium) berkemampuan mendestabilisasikan koloid (menetralkan muatan listrik pada permukaan koloid) sehingga koloid dapat bergabung satu sama lainnya membentuk flok dengan ukuran yang lebih besar sehingga mudah mengendap. Tujuan dari percobaan Jartest adalah untuk menentukan dosis koagulan yang optimum dalam pengolahan air.
33
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 ReaksiReaksi yang terjadi dalam Percobaan Koagulasi yaitu : Al2 (SO4)3 + 6H2O → 2Al (OH)3 + 3H2SO4
Tidak dilakukan Percobaan Koagulasi terhadap sampel air Sungai Cikalimati. Namun prosedur kerja yang dapat dilakukan dalam Percobaan Koagulasi adalah sebagai berikut :
Siapkan 6 buah gelas kimia ukuran 500 mL. Isi masing-masing gelas dengan 500 mL contoh air.
Tambahkan larutan tawas Alumunium (1 mL = 10 mg) secara bertingkat mulai dari 1,0 mL; 1,5 mL; 2,0 mL; … dst. Kemudian simpan dalam alat Jartest.
Kocok dengan kecepatan 100 RPM selama 1 menit dan 60 RPM selama 10 menit.
Setelah selesai, biarkan flok mengendap. Amati bentuk flok, kecepatan mengendap flok, volume flok yang terbentuk, dan waktu yang dibutuhkan untuk mengendapkan flok.
Periksa kekeruhan dan pH terhadap supernatannya. Jika hasil percobaan tidak memuaskan, dapat diulangi dengan penambahan dosis koagulan yang lebih tinggi atau lebih rendah.
2.2.17 Pengukuran Sisa Klor Metode
Metode yang bisa digunakan dalam Pengukuran Sisa Klor yaitu secara colorimetric menggunakan alat komparator.
Prinsip
Klor dalam air dengan Orthotolidin akan membentuk senyawa kompleks yang berwarna kuning. Warna kuning yang terjadi dibandingkan dengan warna standar.
Tidak dilakukan Pengukuran Sisa Klor terhadap sampel air Sungai Cikalimati. Namun prosedur kerja yang dapat dilakukan dalam Pengukuran Sisa Klor adalah sebagai berikut :
Masukkan 10 mL contoh air ke dalam tabung Komparator dan 10 mL aquadest ke dalam tabung yang lainnya (untuk blanko).
Tambahkan ke dalam masing-masing tabung 20 tetes (1 mL) larutan O-tolidin, kocok. Masukkan ke dalam alat komparator.
Untuk blanko, masukkan ke dalam tempat yang di belakangnya terdapat warna kuning dari standar, dan untuk sampel simpan pada tempat yang belakangnya tidak berwarna.
34
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Bandingkan, dan ukur konsentrasi sisa klor berdasarkan perbandingan tersebut.
Pengukuran sisa klor harus secepat mungkin dianalisa dan pada umumnya dilakukan di tempat pengambilan contoh (lapangan), karena gas klor tersebut mudah menguap. Selain dengan Orthotolidin juga dapat digunakan dengan metode yang lainnya, seperti titrasi iodometri, atau dengan indicator DPD (N,N Diethyl-p-phenylenediamine).
2.2.18 Daya Pengikat Klor Metode
Metode yang dapat digunakan dalam percobaan Daya Pengikat Klor sama dengan pada percobaan Pengukuran Sisa Klor, yaitu metode Colorimetri dengan Orthotolidin menggunakan alat Komparator.
Prinsip
Dalam pengolahan air diperlukan pembubuhan senyawa desinfektan seperti kaporit. Untuk menentukan dosis desinfektan yang harus dibubuhkan, perlu dilakukan percobaan Daya Pengikat Klor. DPC adalah banyak senyawa klor (Cl2) yang dibutuhkan oleh air untuk proses desinfeksi
(membunuh bakteri). Daya Pengikat Klor ditentukan dengan cara selisih antara klor yang dibubuhkan dengan sisa klor setelah kontak selama 30 menit.
Tidak dilakukan percobaan Daya Pengikat Klor terhadap sampel air Sungai Cikalimati. Namun prosedur kerja yang dapat dilakukan dalam percobaan Daya Pengikat Klor adalah sebagai berikut :
Siapkan 3 buah labu Erlenmeyer.
Isi masing-masing labu dengan 50 mL contoh air yang telah memenuhi persyaratan secara fisik dan kimia.
Tambahkan 0,10 mL; 0,15 mL; dan 0,20 mL larutan kaporit (1 mL = 1 mg) ke dalam labu tersebut.
Kocok dan simpan di dalam ruang gelap selama 30 menit.
Tentukan sisa klornya dari setiap labu Erlenmeyer dengan cara seperti pemeriksaan pada sisa klor.
Catat sisa klornya dari masing-masing labu Erlenmeyer.
Berikut adalah rumus yang dapat digunakan dalam perhitungan Daya Pengikat Klor :
= 1000
35
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 2.2.19 Oksigen Terlarut (Dissolved Oxygen-DO)DO sering juga disebut dengan kebutuhan oksigen (Oxygen demand), merupakan salah satu parameter penting dalam analisis kualitas air. Nilai DO yang biasa diukur dalam bentuk konsentrasi menunjukkan jumlah oksigen (O2) yang tersedia dalam suatu badan air. Semakin
besar nilai DO pada air, mengindikasikan air tersebut memiliki kualitas yang bagus. Sebaliknya jika nilai DO rendah, dapat diketahui bahwa air tersebut telah tercemar. Pengukuran DO juga bertujuan melihat sejauh mana badan air mampu menampung biota air seperti ikan dan mikroorganisme. Selain itu kemampuan air untuk membersihkan pencemaran juga ditentukan oleh banyaknya oksigen dalam air. Oleh sebab pengukuran parameter ini sangat dianjurkan di samping parameter lain.
Di dalam air, oksigen memainkan peranan dalam menguraikan komponen-komponen kimia menjadi komponen yang lebih sederhana. Oksigen memiliki kemampuan untuk beroksidasi dengan zat pencemar seperti komponen organik sehingga zat pencemar tersebut tidak membahayakan. Oksigen juga diperlukan oleh mikroorganisme, baik yang bersifat aerob serta anaerob, dalam proses metabolisme. Dengan adanya oksigen dalam air, mikroorganisme semakin giat menguraikan kandungan zat pencemar dalam air. Reaksi yang terjadi dalam penguraian tersebut adalah :
Komponen Organik + O + nutrien ⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯ CO +H O + Sel baru + nutrien + energi
Jika reaksi penguraian komponen kimia dalam air terus berlaku, maka kadar oksigen pun akan menurun. Pada klimaksnya, oksigen yang tersedia tidak cukup menguraikan komponen kimia tersebut. Keadaan yang demikian merupakan pencemaran berat pada air.
Metode
Untuk mengukur kadar DO dalam air, ada 2 metode yang sering dilakukan yaitu metode titrasi dan metode elektrokimia (dengan DO-meter).
Prinsip
Prinsip percobaan dengan metode titrasi adalah sebagai berikut : Oksigen akan mengoksidasi Mn2+ dalam suasana basa membentuk endapan MnO
2. Dengan penambahan alkali
iodide dalam suasana asam akan membebaskan iodium. Banyaknya iodium yang dibebaskan ekuivalen dengan banyaknya oksigen terlarut. Iodium yang dibebaskan, dianalisa dengan metode titrasi iodimetri dengan larutan standar Thiosulfat dari indikator larutan kanji.
36
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 ReaksiReaksi yang terjadi dalam percobaan ini diantaranya : Mn 2+ + 2OH - + ½ O
2 → MnO2 + H2O
MnO2 + 2I - + 4H+ → Mn 2+ + I2 + H2O
I2 + 2S2O3 2- → S4O6 2- + 2I –
Percobaan
Sampel Air Sungai Cikalimati diambil sampelnya untuk diperiksa kadar DO yang terkandung di dalamnya menggunakan metode titrasi Iodimetri.
Isi botol BOD dengan contoh air sampai penuh, kemudian tutup. Usahakan jangan sampai ada gelembung udara sedikitpun.
Masukkan 1 mL MnSO4 dan 1 mL larutan alkali Iodida (perekasi Oksigen). Pemasukan
reagen menggunakan pipet 1 mL, ujung pipet harus mencapai larutan dasar botol. Tutup kembali. Tujuan ditambahkannya MnSO4 adalah untuk mengikat oksigen, sehingga
terbentuk MnO2 (endapan coklat).
Kemudian aduk dengan cara membolak-balikkan botol sampai larutan homogen.
Diamkan selama 10 menit sampai kelihatan ada endapan coklat pada dasar botol. (Jika endapan putih berarti tidak ada O2)
Tuangkan sebagian isi botol ke dalam labu Erlenmeyer, tambahkan 1 mL Asam Sulfat pekat dan 20 mL larutan kanji hingga timbul warna ungu. Titrasi secepatnya dengan larutan Thiosulfat 1/80 N sampai warna ungu hilang. Diperoleh volume titran sebanyak 2,4 mL. Untuk larutan yang masih tersisa di dalam botol BOD, tambahkan 1 mL Asam Sulfat pekat,
tutup, dan kocok. Larutan akan berwarna kuning coklat. Titrasi cepat dengan larutan Thiosulfat 1/80 N hingga warnanya menjadi kuning muda. Tambahkan indikator amilum/kanji hingga larutan menjadi biru. Lanjutkan titrasi sampai warna biru tersebut hilang. Diperoleh voume titran sebanyak 11,9 mL.
Jadi volume larutan Thiosulfat yang terpakai adalah 2,4 + 11,9 = 14,3 mL
Perhitungan = × × 1000 × − 2 = 14,3 × 1 80 × 1000 × 8 300 − 2 = 47,99
37
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 2.2.22 Biochemical Oxygen Demand (BOD)BOD adalah banyaknya oksigen yang dibutuhkan oleh bakteri selama penguraian senyawa organik pada kondisi aerobik. Dalam hal ini dapat diinterpretasikan bahwa senyawa organik merupakan makanan bagi bakteri. Parameter BOD digunakan untuk menentukan tingkat pencemar oleh senyawa organik yang dapat diuraikan oleh bakteri. Percobaan BOD adalah peruji hayati (bioassay).
Metode
Metode yang dapat digunakan dalam pengukuran BOD antara lain dengan Metode Titrasi Permanganat, Winkler, dan Titrasi Iodometri.
Prinsip
Prinsip dalam pengukuran BOD yaitu :
Pengukuran BOD terdiri dari pengenceran sampel, inkubasi selama 5 hari pada suhu 20°C dan pengukuran oksigen terlarut sebelum dan sesudah inkubasi. Penurunan oksigen terlarut selama inkubasi menunjukkan banyaknya oksigen yang dibutuhkan oleh sampel air. Oksigen terlarut dianalisa dengan menggunakan metode Winkler.
Percobaan
a. Menentukan Angka Pengenceran
Dilakukan pengenceran terhadap sampel air Sungai Cikalimati dengan beberapa angka pengenceran, diantaranya pengenceran 7x, 4x, dan 3x.
7 ×=700 100 (100 + 600 ) 4 ×=700 175 (175 + 525 ) 3 ×=700 233 (233 + 467 )
Setelah mengetahui angka pengenceran dari sampel air tersebut, maka dilakukan pengenceran sampel air dengan air pengencer yang telah dibuat. Banyaknya air pengencer tersebut disesuaikan dengan hasil prehitungan di atas. Setelah diencerkan, masukkan masing-masing angka pengenceran ke dalam 2 buah botol BOD yang telah dikalibrasi volumenya. Simpan salah satu botol BOD dari masing-masing angka pengenceran tersebut dalam incubator 20°C selama 5 hari (untuk kemudian diperiksa oksigen terlarutnya setelah 5 hari), sedangkan botol BOD yang lainnya langsung diperiksa kandungan oksigen terlarutnya dengan metode titrasi Winkler.
38
Laporan Laboratorium Lingkungan Tahun Ajaran 2011Untuk percobaan BOD ini diperlukan 8 buah botol BOD, yakni 2 botol untuk Blanko ; 2 botol untuk sampel dengan Pengenceran 7x ; 2 botol untuk sampel dengan Pengenceran 4x ; dan 2 botol lagi untuk sampel dengan Pengenceran 3x, dan masing-masing akan diukur DO0 dan DO5.
b. Kalibrasi Botol BOD
Masing-masing botol BOD yang digunakan harus dikalibrasi terlebih dahulu, yaitu dengan cara mengisi botol dengan air hingga penuh, kemudian pindahkan semua air pengisi tersebut ke dalam gelas ukur. Maka diperoleh nilai volume untuk masing-masing botol BOD, antara lain : Botol Blanko : DO0 = 340 mL DO5 = 320 mL
Botol Sampel P7x : DO0 = 310 mL DO5 = 310 mL
Botol Sampel P4x : DO0 = 310 mL DO5 = 310 mL
Botol Sampel P3x : DO0 = 310 mL DO5 = 350 mL
c. Pemeriksaan Oksigen Terlarut
Prosedur untuk pemeriksaan oksigen terlarut dengan metode titrasi Winkler telah dibahas pada materi Pengukuran Dissolved Oxygen (DO). Didapat hasil pengamatan volume titran (Thiosulfat) sebagai berikut :
DO0 DO5 Blanko 24,9 mL 7,8 mL Pengenceran 7x 24,6 mL 6,4 mL Pengenceran 4x 25,6 mL 7,5 mL Pengenceran 3x 24,2 mL 7,0 mL Perhitungan
Pengukuran DO0 untuk Blanko :
= × × 1000 ×
− 2 =
24,9 × 1 80 × 1000 × 8
340 − 2 = 7,37
Pengukuran DO5 untuk Blanko :
= × × 1000 ×
− 2 =
7,8 × 1 80 × 1000 × 8
320 − 2 = 2,45
Pengukuran DO0 untuk sampel dengan Pengenceran 7x :
= × × 1000 ×
− 2 =
24,6 × 1 80 × 1000 × 8
39
Laporan Laboratorium Lingkungan Tahun Ajaran 2011 Pengukuran DO5 untuk sampel dengan Pengenceran 7x := × × 1000 ×
− 2 =
6,4 × 1 80 × 1000 × 8
310 − 2 = 2,08
BOD, 5 hari, 20°C untuk sampel dengan Pengenceran 7x adalah: = [( 1 − 2) − ( 1 − 2) ] × Dimana, D1 = DO 0 hari sampel (mg/L)
D2 = DO 5 hari sampel (mg/L) B1 = DO 0 hari blanko (mg/L) B2 = DO 5 hari blanko (mg/L) P = Angka Pengenceran
f = Koreksi untuk seeding =
= = 0,91
maka,
= [(7,99 − 2,08) − (7,37 − 2,45)0,91] × 7 = 10,03
Jadi, BOD5 untuk sampel yang diencerkan sebanyak 7x adalah sebesar 10,03 mg BOD5/L.
Pengukuran DO0 untuk sampel dengan Pengenceran 4x :
= × × 1000 ×
− 2 =
25,6 × 1 80 × 1000 × 8
310 − 2 = 8,31
Pengukuran DO5 untuk sampel dengan Pengenceran 4x :
= × × 1000 ×
− 2 =
7,5 × 1 80 × 1000 × 8
310 − 2 = 2,44
BOD, 5 hari, 20°C untuk sampel dengan Pengenceran 4x adalah:
f = = = 0,8
maka,
= [(8,31 − 2,44) − (7,37 − 2,45)0,8] × 4 = 7,74
Jadi, BOD5 untuk sampel yang diencerkan sebanyak 4x adalah sebesar 7,74 mg BOD5/L.
Pengukuran DO0 untuk sampel dengan Pengenceran 3x :
= × × 1000 ×
− 2 =
24,2 × 1 80 × 1000 × 8