LAPORAN PRAKTIKUM LABORATORIUM TEKNIK KIMIA 1
ABSORBSI
Dosen Pembimbing: Ayu Ratna Permatasari, ST,MT
Kelompok / Kelas : 6 / 2A
Nama : 1. Muhammad Naufal. S 141411019 2. Oktavia Reni 141411022 3. Suhermina 141411029
Tanggal Praktikum : 03 Desember 2015 Tanggal Pengumpulan Laporan : 10 Desember 2015
PROGRAM STUDI DIPLOMA III TEKNIK KIMIA
JURUSAN TEKNIK KIMIA
POLITEKNIK NEGERI BANDUNG
TAHUN 2015
BAB I PENDAHULUAN
I.1 Latar Belakang
Dalam suatu proses kimia yang diterapkan pada industri pada umumnya tidak melibatkan satu jenis bahan kimia saja yang terlibat, tetapi berbagai bahan kimia dengan komposisi senyawa yang bermacam macam didalamnya. Dan juga wujud dari bahan yang digunakan tersebut dapat berupa padatan, gas, juga cairan selama proses berlangsung. Oleh karena itu, reaksi kimia dalam suatu industri dapat terjadi dalam faseganda atau heterogen, misalnya biner atau bahkan tersier. Absorpsi gas-cair merupakan proses heterogen yang melibatkan perpindahan komponen gas yang dapat larut menuju penyerap yang biasanya berupa cairan yang tidak mudah menguap.
Absorpsi adalah proses pemisahan bahan dari suatu campuran gas dengan cara pengikatan bahan tersebut pada permukaan pelarut cair yang diikuti dengan pelarutan. Kelarutan gas yang akan diserap dapat disebabkan hanya oleh gaya-gaya fisik (pada absorpsi fisik) atau selain gaya tersebut juga oleh ikatan kimia (pada absorpsi kimia). Komponen gas yang dapat mengadakan ikatan kimia akan dilarutkan lebih dahulu dan juga dengan kecepatan yang lebih tinggi.
Proses absorpsi ini banyak digunakan di industri untuk meningkatkan nilai guna dari suatu zat dengan cara merubah fasenya, sebagai pemisah komponen zat kimia yang dianggap merugikan atau menguntungkan, dan sebagai penunjang dari suatu proses lainnya.
I.2 Tujuan Percobaan
Memahami proses absorpsi dan prinsip kerjanya. Menghitung laju kecepatan absorpsi CO2 ke dalam air. Menghitung jumlah CO2 bebas dalam air.
BAB II
LANDASAN TEORI
2.1 PengertianAbsorpsi adalah proses penyerapan suatu zat oleh zat lain. Dalam proses ini, zat yang diserap masuk ke bagian dalam zat penyerap. Misalnya peristiwa pelarutan (gas ke dalam zat cair atau zat padat), difusi (zat cair ke dalam zat padat), warna yang diserap oleh suatu benda (warna absorpsi), penyerapan sinar bias oleh suatu zat pada peristiwa bias kembar (absorpsi selektif) dan penyerapan energy oleh electron di dalam satuan atom (spectrum absorpsi). Sedangkan pengertian absorpsimetri adalah metode analisis untuk menentukan komposisi suatu zat dengan mengukur cahaya yang diserap bahan itu. Misalnya, dengan mengetahui frekuensi warna cahaya yang diserap, dapat ditentukan jenis zat penyerap.
Penyerap tertentu akan menyerap setiap satu atau lebih komponen gas. Pada absorbsi sendiri ada dua macam proses yaitu :
a. Absorbsi fisik
Absorbsi fisik merupakan absorbsi dimana gas terlarut dalam cairan penyerap tidak disertai dengan reaksi kimia. Contoh absorbsi ini adalah absorbsi gas H2S dengan air, metanol, propilen, dan karbonat. Penyerapan terjadi karena adanya interaksi fisik, difusi gas ke dalam air, atau pelarutan gas ke fase cair. Dari asborbsi fisik ini ada beberapa teori untuk menyatakan model mekanismenya, yaitu :
1. teori model film 2. teori penetrasi
3. teori permukaan yang diperbaharui b. Absorbsi kimia
Absorbsi kimia merupakan absorbsi dimana gas terlarut didalam larutan penyerap disertai dengan adanya reaksi kimia. Contoh absorbsi ini adalah absorbsi dengan adanya larutan MEA, NaOH, K2CO3, dan sebagainya. Aplikasi dari absorbsi kimia dapat dijumpai pada proses penyerapan gas CO2 pada pabrik amoniak. Penggunaan absorbsi kimia pada fase
kering sering digunakan untuk mengeluarkan zat terlarut secara lebih sempurna dari campuran gasnya. Keuntungan absorbsi kimia adalah meningkatnya koefisien perpindahan massa gas, sebagian dari perubahan ini disebabkan makin besarnya luas efektif permukaan. Absorbsi kimia dapat juga berlangsung di daerah yang hampir stagnan disamping penangkapan dinamik (zehnjung,2015).
Dalam skala laboratorium, peralatan kolom absorpsi gas biasanya sudah dilengkapi dengan peralatan analisa sampel gas maupun analisa cairan (titrasi). Perangkat peralatan analisa gas berisi larutan NaOH yang reaksinya dengan CO2.
CO2+ 2 NaOH Na2CO3 + H2O
Jumlah CO2 yang terserap sebanding dengan pertambahan volume larutan dalam peralatan analisa tersebut. Dalam industri, proses ini banyak digunakan antara lain dalam proses pengambilan amonia yang ada dalam gas kota yang berasal dari pembakaran batubara dengan menggunakan air. Atau penghilangan gas H2S yang dikandung dalam gas alam dengan menggunakan larutan alkali.
Beberapa hal yang mempengaruhi absorbsi gas ke dalam cairan : 1. Temperature operasi
2. Tekanan operasi
3. Konsentrasi komponen didalam cairan 4. Konsentrasi komponen didalam aliran gas 5. Luas bidang kontak
6. Lama waktu kontak
7. Laju alir gas. Semakin besar laju alir gas, penyerapan semakin buruk. Neraca massa total dalam kolom absorber dapat ditulis sebagai berikut:
G (Yn+1 – Y1) = L (Xn –X0)
Keterangan :
G = laju alir udara bebas CO2
Y1 = rasio laju alir CO2 terhadap udara pada aliran gas keluar
Yn+1 = rasio laju alir CO2 terhadapudara pada aliran gas masuk
L = laju alir air bebas CO2
X0 = rasio laju alir CO2 terhadap udara pada aliran air masuk
Xn = rasio laju alir CO2 terhadap udara pada aliran air keluar
y1 =
(y 1− y 0)(F 2−F 3)(1− y 0) analisa karbon yang larut dalam airy1=
(F 2+F 3)F 2Jika M adalah konsentrasi penitran, Vs adalah volume sampel yang digunakan untuk titrasi, maka penentuan jumlah CO2 bebas (CCo2) pada suatu tangki dengan volume (Vt volume penitran) adalah:
C
co2=
M .Vt Vs
2.2 Jenis Menara Absorpsi
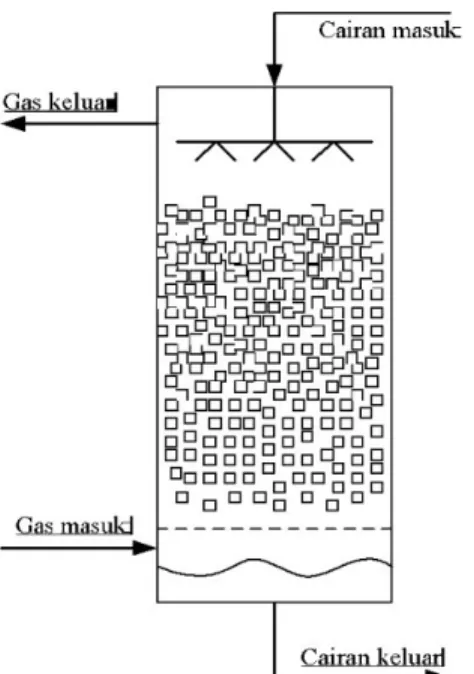
Menara Absorpsi yang digunakan adalah Menara Absorpsi dengan Benda Isi (Packing Column).Menara jenis ini terdiri dari kolom dengan pengisian khusus, yang digunanya untuk memperbesar permukaan kontak dengan jala penyebaran zat cair dan penyebaran gas. Pada zaman dahulu bahan isian yang sering digunakan adalah kokas, pecahan batu, dsb, sedangkan sekarang sering digunakan dari bahan tanah liat, porselen polimer, kaca, logam, dll.
Zat cair disemprotkan dari atas dan mengalir ke bawah sepanjang bahan isian, sedangkan gas yang akan dibersihkan dimasukkan dari dasar kolom dan menyapu sepanjang kolom isian dengan aliran berlawanan arah. Isian biasanya digunakan berbentuk teratur/seragam. Bahan isian biasanya dipasang menggantung diatas dasar kolom untuk memperoleh pembagian gas yang sempurna dan menjaga supaya bagian pengisisan yang paling bawah tidak berada di bawah zat cair absorpsi. Pada kolom yang tinggi, bagian isian dipasang dalam paket-paket dengan memberikan jarak antar paket agar aliran zat cair dan gas dapat terbagi kembali. Dengan cara seperti ini kerugian adanya aliran yang menempel dinding “efek dinding” dalam kolom biasanya dipasang suatu alat penahan ricikan, yaitu alat untuk mencegah tetesan air terseret oleh aliran gas.
Gambar 2.2 Menara absorpsi packing
(sumber : http://dokumen.tips/documents/101-absorpsi.html) 2.3 Kolom Absorpsi
Adalah suatu kolom atau tabung tempat terjadinya proses pengabsorpsi (penyerapan/penggumpalan) dari zat yang dilewatkan di kolom/tabung tersebut. Proses ini dilakukan dengan melewatkan zat yang terkontaminasi oleh komponen lain dan zat tersebut dilewatkan ke kolom ini dimana terdapat fase cair dari komponen tersebut.
Gambar 2.3.1 kolom absorpsi Gambar 2.3.1 kolom absorpsi skala pilot plant
(sumber : laporan praktikum laboratorium teknik kimia kelompok 3)
Absorben adalah cairan yang dapat melarutkan bahan yang akan diabsorpsi pada
permukaannya, baik secara fisik maupun secara reaksi kimia.Absorben sering juga disebut
sebagai cairan pencuci. Persyaratan absorben :
1. Memiliki daya melarutkan bahan yang akan diabsorpsi sebesar mungkin (kebutuhan akan cairan lebih sedikit, volume alat lebih kecil).
2. Selektif
3. Memiliki tekanan uap yang rendah 4. Tidak korosif.
5. Mempunyai viskositas yang rendah 6. Stabil secara termis.
7. Murah
Jenis-jenis bahan yang dapat digunakan sebagai absorben adalah air (untuk gas-gas yang dapat larut, atau untuk pemisahan partikel debu dan tetesan cairan), natrium hidroksida (untuk gas-gas yang dapat bereaksi seperti asam) dan asam sulfat (untuk gas-gas yang dapat bereaksi seperti basa).
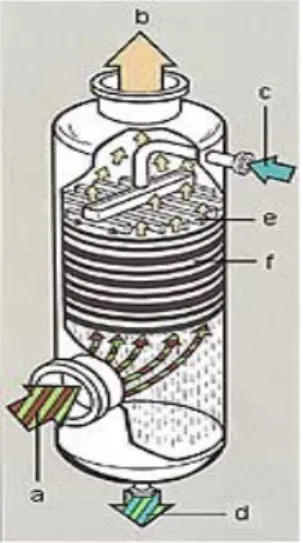
Gambar 2.3.3 Stuktur absorber
Bagian atas : Spray untuk megubah gas input menjadi fase cair. Bagian tengah : Packed tower untuk memperluas permukaan sentuh sehingga mudah untuk diabsorbsi
Bagian bawah : Input gas sebagai tempat masuknya gas ke dalam reaktor.
Keterangan :
(a) input gas (b) gas keluaran (c) pelarut (d) hasil absorbsi (e) disperser (f) packed column
Di industri absorpsi mempunyai fungsi untuk meningkatkan nilai guna dari suatu zat dengan cara merubah fasanya. Contohnya adalah Formalin yang berfase cair berasal dari formaldehid yang berfase gas dapat dihasilkan melalui proses absorpsi.
BAB III
METODOLOGI PERCOBAAN
3.1 Alat dan BahanTabel 3.1.1 Alat
No Alat Spesifikasi Jumlah
1 2 3 4 5 6
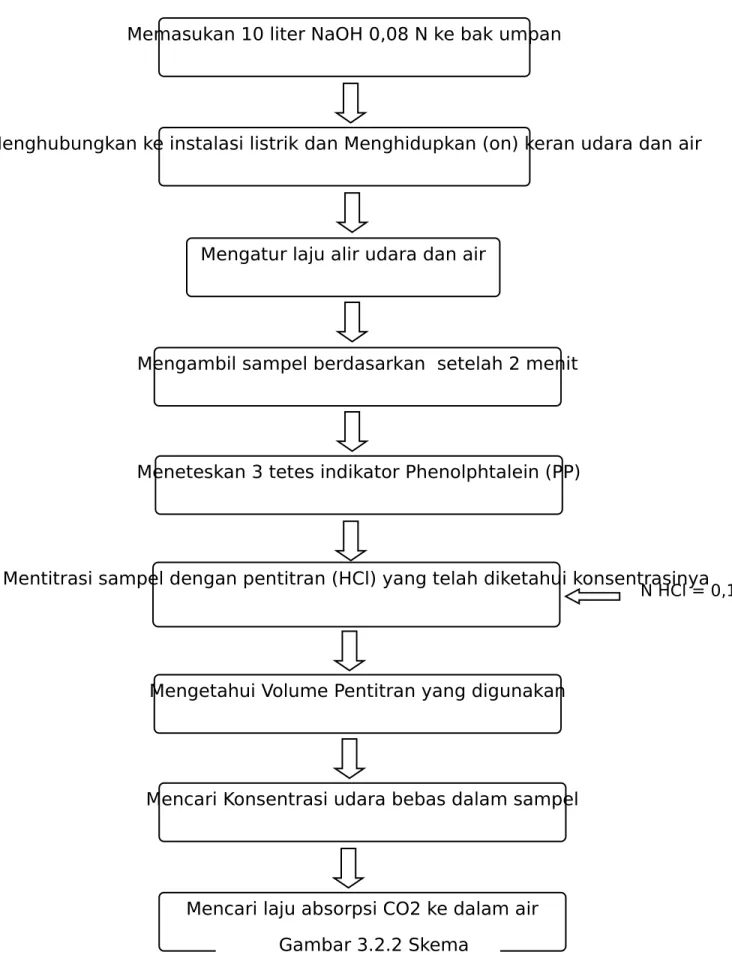
Seperangkat alat absorpsi Stop watch Botol Semprot Pipet Ukur Pipet tetes Buret 10 ml 50 ml 1 1 1 2 2 1 7 Ember 2 8 Baker glass 200 ml 1 Tabel 3.1.2 Bahan No Bahan Spesifikasi 1 2 3 4 5 Aquadest Udara Larutan NaOH Larutan HCl Phenolptalein 0,08 N 0,1 N 3.2 Prosedur Kerja
N HCl = 0,1 N
Menghubungkan ke instalasi listrik dan Menghidupkan (on) keran udara dan air
Mengatur laju alir udara dan air
Mengambil sampel berdasarkan setelah 2 menit
Meneteskan 3 tetes indikator Phenolphtalein (PP)
Mentitrasi sampel dengan pentitran (HCl) yang telah diketahui konsentrasinya
Mengetahui Volume Pentitran yang digunakan
Mencari Konsentrasi udara bebas dalam sampel
Mencari laju absorpsi CO2 ke dalam air Memasukan 10 liter NaOH 0,08 N ke bak umpan Skema Kerja
BAB IV
Gambar 3.2.2 SkemaHASIL DAN PEMBAHASAN
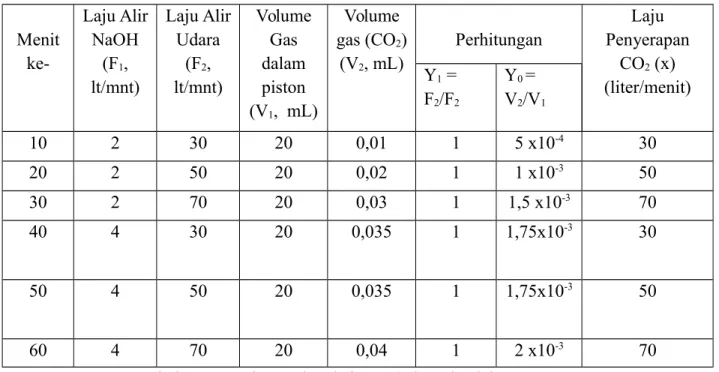
4.1 Hasil Menit ke-Laju Alir NaOH (F1, lt/mnt) Laju Alir Udara (F2, lt/mnt) Volume Gas dalam piston (V1, mL) Volume gas (CO2) (V2, mL) Perhitungan Laju Penyerapan CO2 (x) (liter/menit) Y1 = F2/F2 Y0 = V2/V1 10 2 30 20 0,01 1 5 x10-4 30 20 2 50 20 0,02 1 1 x10-3 50 30 2 70 20 0,03 1 1,5 x10-3 70 40 4 30 20 0,035 1 1,75x10-3 30 50 4 50 20 0,035 1 1,75x10-3 50 60 4 70 20 0,04 1 2 x10-3 70Tabel 4.1 Percobaan Absorbsi CO2 (udara) ke dalam NaOH
Catatan: pada praktikum, praktikan tidak menggunakan CO2 dalam tabung hanya menggunakan
CO2 dari udara. Sehingga tidak terdapat laju alir CO2.
4.2 Titrasi Asam-Basa
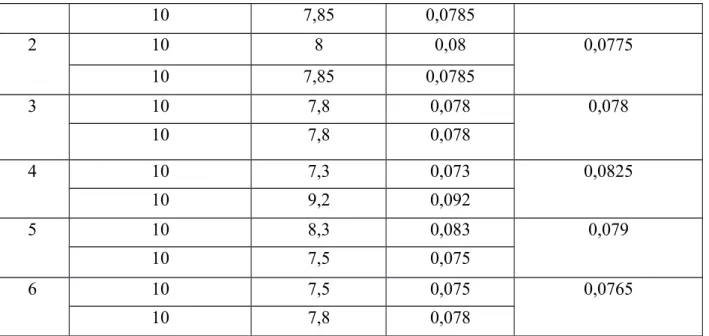
Tabel 4.2 Titrasi Asam Basa Sample Volume NaOH (mL) Volume HCl
0,1N (mL) Konsentrasi CO2 (M) Konsentrasi CO2 rata-rata (M) 1 10 8 0,08 0,0775
10 7,85 0,0785 2 10 8 0,08 0,0775 10 7,85 0,0785 3 10 7,8 0,078 0,078 10 7,8 0,078 4 10 7,3 0,073 0,0825 10 9,2 0,092 5 10 8,3 0,083 0,079 10 7,5 0,075 6 10 7,5 0,075 0,0765 10 7,8 0,078
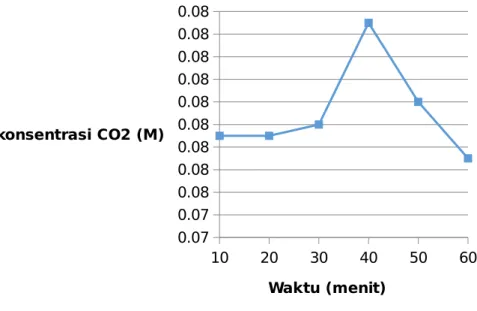
Pada kurva dibawah ini dibuat dari data yang diperoleh namun terdapat data yang tidak sesuai yang ditandai dengan lingkaran berwarna merah sehingga data tersebut dihilangkan.
10 20 30 40 50 60 0.07 0.07 0.08 0.08 0.08 0.08 0.08 0.08 0.08 0.08 0.08 Waktu (menit) konsentrasi CO2 (M)
Kurva dibawah ini adalah kurva setelah data yang tidak sesuai dihilangkan terlihat konsentrasi CO2 yang terbentuk sebanding dengan waktu.
Gambar 4. 2 Kurva Konsentrasi Vs Waktu
10 20 30 40 0.08 0.08 0.08 0.08 0.08 0.08 0.08 0.08 0.08 Waktu (menit) konsentrasi CO2 (M) 4.3 Pembahasan
Absorbsi merupakan salah satu operasi pemisahan dalam industri kimia dimana suatu campuran gas dikontakkan dengan suatu cairan penyerap yang sesuai, sehingga satu atau lebih komponen dalam campuran gas larut dalam cairan penyerap. Tujuan dilakukannya percobaan absorpsi ini adalah untuk mengetahui berapa gas CO2 yang dapat terabsorbsi oleh NaOH. Asumsi yang digunakan pada percobaan ini adalah gas CO2 dan udara merupakan gas ideal. Percobaan ini dilakukan dengan memvariasikan laju alir udara dan laju alir NaOH maka akan di dapat konsentrasi CO2 dalam larutan NaOH.
Absorbsi yang dilakukan menggunakan larutan NaOH 0,1 N sebagai solvent yang dialirkan kedalam kolom packing dengan spray dan CO2 sebagai solute. Namun dalam praktikum praktikan hanya menggunakan gas CO2 dari udara dikarenakan ketidaktersediaan gas CO2. Untuk penggunakan kolom packing bertujuan agar memperluas permukaan bidang kontak antara NaOH dengan CO2. Sehingga didaptkan proses absorbsi yang optimal. NaOH mengalir dari bagian atas kolom menggunakan spray sedangkan CO2 mengalir dari bagian bawah aliran kolom. Perbedaan antara cairan dan gas diketahui dari aliran masuk zat, diketahui bahwa untuk NaOH yang berbentuk cair memiliki massa jenis yang lebih besar dari gas CO2 sehingga untuk cairan dimasukkan melalui aliran atas kolom serta karena sifat alami dari cairan akan mudah mengalir ke bawah akibat gravitasi bumi. Sedangkan gas yang akan bergerak ke atas seperti menguap. Aliran ini ditujukan agar kontak dapat terjadi antara cairan dan gas.
Pada percobaan ini, didapatkan gas CO2 yang terabsorbsi hanya sedikit, hal ini dapat terjadi dikarenakan praktikan hanya menggunakan gas CO2 dari udara. Selain itu gas yang tidak terabsorb akan keluar pada outlet. Reaksi absorpsi CO2 oleh larutan NaOH mengikuti persamaan :
NaOH + CO2→ Na2CO3 + H20
Untuk mengetahui CO2 yang terabsorb, dilakukan titrasi dengan mengambil sampel dari outlet dan dari tangki dengan menambahkan indikator phenolpthalaein (PP) yang bekerja pada trayek basa. Tujuan penambahan ini adalah untuk membantu praktikan menemukan titik yang tepat untuk menghentikan titrasi, karena larutan yang
ditambakan indicator PP akan mengalami perubahan warna, selanjutnya saat berada pada kesetimbangan akan mengalami perubahan warna.
Berdasarkan hasil percobaan ini, sedikit ada gas CO2 yang terserap oleh larutan NaOH). Hal ini bisa terjadi karena :
• Konsentrasi CO2 diudara sangat kecil • Konsentrasi penitran terlalu besar
4.3.2 Oktavia Reni (141411022)
Pada praktikum kali ini dilakukan absorbsi yang merupakan salah satu prose separasi dalam proses industri kimia dengan menggunakan fasa cair sebagai absorber dan gas sebagai fasa terlarutnya. Proses absorbsi seperti ini disebut sebagai absorbsi cair-gas. Praktikum ini mempunyai tujuan untuk dapat memahami prinsip absorbsi dan proses kerjanya, dapat menghitung laju kecepatan absorbsi gas CO2 kedalam air, dan menghitung jumlah CO2 bebas didalam air.
Dalam praktikum ini digunakan CO2 sebagai gas yang akan diabsorbsi dan NaOH sebagai absorben nya. Proses ini berlangsung dengan reaksi kimia berikut:
NaOH(aq) + CO2(g) → NaHCO3(aq)
NaHCO3(aq) + NaOH(aq) → Na2CO3(s) + H2O(l) +
NaOH(aq) + CO2(g) → Na2CO3(s) + H2O(l)
Proses pengontakkan bertujuan untuk mengambil zat/senyawa yang terkandung dalam fasa gas oleh fasa cair. Dalam operasi absorbsi, adanya kontak antara fasa cair dan gas yang menyebabkan terserapnya zat/senyawa yang terkandung dalam fasa gas. Terjadi perbedaan konsentrasi (driving force) antara CO2 di udara dan di dalam liquid dan mengakibatkan terjadinya perpindahan massa dari gas ke larutan.
Adapun hal yang dilakukan saat berlangsungnya proses absorbsi yaitu mengalirkan udara yang bersumber dari compressor menuju dasar kolom absorber, sedangkan liquid dialirkan menuju puncak kolom absorber. Kolom absorber yang digunakan merupakan kolom isian risching ring dengan tujuan untuk memperluas kontak antara fasa cair dan gas di dalam kolom absorber sehingga proses absorbsi berjalan lebih optimal. Laju alir udara dan liquid yang digunakan di variasikan dengan laju udara yaitu 30 L/min, 50 L/min, 70 L/min dan laju liquid 2 L/min dan 4 L/min.
Dari hasil praktikum didapatkan hasil bahwa laju penyerapan gas CO2 dengan proses absorbsi gas-cair yang menggunakan NaOH sebagai absorben berlangsung pada empat tahap. Setiap laju alir liquid menghasilkan laju serapan gas CO2 yang berbeda-beda dan hasilnya meningkat setiap pertambahan waktu dengan laju hasil serapan gas CO2. Laju penyerapan CO2 tiap run-nya adalah Run 1 (pada laju alir air 2 = 30 liter/menit dan laju alir air 4 =30 liter/menit) ,Run 2 (pada laju alir air 2 = 50 liter/menit dan laju alir air 4 =50 liter/menit), Run 3 (pada laju alir air 2 = 70 liter/menit dan laju alir air 4 =70 liter/menit). Setiap laju serapan gas juga dilakukan penentuan konsentrasi gas CO2 yang terserap dengan cara dititrasi menggunakan titran HCl dan indicator PP dengan prinsip seperti titrasi asam-basa. Hasil penetapan konsentrasi didapat pada Run 1 (pada laju alir air 2 konsentrasi CO2 0,0775 M dan laju alir air 4 konsentrasi CO2 0,0825 M), Run 2 (pada laju alir air 2 konsentrasi CO2 0,0775 M dan laju alir air 4 konsentrasi CO2 0,079 M), dan Run 3 (pada laju alir air 2 konsentrasi CO2 0,078 M dan laju alir air 4 konsentrasi CO2 0,0765 M). Dari hasil penetapan konsentrasi CO2 tersebut dapat ditarik kesipulan bahwa laju alir mempengaruhi konsentrasi CO2 yang terserap, dan semain tinggi laju alir liquid yang diberikan semakin sedikit CO2 yag terserap karena waktu kontak antara gas dan liquid absorbennya tidak optimal. Sehingga waktu kontak antara liquid dan gas yag diberikan harus optimal tidak terlalu lama dan tidak terlalu cepat, sesuai dengan kemampuan liquid absorben tersebut untuk menyerap gas pada kolom absorber.
4.3.3 Suhermina (141411029)
Absorpsi merupakan proses pemisahan suatu campuran gas dengan mengkontakkan ke suatu cairan sehingga memisahkan komponen (dapat lebih dari satu komponen) pada gas dan larut pada cairan tersebut. Praktikan menggunakan larutan NaOH yang akan melakukan absorbsi kepada gas CO2. Gas CO2 yang digunakan berasal dari udara bebas. Kandungan CO2 pada udara bebas bervariasi karena dipengaruhi terhadap lingkungannya, tetapi dari keseluruhan udara bebas, CO2 mempunyai fraksi yang sangat kecil.
Proses absorpsi kali ini dilakukan pada menara absorpsi dengan kolom packing (packing yang digunakan adalah raching ring).Prinsip proses absorpsi kali ini adalah dengan mengontakkan CO2 yang terdapat dalam udara dengan aquadest sehingga CO2 akan terabsorp. Fungsi kolom packing adalah untuk memperbesar kontak antara NaOH dengan udara sehingga proses absorpsi CO2 akan berlangsung optimal. Absorbsi yang dilakukan menggunakan larutan NaOH 0,08 N yang dialirkan kedalam kolom dengan spray dan dengan kolom yang dilengkapi dengan packing. Ini bertujuan untuk memperluas permukaan kontak antara NaOH dengan CO2. Sehingga didapatkan proses absorbsi yang optimal. NaOH mengalir dari bagian atas kolom, sedangkan gas CO2 mengalir dari bagian bawah kolom. Dimana diketahui bahwa NaOH mempunyai berat jenis yang lebih besar dari gas CO2. Serta sifat alami bahwa cairan akan mudah mengalir kebawah akibat gravitasi bumi. Sedangkan gas yang akan bergerak ke atas seperti menguap. Aliran ini ditujukan agar kontak dapat terjadi antara cairan dan gas.
Laju alir yang diatur yaitu NaOH dengan 2 dan 4 liter/menit juga laju alir udara 30, 50, dan 70 liter/menit. Sedangkan untuk laju alir CO2yaitu 0,3; 0,5; dan 0,7 liter/ menit. Namun untuk laju alir CO2 tidak dapat presisi karena gas CO2yang digunakan bukan dari tabung melain kan dari udara sekitar yang dipompa. Sampel
diambil setiap 10 menit tetapi untuk laju pertama NaOH selama 15 menit. Reaksi yang terjadi pada percobaan ini: 2 NaOH + CO2 Na2CO3 + H2O
Selanjutnya sampel dari outlet dan dari tangki dititrasi dengan menambahkan indicator phenolphthalein (PP) yang bekerja pada trayek basa. Tujuan penambahan ini adalah untuk membantu praktikan menemukan titik yang tepat untuk menghentikan titrasi, karena larutan yang ditambakan indicator PP akan mengalami perubahan warna, selanjutnya saat berada pada kesetimbangan akan mengalami perubahan warna.
Berdasarkan hasil percobaan ini, tidak ada gas CO2 yang terserap oleh larutan NaOH (larutan langsung menjadi berwarna merah ketika di beri indicator PP). Hal ini bisa terjadi karena :
• Konsentrasi CO2 diudara sangat kecil, sehingga penitran tidak mendeteksi adanya gas CO2 dalam larutan NaOH
• Konsentrasi penitran terlalu besar
Di sisi lain larutan pada outlet menunjukan ada penurunan konsentrasi walaupun tidak terlalu signifikan dan pada akhir proses hanya menunjukan gejala naik turun pada konsentrasi lebih kecil.
BAB V
KESIMPULAN
5.1. KesimpulanSetelah melakukan percobaan dapat disimpulkan bahwa:
1.
Proses absorpsi gas CO2 kedalam larutan NaOH merupakan absorpsi kimia dan berlangsung melalui 4 tahap.2.
Laju penyerapan CO2 yang dihasilkan sebesar Run 1Laju alir air 2 = 30 liter/menit Laju alir air 4 ¿30 liter/menit Run 2
Laju alir air 2 ¿ 50 liter/menit Laju alir air 4 ¿50 liter/menit Run 3
Laju alir air 2 = 70 liter/menit Laju alir air 4 ¿70 liter/menit 3. Konsentrasi CO2 yang dihasilkan sebesar
Run 1
Laju alir air 2 Cco2 = 0,0775 M Laju alir air 4 Cco2=0,0825 M Run 2
Laju alir air 2 Cco2=¿ 0,0775 M Laju alir air 4 Cco2=0,079 M Run 3
Laju alir air 2 Cco2=¿ 0,078 M Laju alir air 4 Cco2=0,0765 M
DAFTAR PUSTAKA
Maarif, Fuad dan Januar Arif F.. “Absorbansi Gas Karbondioksida (CO2) dalam Biogas dengan Larutan NaOH secara kontinyu”. Semarang: Universitas Diponigoro.
Noviirayanti. 2013. “Indikator Asam Basa” http://bisakimia.com/2013/11/09/indikator-asam-basa/ (diakses pada tanggal 09 Desember 2015).
Sulaiman, Fatah. 2008. Modul-1.01 Absopsi. Banten: Universitas Sultan Ageng Tirtayasa. http://dokumen.tips/documents/101-absorpsi.html (diakses pada tanggal 09 Desember 2015).
Zehnjung.2015. Laporan Absorbsi. http://dokumen.tips/documents/laporan-absorbsi.html (diakses pada tanggal 09 Desember 2015).
2000. Forum Teknik Jurnal Teknologi , Jilid 24, No. 2. Yogyakarta: Universitas Gajah Mada. 2014. Absorpsi CO2 dalam larutan NaOH. Semarang: Universitas Diponogoro. http://lab.
tekim.undip.ac.id/proses/files/2014/09/ABSORBSI-CO2-DENGAN-LARUTAN-NaOH.pdf. (diakses pada tanggal 09 Desember 2015).
a. NaOH dalam umpan
VNaOH x MNaOH= VHCl x MHCl
10 M = 8 ml x 0,1
M = 0,08 M
b. Penentuan Jumlah CO2 bebas
Sample 1 (duplo) VCO2x MCO = VHCl x MHCl 10 M = 8 ml x 0,1 M = 0,08 M VCO2x MCO = VHCl x MHCl 10 M = 7,85 ml x 0,1 M = 0,0785M Mrata-rata= 0,08+0,0785 2 =0,0775 M Sample 2 (duplo) VCO2x MCO = VHCl x MHCl 10 M = 8 ml x 0,1 M = 0,08M VCO2x MCO = VHCl x MHCl 10 M = 7,8 ml x 0,1 M = 0,0785M Mrata-rata= 0,08+0,0785 2 =0,0775 M Sample 3 (duplo) VCO2x MCO = VHCl x MHCl 10 M = 7,8ml x 0,1 M = 0,078M VCO2x MCO = VHCl x MHCl 10 M = 7,8ml x 0,1 M = 0,078M Mrata-rata= 0,078+0,078 2 =0,078 M Sample 4 (duplo) VCO2x MCO = VHCl x MHCl 10 M = 7,3 x 0,1 M = 0,073M VCO2x MCO = VHCl x MHCl 10 M = 9,2 x 0,1 M = 0,092M Mrata-rata= 0,073+0,092 2 =0,0825 M Sample 5 (duplo) VCO2x MCO = VHCl x MHCl 10 M = 8,3 x 0,1 M = 0,083M VCO2x MCO = VHCl x MHCl 10 M = 7,5 x 0,1 M = 0,075M Mrata-rata= 0,083+0,075 2 =0,079 M Sample 6 (duplo) VCO2x MCO = VHCl x MHCl 10 M = 7,5 x 0,1 M = 0,075M VCO2x MCO = VHCl x MHCl 10 M = 7,8 x 0,1 M = 0,078M Mrata-rata= 0,075+0,078 2 =0,0765 M
a. Laju penyerapan CO2 (x)
x=(y 1− y 0 )(F 2+F 3)
(1− y 0) Run 1
Laju alir air 2 x=(0,9895)(30)
l menit
(0,9995) = 30 liter/menit Laju alir air 4 x=(0,98825)(30)
l menit
(0,99825) =30 liter/menit Run 2
Laju alir air 2 x=(0,989)(50)
l menit
(0,999) =¿ 50 liter/menit Laju alir air 4 x=(0,98825)(50)
l menit
(0,99825) =50 liter/menit Run 3
Laju alir air 2 x=(0,9885)(70)
l menit
(0,9985) =¿ 70 liter/menit Laju alir air 4 x=(0,988)(70)
l menit