Kesetimbangan Fasa Cair-Cair dan Cair Uap
Kiftiyah Yuni Fatmawardi*, Teguh Andy A.M, Vera Nurchabibah, Nadhira Izzatur Silmi, Yuliatin, Pretty Septiana, Ilham Al Bustomi
Kelompok 5, Kelas AB, Jurusan Kimia, Fakultas MIPA, Universitas Brawijaya, Jl. Veteran 65145, Indonesia
ABSTRAK
Pada percobaan kesetimbangan fasa cair-cair dan cair-uap, praktikan melakukan pengukuran indeks bias terhadap pelarut murni dan campuran metanol dan etanol dengan menggunakan refraktometer. Dari data tersebut, praktikan dapat membuat kurva hubungan antara indeks bias terhadap komposisi. Berdasarkan kurva tersebut, menunjukkan bahwa fraksi mol metanol berbanding terbalik dengan indeks biasnya. Pada destilasi campuran biner, praktikan melakukan destilasi untuk memperoleh destilat dari campuran pelarut methanol dan ethanol. Dengan memanaskan campuran pelarut tersebut, maka komponennya akan mengalami penguapan kemudian mengalami kondensasi dan menghasilkan destilat. Mengukur indeks bias dari destilat. Praktikan memperolehkurva hubungan antara titik didih dengan indeks bias dan titik didih dengan volatilifitas relatif (YA).
In the experimental phase equilibrium liquid-liquid and liquid - vapor , praktikan measurement of the refractive index of the pure solvent and a mixture of methanol and ethanol by using a refractometer . From these data , the practitioner can make a curve relationship between the refractive index of the composition . Based on the curve , showing that the mole fraction of methanol is inversely proportional to the refractive index . In a binary mixture distillation , praktikan perform distillation to obtain a distillate from a mixture of methanol and ethanol. By heating the solvent mixture , the components will undergo evaporation and then condenses and produces distillate . Measure the refractive index of the distillate . Praktikan memperolehkurva relationship between the boiling point of refractive index and boiling point with relative volatilifitas ( YA) .
I. PENDAHULUAN
Suatu proses pemisahan komponen satu dengan komponen lainnya dalam suatu campuran berdasarkan perbedaan titik didih antara komponen-komponen yang akan dipisahkan disebut dengan distilasi. Pada keadaan setimbang komposisi cairan dan komposisi uap berbeda. Pada fasa uap akan mengandung lebih banyak komponen yang volatil atau mudah menguap daripada fasa cair. Pada proses distilasi, cairan akan teruapkan dan mengalami kondensasi lalu menghasilkan distilat. Komponen dengan titik didih lebih rendah akan menguap terlebih dahulu [1].
Diagram fase dari zat murni menunjukkan daerah tekanan dan suhu di mana berbagai tahapan yang adalah termodinamika stabil (Gambar 1.1). Garis memisahkan daerah, yang disebut batas fase (atau kurva koeksistensi), menunjukkan nilai-nilai p dan T di mana dua fase hidup berdampingan dalam keseimbangan dan potensi kimia mereka adalah sama [3].
Gambar 1.1 diagram fasa zat murni
Jika suatu komponen (pelarut) mendekati murni, komponen tersebut berperilaku sesuai dengan Hukum Roult dan mempunyai tekanan uap yang sebanding dengan fraksi mol. Beberapa larutan menyimpang jauh dari Hukum Roult. Walaupun demikian, dalam hal ini hukum itu semakin dipatuhi jika komponennya berlebih (sebagai pelarut) sehingga mendekati kemurnian. Bisa dikatakan, bahwa hukum ini menerangkan pendekatan yang baik untuk pelarut selama larutan ini encer [4].
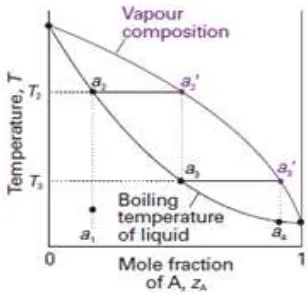
Komposisi kesetimbangan antara uap-cair ditunjukkan dalam diagram fasa seperti Gambar 1.2 [4].
Gambar 1.2 Diagram Fasa Air-Uap
Apabila larutan komponen A dan komponen B dengan fraksi mol masing-masing adalah xA dan xB berada dalam kesetimbangan dengan fasa gasnya, maka tekanan uap
uap parsial dari campuran yang merupakan larutan ideal dapat dihubungkan dengan Hukum Raoult sebagai berikut [5] :
pA= xA.p*A pB= xB.p*B
dimana pA adalah tekanan parsial komponen A, pB adalah tekanan parsial komponen B,
p*A adalah tekanan uap murni komponen A dan p*B tekanan uap murni komponen B [5].
II. METODOLOGI
II.1.Alat dan Bahan
Alat yang digunakan adalah 1 set destilator sederhana, 1 set refraktometer, 4 buah gelas kimia 100 mL, 2 pipet ukur 10 mL, tabung reaksi 15 buah, rak tabung reaksi 1 buah, pipet tetes 2 buah, botol aquades.
Bahan yang digunakan adalah methanol, etanol, aquades, dan aseton.
II.2.Prosedur kerja
2.2.1 Kalibrasi komposisi melalui penentuan indeks bias
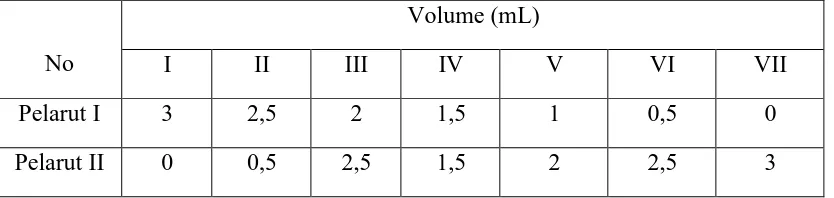
Disiapkan 7 buah tabung reaksi dan diisi dengan campuran pelarut sesuai tugas dari asisten. Dibuat komposisi campuran sesuai Tabel 1, kemudian dihitung fraksi mol setiap komponen. Untuk pelarut murni tidak perlu disiapkan dalam tabung reaksi tetapi langsung dilakukan pengukuran indeks bias.
Tabel 1. Komposisi pada campuran biner 1
No
Volume (mL)
I II III IV V VI VII
Pelarut I 3 2,5 2 1,5 1 0,5 0
Pelarut II 0 0,5 2,5 1,5 2 2,5 3
Dibersihkan tempat sampel pada refraktometer dengan menggunakan aseton 1-2 tetes dan dilakukan pengukuran indeks bias campuran pada Tabel 1. Dibuat kurva antara indeks bias sebagai fungsi komposisi.
2.2.2 Destilasi Campuran Biner
Dibuat 2 seri campuran biner untuk jenis pelarut yang sama dengan Tabel 1 dan dibuat komposisi sesuai Tabel 2. Disiapkan set alat destilasi sederhana dengan menggunakan penangas heating mantle atau penangas air ( disesuaikan dengan jenis pelarut yang ditugaskan asisten).
No
Volume (mL)
I II
Pelarut I 20 20
Pelarut II 4 6
Dimasukkan campuran (1) kedalam labu bundar, kemudian dipasang pada alat destilasi yang telah disiapkan. Dialirkan air pendingin melalui kondensor, kemudian dihidupkan penangas dan dilakukan destilasi campuran. Ditampung komponen yang keluar (destilat) untuk setiap 2 mL dan dicatat temperature saat awal pelarut keluar hingga tercapai volume yang diinginkan. Dilakukan cara yang sama untuk setiap fraksi yang keluar hingga diperoleh 7 kali pengamatan. Setiap fraksi ditampung dalam tabung yang berbeda. Diukur indeks bias destilat untuk setiap fraksi. Destilasi dihentikan untuk campuran 1 diatas, campuran dikeluarkan dan dibuang dalam botol penampung yang telah disiapkan. Dibersihkan labu bundar dan bagian dalam kondensor. Dilakukan prosedur yang sama untuk komposisi campuran 2.
III. HASIL DAN PEMBAHASAN
3.1 Kalibrasi komposisi melalui penentuan indeks bias
X methanol :
etanol n (indeks bias)
0 1.3315
0.2 1.3312
0.4 1.3300
0.6 1.3304
0.8 1.3301
1 1.3303
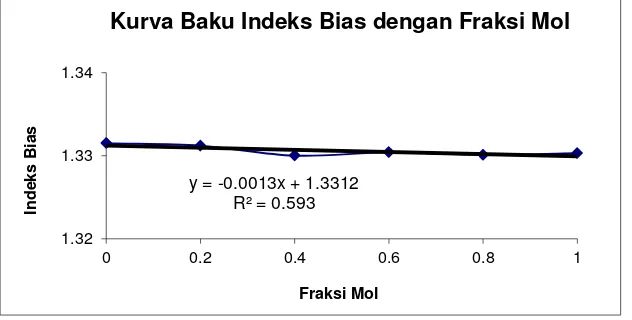
Grafik 1. Indeks Bias dengan Fraksi mol
Dari percobaan yang sudah dilakukan didapatkan pada percobaan kalibrasi komposisi melalui Penentuan indeks bias untuk etanol 3 mL didapatkan indeks bias sebesar 1,3315. Untuk campuran antara etanol 2,5 mL dengan metanol 0,5 mL didapatkan indeks bias sebesar 1,3312. Campuran antara etanol 2 mL dengan metanol 2,5 mL didapatkan indeks bias sebesar 1,3300. Campuran antara etanol 1,5 mL dengan metanol 1,5 mL didapatkan indeks bias sebesar 1,3304. Campuran antara etanol 1 mL dengan metanol 2 mL didapatkan indeks bias sebesar 1,3301. Campuran antarara etanol 0,5 mL dengan metanol 2,5 mL didapatkan indeks bias sebesar 1,3303 dan untuk metanol 3 mL tidak didapatkan indeks bias.
Dari data tersebut indeks bias menurun dari fraksi mol 0-0,4 tetapi mengalami kenaikan pada fraksi mol 0,6 kemudian turun kembali pada fraksi mol 0,8 dan naik pada fraksi mol 1. Sehingga, hubungan antara kurva baku indeks bias dengan fraksi mol didapatkan persamaan y= -0,0013x + 1,3312 dan R2= 0,593. Kurva yang didapatkan tidak sesuai seharusnya indeks bias akan semakin menurun dengan naiknya fraksi mol hal ini menunjukkan bahwa indeks bias berbanding terbalik dengan fraksi mol.
3.2 Destilasi Campuran Biner
Tabel 2. Campuran 20 mL Etanol dan 4 mL Metanol
y = -0.0013x + 1.3312
Grafik 2. Campuran 20 mL Etanol dan 4 mL Metanol
Dari percobaan distilasi campuran biner antara 20 mL etanol dengan 4 mL metanol didapatkan indeks bias dengan 7 kali pengamatan dan setiap pengamatan diambil 2 mL distilat. Untuk distilat pertama sampai distilat ke enam temperatur yang didapatkan konstan yaitu 65 oC. Sedangkan untuk distilat ke tujuh, temperatur yang didapatkan yaitu 66 oC. Indeks bias untuk distilat pertama yaitu 1.3374, distilat kedua 1.3356, distilat ketiga 1.3368, distilat ke empat 1.3339, distilat ke lima 1.3361, distilat ke enam 1.3320, dan distilat ke tujuh 1.3313.
Kurva campuran biner pertama tidak sesuai dengan teori, seharusnya kenaikan temperatur menyebabkan penurunan fraksi mol sedangakan pada percobaan yang dilakukan pada distilat pertama sampai distilat ke enam termperatur yang didapatkan konstan. Hal ini terjadi karena kesalahan praktikan setelah mencuci labu alas bulat masih terdapat aquades yang tertinggal sehingga mempengaruhi titik didih dari larutan. kurva hubungan antara temperatur dengan fraksi mol didapatkan persamaan y=-0,2212x + 65,175 dengan R2=0,0489.
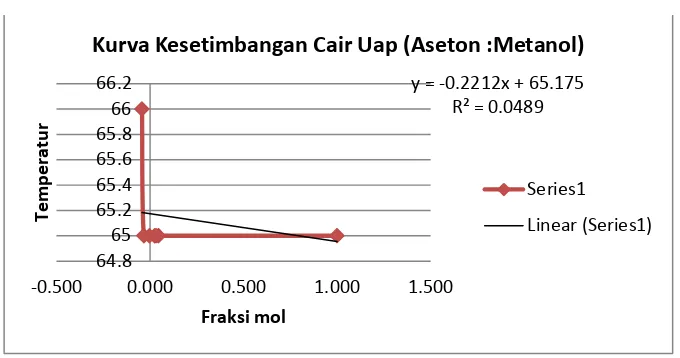
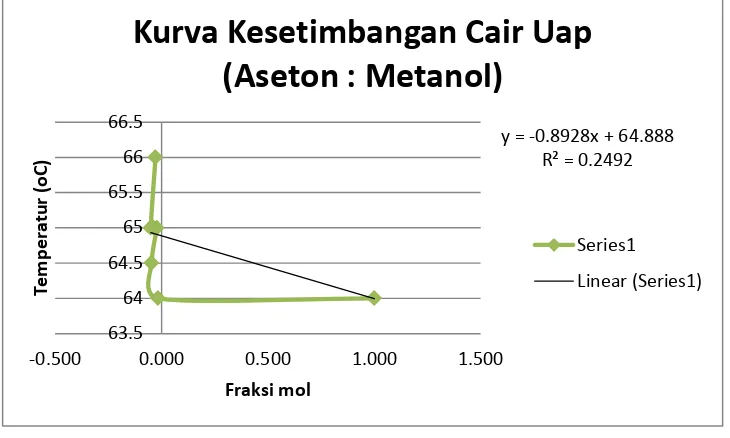
Tabel 3. Campuran 20 mL Etanol dan 6 mL Metanol
y = -0.2212x + 65.175
Kurva Kesetimbangan Cair Uap (Aseton :Metanol)
Series1
Grafik 3. Campuran 20 mL Etanol dan 6 mL Metanol
Campuran 20 mL Etanol dan 6 mL Metanol didapatkan temperatur pada distillat pertama yaitu 64 oC dengan indeks bias 1.3344, pada destilat kedua dengan temperatur 64oC dan indeks bias 1.3331, destilat ketiga dengan temperatur 64.5 oC dan indeks bias 1.3311, destilat keempat dengan temperatur 65 oC dan indeks bias 1.3327, destilat ke lima dengan temperatur 65 oC dan indeks bias 1.3318, distilat keenam dengan temperatur 65 oC dan indeks bias 1.3308, dan distilat ketujuh dengan temperatur 66 oC dan indeks bias 1.3323.
Kurva yang didapatkan tidak sesuai dengan teori, sama dengan kurva campuran biner pertama tetapi temperatur yang dihasilkan lebih bervariasi dan mengalami kenaikan dibandingkan pada kurva campuran biner pertama. Sehingga berpengaruh pada fraksi mol dan hal ini terjadi karena kesalahan yang sama pada percobaan campuran biner pertama. Kurva yang didapatkan memiliki persamaan y=-0,8928x + 64,888 dengan R2= 0,2492.
IV. KESIMPULAN
Berdasarkan praktikum mengenai kesetimbangan cair-cair dan cair uap diperoleh grafik hubungan antara indeks bias dengan fraksi mol. Secara teori indeks bias berbanding terbalik dengan fraksi mol tetapi dari grafik yang didapatkan, fraksi mol tidak berbanding terbalik dengan indeks bias. Pada percobaan distilasi campuran biner diperoleh grafik hubungan kesetimbangan antara uap dan cairan. Grafik tersebut memperlihatkan hubungan fraksi mol terhadap temperatur. Secara teoritis temperatur berbanding terbalik dengan fraksi mol tetapi dari grafik yang didapatkan, fraksi mol tidak berbanding terbalik dengan temperatur.
V. DAFTAR PUSTAKA
[1] Sunarinda, Reno, 2015, Kesetimbangan Fasa Cair-Cair dan Cair Uap, Universitas Pasundan, Bandung.
[2] Montimer, Robert G, 2008, Phisical Chemistry Third Edition, Elsevier Academic Press, Canada.
[3] Atkins, Peter., Paula, J, 2010, Phisical Chemistry Ninth Edition, Oxford University Press, New York.
[4] Potoff, Jeffrey J., J. Ilja Siepman, 2001, Vapor- Liquid Equilibria of Mixtures Containig Alkanes, Carbon Dioxide, and Nitrogen, AIChE Journal, 47(7) : 1676-1682.
[5] Mao, S., Zhenhao Duan., Wenxuan Hu, 2009, A Vapor- Liquid Phase Equilibrium Model for Binari CO2-H2O and CH4-H2O System Above 523K for Application to