Dian Tri Lestarini, Arya Maulana Ichsan, Mutiara Ayu Annisa
Departemen Kimia, Fakultas MIPA, Universitas Indonesia Kampus UI Depok, 16424, Depok, Jawa Barat, Indonesia
E-mail: dian.tri41@sci.ui.ac.id
Abstrak
Percobaan ini bertujuan untuk mengetahui cara mensintesis metil benzoat dengan bahan dasar asam benzoat, metanol dan katalis asam (H2SO4), mengetahui mekanisme pembentukan ester yang terjadi, mengetahui
prinsip reaksi esterifikasi Fischer dan mengetahui fungsi reagen-reagen yang digunakan. Reaksi esterifikasi adalah reaksi pembentukan ester dengan menggunakan asam karboksilat dan derivatnya (asil klorida dan anhidrida) dengan alkohol dalam suasana asam. Reaksi esterifikasi Fischer bersifat reversible. Metoda yang digunakan pada sintesis metil benzoat adalah metoda refluks. Dalam percobaan ini digunakan Na2CO3 5% untuk menetralkan sisa
asam benzoat dan Na2SO4 anhidrat sebagai penarik air. Prinsip dari metode refluks yaitu pemanasan, pendinginan
dan isolasi dimana pelarut volatil yang digunakan akan menguap pada suhu tinggi, namun akan didinginkan dengan kondensor. Produk samping yang dihasilkan adalah air (H2O). Dari percobaan diperoleh volume propil
asetat sebesar 1,25 ml dengan nilai yield 29,87% dan nilai kesalahan relatif 70,13%.
Kata kunci: metil benzoat, esterifikasi fischer, ekstraksi, refluks
1. PENDAHULUAN
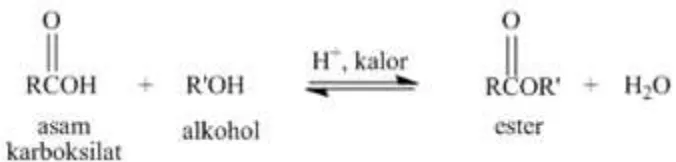
Esterifikasi merupakan reaksi pembentukan ester dari suatu asam karboksilat dan alkohol dengan menggunakan katalis asam. Reaksi ini juga sering disebut esterifikasi Fischer. Ester adalah suatu senyawa yang mengandung gugus -COOR dengan R dapat berbentuk alkil maupun aril. Suatu ester dapat dibentuk dengan reaksi esterifikasi berkatalis asam. Reaksi esterifikasi merupakan reaksi dapat balik (reversible). Ester adalah senyawa organik yang terbentuk melalui penggantian atom H pada gugus hidroksil dengan suatu gugus organik. Ester dapat diubah menjadi bermacam senyawa lain. Ester biasa dijumpai di alam, selain itu ester juga digunakan untuk polimer sintetik yang paling sering, ester digunakan sebagai wewangian dan pemberi citarasa buah sintetik.
Metoda yang digunakan pada percobaan ini yaitu, metoda refluks dan ekstraksi. Refluks digunakan untuk mensintesis senyawa-senyawa yang mudah menguap atau volatile. Prinsip refluks adalah pemanasan, kondensasi, dan sistem tertutup. Sedangkan ekstraksi digunakan untuk pemisahan bahan padat maupun cair dengan bantuan pelarut. Pelarut yang digunakan harus dapat mengekstrak substansi yang diinginkan tanpa melarutkan material lainnya. Adapun tujuan dari percobaan ini yaitu, mengetahui cara mensintesis metil benzoat dengan bahan dasar asam benzoat, metanol dan katalis asam (H2SO4), mengetahui mekanisme pembentukan ester yang terjadi, mengetahui prinsip reaksi esterifikasi Fischer dan mengetahui fungsi reagen-reagen yang digunakan.
2. TINJAUAN PUSTAKA 2.1 Metil benzoat
Gambar 1. Struktur Metil benzoat
Sumber: http://www.sigmaaldrich.com/catalog/substance/methylbenzoate136159358311?lang=en®ion=ID
2.2 Metanol
Metanol, juga dikenal sebagai metil alkohol, wood alcohol atau spiritus, adalah senyawa kimia dengan rumus kimia CH3OH. Metanol merupakan bentuk alkohol paling sederhana. Pada "keadaan atmosfer" berbentuk cairan yang ringan, mudah menguap, tidak berwarna, mudah terbakar, dan beracun dengan bau yang khas (berbau lebih ringan daripada etanol). Metanol digunakan sebagai bahan pendingin anti beku, pelarut, bahan bakar dan sebagai bahan additif bagi etanol industri. Metanol diproduksi secara alami oleh metabolisme anaerobik oleh bakteri. Hasil proses tersebut adalah uap metanol (dalam jumlah kecil) di udara. Setelah beberapa hari, uap metanol
tersebut akan teroksidasi oleh oksigen dengan bantuan sinar matahari menjadi karbon dioksida dan air. Reaksi kimia metanol yang terbakar di udara dan membentuk karbon dioksida dan air adalah sebagai berikut:
2 CH3OH + 3 O2 → 2 CO2 + 4 H2O
Gambar 2. Struktur Metanol
Sumber: https://upload.wikimedia.org/wikipedia/commons/d/d4/Methanol_Keilstrich.svg
2.3 Reaksi Esterifikasi Fischer
Reaksi esterifikasi Fischer adalah reaksi pembentukan ester dengan cara merefluks asam karboksilat bersama alkohol dengan katalis asam dan terdapat kesetimbangan dengan ester dan air. Esterifikasi Fischer berdasarkan nama Emil Fischer, kimiawan organik abad 19 yang mengembangkan metode ini. Walaupun reaksi ini adalah reaksi kesetimbangan, dapat juga digunakan untuk membuat ester dengan hasil yang tinggi dengan menggeser kesetimbangan ke kanan. Hal ini dapat dicapai dengan beberapa teknik. Jika harga alkohol atau asam, murah, dapat digunakan jumlah berlebihan. Cara lain ialah dengan memisahkan ester dan/atau air yang terbentuk (dengan penyulingan), sehingga menggeser reaksi ke kanan.
2.4 Metoda Refluks
Refluks adalah salah satu metode dalam ilmu kimia untuk mensintesis suatu senyawa, baik senyawa organik maupun senyawa anorganik. Biasanya refluks digunakan untuk mensintesis senyawa-senyawa yang mudah menguap atau volatile. Prinsip refluks adalah pemanasan, kondensasi, dan sistem tertutup. Pemanasan pada refluks untuk mempercepat terjadinya reaksi karena pada suhu tinggi tumbukan antar partikel semakin banyak. Hal ini dapat mempercepat reaksi yang terjadi. Selain itu, suhu tinggi juga dapat meningkatkan kelarutan. Pada kondensasi, zat yang menguap akan menjadi cair kembali karena terjadi pendinginan di kondensor. Pada refluks, yang digunakan adalah sistem tertutup. Hal ini akan menjaga volume larutan tetap, tidak berkurang dan tidak bertambah.
Gambar 5. Proses refluks
Sumber: http://ndarucs.blogspot.com/2010/05/metode-sintesis-refluks.html
2.5 Ekstraksi
Proses ekstraksi adalah suatu proses pemisahan dari bahan padat maupun cair dengan bantuan pelarut. Pelarut yang digunakan harus dapat mengekstrak substansi yang diinginkan tanpa melarutkan material lainnya. Prinsip dasar ekstraksi yaitu pemisahan suatu zat berdasarkan perbandingan distribusi zat yang terlarut dalam dua pelarut yang tidak saling melarutkan dan berdasarkan perbedaan massa jenis (ρ) dimana senyawa yang memiliki massa jenis (ρ) yang lebih tinggi berada pada lapisan bawah.
Gambar 6. Corong Pisah
3. METODA PERCOBAAN 3.1 Alat dan Bahan
Alat : Bahan :
1. Labu bulat 1. 2.5 gr Asam benzoat
2. Refluks/kondensor 2. 6,5 ml Metanol
3. Pipet tetes 3. 6,5 ml Na2CO3 5%
4. icebath 4.15 tetes H2SO4 pekat
5. Beaker glass 5. 18,5 ml Aquades
6. Corong Buchner 6. 9 ml eter
7. Corong pisah 7. 5 ml NaCl jenuh
8. Gelas Ukur 8. 1 gr Na2SO4 anhidrat
3.2 Prosedur Sintesis Metil Benzoat
Memasukan 2,5 gr asam benzoat dan 6,5 ml metanol ke dalam labu bulat. Menempatkan labu bulat dalam
icebath kemudian menambahkan 15 tetes H2SO4 pekat. Merefluks selama 1 jam (sebelum merefluks menambahkan batu didih dalam labu bulat). Setelah merefluks, mendinginkan larutan kemudian larutan dipindahkan dan menambahkan 12,5 ml aquades dan 9 ml eter kedalam corong pisah. Mengocok campuraan hingga terbentuk 2 lapisan, membuang lapisan bawah. Menambahkan 6,5 ml aquades dan 6,5 ml Na2CO3 5% kemudian mengocoknya hingga terbentuk 2 lapisan dan membuang lapisan bawah. Menambahkan 5 ml NaCl jenuh mengocok kembali dan mengambil lapisan atas. Memasukan lapisan atas ke dalam beaker glass dan menambahkan 1 gr Na2SO4 anhidrat kemudian mendekantasi ester yang terbentuk dan memasukannya ke dalam gelas ukur. Menimbang gelas ukur tersebut.
3.3 Penentuan Yield Reaksi dan Kesalahan Relatif
Yield ditentukan dengan rumus sesuai yang terdapat dalam buku kimia teknologi semester 6, dengan rumus sebagai berikut:
% ����� = ��������������/�������������� 100%
Sementara kesalahan relatif pada percobaan ini dapat ditentukan dengan menggunakan rumus berikut:
������h��������� = |��������������−�������������| ⁄
�������������
� 100%
Dimana masa teoritis dapat dihitung dengan menggunakan stoikiometri reaksi.
4. HASIL DAN PEMBAHASAN 4.1 Data Pengamatan
Gambar 10. Penambahan NaCl Jenuh Gambar 11. Hasil metil benzoat
4.2 Perhitungan Teoritis
Mol asam benzoat : (massa asam benzoat / Mr asam benzoat) = 2,5 gr / (122 gr/mol) = 0,0205 mol Massa metanol : ρ metanol x volume metanol
= (0,7915 gr/ml) x 6,5 ml = 5,14475 gr
Mol metanol : massa metanol / Mr metanol
= 5,14475 gr / (32 gr/mol) = 0,1607 mol Persamaan reaksi:
As. benzoat + metanol → metil benzoat + H2O
m: 0,0205 mol 0,1607 mol - -
r : 0,0205 mol 0,0205 mol 0,0205 mol 0,0205 mol
s : - 0,1402 mol 0,0205 mol 0,0205 mol
Massa metil benzoat teoritis : mol metil benzoat x Mr metil benzoat = 0,0205 mol x (160 gr/mol) = 3,28 gr
4.3 Perhitungan Percobaan Volume metil benzoat : 1,25 ml
Massa metil benzoat : (massa gelas ukur isi - massa gelas ukur kosong) = (31,34 gr - 30,36 gr) = 0,98 gr
4.4 Persentase Yield dan Kesalahan Relatif
%Yield = (massa percobaan / massa teoritis) x 100% = (0,98 gr / 3,28 gr) x 100% = 29,87%
%Kesalahan Relatif = (massa teoritis - massa percobaan) / (massa teoritis) x 100% = (3,28 gr - 0,98 gr) / 3,28 gr x 100% = 70,13%
4.5 Analisa Hasil
Dalam percobaan ini, disintesis metil benzoat dengan cara mereaksikan asam benzoat dengan metanol juga asam sulfat pekat (H2SO4 pekat) dalam keadaan dingin (pencampuran dilakukan dengan labu bulat berada dalam
icebath). Dalam percobaan ini, asam benzoat dan metanol berfungsi sebagai bahan utama dalam sintesis metil benzoat, sedangkan H2SO4 pekat berfungsi sebagai katalis asam untuk mempercepat laju reaksi. Pencampuran ketiga reagen tersebut dilakukan dalam keadaan dingin yang bertujuan untuk menahan agar reaksinya tidak berlangsung terlebih dahulu sebelum dilakukan pemanasan dengan refluks dan dikarenakan reaksi dengan H2SO4 pekat merupakan reaksi eksoterm yang melepaskan energi (panas).
berada dalam proses tersebut tidak akan hilang, karena uap-uap yang keluar dari hasil pemanasan dengan heating mantle akan masuk ke kondensor dan diubah kembali lagi menjadi tetes-tetes cairan, lalu tetes-tetes cairan tersebut jatuh kembali ke dalam labu bulat, sehingga komposisi zat tetap sama.
Setelah proses refluks, larutan telah bercampur sempurna. Kemudian setelah labu bulat didinginkan di bawah air kran, tahap selanjutnya adalah menuangkan larutan tersebut pada corong pisah. Lalu ke dalam corong pisah tersebut, dilakukan penambahan eter yang bertujuan untuk menarik sisa-sisa pengotor yang bersifat non-polar, lalu dilakukan penambahan air yang bertujuan untuk menarik pengotor yang bersifat polar dan mencuci sisa-sisa asam. Kemudian dilakukan ekstraksi. Pada saat ekstraksi, terbentuk gas karena sifat dari eter yang mudah menguap, oleh karena itu pada saat dilakukan ekstraksi, dibuka kran pada corong pisah agar gas dari penambahan eter tersebut dapat keluar. Kemudian setelah ekstraksi, terbentuk dua lapisan pada corong pisah, dimana lapisan atas merupakan fasa organik dan lapisan bawah merupakan fasa air. Komponen pada fasa air (lapisan bawah) dibuang.
Selanjutnya, dilakukan penambahan Na2CO3 5 % pada corong pisah yang bertujuan untuk menetralisirkan kelebihan asam pada reaksi pembentukan ester. Kemudian dilakukan ekstraksi kembali, terbentuk gas-gas H2O dan CO2. Gas tersebut merupakan air dalam fasa uap. Ekstraksi dilakukan sampai tidak ada lagi gas yang terbentuk. Setelah tidak ada lagi gas yang terbentuk, dilakukan penambahan NaCl jenuh yang bertujuan untuk memecah emulsi, sehingga membentuk dua lapisan. NaCl jenuh juga merupakan agen salting out dimana memiliki kelarutan yang lebih besar dibanding kelarutan zat utama. Lapisan atasnya yaitu berupa metil benzoat dan lapisan bawahnya berupa lapisan anorganik yang selanjutnya dibuang. Kemudian dipindahkan ke dalam beaker glass dan dilakukan penambahan Na2SO4 anhidrat pada metil benzoate yang bertujuan untuk menarik air pada proses esterifikasi ini. Kemudian metil benzoat yang didapat ditimbang beratnya dan diukur volumenya.
Dalam reaksi esterifikasi Fischer, reaksi berjalan reversible. Karena reaksi Fischer merupakan reaksi
reversible, maka hasil reaksi dapat bereaksi kembali membentuk zat reaktan dan begitu juga sebaliknya sehingga komponen dari zat tersebut tidak pernah habis. Kekurangan dari reaksi reversible ini yaitu sulitnya didapatkan produk yang murni. Sedangkan dalam reaksi esterifikasi via anhidrida asetat, reaksi berjalan irreversible. Karena reaksi ini merupakan reaksi irreversible, maka hasil reaksi tidak dapat bereaksi kembali membentuk zat reaktan. Hal ini disebabkan struktur dari anhidrida asetat yang sterik. Kelebihan dari reaksi irreversible ini adalah mudahnya didapatkan produk yang murni. Dari percobaan diperoleh volume metil benzoat sebesar 1,25 ml dengan nilai yield 29,87% dan nilai kesalahan relatif 70,13%.
Berikut merupakan tahap-tahap mekanisme reaksi esterifikasi Fischer :
1. Transfer proton dari katalis asam ke atom karbonil, sehingga meningkatkan elektrofilitas dari atom karbon pada gugus karbonil.
2. Atom karbon karbonil kemudian diserang oleh atom oksigen dari alkohol, yang bersifat nukleofilik sehingga terbentuk ion oksonium.
3. Terjadi pelepasan proton dari gugus hidroksil milik alkohol, menghasilkan kompleks teraktivasi.
4.6 Analisa Kesalahan
Dalam percobaan ini, terdapat kesalahan yang terjadi dapat berupa kurang bersihnya alat yang digunakan, serta kurang maksimalnya pengocokan pada proses ekstraksi sehingga hasil yang didapat kurang sempurna menyebabkan besarnya %KR dan kecilnya nilai %yield.
5. KESIMPULAN
1. Reaksi esterifikasi adalah reaksi pembentukan dengan menggunakan asam karboksilat dan derivatnya (Asil klorida dan Anhidrida) dengan alkohol dalam suasana asam.
2. Esterifikasi Fischer berdasarkan nama Emil Fischer, kimiawan organik abad 19 yang mengembangkan metode reaksi pembentukan ester dengan cara merefluks asam karboksilat bersama alkohol dengan katalis asam dan terdapat kesetimbangan dengan ester dan air.
3. Asam benzoat dan metanol berfungsi sebagai bahan utama dalam sintesis metil benzoat, sedangkan H2SO4 pekat berfungsi sebagai katalis asam untuk mempercepat laju reaksi.
4. Na2CO3 5 % pada corong pisah yang bertujuan untuk menetralisirkan kelebihan asam pada reaksi pembentukan ester. Sedangkan NaCl jenuh yang bertujuan untuk memecah emulsi.
5. Dari percobaan diperoleh volume metil benzoat sebesar 1,25 ml dengan nilai yield 29,87% dan nilai kesalahan relatif 70,13%.
UCAPAN TERIMA KASIH
dengan baik. Selain itu, terima kasih pula untuk asisten laboratorium pada percobaan ini yaitu Ka Magfira yang sudah membantu dan memberikan pengarahan sehingga praktikum ini dapat selesai dengan baik. Tak lupa, penulis mengucapkan terima kasih kepada orang-orang yang sudah berjasa yang telah membuat referensi di internet maupun di buku hingga laporan ini selesai. Penulis mohon maaf apabila laporan ini masih banyak kesalahan dan jauh dari kesempurnaan.
DAFTAR PUSTAKA
Atkins, P.W. 2004. Kimia Fisik jilid 2 edisi ke-4. Jakarta : Erlangga.
Fessenden & Fessenden. 1982. Organic Chemistry 3rd Ed. Jakarta: Erlangga.
Smith, Janice Gorzynski. 2011. Organic Chemistry 3rd ed.. Manoa : University of Hawai’i
Tim KBI Kimia Organik.2011.Penuntun Pratikum Sintesis Organik . Depok : Departemen kimia FMIPA Universitas Indonesia.
LAMPIRAN MSDS
1. Asam Benzoat
Sinonim : Asam karboksilat benzena, asam benzen format, asam dracyclic Rumus molekul : C6H5COOH
Bentuk : Kristal / Bubuk putih Titik leleh : 122 oC
Titik didih : 249 oC Densitas : 1,32 gr/cm3 Titik nyala :121 oC
Kestabilan : Stabil, mudah terbakar
Toksisitas : Berbahaya bila tertelan, dapat menyababkan iritasi, dapat menyebabkan iritasi mata dan saluran pernapasan
2. Metanol
Sinonim : Metanol, metil alkohol, karbinol, wood nafta Rumus molekul : CH3OH
Bentuk : Cairan bening Titik leleh : - 98 oC Titik didih : 64,7 oC Titik nyala : 11 oC
Kestabilan : Stabil, sangat mudah terbakar
Toksisitas : Beracun bila terhirup, bila terpapar dalam jumlah banyak dapat menyebabkan kerusakan mata, ginjal, hati dan jantung
3. Metil Benzoat
Sinonim : miobe oil, esence of niobe Rumus molekul : C8H5COOCH3
Bentuk : Cairan kuning bening Titik leleh : - 12 oC
Titik didih : 199 oC Densitas : 1,09 gr/cm3 Titik nyala : 83 oC
Bentuk : Cairan bening Titik leleh : - 2 oC Titik didih : 327 oC
Kestabilan : Stabil, bereaksi secara eksotermis, bahan mudah terbakar
Toksisitas : Sangat korosif, menyebabkan luka bakar serius, iritasi mata dan kulit
5. Natrium Bikarbonat
Sinonim : Soda bikarbonat, sodium hidrogen bikarbonat Rumus molekul : NaHCO3
Bentuk : Kristal putih Titik leleh : 50 oC Densitas : 2,16 gr/cm3 Kestabilan : Stabil