1
Substitusi Elektrofilik Aromatik: Pembuatan Asam Pikrat
Nuur Indah Wulan Sari (1406557094), Larassati Denaputri (1406603176), Arbhyando Tri Putrananda (1406529784)
Departemen Kimia, Fakultas MIPA, Universitas Indonesia Kampus UI Depok, 16424, Depok, Jawa Barat, Indonesia
E-mail: nuurindahws@gmail.com Abstrak
Reaksi pembuatan Asam Pikrat yang terjadi merupakan reaksi nitrasi yang menghasilkan asam pikrat sebagai turunan (derivative) dari fenol, dimana reaksi nitrasi ialah penggabungan satu atau lebih gugus nitro (-NO2) yang terikat pada karbon sebagai senyawa nitroaromatik. Gugus OH pada fenol merupakan gugus pengaktivasi cincin benzena dan merupakan gugus penunjuk orto dan para (Gugus Aktivasi Kuat), sehingga senyawa asam pikrat memiliki 3 gugus NO2 pada posisi orto dan para. Tujuan dari pecobaan ini selain untuk mengetahui sintesis asam pikrat dari fenol, juga untuk mengetahui mekanisme reaksi yang terjadi pada sintesis asam pikrat, memahami konsep dasar dari reaksi reaksi substitusi elektrofilik aromatik. Metode Substitusi Elektrofilik merupakan reaksi penggantian pada atom hidrogen suatu aromatik oleh suatu elektrofil. Hasil yang diperoleh ialah Asam Pikrat berbentuk padatan kristal berwarna kuning, didapatkan massa Asam Pikrat murninya sebesar 1,93 gram. Dengan % Yield massa dari perhitungannya sebesar 15,87 % dan % KR sebesar 84,12 %
Kata kunci: asam pikrat, fenol, asam nitrat, asam sulfat pekat, substitusi elektrofilik
1. PENDAHULUAN
Asam Pikrat pertama kali dibuat oleh Woulff tahun 1771, dipakai sebagai zat warna kuning untuk sutra dan wol. Kristal padat berwarna kuning ini adalah salah satu fenol yang paling asam dan
vinylogous untuk asam nitrat. Namanya berasal dari Yunani (pik ‘ros), yang berarti “pahit”, yang
mencerminkan rasa pahit. Pada tahun 1885 bangsa Perancis menggunakan sebagai bahan peledak dengan nama melinit dan tahun 1888 Inggris memakainya dengan nama liddyt.
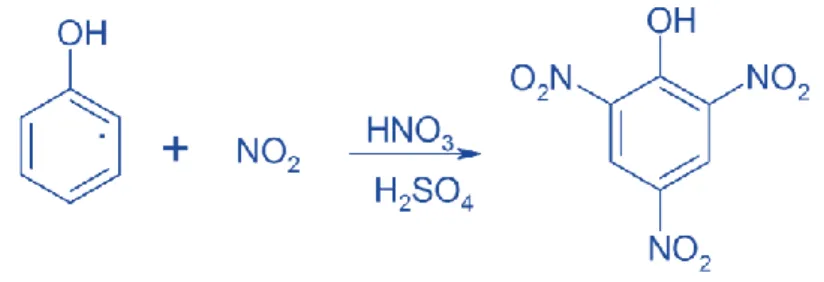
Asam pikrat adalah senyawa kimia yang bersifat eksplosif. Terbentuk karena reaksi antara fenol dan asam nitrat hingga menghasilkan 2,4,6-trinitrofenol. Secara fisik, asam pikrat berupa kristalin kuning dan sangat beracun. Asam pikrat dapat disintesis secara substitusi elektrofilik dari fenol. Reaksi substitusi elektrofilik aromatik. melipati pemindahan atom hidrgoen (proton) aromatic oleh suatu spesi elektrofilik. Substitusi elektrofilik aromatik meliputi pemindahan atom hidrogen (proton) aromatik oleh suatu spesi elektrofilik. Pembuatan asam pikrat didasari oleh reaksi substitusi elektrofilik dengan menambahkan fenol dan HNO3 serta H2SO4 ke dalam campurannya.
Reaksinya :
Gambar 1. Reaksi Pembentukan Asam Pikrat
Sumber Gambar : http://www.academia.edu/10857048/reaksi_pembentukan_asam_pikrat
2. TINJAUAN PUSTAKA
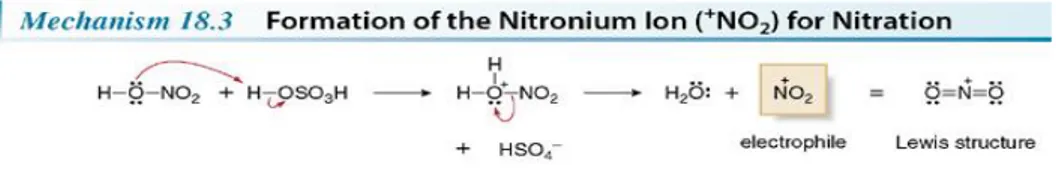
Reaksi yang terjadi merupakan reaksi nitrasi yang menghasilkan asam pikrat sebagai turunan (derivative) dari fenol. Reaksi nitrasi adalah penggabungan satu atau lebih gugus nitro (-NO2) yang terikat pada karbon sebagai senyawa nitroaromatik atau nitroparafin. Dan juga bisa terjadi pada oksigen sebagai senyawa nitrat ester maupun pada nitrogen sebagai senyawa nitramina. Reaksi Pembentukan Nitrasinya, yaitu :
2
Gambar 2. Reaksi Nitrasi
Sumber gambar : Smith, Janice G. 2011. Organic Chemistry, Third Edition. New York : McGraw-Hill
Proses reaksi sebagai subtitusi atom hidrogen, reaksi nitrasi juga bisa berlangsung dengan subtitusi atom atau gugus lain seperti, halida, sulfonat dan asetil. Reaksi nitrasi adalah salah satu reaksi yang penting dalam industri sintesa bahan organik. Garis besar penggunaannya adalah bahan pelarut (solvent), pewarna, farmasi, peledak, maupun bahan antara untuk produk lebih lanjut (Lukman Arifin, dkk. 2013). Sementara yang dimaksud reaksi substitusi elektrofilik adalah reaksi paling utama dari senyawa aromatik dimana elektrofilik (E+) akan bereaksi dengan cincin aromatik dengan mengantikan
satu atom hidrogen.
Berikut ini reaksi substitusi elektrofilik secara umum :
Fenol merupakan senyawa yang sangat reaktif terhadap reaksi substitusi elektrofilik, dikarenakan adanya pasangan elektron bebas (PEB) tak berikatan pada gugus hidroksil yang dapat membentuk kompleks sigma dengan cincin aromatik.
Gambar 3. Fenol
Sumber Gambar : Smith, Janice G. 2011. Organic Chemistry, Third Edition. New York : McGraw-Hill
Gugus hidroksil juga merupakan penunjuk orto-para, dimana gugus hidroksi merupakan gugus yang dapat mengakibatkan cincin benzena menjadi lebih reaktif karena adanya gugus OH sebagai donor Pasangan Elektron Bebas (PEB) yang menyebabkan cincin benzene menjadi lebih stabil saat terjadinya resonansi (Muatan yang beresonansi terstabilkan oleh gugus donor pada penyerangan di posisi Orto dan Para oleh Elektrofil). Berikut Resonansinya :
Gambar 4. Resonansi Orto Para
Sumber Gambar : Smith, Janice G. 2011. Organic Chemistry, Third Edition. New York : McGraw-Hill
Cincin benzene menjadi lebih reaktif dan biasa dinamakan dengan gugus aktivasi. Sementara gugus yang mengakibatkan cincin benzena kurang reaktif dinamakan gugus deaktivasi. Gugus hidroksi merupakan gugus pengaktivasi yang sangat kuat, sehingga gugus tersebut mengarahkan orientasi penyerangan reaksi substitusi elektrofilik pada posisi orto-para.
3 Asam pikrat adalah senyawa kimia secara resmi disebut 2,4,6 - trinitrophenol ( TNP ). Kristal ini kuning padat adalah salah satu yang paling fenol asam dan vinylogous untuk asam nitrat. Seperti senyawa yang sangat ternitrasi lain seperti TNT, asam pikrat adalah bahan peledak. Namanya berasal dari πικρος Yunani (pik ' ros), yang berarti "pahit", yang mencerminkan rasa pahit nya.Penggunaan utamanya adalah sebagai bahan peledak. Pikrat juga telah digunakan dalam pengobatan (antiseptik , membakar perawatan), pewarna, dan sebagai agen kimia.
Gambar 5. Asam Pikrat
Sumber Gambar : https://en.wikipedia.org/wiki/Asam_pikrat
Senyawa kimia asam nitrat (HNO3) adalah sejenis cairan korosif yang tak berwarna, dan
merupakan asam beracun yang dapat menyebabkan luka bakar. Larutan asam nitrat dengan kandungan asam nitrat lebih dari 86% disebut sebagai asam nitrat berasap, dan dapat dibagi menjadi dua jenis asam, yaitu asam nitrat berasap putih dan asam nitrat berasap merah. (Nitric Acid Fact)
Gambar 4. Asam Nitrat
Sumber Gambar : https://en.wikipedia.org/wiki/asam_nitrat
Asam sulfat, H2SO4, merupakan asam mineral (anorganik) yang kuat. Zat ini larut
dalam air pada semua perbandingan. Asam sulfat mempunyai banyak kegunaan dan merupakan salah satu produk utama industri kimia. Kegunaan utamanya termasuk pemrosesan bijih mineral, sintesis kimia, pemrosesan air limbah dan pengilangan minyak. (International Chemical Safety Card 0362)
Gambar 5. Asam Sulfat
Sumber gambar : https://en.wikipedia.org/wiki/asam_sulfat
Etanol juga biasa disebut etil alkohol, minum alkohol, atau hanya alkohol adalah jenis utama dari alkohol ditemukan dalam minuman beralkohol, yang dihasilkan oleh fermentasi gula oleh ragi. Ini adalah neurotoksik obat psikoaktif dan salah satu obat rekreasi yang paling tua yang digunakan oleh manusia. Hal ini dapat menyebabkan keracunan alkohol ketika dikonsumsi dalam jumlah yang cukup. Etanol bersifat volatile, mudah terbakar, cairan tidak berwarna dan sedikit berbau. Hal ini digunakan sebagai antiseptik, pelarut, bahan bakar , dan, karena titik beku yang rendah, menjadi cairan aktif dalam termometer pasca - merkuri. Rumus struktural, CH3CH2OH-, sering disingkat sebagai C2H5OH, C2H6O
atau EtOH. (Brust, 2010)
Gambar 6. Etanol
Sumber gambar : https://en.wikipedia.org/wiki/etanol
3. METODE PERCOBAAN
Menyiapkan labu bulat, masukkan fenol 5 gram, tambahan sama sulfat pekat 15 ml, kocok-kocok, panaskan campuran dalam pemanas air mendidih selama 45 menit , amati perubahan campuran menjadi semakin jernih, yaitu terbentuknya asam fenolsulfonat. Dinginkan dengan icebath,tambahkan dengan hati-hati asam nitrat pekat 15 ml,amati perubahan cairan menjadi semakin kental,segera dilakukan pengocokan selama 1-2 menit akan terbentuk gas kemerahan (nitrogen oksida) dan cairan akan berubah menjadi merah. Panaskan kembali campuran dalam pemanas air mendidih selama 1,5 jam lagi, disertai kadang-kadang dengan pengocokan, biarkan dingin, setelah dingin masukan ke dalam ice bath 10c dan menambahkan air sebanyak 40 ml,dinginkan campuran tersebut dengan ice bath hingga
4 larutan berwarna kuning, saring dengan buchner dengan mencuci dengan air dingin, terbentuk endapan kuning. Memindahkan Kristal yang diperoleh. Rekristalisasikan dengan melarutkan kembali dengan air:etanol (2:1)sampai tepat larut.
(a) (b) (c) (d) (e)
(f) (g)
Gambar (a) pemanas fenol dan asam sulfat pekat (b)pendinginan fenol dan asam sulfat pekat
(c) setelah penambahan asam nitrat (d) setelah gas NO2 hilang (e) proses pendinginan dalam ice bath
(f) kristal yang diperoleh
(g) penyaringan menggunakan buchner dan pencucian dengan etanol:air 3.1 Alat dan Bahan
Labu bulat
Penangas air (waterbath) Corong Buchner
Bahan:
Fenol
Asam sulfat pekat Asam nitrat
3.2 Metode Perhitungan
Persentase yield pada percobaan ini dapat ditentukan dengan menggunakan rumus sebagai berikut: % yield = massa percobaan
massa literatur X 100%
Kesalahan relatif pada percobaan ini dapat ditentukan dengan menggunakan rumus sebagai berikut: % Kr = massa percobaan–massa teoritis
massa teoritis X 100%
Massa teoritis dapat dihitung dengan menggunakan stoikiometri reaksi.
4. HASIL DAN PEMBAHASAN
4.1 Perhitungan Massa, Kesalahan Relatif, dan % Yield dari Asam Pikrat a. Perhitungan massa teoritis
Massa fenol = 5 gram Volume HNO3 = 15 ml
Mr fenol = 94 gr/mol Massa jenis HNO3 = 1.42 gr/ml
Volume H2SO4 = 15 ml Mr HNO3 = 63 gr/mol
Massa jenis H2SO4 = 1.84 gr/ml Mr asam pikrat = 229.1 gr/mol
Mr H2SO4 = 98 gr/mol
Menentukan massa asam pikrat secara teoritis Fenol
5 Mol fenol = 𝑚𝑎𝑠𝑠𝑎 𝑓𝑒𝑛𝑜𝑙 𝑀𝑟 𝑓𝑒𝑛𝑜𝑙 = 5 𝑔𝑟𝑎𝑚 94𝑚𝑜𝑙𝑔𝑟 = 0.0531 𝑚𝑜𝑙 H2SO4 Mol H2SO4 = 𝑚𝑎𝑠𝑠𝑎 𝑗𝑒𝑛𝑖𝑠 𝑥 𝑣𝑜𝑙𝑢𝑚𝑒 𝑀𝑟 = 1.84𝑔𝑟 𝑚𝑙 𝑥 15 𝑚𝑙 98 𝑔𝑟/𝑚𝑜𝑙 = 0.281 𝑚𝑜𝑙 HNO3 Mol HNO3 = 𝑚𝑎𝑠𝑠𝑎 𝑗𝑒𝑛𝑖𝑠 𝑥 𝑣𝑜𝑙𝑢𝑚𝑒 𝑀𝑟 = 1.42𝑔𝑟 𝑚𝑙 𝑥 11 𝑚𝑙 63𝑚𝑜𝑙𝑔𝑟 = 0.338 𝑚𝑜𝑙
Reaksi yang terjadi dalam percobaan
HNO3 + H2SO4 HSO4- + NO2+ + H2O
M 0.338 mol 0.281 mol
B 0,281 mol 0.281 mol 0.281 mol 0,281 mol 0.281mol
S 0.0602 mol − 0.281 mol 0.281 mol 0.281 mol
Mencari massa teoritis dari asam pikrat
M 0.0531 mol 0.281 mol
B 0.0531 mol 0.159 mol 0.0531 mol
S - 0.122 mol 0.0531 mol
Dengan demikian diperoleh massa teoritis dari asam pikrat untuk kemudian dibandingkan dengan hasil percobaan yang didapatkan, yaitu ;
Massa asam pikrat teoritis = mol x Mr = 0.0531 mol x 229.1 gr/mol = 12,16 gr b. Perhitungan Massa Percobaan
Gambar. Massa endapan dan massa kertas saring Dari percobaan didapatkan massanya :
Massa Endapan + Kertas Saring = 2,93
Pada percobaan didapatkan massa Asam Pikrat = (massa kertas saring + endapan) – (massa kertas saring) = (2,93 gr – 1,0 gr) = 1,93 gr HO phenol + 3 NO2+ NO2 OH NO2 NO2
6
% KR massa
= |
𝑚𝑎𝑠𝑠𝑎 𝑝𝑒𝑟𝑐𝑜𝑏𝑎𝑎𝑛−𝑚𝑎𝑠𝑠𝑎 𝑡𝑒𝑜𝑟𝑖𝑡𝑖𝑠 𝑚𝑎𝑠𝑠𝑎 𝑡𝑒𝑜𝑟𝑖𝑡𝑖𝑠| x 100%
= |
1,93 𝑔 – 12,16 𝑔 12,16 𝑔| x 100%
= 84,12%
% Yield massa
=
𝑚𝑎𝑠𝑠𝑎 𝑝𝑒𝑟𝑐𝑜𝑏𝑎𝑎𝑛 𝑚𝑎𝑠𝑠𝑎 𝑡𝑒𝑜𝑟𝑖𝑡𝑖𝑠x 100%
=
1,93 𝑔 12,16 gx 100%
= 15,87 %
4.2 PembahasanPercobaan kali ini dilakukan pembuatan asam pikrat. Percobaan ini bertujuan untuk mengetahui cara mensintesis asam pikrat dari fenol, asam nitrat dan asam sulfat, mengetahui mekanisme reaksi yang terjadi pada sintesis asam pikrat, memahami konsep dasar dari reaksi reaksi substitusi elektrofilik aromatik. Prinsip kerja pada percobaan ini adalah fenol dioksidasi oleh asam nitrat dalam suasana asam. Reaksi yang terjadi adalah reaksi nitrasi yang menggunakan peraksi asam nitrat dengan katalis asam sulfat pekat membentuk senyawa nitro benzena.
Senyawa aromatik adalah senyawa hidrokarbon yang memiliki sifat-sifat yang mirip dengan sifat-sifat kimia dan benzena. Reaksi pada senyawa hidrokarbon aromatik cenderung merupakan reaksi substitusi elekrofilik. Asam pikrat (2,4,6-trinitrofenol) adalah suatu turunan dan fenol. Reaksi pembentukan asam pikrat dari fenol tidak dapat diperoleh secara langsung dari asam nitrat dengan fenol, karena fenol terlalu sensitif terhadap reaksi oksidasi. Untuk memperoleh hasil baik, maka dalam prosesnya fenol harus terlebih dahulu disulfonasi untuk pembentukkan asam, 2,4-disulfonat dan kemudian ditambahkan asam nitrat untuk reaksi campuranya. Gugus asam sulfonat dapat melindungi fenol dan oksidasi dari asam nitrat dan baru kemudian gugus-gugus asam tersebut akan pelan-pelan digantikan oleh gugus nitro.
Mekanisme yang terjadi adalah sebagai berikut.
Berdasarkan mekanisme reaksi yang terjadi, gugus NO2 yang masuk ke dalam fenol berada pada
posisi orto dan para. Hal ini dikarenakan gugus OH pada fenol merupakan gugus pengaktivasi cincin benzema dan merupakan penunjuk posisi orto dan para, sehingga senyawa asam pikrat memiliki 3 gugus NO2 pada posisi orto dan para.
Langkah pertama yang dilakukan adalah mencampurkan fenol dan asam sulfat pekat dalam labu bulat lalu dipanaskan dalam water bath untuk mempercepat proses reaksi. Fenol berfungsi sebagai reagen utama yang mempunyai cincin aromatik dan gugus –OH. Gugus –OH merupakan gugus pendorong elektron yang akan mengaktifkan inti benzene, sekaligus pengaruh posisi orto-para. Asam sulfat pekat berfungsi sebagai reaktan yang akan melindungi posisi para pada fenol sekaligus mengurangi kereaktifan fenol membentuk 4-hidroksi benzenasulfonat dan sebagai katalis yang akan mengubah asam nitrat menjadi ion nitronium. Asam sulfat akan kembali terbentuk setelah atom hidrogen yang berikatan dengan cincin benzene terlepas. Kemudian larutan akan berubah warna menjadi lebih bening yang menandakan bahwa telah terbentuk asam fenolsulfonat.
Langkah selanjutnya adalah mendinginkan larutan sambil ditetesi asam nitrat pekat. Pendinginan dilakukan karena reaksi yang terjadi bersifat eksoterm. HNO3 pekat berfungsi sebagai reaktan penitrasi
yang akan masuk ke dalam cincin benzene dalam bentuk ion nitroniumnya. Ion nitronium terbentuk akibat presensi dari asam sulfat. Ketika penambahan asam nitrat menghasilkan uap kemerahan yaitu gas
OH
+
NO2 H OH NO2 OH :OH H NO2+
H OH NO2 O H H OH NO2+
-H3O+ NO2 NO2 OH O2N No2 No2+
7 NO2 dari reaksi antara asam p-fenolsulfonat dengan asam nitrat. Selanjutnya campuran dipanaskan sambil
dikocok sampai gas NO2 hilang yang ditandai dengan timbulnya uap berwarna kuning.
Langkah selanjutnya adalah menambahkan aquades dan didinginkan hingga terbentuk endapan lalu disaring dan dicuci dengan aquades dingin. Aquades berfungsi sebagai pelarut yang akan menarik pengotor polar yang menempel pada kristal asam pikrat sehingga didapatkan kristal yang murni. Selanjutnya melakukan rekristalisasi dengan penambahan air : etanol (2:1). Rekristalisasi adalah proses pemurnian suatu kristal dengan melarutkan kristal dengan pelarut mendekati titik didih pelarut lalu dinginkan untuk kembali membentuk kristal. Penggunaan air dan etanol ini karena kedua larutan tersebut mempunyai perbedaan kepolaran sehingga dapat menghilangkan pengotor. Selain itu takaran 2:1 dengan komposisi 2 untuk air dan 1 untuk etanol dilakukan agar stabil kadar antara air dan etanol. Disamping itu juga agar tidak banyak kristal asam pikrat yang larut ketika proses rekristalisasi karena asam pikrat larut dalam etanol. Kristal kemudian dikeringkan dan ditimbang. Kristal yang terbentuk berwarna putih kekuningan yang disebut dengan asam pikrat.
Reaksi yang terjadi pada pembuatan asam pikrat ini adalah sebagai berikut:
Dalam percobaan ini didapatkan massa Asam Pikrat murninya sebesar 1,93 gram. Dengan %
Yield massa dari perhitungannya sebesar 15,87 % dan % KR sebesar 84,12 %. Terjadinya kesalahan
diakibatkan oleh beberapa hal diantaranya kesalahan pengukuran dan pembacaan skala peralatan, kurang sterilnya reagen yang digunakan, kurang sterilnya peralatan yang digunakan, terdapat pengotor ketika melakukan reaksi, kurang lamanya waktu pemanasan sehingga kristal yang dihasilkan kurang sempurna.
5. KESIMPULAN
Pada percobaan kali ini dilakukan sintesis Asam Pikrat dari bahan awal Fenol. Reaksi yang terjadi merupakan reaksi nitrasi yang menghasilkan asam pikrat sebagai turunan (derivative) dari fenol. Prinsip reaksi yang digunakan, yaitu reaksi nitrasi. Reaksi nitrasi adalah penggabungan satu atau lebih gugus nitro (-NO2) yang terikat pada karbon sebagai senyawa nitroaromatik atau nitroparafin
Fenol merupakan senyawa yang sangat reaktif terhadap reaksi substitusi elektrofilik, dikarenakan adanya pasangan elektron bebas (PEB) tak berikatan pada gugus hidroksil yang dapat membentuk kompleks sigma dengan cincin aromatik. Cincin benzene menjadi lebih reaktif dan biasa dinamakan dengan gugus aktivasi. Sementara gugus yang mengakibatkan cincin benzena kurang reaktif dinamakan gugus deaktivasi.
Didapatkan massa Asam Pikrat murninya sebesar 1,93 gram. Dengan % Yield massa dari perhitungannya sebesar 15,87 % dan % KR sebesar 84,12 %.
UCAPAN TERIMA KASIH
Terima kasih saya ucapkan kepada rekan praktikum saya, Larasati Denaputri , Arbhyando Tri Putrananda, Yudis Ananda, Shafira Kuamila, dan Syahrul Rizky yang telah membantu dan bekerja sama
8 dengan baik, serta terima kasih untuk Kak Ladya dan kak Rendi, sebagai asisten laboratorium atas bimbingan, bantuan, dan petunjuk yang diberikan selama praktikum sehingga saya dan rekan praktikum saya dapat menyelesaikan praktikum Kopling Radikal ini dengan baik. Juga saya ucapkan terima kasih untuk para dosen dan laboran yang telah mengawasi jalannya praktikum.
DAFTAR PUSTAKA
Fessenden & Fessenden. 1992. Kimia organik. Jakarta : PT. Gramedia.
Groggin, P.H. 1985. Unit Processes in Organic Synthesis. Mac, Grow Hill Book Company Inc. New York.
Harvey, David. 2000. Modern Analytical Chemistry. Singapore: Mc Graw Hill International Ed. Riswiyanto. 2009. Kimia organik. Jakarta : Erlangga
Skoog DA, West DM, Holler FJ. 1996. Fundamentals of Analytical Chemistry. 7th edition. New York: Saunders College Publishers.
Tim KBI Organik. 2013. Praktikum Sintesis Kimia Organik. Depok : FMIPA UI. RIWAYAT PENULIS