Laporan Praktikum Sintesis Kimia Organik Tahun Ajaran 2015/2016 - I
Sintesis Senyawa 1,1-bis-2-naftol
Nurun Nisa Maulida, Calvin Eldona, Riska Tamala
Departemen Kimia, Fakultas MIPA, Universitas Indonesia Kampus UI Depok, 16424, Depok, Jawa Barat, Indonesia
E-mail : nurunisamaulida@gmail.com
Abstrak
Reaksi penggandengan (kopling) merupakan reaksi penggabungan dua senyawa aromatis dengan adanya radikal bebas pada komponen reagen dengan katalis besi (III) klorida. Untuk mempercepat terjadinya reaksi kopling ini, dibutuhkan pemasanan. Dinginkan dengan air es agar proses kristalisasi berjalan cepat. Hasilnya didapatkan serbuk putih. 1,1-bis-2-naftol.
Kata Kunci : 2-naftol, kopling, reaksi, penggandengan, aromatis, katalis
……… 1. PENDAHULUAN
Percobaan ini akan dilakukan sintesis senyawa 1,1-bis-2-naftol dari 2-naftol. Tujuannya agar kita dapat mengetahui mekanisme dari sintesis senyawa 1,1-bis-2-naftol melalui reaksi kopling radikal yang terjadi, mekanisme sintesisnya, serta fungsi-fungsi dari reagen yang digunakan dalam sintesis senyawa ini.
2. TINJAUAN PUSTAKA
2.1. Prinsip Reaksi Penggandengan (Reaksi Kopling)
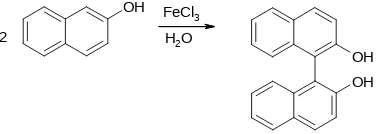
Prinsip dasar pada percobaan ini yaitu reaksi kopling radikal. Reaksi kopling radikal merupakan reaksi penggabungan dua senyawa aromatis dengan adanya radikal bebas pada komponen reagen.Reaksi kopling, ataupun penggandengan oksidatif merupakan istilah dalam kimia organik yang merujuk pada sekelompok reaksi kimia organologam di mana dua radikal hidrokarbon digandengkan (kopling) dengan bantuan katalis yang mengandung logam. Banyak reaksi penggandengan melibatkan senyawa turunan fenol. Dalam percobaan ini bi naftol
merupakan produk reaksi penggandengan 2-naftol menggunakan besi (III) klorida.
Gambar 1. Reaksi penggabungan 2-naftol (diambil dari laporan Hanif Mubarok)
3. METODE PERCOBAAN 3.1. Alat dan Bahan
a. Tabung reaksi a. 2-Naftol
b. Beaker glass b. Besi (III) Klorida
c. Penyaring Buchner c. Aquades
d. Mortar dan alu
OH
2
FeCl3 H2O
OH OH
m b
s
9,98 x 10-3
9,98 x 10-3
0
4,99 x 10-3
2
3.2. Sintesis 1,1-bis-2-naftol
Pertama timbang 1,5 gram 2-naftol dan 0,5 gram besi (III) klorida. Campurkan 2-naftol, besi (III) klorida dan 2 tetes air di dalam mortar. Haluskan campuran dengan menggunakan mortar dan alu selama 20 menit, kemudian diamkan campuran ini selama 2 jam dengan kondisi terututp. Larutkan dengan 20 mL aquades ke dalam beaker 100 mL dan mendidihkannya selama 10-15 menit di atas hot plate. Dinginkan campuran dan saring padatan yang terbentuk.
3.3. Penentuan Yield Reaksi dan Kesalahan Relatif Massa 1,1-bis-2-naftol Percobaan
Mol 1,1-bis-2-naftol Teoritis
%Yield =
|
massa percobaan
massateoritris
|
x
100
% Kesalahan =
|
massa teoritris
−
massa hasil percobaan
massa teoritris
|
x
100
4. HASIL DAN PEMBAHASAN 4.1. Pembuatan 1,1-bis-2-naftol
Dalam percobaan ini, mula-mula ditimbang 1,5 gram 2-naftol lalu dicampurkan dengan 0,5 gram FeCl3 di dalam mortar. Lalu, tambahkan 2 tetes air ke dalam campuran tersebut dihaluskan dengan alu selama 20 menit, setelah selesai diamkan selama 1,5-2 jam. Kemudian, pindahkan dalam beaker glass dan larutkan dengan 20 mL aquades, panaskan di atas hot plate untuk mempercepat terjadinya reaksi kopling. Dinginkan dalam suhu kamar, lalu untuk mempercepat terjadinya proses kristalisasi dinginkan beaker glass yang berisi campuran di dalam bak es. 4.2. Mekanisme Reaksi Kopling
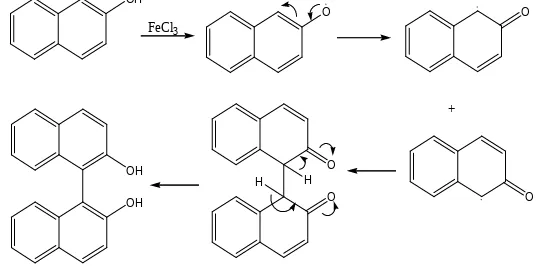
Reaksi kopling radikal merupakan reaksi penggabungan dua senyawa aromatis dengan adanya radikal bebas pada komponen reagen. Komponen radikal bebas pada senyawa aromatis ialah atom dengan jumlah Alectron yang tidak octet, maka bersifat sangat reaktif dan tidak stabil sehingga dapat membentuk ikatan. Mekanisme reaksi yang terjadi secara keseluruhan dari percobaan ini adalah sebagai berikut.
OH
FeCl3
O O
+
O O
O H H OH
OH
Gambar 2. Mekanisme rekasi kopling (diambil dari laporan praktikum Hanif Mubarok)
Massa zat = (Massa kertas saring + zat) – Massa kertas saring
Mol 2-naftol =
massa
2
−
naftol
3
4.3. Pengolahan Data
Massa 1,1-bis-2-naftol Percobaan
Mol 1,1-bis-2-naftol Teoritis
Reaksi yang terjadi
OH
2
FeCl3 H2O
OH OH
m b
s
9,98 x 10-3
9,98 x 10-3
0
4,99 x 10-3
4,99 x 10-3
M : 9.988 x 10-3 mol
-R :
9.988 x 10-3 mol 4.994 x 10-3 mol
S : - 4.994 x 10-3 mol
Massa 1,1-bis-2-naftol Teoritis
Massa = n x Mr = 4.994 x 10-3 mol x 286.32 gram/mol = 1.43 gram
%Yield =
|
massa percobaan
massateoritris
|
x
100
=
|
1.4
1.43
|
x
100
= 97.9%% Kesalahan =
|
1.43
−
1.4
1.43
|
x
100
= 2.1%4.4. Fungsi Reagen
Dalam percobaan ini digunakan beberapa reagen diantaranya 2-naftol, FeCl3 dan aquades. Fungsi dari 2-naftol adalah sebagai bahan baku utama pembuatan 1,1-bis-2-naftol dan FeCl3 befungsi sebagai katalis logam dan penangkap proton dari 2-naftol sehingga terbentuk radikal. Aquades berfungsi sebagai pelarut dan larutan pencuci.
4.5. Analisis Kesalahan
Massa zat = (Massa kertas saring + zat) – Massa kertas saring
= 2,19 gram – 0,79 gram
= 1,4 gram
Mol 2-naftol =
massa
2
−
naftol
Mr
2
−
naftol
1.44
gram
-4
Terdapat presentase kesalahan relative sebesar 2.1% dalam percobaan ini. Hal ini dapat terjadi karena beberapa hal diantaranya, ketika menghaluskan senyawa 2-naftol dan FeCl3 di dalam mortar dan dipindahkan ke dalam beaker glass campuran tersebut banyak yang masih tertinggal di dalam mortar dan massanya menjadi berkurang. Pemanasan merupakan katalis yang dapat mempercepat reaksi kopling, dalam hal ini pemanasan mungkin belum merata, sehingga reaksi kopling berjalan kurang baik serta proses kristalisasi yang kurang sempurna.
5. KESIMPULAN
Pada percobaan ini didapatkan padatan 1,1-bis-2-naftol dengan cara mereaksikan 2-naftol dengan katalis FeCl3 proses pemanasan. Prinsip dasar pada percobaan ini yaitu reaksi kopling radikal. Reaksi kopling radikal merupakan reaksi penggabungan dua senyawa aromatis dengan adanya radikal bebas pada komponen reagen. Reagen 2-naftol merupakan reagen utama agar terjadinya reaksi kopling, FeCl3 berfungsi sebagai katalis logam dan penangkap proton 2-naftol dan aquades sebagai pelarut dan pencuci endapan dari kotoran. Hasilnya, didapatkan massa 1,1-bis-2-naftol yang diperoleh yaitu 1.4 gram dengan % kesalahan relatif sebesar 2.1 % dan % Yield percobaan ini sebesar 97,9%.
UCAPAN TERIMA KASIH
Puji dan syukur atas pertolongan Allah Yang Mahakuasa atas pertolongan dan karunia-Nya, sehingga saya bisa menyelesaikan laporan praktikum ini dengan baik, benar dan tepat waktu. Saya juga mengucapkan terima kasih kepada assisten laboratorium, laboran beserta dosen-dosen kimia organik, atas bantuan mereka saya bisa melakukan praktikum dengan baik dan benar dan juga kepada rekan-rekan kerja saya yaitu Riska, Calvin, Shali, Rahmi dan Tiar. Dalam penulisan laporan ini, saya banyak mendapatkan dukungan dan bantuan baik berupa moril maupun bantuan secara fisik, maka saya ucapkan terima kasih kepada mahasantri PESAN BISA, terutama kepada Deatri dan Tiara yang telah meminjamkan laptopnya. Jazaakumullahu khoyron.
DAFTAR PUSTAKA
Fessenden & Fessenden. 1982
. Organic Chemistry. Ed 3
. Jakarta : Erlangga.
Sykes, Peter. 1989.
Penuntun Mekanisme Reaksi Kimia Organik
. Jakarta : Gramedia.
Tim KBI Kimia Organik.
Diktat Praktikum Sintesis Organik
. Depok : Departemen
Kimia FMIPA UI.