LAPORAN PRAKTIKUM KIMIA ORGANIK (KI2051)
PERCOBAAN 7
PROTEIN DAN KARBOHIDRAT: SIFAT DAN REAKSI KIMIA
Nama : Ganjar Abdillah Ammar
NIM : 11213021
Kelompok : 3
Tanggal Percobaan : 22 Oktober 2014 Tanggal Laporan : 29 Oktober 2014
Asisten : Ni Kadek Yuliartani / 20514012 Stefan Marco Rumengan / 20514048
LABORATORIUM KIMIA ORGANIK
PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
INSTITUT TEKNOLOGI BANDUNG
2014
Protein dan Karbohidrat: Sifat Dan Reaksi Kimia
I. Tujuan Percobaan
1. Menentukan keberadaan gugus hidroksi fenolik pada larutan kasein dan tirosin dengan uji Millon.
2. Menentukan keberadaan gugus α amina bebas pada larutan kasein dan glisin dengan uji Ninhidrin.
3. Menentukan keberadaan sulfur atau belerang pada asam amino sistein dengan uji Sulfur.
4. Menentukan keberadaan gugus amina pada glisin dan kasein dengan uji asam nitrit.
5. Menentukan keberadaan gugus karboksil dan asam amida pada urea dan kasein uji Biuret.
6. Menentukan keberadaan protein yang mengandung asam amino dengan cincin benzena pada kasein dengan uji Xanthoproteat.
7. Menentukan keberadaan karbohidrat pada sampel larutan gula dengan uji Molisch.
8. Menentukan gula pereduksi dari sampel larutan gula dengan uji benedict.
9. Menentukan gula monosakarida atau disakarida pada sampel larutan gula dengan uji Barfoed.
10. Menentukan kandungan glukosa pada sampel larutan gula dengan alat Test-Tape.
2.1. Protein
2.1.1. Penjelasan Protein
Protein merupakan suatu zat makanan yang amat penting bagi tubuh karena zat ini disamping berfungsi sebagai bahan bakar dalam tubuh juga berfungsi sebagai zat pembangun dan pengatur. Protein adalah sumber asam-asam amino yang mengandung unsur-unsur C,H,O,dan N yang tidak dimiliki oleh lemak. Molekul protein mengandung pula fosfor,belerang dan ada jenis protein yang mengandung unsur logam seperti besi dan tembaga (Winarno, 1991).
Untungnya semua protein terdiri atas satu atau lebih polimer yang linier dan bercabang. Monomer yang membuat polimer ini disebut asam amino.dalam kebanyakan protein terdapat 20 jenis asam amino. Asam amino ini terikat menjadi satu rantai dalam jumlah 100 sampai 300 (Kimball, 1992).
Berdasarkan fungsi biologinya protein dibagi menjadi 4 yaitu enzima,proteina pembangunan, proteina kontraktil, proteina pengangkut. Enzima merupakan golongan proteina yang terbesar dan paling besar, proteina pembangunan berfungsi sabagai unsur pembentuk struktur, proteina kontraktil merupakan golongan proteina yang berperan dalam proses gerak dan proteina pengangkut merupakan kemampuan mengikat molekul tertentu dan melakukan pengangkutan berbagai macam zat melalui aliran darah.
Protein berfungsi sebagai unsur pembentuk struktur sel, misalnya dalam rambut, wol,kalogen, jaringan penghubung, membran sel, dan lain-lain. Menurut (Winarno, 1991) protein berfungsi sebagai bahan bakar dalam tubuh juga berfungsi sebagai zat pengatur dan pengatur.
Protein yang larut dalam air akan membentuk ion yang mempunyai muatan positif dan negatif. Proein dapat diendapkan dengan ion logam seperti Hg2+, Fe2+, Cu2+, Pb2+, ion salisilat, pikrat dan sulfosalisilat.
Berdasarkan sifat tersebut protein pada putih telur atau susu dapat digunakan sebagai antidotum atau penawar racun apabila orang keracunan logam berat (Poedjiadi, 2007).
Protein juga mempunyai fungsi khususyaitu protein yang aktif. Beberapa diantaranya adalah enzim yang berperan sebagai biokatalisator, hemoglobin sebagai pengangkut oksigen,hormon sebagai pengatur metabolisme tubuh dan antibodi untuk mempertahankan tubuh dari seranga penyakit.
2.1.2. Pengujian Protein
A. Uji Millon
Asam amino dengan gugus fenolik akan dapat dideteksi oleh reagen Millon yang merupakan larutan merkuro dan merkuri nitrat. Hasil positif akan ditunjukkan dari endapan merah setelah dipanaskan. (Winarno 1992).
Uji paling umum untuk menentukan adanya protein dari suatu bahan. Semua asam amino dan peptida yagn mengandung gugus α-amino bebeas memberikan reaksi ninhidrin positif dengan menunjukkan reaksi terbentuknya warna biru sampai ungu.
C. Uji Sulfur
Untuk mengetahui suatu protein yang mengandung asam amino dengan atom S, misalnya cystein dan methionin. Pada uji ni dalam suasanan basa,Pb asetat aka bereaksi dengan S dari asam amino membentuk garam PbS berwarna hitam. (Winarno 1992).
D. Uji Asam Nitrit
Bertujuan untuk mengetahui adanya gugus amina bebas pada asam amino dan protein yang ditandai dengan terbentuknya gan nitrogen. Reaksi asam nitrit merupakan reaksi yang menunjukkan adanya amina primer pada pengujian protein.
E. Uji Biuret makanan yang mengandung protein akan berubah menjadi berwarna ungu. Pada uji biuret tidak spesifik terhadap protein dikarenakan dipanaskan dehan HNO3 pekat akan dihasilkan endapan putih yang
2.2. Karbohidrat aldehida atau palihidroksil-keton atau senyawa-senyawa yang diturunkan dari gugus ini (Sudarmadji, 1989). Berbagai senyawa yang termasuk kelompak karbohidrat mempunyai molekul yang berbeda-beda ukurannya, yaitu dari senyawa yang sederhana yang mempunyai berat molekul 500.000 bahkan lebih. Berbagai senyawa itu dibagi dalam tiga golongan yaitu golongan monosakarida,golongan oligosakarida dan golongan polisakarida (Poedjiadi, 1994).
Monosakarida hanya sedikit monosakarida yang terdapat di alam. Kebanyakan didapat dari hasil hidrolisa atau fermentasi dari harbohidrat kompleks (Tillman, 1991). Monosakarida sering disebut gula sederhana dan larut dalam air sering dibagi atas dasar jumlah atom karbon menjadi sub-golongan monosakarida atau gula sederhana. Terdiri dari hanya satu unit polihidroksi aldehid atau keton. Monosakarida yang paling banyak di alam adalah D-glukosa 6-karbon (Lehninger, 2000).
bersifat pereduksi karena gugus fungsionalnya yaitu gugus karbonil yang masih reaktif (bebas), (Hawab 2004).
Polisakarida merupakan polimer yang tersusun atas sejumlah besar monosakarida yang bertautan melalui ikatan glikosidik. Fungsi utamanya adalah sebagai komponen struktual atau sebagai bentuk penyimpana energi. Glikoligen ditemukan dalam hewan, serupa dengan pati tetapi mengandung jauh lebih banyak cabang-cabang yang meluas (Kuchel,1990).
Gula pereduksi adalah gula yang nerupakan reduktor, contohnya adalah monosakarida dan disakarida kecuali sukrosa. Sedangkan gula non pereduksi adalah gula yang bukan merupakan reduktor (Sudarmadji,1989). Monosakrida adalah karbohidrat yang tidak dapat dihidrolisis menjadi karbohidrat yang lebih sederhana. Monosakarida ini dapat diklasifikasikan sebagai triosa, tetrosa, pentosa, heksosa, atau heptosa, bergantung pada jumlah atom karbon; dan sebagai aldosa atau ketosa bergantung pada gugus aldehida atau keton yang dimilki senyawa tersebut (Murray dkk, 2009). Sebagian besar monosakarida dikenal sebagai heksosa, karena terdiri atas 6-rantai atau cincin karbon. Atom-atom hidrogen dan oksigen terikat pada rantai atau cincin ini secara terpisah atau sebagai gugus hidroksil (OH). Ada tiga jenis heksosa yang penting dalam ilmu gizi, yaitu glukosa, fruktosa, dan galaktosa. Ketiga macam monosakarida ini mengandung jenis dan jumlah atom yang sama, yaitu 6 atom karbon, 12 atom hidrogen, dan 6 atom oksigen. Perbedaannya hanya terletak pada cara penyusunan atom-atom hidrogen dan oksigen di sekitar atom-atom-atom-atom karbon. Perbedaan dalam susunan atom inilah yang menyebabkan perbedaan dalam tingkat kemanisan, daya larut, dan sifat lain ketiga monosakarida tersebut (Almatsier, 2010).
atom oksigen. Ikatan glikosidik ini biasanya terjadi antara atom C nomor 1 dengan atom C nomor 4 dan membentuk ikatan alfa, dengan melepaskan satu molekul. Hanya karbohidrat yang unit monosakaridanya terikat dalam bentuk alfa dapat dicernakan. Disakarida dapat dipecah kembali menjadi dua molekul monosakarida melalui hidrolisis. Glukosa terdapat pada empat jenis disakarida; monosakarida lainnya adalah fruktosa dan galaktosa (Almatsier, 2010).
2.1.2. Pengujian Karbohidrat
A. Uji Molisch
Reaksi dehidrasi dari karbohidrat dari asam sulfat dan alfa naftol, sehingga dapat teramati senyawa kompleks berwarna ungu. Asam sulfat berfungsi dalam pembentukan senyawa furfural dan sebagai condensation agent. Diperoleh cincin berwarna ungu yang menunjukkan uji positif pada suatu sampel (Soendoro, 2005).
B. Uji Benedict
Reagen benedict adakah larutan CuSO4 yang akan direaksikan
dengan gula pereduksi dalam suasana alkali. Gula pereduksi akan menunjukkan warna endapan merah bata yang merupakan Cu2O
hasil reduksi CuO. Tujuan benedict adalah mendeteksi keberadaan gula pereduksi dari sampel karbohidrat, sedangkan gula pereduksi berupa aldehid dan keton (Soendoro, 2005).
C. Uji Barfoed
D. Uji Hidrolisis Glukosa
Polisakarida maupun disakarida dapat terhidrolisis di dalam larutan asam menjadi monosakarida-monosakarida. Uji kandungan glukosa dilakukan dengan Test-Tape berupa glukotes. Tape ini mengandung enzim glukosa oksidase dan peroksidase serta ortotoluidin. Asam glukonat dan hidrogen peroksida diperoleh dari oksidasi glukosa oleh glukosa oksidase dan hidrogen peroksida akan bereaksi dengan peroksidase menghasilkan oksigen, sedangkan yang membuat level (tingkatan warna) karena orto-toluidin.
III. Data Pengamatan
3.1 Uji Kimia Protein dan Asam Amino 3.1.1 Uji Millon
Tabel 1. Pengamatan uji Millon pada larutan kasein dan tirosin
Tirosin 0.1 1 Warna
Tabel 2. Pengamatan uji ninhidrin pada larutan kasein dan glisin
Substra
Glisin 0.1 1 Bening Warna ungu
gelap
3.1.3 Uji Sulfur
Tabel 3. Pengamatan uji sulfur pada larutan kasein dan sistein
Substra
Sistein 0.1 1 Warna
putih
Warna coklat mendekati hitam
3.1.4 Reaksi dengan Asam Nitrit
A. Pada Larutan Glisin
+ 1 ml NaNO3 5%
Tabel 4. Pengamatan larutan glisin dan HCl pada uji asam nitrit
Substrat Volume Pengamatan Gambar
Awal Akhir
Glisin 1 gram Bening Gelembung
banyak, warna biru muda
HCL 10% 5 ml Bening
Gelembung sedikit, warna tetap
B. Pada Larutan Kasein
Tabel 5. Pengamatan larutan kasein pada uji asam nitrit
Substrat Volume
(ml)
Pengamatan
Gambar
Awal Akhir
Kasein 2 Warna putih Endapan putih
3.1.5 Uji Biuret A. Pada urea
Pereaksi: + 2 ml NaOH 10% + 2-3 tetes CuSO4 2%
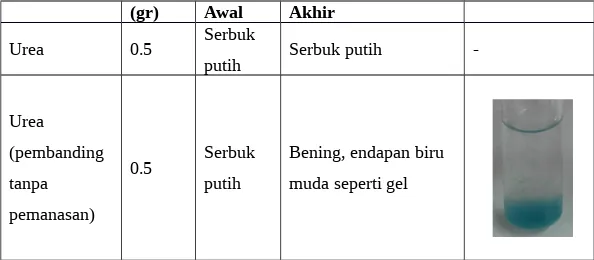
Tabel 6. Pengamatan uji Biuret pada urea yang dipanaskan dan yang tidak dipanaskan
(gr) Awal Akhir
Tabel 7. Pengamatan uji Biuret pada larutan kasein
Substrat Volume
Pereaksi: + 2 ml asam nitrat pekat + NaOH 10%
Tabel 8. Pengamatan uji Xanthoproteat pada larutan kasein
3.2 Uji Kimia Karbohidrat 3.2.1 Uji Molisch
Tabel 9. Pengamatan uji Molisch pada lima sampel karbohidrat: laktosa, glukosa, maltosa, fruktosa dan sukrosa
Substrat Pengamatan Gambar
Laktosa
Putih keruh, ada gelembung, terbentuk 2 fasa cair
Glukosa
Putih keruh, ada gelembung, terbentuk 2 fasa cair
Maltosa
Putih keruh, ada gelembung, terbentuk 2 fasa cair
Fruktosa
Terbentuk 3 fasa dengan cincin ungu ditengah
Sukrosa
3.2.2 Uji Benedict
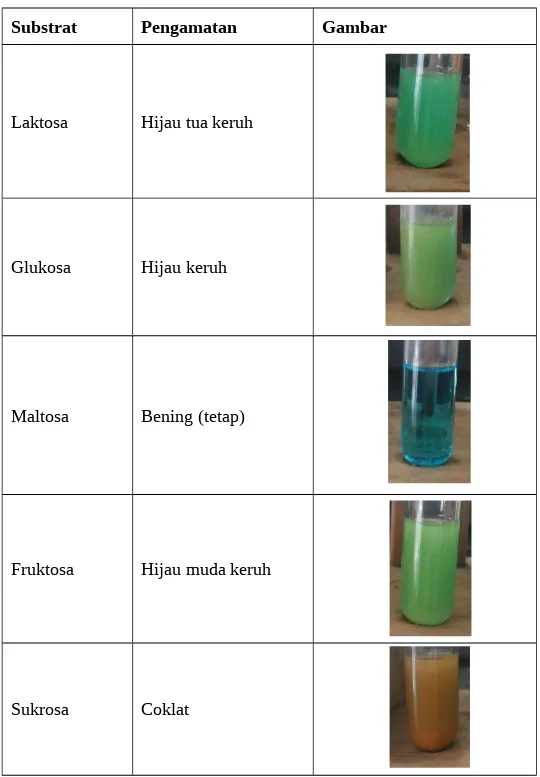
Tabel 10. Pengamatan uji Benedict pada lima sampel karbohidrat: laktosa, glukosa, maltosa, fruktosa dan sukrosa
Substrat Pengamatan Gambar
Laktosa Hijau tua keruh
Glukosa Hijau keruh
Maltosa Bening (tetap)
Fruktosa Hijau muda keruh
Aquades Bening (tetap)
3.2.3 Uji Barfoed
Tabel 11. Pengamatan uji Barfoed pada lima sampel karbohidrat: laktosa, glukosa, maltosa, fruktosa dan sukrosa
Substrat Pengamatan Gambar
Laktosa Biru
Glukosa Endapan merah bata
Maltosa Biru
Sukrosa Biru
3.2.4 Uji Hidrolisis Glukosa
Tabel 12. Pengamatan uji hidrolisis glukosa pada empat sampel karbohidrat: kanji, laktosa, maltosa dan sukrosa
Substrat Pengamatan Gambar
Kanji Biru muda
Laktosa Hijau tosca
Sukrosa Coklat
Gambar 1.
Hasil uji hidrolisis gula dengan test-tape pada larutan kanji, laktosa, maltosa dan sukrosa
IV. Pembahasan
4.1. Uji Kimia Protein dan Asam Amino
4.1.1. Uji Millon
4.1.2. Uji Ninhidrin
Gugus amino bebas dapat dideteksi dengan senyawa ninhidrin dengan hasil warna ungu yang menunjukkan uji berlangsung positif. Didapatkan bahwa kasein dan glisin –berkonsentrasi 0.1 M- yang masing-masing di tetesi 4 tetes ninhidrin 0.1% dan dipanaskan, larutan kasein berubah warna menjadi biru dan larutan glisin menjadi ungu. Hal ini menunjukkan bahwa larutan glisin memiliki asam amino bebas karena uji berlangsung positif dan kasein berwarna biru dongkar (biru gelap) yang menjelaskan bahwa di dalam kasein terdapat asam amino bebas tetapi dengan konsentrasi yang lebih kecil dari pada larutan glisin sendiri. Berdasarkan referensi warna ungu yang muncul disebabkan pembentukan kompleks warna ungu.
4.1.3. Uji Sulfur
Dari hasil pengamatan diperoleh bahwa kasein tidak mengalami perubahan warna (tetap putih) sedangkan sistein mengalami perubahan warna dari warna putih menjadi coklat kehitaman. Hal ini mengindikasikan bahwa sistein mengandung atom sulfur sedangkan kasein tidak mengandung asam amino yang memiliki atom sulfur. Kedua larutan yang berkonsentrasi 0.1 M direaksikan dengan NaOH agar mendenaturasi protein yang akan mengakibatkan ikatan pada atom S terputus dan penambahan timbal asetat 10%. Sehingga memudahkan timbal asetat bereaksi dengan kedua larutan. Warna coklat kehitaman ditimbulkan akibat endapan PbS (timbal sulfida) yang merupakan hasil dari reaksi timbal asetat dengan sistein, sehingga atom sulfur yang terdapat dalam sistein akan berikatan dengan timbal dan asetat berikatan dengan sistein tanpa atom sulfur. PbS inilah yang membuat kompleks berwarna hitam, hasil dari pengujian tidak menunjukkan warna hitam melainkan coklat kehitaman karena kurangnya jumlah tetesan timbal asetat yang akan bereaksi dengan sistein, sehingga tidak semua atom S pada sistein bereaksi dengan timbal asetat.
Reaksi 0.1 gram glisin dengan 5 ml HCl 10% dan NaNO2 5% akan
menghasilkan gas nitrogen (N2) dan rantai asam karboksilat. Gas nitrogen
ini dapat diamati dari hasil reaksi yang muncul selama pengamatan dan juga larutan berubah warna menjadi biru muda. Warna biru muda ini terjadi karena asam amino bereaksi dengan asam klorida membentuk senyawa lain. Sedangkan HCl murni yang direaksikan dengan NaNO2 5%
hanya membuat sedikit gelembung dan berwarna tetap (bening). Sedangkan kasein yang ditambahkan NaNO2 5% akan menghasilkan
endapan putih yang mengindikasikan tidak ada reaksi pada kasein.
4.1.5. Uji Biuret
Uji biuret digunakan untuk menguji adanya ikatan peptida dan protein pada umumnya. Sehingga dari hasip pengamatan terhadap 0.5 gram urea yang direaksikan dengan 2 ml NaOH 10% dan 3 tetes CuSO4 2%
menghasilkan endapan biru seperti gel, awalnya berwarna putih (serbuk). Sedangkan urea yang dipanaskan terlebih dahulu yang selanjutnya direaksikan sama seperti tanpa dipanaskan. Tidak akan bereaksi apa-apa, karena ikatan yang amina yang ada pada urea lepas selama pemanasan menjadi gas nitrogen yang ditunjukkan perubahan kertas lakmus yang berwarna biru. Selanjutnya kasein juga diujikan untuk menentukan apakah merupakan sebuah protein, yaitu dengan penambahan 2 ml air suling dan 2 tetes CuSO4 2% menghasilkan produk yang sama dengan urea diatas tetapi
hanya saja endapannya berwarna biru muda. Warna ini disebabkan oleh Cu2+ beraksi dengan 4 asam amino sehingga membentuk kompleks warna.
Pada referensi warna yang ditunjukkan seharusnya berwarna ungu tapi tidak pada percobaan kali ini, disebabkan karena kurangnya tetesan tembaga sulfat yang diberikan, sehingga tidak memaksimalkan pembentukan komplek ungu pada larutan. Pada akhirnya larutan hanya berwarna biru muda (ungu muda sekali).
Asam nitrat pekat digunakan dalam larutan kasein untuk menguji keberadaan gugus fenil (cincin benzena). Didapat bahwa 0.1 gram kasein memiliki asam amino yang memiliki gugus fenil yang ditunjukkan dari hasil pengamatan berupa perubahan warna larutan menjadi kuning tua. Pembentukkan warna kuning tua muncul setelah dipanaskan, yang sebelum pemanasan berupa endapan putih. Penambahan 2 ml asam nitrat pekat dan beberapa NaOH 10% berlebih, hal ini bertujuan membentuk lingkungan dalam suasana basa dan menyebabkan senyawa terionisasi dan berubah warna menjadi kuning tua.
4.2. Uji Kimia Karbohidrat
4.2.1. Uji Molisch
Dari hasil pengujian didapat cincin ungu diantara fasa cair tiap pengujian sampel karbohidrat yaitu pada sukrosa dan fruktosa. Cincin ungu ini disebabkan karena adanya 2 ml H2SO4 yang membuatnya menjadi furfural.
Sedangkan alfa naftol yang merupakan reagen Molisch akan bereaksi dengan senyawa furfural membentuk senyawa kompleks berwarna ungu. Laktosa glukosa dan maltosa tidak menunjukkan ciri ini disebabkan karena adanya kesalahan penuangan H2SO4, yaitu terlalu cepat dalam
menuangkannya sehingga reaksi berjalan terlalu cepat dan kemudian tidak terlihat pada ketiga sampel. Dihipotesiskan juga karena struktur sukrosa terdiri dari fruktosa yang memiliki ciri tersendiri yang dapat mempertahankan warna cincin ungu lebih baik dibandingkan struktur-struktur karbohidrat lain.
4.2.2. Uji Benedict
karena salah melabeli sehingga tertukar antara sampel sukrosa dengan sampel maltosa.
4.2.3. Uji Barfoed
Diperoleh dari hasil pengamatan bahwa terdapa 2 larutan yang menimbulkan endapan merah bata yaitu glukosa dan fruktosa. Keduanya adalah monosakarida. Monosakarida akan lebih cepat bereaksi dengan reagen Barfoed dari pada disakarida, dan hal ini sesuai dengan referensi bahwa larutan disakarida tidak tampak adanya endapan merah bata seperti kedua monosakarida tersebut.
4..2.4. Uji Hidrolisis glukosa
V. Kesimpulan
» Tirosin memiliki gugus fenolik.
» Kasen dan glisin memiliki gugus amino bebas. » Sistein memiliki unsur belerang (S).
» Glisin memiliki gugus amina bebas.
» Urea memiliki ikatan peptida dan terdapat protein.
» Kasein merupakan senyawa yang memiliki ikatan benzena.
» Glukosa, fruktosa, maltosa, laktosa dan sukrosa merupakan senyawa karbohidrat.
» Glukosa, fruktosa, maltosa dan laktosa adalah gula pereduksi
» Glukosa dan fruktosa adalah monosakarida sedangkan laktosa, maltosa dan sukrosa adalah disakarida
VI. Daftar Pustaka
Almatsier. S. 2010. Prinsip Dasar Ilmu Gizi. Jakarta : Gramedia Pustaka Utama
Hawab, M. 2004. Pengantar Biokimia. Bayu Media Publishing, Bogor. Kuchel, Philip. 1990. Biokimia. Erlangga, Jakarta.
Poedjiadji, Anna.1994.Dasar-Dasar Biokimia. Universitas indonesia, Jakarta.
Lehninger, Albert.2000. Dasar-Dasar Biokimia. Erlangga, Jakarta.
Murray, R. K. 2009. Biokimia Harper. Jakarta: Penerbit Buku Kedokteran EGC
Soendoro, 2005.
Sudarmadji, Slamet, 1989. Analisa Bahan Makanan dan Pertanian. Liberty Yogyakarta,Yogyakarta.
Winarno, F.G.1991. Kimia Pangan dan Gizi. Gramedia Pustaka Utama, Jakarta
LAMPIRAN
Lampiran 1. Struktur Senyawa Dan Reaksi Pengujian Karbohidrat Dan Protein Nama
Senyaw a
Struktur molekul
Kasein
Tirosin
Sistein
Glukosa
Fruktosa
Maltosa
Sukrosa
Pati
Millon
Ninhidrin
Sulfur
Reaksi dengan asam nitrit
Biuret
Xanthproteat
Pb(CH3COO)2 + HS-CH2-CHNH2-COOH → CH3
COOH-CH3COO-CH2-CHNH2
COOH + PbS(s)
(Sistein )
2HO CH2 – CH – COOH + Hg(NO3)2 1
NH2
HOOC-CH-CH2 Hg CH2-CH-COOH + 2HNO3
NH
Molisch
Benedict
Lampiran 2. Material Safety Data Sheet (MSDS)
0 NaNO2 5% 320 271 68.99 2.13 v - putih higroskopis
1
4 Alfa Naftol 279 95.5 144 1.1 sedikit - - iritan
1
5 H2SO4 33.7 10 98.07 1.84 - -
-Asam Kuat 1