SINTESIS BENZOIL EUGENOL DARI EUGENOL DAN BENZOIL KLORIDA DALAM PIRIDINA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Oleh :
Emanuel Dani Ramdani NIM: 078114095
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
SINTESIS BENZOIL EUGENOL DARI EUGENOL DAN BENZOIL KLORIDA DALAM PIRIDINA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Oleh :
Emanuel Dani Ramdani NIM: 078114095
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iii Skripsi
SINTESIS BENZOIL EUGENOL DARI EUGENOL DAN BENZOIL KLORIDA DALAM PIRIDINA
Yang diajukan oleh: Emanuel Dani Ramdani
NIM : 07 8114 095
telah disetujui oleh
Pembimbing
v
HALAMAN PERSEMBAHAN
So do not fear, for I am with you; do not be dismayed, for I am your
God. I will strengthen you and help you; I will uphold you with
My righteous right hand.
Isaiah 41:10
It is hard to fail, but it is worse never to have tried to succeed.
(Theodore Roosevelt)
vi
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma :
Nama : Emanuel Dani Ramdani No mahasiswa : 078114095
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah yang berjudul :
“Sintesis Benzoil Eugenol dari Eugenol dan Benzoil Klorida dalam Piridina”
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama mencantumkan nama saya sebagai Penulis.
Demikian pernyataan ini saya buat dengan sebenarnya. Dibuat di Yogyakarta
Pada tanggal 21 Februari 2011
Yang menyatakan
vii PRAKATA
Puji Syukur kepada Tuhan Yang Maha Pengasih dan Penyayang atas semua berkat dan penyertaan-Nya kepada penulis, sehingga penulis dapat menyelesaikan laporan akhir ini dengan baik. Laporan akhir ini disusun untuk memperoleh gelar Sarjana Strata Satu Program Studi Farmasi (S.Farm).
Penulis banyak mengalami kesulitan dan hambatan dalam menyelesaikan laporan akhir ini. Namun dengan bantuan dari banyak pihak, akhirnya penulis dapat menyelesaikan laporan akhir tersebut. Dengan kerendahan hati penulis ingin mengucapkan terimakasih atas bantuan yang telah diberikan kepada :
1) Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2) Jeffry Julianus, M.Si., selaku dosen pembimbing yang telah memberikan bimbingan dan arahan kepada penulis.
3) Dra. M. M. Yetty Tjandrawati, M.si., selaku dosen penguji atas kesediaannya meluangkan waktu untuk menjadi dosen penguji, serta kritik dan saran yang diberikan.
4) Lucia Wiwid Wijayanti, M.Si., selaku dosen penguji atas kesediaannya meluangkan waktu untuk menjadi dosen penguji, serta kritik dan saran yang diberikan.
viii
6) Wawan, Dika, Yudi sebagai teman satu tim atas bantuan, kerjasama, dan dukungannya.
7) Ryan dan Ridho atas persahabatan yang erat selama ini. 8) Teman-teman kontrakan asik atas kebersamaannya selama ini. 9) Fransisca Angesti Nariswari yang setia memberi semangat.
10)Teman-teman Kuningan yang selalu memberi semangat dan dukungan. 11)Teman-teman FST 2007 atas suka dan duka yang kita lewati bersama.
12)Mas Parlan, Mas Kunto, Mas Bimo serta laboran-laboran yang lain atas bantuannya selama penulis menyelesaikan laporan akhir.
13)Semua pihak yang tidak dapat disebutkan satu per satu yang telah membantu penulis dalam menyelesaikan laporan akhir ini.
Penulis menyadari bahwa dalam penulisan laporan akhir ini banyak kekurangan mengingat adanya keterbatasan kemampuan dan pengetahuan penulis. Untuk itu penulis mengharapkan saran dan kritik yang membangun dari semua pihak. Akhir kata semoga laporan ini dapat berguna bagi pembaca.
ix
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya dari orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 21 Februari 2011 Penulis
x DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
PERNYATAAN PERSETUJUAN PUBLIKASI...vi
PRAKATA ... vii
PERNYATAAN KEASLIAN KARYA ... ix
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
INTISARI ... xvi
ABSTRACT ... xvii
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
1. Perumusan Masalah ... 3
2. Keaslian Penelitian ... 3
3. Manfaat Penelitian ... 4
xi
BAB II. PENELAAHAN PUSTAKA... 5
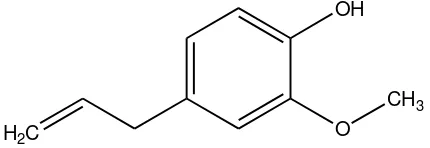
A. Eugenol ... 5
B. Sintesis Benzoil Eugenol ... 6
C. Uji Titik Lebur ... 8
D. Identifikasi dan Uji Kemurnian dengan Kromatografi Lapis Tipis….8 E. Kromatografi Gas………9
F. Spektroskopi Infra Merah (Infra Red)………10
G. Spektroskopi Resonansi Magnetik Inti Proton (Nuclear Magnetic Resonance Proton)... ... ...11
H. Spektroskopi Massa (MassSpectroscopy)………11
I. Landasan Teori………12
J. Hipotesis………..13
BAB III. METODOLOGI PENELITIAN ... 14
A. Jenis dan Rancangan Penelitian ... 14
B. Variabel Penelitian ... 14
C. Definisi Operasional Penelitian... 14
D. Bahan Penelitian... 15
E. Alat Penelitian ... 15
F. Tata Cara Penelitian ... 15
G. Analisis Hasil ... 18
BAB IV. HASIL DAN PEMBAHASAN ... 19
xii
B. Uji Pendahuluan ... 22
1. Uji Organoleptis ... 22
2. Uji Kelarutan ... 22
3. Uji Titik Lebur ... 24
4. Uji Kromatografi Lapis Tipis (KLT) ... 24
5. Uji Kromatografi Gas ... 26
C. Elusidasi Struktur ... 27
1. Spektroskopi Infra Merah ... 27
2. Spektroskopi H1-NMR ... 20
3. Spektroskopi Massa ... 34
BAB V. KESIMPULAN DAN SARAN ... 36
A. Kesimpulan ... 36
B. Saran ... 36
DAFTAR PUSTAKA ... 37
LAMPIRAN ... 39
xiii
DAFTAR TABEL
Tabel I. Data Organoleptis Senyawa Hasil Sintesis dengan Eugenol ... 22
Tabel II. Data Kelarutan Senyawa Hasil Sintesis dengan Eugenol ... 23
Tabel III. Data Harga Rf Senyawa Hasil Sintesis dengan Eugenol ... 25
Tabel IV. Analisis Gugus Dari Spektra Senyawa Hasil Sintesis ... 28
Tabel V. Perbandingan Gugus Fungsional Senyawa Eugenol dengan Senyawa Hasil Sintesis ... 28
xiv
DAFTAR GAMBAR
Gambar 1. Struktur Eugenol. ... 5
Gambar 2. Mekanisme reaksi SNA ... 6
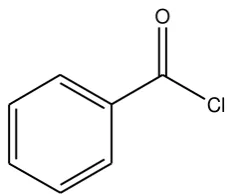
Gambar 3. Struktur Benzoil Klorida ... 6
Gambar 4. Struktur Piridina ... 7
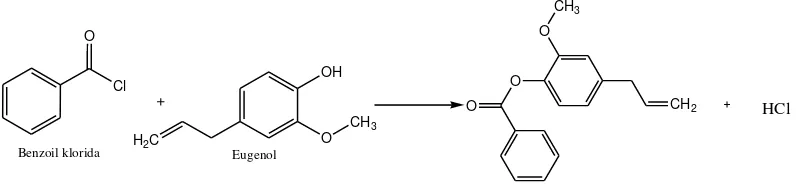
Gambar 5. Reaksi Pembentukan Benzoil Eugenol ... 13
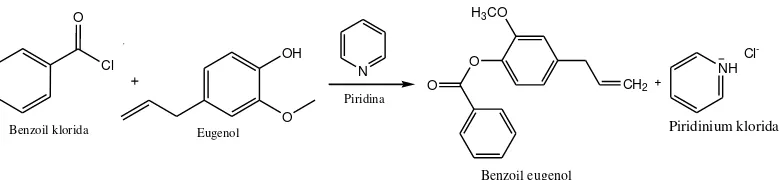
Gambar 6. Reaksi pembentukan benzoil eugenol ... 19
Gambar 7. Mekanisme reaksi pembentukan benzoil eugenol ... 20
Gambar 8. Perbedaan gugus pergi pada benzoil klorida dan ion benzoil piridinium ... 21
Gambar 9. Hasil uji Kromatografi Lapis Tipis ... 25
Gambar 10. Kromatogram Kromatografi Gas Senyawa Hasil Sintesis ... 26
Gambar 11. Spektra Infra Merah Senyawa Hasil Sintesis ... 27
Gambar 12. Spektra Resonansi Magnetik Inti Senyawa Hasil Sintesis ... 29
Gambar 13. Pencacahan Tipe Proton Benzoil Eugenol ... 30
Gambar 14. Spektra Massa Senyawa Hasil Sintesis ... 34
xv
DAFTAR LAMPIRAN
Lampiran 1. Perhitungan Jumlah Rendemen Benzoil Eugenol ... 40
Lampiran 2. Foto Senyawa Hasil Sintesis ... 41
Lampiran 3. Kromatogram Kromatografi Gas Senyawa Hasil Sintesis ... 42
Lampiran 4. Spektra Infra Merah Senyawa Hasil Sintesis ... 43
Lampiran 5. Spektra 1H-NMR Senyawa Hasil Sintesis ... 44
Lampiran 6. Spektra Massa Senyawa Hasil Sintesis ... 45
Lampiran 7. Spesifikasi Alat Gas Chromatography-Mass Spectrometry Senyawa Hasil Sintesis……….46
Lampiran 8. Spesifikasi Infrared Spectrophotometry Senyawa Hasil Sintesis...47
xvi INTISARI
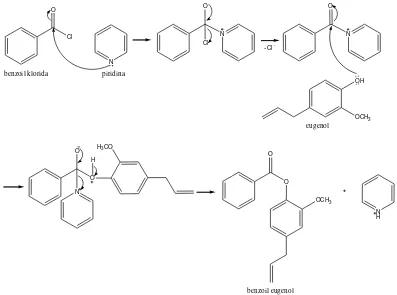
Eugenol merupakan salah satu senyawa yang sering digunakan sebagai obat antiinflamasi dengan menghambat pembentukan prostaglandin melalui jalur siklooksigenase-2 (COX-2). Struktur eugenol yang kurang meruah mengakibatkan eugenol bersifat non-selektif terhadap COX-2 sehingga dapat pula menghambat siklooksigenase 1 (COX-1). Penghambatan terhadap COX-1 akan mengakibatkan efek samping pada saluran gastrointestinal. Untuk meningkatkan selektifitasnya, dapat dilakukan penambahan gugus benzoil sehingga dihasilkan benzoil eugenol.
Sintesis benzoil eugenol dilakukan dengan mereaksikan eugenol (0,041 mol) dan benzoil klorida (0,082 mol) dalam piridina. Dilakukan sejumlah analisis terhadap senyawa hasil sintesis yang meliputi: uji organoleptis, uji kelarutan, uji titik lebur, uji kromatografi lapis tipis (KLT), uji kromatografi gas, elusidasi struktur dengan spektroskopi inframerah (IR), spektroskopi resonansi magnetik inti (RMI) proton, dan spektroskopi massa serta dihitung rendemennya.
Senyawa hasil sintesis berupa kristal putih, berbau cengkeh, larut dalam etil asetat dan kloroform, sukar larut dalam alkohol, tidak larut dalam akuadest dan larutan NaOH 10%. Uji titik lebur menunjukkan titik lebur senyawa hasil sintesis adalah 610C. Uji KLT (dalam fase diam silika gel GF254 dan fase gerak
heksana:etil asetat (96:4)) dan kromatografi gas menunjukkan kemurnian senyawa hasil sintesis 100%. Elusidasi struktur dengan spekroskopi IR, RMI proton, dan spektroskopi massa menunjukkan bahwa senyawa hasil sintesis adalah benzoil eugenol dengan bobot molekul 268 dan rumus molekul C17H16O3. Rendemen
xvii
ABSTRACT
Eugenol, a compound which used as an anti-inflammatory medicine, can inhibit prostaglandin formation by blocking cyclooxigenase 2 (COX-2) pathway. The small structure of eugenol can cause non-selective cyclooxigenase inhibition, so eugenol can inhibit either cyclooxigenase 1 (COX-1) or COX-2. COX-1 inhibition will cause gastrointestinal ulcer as its side effect. Benzoyl group can be added to eugenol for increasing its selectivity so they can form benzoyl eugenol.
Benzoyl eugenol was synthesized by reacting eugenol (0,041 mol) and benzoyl chloride (0,082 mol) in the presence of pyridine. The synthesized compound was analyzed by organoleptic test, solubility test, melting point test, thin layer chromatography (TLC), gas chromatography (GC), structure elucidation with infrared spectrometry, nuclear magnetic resonance proton (1 H-NMR) spectrometry, and mass spectrometry along with rendemen’s calculation.
The synthesized compound is a white crystalline solid with cloves odor. It is soluble in ethyl acetate and chloroform, slightly soluble in ethanol 96%, and insoluble in water and hydroxide alkali solution. The melting point of synthesized compound is 610C. TLC (in silica gel GF254 stationary phase and hexane:ethyl acetate(96:4) mobile phase) and GC chromatogram show that synthesized compound is 100% pure. The structure elucidation with infrared spectrometry, 1
H-NMR spectrometry, and mass spectrometry shows that the synthesized compound is benzoyl eugenol. Its molecular mass is 268 with molecular formula C17H16O3. Rendemen of benzoyl eugenol which produced is 46%.
1 BAB I PENDAHULUAN
A. Latar Belakang
Inflamasi merupakan respon dari sel hidup terhadap suatu luka yang terjadi karena adanya interaksi antara asam arakhidonat dan enzim siklooksigenase 2 (COX-2) yang menyebabkan terbentuknya prostaglandin (Vane, Botting, and Botting, 1996). Untuk mengobati inflamasi, interaksi antara asam arakhidonat dengan COX-2 harus dihambat sehingga prostaglandin tidak terbentuk.
Salah satu senyawa yang sering digunakan sebagai obat antiinflamasi adalah eugenol. Aktivitas eugenol sebagai antiinflamasi terkait dengan kemampuannya dalam penghambatan pembentukan prostaglandin melalui jalur COX-2 (Ozturk dan Ozbek, 2005). Struktur eugenol yang relatif kecil dan kurang meruah mengakibatkan eugenol bersifat non-selektif terhadap COX-2 sehingga dapat pula menghambat enzim siklooksigenase 1 (COX-1). Ketidak selektifan ini disebabkan karena struktur COX-2 mirip dengan COX-1. Penghambatan terhadap COX-1 akan mengakibatkan efek samping terutama pada saluran gastrointestinal (Fabiola, Damodharan, Pattabhi, and Nagarajan, 2001).
Perbedaan struktur COX-2 dengan COX-1 terletak asam amino penyusun side pocket-nya. Side pocket COX-1 tersusun atas residu asam amino isoleusin
2
ke pocket-nya terbuka. Oleh karena itu, struktur COX-2 mempunyai ukuran side pocket yang lebih besar daripada struktur COX-1 (Fabiola et al., 2001). Untuk
meningkatkan selektifitas obat terhadap COX-2 dapat dilakukan peningkatan ukuran molekul. Salsalat merupakan salah satu obat hasil modifikasi dari asam salisilat yang memiliki selektifitas COX-2 yang tinggi (Scheiman and Elta, 1990).
Usaha yang dilakukan untuk meningkatkan selektifitas eugenol adalah dengan melakukan modifikasi struktur sehingga dihasilkan derivat eugenol dengan struktur yang lebih besar. Modifikasi terhadap struktur eugenol dapat dilakukan dengan menambahkan gugus benzoil sehingga dihasilkan benzoil eugenol. Gugus benzoil dapat masuk ke dalam eugenol karena memiliki atom –C karbonil yang bersifat elektrofil. Atom –C karbonil ini akan bereaksi dengan –OH fenolik dari eugenol. Penambahan gugus benzoil ini menyebabkan ukuran senyawa menjadi lebih besar sehingga menjadi lebih selektif. Hal ini dikarenakan struktur COX-2 mempunyai ukuran side pocket yang lebih besar daripada struktur COX-1.
3
yang reaktif sehingga reaksi diharapkan dapat berjalan dengan cepat dan rendemen yang dihasilkan banyak.
Hasil reaksi antara eugenol dan benzoil klorida menghasilkan asam klorida. Adanya asam klorida dapat menghidrolisis ikatan ester dari benzoil eugenol sehingga rendemen akan berkurang. Umumnya digunakan natrium hidroksida (NaOH) untuk menghilangkan asam klorida tersebut. Akan tetapi, NaOH dapat menghidrolisis benzoil klorida menjadi asam benzoat yang kurang reaktif. Oleh karena itu, pada penelitian ini digunakan basa piridina untuk mengikat asam klorida. Selain itu, piridina dapat bereaksi dengan benzoil klorida membentuk benzoilpiridinium yang lebih reaktif. Diharapkan dengan penggunaan piridina dapat menghasilkan rendemen yang baik.
1. Permasalahan
a. Apakah benzoil eugenol dapat disintesis dari eugenol dan benzoil klorida dalam piridina?
b. Berapakah rendemen sintesis benzoil eugenol dari eugenol dan benzoil dalam dengan piridina?
2. Keaslian Penelitian
4
3. Manfaat Penelitian a. Manfaat Teoritis
Penelitian ini bermanfaat untuk memperkaya pengetahuan dalam bidang sintesis benzoil eugenol yang berasal dari eugenol dan benzoil klorida dengan piridina menurut reaksi substitusi nukleofilik asil.
b. Manfaat Metodologis
Penelitian ini bermanfaat dalam menemukan jalur sintesis benzoil eugenol baru yaitu dengan menggunakan piridina sehingga bisa didapatkan rendemen yang tinggi.
B. Tujuan Penelitian Penelitian ini bertujuan untuk:
1. Membuktikan bahwa benzoil eugenol dapat disintesis dari eugenol dan benzoil klorida dengan piridina.
5 BAB II
PENELAAHAN PUSTAKA
A. Eugenol
Eugenol atau 2-metoksi-4-(2-propenil)fenol, merupakan turunan guaiakol yang mendapat tambahan rantai alil. Senyawa ini dapat dikelompokkan dalam keluarga alilbenzena dari senyawa-senyawa fenol (Anonim, 2009).
6
B. Sintesis Benzoil Eugenol
Senyawa Benzoil Eugenol dapat disintesis melalui reaksi substitusi nuklofilik asil (SNA). Reaksi SNA merupakan reaksi antara suatu turunan asam karboksilat dengan suatu nukleofil (Morrison and Boyd, 1976). Eugenol dapat diasilasi karena memiliki gugus –OH fenolik yang bermuatan parsial negatif sehingga dapat berfungsi sebagai nukleofil. Agen pengasilasi yang digunakan adalah benzoil klorida.
Gambar 2. Mekanisme reaksi SNA
Benzoil klorida merupakan senyawa turunan asam karboksilat dan termasuk golongan halida asam. Senyawa ini merupakan cairan dengan bau yang menyengat dan akan terdekomposisi oleh air dan alkohol. Senyawa benzoil klorida dapat bercampur dengan eter, benzena, karbon disulfida, dan minyak (Budavari, 1989).
O
Cl
7
Dari semua turunan asam karboksilat, golongan halida asam adalah yang paling reaktif karena ion halida merupakan gugus pergi yang baik (Fessenden dan Fessenden, 1994). Dengan demikian, benzoil klorida memiliki kereaktifan yang tinggi sehingga dapat bereaksi dengan eugenol.
Dalam reaksi antara benzoil klorida dengan eugenol, akan dihasilkan asam klorida (HCl). Karena HCl dapat merusak senyawa hasil reaksi, biasanya suatu basa ditambahkan untuk menghilangkan HCl tersebut (Fessenden dan Fessenden, 1994). Umumnya, basa yang digunakan adalah larutan 10% NaOH. Akan tetapi, NaOH dapat menghidrolisis sejumlah benzoil klorida dan menghasilkan asam benzoat (Vogel, 1956).
Untuk meminimalkan terbentuknya asam benzoat, penggunaan larutan NaOH dapat diganti dengan piridina. Piridina merupakan cairan tidak berwarna dengan bau tajam dan tidak mengenakkan. Senyawa ini dapat bercampur dengan air, alkohol, eter, petroleum eter, minyak, dan banyak pelarut organik lainnya. (Budavari, 1989).
N
Gambar 4. Struktur Piridina
8
dengan benzoil klorida membentuk ion benzoil piridinium. Ion benzoil piridinium ini lebih reaktif daripada benzoil klorida (Carey and Sundberg, 2007).
C. Uji Titik Lebur
Pemeriksaan titik lebur merupakan suatu aspek penting yang seringkali dilakukan dalam penelitian sintesis suatu senyawa. Hal ini dibenarkan karena pemeriksaaan titik lebur dapat memberikan informasi kemurnian suatu senyawa hasil sintesis. Ketajaman jarak lebur senyawa merupakan merupakan kriteria kemurnian suatu senyawa. Pada umumnya, suatu senyawa memiliki kemurnian yang baik apabila jarak leburnya tidak lebih dari 20C. Rentangan lebih besar dari jarak ini dapat dikatakan senyawa kurang murni (MacKenzie, 1967).
D. Identifikasi dan Uji Kemurnian dengan Kromatografi Lapis Tipis Kromatografi lapis tipis (KLT) dapat digunakan untuk mengidentifikasi komponen tertentu. Teknik ini sering dilakukan dengan lempeng kaca atau plastik yang dilapisi dengan fase diam. Senyawa yang akan dianalisis ditotolkan pada dasar lempengan yang dilapisi fase diam dan dielusi dengan fase gerak yang akan bergerak naik oleh karena gaya kapilaritas (Bresnick, 2004).
9
bahwa jarak rambat senyawa pada lempengan dapat digunakan sebagai cerminan polaritas suatu senyawa (Bresnick, 2004).
Proses kromatografi lapis tipis dapat diubah-ubah dengan memodifikasi fase diam atau dengan mengubah kepolaran fase gerak yang digunakan, dimana mengubah kepolaran fase gerak lebih mudah dilakukan. Polaritas fase gerak diubah dengan cara menambahkan fase gerak lain sehingga diperoleh kepolaran yang tepat untuk memisahkan campuran senyawa (Gritter, Bobbit, and Scharting 1991).
Kromatografi lapis tipis dapat digunakan untuk menguji kemurnian secara kualitatif dari campuran suatu senyawa. Hal ini berkaitan untuk pembuktian ada atau tidaknya komponen yang dicari dan apakah komponen tersebut murni atau tidak. Penggunaan secara khusus KLT adalah untuk mengetahui kemurnian senyawa selama proses pemurnian. Hal ini dilakukan dengan cara membandingkan senyawa hasil pemurnian dengan senyawa standarnya. Senyawa yang murni akan memberikan bercak tunggal pada berbagai fase gerak dengan berbagai tingkat kepolaran dan mempunyai harga Rf yang sama dengan senyawa
standarnya (Gasparic and Churacek, 1978).
E. Kromatografi Gas
10
komponen atau campuran dari komponen) serta analisa kuantitatif (penentuan jumlah dari suatu komponen atau komponen-komponen dalam suatu campuran) (Sastrohamidjojo, 1991)
Prinsip dasar kromatografi gas melibatkan volatilisasi atau penguapan sampel dalam inlet injector, pemisahan komponen-komponen dalam campuran, dan deteksi tiap komponen dengan detektor (Rohman, 2009).
Data kromatografi gas biasanya terdiri dari waktu retensi atau waktu tambat berbagai komponen campuran. Waktu retensi diukur mulai dari titik penyuntikan sampai titik maksimum puncak dan sangat khas untuk senyawa tertentu pada kondisi tertentu (kolom, suhu, gas pembawa, dan laju aliran) (Gritter et al., 1991)
F. Spektroskopi Inframerah (Infra Red)
Spektrum infra merah pada dasarnya merupakan gambaran dari pita absorbsi yang spesifik dari gugus fungsional yang mengalami vibrasi karena pemberian energi. Interaksi antara gugus dengan atom yang mengelilinginya dapat menandai spektrum itu dalam setiap senyawa. Untuk analisa kualitatif, ada atau tidaknya absorbsi pada frekuensi tertentu merupakan penanda ada tidaknya gugus fungsinal tertentu. Penggunaan spektrofotometri infra merah pada bidang kimia organik mengunakan daerah dari 650-4000 cm-1 (15,4-2,5 μm) (Sastrohamidjojo, 2001).
11
G. Spektroskopi Resonansi Magnetik Inti Proton (Nuclear Magnetic Resonance Proton)
Resonansi magnetik inti diakibatkan oleh penyerapan radisai elektromagnetik di daerah frekuensi radio oleh proton dalam suatu medan magnet (Silverstein and Webster,1998). Penyerapan radiasi elektromagnetik yang terjadi merupakan fungsi dari inti tertentu dalam suatu molekul.
Medan magnet yang diderita oleh sebuah proton dipengaruhi oleh keadan spin dari proton-proton tetangganya. Proton-proton yang saling mempengaruhi ini
berada dalam lingkungan magnet dan molekul yang berlainan. Penyerapan energi yang berbeda – beda oleh proton akan menghasilkan spektrum dari berbagai proton (Sastrohamidjojo, 2001).
Dari spektrum 1H-NMR dapat diketahui: jumlah lingkungan proton yang terdapat dalam satu molekul, jumlah proton yang terdapat pada masing-masing lingkungan proton tersebut, jumlah proton pada atom karbon tetangga. Tinggi garis integrasi yang muncul sebagai deretan anak tangga yang digambar bertumpuk dengan spektrum NMR-nya, hanya memberikan jumlah relatif dari tiap jenis proton dan tidak menunjukkan jumlah absolut dari tiap jenis proton.
H. Spektroskopi Massa (Mass Spectroscopy)
12
positif dan bertenaga tinggi yaitu: ion molekul dan ion anak. Hanya ion bermuatan positif yang dapat dideteksi sedang ion netral dan ion bermuatan negatif diserap oleh dinding tabung vakum. Pemisahan ion-ion berdasarkan perbandingan massa terhadap muatan, dimana muatan ion biasanya adalah satu sehingga dapat diketahui massa dari ion tersebut (Williams and Fleming, 1997).
Metode yang paling sering digunakan dalam spektroskopi massa untuk menghasilkan ion dari sampel yang akan dianalisis yaitu electron impact – mass spectroscopy (EI-MS). Pada metode EI-MS, molekul-molekul dalam fase gas
akan ditumbuk oleh elektron dengan energi 70ev yang mengakibatkan hilangnya 1 elektron dari molekul dan menghasilkan ion molekul yang merupakan suatu radikal kation (M.+). Ion molekul dapat mengalami fragmentasi lebih lanjut menjadi fragmen ion-ion yang lebih kecil (Silverstein dan Webster, 1998).
I. Landasan Teori
Reaksi substitusi nuklofilik asil (SNA) merupakan reaksi antara suatu turunan asam karboksilat dengan suatu senyawa alkohol untuk menghasilkan ester. Reaksi sintesis benzoil eugenol didasarkan pada reaksi SNA yang melibatkan eugenol sebagai nukleofil, benzoil klorida sebagai elektrofil, dan piridina.
13
Gambar 5. Reaksi Pembentukan Benzoil Eugenol
Asam klorida (HCl), yang terbentuk dalam reaksi pembentukan benzoil eugenol, dapat menghidrolisis benzoil eugenol dan menyebabkan hasilnya berkurang. Umumnya NaOH digunakan untuk mengikat HCl yang terbentuk, namun NaOH dapat menghidrolisis benzoil klorida menjadi asam benzoat yang kurang reaktif. Oleh karena itu, piridina digunakan untuk mengikat HCl yang terbentuk. Selain itu, piridina dapat mengubah benzoil klorida menjadi benzoilpiridinium yang lebih reaktif. Diharapkan penggunaan piridina dapat menghasilkan rendemen yang tinggi.
J. Hipotesis
1. Benzoil eugenol dapat disintesis dari eugenol dan benzoil klorida dengan pelarut piridina.
14 BAB III
METODOLOGI PENELITIAN
A. Jenis Penelitian
Penelitian ini termasuk jenis penelitian deskriptif non-eksperimental karena tidak ada perlakuan terhadap subyek uji dan hanya memaparkan fenomena yang terjadi.
B. Variabel Penelitian
1. Variabel Bebas : Jumlah mol dari starting material 2. Variabel Tergantung : Rendemen senyawa hasil sintesis
C. Definisi Operasional Penelitian
1. Starting material: merupakan senyawa yang digunakan dalam sintesis yang merupakan senyawa asal, dalam hal penelitian ini adalah senyawa eugenol dan benzoil klorida
15
D. Bahan Penelitian
Eugenol (p.a., Sigma), benzoil klorida (p.a., E. Merck), aquadest (Laboratorium Kimia Organik Fakultas Farmasi USD), n-hexane (p.a., E. Merck), etil asetat (p.a., E. Merck), toluene (p.a., E. Merck), piridina (p.a., E. Merck), es batu, dan silika gel GF 254 dengan ketebalan 1cm (E. Merck), kertas saring.
E. Alat penelitian
Neraca analitik (Mettler PM 100), alat-alat gelas pada umumnya, labu Erlenmeyer bertutup (Pyrex), mikropipet (Socorex), labu hisap, corong Buchner, pompa vakum (Robinair, Model no. 15100, Vacuum Pump Instruction Manual), penangas air (Memmert Water Bath, WB 7-45), alat uji leleh (Electrothermal), tabung kapiler, bejana kromatografi lapis tipis, lampu UV (Desaga, Germany), spektrofotometer IR (IR Shimadzu Prestige-21), spektrometer 1H-NMR (1H-NMR JOEL-MY60), kromatografi gas-spektrometer massa (Shimadzu QP 2010S), desikator berisi silika.
F. Tata Cara Penelitian 1. Sintesis Benzoil Eugenol
16
dengan magnetic stirrer. Campuran tadi dibiarkan dalam air es hingga terbentuk padatan. Padatan yang terbentuk kemudian disaring dengan corong Buchner dan direkristalisasi dengan etanol 96%. Setelah rekristalisasi, kristal ditimbang dan dihitung rendemennya dengan rumus:
𝑅𝑒𝑛𝑑𝑒𝑚𝑒𝑛= 𝑏𝑒𝑟𝑎𝑡𝑠𝑒𝑛𝑦𝑎𝑤𝑎ℎ𝑎𝑠𝑖𝑙𝑝𝑒𝑟𝑐𝑜𝑏𝑎𝑎𝑛
𝐵𝑒𝑟𝑎𝑡𝑠𝑒𝑛𝑦𝑎𝑤𝑎𝑠𝑒𝑐𝑎𝑟𝑎𝑡𝑒𝑜𝑟𝑖𝑡𝑖𝑠 × 100%
2. Pemeriksaan Pendahuluan Senyawa Hasil Sintesis a. Organoleptis
Kristal hasil sintesis diperiksa bentuk, warna, dan baunya. Hasilnya dibandingkan dengan eugenol.
b. Pemeriksaan Senyawa Hasil Sintesis dengan Kromatografi Lapis Tipis (KLT)
Kristal hasil sintesis dilarutkan dalam etanol kemudian ditotolkan pada lempeng silika gel GF 254 yang sebelumnya telah diaktifkan pada suhu 1000C
selama 30 menit. Pada lempeng silika tersebut ditotolkan pula eugenol dalam etanol sebagai pembanding. Pengembangan dilakukan dalam bejana yang telah dijenuhi heksana:etil asetat (96:4) dengan jarak rambat 10 cm. Bercak dilihat di bawah sinar UV pada panjang gelombang 254 nm dan dihitung harga Rf nya.
c. Pemeriksaan kelarutan senyawa hasil sintesis
17
Prosedur yang sama dilakukan menggunakan larutan NaOH 10%, etanol 96%, kloroform, dan etil asetat. Kemudian dibandingkan dengan kelarutan eugenol dalam pelarut yang sama.
d. Pemeriksaan titik lebur senyawa hasil sintesis
Sejumlah kristal hasil sintesis diisikan ke dalam tabung kapiler, kemudian dimasukkan pada thermophan. Kenaikan suhu thermophan diatur 0,50C tiap menit. Kristal diamati dan dicatat suhunya ketika mulai melebur.
3. Elusidasi Struktur Senyawa Hasil Sintesis
a. Elusidasi struktur dengan spektroskopi inframerah (IR)
Kristal hasil sintesis, kurang lebih 1 mg, dicampur homogen dengan KBr kurang lebih 150 mg, lalu dikempa dan dibuat pelet. Selanjutnya dibuat spektra inframerah dengan spektrofotometer inframerah.
b. Elusidasi struktur dengan spektroskopi resonansi magnetik inti 1H(1H NMR)
Kristal hasil sintesis, kurang lebih 10-50 mg, dimasukkan ke dalam tabung dan ditambahkan pelarut deuterated chloroform (CDCl3) serta beberapa tetes
18
c. Elusidasi struktur dengan spektroskopi massa (MS)
Kristal hasil sintesis dilarutkan dalam etanol, kemudian dilakukan pemeriksaan dengan alat kromatografi gas-spektroskopi massa dengan kondisi: alat pengionan Electron Impact (EI) 70 eV, suhu injector 3000C, jenis kolom Rastek Rxi-5MS (30m), suhu kolom 1200C, gas pembawa helium, tekanan 27.4 kPa, kecepatan alir fase gerak 80 ml/menit
G. Analisis Hasil a. Rendemen senyawa hasil sintesis
b. Data uji pendahuluan berdasarkan : 1. Organoleptis
2. Data KLT 3. Data kelarutan 4. Data titik lebur 5. Data kromatografi gas
c. Identifikasi struktur senyawa hasil sintesis berdasarkan: 1. Spektra IR
19 BAB IV PEMBAHASAN
A. Sintesis Benzoil Eugenol
Sintesis senyawa benzoil eugenol dilakukan berdasarkan reaksi substitusi nukleofilik asil dengan mereaksikan eugenol dan benzoil klorida dalam pelarut piridin. Dalam reaksi substitusi nukleofilik asil terjadi penggantian (substitusi) atom –H pada gugus hidroksi (-OH) fenolik dari eugenol oleh gugus benzoil dari benzoil klorida.
Gugus -OH fenolik eugenol, yang memiliki pasangan elektron bebas, bertindak sebagai nukleofil sedangkan benzoil klorida memiliki atom karbon karbonil bertindak sebagai elektrofil. Pada reaksi ini digunakan benzoil klorida karena atom klor (-Cl) pada benzoil klorida dapat menarik elektron dari atom karbon (-C) karbonil. Hal ini menyebabkan atom C karbonil akan menjadi lebih positif dan lebih mudah diserang oleh suatu nukleofil. Selain itu, atom Cl merupakan gugus pergi yang baik sehingga mudah tersubstitusi oleh nukleofil yang lain. Digunakan benzoil klorida berlebih (0,082 mol) supaya gugus OH fenolik eugenol dapat terbenzoilasi semuanya.
O
20
Dalam reaksi dihasikan asam klorida (HCl) yang dapat memecah ikatan ester dalam benzoil eugenol. Oleh karena itu, untuk mencegah pemecahan benzoil eugenol, ditambahkan piridina untuk mengikat HCl.
Piridina, selain sebagai pengikat HCl, dapat juga meningkatkan reaktivitas benzoil klorida sebagai agen pengasilasi. Piridina, yang merupakan nukleofil yang lebih baik daripada alkohol netral, akan bereaksi dengan benzoil klorida membentuk ion benzoil piridinium (Carey and Sundberg, 2007). Ion benzoil piridinium yang terbentuk akan bereaksi dengan eugenol membentuk benzoil eugenol. Karena ion benzoil piridinium sangat reaktif, reaksi ini akan langsung terjadi. Berikut adalah mekanisme reaksi pembentukan benzoil eugenol:
O
21
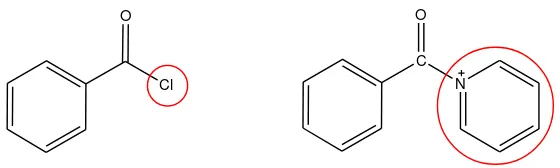
Jika dibandingkan dengan benzoil klorida, ion benzoil piridinium memiliki kereaktifan yang lebih tinggi. Perbedaan kereaktifan ini disebabkan oleh gugus yang terikat pada atom –C karbonil. Gugus piridinium pada benzoil piridinium bermuatan positif dan memiliki kekuatan untuk menarik elektron yang lebih besar daripada atom klor pada benzoil klorida. Oleh karena itu, atom –C karbonil pada ion benzoil piridinium akan lebih bermuatan positif daripada atom -C karbonil pada benzoil klorida.
C N O O
Cl
Gambar 8. Perbedaan gugus pergi pada benzoil klorida dan ion benzoil piridinium
22
B. Uji Pendahuluan 1. Uji Organoleptis
Uji organoleptis dilakukan dengan membandingkan bentuk, warna, dan bau antara senyawa hasil sintesis dengan eugenol sebagai starting material. Data hasil uji organoleptis dapat dilihat pada tabel berikut.
Tabel I. Data Organoleptis Senyawa Hasil Sintesis dengan Eugenol Karakteristik Eugenol Senyawa hasil sintesis
Bentuk Cair Kristal
Warna Kuning pucat Putih
Bau Cengkeh Cengkeh
Dari tabel di atas, sudah terjadi perbedaan karakteristik antara kedua senyawa tersebut. Dengan demikian telah terbentuk senyawa baru, yang diperkirakan adalah benzoil eugenol,.
2. Uji Kelarutan
23
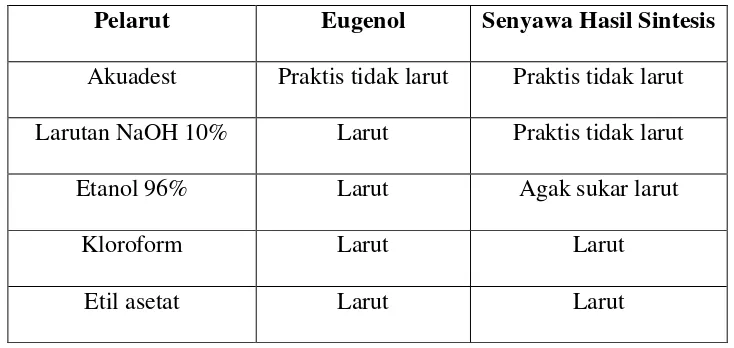
Berikut adalah data hasil uji kelarutan:
Tabel II. Data Kelarutan Senyawa Hasil Sintesis dengan Eugenol Pelarut Eugenol Senyawa Hasil Sintesis Akuadest Praktis tidak larut Praktis tidak larut Larutan NaOH 10% Larut Praktis tidak larut
Etanol 96% Larut Agak sukar larut
Kloroform Larut Larut
Etil asetat Larut Larut
Dari tabel di atas, diketahui bahwa senyawa hasil sintesis memiliki sifat yang lebih non-polar dibandingkan eugenol sehingga lebih sukar larut dalam etanol 96%. Adanya tambahan gugus benzoil pada senyawa hasil sintesis menyebabkan tertutupnya gugus –OH fenolik yang bersifat polar. Selain itu, gugus benzoil menyebabkan senyawa hasil sintesis menjadi semakin besar sehingga mengurangi kepolarannya.
24
3. Uji Titik Lebur
Hasil pengukuran menunjukkan bahwa titik lebur dari senyawa hasil sintesis adalah 610C. Berdasarkan hasil tersebut, dapat disimpulkan bahwa senyawa hasil sintesis ini sudah murni.
Hasil ini menunjukkan bahwa senyawa hasil sintesis memiliki titik lebur yang lebih tinggi daripada eugenol, yaitu -90C. Peningkatan titik lebur disebabkan oleh penambahan gugus benzoil sehingga bobot molekulnya bertambah besar. Bertambahnya bobot molekul senyawa akan meningkatkan titik leburnya.
4. Uji Kromatografi Lapis Tipis (KLT)
Uji KLT dilakukan untuk uji kemurnian senyawa hasil sintesis dan dibandingkan dengan senyawa eugenol. Uji KLT dilakukan dengan fase diam silika gel GF254. Fase gerak yang digunakan adalah heksana:asetat (96:4) dan
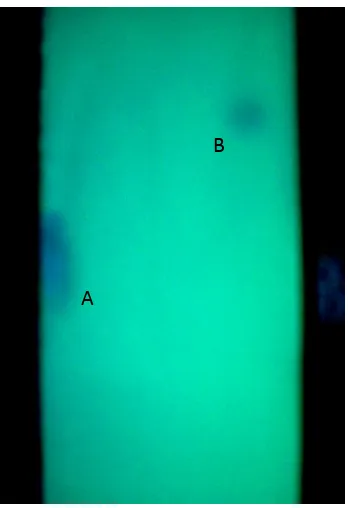
25
Gambar 9. Hasil uji Kromatografi Lapis Tipis Keterangan:
A= Eugenol
B= Senyawa hasil sintesis
Fase diam silika gel GF254 Merck®
Fase gerak Heksan:Etil Asetat (96:4)
Tabel III. Data Harga Rf Senyawa Hasil Sintesis dengan Eugenol
Senyawa Rf
Eugenol 0,54
Senyawa Hasil Sintesis 0,82
Hasil uji KLT menunjukkan bahwa senyawa hasil sintesis mempunyai bercak tunggal yang berbeda dari eugenol. Bercak ini memiliki harga Rf yang
lebih besar daripada eugenol. Semakin besar nilai Rf suatu senyawa, maka
A
26
senyawa itu semakin kuat terikat pada fase geraknya yang bersifat kurang polar namun semakin lemah terikat pada fase diam yang bersifat lebih polar. Dari hasil KLT ini bisa disimpulkan bahwa senyawa hasil sintesis memiliki sifat yang kurang polar dibandingkan senyawa eugenol. Sifat yang kurang polar ini dikarenakan adanya tambahan gugus benzoil yang menutupi gugus hidroksi fenolik eugenol.
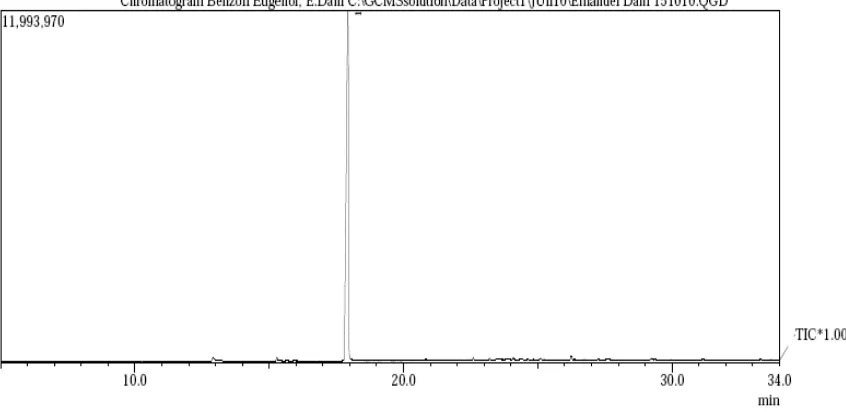
5. Uji Kromatografi Gas
Uji kromatografi gas dilakukan untuk mengetahui senyawa dalam hasil sintesis. Hasil kromatogram menunjukkan bahwa hanya terdapat satu buah peak yang terdeteksi pada Rt 17,91. Hasil ini menunjukkan hanya terdapat satu
senyawa pada senyawa hasil sintesis. Berdasarkan hasil kromatogram diketahui bahwa kemurnian senyawa hasil sintesis adalah 100%. Dengan demikian, dapat disimpulkan bahwa senyawa hasil sintesis ini murni karena hanya mengandung satu senyawa saja.
27
C. Elusidasi Struktur 1. Spektroskopi Infra Merah
Gugus-gugus fungsional dalam senyawa hasil sintesis dapat dianalisis menggunakan spektroskopi infra merah dan kemudian dibandingkan dengan gugus senyawa pembanding, yaitu eugenol.
Gambar 11. Spektra Infra Merah Senyawa Hasil Sintesis
28
senyawa hasil sintesis. Adanya gugus karbonil dan ikatan C-O menunjukkan bahwa senyawa hasil sintesis adalah ester.
Tabel IV. Analisis Gugus Dari Spektra Senyawa Hasil Sintesis Nomor pita Bilangan gelombang (cm-1) Gugus Fungsional
A 1600 C=C Alil
B 1735 C=O Ester
C 1265 C-O Ester
D 1510 C=C Aromatik
Tabel V. Perbandingan Gugus Fungsional Senyawa Eugenol dengan Senyawa Hasil Sintesis
Gugus Fungsi Eugenol Senyawa hasil sintesis
Aromatik (+) (+)
Alil (+) (+)
C-O ester (-) (+)
Karbonil (-) (+)
-OH (+) (-)
29
2. Spektroskopi 1H-NMR
Spektroskopi 1H-NMR berfungsi untuk mengidentifikasi tipe proton dan jumlah proton yang ada pada senyawa hasil sintesis. Spektra senyawa hasil sintesis ditunjukkan oleh gambar 14.
Gambar 12. Spektra Resonansi Magnetik Inti Senyawa Hasil Sintesis
30
Gambar 13. Pencacahan Tipe Proton Benzoil Eugenol
Dari gambar di atas proton bernomor 1 merupakan proton pada karbon yang terikat pada cincin aromatis dan terhibridisasi sp3. Adanya efek anisotropik dari cincin aromatis dan gugus alkena menyebabkan elektron dari proton yang terikat tertarik ke arah cincin dan gugus alkena. Hal ini menyebabkan proton bernomor 1 menjadi kurang terperisai sehingga serapannya berada di bawah medan yaitu di geseran kimia δ 3,2 ppm.
Proton bernomor 2 merupakan proton pada karbon yang terikat pada atom oksigen dengan hibridisasi sp3. Adanya atom oksigen yang bersifat elektronegatif mengakibatkan elektron dari proton tertarik ke atom oksigen. Akibatnya, proton nomor 2 akan menjadi kurang terperisai sehingga menyerap di bawah medan yaitu
di geseran kimia δ 3,7 ppm.
Proton bernomor 3 merupakan proton yang terikat pada atom C terhibridisasi sp2. Adanya efek anisotropik dari C=C menyebabkan proton 3 menjadi tidak terperisai dan akan menyerap di geseran kimia δ 5,2 ppm.
31
terperisai. Dalam benzena, elektron π terdelokasi melingkar di atas cincin
aromatik dan lingkaran elektron tersebut terinduksi dan bersirkulasi dengan adanya medan yang digunakan menghasilkan arus listrik yang disebut arus cincin. Arus cincin mengimbas medan magnet dalam molekul benzena dan memperkuat medan magnet luar sehingga proton-proton pada benzena menjadi tidak terperisai. Proton bernomor 4 dan 5 merupakan proton yang terikat pada benzena sehingga akan memberikan serapan di daerah geseran kimia 6,5-8,4. Akan tetapi, proton 4 dan proton 5 tidak ekivalen. Hal ini dikarenakan proton 5 lebih dekat dengan atom oksigen yang terikat pada gugus karbonil. Saat terjadi resonansi, karbonil akan menarik elektron dari atom oksigen di sebelahnya sehingga atom oksigen tersebut menjadi lebih positif. Karena atom oksigen menjadi lebih positif, maka elektron pada proton 5 lebih tertarik ke atom oksigen. Hal ini menyebabkan proton 5 akan memberi serapan lebih di bawah proton 4. Proton 4 akan
memberikan serapan di geseran kimia δ 6,8 ppm karena hanya dipengaruhi oleh
efek anisotropik dari cincin benzena sedangkan proton 5 akan memberikan
serapan di geseran kimia δ 7,0 ppm.
32
suatu proton dengan karbon yang terikat karbonil, serapannya akan semakin berada di geseran kimia yang lebih rendah. Jadi proton 7 akan berada di geseran kimia yang lebih rendah dari proton 6. Proton 6 akan memberikan serapan di
geseran kimia δ 7,6 ppm karena hanya dipengaruhi oleh efek anisotropik dari
cincin benzena sedangkan proton 7 akan memberikan serapan di geseran kimia δ 8,2 ppm
34
8,2 Multiplet
H C
CH O
O 2
Dari hasil interpretasi spektra 1H-NMR, dapat disimpulkan bahwa senyawa hasil sintesis adalah benzoil eugenol.
3. Spektroskopi Massa
Spektroskopi massa menunjukkan massa molekular dan pola fragmentasi dari senyawa hasil sintesis. Dari hasil spektra massa menunjukkan senyawa hasil sintesis memiliki ion molekul dengan m/z 268. m/z ini sesuai dengan bobot molekul benzoil eugenol, yaitu 268 g/mol. Fragmen ion paling stabil memiliki m/z 105 yaitu yang merupakan pemecahan dari ikatan ester benzoil eugenol. Oleh karena berdasarkan spektra massa dapat disimpulkan bahwa senyawa hasil sintesis adalah benzoil eugenol. Mekanisme fragmentasi dari benzoil eugenol dapat dilihat pada gambar 17.
35
70 eV EI
O
O
OCH3
O
O
OCH3
(m/z=268)
O
O
OCH3
(m/z=105)
O
(m/z=77)
C O
36 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Senyawa benzoil eugenol dapat disintesis dengan mereaksikan eugenol dan benzoil klorida dalam piridina. Kesimpulan ini diperkuat dengan uji-uji yang telah dilakukan. Hasil uji-uji pendahuluan dan elusidasi struktur dengan menggunakan spektroskopi inframerah, 1H-NMR, dan spektrometri massa menunjukkan kesimpulan bahwa senyawa hasil sintesis adalah benzoil eugenol.
2. Rendemen senyawa benzoil eugenol hasil sintesis dari eugenol dan benzoil klorida dalam piridina sebesar 46%.
B. Saran
1. Perlu dilakukan optimasi lama waktu reaksi sintesis benzoil eugenol dengan piridina.
37 Daftar Pustaka
Anonim, 2009, Kegunaan Eugenol, http://www.3dchem.com/molecules.asp? ID=333, diakses tanggal 11 Februari 2010.
Bresnick, M.D, 2004, Intisari Kimia Organik, Penerbit Hipokrates, Jakarta, 96-99, 101-10.
Budavari, 1989, The Merck Index, eleventh edition, Merck&Co.Inc., Rahway, N.J., USA, 9.
Carey, F.A., and Sundberg, R.J., 2007, Advanced Organic Chemistry Part B: Reactions and Synthesis, 4th Edition, Springer Science+Business Media, LCC., New York, 244.
Fabiola, G.F., Damodharan, L., Pattabhi, V., and Nagarajan, K., 2001, Cyclooxygenase-2 – An Attractive Target for Fruitful Drug Design, Current Science, 80(1), 26-34
Fessenden, R. J. and Fessenden, J. S., 1994, Organic Chemistry, diterjemahkan oleh Aloysius Hadyana Pudjaatmaka, Jilid II, Edisi ketiga, Penerbit Erlangga, Jakarta, 82-84, 109-111, 454-462.
Gasparic, J., and Churacek, J., 1978, Laboratory Handbook of Paper and Thin-Layer Chromatography, Ellis Horwood Limited, England.
Gritter, J. R., Bobbit, J. M., and Scharting, A. E., 1991, Pengantar Kromatografi, diterjemahkan oleh Kosasih Padmawinata, Edisi II, ITB, Bandung, 109-112.
MacKenzie, 1967, Experimental Organic Chemistry, 3rd Edition, Prentice-Hall, Inc., Englewood Cliffs, New Jersey.
Morrison, R.T., and Boyd, R.N., 1976, Organic Chemistry, 3rd Edition, Prentige Hall of India Private Ltd., London, 661-667.
Ozturk, A., and Ozbek, H., 2005, The Anti-Inflammatory Activity Of Eugenia Caryophyllata Essential Oil: An Animal Model Of Anti-Inflammatory Activity, Eur. J. Gen. Med., 159-163
38
Sadehgian, I., Seyedi, M.S., Saberi, M.R., Arghiani, Z., Riazi, M., 2007, Design and Synthesis of Eugenol Derivatives, as potent 15-lipooxygenase inhibitors, Bioorganic and Medical Chemistry Journal, 890-901. Sastrohamidjojo, H., 1991, Kromatografi, Edisi Kedua, Liberty, Yogyakarta,
34-36.
Sastrohamidjojo, H., 2001, Spektroskopi, Edisi Kedua, Liberty, Yogyakarta. Scheiman, J.M., and Elta, G.H., 1990, Gastroduodenal Mucosal Damage with
Salsalate versus Aspirin: Results of Experimental Models and Endoscopic Studies in Humans, Semin Arthritis Rheum, 121-127. Silverstein, R. M., and Webster, F. M., 1998, Spectrometric Identification of
Organic Compounds, 6th Ed, John Wiley & Sons, Inc., New York. Vane, S.J., Botting, J., and Botting, R., 1996, Improved Non Steroid
Anti-Inflamatory Drugs COX-2 Enzyme Inhibitors, Kluver Academic Publishers, London.
Vogel, A.I., 1956, A Textbook of Practical Organic Chemistry, 3rd Edition, 582, Longman, Green & Co., London.
39
40
Lampiran 1. Perhitungan Jumlah Rendemen Benzoil Eugenol
O
0,041 mol 0,041 mol 0,041 mol
41
42
43
44
45
46
Lampiran 7. Spesifikasi Alat Gas Chromatography-Mass Spectrometry
47
Lampiran 8. Spesifikasi Infrared Spectrophotometry Senyawa Hasil Sintesis
Alat : Fourier Transform Infrared Spectrophotometer (FT-IR)-PRESTIGE-21-SHIMADZU
λ Scanning : 400-4000 nm
48
Lampiran 9. Spesifikasi 1H-NMR Spectrometry Senyawa Hasil Sintesis
Alat : 1H-NMR JEOL-MY60
49
BIOGRAFI PENULIS
Emanuel Dani Ramdani lahir di Kuningan, 24 Desember 1989 sebagai putra ketiga dari tiga bersaudara pasangan Yohanes Jupri dan Lucia Darwasih. Penulis menempuh pendidikan di SD Yos Sudarso Cigugur (1995-2001) dan melanjutkan ke SLTP Yos Sudarso Cigugur (2001-2004). Setelah menyelesaikan pendidikan di SMA Kolese de Britto (2004-2007), penulis melanjutkan kuliah di Fakultas Farmasi Universitas Sanata Dharma (2007-sekarang). Selama masa kuliah, penulis pernah menjadi asisten praktikum Kimia Organik (2009-2010), asisten praktikum Kimia Dasar (2009), dan asisten praktikum Spektroskopi (2010). Penulis juga aktif
dalam kegiatan kampus yaitu: anggota UKF “Squadra Viola”, Sie Acara Panitia