i
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Oleh :
Karolina Reyni Kristiani NIM : 068114102
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
SKRIPSI
Presented as partitial fulfilment of the requirement To Obtain Sarjana Farmasi
In Faculty of Pharmacy
By :
Karolina Reyni Kristiani NIM : 068114102
FACULTY OF PHARMACY SANATA DHARMA UNIVERSITY
v
kananku, aku tidak goyah. Sebab itu hatiku bersukacita dan jiwaku
bersorak–sorak, bahkan tubuhku akan diam dengan tentram, sebab Engkau
tidak menyerahkan aku kepada dunia orang mati, dan tidak membiarkan
Orang Kudus-Mu melihat kebinasaan. Engkau memberitahukan
kepadaku jalan kehidupan; Engkau melimpahi aku dengan sukacita
dihadapan-Mu”
(Kis, 2 :25-28)
Kupersembahkan karya serdehana ini untuk:
Tuhan Yesus yang selama ini setia menjadi sahabatku dan menjadi
sumber kekuatan serta pengharapan ketika aku lemah.
Ibu-Bapakku, terimakasih atas cinta, doa, semangat dan perhatiannya.
Adik-adikku ; Ipin, Ido, dan Karin.
vii
menyelesaikan skripsi yang berjudul “Ketoksikan Akut Sari Wortel (Daucus carota L.) pada Tikus Betina Galur Wistar dengan Kajian Terhadap Histologi Organ Hati, Aktivitas SGPT dan SGOT.” Skripsi ini disusun guna memenuhi salah satu syarat untuk mencapai gelar Sarjana Strata Satu Studi Ilmu Farmasi (S.Farm) pada Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Tersusunnya skripsi ini tidak luput dari bantuan dan dorongan berbagai pihak. Untuk itu penulis mengucapkan terimakasih kepada :
1. Tuhan Yesus Kristus yang telah menyertai, membimbing dan menguatkan penulis terkhususnya dalam menyelesaikan penelitian ini.
2. Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
3. Yosef Wijoyo, M.Si., Apt. selaku dosen pembimbing yang telah menyediakan waktu dan tenaga untuk memberikan petunjuk, arahan, saran dan bimbingan dalam penyusunan skripsi ini.
4. Ipang Djunarko, S.Si., Apt. dan Phebe Hendra, Ph.D., Apt. selaku dosen penguji skripsi yang telah memberikan waktu, saran dan masukan demi kesempurnaan skripsi ini.
viii
yang telah memberikan petunjuk dan bimbingan statistik untuk pengolahan data hasil penelitian.
8. Mas Heru, Mas Parjiman, dan Mas Kayat yang selalu meluangkan waktu untuk membantu dalam pelaksanaan penelitian ini.
9. Orang tua dan adik-adik penulis yaitu Vina, Ido dan Karin yang telah memberikan dukungan moral dan materiil selama menyusun skripsi ini.
10. Sahabat-sahabatku, Gessy, Manik, Shiela, Rocha, Sari dan Ping yang telah mendukung dan memberi semangat dalam penyusunan skripsi ini.
11. Seluruh keluarga besarku : Nenek, Tuo elas, Tuo Ondo, Tuo Agus, Kak Warti, Kak Feni, Kak Vina, Tante Meli, Icha, Titi, Om dan Tante Yong Sin untuk dukungan dan doanya.
12. Pastor Indro, Pastor Niko, Fr. Galih dan Setiawan untuk masukkan yang diberikan kepada penulis ketika berada pada masa-masa sulit.
13. Kwee Cahya Faisal untuk cinta, dukungan, perhatian dan semangat dari awal masa kuliah hingga semester VI.
ix banyak membantu penyelesaian skripsi ini.
Semoga Tuhan YME memberikan perlindungan dan karunianya kepada semua pihak yang telah berjasa dalam penyusunan skripsi ini.
Penulis menyadari bahwa penelitian ini masih banyak kekurangannya. Untuk itu kritik dan saran yang membangun sangat penulis harapkan. Akhir kata semoga skripsi ini dapat memberi manfaat bagi para pembaca.
x
dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 25 November 2009 Penulis
Karolina Reyni Kristiani
xi
Penelitian ini merupakan penelitian eksperimental murni dengan rancangan acak lengkap pola searah. Hewan uji dibagi dalam 5 kelompok yaitu kelompok kontrol, kelompok dosis 66,551 g/kg BB; 79,861 g/kg BB; 95,833 g/kg BB; 115 g/kg BB. Penelitian ini mengamati perubahan berat badan, gejala klinis, jumlah tikus yang mati, histologi hati, aktivitas SGPT dan SGOT. Analisis statistik normalitas data menggunakan uji Shapiro Wilk. Aktivitas SGPT dan SGOT antar kelompok perlakuan dan data berat organ relatif dianalisis dengan
One-Way ANOVA atau Kruskal-Wallis. Aktivitas SGPT dan SGOT sebelum dan
sesudah perlakuan dibandingkan dengan uji paired T-test atau uji Wilcoxon. Perubahan berat badan dianalisis dengan menggunakanGeneral Linear Methods-Multivariate.
Hasil penelitian menunjukan bahwa sari wortel tidak menyebabkan kematian subyek uji sehingga diperoleh LD50semu sari wortel (Daucus carotaL.)
adalah >115 g/kg BB. Pada pemberian sari wortel tidak menimbulkan gejala toksik dan secara histologi tidak menunjukan perubahan struktur pada sel hati. Pemberian akut sari wortel tidak menyebabkan perubahan aktivitas SGPT dan SGOT.
xii
This research is a pure experimental research by completed random of direct-current plan. The tested animals were divided into five treated groups namely control group, dosage groups of carrot juice at 66,551 g/kg bodyweight; 79,861 g/kg bodyweight; 95,833 g/kg bodyweight; 115 g/kg bodyweight. This research observed the change of bodyweight, clinical symptom, the number of the dead rat, the histology of liver, and the activity of SGPT and SGOT. The analytical statistic of normality data used the test of Shapiro Wilk. The activity of SGPT and SGOT of each of the treated groups and the data of relative weight of liver were analized by One way ANOVA or Kruskal-Wallis. Before and after treatment the activity of SGPT and SGOT were compared by paired T-test or Wilcoxon test. The change of the bodyweight was analized by General Linear Methods-Multivariate.
The result showed that the carrot juice had no death effect to the tested animals so that pseudo LD50 of the carrot juice is > 115 g/kg bodyweight. Giving
the carrot juice didn’t cause toxic symptoms. It didn’t show the change of any liver cell’s structure either.
Giving the accute of carrot juice does not cause the change of SGPT and SGOT activities.
xiii
HALAMAN PERSETUJUAN PEMBIMBING………... iii
HALAMAN PENGESAHAN………... iv
HALAMAN PERSEMBAHAN………... v
PERNYATAAN PERSETUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS...vi
PRAKATA... vii
PERNYATAAN KEASLIAN KARYA... x
INTISARI... xi
ABSTRACT... xii
DAFTAR ISI...xiii
DAFTAR GAMBAR...xvi
DAFTAR TABEL...xx
DAFTAR LAMPIRAN...xxii
BAB I. PENGANTAR A. Latar Belakang...1
1. Permasalahan... 3
2. Keaslian penelitian...4
3. Manfaat penelitian... 6
B. Tujuan Penelitian...6
xiv
B. Uji Toksikologi... 10
C. Uji Toksisitas Akut... 11
D. Median Lethal Dose(LD50)... 12
E. Uraian Tanaman... 13
F. Bata Karoten...17
G. Hati... 18
H. Tipe Kerusakan Pada Hati... 21
1. Perlemakan hati... 21
2. Nekrosis pada hati... 21
3. Sirosis... 24
4.Miscellaneous effect... 24
5. Karsinogenesis...25
6. Degenerasi... 25
7. Kongesti...26
8. Peradangan...27
I. Evaluasi Kerusakan Hati... 27
J. Aminotransferase...28
K. Landasan Teori... 30
xv
C. Definisi Operasional... 32
D. Bahan dan Alat... 33
1. Bahan...33
2. Alat... 34
E. Tata Cara Penelitian... 35
1. Penyiapan hewan uji...35
2. Pengelompokan hewan uji...35
3. Pengumpulan bahan...36
4. Determinasi tanaman... 36
5. Pembuatan sediaan uji... 36
6. Penentuan dosis... 37
7. Uji toksisitas... 37
8. Pengamatan...38
9. Pembuatan dan pemeriksaan preparat histologi... 38
F. Tata Cara Analisis Hasil ... 39
BAB IV. HASIL DAN PEMBAHASAN A. Determinasi Tanaman Wortel (Daucus carotaL.)...42
B. Preparasi Sari Umbi Wortel (Daucus carotaL.)...42
C. Penentuan Dosis...43
xvi
H. Berat Organ Hati Relatif dan Pemeriksaan Histologi Organ Hati...61
BAB V. KESIMPULAN DAN SARAN A. Kesimpulan... 74
B. Saran... 74
DAFTAR PUSTAKA... 76
LAMPIRAN... 81
xvii
Gambar 2. Organ Hati... 20
Gambar 3. Histologi Organ Hati... ... 20
Gambar 4. Pola Nekrosis Hati... 23
Gambar 5. Skema Pengelompokan Hewan Uji... 35
Gambar 6. Skema Kerja Preparasi Sari Wortel (Daucus carotaL.)... 36
Gambar 7.Kurva Purata Perubahan Berat Badan Tikus Hari ke-0, ke-7, ke-14 Setelah Pemberian Sari Wortel (Daucus carota L.) secara Oral Dosis Tunggal ... 48
Gambar 8. Diagram Perbandingan Purata SGPT Tikus Galur Wistar Sebelum dan Sesudah 24 Jam Setelah Pemberian Sari Wortel (Daucus carota L.)...52
Gambar 9. Diagram Perbandingan Purata SGPT Tikus Galur Wistar Sebelum dan Sesudah 14 Hari Setelah Pemberian Sari Wortel (Daucus carotaL.).. 54
Gambar 10. Diagram Perbandingan Purata SGOT Tikus Galur Wistar Sebelum dan Sesudah 24 Jam Setelah Pemberian Sari Wortel (Daucus carota L.)...57
xviii
Gambar 13.Contoh Irisan Melintang Jaringan Normal Hati Tikus Betina Galur Wistar Sesudah 24 Jam Setelah Pemberian Sari Wortel (Daucus carota
L.), Kelompok Kontrol Negatif, Perbesaran 200x, Pengecatan Hematosiklin-Eosin... 65 Gambar 14.Contoh Irisan Melintang Jaringan Normal Hati Tikus Betina Galur Wistar Sesudah 24 Jam Setelah Pemberian Sari Wortel (Daucus carota
L.), Kelompok Dosis 66,551 g/kg BB, Perbesaran 200x, Pengecatan Hematosiklin-Eosin... 66 Gambar 15. Diagram Purata Berat Organ Hati Relatif Tikus Betina Galur Wistar Sesudah 14 Hari Setelah Pemberian Sari Wortel (Daucus carotaL.).. 68 Gambar 16. Contoh Irisan Melintang Jaringan Hati Tikus Betina Galur Wistar
xix
xx
Tabel II. Taksonomi Tanaman Wortel (Daucus carotaL.)... 13 Tabel III. Ciri-Ciri Aminotransferase Yang Berkaitan dengan Organ Hati... 29 Tabel IV. Jumlah Tikus Yang Mati Pada Pengamatan 24 Jam Setelah Pemberian
Dosis Tunggal Sari Wortel (Daucus carotaL.)... 44 Tabel V. Jumlah Tikus Yang Mati Pada Pengamatan Hari ke-14 Setelah
Pemberian Dosis Tunggal Sari Wortel (Daucus carotaL.)... 44 Tabel VI. Hasil Pemeriksaan Kualitatif Gejala-Gejala Toksik Tikus Betina Sesudah 24 Jam dan 14 hari Setelah Pemberian Dosis Tunggal Sediaan Uji Sari Wortel (Daucus carotaL.)... 46 Tabel VII. Purata Perubahan Berat Badan Tikus Hari ke-0, ke-7, dan ke-14 Setelah Pemberian Sediaan Uji Sari Wortel (Daucus carota L.) secara Oral Dosis Tunggal... 48 Tabel VIII. Perbandingan Purata SGPT Tikus Betina Galur Wistar Sebelum dan
Sesudah 24 Jam Setelah Pemberian Sari Wortel (Daucus carota L.) secara Oral dengan Dosis Tunggal ...51 Tabel IX. Perbandingan Purata SGPT Tikus Betina Galur Wistar Sebelum dan
xxi
Tabel XI. Perbandingan Purata SGOT Tikus Betina Galur Wistar Sebelum dan Sesudah 14 Hari Setelah Pemberian Sari Wortel (Daucus carota L.) secara Oral dengan Dosis Tunggal...59 Tabel XII. Purata Berat Organ Hati Relatif Tikus Betina Galur Wistar Pada 24
Jam Setelah Pemberian Sari Wortel (Daucus carota L.) secara Oral dengan Dosis Tunggal... 63 Tabel XIII. Hasil Pemeriksaan Histologi Organ Hati Relatif Tikus Betina Galur
Wistar Pada 24 Jam Setelah Pemberian Sari Wortel (Daucus carota L.) secara Oral dengan Dosis Tunggal...65 Tabel XIV. Purata Berat Organ Hati Relatif Tikus Betina Galur Wistar Pada 14
Hari Setelah Pemberian Sari Wortel (Daucus carota L.) secara Oral dengan Dosis Tunggal... 67 Tabel XV.Hasil Pemeriksaan Histologi Organ Hati Relatif Tikus Betina Galur
xxii
Lampiran 2. Umbi Wortel (Daucus carota L.)...81 Lampiran 3.Juice Extractor...82 Lampiran 4. Preparasi Sari Wortel (Daucus carotaL.)... 82 Lampiran 5. Sari Wortel (Daucus carotaL.)... 83 Lampiran 6. Penimbangan Hewan Uji... 83 Lampiran 7. Makroskopi Organ Hati Tikus Betina Galur Wistar pada 24 Jam
Setelah Pemberian Sari Wortel (Daucus carotaL.)... 84 Lampiran 8. Makroskopi Organ Hati Tikus Betina Galur Wistar pada Hari ke-14
Setelah Pemberian Sari Wortel (Daucus carotaL.)... 84 Lampiran 9. Surat Hasil Determinasi Tanaman Wortel (Daucus carota
L.)... 85 Lampiran 10. Surat Keterangan Pembelian Hewan Uji... 86 Lampiran 11. Hasil Uji SGPT dan SGOT Pada Sampel Darah Tikus Betina Galur
Wistar Sebelum Pemberian Sari Wortel (Daucus carota
L.)... 88 Lampiran 12. Hasil Uji SGPT dan SGOT Pada Sampel Darah Tikus Betina Galur
Wistar Pada 24 Jam Setelah Pemberian Sari Wortel (Daucus carota
xxiii
Lampiran 14. Hasil Pemeriksaan Histologi Organ Hati 24 Jam Setelah Pemberian Sari Wortel (Daucus carotaL.)... 92 Lampiran 15. Hasil Pemeriksaan Histologi Organ Hati Pada Hari ke-14 Setelah
Pemberian Sari Wortel (Daucus carotaL.)... 93 Lampiran 16. Berat Organ Hati 24 Jam dan Hari ke-14 Setelah Pemberian Sari
Wortel (Daucus carotaL.)... 94 Lampiran 17. Uji Normalitas Data Berat Badan Tikus Betina Galur Wistar Pada
Hari ke-0, ke-7, dan ke-14... 94 Lampiran 18. Analisis Statistik Data Berat Badan Tikus Betina GalurWistar Hari
ke-0, ke-7 dan ke-14 setelah Pemberian Sari Wortel ...95 Lampiran 19. Analisis Statistik Data Berat Berat Organ Hati Relatif Pada Tikus
Betina Galur Wistar Pada 24 Jam Setelah Pemberian Sari Wortel... 98 Lampiran 20. Analisis Statistik Data Berat Berat Organ Hati Relatif Pada Tikus
Betina Galur Wistar Sesudah 14 Hari Setelah Pemberian Sari Wortel... 99 Lampiran 21. Analisis Statistik Data Aktivitas SGPT Antara Kelompok Perlakuan
xxiv
Lampiran 23. Analisis Statistik Data Aktivitas SGOT Antara Kelompok Perlakuan Sebelum dan Sesudah 24 Jam Setelah Pemberian Sari Wortel... 104 Lampiran 24. Analisis Statistik Data Aktivitas SGOT Antara Kelompok Perlakuan
Sebelum dan Sesudah 14 Hari Setelah Pemberian Sari Wortel...105 Lampiran 25. Uji Statistik Aktivitas SGPT Sebelum dan Sesudah 24 Jam
Pemberian Sari Wortel Pada Kelompok Kontrol, Kelompok Dosis 66,551 g/kg BB, Kelompok Dosis 78,861 g/kg BB, Kelompok Dosis 95,833 g/kg BB, dan Kelompok Dosis 115 mg/kg BB... 106 Lampiran 26. Uji Statistik Aktivitas SGPT Sebelum dan Sesudah 14 Hari
Pemberian Sari Wortel Pada Kelompok Kontrol, Kelompok Dosis 66,551 g/kg BB, Kelompok 78,861 g/kg BB, Kelompok 95,833 g/kg
BB, dan Kelompok Dosis 115 mg/kg
BB... 109 Lampiran 27. Uji Statistik Aktivitas SGOT Sebelum dan Sesudah 24 Jam
xxv
Pemberian Sari Wortel Pada Kelompok Kontrol, Kelompok Dosis 66,551 g/kg BB, Kelompok 78,861 g/kg BB, Kelompok 95,833 g/kg
BB, dan Kelompok Dosis 115 mg/kg
BB... 113 Lampiran 29. Hasil Randomisasi Hewan Uji...117 Lampiran 30. Hasil Pemeriksaan Kualitatif Gejala Toksik Tikus Betina Kelompok
Kontrol Yang Tidak Diberi Sediaan Uji... 118 Lampiran 31. Hasil Pemeriksaan Kualitatif Gejala Toksik Tikus Betina Kelompok
66,551 g/kg BB dari Sediaan Uji... 119 Lampiran 32. Hasil Pemeriksaan Kualitatif Gejala Toksik Tikus Betina Kelompok
79,861 g/kg BB dari Sediaan Uji... 120 Lampiran 33. Hasil Pemeriksaan Kualitatif Gejala Toksik Tikus Betina Kelompok
95,833 g/kg BB dari Sediaan Uji... 121 Lampiran 34. Hasil Pemeriksaan Kualitatif Gejala Toksik Tikus Betina Kelompok
115 g/kg BB dari Sediaan Uji... 122 Lampiran 35. Data Penimbangan Berat Badan Tikus Betina GalurWistar... 123 Lampiran 36. Perhitungan Dosis...124 Lampiran 37. Perhitungan LD50ke Manusia...126
1
A. Latar Belakang
Dewasa ini terjadi peningkatan penggunaan bahan alam sebagai alternatif pengobatan untuk penyakit, yang dinilai lebih aman dan jarang terjadi efek samping. Selain itu, cara penggunaan yang sederhana, mudah didapat, harga terjangkau dan manjur membuat bahan alam lebih disukai dalam pengobatan. Penggunaan bahan alam dalam pengobatan merupakan suatu kenyataan yang bersifat empirik untuk mencapai kesembuhan atau pemeliharaan dan peningkatan taraf kesehatan yang diwariskan secara turun-temurun dan telah menjadi bagian integral dalam kehidupan masyarakat, dalam hal ini masyarakat Indonesia (Anonim, 2003).
Bahan alam sebagai alternatif pengobatan dikenal dengan sebutan obat tradisional. Obat tradisional adalah bahan atau ramuan bahan yang berupa bahan tumbuhan, bahan hewan, bahan mineral, sediaan sarian (galenik) atau campuran dari bahan-bahan tersebut yang secara turun-temurun telah digunakan untuk pengobatan berdasarkan pengalaman (Anonim, 1989; Anonim, 1992).
Daucus carota L. atau wortel merupakan tanaman yang berkhasiat
20,1%-94,6%. Kemampuan hepatoprotektif ini diduga karena wortel mempunyai kandungan utama senyawa beta karoten, yang dikenal sebagai antioksidan dan penangkap radikal yang efektif (Hamilton, Kalu, Pisk, Padley dan Pierce, 1997; Bohne, 1997). Karotenoid selain berfungsi sebagai antioksidan, juga berperan sebagai prooksidan. Dalam tekanan oksidatif dan terkena intensitas cahaya yang tinggi, beta karoten akan mengalami autooksidasi menjadi apo 8, 10, 12 dan 14-karotenal dapat menyebabkan kerusakan sel (Null, 2000). Pada penelitian Palozza, Calviello, De Leo, Serini dan Bartoli (2000) ditemukan bahwa karotenoid dapat bertindak sebagai prooksidan melalui modulasi kandungan besi pada jaringan, dengan ditemukan konsentrasi besi yang besar pada hati mencit yang diberikan karotenoid (Canthaxanthin). Menurut Halliwell dan Guitteridge (1990), besi dapat meningkatkan kadar radikal bebas oksi endogen melalui reaksi fenton yang berperan dalam proses oksidasi.
dan Glutamat Axaloasetat Piruvat Transaminase (GOT). Aktivitas SGPT akan meningkat signifikan apabila terjadi kerusakan akut pada hati, sedangkan aktivitas SGOT akan meningkat signifikan bila terjadi kerusakan kronis pada hati.
Uji toksisitas akut merupakan salah satu bagian dari uji praklinik yang menguji toksisitas suatu senyawa kepada hewan uji dalam waktu singkat pada sekali pemberian (Loomis, 1978). Pada penelitian ini, dilakukan uji ketoksikan akut sari wortel dengan kajian pada aktivitas SGPT dan SGOT serta histologi organ hati. Pengkajian secara khusus pada organ hati karena organ hati merupakan organ memiliki fungsi utama yaitu mengumpulkan dan membiotransformasi xenobiotik sehingga dapat dieliminasi keluar dari tubuh. Fungsi ini akan meningkat bila ada sejumlah besar senyawa kimia yang masuk atau diberikan pada hewan uji dalam studi toksisitas (Lu, 1995). Sari wortel diduga berpotensi menyebabkan toksisitas karena adanya senyawa karotenoid yang dapat bersifat sebagai prooksidan. Bersama dengan ED50 sari wortel yang memberikan efek
hepatoprotektif (1,05 ml/kg BB) dari penelitian Wijoyo (2004), nilai LD50 dari
penelitian ini dapat digunakan untuk menentukan indeks terapi sari wortel yang merupakan parameter keamanan.
1. Permasalahan
Berdasarkan uraian yang telah dikemukanan sebelumnya, permasalahan yang muncul adalah:
a. Berapa besar potensi ketoksikan akut (LD50) sari wortel (Daucus carota L.)
b. Apa saja gejala ketoksikan yang timbul akibat pemberian akut sari wortel (Daucus carotaL.) pada tikus betina galur Wistar ?
c. Apakah pemberian sari wortel (Daucus carota L.) dalam waktu singkat dapat menyebabkan terjadinya toksisitas ditinjau dari parameter histologi hati, aktivitas SGPT (serum Glutamat Piruvat Transaminase) dan SGOT (serum Glutamat Axaloasetat Transaminase) ?
2. Keaslian penelitian
Penelitian tentang wortel telah banyak dilakukan, diantaranya:
a. Uji Toksisitas Akut Perasan Umbi Wortel (Daucus carota L.) Terhadap
Artema Salina Leachserta Profil Kromatografi oleh Dewi (2000).
b. Antaraksi Sari Wortel (Daucus carota L.)-Parasetamol Kajian Terhadap Kehapotoksikan dan Kinerja Toksikokinetika Parasetamol pada Tikus oleh Wijoyo (2001).
c. Daya Antiinflamasi Infusa Umbi Wortel (Daucus carota L.) pada mencit Jantan oleh Hapsari (2003).
d. Daya Antiinflamasi Perasan Umbi Wortel (Daucus carota L.) pada Mencit Putih Jantan oleh Winarsih (2003).
e. Daya Antiinflamasi Sari Umbi Wortel (Daucus carota L.) pada Mencit Jantan Kajian Terhadap Lama Masa Pemberian oleh Rasmandani (2004).
g. Efek Hepatoprotektif Sari Umbi Wortel (Daucus carotaL.) pada Tikus Jantan Terinduksi Parasetamol: Kajian terhadap Lama Masa Preperlakuan oleh Wijoyo (2004).
h. Daya Analgesik Kombinasi Jus Wortel (Daucus carota L.) dan Apel (Pyrus malusL.) pada Mencit Betina oleh Berchmans (2005).
i. Pengaruh PerlakuanBeta-karoten secara Per Oral terhadap Aktivitas Glutation S Transferase KelasMUHati Tikus dengan Subtrat 1,2 Dikloro 4 Nitrobenzen oleh Suteja (2006).
j. Inotropic and Cardioprotective Effects of Daucus carota Linn. on
Isoproterenol-Induced Myocardial Infarctionoleh Muralidharan,et al.(2008) k. Toksisitas Akut Sari Wortel (Daucus carota L.) Kajian Terhadap Organ
Lambung, Hati dan Ginjal pada Mencit Putih Betina Galur Balb/C oleh Karlina (2009).
l. Pengaruh Pemberian Akut Jus Wortel (Daucus carota L.) pada Tikus Jantan Galur Wistar Kajian Terhadap Organ Ginjal dan Kadar Kreatinin Serum oleh Thejo (2009).
m. Pengaruh Pemberian Akut Jus Wortel (Daucus carota L.) pada Tikus Jantan Galur Wistar Kajian Terhadap Organ Hati dan Aktivitas SGPT oleh Novianti (2009).
dengan kajian terhadap aktivitas SGPT dan SGOT serta histologi organ hati belum pernah dilakukan sebelumnya.
3. Manfaat penelitian
a. Manfaat teoritis
Memberikan sumbangan bagi ilmu pengetahuan mengenai ketoksikan akut sari wortel (Daucus carata L.) terkait gejala toksik, spektrum efek toksik terhadap organ hati, aktivitas SGPT dan SGOT apabila sari tersebut diberikan dalam waktu singkat.
b. Manfaat praktis
Memberikan informasi kepada masyarakat mengenai ketoksikan akut sari wortel (Daucus carota L.) dinilai dari aktivitas SGPT dan SGOT serta histologi organ hati setelah pemberian sari wortel.
B. Tujuan Penelitian
1. Tujuan umum
Mengetahui ketoksikan akut pemberian sari wortel (Daucus carota L.) pada tikus betina galur Wistar.
2. Tujuan khusus
a. Mengetahui besar potensi ketoksikan akut (LD50) sari wortel (Daucus carotaL.) pada tikus betina galur Wistar.
8
A. Toksikologi
efek toksik selalu merupakan fungsi dosis dan waktu (lama pemejanan). Keberadaan ini dipengaruhi oleh absorpsi, distribusi, metabolisme dan eskresi serta keefektifan antaraksi zat beracun dengan sel sasaran (Koeman, 1987; Donatus, 2001).
Menurut Donatus (2001), dalam mempelajari toksikologi ada empat asas utama yang perlu dipahami, meliputi kondisi pemejanan dan kondisi makhluk hidup (kondisi efek toksik), mekanisme aksi efek toksik, wujud efek toksik, dan sifat efek toksik atau pengaruh berbahaya racun. Pemahaman terhadap kondisi pemejanan dan kondisi makhluk hidup akan mempermudah dalam menghayati aneka ragam faktor yang mempengaruhi ketoksikan suatu senyawa. Pemahaman terhadap mekanisme aksi akan mempermudah dalam menghayati penyebab timbulnya efek toksik, sedangkan pemahaman terhadap wujud dan sifat efek toksik mempermudah penghayatan respon tubuh terhadap ketoksikan suatu senyawa dan tolok ukur kualitatifnya. Selain itu, tolok ukur kuantitatif ketoksikan suatu senyawa dengan mudah dapat dihayati melalui pemahaman terhadap kekerabatan antara kondisi pemejanan dan wujud efek toksik.
tersebut, selanjutnya dapat dievaluasi batas aman suatu senyawa atau racun apapun (Donatus, 2001).
B. Uji Toksikologi
Penelitian toksisitas pada hewan coba sering mengungkapkan serangkaian efek akibat pejanan toksikan dalam berbagai dosis untuk berbagai masa pejanan. Karenanya, penelitian ini merupakan sumber data utama bagi evaluasi toksikologi. Efek toksikan antara lain berhubungan dengan masa pejanan (Lu, 1995).
Uji toksikologi bertujuan untuk mengeliminasi resiko potensi toksik yang dimiliki suatu senyawa dengan mengevaluasi keberbahayaan senyawa tersebut untuk menentukan batas aman bila digunakan pada manusia yang mana nilai ini diketahui dari hasil ujiin vivo pada hewan uji. Hal ini sangat penting karena dari analisis hubungan kualitatif antara struktur dan aktivitas saja, tidak bisa diekstrapolasi potensi ketoksikan secara biologis (toksikologi) menggunakan hewan uji. Oleh karena itu, uji toksikologi tidak etis jika langsung diujikan pada manusia (Hodgson, 2000).
terkontrol, durasi pemejanan dapat diatur, serta dapat dilakukan pemeriksaan secara rinci pada semua jaringan (histopatologi) (Hodgson, 2000). Pemilihan hewan uji idealnya didasari atas kesamaan sistem metabolisme zat kimia tersebut dengan manusia, serta diberikan melalui jalur yang biasa digunakan pada manusia (Lu, 1995).
Oleh Donatus (2001), uji toksikologi dibagi menjadi 2 golongan yaitu uji ketoksikan tak khas dan uji ketoksikan khas. Uji ketoksikan tak khas merupakan uji toksikologi yang dirancang untuk mengevaluasi keseluruhan atau spektrum efek toksik suatu senyawa pada aneka ragam jenis hewan uji, sedangkan uji ketoksikan khas ialah uji toksikologi yang dirancang untuk mengevaluasi secara rinci efek yang khas dari suatu senyawa pada aneka ragam jenis hewan uji.
C. Uji Toksisitas Akut
kasus tertentu selama 7-14 hari. Pengamatan dilakukan terhadap gejala-gejala klinis, jumlah hewan yang mati dan histopatologi organ (Donatus, 2001).
Dari uji toksisitas akut akan diperoleh data kualitatif dan kuantitatif. Data kualitatif yaitu penampakan klinis dan morfologis efek toksik senyawa uji sedangkan data kuantitatif berupa LD50 (Donatus, 2002; Priyanto, 2007) dapat
digunakan untuk menentukan potensi ketoksikan akut senyawa relatif terhadap senyawa lain dan untuk memperkirakan dosis pada uji lain. Pengujian ini juga dapat menunjukkan organ sasaran yang mungkin dirusak dan efek toksik spesifiknya, serta memberikan petunjuk tentang dosis yang sebaiknya digunakan dalam pengujian yang lebih lama (Lu, 1995).
D. Median Lethal Dose(LD50)
Median Lethal Dose (LD50) didefinisikan sebagai dosis suatu senyawa
yang akan menimbulkan kematian pada 50% hewan uji. LD50 merupakan harga
perhitungan yang diperoleh secara statistik. Ini merupakan suatu suatu harga perhitungan yang menggambarkan estimasi yang paling baik dari dosis yang diperlukan untuk menimbulkan kematian pada 50% hewan uji, karenanya selalu disertai dengan suatu putara estimasi dari harga kesalahannya seperti probabilitas kisaran nilainya (Loomis, 1978).
Potensi ketoksikan akut (LD50) sedian uji menurut Loomis (1978) dapat
Tabel I. Kategori Potensi Ketoksikan Akut (LD50) Menurut Loomis (1978)
Kategori Kisaran dosis
Luar biasa toksik < 1 mg/kg
Sangat toksik 1-50 mg/kg
Cukup toksik 50-500 mg/kg
Sedikit toksik 0,5-5 g/kg
Praktis tidak toksik 5-15 g/kg
Relatif kurang berbahaya >15 g/kg
E. Uraian Tanaman
1. Taksonomi tanaman
Taksonomi tanaman wortel (Daucus carotaL.) dapat dilihat pada Tabel II.
Tabel II. Taksonomi Tanaman Wortel (Daucus carotaL.)(Backer dan Van Den Brink, 1968)
Divisio :Spermatophyta
Sub-divisio : Angiospermae
Classis : Dicotyledonae
Ordo : Umbelliferales
Familia : Apiaceae
Genus : Daucus
Spesies :Daucus carotaL.
2. Kandungan kimia
Setiap 100 g umbi segar mengandung 42,00 kalori; protein 1,20 g; lemak 0,30 g; karbohidrat 9,30 g; kalsium 39,00 mg; fosfor 37,00 mg; zat besi 0,30 g; vitamin A 12.000,00 SI; vitamin B1 0,06 mg; vitamin C 6,00 mg; air 88,20 g;
bagian yang dapat dicerna 88,00 gram (Rukmana,1995). Kandungan lain yang telah diketahui antara lain pyrrolidine, daucine, daucosterne, minyak yang penting adalah imonene, pinene, cineole. Di dalam benih berisi asam tiglat,
dalam jumlah besar. Provitamin A adalah bentuk awal dari vitamin A setelah dikonsumsi (Patijo, 2006). Provitamin A tersebut adalah beta karoten.
Sebagai bahan pangan wortel mentah mengandung lebih banyak nutrisi dibandingkan wortel yang telah dimasak. Satu umbi wortel yang berukuran sedang dengan berat 2,5 ons mengandung 19 mg kalsium, 32 mg fosfor, 233 mg kalium, 7 mg vitamin C, 7 g karbohidrat, dan 2.025 RE (Retinol Equivalent) vitamin A (Roberti, 2000).
3. Nama daerah
Tanaman wortel sebenarnya berasal dari luar negeri yang beriklim sedang (subtropis) atau tepatnya berasal dari timur dekat (Asia kecil, Trans Kaukasia, Iran, dan dataran tinggi Turkmenistan) dan Asia tengah. Tanaman wortel ditemukan sekitar 6500 tahun yang lalu. Indonesia mulai membudidayakan di daerah Lembang dan Cipanas, Jawa Barat kemudian menyebar luas di seluruh Indonesia.
Tanaman wortel di Inggris disebut carrot, sedangkan di Indonesia dikenal dengan nama daerahnya masing-masing antara lain yaitu :bortol (Sunda, Priangan),wertel, wertol, danortel(Madura) (Rukmana, 1995).
4. Morfologi tanaman
Bunga payung majemuk; ibu tangkai bunga majemuk panjamg 2-25 cm; terdapat bunga steril berwarna gelap; tangkai ½-11/2 cm; banyak terdapat
cm; kelopak bunga dengan ujung runcing; mahkota bunga berwarna putih atau merah muda pucat; buah panjangnya 3-4 mm; kasar dan sering melengkung. Batang beralur, berbulu kaku. Daun majemuk menyirip; daun muda atau bagiannya seperti mata tombak atau runcing, tegak; akar (dalam pertumbuhan liar) kuat (Backer dan Van den Brink, 1968).
5. Ekologi dan penyebaran
6. Budidaya tanaman wortel
Kegiatan budidaya ada beberapa tahap, yaitu pengelohan tanah, penggunaan benih yang bermutu, teknik penanaman, penyediaan pupuk, dan pestisida, serta pemeliharaan intensif, semuanya itu penting untuk hasil yang optimum. Tanaman wortel diperbanyak dengan bijinya. Kriteria biji yang bermutu tinggi antara lain mempunyai daya kecambah dan vigor yang tinggi, tahan terhadap penyakit dan menghasilkan produksi yang tinggi (Berlian, 1995).
7. Kegunaan di masyarakat
F. Beta Karoten
Beta karoten merupakan salah satu dari sekitar 500 karotenoid yang ada di alam dan mempunyai aktivitas vitamin A paling tinggi. Dalam metabolisme, diperkirakan 1/3 beta karoten diabsorpsi dan separuhnya diubah menjadi retinol. Sekitar 1/6 beta karoten digunakan sebagai retinol (vitamin A). Secara teoritis setiap 30 mg beta karoten dapat menghasilkan 5 mg retinol. Jika semua retinol diubah, akan ekivalen dengan 50.000 IU vitamin A. Beta karoten diabsorpsi melalui membran sitoplasma lapisan sel mukosa intestinum, kemudian dapat diubah menjadi vitamin A atau langsung ke pembuluh darah. Karoten disimpan di dalam lemak dan terdapat pada berbagai organ dan jaringan seperti epidermis dan dermis kulit, sel darah merah dan putih serta platelet. Absorpsi karotenoid dapat meningkat dengan adanya garam empedu, lipid, protein dan zink. Kelebihan vitamin A dapat menyebabkan hipervitaminosis (Suwandi, 1991).
Selain berperan sebagai antioksidan, beta karoten berperan pula sebagai prooksidan melalui modulasi kandungan besi pada jaringan (Halliwell dan Gutteridge, 1990). Dalam penelitian Palozza, et al. (2000) ditemukan kadar besi yang besar pada mencit yang diberi karotenoid canthaxanthin dibandingkan kelompok kontrol. Besi dapat meningkatkan kadar radikal bebas oksi endogen melalui reaksi fenton yang berperan dalam proses oksidasi (Halliwell dan Gutteridge, 1990). Beta karoten dapat mengalami auto-oksidasi menghasilkan produk degradasi oksidatif, yaitu retinal dan apokarotenal (Woggon, 2002). Retinal dapat merusak DNA sehingga mengganggu transkripsi RNA yang akhirnya menghambat biosintesis protein. Selain itu, produk degradasi oksidatif beta karoten dapat bereaksi dengan amina primer membentuk imina yang dapat menyebabkan penurunan asam amino (Murata and Kawanishi, 2000). Hal ini akan menyebabkan kegagalan translokasi nukleotida adenin, meningkatkan stress oksidatif dalam mitokondria (Siems, Sommerburg, Schild, Augustin, Langhans dan Wiswedel, 2002).
G. Hati
Sinusoid memiliki permeabilitas yang tinggi dan berisi sel-sel fagosit yaitu sel-sel kupffer (Stine dan Brown, 1996).
Gambar 1. Struktur Rinci Pada Lobus Hati (Chandrasoma dan Taylor, 2006)
Hati merupakan organ yang penting dalam proses metabolisme. Nutrien yang terdapat didalam darah dari saluran gastrointestinal menuju hati melalui vena portal. Nutrien tersebut ialah karbohidrat, lipid dan vitamin yang dapat diubah dan simpan hingga dibutuhkan oleh tubuh. Sel hati memiliki kemampuan untuk memetabolisme karbohidrat, lipid dan protein (Stine dan Brown, 1996).
Hati merupakan bagian yang signifikan berperan dalam terjadinya metabolisme xenobiotik. Hal ini berarti bahwa hepatosit beresiko untuk terkena metabolit toksik bioaktif yang dihasilkan dari metabolisme beberapa toksikan. Jalur langsung toksisitas yaitu melalui darah yang berasal dari saluran gastrointestinal akibat tertelan xenobotik, diabsorpsi, dan mengalami siklus enterohepatik yaitu berupa pengulangan reabsorpsi dari empedu dan kembali ke hati, meningkatkan resiko sel hati untuk terkena toksikan (Stine dan Brown, 1996).
Gambar 2. Organ Hati (Anonim, 2009)
H. Tipe Kerusakan Pada Hati
1. Perlemakan hati (Steatosis)
Perlemakan hati adalah hati yang mengandung berat lipid lebih dari 5%. Lesi bersifat akut (Lu, 1995). Hati merupakan tempat sintesis, penyimpanan dan penghasil lipid sehingga hal itu dapat menjadi interfensi dengan proses perlemakan hati menyebabkan akumulasi lemak di dalam hati itu sendiri. Hati mengambil asam lemak bebas dan bergabung dengan gliserol membentuk trigliserida. Trigliserida akan digabungkan dengan fosfolipid, kolesterol dan protein menjadi Very Low Density Lipoprotein (VLDL). VLDL kemudian masuk ke aliran darah, membawa trigliserida ke sel lain (Stine dan Brown, 1996). Mekanisme pelemakan hati diduga karena rusaknya pelepasan trigliserida hati ke plasma karena trigliserida hanya diekskresi bila dalam keadaan tergabung dengan lipoprotein (membentuk VLDL) (Lu, 1995).
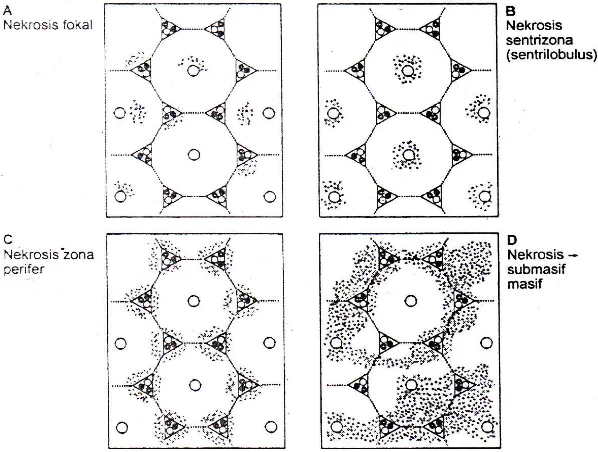
2. Nekrosis pada hati
Perubahan sel berupa nekrosis adalah bentuk kematian sel pada jaringan organisme hidup dan merupakan proses patologis setelah terjadi cidera sel dan sering mengenai jaringan padat (Underwood, 1994). Inti sel yang mengalami nekrosis mempunyai ciri karioisis (inti sel yang mati menghilang), piknosis (inti sel yang mengalami penyusutan), atau karioreksis (inti sel yang mati hancur dan meninggalkan pecahan zat kromatin yang tersebar di dalam sel) (Abrams, 1995).
jaringan normal disekitarnya. Penyebab nekrosis hati dapat dipengaruhi secara langsung oleh agen yang bersifat tosik seperti zat-zat kimia maupun toksin kuman (nekrosis toksopatik), ataupun dapat juga disebabkan karena kekurangan faktor-faktor yang sangat dibutuhkan sel seperti O2 dan zat-zat makanan (nekrosis
trofopatik) (Ressang, 1984). Infeksi bakteri dapat pula menyebabkan terjadi nekrosis (Graves dan Faccini, 1984). Berikut adalah keterangan tentang pola-pola nekrosis.
a. Nekrosis fokal
Nekrosis sel hati fokal merupakan nekrosis yang terjadi secara acak atau sekelompok sel pada seluruh daerah lobulus-lobulus hati. Tidak semua lobulus terkena. Nekrosis ini dikenali pada biopsi melalui badan asidofilik dan daerah lisis sel hati yang dikelilingi oleh kumpulan sel kupffer dan radang. Badan asidofilik merupakan sel hati nekrotik dengan inti piknotik atau lisis dan sitoplasma terkoagulasi berwarna merah muda (Chandrasoma dan Taylor, 2006).
b. Nekrosis zona
porta terjadi pada eklampsia dan keracunan fosfor (Chandrasoma dan Taylor, 2006).
c. Nekrosis submasif dan masif
Nekrosis submasif merupakan nekrosis sel hati yang meluas melewati batas lobulus, sering menjembatani daerah porta dengan vena sentralis (“bridging necrosis”). Bentuk nekrosis yang paling berat adalah nekrosis hati masif, dengan daerah hati yang berkonfluensi luas mengalami nekrosis sehingga tertinggal pulau-pulau kecil sel hati viabel yang tetap utuh. Nekrosis masif ditandai oleh pengecilan hati mendadak, yang tampak kuning, dan membubur, dengan kapsul yang berkerut. Daerah sisa sel hati viabel tampak sebagai daerah bercak coklat tua yang kontras dengan zona kuning nekrotik (Chandrasoma dan Taylor, 2006).
3. Sirosis
Pemejanan kronik untuk hapatotoksikan dapat menyebabkan kondisi sirosis. Kombinasi dari kerusakan hapatosit dan kurangnya regenerasi dengan ditingkatkan aktivitas fibrosis dan akumulasi dari kolagen di hati. Ini tidak hanya menghilangnya jaring-jaring dari fungsi hepatosit tetapi juga signifikan mengganggu aliran dalam hati (Stine dan Brown, 1996).
Secara makroskopik, hati membesar pada stadium awal tetapi kemudian mengecil karena kehilangan sel-sel dan kontraksi jaringan fibrosa. Hati teraba lebih keras dibandingkan normal. Berdasarkan ukuran nodul (lebih atau kurang dari 3 mm) diklasifikasikan sebagai makronodular, mikronodular atau kombinasi dari keduanya. Secara histologis, pembentukan nodul regeneratif bersifat khas. Nodul ini dibentuk oleh sel-sel hati hiperplastik yang tersesun ke dalam lempeng-lempeng tak teratur (Chandrasoma dan Taylor, 2006).
4. Miscellaneous effect
5. Karsinogenesis
Banyak hepatotoksikan, termasuk karbon tetraklorida dan kloroform menunjukan karsinogen pada hati dalam penelitian pada hewan. Kelompok lain yang pontesial menyebabkan karsinogen pada hati adalah aflatoksin, yaitu toksin yang dihasilkan oleh fungi yang tumbuh pada biji padi dan makanan lainnya. Aflatoksinβ1dimetabolisme oleh sitokrom P-450 pada epoksid reaktif yang dapat
berikatan pada DNA (Stine dan Brown, 1996).
6. Degenerasi
Degenerasi merupakan perubahan morfologik yang diakibatkan oleh pengaruh luka yang tidak fatal dan kondisi ini masih dapat terbalikkan (reversibel) (Anonim, 1973; Robbins, 1974). Degenerasi diklasifikasikan menjadi beberapa tipe yaitu:
a. Degenerasi Hidrofik
b. Degenerasi melemak
Degenerasi melemak merupakan perubahan morfologik pada organ hati akibat luka yang ditandai dengan adanya lemak pada sel (Hegazy, 2009). Pada beberapa keadaan, degenerasi melemak dapat sebagai indikator lain untuk jejas reversibel sel. Ini merupakan reaksi yang kurang umum, terutama dijumpai dalam sel-sel yang terlibat dan tergantung pada metabolisme lemak, seperti hepatosit dan sel-sel miokardium, karena ini adalah bentuk penimbunan intrasel (Robbins dan Kumar, 1995).
c. DegenerasiAlbuminous
Degenerasi albuminous merupakan perubahan sel yang ditandai pembengkakan sel dan granulasi di sitoplasma (Hagazy, 2009).
d. DegenerasiHyaline
DegenerasiHyalinemerupakan perubahan sel hati menjadi homogen dan kehilangan struktur (Hagazy, 2009).
7. Kongesti
Terdapat 2 macam mekanisme terjadinya kongesti yaitu kenaikan jumlah darah yang mengatur daerah tertentu dan penurunan jumlah darah yang mengalir dari daerah tertentu. Pada mekanisme pertama dikenal sebagai kongesti aktif yang biasa terjadi pada daerah arterial karena dilatasi kapiler akibat rangsang vasodilator atau kumpulan vasokonstriktor. Contoh fisiologi kongesti aktif adalah pengiriman darah yang lebih banyak sesuai kebutuhan pada jaringan yang sedang bekerja seperti otot yang sedang berkonstraksi aktif. Pada mekanisme kedua dikenal sebagai kongesti pasif yang sering terjadi pada daerah aliran vena, selain sebab-sebab lokal seperti tumor yang menekan aliran darah vena, kongesti pasif sapat disebabkan oleh sebab-sebab sentral atau sistemik seperti gagal jantung (Abrams, 1995).
8. Peradangan
Radang ialah reaksi jaringan hidup terhadap semua bentuk jejas. Dalam aksi ini ikut berperan pembuluh darah, saraf, cairan dan sel-sel tubuh di tempat jejas. Proses radang merupakan proses memusnahkan, melarutkan atau membatasi agen penyebab jejas dan merintis jalan untuk pemulihan jaringan yang rusak pada tempat itu (Robbins dan Kumar, 1995).
I. Evaluasi Kerusakan Hati
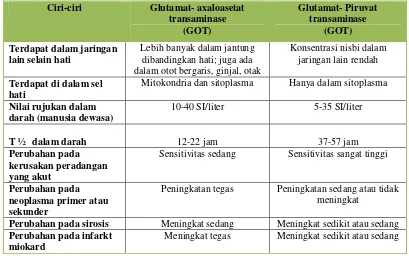
kerusakan adalah aminotransperase yaitu serum Glutamat-Axaloasetat Transaminase (SGOT) dan serum Glutamat Piruvat Transaminase (SGPT), serum Alkaline Phosphatase (AP), serum Laktat Dehidrogenase (LDH), dan banyak lainnya. Beberapa enzim lebih spesifik untuk penilaian kerusakan pada hati dari pada organ lain. Disisi lain, beberapa dari enzim tersebut cukup spesifik tidak hanya untuk menunjukan kerusakan hati (Stine dan Brown, 1996).
J. Aminotransferase (Transaminase)
Sebagai nama untuk enzim yang mengkatalis perpindahan reversibel satu gugusan amino dari asam amino ke asam alfa-keto, sekarang lebih dipakai aminotransferase. Kedua macam aminotransferase yang paling sering diukur ialah alanin aminotransferase (ALT) atau disebut juga glutamat-piruvat transaminase (GPT) dan aspartat aminotransferase (AST) atau glutamat-oxaloasetat transaminase (GOT) (Widmann, 1995).
berpengaruh kepada aktivitas GPT dalam serum sehingga GPT dalam serum meningkat pesat daripada GOT ketika terjadi kerusakan hati (Widmann, 1995). GPT serum meningkat pada kerusakan akut dan GOT serum meningkat jika terjadi kerusakan kronis. Aktivitas normal dari SGPT dan SGOT untuk tikus yaitu masing-masing 12 ± 4,40 IU/L dan 141±67 IU/L (Wibowo, Maslachah, Bijanti, 2009). Enzim GPT dan GOT yang normal berada didalam organ hati dapat keluar ke peredaran darah. Hal ini disebabkan karena sel-sel hati yang dekat vena sentralis lobulus sangat mudah dipengaruhi hipoksia menyebabkan sel-sel hati menderita dan kadar aminotransferase meningkat sedang. Sel-sel hati yang terletak di tengah lobulus mengalami kerusakan bila hipotensi dalam sistem arteri menyebabkan jumlah darah yang masuk ke dalam hati berkurang menghambat darah ke luar dari vena sentralis (Widmann, 1995).
Tabel III. Ciri-ciri aminotransferase yang berkaitan dengan hati(Widmann, 1995)
Ciri-ciri Glutamat- axaloasetat
Lebih banyak dalam jantung dibandingkan hati; juga ada dalam otot bergaris, ginjal, otak
Konsentrasi nisbi dalam jaringan lain rendah
Terdapat di dalam sel hati
Mitokondria dan sitoplasma Hanya dalam sitoplasma
Nilai rujukan dalam darah (manusia dewasa)
10-40 SI/liter 5-35 SI/liter
T ½ dalam darah 12-22 jam 37-57 jam
Perubahan pada kerusakan peradangan yang akut
Sensitivitas sedang Sensitivitas sangat tinggi
Perubahan pada neoplasma primer atau sekunder
Peningkatan tegas Peningkatan sedang atau tidak meningkat
Perubahan pada sirosis Meningkat sedang Meningkat sedikit atau sedang
Perubahan pada infarkt miokard
K. Landasan Teori
Sari wortel berkhasiat sebagai hepatoprotektif pada kerusakan hati yang dinduksi parasetamol (Wijoyo, 2004). Kemampuan hepatoprotektif ini diduga karena wortel memiliki kandungan utama beta karoten yang dapat menangkap radikal bebas dan bertindak sebagai antioksidan. Namun, bila kadar beta karoten tinggi dalam tekanan oksidatif, senyawa tersebut dapat bertindak sebagai prooksidan yang dapat menyebabkan kerusakan sel. Sifat prooksidan terjadi melalui modulasi besi pada jaringan hati. Besi dapat meningkatkan kadar radikal bebas oksi endogen melalui reaksi fenton yang berperan dalam proses oksidasi. Sifat prooksidan ini, yang diduga dapat merusak organ hati yang menyebabkan enzim GPT dan GOT yang dalam keadaan normal terdapat dalam sel hati keluar ke peredaran darah (Widmann, 1995).
L. Hipotesis
31
A. Jenis dan Rancangan Penelitian
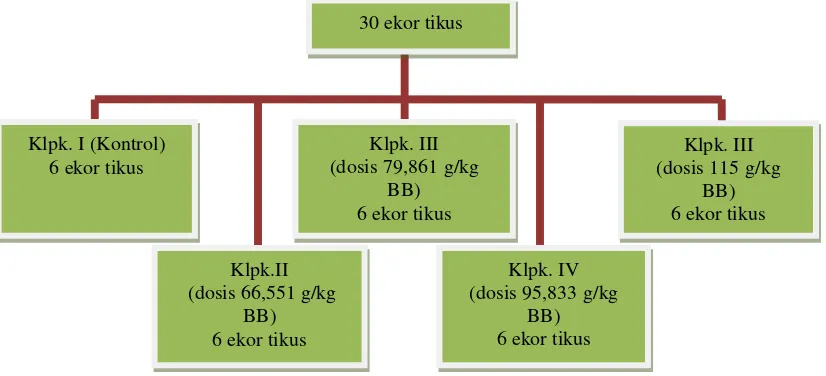
Penelitian ini merupakan penelitian eksperimental murni dengan menggunakan rancangan acak lengkap pola searah. Pada penelitian ini subjek uji yang terbagi dalam 5 kelompok, dimana 1 kelompok terdiri atas 6 ekor hewan uji. Kelompok I adalah kontrol basal yang tidak diberi sari wortel, kelompok II adalah kelompok yang diberi sari wortel dosis 66,551 g/kg BB, kelompok III adalah kelompok yang diberi dosis sari wortel 79,861 g/kg BB, kelompok IV adalah kelompok yang diberi dosis sari wortel 95,833 g/kg BB, dan kelompok V adalah kelompok yang diberi dosis sari wortel 115 g/kg BB.
B. Variabel Penelitian
1. Variabel bebas (independent): peringkat dosis sari wortel yang dibuat dalam 4 peringkat dosis.
a. Peringkat dosis I : 66,551 g/kg BB b. Peringkat dosis II : 79,861 g/kg BB c. Peringkat dosis III : 95,833 g/kg BB d. Peringkat dosis IV : 115 g/kg BB
2. Variabel tergantung (dependent) : LD50, gejala toksik, berat organ, histologi
3. Variabel pengacau terkendali:
a. Bahan uji : umbi wortel diperoleh dari warung sayur Ibu X, Maguwoharjo, Sleman, Yogyakarta, pada tanggal 4 September 2009, yang menurut keterangan beliau wortel tersebut berasal dari daerah Tawangmangu.
b. Hewan uji : tikus
c. Berat badan : 150-200 g.
d. Jenis kelamin : betina.
e. Galur : Wistar.
f. Umur hewan uji : 2–3 bulan.
g. Zat gizi dalam pakan : hewan uji diberikan makanan 10% dari berat badannya.
h. Suhu ruangan : hewan uji dibuat dengan kondisi yang sama mulai dari pemeliharaan sampai pada percobaan penelitian dengan suhu ruangan 28oC .
4. Variabel pengacau tak terkendali : kondisi patologis hewan uji.
C. Definisi Operasional
1. Sari wortel adalah cairan yang diperoleh dari umbi wortel dengan menggunakan juice extractor yang kemudian disaring dengan penyaring dan kertas saring.
3. Harga LD50 adalah dosis tunggal yang dapat menyebabkan 50% kematian
hewan uji akibat pemberian akut sari wortel.
4. Pemeriksaan aktivitas SGPT dan SGOT dalam serum merupakan dua dari beberapa pemeriksaan fungsi hati. Dalam penelitian ini digunakan untuk mengetahui apakah terjadi gangguan fungsi hati setelah pemberian akut sari wortel (Daucus carotaL.).
5. Hari ke-0 adalah hari ketika sari wortel diberikan kepada hewan uji. 6. Hari ke-1 adalah hari setelah 1 hari pemberian sari wortel.
7. Hari ke-7 adalah hari setelah 7 hari pemberian sari wortel. 8. Hari ke-14 adalah hari setelah 14 hari pemberian sari wortel.
9. Kontrol yang digunakan adalah kontrol basal yang tidak diberikan apapun.
D. Bahan dan Alat
1. Bahan
Adapun bahan yang digunakan dalam penelitian ini adalah:
a. Subyek uji yang digunakan adalah tikus putih betina galur Wistar dengan berat badan 150-200 g, umur berkisar antara 2-3 bulan, dan berjumlah 30 ekor yang diperoleh dari LPPT II Universitas Gadjah Mada, Yogyakarta. b. Umbi wortel diperoleh dari warung sayur Ibu X, Maguwoharjo, Sleman,
Yogyakarta pada 4 September 2009, yang menurut keterangan beliau wortel tersebut berasal dari daerah Tawangmangu.
2. Alat
Adapun alat yang digunakan dalam penelitian ini adalah: a. Kandang tikus.
b. Juice extractor(Miyako JE-537,Capacity600 ml,Voltase220V). c. Pot unguenta.
d. Labu ukur 1000 ml. e. Labu ukur 500 ml. f. Corong pisah. g. Pipet tetes.
h. Gelas ukur 1000 ml. i. Beker glass 500 ml. j. Gelas arloji.
k. Mikrotub.
l. Gunting bedah. m. Pinset.
n. Papan bedah. o. Jarum pantul.
p. Timbangan (analitical balance). q. Timbangan tikus.
r. Spuit injeksi oral (Turumo Syringe, Terumo (Philippines) Corporation Bidan, 10 ml).
s. Kamera Hp.
E. Tata Cara Penelitian
1. Penyiapan hewan uji
Hewan uji yang digunakan berjumlah 30 ekor tikus putih betina galur Wistar. Sebelum perlakukan tikus tersebut diadaptasikan atau dikarantinakan dengan lingkungan laboratorium selama 10 hari. Selama adaptasi tersebut tikus diberi makan dan minum secukupnya. Pakan yang diberikan disesuaikan dengan berat badan dari tikus yaitu 10% BB per hari. Sedangkan minum yang diberikan adalah Aqua sebanyak 240 ml per hari.
2. Pengelompokkan hewan uji
Penelitian ini mengikuti rancangan acak lengkap pola searah. Pengelompokan hewan uji dilakukan sehari sebelum perlakuan dimulai. Masing-masing tikus diberi kode nomor uji, dan pada sangkar diberi etiket. Hewan uji yang digunakan adalah 30 ekor, masing-masing kelompok terdiri dari 6 ekor hewan uji. Sebelum perlakuan, hewan uji dipuasakan dahulu selama 24 jam, dengan tetap diberikan air secukupnya.
Gambar 5. Skema Pengelompokan Hewan Uji
3. Pengumpulan bahan
Bahan uji yang digunakan adalah umbi wortel yang diambil sarinya dengan juice extractor. Umbi wortel (Daucus carota L.) diperoleh dari warung sayur, Maguwoharjo, Sleman, Yogyakarta pada 4 September 2009.
4. Determinasi tanaman
Tanaman Wortel (Daucus carota L.) yang akan digunakan dalam penelitian ini dideterminasi di bagian Biologi Farmasi Fakultas Farmasi Universitas Gadjah Mada untuk memastikan kebenaran sampel yang digunakan.
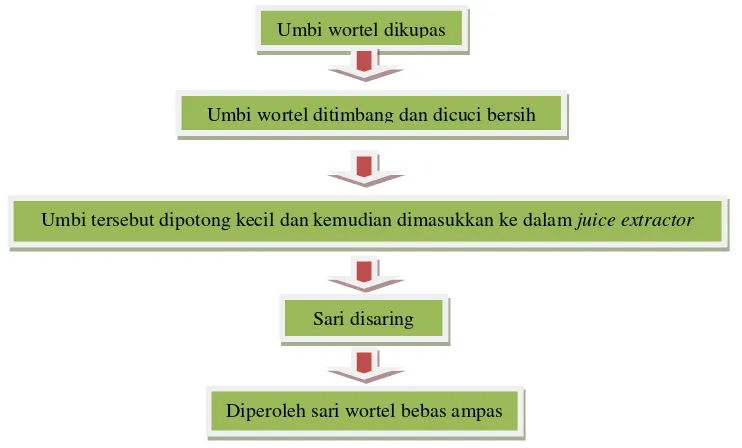
5. Pembuatan sedian uji
Umbi wortel dipilih yang tanpa luka pada umbinya, dikupas dan kemudian ditimbang sebanyak ±400,4 g. Umbi tersebut dicuci bersih dan dipotong menjadi bagian kecil kemudian dimasukkan ke dalam juice extractor. Hasil yang diperoleh lalu disaring dengan penyaring dan kertas saring sehingga diperoleh sari wortel. Pembuatan sari wortel harus selalu dibuat baru.
Gambar 6. Skema Kerja Preparasi Sari Wortel (Daucus carotaL.)
Umbi wortel dikupas
Umbi wortel ditimbang dan dicuci bersih
Umbi tersebut dipotong kecil dan kemudian dimasukkan ke dalamjuice extractor
Sari disaring
6. Penentuan dosis
Pada orientasi digunakan dosis tertinggi yang secara teknis masih bisa diberikan dan tidak melebihi volume maksimum yang masih boleh diberikan kepada hewan uji (5,0 ml/100 g BB). Dari hasil orientasi didapatkan dosis tertingginya yaitu 115 g/kg BB dan diharapkan mematikan seluruh hewan uji. Untuk kontrol tidak diberikan sari wortel atau sediaan apapun. Dari dosis tertinggi tersebut diturunkan dengan interval konstan yaitu 1,2 dan diperoleh peringkat dosis III yaitu 95,833 g/kg BB, peringkat dosis II yaitu 79,861 g/kg BB, peringkat dosis I yaitu 66,551 g/kg BB. Perhitungan dosis dapat dilihat pada Lampiran 36.
7. Uji toksisitas
Uji toksisitas diawali dengan menginjeksikan secara oral sari wortel kepada tikus, dan kemudian mengamati perilaku tikus selama 3 jam pertama dengan membandingkan antara perilaku tikus kelompok yang diberikan sari wortel terhadap tikus kelompok kontrol dan mencatat pada blanko data. Bila saat pengamatan terdapat hewan uji yang mati, dilakukan pembedahan dan pengambilan organ hati dari hewan uji. Organ hati yang telah diambil, dicuci dalam NaCl fisiologis, ditimbang dan diawetkan dalam formalin 10%.
Sebelum dilakukan pembedahan, baik 24 jam maupun setelah hari ke-14, dilakukan pengambilan darah dari sinus orbitalis pada mata tikus. Pengambilan darah ini dilakukan untuk mengukur aktivitas SGPT dan SGOT. Pemeriksaan kadar SGPT dan SGOT dilakukan di LPPT I, Universitas Gadjah Mada, Yogyakarta.
8. Pengamatan
Pengamatan dilakukan terutama 3 jam setelah pemberian sediaan uji dan pengamatan selanjutnya 24 jam setelah pemberian sediaan uji. Efek tertunda diamati sampai hari ke 14. Kriteria pengamatan meliputi :
a. Pengamatan fisik terhadap gejala-gejala toksik. Pengamatan dilakukan sesering mungkin pada 24 jam pertama setelah pemberian sediaan uji dan sekali sehari selama masa uji yaitu 14 hari.
b. Pengambilan darah hewan uji dilakukan 3 hari sebelum pemberian sari (Daucus carota L)., 24 jam dan pada hari ke 14 setelah pemberian sari wortel (Daucus carotaL.) untuk pemeriksaan aktivitas SGPT dan SGOT.
c. Pemeriksaan histologi organ hati waktu 24 jam dan 14 hari setelah pemberian sari wortel.
d. Kematian hewan uji pada masing–masing kelompok diamati pada 24 jam dan selama 14 hari setelah pemberian sari wortel.
9. Pembuatan dan pemeriksaan preparat histologi
hati dilakukan di Laboratorium Patologi, Fakultas Kedoteran Hewan, Universitas Gadjah Mada, Yogyakarta. Pemeriksaan dengan membandingkan antara kelompok kontrol dan kelompok yang diberikan sari wortel (Daucus carotaL.).
F. Tata Cara Analisis Hasil
Data yang didapat dari penelitian ada beberapa macam yaitu LD50,
spektrum efek toksik, data histologi dan aktivitas SGPT dan SGOT.
1. Data kematian hewan uji digunakan untuk mengetahui harga LD50 yang
kemudian dapat ditentukan poteksi ketoksikannya. Harga LD50 dihitung dari
jumlah yang mati pada masing-masing kelompok, menggunakan metode probit (Metode Miller-Tainter) dan secara kuantitatif digunakan untuk menentukan potensi ketoksikan akut mengikuti ketentuan Loomis (1978). Jika sampai batas volume maksimal yang boleh diberikan tidak menimbulkan kematian hewan uji, maka peringkat dosis tertinggi dinyatakan sebagai LD50
semu.
2. Pengamatan gejala ketoksikan dilakukan dengan mengamati tingkah laku hewan uji selama masa percobaan dan membandingkan tingkah laku kontrol negatif dengan kelompok yang diberikan sari wortel.
3. Histologi organ hati dilakukan dengan membandingkan kondisi histologi pada organ hati kelompok kontrol terhadap organ hati kelompok perlakuan dari masing–masing peringkat dosis sari wortel.
setelah 24 jam serta 14 hari sesudah pemberian sari wortel. Namum bila data yang diperoleh tidak terdistribusi secara normal maka akan dilakukan transformasi data dan dilakukan kembali uji normalitas data. Bila data hasil transformasi masih tidak normal maka analisis selanjutnya dengan menggunakan Uji Wilcoxon. Pada analisis data SGPT dan SGOT untuk melihat perbedaan antar kelompok perlakuan terhadap kontrol pada waktu sebelum, sesudah 24 jam dan sesudah 14 hari setelah pemberian sari wortel menggunakan ujiOne-WayANOVA bila data terdistribusi normal, namun bila data terdistribusi tidak normal maka dilakukan analisis menggunakan uji
Kruskal-Wallis. Bila nilai singnifikansi (p) < 0,05 maka dilakukan uji Post
Hoc LSD setelah uji One-Way ANOVA atau Mann-Whitney setelah uji
Kruskal Wallis.
5. Berat badan hewan uji dari hari ke-0, ke-7 dan ke-14 diuji normalitas menggunakan Uji Shapiro-Wilk. Bila data terdistribusi normal maka selanjutnya akan dianalisis dengan uji General Linear Model-Multivariate, sebaliknya bila data tidak terditribusi normal maka akan dilakukan transformasi data dan dilakukan kembali uji normalitas. Bila hasilMultivariat
menghasilkan nilai signifikansi (p) < 0,05 maka dilanjutkan dengan uji Post Hoc Scheffe.
6. Berat organ hati relatif diuji normalitas menggunakan Uji Shapiro-Wilk. Bila data terdistribusi normal maka analisis selanjutnya dengan uji One-way
hasil data hasil transformasi tidak normal maka analisis selanjutnya adalah uji
Kruskal-Wallis. Jika hasil analisis dengan Uji One-Way ANOVA atau Uji
42
A. Determinasi TanamanDaucus carotaL.
Determinasi dilakukan di Laboratorium Biologi Farmasi Universitas Gadjah Mada Yogyakarta yang hasilnya sesuai dengan Lampiran 9. Tujuan dilakukan determinasi adalah untuk memastikan bahwa simplisia yang digunakan sebagai sampel benar tanaman wortel (Daucus carota L.). Hasil determinasi yang diperoleh dinyatakan bahwa umbi simplisia yang digunakan dalam penelitian ini adalah benar umbi tanaman wortel (Daucus carotaL.).
B. Preparasi Sari UmbiDaucus carotaL.
Sediaan uji berupa sari umbi wortel (Daucus carota L.) dibuat dengan menggunakanjuice extractor. Sampel umbi wortel diperoleh dari pedagang sayur, Maguwoharjo, Sleman, Yogyakarta yang menurut keterangan beliau bahwa umbi wortel (Daucus carota L.) tersebut berasal dari Tawangmangu, Solo, Jawa Tengah.
Sari yang diperoleh dari hasil penyarian menggunakan juice extractor
sediaan uji diberikan. Selanjutnya sari yang diperoleh tersebut dapat diberikan kepada hewan uji.
C. Penentuan Dosis
Peringkat dosis yang digunakan dalam penelitian ini diperoleh melalui orientasi, yaitu dengan cara memberikan sari dosis tertinggi yang secara teknis masih dapat diberikan dengan tetap memperhatikan volume pemberian maksimal yang masih diizinkan diberikan pada hewan uji yaitu 5 ml/100 g BB. Pada percobaan pendahuluan atau orientasi tidak dicobakan dosis terendah karena belum diketahui dosis terapi yang biasa digunakan manusia. Hasil orientasi diperoleh dosis tertinggi yaitu 115 g/kg BB dan dosis tersebut tidak menimbulkan kematian pada hewan uji. Berdasarkan peringkat dosis tertinggi yang diperoleh, dibuat 3 peringkat dosis dibawahnya, dengan faktor pembagian tetap yaitu 1,2. Dari pembagian dengan faktor pembagi tersebut diperoleh dosis 95,833 g/kg BB, 79,861 g/kg BB, dan 66,551 g/kg BB. Untuk kelompok kontrol negatif, hewan uji tidak diberi sari wortel.
D. Potensi Ketoksikan Akut (LD50)
Tabel IV. Jumlah Tikus yang Mati pada Pengamatan 24 Jam setelah Pemberian Dosis Tunggal Sari Wortel (Daucus carotaL.)
Kelompok Perlakuan ∑
Tikus
II Sediaan uji dosis 66,551 g/kg BB 6 0 0
III Sediaan uji dosis 79,861 g/kg BB 6 0 0
IV Sediaan uji dosis 95,833 g/kg BB 6 0 0
V Sediaan uji dosis 115 g/kg BB 6 0 0
>115 g /kg BB
Selanjutnya, 3 ekor hewan uji dari setiap kelompok dikorbankan untuk diamati perubahan pada organ hati, sedangkan 3 ekor hewan uji yang tersisa tetap dilakukan pengamatan hingga hari ke-14 guna melihat kemungkinan adanya efek toksik yang tertunda. Hasil pengamatan terhadap hewan uji setelah pengamatan lanjutan hingga hari ke-14, disajikan pada tabel V.
Tabel V. Jumlah Tikus yang Mati pada Pengamatan 14 Hari setelah Pemberian Dosis Tunggal Sediaan Uji Sari Wortel (Daucus carotaL.)
Kelompok Perlakuan ∑
Tikus
II Sediaan uji dosis 66,551 g/kg BB 3 0 0
III Sediaan uji dosis 79,861 g/kg BB 3 0 0
IV Sediaan uji dosis 95,833 g/kg BB 3 0 0
V Sediaan uji dosis 115 g/kg BB 3 0 0
Pada tabel IV dan V dapat dilihat bahwa pemberian dosis tunggal sediaan uji sari wortel (Daucus carotaL.) secara oral pada tikus betina galur Wistar tidak menimbulkan kematian hewan uji pada seluruh kelompok perlakuan selama masa uji 24 jam maupun 14 hari setelah pemberian sediaan uji sehingga potensi ketoksikan akut (LD50) dari sari wortel (Daucus carotaL.) tidak dapat ditentukan
dapat ditentukan adalah potensi ketoksikan akut semu (LD50 semu) yaitu > 115
g/kg BB. Jika dosis tersebut dikonversikan ke manusia maka dosis 115 g/kg BB pada tikus setara dengan 18,4 g/kg BB. LD50semu ini memiliki makna toksikologi
berdasarkan kriteria Loomis (1978) yaitu dalam kategori relatif kurang berbahaya (>15 g/kg).
Pada penelitian Wijoyo (2004), diketahui ED50 hepatoprotektif sari
wortel adalah 1,05 ml/kg BB. Bila dosis 115 g/kg BB tersebut dikonversi dalam bentuk volume maka diperoleh dosis 50 ml/kg BB. Dosis tersebut kemudian dibagi dengan nilai ED50hepatoprotektif sari wortel maka diperoleh indeks terapi
sari wortel yaitu 47,62. Indeks terapi merupakan konsep yang bermanfaat dalam mempertimbangkan batas keamanan bagi penggunaan praktis obat dalam hal ini yaitu sari wortel. Semakin besar nilai indeks terapi maka senyawa tersebut dinilai semakin aman.
E. Pengamatan Gejala Toksik
Pengamatan kualitatif terhadap gejala–gejala toksik yang mungkin timbul dilakukan terus-menerus pada 3 jam pertama dan dilanjutkan sampai hari ke-14. Pengamatan dilakukan setiap hari, mulai dari hari ke-0 sampai hari ke-14 setelah pemberian sediaan uji untuk mengetahui kemungkinan timbulnya efek toksik yang tertunda. Hasil pemeriksaan gejala–gejala toksik hewan uji setelah pemejanan dosis tunggal sediaan uji secara oral seperti pada tabel VI .
sehingga dapat mengenali adanya perubahan sikap atau gejala toksik yang muncul akibat pemberian sediaan uji dengan tepat. Gejala toksik yang diamati meliputi perubahan perilaku, gerakan (menjilat, menggaruk, kedutan, tremor, menggeliat, ataksia, paralisis, konvulsi, keterpaksaan gerak), kereaktifan terhadap rangsang (keberangasan, kepasifan, anestesia, hiperestesia), sekresi, penafasan, kardiovaskuler, mata, kulit, rambut, dan kondisi umum (berat badan, makanan, minuman dan kematian).
Tabel VI. Hasil Pemerikasaan Kualitatif Gejala–Gejala Toksik Tikus Betina Pada 24 Jam dan 14 hari setelah Pemberian Dosis Tunggal Sediaan Uji Sari Wortel (Daucus carotaL.)
Kelompok Pengamatan 24 Jam Pengamatan hingga hari ke-14
n Gejala toksik n Gejala toksik
I 6 - 3
-(-) = tidak menunjukan gejala toksik
Kelompok I = kelompok kontrol
Kelompok II = kelompok yang diberikan sediaan uji dosis 66,551 g/kg BB Kelompok III = kelompok yang diberikan sediaan uji dosis 79,861g/kg BB Kelompok IV = kelompok yang diberikan sediaan uji dosis 95,833 g/kg BB Kelompok V = kelompok yang diberikan sediaan uji dosis 115 g/kg BB
Tabel VI tidak memperlihatkan gejala toksik sehingga dapat disimpulkan bahwa pemberian sediaan sari wortel (Daucus carota L.) secara oral dalam dosis tunggal tidak mempengaruhi perilaku, gerakan, kereaktifan terhadap rangsangan, ukuran pupil, sekresi, pernafasan, kulit, rambut, dan kematian.
F. Perubahan Berat Badan
setelah pemberian sediaan hewan uji ada yang mati maka hal tersebut menunjukkan beberapa kemungkinan. Kemungkinan pertama, sediaan tersebut mempengaruhi organ–organ vital sehingga mengganggu proses homeostasis tubuh yang dapat menimbulkan kerusakan struktural yang seringkali merupakan wujud akhir dari perubahan fungsional atau biokimia dan akhirnya menyebabkan kematian. Perubahan ini dapat diketahui dari pemeriksaan histopatologi. Kemungkinan yang kedua, bila terjadi kematian hewan uji tetapi fungsi organ tersebut masih baik adalah karena pemberian sediaan uji menyebabkan selera makan hewan uji berkurang. Hal ini dapat berdampak pada daya tahan tubuh hewan uji akan menurun dan mengganggu proses homeostatis tubuh sehingga menyebabkan hewan uji tersebut sakit dan akhirnya mati. Untuk mengevaluasi mekanisme penyebab kematian dapat ditinjau dari gejala toksik yang muncul serta data perubahan berat badan hewan uji.
terdistribusi normal maka uji dilanjutkan dengan analisis statistik parametrik yaitu ujiGeneral Linear Model-Multivariatedangan taraf kepercayaan 95%.
Tabel VII. Purata Perubahan Berat Badan Tikus Hari ke-0, ke-7, dan ke-14 Hari setelah Pemberian Sediaan Uji Sari Wortel (Daucus carotaL.) secara Oral Dosis Tunggal
Hari Perlakuan Perubahan berat
badan per hari (g) X ± SE
Sig.
Kontrol 145,933±4,9049
-Sediaan uji dosis 66,551 g/kg BB 153,733±2,6034 tb Sediaan uji dosis 79,861 g/kg BB 144,000±2,8024 tb Sediaan uji dosis 95,833 g/kg BB 143,400±5,5570 tb Hari ke-0
Sediaan uji dosis 115 g/kg BB 147,667±1,6344 tb
Hari ke-7 Kontrol 151,267±1,5070
-Sediaan uji dosis 66,551 g/kg BB 160,133±1,3383 tb Sediaan uji dosis 79,861 g/kg BB 151,067±4,6966 tb Sediaan uji dosis 95,833 g/kg BB 151,533±3,0030 tb
Sediaan uji dosis 115 g/kg BB 158,333±1,4796 tb
Hari ke-14 Kontrol 164,933±3,0601
-Sediaan uji dosis 66,551 g/kg BB 176,267±4,2211 tb Sediaan uji dosis 79,861 g/kg BB 165,200±5,6395 tb Sediaan uji dosis 95,833 g/kg BB 167,467±2,0955 tb
Sediaan uji dosis 115 g/kg BB 172,600±1,9406 tb
Keterangan : tb = berbeda tidak bermakna dibandingkan kontrol dengan nilai p>0,05
Kurva purata perubahan berat badan hari ke-0, ke-7 dan ke-14 menunjukan adanya peningkatan berat badan pada setiap kelompok perlakuan. Data berat tersebut kemudian dianalisis dengan statistik yaitu uji Shapiro-Wilk untuk mengetahui normalitas data. Dari hasil uji tersebut diperoleh nilai signifikansi lebih dari 0,05 yang memiliki arti bahwa data purata perubahan berat badan terdistribusi secara normal. Oleh karena data terdistribusi secara normal, maka dilanjutkan dengan Uji General Linear Model-Multivariatedengan menggunakan
uji Post Hoc scheffe. Hasil uji General Linear Model-Multivariate taraf
kepercayaan 95% dan Post Hoc scheffe terhadap purata perubahan berat badan hari ke-0, ke-7 dan ke-14 setelah pemberian sari wortel (Daucus carota L.) menunjukan perbedaan berat badan yang tidak bemakna (p>0,05) pada hari ke-0, ke-7 dan ke-14 antara kelompok dosis 66,551 g/kg BB, kelompok dosis 79,861 g/kg BB, kelompok dosis 95,833 g/kg BB dan kelompok dosis 115 g/kg BB terhadap kelompok kontrol. Dari hasil tersebut maka dapat disimpulkan bahwa pemberian sari wortel (Daucus carotaL.) tidak mempengaruhi berat badan hewan uji.
G. Pemeriksaan SGPT dan SGOT
dasar aktivitas SGPT dan SGOT pada hewan uji sebelum diberikan sediaan uji. Kemudian pada waktu 24 jam dilakukan pengukuran aktivitas SGPT dan SGOT kembali, untuk melihat pengaruh sari wortel terhadap aktivitas SGPT dan SGOT dalam waktu singkat. Pengukuran SGPT dan SGOT pada hari ke-14 bertujuan untuk melihat reversibilitas aktivitas SGPT dan SGOT bila terjadi perubahan pada waktu 24 jam.
1. Pemeriksaan SGPT
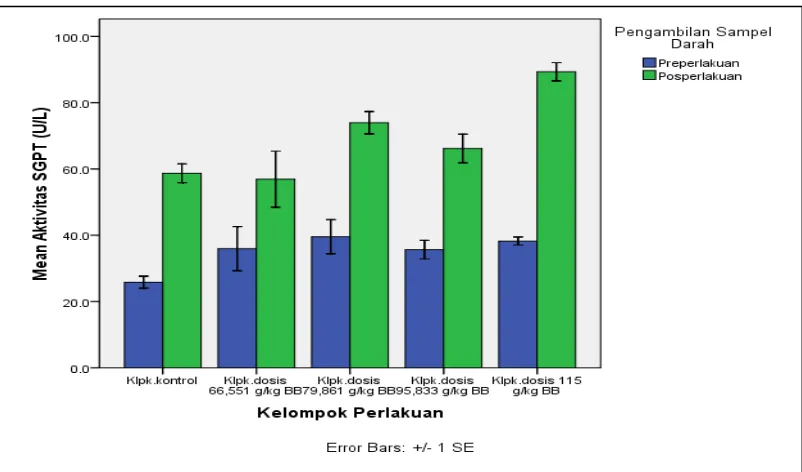
Pemeriksaan SGPT digunakan sebagai data pendukung untuk menentukan kerusakan akut pada organ hati. Pada hasil analisis statistik, diketahui data aktivitas SGPT sebelum perlakuan terdistribusi secara tidak normal walaupun telah dilakukan tranformasi data dengan nilai signifikansi 0,033 (p<0,05), sedangkan data sesudah 24 pemberian sari wortel terdistribusi normal dengan nilai signifikansi 0,063 (p>0,05). Dari uji Kruskal-Wallis data SGPT sebelum perlakuan diperoleh nilai signifikansi 0,112 (p>0,05) yang memiliki makna bahwa perbedaan aktivitas SGPT antar kelompok dosis sari wortel terhadap kontrol sebelum perlakuan tidak bermakna. Untuk data aktivitas SGPT 24 jam setelah perlakuan, dianalisis dengan ujiOne-WayANOVA dan diperoleh nilai signifikasi 0,267 (p>0,05) yang memiliki makna bahwa perbedaan aktivitas SGPT antar kelompok yang diberikan sari wortel terhadap kelompok kontrol setelah 24 jam tidak bermakna.
perlakuan terhadap aktivitas SGPT. Uji Paired-T testatau uji Wilcoxondilakukan dengan membandingkan data aktivitas SGPT sebelum dan 24 jam setelah perlakuan pada masing-masing kelompok. Hasil analisis statistik aktivitas SGPT sebelum dan 24 jam setelah perlakuan dapat dilihat pada Tabel VIII. Dari hasil analisis statistik, aktivitas SGPT sebelum dan 24 jam setelah perlakuan berbeda tetapi tidak bermakna (p>0,05) pada semua kelompok baik itu kelompok kontrol hingga kelompok dosis tertinggi dengan nilai signifikansi yaitu kelompok kontrol 0,266; kelompok dosis 66,551 g/kg BB 0,986; kelompok dosis 79,861 g/kg BB 0,778; kelompok dosis 95,833 g/kg BB 0,075; dan kelompok dosis 115 g/kg BB 0,275. Dari data ini, dapat disimpulkan bahwa sari wortel pada dosis 66,551 g/kg BB sampai 115 g/kg BB tidak berpengaruh pada aktivitas SGPT.
Tabel VIII. Perbandingan Purata Kadar SGPT Tikus Betina Galur Wistar Sebelum dan sesudah 24 Jam Setelah Pemberian Sari Wortel (Daucus carotaL) secara Oral dengan Dosis
Tunggal
Kelompok Purata SGPT Praperlukuan X ± SE
I 28,433±1,9785 41,967±7,0433 tb1
II 46,233±8,9698 45,967±6,5333 tb2
III 49,233±13,6504 54,033±6,5024 tb3
IV 28,800±3,8301 67,700±8,1592 tb4
V 32,100±1,9655 106,633±48,6562 tb5
Keterangan :
Kelompok I = kelompok kontrol
Kelompok II = kelompok yang diberikan sediaan uji dosis 66,551 g/kg BB Kelompok III = kelompok yang diberikan sediaan uji dosis 79,861 g/kg BB Kelompok IV = kelompok yang diberikan sediaan uji dosis 95,833 g/kg BB Kelompok V = kelompok yang diberikan sediaan uji dosis 115 g/kg BB
tb1 = berbeda tidak bermakna antara aktivitas SGPT sebelum dan 24 jam setelah pemberian sediaan uji (p>0,05) pada kelompok kontrol
tb2 = berbeda tidak bermakna antara aktivitas SGPT sebelum dan 24 jam setelah pemberian sediaan uji (p>0,05) pada kelompok dosis 66,551 g/kg BB
tb3 = berbeda tidak bermakna antara aktivitas SGPT sebelum dan 24 jam setelah pemberian sediaan uji (p>0,05) pada kelompok dosis 79,861 g/kg BB
tb4 = berbeda tidak bermakna antara aktivitas SGPT sebelum dan 24 jam setelah pemberian sediaan uji (p>0,05) pada kelompok dosis 95,833 g/kg BB
tb5 = berbeda tidak bermakna antara aktivitas SGPT sebelum dan 24 jam setelah pemberian sediaan uji (p>0,05) pada kelompok dosis 115 g/kg BB
Gambar 8. Diagram Perbandingan Purata SGPT Tikus Galur WistarSebelum dan Pada 24 Jam Setelah Pemberian Sari Wortel (Daucus carotaL.)
Pada hari ke-14 dilakukan pengambilan sampel darah untuk melihat reversibilitas aktivitas SGPT. Dari hasil uji normalitas diperoleh bahwa data kelompok sebelum dan 14 hari setelah perlakuan terdistribusi secara normal dengan signifikansi masing-masing 0,669 dan 0,987 (p>0,05). Selanjutnya data tersebut dianalisis denganOne-WayANOVA dan diperoleh hasil yaitu perbedaan tidak bermakna untuk aktivitas SGPT sebelum perlakuan antara kelompok dosis sari wortel terhadap kelompok kontrol dengan nilai signifikansi 0,215 (p>0,05), sedangkan data aktivitas SGPT setelah 14 hari sesudah perlakuan ditemukan perbedaan bermakna antara kelompok dosis sari wortel terhadap kelompok kontrol dengan nilai signifikansi 0,005 (p<0,05). Dari uji Post Hoc LSD