DISERTASI
KONSTRUKSI MODEL MATEMATIKA KOALISI
ANTARA VIRUS INFLUENZA H5N1 DAN H1N1
PANDEMIK
( THE CONSTRUCTION OF MATHEMATICS COALISION
MODELS BETWEEN H5N1 AND PANDEMIC H1N1
INFLUENZA VIRUS)
HARIYANTO
NIM. 090810117-D
PROGRAM STUDI S3 MIPA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS AIRLANGGA
2014
DAFTAR ISI
Halaman
PENGESAHAN i
DAFTAR ISI ii
PRAKATA v
UCAPAN TERIMAKASIH vi
DAFTAR GAMBAR vii
DAFTAR TABEL ix
DAFTAR LAMPIRAN xi
DAFTAR SINGKATAN xii
DAFTAR SIMBOL xiii
INTISARI xiv
ABSTRACT xvi
MOTTO xviii
BAB I PENGANTAR
1.1 LATAR BELAKANG 1
1.2 RUMUSAN MASALAH 3
1 3 TUJUAN PENELITIAN 4
1.4. MANFAAT PENELITIAN 4
BAB II TINJAUAN PUSTAKA
2.1 DEFINISI 6
2.1.1 Phenomena Obyek 6
2.1.3 Bilangan Reproduksi Dasar 17
2.1.4 Traveling Wave dari Virus 22
2.1.5 Analisa Persistensi dan Well-Posed 25
BAB III KONSEP ILMIAH
3.1 KONSEP ILMIAH 29
3.2 ROADMAP PENELITIAN 37
3.3 PETA TEORI PENELITIAN DISERTASI 40
BAB IV METODE PENELITIAN
4.1 JUSTIFIKASI METODE PENELITIAN TERHADAP
PENELITIAN SEBELUMNYA
43
4.2 RANCANGAN PENELITIAN 44
BAB V HASIL DAN PEMBAHASAN
5.1 KONSTRUKSI MODEL KOALISI 50
5.1.1 Perubahan Iindividual Populasi pada Lokasi
Spasial dan Temporal
50
5.1.2 Perubahan Individual Populasi karena Reaksi
Biologi
56
5.1.3 Mengkonstruksi Model Matematika Koalisi 61
5.1.4 Reduksi Konstruksi Model Matematika Koalisi
Berdasarkan Perubahan Individual Populasi
86
5.2 ANALISA KUALITATIF PADA KONSTRUKSI
MODEL MATEMATIKA KOALISI TAHAPAN
PERTAMA
92
5.2.1 Well-posedness dari Konstruksi Model Matematika
Koalisi tahapan pertama
100
5.2.2 Analisa terhadap Densitas Populasi 108
5.3 ANALISA KUALITATIF PADA KONSTRUKSI
MODEL MATEMATIKA KOALISI TAHAPAN
KEDUA
121
5.3.1. Well-posedness dari Konstruksi Model Matematika
Koalisi tahapan kedua
129
5.3.2. Analisa terhadap Densitas Populasi 138
5.3.3. Analisa Persistensi terhadap Virus Super-Strain 144
5.4 ANALISA KUALITATIF PADA KONSTRUKSI
MODEL MATEMATIKA KOALISI TAHAPAN
KETIGA
153
5.4.1. Well-posedness dari Konstruksi Model Matematika
Koalisi tahapan ketiga
158
5.4.2. Analisa terhadap Densitas Populasi 168
5.4.3. Analisa Persistensi terhadap Virus Super-Strain 176
5.5. ANALISA PENYEBARAN VIRUS SUPER-STRAIN 181
5.5.1. Analisa Persistensi Virus Super-strain 182
5.5.2. Analisa Model Traveling Wave dari penyebaran
Virus Super-strain
192
BAB VI KESIMPULAN DAN SARAN
6.1 KESIMPULAN 202
6.2 SARAN 203
PRAKATA
Segala puji dan syukur kehadirat Allah SWT yang telah melimpahkan rahmat dan
hidayah-Nya sehingga penulis dapat menyelesaikan naskah disertasi ini.
Disertasi dengan judul “ KONSTRUKSI MODEL MATEMATIKA
KOALISI
ANTARA VIRUS INFLUENZA H5N1 DAN H1N1 PANDEMIK “ disusun untuk
memenuhi salah satu syarat dalam menenpuh ujian kelayakan, tertutup dan terbuka dalam
rangka untuk memperoleh gelar Doktor MIPA di FAKULTAS SAINS DAN
TEKNOLOGI - UNAIR.
Saya pilih judul dari disertasi ini dengan pertimbangan bahwa kedua virus tersebut telah
menyebar di Indonesia yang bersifat endemik maupun pandemik lokal, kajian dari
disiplin ilmu matematika terhadap gerakan spasial dan temporal dari individual sehingga
terjadi koalisi dari kedua virus belum pernah dilakukan. Oleh karena itu hasil yang
diperoleh dari disertasi ini diharapkan dapat memberikan masukan lebih dini pada
pengambil kebijakan.
Penyusunan naskah disertasi ini tidak terlepas dari dukungan berbagai pihak.Oleh
karena itu, saya sampaikan rasa hormat dan ucapan terimakasih kepada:
1. Prof. Dr. Basuki Widodo, M.Sc selaku Promotor yang telah memberikan
pengarahan tentang materi disertasi maupun publikasi internasional.
2. Dr. C.A Nidom, drh. M.S selaku Kopromotor yang telah memberikan pengarahan
tentang materi disertasi.
3. Prof. Dr. I Nyoman Budiantara, M.Si selaku Kopromotor yang telah memberikan
pengarahan tentang materi disertasi.
4. Rektor ITS yang telah memberikan ijin untuk studi lanjut S3
5. DITJEN-DIKTI Kementerian Pendidikan dan Kebudayaan yang telah
memberikan beasiswa BPPS
6. Prof. Win Darmanto,M.Si. PhD selaku Dekan FST-UA yang telah memberikan
Kritik dan saran sangat diharapkan dalam rangka kesempurnaan naskah disertasi
ini, semoga dapat bermanfaat untuk perkembangan teori pemodelan matematika dalam
bidang biologi maupun epidemiologi.
UCAPAN TERIMA KASIH
Saya sampaikan pula kepada berbagai pihak yang telah mendukung dalam penyelesaian
disertasi ini antara lain:
1. Prof. Dr. Darminto, M.Sc selaku Pembantu Rektor IV yang telah mengajukan
permohonan bantuan penyelesaian studi S3
2. Ketua LPPM-ITS yang telah memberikan kesempatan untuk mengikuti penelitian
dari sumber dana Penelitian Hibah Doktor/ BOPTN – ITS 2012.
3. Prof. Dr. R Y Perry Burhan, MSc dan Dr.Mahmud Yunus, MSi. selaku Dekan
dan Pembantu Dekan FMIPA-ITS yang selalu memantau perkembangan studi
S3.
4. Prof. Dr. Suhariningsih, M.Si selaku ASDIR I Program Pasca Sarjana UNAIR
yang telah memberikan semangat dan motivasi.
5. Prof. Dr. Bambang Irawan, MSc selaku Kaprodi S3 MIPA FST UNAIR yang
telah memberikan kemudahan dalam penyelesaian disertasi
6. Prof. Dr. Marjono, M.Phil, Dr. Abadi, M.Sc, Dr. Fatma, Dr. Imam Utoyo selaku
anggota Tim Penguji telah memberikan masukan pada penelitian disertasi.
7. Dr. Erna Apriliani, M.Si selaku Ketua Jurusan Matematika FMIPA –ITS yang
telah memberikan semangat, motivasi dan pendanaan.
8. Dr. Subchan, M.Sc selaku Kepala Laboratorium Pemodelan dan Sistem Jurusan
Matematika FMIPA-ITS yang telah memberikan fasilitas untuk menyelesaikan
disertasi ini.
9. Dr. Miswanto, M.Si selaku Ketua Departeman Matematika FST-UA yang telah
memberikan masukan dalam penyelesaian naskah disertasi
10.Teman-teman dari Dosen Matematika FMIPA-ITS terutama Dr. Subiono yang
telah memberikan masukan dan diskusi dalam penyelesaian disertasi ini.
11.Teman-teman S3 MIPA FST-UA tahun 2008 yang telah memberikan motivasi
dan masukan dalam penyelesaian disertasi.
12.Istri dan anak-anak tercinta Nisa,Kiki,Ufi dan Bagus serta cucu Ibang yang selalu
DAFTAR GAMBAR
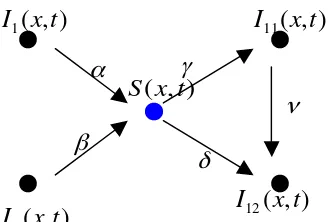
HalamanGambar 2.1 : Network dari perubahan keadaan 10
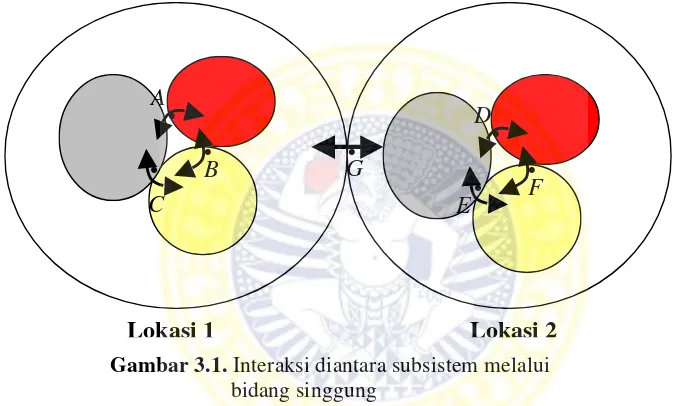
Gambar 3.1 : Interaksi diantara subsistem melalui bidang singgung 32
Gambar 3.2 : Perubahan Dinamis pada lokasi 1 33
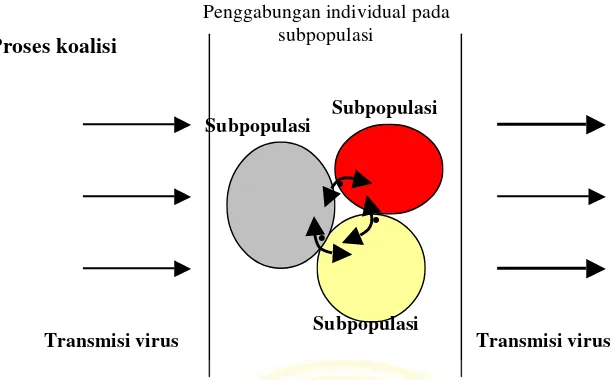
Gambar 3.3 : Proses terjadinya koalisi 33
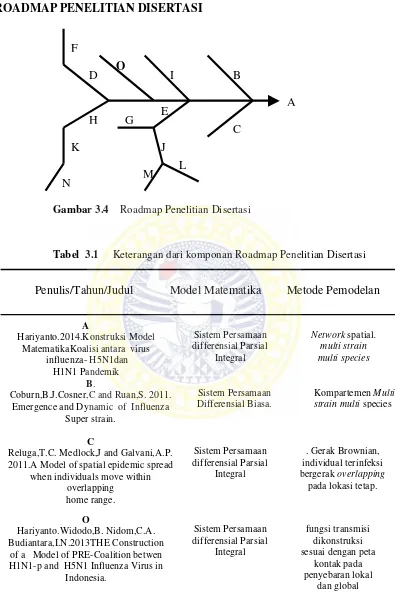
Gambar 3.4 : Roadmap Penelitian Disertasi 37
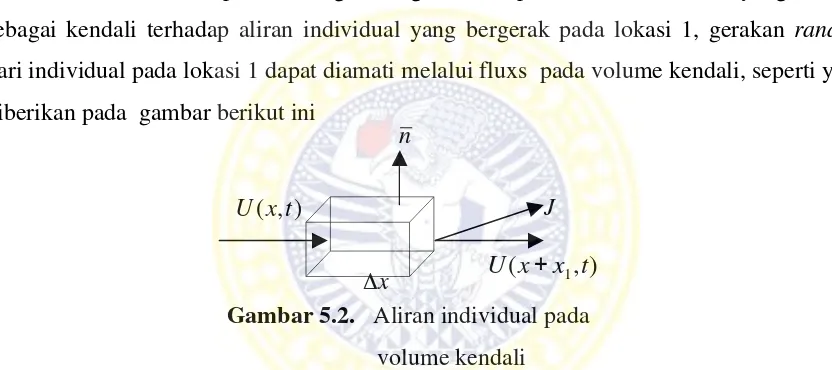
Gambar 5.1 : Aliran individual bergerak pada lokasi 1 dan lokasi 2 51
Gambar 5.2 : Aliran individual pada volume kendali. 51
Gambar 5.3 : Gerakan silang individual populasi pada masing-masing
lokasi. 54
Gambar 5.4 : Model transmisi virus multistrain multiinfeksi 57
Gambar 5.5 : Infeksi dinamis dari virus influenza H1N1-p 58
Gambar 5.6: Network kontak individual pada penyebaran virus H1N1-p
lokasi 1 62
Gambar 5.7 Network kontak individual pada penyebaran virus H5N1
lokasi 1. 65
Gambar 5.8 Network kontak dan intyeraksi individual pada penyebaran
virus H1N1-p lokasi 1 70
Gambar 5.9 Network kontak dan interaksi individual pada penyebaran
Gambar 5.10 Network kontak dan interaksi individual pada penyebaran
virus H1N1-p dan H5N1 serta subtitusi asam amino di
lokasi 1
78
Gambar 5.11: Relasi nilai karakteristik dengan kecepatan penyebaran 195
Gambar 5.12 : Traveling Wave virus super-strain 201
DAFTAR TABEL
HalamanTabel 2.1 Konfirmasi tentang manusia terinfeksi virus H5N1 di
Indonesia
7
Tabel 2.2 Pandemik virus influenza A - manusia 8
Tabel 2.3 Perubahan pada status individual 10
Tabel 3.1 Keterangan dari komponen Roadmap Penelitian Disertasi 37
Tabel 3.2 Teori Penelitian Disertasi 40
Tabel 5.1 Aliran perubahan populasi terhadap penyebaran virus
H1N1-p
63
Tabel 5.2 Aliran perubahan populasi unggas dan manusia
terhadap penyebaran virus H5N1 tahapan pertama
66
Tabel 5.3 Aliran perubahan populasi manusia terhadap
penyebaran virus H1N1-p tahapan pertama
Tabel 5.4a Aliran perubahan populasi manusia terhadap penyebaran
virus H5N1 tahapan kedua
71
73
Tabel 5.4b Aliran perubahan populasi manusia terhadap penyebaran
virus H5N1 tahapan kedua
74
Tabel 5.5a Aliran perubahan populasi manusia terhadap penyebaran
virus H5N1 dan H1N1-p tahapan ketiga
Tabel 5.5b Aliran perubahan populasi manusia terhadap penyebaran
virus H5N1 dan H1N1-p tahapan ketiga
79
80
Tabel 5.6a Perubahan/transisi subpopulasi karena transmisi virus 87
Tabel 5.6b Perubahan/transisi subpopulasi karena transmisi virus 88 Tabel 5.7 Perubahan/transisi subpopulasi karena recovery 89
Tabel 5.8 Perubahan/transisi subpopulasi kemampuan melakukan
transmisi
90
DAFTAR LAMPIRAN
HalamanData Pribadi I
Riwayat Pendidikan. I
Riwayat Kerja. I
Daftar Penelitian. II
Daftar Publikasi. II
Singkatan DAFTAR SINGKATAN
H1N1-p,H5N1 Jenis virus A yang juga virus pandemik flu babi dan virus avian
yang dapat menyerang manusia.
Outbreak Penularan atau penyebaran virus yang terjadi diseluruh dunia.
Pandemik Seperti pada Outbreak tetapi hanya regional saja.
Endemik Penyebaran atau penularan virus yang setiap saat muncul.
Host Individual populasi yang berpotensi untuk terinfeksi virus.
Epidemiologi Ilmu yang mempelajari tentang penyakit atau penularan virus.
Virulence Karakteristik virus yang dapat diamati pada pengaruh individual
setelah terinfeksi.
Susceptible Individual populasi yang tidak terinfeksi.
Ekspose Individual populasi yang terinfeksi tetapi belum mentransmisi
Infection Individual populasi yang terinfeksi dan mentransmisi.
Recovered Individual populasi yang terinfeksi dan sembuh.
Transmisi Penularan virus.
Singelton Biasanya digunakan pada himpunan yaitu himpunan yang hanya
mempunyai 1 elemen.
Strain Regenerasi dari virus sebelumnnya dan mempunyai karakteristik
yang berbeda walaupun dalam satu garis keturunan.
Co-infeksi individual populasi yang terinfeksi lebih dari 1 virus.
Co-transmisi Suatu kondisi sebelum terjadinya Co-infeksi.
Cross-transmisi. Transmisi virus yang terjadi diantara individual populasi terinfeksi.
Simbol DAFTAR SIMBOL
1
Ω Domain dari individual populasi yang bergerak di lokasi 1.
2
Ω Domain dari individual populasi yang bergerak di lokasi 2. )
(−∗− Operator dari integral konvolusi
0
R Bilangan reproduksi dasar.
R Bilangan real.
) (R0
maks Nilai maksimum dari R0 yang digunakan.
−
U Titik kesetimbangan bebas virus.
+
U Titik kesetimbangan endemik.
) (u0
ϕ Operator ϕ yang didefinisikan pada u0.
J
D1 Koefisien diffusi dari virus super-strain di lokasi 1
) ), ( (X t t
f Norm matriks. f(X(t),t)adalah nilai maksimum dari k(t) yang
memenuhi f(X(t),t) <k(t)maks X .
) , ( 1 R
C Ω Himpunan fungsi kontinu dengan domain di lokasi 1 untuk t∈R
2
∇ Operator Laplacian
x
Δ Operator beda pada .x
∫
Ω1
Operator integral untuk integrand dengan domain di lokasi 1.
) , (M K
π Menyatakan himpunan π(x,t):x∈M,t∈K.
∑
Deret penjumlahan.INTISARI
KONSTRUKSI MODEL MATEMATIKA KOALISI ANTARA VIRUS
INFLUENZA H5N1 DAN H1N1 PANDEMIK
Hariyanto
Jurusan Matematika FMIPA-ITS
Basuki Widodo
Jurusan Matematika FMIPA-ITS
C.A. Nidom
AVIAN Influenza Researc Center - UNAIR
I. Nyoman Budiantara
Jurusan Statistik FMIPA ITS
Keberadaan Genotipe dari virus H5N1 menunjukkan bahwa semua novel
genotipe selalu ditemukan dalam bentuk isolasi pada unggas dan burung domestik, virus
H5N1 mampu beradaptasi pada binatang maupun manusia jika terjadi mutasi pada asam
amino protein PB2 nomor 627 dan 701, sedangkan Virus H1N1-p sudah mampu
beradaptasi terhadap binatang maupun manusia tanpa mutasi 627. Kedua virus tersebut
mempunyai struktur yang sama yaitu 8 gen yang saling lepas sehingga sangat mudah
untuk terjadi koalisi, untuk mengetahui proses terjadinya koalisi serta potensi terjadinya
pandemik dari strain baru maka pada penelitian dilakukan konstruksi model matematika
dengan mengamati setiap perubahan subpopulasi yang disebabkan oleh gerakan dinamis
dan evolusi genetika pada setiap individual populasi. Analisis persistensi terhadap
penyebaran virus influenza H5N1, H1N1-p dan Super-Strain dilakukan pada setiap
tahapan konstruksi model yang didefinisikan sebagai metric transmisi, sedangkan untuk
mengetahui penyebaran secara global maupun lokal dapat dilakukan dengan menganalisis
terhadap kecepatan gelombang penyebaran dan kemampuan virus dalam melakukan
perubahan yang terjadi pada penyebaran virus influenza H1N1 pandemik akan tetapi
persisten terhadap penyebaran virus influenza H5N1 pada kondisi stabil.
Kata Kunci : Model Matematika, Koalisi virus influenza, Persistensi, Kecepatan
gelombang..
ABSTRACT
The Construction of Mathematics Coalision Models between H5N1 and
Pandemic H1N1 Influenza Virus
Hariyanto
Mathematics Departement of ITS and Doctorate student in Airlangga University
Basuki Widodo
Mathematics Departement of ITS
CA Nidom
AVIAN Influenza Reseach Center - UNAIR
I. Nyoman Budiantara
Statistics Departement of ITS
The existence of genotypes of H5N1 viruses show that all novel genotype are
always found in the form of isolation in poultry and domestic birds. The H5N1 virus
adapting to humans and animals if there is a mutation in the PB2 protein amino acid
numbers 627 and 701. While, the pandemic H1N1 virus has been able to adapt to
animals and humans without mutations of 627. Both the virus have the same structure
that is independent of the other eight genes that are so very easy to happen coalition. To
understand the process of the coalition, as well as the potential for a pandemic of a new
strain have been done. The construction of a mathematical model is applied to observe
any changes in subpopulations that cause a dynamic movement and evolution genetics
of each individual of the population. The analysis of the persistence of the spread of the
H5N1 and the pandemic of H1N1 influenza virus and Super - Strain perform at each
stage of the construction of the model. The model is defined as a metric transmission, in
show that the super virus strains against persistent changes in the spread of the pandemic
H1N1 influenza virus. However, if against persistently the spread of H5N1 influenza
virus in a stable condition.
Keywords: Mathematical Model, Influenza virus coalition, Persistence, wave speed.
Barang siapa menemukan ( merintis ) sesuatu yang baru dan baik
maka baginya pahala atas penemuannya dan pahala bagi orang
yang mengamalkannya ( Al- Hadits )
BAB I
PENGANTAR
1.1 LATAR BELAKANG
Koalisi diantara virus akan terjadi jika material genetika dari beberapa
speciesbergabung dan menghasilkan species baru yang mempunyai karakteristik berbeda tetapi
masih mempunyai garis keturunan dari species sebelumnya. Koalisi dari virus influenza
terjadi berasal dari genome yang terdiri dari 8 segmen berbeda pada RNA dan
segmen-segmen tersebut mirip dengan minikromosom yang setiap saat akan menyatu. Jika host
yang berperan sebagai mixing vessel terinfeksi oleh 2 virus dengan strain yang berbeda
maka kemungkinan yang terjadi adalah terbentuknya pasangan viral partikel baru. Partikel
tersebut terbentuk oleh segmen-segmen asli, yang dapat berasal dari salah satu strain.
Pasangan viral partikel tersebut disebut sebagai strain baru, yang akan menjadi bagian dari
kedua virus tersebut.
Pada umumnya koalisi yang terjadi berbentuk genetik shift, antara lain pandemik
dari strain virus influenza Asian H2N2 pada tahun 1957, rekombinasi yang terjadi antara
virus H5N1 dan H1N1 tahun 1918 dan potensi terjadi pandemik dari virus influenza H1N1
sebagai rekombinasi antara virus influenza burung,babi dan manusia (Trampuz et al.,
2004,Flahault et al.,2009). Penyebaran virus influenza burung H5N1 secara global juga
terjadi di Indonesia yang berpotensi terjadinya koalisi dengan virus manusia. Beberapa
penelitian di laboratorium telah dilakukan antara lain koalisi antara H5N1 unggas
A/Chicken/South Kalimantan/UT6028/06(SK06H5N1 dengan H3N2
A/Tokyo/UT-SK-1/Tok07.H3N2 yang menghasilkan virus dengan patogen tinggi. Mutasi genetika yang
dihasilkan dari outbreak flu babi pada tahun 2009 adalah H1N1 Pandemik yang sangat
mudah dan cepat menyebar dari manusia ke manusia serta mampu beradaptasi terhadap
manusia tanpa melalui asam amino.Virus influenza H5N1 sangat mudah berkoalisi dengan
virus influenza H1N1-p jika kedua virus bertransmisi pada host yang sama (Lie et
al.,2009;WHO.,2008).
Untuk mengetahui pola penyebaran virus influenza secara global, Arino et al.,(2005)
dimana individual bergerak dinamis pada beberapa lokasi sehingga model dapat digunakan
untuk mengetahui pola penyebaran pada lokasi lainnya terhadap lokasi utama. Model yang
diperoleh berbentuk sistem persamaan differensial biasa. Sedangkan Byluss,K.B.,(2005)
mengembangkan konstruksi model global dengan menggunakan operator integral konvolusi
dan operator diffusi sebagai distribusi lokasi dan global sehingga model yang diperoleh
berbentuk sistem reaksi-diffusi. Pada penelitian yang lain, Coburn et al.,(2011)
mengkonstruksi model penyebaran virus influenza H1N1 dan H5N1 berdasarkan pada
kontak dan interaksi yang terjadi pada multi species sehingga transmisi dari multi strain
yang terjadi pada individual berada pada lokasi yang tetap. Pergerakan dinamis dari
individual hanya diamati pada satu lokasi secara tertutup.
Domain dari penelitian disertasi adalah koalisi antara virus influenza H5N1 dan
H1N1 pandemik. Penyebaran dari virus influenza H5N1 diamati menyerang pada unggas
dan manusia dan H1N1-p menyerang pada manusia, pola penyebaran virus tersebut
dinamakan multi strain multispecies. Konstruksi model matematika dilakukan secara
bertahap berdasarkan pada proses koalisi, yang terdiri dari kontak dan interaksi dari 2 jenis
individual yang bergerak pada 2 lokasi. Telah diketahui bahwa virus influenza H5N1
mempunyai patogenitas tinggi dan H1N1 pandemik mampu beradaptasi pada manusia
sehingga pada setiap lokasi mempunyai peluang yang sangat besar untuk terjadi koalisi
pada manusia.
1.1.1 Kajian Masalah
Berdasarkan pada latar belakang masalah tersebut maka kajian masalah yang
dilakukan adalah:
1. Penyebaran virus H5N1 dan H1N1 pandemik yang mempunyai 8 gen saling lepas
mempunyai peluang yang sangat besar terjadinya koalisi. Selain itu kedua virus
tersebut sangat mudah untuk bermutasi melalui asam amino dan kedua-duanya
mampu beradaptasi terhadap manusia dan binatang.
2. Persistensi terhadap pathogenitas dari virus tersebut mencerminkan eksistensi virus
3. Di Indonesia, virus H1N1 pandemik beradaptasi terhadap manusia, demikian pula
flu burung (H5N1) beradaptasi pada hewan dan manusia artinya dengan mobilitas
yang dinamis dari individual populasi dapat memperluas wilayah penyebaran, oleh
karena itu terdapat peluang terjadinya pandemik dari koalisi antara virus H5N1
dengan H1N1 pandemik.
1.2 RUMUSAN MASALAH
1. Bagaimana membangun konstruksi model matematika koalisi virus influenza H5N1
dengan H1N1 pandemik sebagai suatu model sistem yang terdiri dari
subsistem-subsistem sesuai dengan proses koalisi sampai pada co-infection dan akhirnya
terdapat subpopulasi strain baru.
2. Bagaimana melakukan analisa persistensi terhadap penyebaran virus influensa
H1N1 pandemik dan H5N1 pada masing-masing rangkaian tahapan konstruksi
model koalisi, analisa eksistensi dan ketunggalan penyelesaian dari masing-masing
tahapan proses koalisi dan bagaimana melakukan analisa terhadap model sistem
koalisi sebagai sistem dinamik.
3. Bagaimana membangun model sistem traveling wave front dari model subsistem
strain baru dan menganalisis kecepatan penyebaran virus baru serta menentukan
jumlah gelombang dan panjang gelombang penyebaran virus baru.
1.2.1 Batasan Masalah
Batasan masalah pada penelitian ini adalah:
1. Lokasi sebagai obyek mempunyai jarak atau saling bersinggungan, dan pada
penelitian ini diambil 2 lokasi.
2. Virus influensa H5N1 dan H1N1 pandemik distribusi penyebarannya merata pada
kedua lokasi tersebut dengan spesifikasi bahwa H5N1 mempunyai phatogenitas
tinggi yang transmisinya melalui kontak dan interaksi dari unggas ke manusia.
Sedangkan H1N1 pandemik beradaptasi pada manusia dan binatang, kedua virus
3. Populasi host yang terdiri dari manusia dan unggas bergerak dinamis sehingga
lokasi dianggap sebagai domain yang terbuka.
4. Fungsi transmisi dari kedua virus berbentuk f(S,I)=βSpIqdengan p =q =1dan
dibangun dengan menggunakan hukum energi dengan mass infection sebagai
landasan untuk formulasi kwantiti pada perubahan setiap subpopulasi.
5. Virus influensa H5N1 pada penelitian ini diambil khusus untuk virus yang hanya
invasi pada manusia dan unggas.yaitu salah satu tipe virus dari 170 varian yang
berada di Indonesia.
1.3 TUJUAN .PENELITIAN
Tujuan dari penelitian desertasi ini adalah memberikan penyelesaian yang berkaitan
dengan permasalahan obyek penelitian, permasalahan tersebut berkaitan dengan strategi
pencegahan dan pengelolaan penyebaran virus influenza. Secara khusus; tujuan penelitian
ini adalah:
1. Membangun konstruksi model matematika koalisi virus influenza H5N1 dengan
H1N1 pandemik sebagai suatu model sistem yang terdiri dari subsistem-subsistem
sesuai dengan proses koalisi sampai pada co-infection dan akhirnya terdapat
subpopulasi strain baru.
2. Melakukan analisa persistensi terhadap penyebaran virus influensa H1N1
pandemik dan H5N1 pada masing-masing rangkaian tahapan konstruksi model
koalisi, analisa eksistensi dan ketunggalan penyelesaian dari masing-masing
tahapan proses koalisi dan melakukan analisa terhadap model sistem koalisi
sebagai sistem dinamik.
3. Membangun model sistem traveling wave front dari model subsistem strain baru
dan menganalisis kecepatan penyebaran virus baru serta menentukan jumlah
1.4 MANFAATPENELITIAN
Manfaat yang dapat diperoleh dari penelitian disertasi ini adalah:
1. Virus influenza H5N1 dan H1N1 pandemik merupakan virus dengan genetika yang
tidak stabil sehingga sewaktu-waktu dapat berubah dengan melalui berbagai macam
sebab antara lain mutasi dan koalisi, oleh karena itu penelitian disertasi ini dapat
memberikan informasi lebih awal melalui kajian berbentuk analisa pada konstruksi
model matematika koalisi.
2. Kecepatan gelombang penyebaran diprediksi berdasarkan pada penyelesaian sistem
persamaan traveling wave yang dapat memberikan gambaran terhadap pengambil
BAB II
TINJAUAN PUSTAKA
2.1 DEFINISI
Pada penelitian disertasi dimulai dengan melakukan beberapa kajian yang berkaitan
dengan tujuan penelitian antara lain mengumpulkan beberapa materi yang diperlukan yang
terbagi dalam 5 bagian yaitu:
1. Phenomena obyek, menjelaskan beberapa pustaka rujukan berupa jurnal dan artikel
yang membahas tentang virus influenza A antara lain virus influenza H5N1, H1N1
pandemik dan koalisi dari kedua virus tersebut di Indonesia.
2. Pemodelan Matematika, menjelaskan beberapa pustaka rujukan yang berkaitan
dengan model matematika untuk penyebaran virus dengan berbagai pendekatan
antara lain model matematika penyebaran virus spasial, antar kota/wilayah, network
spasial dan model matematika dibangun berdasarkan perubahan yang terjadi pada
genetika virus.
3. Reproduksi dasar, menjelaskan beberapa pustaka rujukan yang berkaitan dengan
trasnmisi kedua pada individual susceptible yaitu bilangan reproduksi dasar R0.
4. Traveling wave, menjelaskan beberapa pustaka rujukan yang berkaitan dengan
kecepatan gelombang penyebaran virus antara lain transformasi/ reduksi model
pada penyebaran virus influenza.
5. Analisis, menjelaskan beberapa pustaka rujukan yang berkaitan dengan analisa
persistensi, eksistensi dan ketunggalan.
2.1.1 Phenomena obyek.
Virus influenza H5N1 dan H1N1 Pandemik
Kode genetik dari virus influenza tipe A adalah hemaglutinin atau disingkat H dan
neuraminidase atau disingkat N dengan masing-masing terdiri dari 16 subtipe H dan 9
subtipe N, subtipe dari kode genetik pada virus influenza sangat mempengaruhi invasi virus
mengakibatkan terjadinya evolusi genetik yang berbentuk mutasi atau koalisi (Al Hajjar
and Mcintosh.,2010; Liu et al.,2009).
Pandemik adalah epidemik dengan penyebaran yang sangat luas ( penyebaran
virus yang diukur berdasarkan pada lokasi penyebarannya ) disebabkan oleh novel virus
yang berpengaruh terhadap sebagian atau semua kelompok usia dengan satuan bulan untuk
periode penyebarannya, novel virus dapat pula terjadi epidemik yang lebih besar dan
meluas pada beberapa negara dalam waktu yang sama. Beberapa indikator yang
menunjukkan terjadinya pandemik pada penyebaran virus influenza yaitu munculnya strain
baru dan menyebar dari manusia ke manusia.
Di Indonesia, penyebaran virus influenza dimulai pada unggas dan kemudian menyebar
pada manusia. Penyebaran tersebut dalam jumlah kasus rendah dengan angka kematian
( case fatality rate) sangat tinggi yaitu 60%-80% (Trampuz et al.,2004;WHO,2008).
Tabel 2.1: Konfirmasi tentang manusia yang terinfeksi virus influenza A-H5N1 di Indonesia.
Sumber: (WHO.,2008).
184 orang positif terinfeksi dan 152 orang meninggal Sampai dengan
24 Januari 2012
11 kasus yang terjadi di tahun 2011 Sampai dengan
April 2010
136 orang meninggal 19 orang meninggal 20 kasus
1 Januari 2009 s/d 28 Desember 2009
101 orang meninggal
112 orang meninggal 124 kasus
135 kasus Sampai dengan Januari 2008
.Sampai dengan Juni 2008
479 kasus komulatif, 33 kasus konfirmatif
74 orang positif terinfeksi, 56 meninggal Juli 2005-Nopember
2006
Jumlah meninggal Jumlah kasus
Tahun
Juli 2006- Juni 2007
Virus swine H1N1 merupakan subtipe dari virus influenza A secara kontinu
bersirkulasi pada babi, di US,Asia dan Eropa antigenik virus tersebut relatif stabil.
Transmisi silang dari virus H1N1 swine secara periodik terjadi pada manusia, dan terjadi
outbreak di Hongkong pada tahun 2009 yang dikenal dengan virus influenza H1N1
pandemik.
Pandemik dari virus influenza A manusia diberikan pada tabel berikut ini
Tabel 2.2: Pandemik virus influenza A –manusia
Sumber(WHO.,2008).
Dari Tabel tersebut diatas dapat diketahui bahwa periode terjadinya pandemik virus
influenza A – manusia antara 9 s/d 38 tahun. Muncul strain baru sebagai hasil koalisi
antara virus influenza A-manusia ( H2N2 dan H3N2 ) dengan virus influenza A – burung
sebanyak 2 kali. Sedangkan, 1 kali terjadi outbreak flu babi pada tahun 2009, virus tersebut
mampu beradaptasi pada manusia maupun binatang tanpa harus bermutasi dengan asam
amino Pb2 kode 627.
1977 China
,Russia Russian
flu
Low mortality Reappereance
of 1950 H1N1 virus
H1N1
Negara asal Viral gene
Tahun Nama virus Subtipe Meninggal
25-50 juta Unclear,contains
mamalian and avian gene
1918-1919
China, Europe, South America H1N1
Spanish flu
1957 Reassortment >1juta
with avian virus China
H2N2 Asian
flu
1968 Hongkong H3N2 China flu
Reassortment with avian
virus
>1juta
Meksiko 2009 Swain
flu
Terdapat 137.232 kasus Diduga terjadi
karena co-infection dan
Koalisi virus influenza di Indonesia
Virus influenza H5N1 mulai masuk ke Indonesia pada tahun 2003 dan sampai
tahun 2009 berada ada phase 4 dengan FCR sebesar 76,28%, kondisi yang sangat
mengkawatirkan pada awal tahun 2010 dengan 20 kasus 19 diantaranya meninggal dunia.
Berdasarkan hasil dari penelitian menunjukkan bahwa di Indonesia terdapat 170 variant flu
burung yang terdiri dari 3 jenis virus dengan variasi invasi yang berbeda-beda tarhadap
Host. Virus influenza H1N1 pandemik diperkirakan menyebar di Indonesia sekitar awal
tahun 2010 dengan kharakteristik yang mudah menyebar dari manusia ke manuisa dan
mudah beradaptasi, jika virus H5N1 yang beradaptasi pada manusia melalui Pb2 bertemu
dengan virus influenza yang transmisinya melalui kontak dari manusia ke manusia maka
kedua virus tersebut akan sangat mudah untuk berkoalisi(Liu et al.,2009;Lie et al.,2009;
WHO,2008).
2.1.2 Pemodelan matematika
Model matematika influenza sebagai model epidemiologi dibangun berdasarkan
model kompartemen, phenomena epidemiologi sebagai obyek terdiri dari komponen
individual populasi yang bergerak dinamis. Salah satu metode pendekatan yang dapat
digunakan untuk membangun model epidemiologi adalah menyusun jaringan kontak pada
populasi individual (host ). Pada pustaka ini, model matematika dibangun dengan
menggunakan model kompatemen standar yaitu SIS atau SIR dengan tujuan untuk
menentukan keterkaitan antara managemen virulence dengan struktur kontak pada
individual populasi. Evolusi virulence pada host yang berkaitan dengan kontak network
diantara host ekivalen dengan transmisi virus.
Jika multiple infeksi merupakan faktor yang menentukan terjadinya evolusi
virulence maka akan terdapat umpan balik melalui epidemiologi. Banyaknya strain
menyebabkan host bergantung pada wilayah populasi virus maupun perubahan yang terjadi
pada evolusi virulence, host diasumsikan dalam bentuk sosial network yang tetap, jika
setiap host melakukan kontak dengan host lainnya sebanyak n maka kontak yang tarjadi
merupakan hasil dari interaksi host terhadap sekelilingnya ( host pada graph dinyatakan
individual susceptible S dan dapat terinfeksi oleh satu dari dua strain I dan J (recovered
dan immune). Perubahan yang terjadi pada host ditunjukkan pada Tabel berikut ini:
Tabel 2.3. Perubahan pada status individual
Sumber: (Kelling et al.,2005).
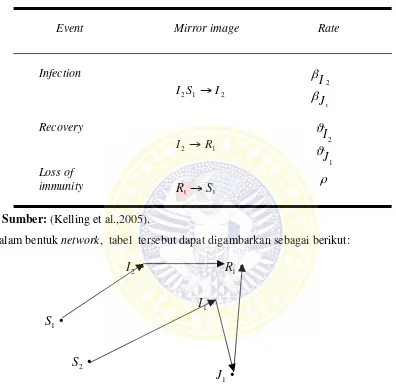
Dalam bentuk network, tabel tersebut dapat digambarkan sebagai berikut:
Gambar 2.1. Network dari perubahan status individual.
Mixing network diantara populasi susceptible dan terinfeksi terjadi karena terdapat
kontak antara individual susceptible S1 dengan individual terinfeksi I2 atau ditulis secara
simbolik S1 I2, transmisi virus pada S1 menyebabkan terjadi perubahan pada S1 sebesar
1
S I2, demikian pula untuk individual populasi lain yang dinyatakan pada network tersebut
(Kelling et al.,2005).
•
1
R
•
1
J
•
2
S
•
1
I
•
1
S
•
2
I
ρ 1
1 S
R →
S Loss of
immunity
1 2
R J
R I
→ →
2
I ϑ
1
J ϑ Recovery
2
I β
1
J β Infection
Rate Mirror image
Event
2 1 2
J S J
I S I
→ →
Pada bembahasan berikut, ditunjukkan bahwa transmisi suatu virus pada individual
dapat berbentuk fungsi transmisi T(S,I), fungsi transmisi atau rate incidence adalah
banyaknya kasus baru persatuan waktu dan merupakan komponen utama dari setiap model
epidemiologi. Untuk model susceptible dinyatakan S(t) T(S,I)
pupulasi sebagai peubah. Fungsi transmisi yang berbentuk bilinear dapat digunakan pada
model epidemiologi yaitu
p q
Bentuk fungsi transmisi tersebut digunakan bergantung pada keadaan phenomena yang
diamati, berikut penjelasannya:
1. Fungsi transmisi berbentuk T(S,I)=βSpIdigunakan untuk mengamati
konsekuensi dari bermacam asumsi jika hukum atau aturan yang berkaitan dengan
phenomena tidak diketahui.
2. Fungsi transmisi berbentuk q SI I
S
T( , )=β adalah fungsi transmisi yang
digunakan untuk fungsi transmisi yang tidak linear.
Untuk mendapatkan formulasi model digunakan asumsi bahwa populasi susceptible
dan infeksi heterogen dan misalkan S(t,w1)dan I(t,w2)menyatakan densitas dari susceptible dan infeksi yang independen sehingga
β
(w1,w2)=β
1(w1)β
2(w2).Jika banyaknya susceptible dengan nilai w1 yang terinfeksi oleh individual terinfeksi dengannilai w2 maka
β(w1.,w2)S(t,w1).I(t,w2)=β1(w1.)S(t,w1)β2(w2)I(t,w2)
dan total perubahan pada subpopulasi terinfeksi dengan nilai karakteristik w2adalah
1 1 2
1
1
2) ( , ) ( , )
, (
.I t w
∫
w w S t w dw Ωβ = 1 1 1
1 1 2 2
2(w )I(t,w )
∫
.(w )S(t,w )dwΩ β
β 2.3
dengan kondisi awal
I(0,w2)= pi(0,w2)I(0),s(0,w1)= ps(0,w1)S(0)(Novozhilov, A.2008). Model spasial dari influenza pertama kali dikembangkan pada tahun 1960,
kemudian dikembangkan menjadi bentuk model penyebaran geografik dari influenza di
Uni Sovyet dengan menggunakan data perjalanan. Untukmelakukan kajian pengaruh dari
perjalanan terhadap model pandemik influenza dilakukan kuantifikasi terhadap perjalanan
tersebut sehingga dapat diketahui penyebaran influenza secara geografik. Model epidemik
influenza yang terjadi di 9 kota di Eropa digunakan untuk mengestimasi derajat keterkaitan
antara epidemik di kota utama dan juga digunakan untuk mengetahui sinkronisasi spasial
dan temporal dari epidemic influenza yang terjadi di kota lainnya (Coburn et
al.,2011;Flahault et al.,2009).
Pemodelan berikutnya dibangun berdasarkan pada asumsi bahwa individual
bergerak dan akan kembali pada lokasi tetapnya artinya bahwa individual mempunyai
tempat ataupun lokasi yang tetap untuk waktu tertentu, dengan demikian individual
melakukan gerakan terbatas dan populasi dari individual mempunyai distribusi uniform.
Misalkan setiap individual mempunyai posisi spasial x dengan lokasi tetap xh, individual
yang berada pada lokasi tetap konstan tetapi posisi individual berubah berdasarkan pada
random walk atas waktu, secara khusus, diasumsikan bahwa individual adalah attracted
pada lokasi tetapnya dengan rangkaian perubahan tempat dari lokasi tetapnya sebesar
. h x
x− Misalkan posisi awal y dengan density probabilitas p(x y,xh,t),jika individual
bergerak dari y ke lokasi tetapnya kemudian bergerak ke posisi spasial x maka pergerakan
individual tersebut merupakan gerak Brownian berbentuk
2 [( ) ]
2
p x x x x
p D t p
h − ∂
∂ + ∂ ∂ = ∂ ∂
α 2.4
dengan kondisi awal ( , ,0) (x y), h
x y x
p =δ − D sebagai rate diffusi dan α adalah
kekuatan atractive dari individual terhadap lokasi tetapnya. Persamaan 2.4 mempunyai
pada penyelesaian traveling wave dan dalam keadaan yang realistis kecepatan gelombang
lebih besar dari c∗ (Reluga et al.,2011).
Metode pemodelan berikutnya membagi populasi menjadi beberapa subpopulasi dengan menyertakan komparteman latent, jika individual berada pada periode latent yang
kemudian berada pada klas infeksi maka rate dari perubahan populasi terinfeksi pada
waktu t dan lokasi x bergantung pada individual baru terinfeksi persatuan waktu t+Δt,
misalkan terdapat peubah penyakit dalam individual aselama τ dapat ditulis E(t,a,x)yang
menyatakan density dari populasi ekspose pada waktu t dan lokasi .x
Model standar yang sering digunakan dengan populasi yang terbagi dalam struktur usia
maka diffusi spasial dapat dinyatakan sebagai berikut (Li and Zou. 2009):
dari persamaan (2.8) dideferensialkan terhadap t diperoleh:
∫
Andaikan terdapat populasi yang terletak pada 2 lokasi yaitu Ω1 dan Ω2 dengan ukuran
1
L dan L2,populasi dibagi dalam 3 klas yaitu susceptible, infected dan recovered dengan densiti spasial Si(xi,t),Ii(xi,t) dan Ri(xi,t) yang saling berhubungan dalam lokasi i
dengan i=1,2, densiti dari total populasi pada 2 lokasi tersebut adalah N1(x1,t)dan
) , ( 2
2 x t
N maka total populasi pada kedua lokasi tersebut adalah
∫
∫
Ω Ω
+ =
1 2
2 2 2 1
1
1( , ) ( , )
)
(t N x t dx N x t dx
TP . 2.11
Diasumsikan bahwa pergerakan individual kelokasi 1 sama dengan proporsi dari populasi
pada lokasi 2 yang bergerak ke lokasi 1, jika diasumsikan bahwa transmisi dari virus
terjadi pada kontak tertutup ( yaitu susceptible dapat terinfeksi hanya setelah kontak dengan
beberapa individual terinfeksi dilokasi pada titik yang sama) dan tidak terdapat periode
latent maka model penyebaran spasial dari epidemik pada 2 lokasi dapat ditulis dalam
bentuk sebagai berikut:
1 ( 1, 1) ( 1 1) 1( 12 1) ( 21 2) S S K S
K S S S K I S S f t S
∗ + ∗ −
∗ +
= ∂ ∂
1 f I(S1,I1) rI1 (K1I I1) I1(K12I 1) (K21I I2) t
I
∗ + ∗ −
∗ + − =
∂ ∂
2.12
1 rI1. (K1R R1) R1(K12R 1) (K21R R2) t
R
∗ +
∗ −
∗ +
= ∂ ∂
dengan Si, dan Ii Ri adalah vector dari individual susceptible, infected dan recovery pada
model tersebut diatas diasumsikan bahwa penyakit menyebabkan terjadinya immunity
permanent artinya setelah individual recovery dengan rate recovery memenuhi
0
≥
r (Blyuss,K.B. 2005).
Tinjauan pustaka berikutnya dirujuk dari Ruan,S.(2006) yang melakukan generalisasi terhadap model Kermark-MCKendrick berbentuk persamaan diferensial
integral yang bergantung pada ruang. dengan R=(−∞,∞),R+ =[0,∞).
Misalkan S(x,t),I(x,t)dan R(x,t) menyatakan density lokal dari individual susceptible,
pada waktu t,diasumsikan bahwa semua individual terinfeksi dengan rate infeksi
berbentuk
∫
∞
−∞
−y dy x
K t x
I( , ) ( )
β dengan β >0 konstan dan density K(x−y)>0 yang
mempunyai kontribusi terhadap individual susceptible menjadi terinfeksi pada lokasi x
setalah melakukan kontak dengan individual terinfeksi yang berasal dari lokasi y.
Individual yang removed dinyatakan sebagai immune atau mati dengan rate removal γ >0
berbentuk γI(x,t)(γI(x,t)menunjukkan bahwa mati disebabkan oleh penyakit yang
menyebar berarti terjadi penggabungan individual pada subpopulasi removed dan tidak
mempengaruhi perubahan yang terjadi pada subpopulasi terinfeksi ), dengan penjelasan
tersebut diatas maka model Kendal dapat dinyatakan sebagai berikut:
∫
∞−∞
− −
= ∂ ∂
dy y x K t y I t x S t
S
) ( ) , ( ) , (
β
S(x,t) I(y,t)K(x y)dy I(x,t) t
I
γ
β −
∞
−∞
−
=
∂ ∂
∫
2.13I(x,t) t
R γ =
∂ ∂
Kondisi tunak dari sistem 2.13 diberikan oleh S =σ,I =R =0dengan σ >0konstan. Untuk melakukan kajian tentang perilaku asimtotik dari penyelesaian sistem tersebut
diberikan oleh nilai awal sebagai berikut:
S(x,0)=σ, I(x,0)=I0(x), R(x,0)=0,x∈R 2.14
dengan I0(x)>0kontinu sedemikian hingga I(x)≡0dan I(x)≠0dalam [x0,∞)untuk suatu x0 ∈R (Ruan,S. 2006).
Model yang akan dibahas berikutnya adalah model multi species yang dibangun
berdasarkan pada transmisi silang diantara 2 species yaitu burung sebagai host dan nyamuk
sebagai vektor sehingga model sistem diperoleh dari interaksi antara burung dengan
nyamuk yang terinfeksi, sedangkan submodel sebagai bagian dari sistem dibangun
berdasarkan pada transmisi yang terjadi pada burung dan untuk transmisi pada nyamuk
Populasi individual burung dibagi dalam subpopulasisusceptible (SB), infection
( IB ), recovered ( RB ) dan mati ( XB ) dengan indek menyatakan burung dengan total
populasi burung dinyatakan dengan NB=( SB+ IB+ RB ), sedangkan pada nyamuk dibagi
dalam larva ( LN ), susceptible (SN ), exposed (EN) dan infection (IN ) untuk nyamuk
perempuan dimana total populasi nyamuk perempuan dinyatakan oleh N
N =( IN+ SN+
N
E + IN ), diharapkan model yang diperoleh secara esensial dapat mencakup dinamika dari
penyakit yang berkaitan dengan WN dengan penjelasan sebagai berikut:
1. Model dibangun hanya untuk mengamati penyebaran virus west nile melalui
transmisi silang antara nyamuk sebagai vektor dan host burung tanpa malakukan
prediksi terhadap kemungkinan terjadinya pandemik.
2. Submodel dari nyamuk memberikan gambaran tentang pertumbuhan populasi
nyamuk yang heterogen sehingga sangat mempengaruhi populasi nyamuk yang
terinfeksi virus west nile dan berakibat meningkatkan rate trasnmsisi dari virus
(Wonham et al.,2004).
Model berikutnya merupakan pengembangan dari model pada Wonham et al.(2004)
dengan 3 species dan model berbentuk sistem persamaan diferensial biasa yang digunakan
sebagai landasan untuk melakukan monitoring terhadap populasi dinamik temporal dari
nyamuk perempuan susceptible Mu(t), nyamuk perempuan terinfeksi Mi(t),burung
susceptibleBu(t),burung terinfeksi Bi(t),manusia susceptible S(t),manusia terinfeksi
tanpa tanda-tanda E(t),manusia terinfeksi dengan tanda-tanda I(t),manusia terinfeksi
dengan penanganan rumah sakit H(t),manusia yang terinfeksi kemudian sembuh
), (t
R model dibangun berdasarkan karakteristik phenomena dari west nile yaitu:
1. Terjadi transmisi silang antara vector nyamuk dengan host burung artinya nyamuk
terinfeksi oleh karena mendapatkan makanan berupa darah dari burung, demikian
pula dapat terjadi pada burung terinfeksi, oleh karena gigitan nyamuk yang
terinfeksi maka penyebaran virus dapat terjadi pada masing-masing species
sehingga diperoleh model penyebaran pada nyamuk dan model penyebaran pada
2. Transmisi virus pada manusia terjadi jika transmisi dilakukan oleh nyamuk melalui
gigitannya dan transmisi pada manusia tidak simetris, belum terjadi transmisi virus
pada species yang sama.
) ( )
(t M t M
NM = u + i menunjukkan total populasi dari nyamuk perempuan dalam
komunitas, NB = Bu(t)+Bi(t) adalah total populasi dari burung dalam komunitas dan
) ( ) ( ) ( ) ( )
(t E t I t H t Rt S
NH = + + + + adalah total populasi manusia.
Populasi dari nyamuk perempuan susceptible meningkat melalui burung atau migrasi dari
nyamuk susceptible pada tingkat konstan ΠM,populasi tersebut akan berkurang oleh karena terinfeksi dan meninggal dengan rate
µ
B,submodel dari nyamuk dapat dinyatakan dalam bentuk sistem persamaan differensial sebagai berikut:
(
)
M uB
i u H B M M
u
M N
B M N
N N b dt
dM
µ
β
− −
Π
= 1 , , 1
(
)
M iB
i u H B M
i M
N
B M N
N N b dt
dM β µ
−
= 1 , , 1 2.15
dengan b1
(
NM,NB,NH)
adalah tingkat gigitan nyamuk per kapita pada host ( burung ) utama. β1 adalah probabilitas dari transmisi West Nile dari burung terinfeksi ke nyamuktak terinfeksi, oleh karena nyamuk menggigit burung dan manusia dan jika jumlah rata-rata
dari gigitan nyamuk yang diterima oleh burung dan manusia bergantung dari total populasi
dari nyamuk, burung dan manusia pada komunitasnya maka dapat didefinisikan bahwa
tingkat gigitan merupakan fungsi dari total populasi b1=b1
(
NM,NB,NH)
(Boman et al.,2005).2.1.3 Bilangan reproduksi dasar
Analisa terhadap penyebaran virus dapat dilakukan melalui 3 kuantiti threshold
σ
,
0
R dan R yang ketiganya saling terkait walaupun masing-masing muncul pada keadaan
yang berbeda. 3 kuantiti threshold adalah
1. bilangan reproduksi dasar yang didefinisikan sebagai rata-rata banyaknya terinfeksi
perlu dicatat bahwa R0 juga disebut sebagai ratio reproduksi dasar atau tingkat
reproduksi dasar, secara implisit dapat diasumsikan bahwa individual yang
terinfeksi berada diluar populasi susceptible dan berada pada populasi terinfeksi
selama periode infeksi.
2. Bilangan kontak σ didefinisikan sebagai rata-rata banyaknya kontak yang cukup dari individual terinfeksi selama periode infeksi, pengertian kontak yang cukup
adalah individual yang cukup untuk melakukan transmisi.
3. Bilangan replacement adalah rata-rata banyaknya individual terinfeksi kedua yang
disebabkan oleh typical infective selama periode infeksi, beberapa peneliti
menggunakan bilangan reproduksi dari pada bilangan replacement.
Perlu diketahui bahwa 3 kuantiti R0,σ dan R semuanya sama pada saat penyakit infeksi mulai menyebar pada populasi susceptible.
Pada literatur pemodelan epidemiologi, bilangan reproduksi dasar R0 sering
digunakan untuk kuantiti threshold yang ditentukan pada saat penyakit menyerang
populasi, dengan demikian R0 hanya didefinisikan pada waktu invasi sedangkan R,σ
didefinisikan pada semua waktu. Pada beberapa model matematika yang berkaitan dengan
penyebaran infeksi bilangan kontak σ konstan sehingga kedua kuantiti threshold selalu sama dengan bilangan reproduksi dasar R0 dan σ dapat digunakan secara bergantian. Pada teorema invasi dapat ditentukan untuk kedua kuantiti tersebut akan tetapi untuk model
matematika tertentu bilangan kontak σ lebih kecil dari bilangan reproduksi dasar R0 sesudah terjadinya invasi(Hectcote,H.W. 2000).
Bilangan reproduksi dasar untuk network dengan n kota dapat diperoleh dengan
menyelesaikan nilai eigen dari matriks Yacobian berukuran 4n x 4n. Seperti halnya pada
perubahan parameter, nilai eigen harus dihitung kembali pada setiap kasus. Estimasi
terhadap kondisi threshold(T0)dilakukan secara analitik yaitu ketika terjadi penyebaran
infeksiR0 >1 atau setelah terjadi penyebaran infeksi R0 <1 dan estimasi tersebut
Bilangan reproduksi dasar untuk multicity dapat diperoleh dengan menghitung bilangan
reproduksi dasar untuk setiap kota dengan asumsi bahwa penyebaran virus diisolasi pada
setiap kota dan selanjutnya dapat digunakan sebagai petunjuk untuk melakukan estimasi
terhadap bilangan reproduksi untuk kota yang lain. Batas atas R0 kota ke-k untuk waktu
maksimum bergantung dari infeksifitas β = βmaks yang dinyatakan dalam bentuk
0 ( )
α φ
β
+ =
k k r maks R
dengan
α φk +
1
sebagai waktu rata-rata individual terinfeksi pada kota ke-k dan φk
didefinisikan sebagai jumlahan dari rate mortalitas dan migrasi keluar dari kota –k dengan
bentuk
∑
= += k
i ki
k D
1
µ
φ . 2.16
Definisi untuk batas atas dari kondisi threshold pada sistem penyebaran beberapa kota
ditentukan melalui definisi bilangan reproduksi untuk setiap kota karena jika penyebaran
epidemik terjadi pada satu kota maka akan terjadi persisten untuk seluruh populasi,
formulasi untuk kondisi threshold tersebut adalah :
T0 =maks(R0k) untuk k=1.2.3…n 2.17
Bentuk formulasi tersebut sebagai ukuran untuk nilai threshold saja dan bukan bilangan
reproduksi dasar, sedangkan T0 akan menunjukkan indikasi yang akurat jika epidemik pada
persisten populasi pada beberapa kota atau penyebaran virus berhenti. Berdasarkan pada
data dari CDC tentang baseline parameter diperoleh T0 =1.02 dan terjadi di Pittsburgh.
Jika terjadi R0 ≈T0 ≈1maka model akan sensitive terhadap perubahan kecil dari βr dan
jika ε >0,02 maka bilangan reproduksi yang efektif akan berada dibawah 1 pada musim
summer, indikasi tersebut menunjukkan bahwa influenza tidak persisten selama kondisi
summer, oleh karena T0 dan R0 bergantung secara linear pada jumlah kontak perhari maka
dilakukan strategi efektif untuk memperlambat outbreak awal dari epidemik yaitu dengan
1
0 ≈
Model spasial dari proses transmisi lokal dimulai dari fungsi U(r)sebagai
probabilitas dari transmisi penyakit dengan jarak r = r diantara individual, U(r)
biasanya dinyatakan sebagai kernel dan bentuk normal untuk setiap individual dalam
populasi sebesar Nadalah:
∫
U(r)dr =1 Q2.18
dengan Q sebagai luasan yang menyatakan terjadinya transmisi.dan U(r)adalah rata –rata
dari semua individual yang berada pada luasan tersebut, Hazard infeksi didefinisikan
sebagai individual terinfeksi ipada lokasi yi bergerak menuju ke host susceptible jpada
lokasi xjsehingga diperoleh βU(xj −yi)dengan β sebagai rate kontak yaitu kontak
antara individual terinfeksi dan susceptible, dapat pula didefinisikan bahwa fungsi hazard
adalah individual yang sembuh dari infeksi sebesarγ.
Beberapa contoh tentang bilangan reproduksi dasar dari pergerakan individual populasi
antara lain:
∫
Ω +
−
= dr
r U
R )
) ( ) ( 1
1 1
(
0
γ
β , untuk model spasial 2.19
) ) 1 (
1 1 (
0
γ τ
+ − =n
R , untuk model network (Ruan,S.2006).
Pada umumnya untuk menghitung bilangan reproduksi dasar pada populasi heterogen yang
dinyatakan dengan R0dapat dilakukan dengan menentukan nilai eigen dari operator liniear
generasi mendatang, jadi dengan menggunakan iterasi pada operator tersebut dapat
diperoleh banyaknya individual terinfeksi pada generasi yang susceptible, model tersebut
juga telah dikembangkan pada derajat 2 dalam γ β
yaitu
0 (1 ) n R
γ β γ β
−
Untuk n→∞ diperoleh
γ β =
0
R artinya bahwa model network spasial konvergen ke mass
action (Parham and Paul,2006).
Bilangan reproduksi dasar dapat pula sebagai ukuran dari penyebaran suatu virus, suatu
sistem yang spasial maka heterogenitas populasi yang bergerak dapat dilihat pada koefisien
diffusinya sehingga untuk koefisien diffusi yang lebih besar nol dapat mengurangi
terjadinya penyebaran virus yang labih luas.
Bilangan reproduksi dasar dapat diformulasi sebagai rate transmisi virus dibagai dengan
koefisien diffusi ditambah dengan rate recovery dan akan maksimum jika rate recovery
mendekati nol.
Misalkan domain terbatas Ω∈Rm(m≥1)dengan ∂Ω smooth jika m>1 maka model
reaksi diffusi SIS berbentuk
I, I S
SI S d t S
S γ
β + + − Δ = ∂ ∂
,
Ω ∈
x t>0 2.21
I, I S
SI I
d t I
I γ
β − + + Δ = ∂ ∂
,
Ω ∈
x t >0
bilangan reproduksi dari model 2.21 ditunjukkan pada Lemma berikut ini
Lemma 2.1
Didefinisikan bilangan reproduksi dasar dari model 2.21 adalah
⎪ ⎭ ⎪ ⎬ ⎫
⎪ ⎩ ⎪ ⎨ ⎧
+ ∇ Ω
∈ =
∫
∫
Ω Ω
2 2
2
1 0
)
( ϕ γϕ
βϕ
ϕ H dI
Sup
R maka 2.22
(a). R0 adalah fungsi positif dan monoton turun bila dI >0
(b) R0→ : } )
( ) (
{ x∈Ω x
x Max
γ β
untuk dI →0
(c) R0→
∫
∫
Ω Ω
γ β
(d) R0 >1 jika λ∗ <0,R0 =1 jika λ∗ =0 dan R0 <1 jika λ∗ >0(Allen et al.,2010).
2.1.4 Traveling wave dari virus
Model yang dibangun berikut ini, merupakan pengembangan dari model Kendal
dengan membagi populasi menjadi subpopulasi yang homogen, individual bergerak
dinamis yang bergantung pada ruang dan waktu dengan subpopulasi terinfeksi yang spasial,
misalkan S(x,t),I(x,t)dan R(x,t) menyatakan density lokal dari individual susceptible,
terinfeksi dan removed.pada waktu t dalam lokasi x∈R dengan rate infeksi
∫
∞
−∞
−y dy x
K t x
I( , ) ( )
β ,
oleh karena individual pada subpopulasi bergerak dinamis maka akan terdapat perubahan
status terhadap penyakit. Individual yang bergerak pada setiap titik pada subpopulasi
bergantung pada kecepatan traveling wave, persamaan traveling wave dapat dibangun
dengan transformasi (S(x−ct,t),I(x−ct,t),R(x−ct,t))terhadap model sistem sehingga
dengan menyelesaikan persamaan traveling wave dapat diperoleh kecepatan traveling
wave(Ruan,S,2006).
Perhatikan model oleh Li and Zou.(2009) yang dibangun berdasarkan pada struktur usia dan diffusi berbentuk:
t
x t S
∂ ∂ ( , )
=
2 2
) , ( x
x t S S D
∂ ∂ +
µ - dS(t,x)- rI(t,x)S(t,x) 2.23
= ∂ ∂
t x t I( , )
2 2
) , , (
x x a t I DI
∂ ∂
-βI(t,x)+ rI(t ,y)S(t ,y).f (x−y)dy ∞
∞
− −
∫
−α τ τ
ε
dengan α
πα
α 4
4 1 ) (
2
x
e x
f = , β =σ +γ +d , t >0,x∈R 2.24
Penyelesaian traveling wave front dari persamaan tersebut diatas adalah penyelesaian
khusus dari bentuk S(t,x)=φ(x+ct) dan I(t,x)=ψ(x+ct)dengan c>0 sebagai
kecepatan gelombang, jika persamaan 2.23 dan 2.24 mempunyai 2 kondisi tunak konstan
) , ( − −
=
− S I
persamaan
φ
(−∞)=S−,ψ
(−∞)=I−, φ(+∞)=S+dan ψ(+∞)=I+ maka penyelesaian traveling wave disebut sebagai traveling wave front. Secara biologi, traveling wave frontmerupakan kondisi terjadinya perubahan dari kesetimbangan U− menuju kesetimbangan
+
U berdasarkan pada nilai dari kondisi tunak U− dan U+. Sedangkan kecepatan
gelombang dapat menjelaskan kecepatan penyebaran spasial dari penyakit dan kemudian
dapat mengukur bagaimana kecepatan penyakit tersebut menyerang secara geografik.
Dengan demikian traveling wave front sangat penting untuk model penyakit dengan
heterogenitas yang spasial.
Model spasial dari penyebaran virus WN merupakan pengembangan secara spasial
terhadap model dinamika non spasial yang menghasilkan model kompleks, reduksi model
dilakukan agar supaya lebih mudah untuk melakukan analisa terhadap penyebaran virus
dengan memberikan beberapa asumsi sehingga diperoleh model berbentuk:
Untuk mendapatkan penyelesaian traveling wave, perhatikan definisi berikut ini:
Definisi 2.1
Penyelesaian traveling wave dengan kecepatan c untuk model sistem 2.25 adalah
penyelesaian yang mempunyai bentuk
(
IV(x−ct),IR(x−ct))
dan berhubungan dengan titikkesetimbangan penyakit endemik dan bebas penyakit dari sistem sehingga