POTENSI ANTIBAKTERI FRAKSI KLOROFORM- ETANOL-ASAM ASETAT DARI EKSTRAK ETANOL-ASAM ASETAT KULIT BATANG
KEMIRI [Aleurites moluccana (L.) Willd] TERHADAP Staphylococcus aureus
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh:
P. Silih Widhiandhisti NIM : 038114069
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2007
Ketika satu pintu tertutup, ada pintu lain
yang terbuka. Namun, kita sering kali
hanya menyesali yang tertutup, sehingga
tak menyadari yang terbuka buat kita!
(Alexander Graham Bell)
Karya ini kupersembahkan untuk:
Tuhan Yesus & Bunda Maria
Bapak dan Ibuku yang
terkasih
Adikku dan keluarga besar
Juga orang-orang yang tersisih dan
terlupakan
INTISARI
Di Jawa, kulit batang kemiri ( Aleurites moluccana L. Willd ) digunakan untuk mengobati diare dan disentri. Penelitian ini termasuk penelitian eksperimental murni. Tujuannya untuk mengetahui fraksi aktif dalam ekstrak etanol kulit batang kemiri yang berpotensi sebagai antibakteri terhadap
Staphylococcus aureus dan identitas fraksi aktif tersebut.
Ekstraksi kulit batang kemiri dilakukan menggunakan pelarut etanol dengan metode remaserasi. Fraksinasi kulit batang kemiri menggunakan kromatografi kolom dengan pelarut kloroform-etanol-asam asetat. Uji potensi antibakteri dilakukan dengan menggunakan metode difusi sumuran untuk pemilihan fraksi aktif. Fraksi aktif ekstrak serbuk kulit batang kemiri diuji dengan bioautografi kontak untuk mengetahui potensinya terhadap S. aureus. Metode Kromatografi Lapis Tipis (KLT) dilakukan untuk mengetahui identitas senyawa yang berpotensi sebagai antibakteri.
Hasil penelitian menunjukkan bahwa fraksi kloroform-etanol-asam asetat (90:5:5) merupakan fraksi aktif. Pada uji KLT diperoleh dugaan bahwa senyawa yang terkandung dalam fraksi aktifnya adalah alkaloid golongan indol. Pada pengujian dengan bioautografi kontak tidak menunjukkan adanya potensi antibakteri dari alkaloid.
Kata kunci : Aleurites moluccana L. Willd, Staphylococcus aureus, ekstrak etanol, fraksi kloroform-etanol-asam asetat, kromatografi kolom, bioautografi kontak, KLT, alkaloid.
ABSTRACT
In Java, Candelnut (Alleurites moluccana L. Willd) bark is used to cure diarrhea and dysentery. This experiment was pure experimental research. The purpose of this research is know antibacterial potency of chloroform-ethanol-acetic acid fraction from ethanol extract of candelnut bark againts Staphylococcus aureus and identity of the active fraction.
Extraction of candelnut bark was done by remaseration method using ethanol. Fractionation of candelnut bark by Coloum Chromatography using a moving phase chloroform-ethanol-acetic acid. An antibacterial potency test was done by diffusion method to get active fraction. The active fraction of candelnut bark powder extract tested by contact bioautography method to know antibacterial potency againts S. aureus. Thin Layer Chromatography (TLC) method was done to know identity of substance that has antibacterial potency.
The result shows that chloroform–ethanol–acetic acid (90:5:5) fractions is an active fraction. In TLC test, it is estimated that the active compound is indole alkaloida. Potential testing by using contact bioautography method does not show any antibacterial potency of alkaloid.
Keywords : candelnut bark (Aleurites moluccana L. Willd), Staphylococcus aureus, ethanol extract, chloroform–ethanol–acetic acid fraction, Coloum Chromatography, contact bioautography, Thin Layer Chromatography, alkaloid.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa, atas berkat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul POTENSI ANTIBAKTERI FRAKSI KLOROFORM- ETANOL-ASAM ASETAT DARI EKSTRAK ETANOL-ETANOL-ASAM ASETAT KULIT BATANG KEMIRI [Aleurites moluccana (L.) Willd] TERHADAP Staphylococcus aureus. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S. Farm) Program Studi Ilmu Farmasi Universitas Sanata Dharma.
Skripsi ini dapat berjalan dan diselesaikan dengan baik berkat bantuan, dukungan dan kerjasama dari berbagai pihak. Oleh karena itu, penulis ingin menyampaikan terima kasih yang sebesar-besarnya kepada :
1. Ibu Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Bapak Ign. Y. Kristio Budiasmoro, M.Si selaku dosen pembimbing yang telah meluangkan waktu untuk memberi bimbingan dan motivasi, terima kasih pak…
3. Bapak Yohanes Dwiatmaka, M.Si. selaku dosen penguji yang telah meluangkan waktu untuk menguji dan memberikan masukan, kritik dan saran kepada penulis.
4. Ibu Yustina Sri Hartini, M.Si., Apt selaku dosen penguji yang telah meluangkan waktu untuk menguji dan memberikan masukan, kritik dan saran kepada penulis.
5. Bapak dan Ibu dosen Fakultas Farmasi yang telah membimbing saya selama saya belejar di Universitas Sanata Dharma.
6. Segenap karyawan Universitas Sanata Dharma Yogyakarta khususnya karyawan Fakultas Farmasi yang telah membantu saya.
7. Bapak dan Ibuku terkasih, terima kasih atas segala doa dan dukungan, kesabaran, semangat dan kasih sayang yang tiada habisnya sehingga skripsi ini dapat diselesaikan dengan baik.
8. Adikku Mayang, terima kasih atas segala doa, dorongan, semangat dan dukungan yang selama ini telah diberikan.
9. Keluarga besarku, terutama almarhum simbah putri, terima kasih atas restumu di alam sana.
10.Teman dekat dan curhatku Nia, terimakasih atas pertemanan yang indah ini, aku berharap bisa abadi Ni….
11.Maria Goretti, terima kasih sudah jadi temanku.
12.Teman-temanku Essy, Fani, Hani, Endah, Dessy, Tata, yang senantiasa memberiku semangat, dan Wewen
13.Teman seperjuangan di lab mikro Vian, Rosa, Tina, Nella, Devi, Oca, Titin dll, akhirnya kita lulus.
1. Keterangan Botani ... 6
E. Metode Pengukuran Potensi Antibakteri ... 12
B. Variabel Penelitian dan Definisi Operasional ... 22
4. Identifikasi Kandungan Senyawa Aktif Kulit Batang Kemiri (Aleurites moluccana L. Willd) dengan Uji Tabung ... 26
5. Ekstraksi Kulit Batang Kemiri ... 27 6. Preparasi Sampel, Fase diam, dan Fase gerak
Kromatografi Kolom ... 7. Fraksinasi Ekstrak Etanol-Asam Asetat dengan
Kromatografi Kolom... 8. Uji Potensi Antibakteri Tiap Fraksi dan Pemilihan
Fraksi Aktif... 9. Uji Kualitatif Fraksi Aktif dengan Metode KLT
10.Uji Potensi Senyawa Aktif Dari Fraksi Aktif Terhadap
Staphylococcus aureus dengan Metode Bioautografi
Kontak ... 31
D. Identifikasi Kandungan Senyawa Aktif Kulit Batang Kemiri (Aleurites moluccana L. Willd) dengan Uji Tabung ... 38
E. Ekstraksi Kulit Batang Kemiri ... 39
F. Preparasi Sampel, Fase diam, dan Fase gerak Kromatografi Kolom ... 42
G. Fraksinasi Ekstrak Etanol-Asam Asetat dengan Kromatografi Kolom ... 43
H. Uji Potensi Antibakteri Tiap Fraksi dan Pemilihan Fraksi Aktif... 45
I. Uji Kualitatif Fraksi Aktif dengan Metode KLT ... 48
J. Uji potensi antibakteri senyawa aktif dari fraksi aktif (fraksi V) terhadap Staphylococcus aureus dengan metode Bioautografi Kontak... 55
BAB V. KESIMPULAN DAN SARAN ... 57
A. Kesimpulan ... 57
B. Saran ... 57
DAFTAR PUSTAKA ... 58
LAMPIRAN ... 61
BIOGRAFI PENULIS... 70
DAFTAR TABEL
Halaman 39 Tabel I. Hasil uji tabung serbuk kulit batang kemiri ...
Tabel II. Rerata diameter zona hambat fraksi kloroform-etanol-asam asetat dari ekstrak etanol-asam asetat kulit batang kemiri
terhadap Staphylococcus aureus... 47 Tabel III. Hasil identifikasi senyawa alkaloid kuaterner fraksi
kloroform:etanol:asam asetat (90:5:5) dari ekstrak etanol-asam asetat dengan fase gerak kloroform : etanol : etanol-asam
asetat (60:20:20)... 49 Tabel IV. Hasil identifikasi senyawa alkaloid tersier fraksi
kloroform:etanol:asam asetat (90:5:5) dari ekstrak etanol-asam asetat dengan fase gerak kloroform:etanol:etanol-asam
asetat (60:20:20)... 51 Tabel V. Hasil Uji potensi antibakteri fraksi aktif (fraksi V) terhadap
Staphylococcus aureus dengan metode Bioautografi
Kontak... 56
DAFTAR GAMBAR
Halaman Gambar 1. Skema penelitian potensi antibakteri fraksi
kloroform-etanol-asam asetat dari ekatrak kloroform-etanol-asam asetat kulit batang kemiri terhadap Staphylococcus aureus
... 34
Gambar 2. Kromatogram alkaloid kuaterner fraksi aktif [kloroform : etanol : asam asetat (90 : 5 : 5)] dari ekstrak etanol-asam asetat kulit batang kemiri (Aleurites moluccana L.
Willd)... 50 Gambar 3. Kromatogram alkaloid tersier fraksi aktif [kloroform :
etanol : asam asetat (90 : 5 : 5)] dari ekstrak etanol-asam asetat kulit batang kemiri (Aleurites moluccana L.
Willd)... 52 Gambar 4. Reaksi piridin dengan pereaksi CAS ... 53 Gambar 5. Reaksi pembentukan senyawa kompleks oleh alkaloid indol
dengan pereaksi CAS...
54 54 Gambar 6. Struktur gugus amin pada alkaloid tersier dan kuartener .
DAFTAR LAMPIRAN
Halaman Lampiran 1. Surat Pengesahan Determinasi ………. 61 Lampiran 2. Foto Tanaman Kemiri [Aleurites moluccana (L.) Willd].... 62 Lampiran 3. Foto Hasil Uji Potensi Antibakteri Fraksi Hasil
Pemisahan Kromatografi Kolom Terhadap
Staphylococcus aureus Secara Difusi Sumuran
... 63 Lampiran 4. Foto Hasil Uji Potensi Antibakteri Piridin sebagai Kontrol
Positif Terhadap Staphylococcus aureus Secara Difusi
Sumuran ... 64 Lampiran 5. Foto Hasil Kromatografi Lapis Tipis (KLT) Piridin
dengan Fase Gerak Kloroform : Etanol : Asam Asetat
(60:20:20) ... 65 Lampiran 6. Foto Hasil Kromatografi Lapis Tipis (KLT) Alkaloid
Tersier dengan Fase Gerak Kloroform : Etanol : Asam
Asetat (60:20:20) ... 66 Lampiran 7. Foto Hasil Kromatografi Lapis Tipis (KLT) Alkaloid
Kuartener dengan Fase Gerak Kloroform : Etanol : Asam
(60:20:20) ... 67 Lampiran 8. Hasil Uji Potensi Antibakteri Alkaloid Tersier Fraksi V
[Kloroform : Etanol : Asam Asetat (60:20:20)] Kulit Batang Kemiri dengan Metode Bioautografi Kontak
Terhadap Staphylococcus . aureus ... 68 Lampiran 9. Hasil Uji Potensi Antibakteri Alkaloid Kuartener fraksi V
[Kloroform : Etanol : Asam Asetat (60:20:20)] Kulit Batang Kemiri Dengan Metode Bioautografi Kontak
Terhadap Staphylococcus aureus ... 69
BAB I PENGANTAR A. Latar Belakang
Staphylococcus aureus bersifat patogen dan invasif menghasilkan enzim koagulase dan pigmen kuning yang bersifat hemolitik. Bakteri ini merupakan patogen utama bagi manusia. Hampir setiap orang mengalami infeksi oleh
S.aureus di sepanjang hidupnya, bervariasi beratnya (Jawetz et al., 1996). Saat ini,
S.aureus merupakan bakteri yang telah resisten terhadap antibiotik golongan penisilin (MRSA) karena infeksi nosokomial yang terjadi di rumah sakit (Anonim, 2006).
Kemiri (Aleurites moluccana L. Willd) merupakan tanaman yang dapat tumbuh di Indonesia. Tanaman ini tergolong dalam familia Euphorbiaceae. Di Jawa, kulit batang kemiri digunakan untuk mengobati diare dan disentri (Anonim, 1995).
Senyawa alam digunakan sebagai obat atau untuk memproduksi dan menemukan obat baru (Samuelsson, 1999). Berbagai macam khasiat dari kemiri dikarenakan kandungan senyawa-senyawa aktif yang dimilikinya antara lain polifenol, tanin, alkaloid (Arief, 1996). Kandungan senyawa aktif tersebut, ada yang bersifat polar dan non polar (Anonim, 1986).
Pada penelitian ini dilakukan pengujian potensi antibakteri fraksi kloroform-etanol-asam asetat dari ekstrak kloroform-etanol-asam asetat kulit batang kemiri terhadap
S.aureus menggunakan metode bioautografi kontak. Penelitian ini merupakan
lanjutan dari penelitian terdahulu (Melinda, 2005) tentang potensi antibakteri fraksi etil asetat dan fraksi etanol kulit batang kemiri terhadap Staphylococcus aureus dan diketahui bahwa fraksi etanol kulit batang kemiri memiliki potensi antibakteri terhadap S.aureus.
Kulit batang kemiri mengandung senyawa tanin (Duke, 1999). Walaupun demikian, menurut penelitian terdahulu (Melinda, 2005) diduga fraksi aktif dari fraksi etanol dan fraksi etil asetat kulit batang kemiri yang berpotensi sebagai antibakteri adalah alkaloid golongan piridin-piperidin dengan KHM fraksi etil asetat 10 mg/ml. Alkaloid merupakan senyawa yang bersifat non polar, larut dalam etanol (Anonim, 1986a), oleh sebab itu, digunakan pelarut etanol.
Biasanya alkaloid diperoleh dengan cara maserasi (Robinson, 1995). Kromatografi kolom digunakan untuk fraksinasi ekstrak etanol-asam asetat yang didapat. Ada 3 macam fase gerak yang digunakan yakni kloroform-etanol (95:5) (Cordell, 1981), kloroform-etanol-asam asetat (90:8:2) dan kloroform-etanol-asam asetat (90:5:5) yang didapat dari orientasi. Digunakan 3 macam fase gerak dengan perbandingan yang berbeda-beda bertujuan agar jumlah senyawa yang terkandung dalam tiap fraksi menjadi lebih sedikit sehingga dapat diketahui fase gerak yang lebih optimal untuk menyari senyawa antibakteri terhadap S.aureus.
ekstrak etanol kulit batang kemiri yang berpotensi sebagai antibakteri terhadap
S.aureus adalah alkaloid golongan piridin-piperidin.
Berdasarkan keterangan di atas, maka dapatlah dilakukan penelitian untuk mengetahui beberapa fraksi aktif dalam fraksi kloroform-etanol-asam asetat hasil kromatografi kolom dari ekstrak etanol-asam asetat kulit batang kemiri yang berperan sebagai antibakteri terhadap S.aureus.
1. Permasalahan
a. Apakah fraksi kloroform : etanol (95:5), fraksi kloroform : etanol : asam asetat (90:8:2), dan fraksi kloroform : etanol : asam asetat (90:5:5) dari ekstrak etanol-asam asetat kulit batang kemiri mempunyai potensi antibakteri terhadap S.aureus?
b. Fraksi mana yang terdapat dalam ekstrak etanol-asam asetat serbuk kulit batang kemiri yang aktif terhadap S.aureus?
c. Identitas senyawa apakah yang terdapat dalam fraksi aktif antibakteri
S.aureus secara KLT?
d. Apakah dengan metode bioautografi kontak alkaloid yang terdapat dalam fraksi aktif mempunyai potensi antibakteri terhadap S.aureus?
2. Keaslian Penelitian
pernah dilakukan di Universitas Sanata Dharma.
3. Manfaat Penelitian a. Manfaat Praktis :
Memberikan informasi kepada masyarakat tentang fraksi manfaat kulit batang kemiri yang berkhasiat untuk alternatif pengobatan tradisional sebagai antibakteri terhadap S.aureus.
b. Manfaat Teoritis :
Menambah informasi untuk mengembangkan ilmu pengetahuan khususnya di bidang kesehatan tentang senyawa aktif dalam kulit batang kemiri yang berpotensi sebagai antibakteri terhadap S.aureus yang diharapkan dapat dijadikan acuan untuk penelitian selanjutnya.
B. Tujuan Penelitian Tujuan penelitian ini adalah :
a. Mengetahui apakah fraksi kloroform : etanol (95:5), fraksi kloroform : etanol : asam asetat (90:8:2), dan fraksi kloroform : etanol : asam asetat (90:5:5) dari ekstrak etanol-asam asetat kulit batang kemiri mempunyai potensi antibakteri terhadap S.aureus.
b. Mengetahui fraksi mana yang terdapat dalam ekstrak etanol-asam asetat kulit batang kemiri yang aktif terhadap S.aureus.
BAB II
PENELAAHAN PUSTAKA A. Deskripsi Tanaman 1. Keterangan Botani
Kemiri (Aleurites moluccana L. Willd) termasuk dalam suku
Euphorbiaceae dengan sinonim Aleurites triloba Forst. Di Sumatra, kemiri disebut kereh, kumili, hambiri, kembiri, gambiri, buwa, kare, buwah keras, buwah tondeh, buwa hare, dudulaa, sapiri; masyarakat Jawa biasa menyebut kemiri dengan nama kemiri, muncang, derekan, pidekan; di Nusatenggara disebut derekan, kamere, kawilu; di Sulawesi disebut bintalo, dan di Maluku disebut kamili, buah kareh, kemiling, saketa (Anonim, 1995).
2. Pertelaan Morfologi
Pohon dengan tinggi 25-30 m, batang tegak, berkayu, permukaan banyak lentisel, percabangan simpodial, pada batang sebelah atas terdapat tonjolan bekas melekatnya tangkai daun, coklat. Daun tunggal, berseling, lonjong, tepi rata, bergelombang, ujung runcing, pangkal tumpul, pertulangan menyirip, permukaan atas licin, bawah halus, panjang 18-25 cm, lebar 7-11 cm, tangkai silindris, panjang 10-15 cm, hijau. Bunga majemuk, bentuk malai, berkelamin dua, diujung cabang, tangkai silindris, panjang 2-3, 5 cm, hijau kecoklatan,
kelopak lonjong, permukaan bersisik rapat, hijau, benang sari jumlah 5-8 buah, tangkai sari bulat, merah, kepala sari bentuk kerucut, merah, putik
bulat, putih, mahkota putih. Buahnya kotak, bulat telur, beruas-ruas, panjang
± 7 cm, lebar ± 6,5 cm, masih muda hijau setelah tua coklat, berkeriput. Biji
bulat, berkulit keras, berusuk atau beralur, diameter ± 3,5 cm, berdaging, berminyak, putih kecoklatan. Akar tunggang, coklat (Hutapea dkk, 1993).
3. Kandungan kimia tanaman kemiri
Kulit batang kemiri mengandung senyawa tanin (Duke, 1999). Fraksi etanol dan fraksi etil asetat kulit batang kemiri mengandung alkaloid piridin– piperidin (Melinda, 2005). Kulit batang kemiri mengandung senyawa acetylalueritolic acid (Kardono dkk, 2003).
4. Khasiat
Di Jawa, kulit batang kemiri digunakan untuk mengobati diare dan disentri (Duke, 1999). Kulit batang kemiri dapat digunakan untuk obat berak darah, sariawan dan mencret (Anonim, 1986b).
B. Alkaloid
Biasanya alkaloid diperoleh dengan cara maserasi menggunakan air yang telah diasamkan sehingga akan melarutkan garam alkaloid, atau dengan membasakan bagian tumbuhan (misal dengan natrium karbonat), kemudian alkaloid bebas diekstraksi dengan pelarut organik seperti kloroform, eter, dll (Robinson, 1995).
Alkaloid berbentuk kristal padat tanwarna, namun ada pula yang berupa cairan (efedrin, koniin, dan spartein berupa cairan pada suhu kamar) dan alkaloid yang berwarna pun langka (berberina dan serpentine berwarna kuning) (Robinson, 1995). Alkaloid berasa pahit dan sukar larut dalam air tetapi larut dalam pelarut organik yang non polar yang tidak campur dengan air seperti kloroform, eter, dll. Garam alkaloid larut dalam air tetapi tidak larut dalam pelarut organik (Mursyidi, 1990).
C. Staphylococcus aureus
Staphylococcus aureus merupakan bakteri gram positif, anaerob fakultatif yang tidak membentuk spora, tidak bergerak, dinding selnya mengandung peptidoglikan dan asam teikoat. Selnya berbentuk bola dengan diameter kira-kira 1 μm tersusun berkelompok menyerupai buah anggur. S.aureus tumbuh paling cepat pada suhu 37oC. S.aureus relatif tahan terhadap panas (50oC selama 30 menit) dan tahan terhadap 9% natrium klorida, tetapi dapat dihambat oleh zat kimia tertentu seperti 3% heksaklorofen (Jawetz et al., 1996).
dalam folikel rambut menimbulkan nekrosis jaringan (faktor dermonekrotik) (Jawetz et al., 1996).
D. Penyarian 1. Cara Penyarian
Secara umum, cara penyarian dibedakan menjadi dua, yakni dengan pemanasan dan dengan cara dingin. Penyarian dengan pemanasan terdiri dari infundasi dan penyarian berkesinambungan. Sedangkan penyarian dengan cara dingin meliputi perkolasi dan maserasi.
Infundasi digunakan untuk menyari bahan nabati seperti glikosida, dll. Infundasi dilakukan dengan cara mencampur serbuk simplisia dengan air dalam panci, kemudian dipanaskan pada suhu 90oC selama 5 menit. Sediaan cair yang didapat disebut infus. Penyarian dengan cara seperti ini akan didapat infus yang tidak stabil dan mudah ditumbuhi kapang. Karena itu, penyimpanannya tidak boleh lebih dari 24 jam (Anonim, 1986a).
Perkolasi merupakan suatu cara penyarian dengan cara mengalirkan cairan penyari melalui serbuk simplisia. Serbuk simplisia ditempatkan pada suatu bejana silinder dengan pada bagian bawah bejana terdapat suatu sekat yang berpori. Cairan penyari dialirkan melalui serbuk simplisia dan akan melarutkan zat aktif sampai keadaan jenuh. Cairan penyari dapat mengalir karena adanya gaya berat dan cairan diatasnya dikurangi gaya kapiler yang cenderung menahannya. Alat yang digunakan disebut perkolator. Serbuk simplisia yang akan diperkolasi tidak langsung dimasukkan dalam perkolator, tetapi dimaserasi terlebih dahulu pada tempat tertutup. Ini penting untuk bahan yang mudah mengembang bila terkena air (Anonim, 1986a).
Etanol dipertimbangkan sebagai penyari karena: lebih selektif, kapang dan kuman sulit tumbuh dalam etanol 20% keatas, tidak beracun, netral, absorbsinya baik, etanol dapat bercampur dengan air pada segala perbandingan, panas yang diperlukan untuk pemekatan lebih sedikit. Kekurangannya, etanol mahal harganya. Etanol dapat melarutkan alkaloid basa (Anonim,1986a).
2. Maserasi
kesetimbangan konsentrasi di dalam dan di luar sel. Cara penyarian ini digunakan untuk zat aktif yang mudah larut dalam cairan penyari, tidak mudah mengembang.
Keuntungan cara penyarian ini adalah pengerjaan dan peralatan yang sederhana dan mudah untuk dilakukan. Sedangkan kerugiannya adalah pengerjaan yang lama serta penyarian yang kurang sempurna. Pada maserasi, diperlukan pengadukan untuk meratakan konsentrasi larutan di luar butir simplisia sehingga derajat perbedaan konsentrasi di dalam dan di luar sel tetap terjaga.
Maserasi dapat dimodifikasi menjadi :
a. Digesti dengan menggunakan pemanasan lemah 40-50oC untuk simplisia yang tahan terhadap pemanasan.
b. Maserasi dengan mesin pengaduk, dilakukan untuk mempersingkat waktu ekstraksi yakni 6-24 jam dengan adanya mesin pengaduk yang berputar terus menerus.
c. Remaserasi, dengan membagi cairan penyari menjadi 2 bagian. Serbuk simplisia dimaserasi dengan cairan penyari pertama, dan setelah dienaptuangkan dan diperas, ampas dimaserasi dengan cairan penyari kedua.
e. Maserasi melingkar bertingkat dilakukan karena maserasi melingkar tidak dapat dilakukan secara sempurna karena pemindahan massa berhenti bila keseimbangan telah terjadi (Anonim, 1986a).
E. Metode Pengukuran Potensi Antibakteri Metode pengukuran antibakteri dapat dibedakan menjadi 2 yaitu: 1. Metode dilusi
Ada dua macam cara yaitu dilusi cair dan dilusi padat. Pada prinsipnya antibiotik diencerkan sehingga diperoleh beberapa macam kadar. Pada dilusi cair, tiap-tiap kadar sampel obat ditambahkan pada suspensi kuman dalam media. Pada dilusi padat setiap kadar obat dicampur dengan media agar kemudian ditanami kuman. Pengamatannya adalah ada tidaknya pertumbuhan kuman atau bila mungkin tingkat kesuburan kuman. Metode dilusi ini dapat digunakan untuk menentukan KHM dan KBM (Anonim, 1993).
2. Metode difusi
Merupakan salah satu metode yang digunakan untuk mengukur potensi antibakteri berdasarkan pengamatan luas zona jernih yang terbentuk di sekitar tempat penginokulasian obat karena berdifusinya obat (Jawetz et al., 1996).
Dilakukan dengan cara menempatkan obat pada media padat yang telah ditanami dengan biakan bakteri. Metode difusi ada beberapa cara :
a. Cara Kirby Bauer
kertas samir yang mengandung antibakteri diatasnya, diinkubasikan pada 37°C selama 18-24 jam. Hasilnya dibaca berupa zona radikal dan irradikal. Zona radikal adalah suatu daerah di sekitar kertas samir (disk) yang tidak ditemukan sama sekali pertumbuhan bakteri. Sedangkan zona irradikal adalah suatu daerah sekitar
disk yang pertumbuhan bakteri dihambat tetapi tidak dimatikan (Anonim, 1993). b. Cara sumuran
Penyiapan dilakukan seperti cara Kirby Bauer. Setelah biakan siap, dibuat sumuran dengan diameter tertentu dan tegak lurus terhadap permukaan media, ke dalam sumuran ini diteteskan larutan uji lalu diinkubasi selama 24-48 jam pada suhu 37°C. Hasilnya dibaca sama seperti cara Kirby Bauer (Anonim, 1993). c. Cara pour plate
Suspensi bakteri yang telah memenuhi standar konsentrasi bakteri (108 CFU/ml) diambil 1 ose dan dimasukkan ke dalam 4 ml media agar base 1,5% yang mempunyai suhu 50°C. Setelah suspensi kuman tersebut homogen, dituang pada media agar Mueller Hinton, ditunggu sebentar agar membeku, disk
diletakkan di atas media, diinkubasi selama 15-20 jam pada suhu 37°C, dibaca hasilnya sesuai cara Kirby Bauer (Anonim, 1993).
F. Fraksinasi
1. Pengendapan
Pengendapan terjadi ketika konsentrasi bahan dalam larutan melebihi kelarutan maksimumnya. Campuran dapat diendapkan dengan berbagai metode. Pengendapan dapat digunakan untuk memindahkan bahan penting atau memindahkan material yang tidak diinginkan dan mempertahankan bahan yang penting dalam larutan. Metode yang paling sederhana adalah dengan menurunkan temperatur larutan. Komponen yang kurang larut dapat diendapkan dan dipisahkan dengan sentrifugasi atau filtrasi. Cara lainnya yaitu dengan mengubah polaritas pelarut dengan menambahkan pelarut yang dapat bercampur dengan polaritas yang berbeda. Salting out juga merupakan salah satu cara fraksinasi dengan pengendapan yaitu dengan menambahkan ekstrak berair dengan larutan elektrolit yang sangat larut air sehingga bahan non-ionik akan terendapkan (Houghton, 1988).
2. Ekstraksi pelarut-pelarut
sebaiknya campuran digojog dengan lembut. Cara fraksinasi ini menggunakan corong pisah (Houghton, 1988).
3. Destilasi
Metode ini digunakan untuk memisahkan campuran komponen volatile. Cara ini dilakukan secara ekstensif dalam industri, namun penggunaannya terbatas untuk fraksinasi ekstrak tanaman dan hanya dapat dipakai untuk minyak volatile
(minyak esensial). Alat yang digunakan adalah destilator (Houghton, 1988). 4. Dialisis
Metode dialisis digunakan untuk pemisahan komponen dalam suatu campuran berdasarkan ukuran molekulnya. Bagian yang penting dari prosedur ini adalah membran semipermeabel yang tipis yang mengandung polimer dengan pori-pori tertentu yang memberikan jalan untuk molekul kecil (massa molekul < 1000 dalton). Molekul dengan ukuran yang lebih besar tidak mungkin dapat lewat. Tekanan osmotik yang mendekati molekul berukuran kecil dalam suatu campuran mampu melewati membran sedangkan molekul yang lebih besar tertinggal (Houghton, 1988).
5. Elektroforesis
6. Kromatografi
Kromatografi merupakan teknik yang digunakan pada fraksinasi ekstrak untuk isolasi banyak senyawa alam. Kromatografi terdiri dari dua fase yaitu fase diam dan fase gerak. Fase diam biasanya berupa padatan. Proses kromatografi terjadi akibat adanya kesetimbangan dinamik zat terlarut pada dua fase.
Kromatografi dibagi menjadi dua yaitu adsorpsi dan partisi. Adsorpsi merupakan distribusi senyawa diantara permukaan padat dan cairan. Partisi merupakan distribusi senyawa diantara dua cairan yang tidak saling campur.
Kromatografi kolom merupakan teknik yang paling tua. Kromatografi kolom merupakan bentuk kromatografi cair yang digunakan untuk memisahkan campuran dalam jumlah besar. Sebuah tabung diisi dengan fase diam padat, sampel diletakkan di bagian atas kolom (tabung kaca atau plastik) dan fase gerak dialirkan ke bawah melewati kolom. Biasanya fase diam dibuat dalam bentuk suspensi dan dimasukkan ke dalam kolom. Campuran senyawa (cuplikan) dialirkan di atas fase diam dan fase gerak dibiarkan mengalir karena adanya pengaruh gaya gravitasi atau karena adanya tekanan rendah, melewati cuplikan dan fase diam dan membawa serta senyawa yang larut didalamnya. Dengan demikian, senyawa dalam cuplikan dapat dipisahkan dan dikumpulkan sebagai fraksi (Gritter, 1991).
air atau pelarut berproton seperti alkohol atau amina, fase diam dikatakan tidak aktif, maka harus dilakukan pengaktifan dengan pemanasan untuk menghilangkan air. Fase diam yang paling sering digunakan adalah alumina dan silika gel, merupakan fase diam yang paling berguna dan mudah didapat. Pemilihan fase gerak merupakan hal yang penting karena harus dapat menentukan pelarut yang sesuai untuk dapat menghasilkan pemisahan yang diinginkan (Gritter, 1991).
G. Kromatografi Lapis Tipis (KLT)
KLT merupakan salah satu metode yang digunakan untuk memisahkan komponen-kompenen. Pada dasarnya, KLT menggunakan dua fase, yaitu fase diam (stationary) dan fase gerak (mobil). Fase diam berupa zat padat, sedangkan fase gerak berupa zat cair. Karena itu, KLT dikenal sebagai kromatografi serapan (absorption chromatography). Pada kromatografi, senyawa yang dipisahkan akan terdistribusi diantara fase gerak dan fase diam (Sastrohamidjojo, 1985).
KLT digunakan untuk tujuan kualitatif, kuantitatif, atau preparatif. Secara kualitatif, KLT digunakan untuk melihat ada atau tidaknya suatu senyawa di dalam cuplikan. Pada kromatogram KLT dikenal istilah faktor retardasi (Rf) yang didefinisikan :
(Mulja dan Suharman, 1995).
Pemilihan fase diam didasarkan pada polaritasnya. Fase diam yang banyak digunakan adalah silika gel. Silika gel G merupakan silika gel yang dicampur dengan CaSO4 lebih kurang 13%. CaSO4 berfungsi sebagai perekat gypsum pada pelat. Pemilihan fase gerak didasarkan pada polaritas sampel, untuk sampel non polar, dipilih fase gerak yang non polar dan sebaliknya (Mulja dan Suharman, 1995).
H. Bioautografi
Merupakan salah satu cara yang digunakan untuk mendeteksi aktivitas antibakteri suatu senyawa dengan kromatogram hasil pemisahan senyawa uji pada KLT. Caranya dengan menempelkan kromatogram hasil pemisahan pada KLT pada media agar dalam cawan petri yang telah diinokulasikan bakteri yang akan diuji. Setelah itu, dilakukan inkubasi selama 15-20 jam pada 37oC. Senyawa pada kromatogram akan berdifusi ke dalam media agar dan akan tampak zona jernih di sekitar kromatogram jika senyawa tersebut memiliki daya antibakteri sedangkan daerah yang jauh dari bercak akan tampak keruh (Zweig dan Whitaker, 1971). Bioautografi merupakan metode universal untuk mengetahui antibiotik yang belum diketahui komponennya (Stahl, 1969). Metode ini membutuhkan waktu 6-16 jam tergantung dari pertumbuhan mikroorganisme. Deteksi kimia dengan reaksi warna spesifik digunakan sebagai pembanding hasil bioautografi sehingga kedua metode diatas saling melengkapi (Stahl, 1969).
antimikrobia berdifusi dari plat yang diinokulasikan ke media agar. Kromatogram diinokulasikan pada media agar dan didiamkan beberapa menit atau jam untuk memberi kesempatan untuk berdifusi. Kromatogram diangkat dan media agar diinkubasikan. Zona hambat akan tampak pada permukaan media agar di sekitar bercak kromatogram. Kerugian metode ini adalah kesulitan dalam menyempurnakan kontak antara agar dan plat kromatogram dan kemampuan penyerapan pada permukaan media agar (Choma, 2005).
Pada metode bioautografi immersi dan bioautografi langsung dibutuhkan larutan tetrazolium yang digunakan untuk mendeteksi zona hambat. Daerah yang ditumbuhi oleh organisme akan berwarna merah sedangkan daerah hambatan akan berwarna jernih. Bioautografi langsung dilakukan dengan mencelupkan atau menyemprot suspensi bakteri yang dicampur dengan larutan tetrazolium. Kemudian plat diinkubasi. Cara ini yang paling rumit dan alat yang digunakan lebih mahal dibandingkan bioautografi kontak (Choma, 2005).
Pada bioautografi immersi kromatogram ditutup dengan agar yang masih cair. Setelah agar memadat kemudian diinkubasi. Kekurangan dari bioautografi
immersi yaitu adanya pengenceran antibakteri pada lapisan agar selama agar masih berbentuk cair sehingga zona hambat yang terjadi dapat menyebar (Choma, 2005).
hambat akan berwarna biru (Zweig dan Whitaker, 1971 ; Wagman dan Weinstein, 1973).
I. Landasan Teori
Kulit batang kemiri digunakan untuk mengobati diare dan disentri (Anonim, 1995). Salah satu senyawa kimia yang terkandung dalam kemiri adalah alkaloid (Arief,1996). Alkaloid dapat tersari dalam etanol dan memiliki aktivitas fisiologi sebagai antibakteri terhadap S.aureus (Melinda, 2005) dengan S.aureus
merupakan bakteri flora normal dalam hidung manusia (Jawetz et al., 1996). Saat ini, S.aureus merupakan jenis bakteri yang sudah resisten terhadap antibiotik golongan penisilin [MRSA (Methicilin-Resistant Staphylococcus aureus)]. Bakteri ini merupakan patogen utama bagi manusia. Piridin-piperidin merupakan golongan alkaloid yang mempunyai aktivitas antibakteri yang kuat maupun lemah ( Roberts, 1998).
metanol : asam asetat (60:10:1). Namun pada penelitian ini fase gerak yang digunakan adalah kloroform : etanol (95:5), kloroform : etanol : asam asetat (90:8:2), dan kloroform : etanol : asam asetat (90:5:5). Etanol digunakan sebagai pengganti metanol karena metanol bersifat toksik. Karena metanol mempunyai nilai kepolaran 5,1 dan etanol 5,2 maka perbandingan jumlah etanol yang digunakan lebih sedikit. Hal ini bertujuan supaya kepolaran fase gerak yang digunakan mendekati kepolaran fase gerak kloroform : metanol : asam asetat (60:10:1) sehingga alkaloid tersari di fase gerak ini.
Untuk memilih fraksi yang aktif sebagai antibakteri, digunakan metode difusi. Bioautografi dilakukan untuk mengetahui apakah senyawa yang terdapat dalam fraksi aktif berpotensi sebagai antibakteri terhadap S.aureus dengan mendeteksi bercak pada kromatogram hasil KLT dan reaksi warna pada kromatogram KLT dan nilai Rf antara zona hambat yang terbentuk dengan nilai Rf pembanding (piridin) digunakan untuk mendapatkan identitas fraksi aktif sebagai antibakteri.
J. HIPOTESIS
BAB III
METODOLOGI PENELITIAN A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian rancangan eksperimental murni dengan rancangan penelitian acak lengkap pola searah. Penelitian ini dilakukan di Laboratorium Farmakognosi Fitokimia dan Laboratorium Mikrobiologi, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
B. Variabel Penelitian dan Definisi Opersional 1. Variabel Penelitian
a. Variabel bebas
Beberapa fraksi hasil pemisahan kromatografi kolom. b. Variabel tergantung
Zona hambat yang terbentuk di sekitar lubang sumuran pada metode difusi padat atau yang terbentuk di sekitar bercak pada kromatogram hasil bioautografi kontak.
c. Variabel terkendali
Umur tanaman kemiri ± 6 tahun dari lingkungan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta, suhu pengeringan 60°C, waktu maserasi 24 jam, waktu inkubasi bakteri uji 24 jam, suhu inkubasi bakteri uji 370C, volume dan jenis media pertumbuhan mikroba uji yaitu nutrien agar.
2. Definisi Operasional
a. Kulit batang kemiri (Aleurites moluccana L. Willd) adalah bagian luar dari dahan dan cabang pohon kemiri yang berbatasan dengan kambium batang dan pohon kemiri yang digunakan berada di lingkungan Universitas Sanata Dharma Yogyakarta dengan usia ± 6 tahun.
b. Potensi antibakteri adalah kemampuan fraksi kloroform : etanol (95:5), fraksi kloroform : etanol : asam asetat (90:8:2), dan fraksi kloroform : etanol : asam asetat (90:5:5) dari ekstrak etanol-asam asetat kulit batang kemiri untuk menghambat atau membunuh bakteri S.aureus.
c. Ekstrak etanol-asam asetat adalah semua senyawa yang terkandung dalam kulit batang kemiri yang dapat tersari dalam pelarut etanol-asam asetat. d. Fraksi adalah hasil pemisahan dari kromatografi kolom dalam berbagai
variasi perbandingan pelarut yaitu fraksi I [kloroform : etanol (95:5)], fraksi III [kloroform : etanol : asam asetat (90:8:2)], dan fraksi V [kloroform : etanol : asam asetat (90:5:5)].
e. Fraksi kloroform-etanol adalah fraksi yang mengandung senyawa hasil pemisahan dari kromatografi kolom yang dapat tersari dalam pelarut kloroform-etanol.
f. Fraksi kloroform-etanol-asam asetat adalah fraksi yang mengandung senyawa hasil pemisahan dari kromatografi kolom yang dapat tersari dalam pelarut kloroform-etanol-asam asetat.
S.aureus ditunjukkan dengan diameter zona hambat terbesar pada difusi padat dengan metode sumuran.
h. Zona hambat adalah zona jernih pada media agar yang telah ditanami bakteri uji, yang terbentuk di sekitar lubang sumuran atau di sekitar bercak plat kromatogram karena potensi antibakteri yang ditimbulkan oleh fraksi aktif.
i. Difusi sumuran adalah metode yang digunakan untuk menguji potensi antibakteri fraksi kloroform : etanol (95:5), fraksi kloroform : etanol : asam asetat (90:8:2), dan fraksi kloroform : etanol : asam asetat (90:5:5) dari ekstrak etanol-asam asetat kulit batang kemiri terhadap S.aureus. j. Bioautografi kontak adalah metode untuk mendeteksi bercak senyawa
aktif pada kromatogram hasil KLT yang mempunyai potensi sebagai antibakteri terhadap bakteri S.aureus dengan cara menempelkan kromatogram pada media agar yang telah diinokulasikan bakteri uji.
C. Bahan dan Alat Penelitian 1. Bahan
standar Mc Farland II (setara dengan kepadatan bakteri 6.108 CFU/ml), kloroform p.a, etanol p.a, asam asetat p.a, pereaksi semprot CAS (Cerium Amonium Sulfat), pereaksi Bourchardat, Dragendorff, dan Mayer, HCl 1%, Na2CO3 1 M, NaSO4 anhidrat.
2. Alat
Alat-alat yang digunakan adalah alat-alat gelas yaitu Erlenmeyer, bekker glass, tabung reaksi, corong, labu ukur, pipet tetes, pHmeter, cawan petri, batang pengaduk, gelas ukur, sendok, pelubang sumuran, shaker (Innova 2100, New Brunswick Scientific), corong Buchner (New Cartle, Staffs, England),
rotaevaporator (Janke dan Kunkel, Ika-Labotechnik, RV 05-ST), autoclave
(Model KT-40, ALP Co. Ltd Hamurasi Tokyo Japan); oven (memmert),
waterbath (Mammert), alat kromatografi kolom, corong pisah, inkubator (Mammert, tipe BE 400, GmbH+CoKG-D91126, Swahaban FRG Germanymicrobiological safety cabinet), neraca analitik (Scaltec Instruments Heiligen Stadt Germany), lampu spiritus, jarum ose, flakon, tempat pengembangan (Chamber) KLT, mikrokapiler, penyangga lempeng kaca, kertas saring dan penyemprot reagen penampak, lampu UV 254 nm dan UV 365 nm.
D. Tata Cara Penelitian 1. Identifikasi Tanaman
Yogyakarta dengan cara mendeterminasi bagian tanaman (bagian bunga dan daun) dengan buku panduan Selected Medical Plant Monographic and Description (Kardono dkk, 2003).
2. Pengumpulan Bahan
Kulit batang kemiri didapat dari pohon kemiri di lingkungan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta yang berumur ± 6 tahun pada bulan Februari sampai bulan Maret. Bagian yang diambil adalah bagian cabang batang yang berdiameter antara 4–12 cm. Kulit batang dicuci dengan air mengalir untuk menghilangkan pengotor kemudian ditiriskan untuk menghilangkan sisa-sisa air cucian. Selanjutnya dipotong kecil-kecil dan dikeringkan.
3. Pengeringan dan Pembuatan Serbuk
Pengeringan dilakukan dengan menggunakan oven pada suhu 600C selama ± 2 hari. Pengeringan dilakukan hingga kulit batang tersebut mudah dipatahkan. Lalu diserbuk dan diayak dengan ayakan dengan nomor mesh 28 hingga didapat serbuk yang halus.
4. Identifikasi Kandungan Senyawa Aktif Kulit Batang Kemiri (Aleurites moluccana L. Willd) dengan Uji Tabung
a. Uji Alkaloid
dengan 10 ml HCl 1% selama 30 menit. Suspensi disaring dengan kapas. Eluen dibagi ke dalam tiga tabung reaksi A, B, dan C sama banyak. Ke dalam tabung reaksi A ditambah 3 tetes pereaksi Dragendorff, ke dalam tabung reaksi B ditambah pereaksi Mayer, dan ke dalam tabung reaksi C ditambah pereaksi Bourchardat. Jika terbentuk endapan dengan penambahan ketiga pereaksi tersebut, menunjukkan adanya alkaloid.
b. Uji Polifenol
Dua gram serbuk kulit batang kemiri dipanaskan dengan 10 ml air selama 10 menit dalam penangas air mendidih. Disaring panas-panas, setelah dingin, ditambah 3 tetes pereaksi besi (III) klorida. Didapatkan warna hijau-biru menunjukkan adanya polifenol.
5. Ekstraksi Kulit Batang Kemiri
Serbuk ditimbang sebanyak ± 250 gram dan dibagi ke dalam 5 buah
Erlenmeyer masing-masing berisi 50 gram serbuk. Tiap Erlenmeyer
ditambahkan pelarut petroleum eter sampai serbuk terendam ± 150 ml, kemudian ditutup dan digojog menggunakan shaker selama 1 jam. Lalu disaring dengan corong Buchner, filtrat yang didapat dibuang sedangkan ampas dikeringkan dengan oven pada suhu 400C untuk menghilangkan sisa petroleum eter. Ampas yang didapat dimaserasi menggunakan etanol-asam asetat 10% sampai pHnya 4-5. Kemudian digojog menggunakan shaker
menggunakan etanol-asam asetat 10%, seperti cara diatas. Kemudian disaring dengan corong Buchner hingga didapat filtrat II dan ampas II. Ampas II diremaserasi seperti cara diatas hingga didapat filtat III dan ampas III. Ampas III buang sedangkan filtrat III dijadikan satu dengan filtrat I dan filtrat II, kemudian diuapkan dengan rotaevaporator hingga volume filtrat berkurang sepertiga dari volume sebelumnya. Setelah itu diuapkan diatas waterbath, sampai didapat ekstrak etanol-asam asetat kental.
7. Fraksinasi Ekstrak Etanol-Asam Asetat dengan Kromatografi Kolom Ke dalam kolom, sebanyak 1,0 ml sample dimasukkan secara hati-hati. Ketika sampel hampir masuk semua, keran dibuka dan fase gerak kloroform : etanol (95:5) dialirkan melalui dinding kolom. Fase gerak dialirkan terus menerus sehingga di atas fase diam selalu terdapat eluen 0,5-1 cm. Di dalam
8. Uji Potensi Antibakteri Tiap Fraksi dan Pemilihan Fraksi Aktif a. Pembuatan Suspensi bakteri Staphyloccocus aureus
Ke dalam 5 ml nutrien broth, bakteri uji dari kultur murni diinokulasikan sebanyak 1 ose dan diinkubasi selama 24 jam. Setelah 24 jam, kepadatan bakteri uji disamakan dengan larutan standar Mc Farland II (setara dengan kepadatan bakteri 6.108 CFU/ml).
b. Pembiakan bakteri uji secara pour plate
Ke dalam tabung reaksi yang berisi agar cair yang telah didinginkan pada suhu 450C, sebanyak 1,0 ml suspensi bakteri diinokulasikan. Tabung reaksi di vortex, campuran dituang ke dalam cawan petri steril dan dibiarkan memadat. Inkubasikan terbalik.
c. Pengujian dan penentuan fraksi aktif
Pada media agar yang telah diinokulasikan bakteri S.aureus, dibuat lubang sumuran. Ke dalam tiap lubang dimasukkan berbagai macam fraksi yang didapat (satu lubang satu fraksi). Inkubasi selama 24 jam pada suhu 370C. Setelah 24 jam, zona hambat yang terbentuk diamati. Zona hambat dengan diameter terbesar dipilih sebagai fraksi aktif.
9. Uji Kualitatif Fraksi Aktif Dengan Metode KLT
Fraksi kental hasil penyarian serbuk kulit batang kemiri secara kromatografi kolom disari dengan HCl 1% sebanyak 3 ml di atas waterbath
cairan, lapisan atas dinetralkan dengan asam asetat dan merupakan larutan untuk uji alkaloid kuaterner. Lapisan bawah disari dengan HCl 1% dan didapat dua lapisan cairan. Lapisan atas digunakan untuk uji alkaloid tersier dan lapisan bawah disingkirkan. Larutan uji alkaloid kuaterner dan tersier tersebut masing-masing dipekatkan di atas waterbath kemudian dilarutkan dengan air beberapa tetes untuk uji KLT. Pada KLT, digunakan fase diam silika gel G 254, fase gerak yang digunakan adalah fase gerak kloroform : etanol : asam asetat (60:20:20). Setelah fraksi aktif ditotolkan pada fase diam, dimasukkan ke dalam tabung pengembang yang telah berisi fase gerak. Pengembangan dilakukan dua kali yakni 5 cm dan 10 cm sehingga jarak elusi fase gerak 15 cm. Setelah itu, fase diam diangkat kemudian diangin-anginkan sampai kering setelah itu dideteksi dengan UV 254 nm dan 365 nm. Dilakukan uji identifikasi senyawa hasil KLT dengan pereaksi warna CAS, kemudian hasilnya dibandingkan dengan pembanding.
10.Uji Potensi Antibakteri Senyawa Aktif Dari Fraksi Aktif Terhadap Staphylococcus aureus dengan Metode Bioautografi Kontak
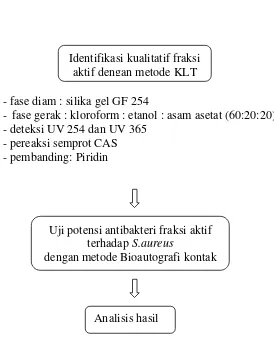
Pengeringan dan pembuatan serbuk - diameter 4-12 cm
Identifikasi tanaman
Pengumpulan kulit batang - makroskopis
Pembuatan ekstrak etanol-asam asetat Maserasi menggunakan pelarut etanol-asam asetat
Uji tabung - uji alkaloid - uji polifenol
- Pengeringan dengan oven 600C - Penyerbukan dan Pengayakan
Fraksinasi ekstrak etanol-asam asetat dengan kromatografi kolom - fase diam : silika gel GF 254
- fase gerak :
1. kloroform : etanol (95:5)
2. kloroform : etanol : asam asetat (90:8:2) 3. kloroform : etanol : asam asetat (90:5:5)
Identifikasi kualitatif fraksi aktif dengan metode KLT - fase diam : silika gel GF 254
- fase gerak : kloroform : etanol : asam asetat (60:20:20) - deteksi UV 254 dan UV 365
- pereaksi semprot CAS - pembanding: Piridin
Uji potensi antibakteri fraksi aktif terhadap S.aureus
dengan metode Bioautografi kontak
Analisis hasil
Gambar 1. Skema Penelitian Potensi Antibakteri Fraksi Floroform-Etanol-Asam Asetat dari Ekstrak Etanol-Floroform-Etanol-Asam Asetat Kulit Batang Kemiri Terhadap Staphylococcus aureus
E. Analisis Hasil
Uji potensi antibakteri fraksi kloroform : etanol (95:5), fraksi kloroform : etanol : asam asetat (90:8:2), dan fraksi kloroform : etanol : asam asetat (90:5:5) dari ekstrak etanol serbuk kulit batang kemiri ditunjukkan dengan diameter zona hambat yang diperoleh dengan metode pengujian menggunakan difusi sumuran. Potensi dilihat dari ada tidaknya zona hambat disekitar sumuran. Kandungan senyawa dalam fraksi aktif kulit batang kemiri diperoleh dengan uji tabung.
Potensi antibakteri fraksi aktif diperoleh dengan melihat ada tidaknya zona hambat yang ditimbulkan oleh bercak kromatogram yang diletakkan pada media agar yang telah diinokulasi bakteri uji S.aureus.
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN A. Identifikasi Tanaman
Langkah pertama yang dilakukan dalam penelitian ini adalah identifikasi tanaman kemiri (Aleurites moluccana L. Willd). Langkah ini dilakukan dengan tujuan untuk memastikan bahwa tanaman yang diteliti benar-benar merupakan tanaman yang diharapkan, yakni tanaman kemiri (Aleurites moluccana L. Willd). Dari hasil identifikasi, dapat dipastikan bahwa tanaman yang akan diteliti merupakan tanaman kemiri (Aleurites moluccana L. Willd).
B. Pengumpulan Bahan
Dalam penelitian ini, bahan yang akan diteliti adalah bagian kulit batang tanaman kemiri di lingkungan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta yang berumur ± 6 tahun. Pengambilan bahan dilakukan antara bulan Februari sampai dengan Maret 2005. Kulit batang kemiri yang akan diteliti didapat dari batang yang berdiameter antara 4-12 cm karena batang dengan diameter tersebut dapat dianggap sudah cukup tua/ dewasa dan diharapkan zat kimia yang terkandung sudah cukup banyak untuk penelitian. Selain itu, batang dengan diameter 4-12 cm akan lebih mudah untuk dikuliti daripada yang berukuran kurang atau lebih dari kisaran tersebut. Kulit batang yang didapat dicuci dengan air mengalir dengan tujuan untuk membersihkan kotoran-kotoran yang menempel yang jika tidak dibersihkan akan mengganggu jalannya penelitian yakni pada saat identifikasi senyawa. Digunakan air mengalir agar
kotoran yang menempel langsung terbawa oleh air meninggalkan kulit batang kemiri. Kemudian ditiriskan untuk menghilangkan sisa-sisa air cucian. Selanjutnya kulit batang kemiri dipotong kecil-kecil untuk memudahkan pada saat penyerbukan.
C. Pengeringan dan Pembuatan Serbuk
akan meningkatkan efektifitas penyarian karena zat yang tersari akan lebih banyak dan penyarian dapat berlangsung lebih cepat. Setelah bahan diserbuk, selanjutnya bahan diayak untuk memperoleh serbuk yang halus untuk meningkatkan efektifitas penyarian. Ayakan yang dipakai adalah ayakan dengan nomor mesh 28. Serbuk halus yang telah didapat selanjutnya disari menggunakan pelarut yang telah ditentukan.
D. Identifikasi Kandungan Senyawa Aktif Kulit Batang Kemiri (Aleurites moluccana L. Willd) dengan Uji Tabung
Sebelum memasuki langkah selanjutnya, terlebih dahulu dilakukan uji tabung serbuk kulit batang kemiri. Tujuan dilakukan uji ini adalah untuk mengetahui zat kimia yang terkandung dalam serbuk kulit batang kemiri. Uji tabung yang dilakukan adalah uji alkaloid dan uji polifenol karena mengacu pada penelitian sebelumnya (Melinda, 2005) bahwa dalam kulit batang kemiri mengandung alkaloid dan polifenol. Uji alkaloid dilakukan untuk lebih memastikan adanya alkaloid dalam kulit batang kemiri yang berpotensi sebagai antibakteri terhadap
Bourchardat. Pada uji polifenol, didapatkan hasil yang positif. Artinya simplisia mengandung polifenol ditandai dengan filtrat menjadi berwarna hijau biru pada penambahan FeCl3.
Tabel I. Hasil Uji Tabung Serbuk Kulit Batang Kemiri
No. Pengujian Pengamatan Hasil
1. Uji Alkaloid
Filtrat 1 + Dragendorff LP Filtrat 2 + Mayer LP Filtrat 3 + Bourchardat LP
Terbentuk endapan coklat merah Terbentuk endapan putih
Hasil uji tabung sesuai dengan penelitian terdahulu (Melinda, 2005) bahwa kulit batang kemiri mengandung alkaloid dan polifenol. Kedua zat tersebut memiliki potensi sebagai antibakteri. Menurut penelitian Melinda (2005), zat yang terkandung dalam kulit batang kemiri, yang berpotensi sebagai antibakteri terhadap S.aureus adalah alkaloid. Oleh karena itu, penelitian ini akan membahas alkaloid sebagai antibakteri terhadap S.aureus.
E. Ekstraksi Kulit Batang Kemiri
yang hampir sama dengan polaritas etanol, kapang dan kuman sulit tumbuh dalam etanol 20% keatas karena itu dipakai etanol 70%, tidak beracun, netral, absorpsinya baik, etanol dapat bercampur dengan air pada segala perbandingan, panas yang dipakai untuk pemekatan lebih sedikit (Anonim, 1986a). Etanol dapat melarutkan alkaloid basa (Anonim, 1986a) karena penelitian ini lebih ditekankan pada pengidentifikasian alkaloid yang terkandung dalam kulit batang kemiri yang berpotensi sebagai antibakteri terhadap S.aureus (Melinda, 2005).
dilakukan dengan menggunakan rotaevaporator hingga volume filtrat berkurang sepertiga dari volume sebelumnya. Penggunaan rotaevaporator untuk mempercepat pemisahan cairan penyari dengan ekstrak. Setelah itu diuapkan di atas waterbath pada suhu 50oC, sampai didapat ekstrak etanol-asam asetat kental. Berat ekstrak etanol-asam asetat kental yang diekstrak secara maserasi dari 250 gram serbuk kulit batang kemiri adalah 2,12 gram. Ekstrak ini yang nantinya akan dikromatografi kolom untuk mendapatkan fraksi-fraksi dengan zat-zat yang tersari dari kulit batang kemiri terbagi dalam fraksi-fraksi tersebut sesuai dengan polaritasnya.
dengan fase gerak kloroform : etanol (95:5) sampai terbentuk bubur silika gel. Bila terbentuk buih dihilangkan karena adanya buih akan menyebabkan terbentuknya rongga udara pada fase diam sehingga akan mengganggu proses pemisahan. Suspensi silika gel G 254 dimasukkan ke dalam kolom, kolom ditepuk-tepuk untuk memperoleh lapisan yang seragam sehingga pengepakan homogen dan gelembung-gelembung yang terbentuk hilang. Sesudah homogen, ditambah NaSO4 anhidrat. Penggunaan NaSO4 anhidrat bertujuan untuk mengikat H2O yang mungkin terkandung dalam fase gerak dan menyerap O2 sehingga mencegah kolom agar tidak terisi oleh udara dan H2O. Adanya H2O dapat mengganggu fase gerak dalam membawa zat aktif yang larut di dalamnya karena H2O dapat menempati rongga-rongga tempat merembesnya fase gerak untuk membawa zat aktif. Selain itu, penambahan NaSO4 bertujuan untuk melindungi fase diam agar tidak rusak saat cuplikan dan fase gerak di tuang ke kolom. Fase diam dicuci dengan fase gerak kloroform : etanol (95:5) kemudian dibiarkan menetes hingga volume fase gerak yang tertinggal di atas fase diam ± 0,5 cm agar permukaan fase diam tidak kering.
digunakan akan semakin baik karena itu berarti jumlah zat yang terkandung di dalam fraksi-fraksi terpisah lebih banyak pula sehingga akan lebih memudahkan pada uji kualitatif selanjutnya. Fase gerak dialirkan terus menerus sehingga di atas fase diam selalu terdapat eluen 0,5-1,0 cm agar permukaan fase diam tidak kering. Fase gerak dialirkan melalui dinding kolom untuk menjaga agar permukaan fase diam tetap rata/ homogen karena jika diteteskan dapat menyebabkan permukaan fase diam menjadi tidak rata. Fase gerak yang digunakan untuk menyari alkaloid piridin adalah kloroform : metanol : asam asetat (60:10:1) (Cordell, 1981). Namun pada penelitian ini fase gerak yang digunakan adalah kloroform : etanol (95:5), kloroform : etanol : asam asetat (90:8:2), dan kloroform : etanol : asam asetat (90:5:5). Etanol digunakan sebagai pengganti metanol karena metanol bersifat toksik. Karena metanol mempunyai nilai kepolaran 5,1 dan etanol 5,2 maka perbandingan jumlah etanol yang digunakan lebih sedikit. Hal ini bertujuan supaya kepolaran pelarut mendekati kepolaran fase gerak kloroform : metanol : asam asetat (60:10:1) sehingga alkaloid tersari di fase gerak ini. Masing-masing fase gerak diperlukan sebanyak 100 ml. Tujuan digunakan 3 macam fase gerak dengan variasi perbandingan adalah untuk mendapatkan pemisahan yang lebih baik sesuai dengan polaritasnya. Ini akan lebih menguntungkan pada saat pengidentifikasian.
III = ± 80 ml, dan fraksi V = ± 90 ml. Fraksi II dan fraksi IV (masing-masing fraksi didapat volume ± 20 ml) tidak digunakan karena fraksi II diperkirakan merupakan fraksi peralihan dari fase gerak I ke fase gerak III sedangkan fraksi IV diperkirakan merupakan fraksi peralihan dari fase gerak III ke fase gerak V. Namun demikian, belum ada bukti kualitatif yang menyatakan bahwa fraksi II dan fraksi IV merupakan fraksi peralihan. Dari ketiga fraksi ini dipilih salah satu yang memberikan potensi yang paling besar sebagai antibakteri. Selanjutnya fraksi ini akan digunakan untuk uji kualitatif secara KLT dengan pereaksi warna dan bioautografi kontak.
H. Uji Potensi Antibakteri Tiap Fraksi dan Pemilihan Fraksi Aktif Pengujian potensi antibakteri dilakukan menggunakan metode difusi sumuran. Bakteri yang digunakan adalah S.aureus. Pertimbangan penggunaan bakteri ini adalah karena bakteri ini merupakan bakteri gram positif yang bersifat patogen dan merupakan bakteri flora normal bagi beberapa orang karena empat puluh sampai lima puluh persen manusia merupakan pembawa S.aureus dalam hidung dan dalam folikel rambut (Jawetz et al., 1996). Selain itu S.aureus
langkah selanjutnya, dengan fraksi ini akan dicari identitas zat aktif yang terkandung di dalamnya yang berpotensi sebagai antibakteri. Pemilihan fraksi aktif dilakukan dengan melihat zona jernih di sekitar lubang sumuran yang memiliki diameter yang terbesar. Larutan standar kepadatan bakteri uji yang digunakan adalah larutan standar Mc Farland II (setara dengan kepadatan bakteri 6.108 CFU/ml) karena partikel pada larutan standar Mc Farland II memiliki ukuran partikel yang hampir sama dengan ukuran partikel sel bakteri S.aureus. Bakteri uji yang digunakan adalah bakteri uji yang berumur 24-48 jam karena pada waktu tersebut, pertumbuhan bakteri sedang memasuki fase logaritmik/ eksponensial. Pada fase ini, bakteri sedang tumbuh secara optimal sehingga waktu tersebut merupakan waktu yang optimal untuk dilakukan pengujian dan hasil pengamatan yang didapat benar-benar obyektif karena bakteri uji yang mati disebabkan oleh zat aktif yang terkandung dalam fraksi, bukan karena umur bakteri yang sudah tua. Pembiakan bakteri uji dilakukan menggunakan cara pour plate karena S.aureus merupakan bakteri gram positif, bersifat anaerob fakultatif yang tidak membentuk spora, tidak bergerak (Jawetz et al., 1996) sehingga dengan metode pour plate diharapkan S.aureus dapat tersebar merata dalam media uji, tidak hanya tumbuh di permukaan. Inkubasi terbalik yang dilakukan bertujuan untuk menghindari titik-titik air yang terbentuk dari uap panas media agar sehingga dapat menghalangi pengamatan.
menggunakan metode sumuran agar fraksi yang diuji tidak hanya berdifusi di permukaan media saja tetapi merata ke dalam media, pada metode ini, zat aktif akan berdifusi ke dalam media agar NA dan ke dalam sel bakteri sehingga ada faktor yang menentukan zat aktif dapat berdifusi, yakni sifat polaritas dari zat aktif. Media agar NA yang digunakan bersifat polar, demikian pula dinding sel
S.aureus karena tersusun atas polisakarida, asam teikoat dan protein (Jawetz et al., 1991) sehingga zat-zat yang bersifat polar akan lebih mudah untuk berdifusi dan menembus dinding sel bakteri. Pelarut fraksi akan membantu berdifusinya zat aktif ke dalam media agar NA sehingga pelarut yang bersifat polar akan lebih mudah membawa zat aktif berdifusi ke dalam media agar NA. Kontrol positif yang digunakan adalah piridin. Konsentrasi piridin yang digunakan adalah 5%. Kontrol negatif yang digunakan adalah DMSO. Kontrol kontaminasi berupa media agar untuk memastikan bahwa media agar yang digunakan tidak terkontaminasi.
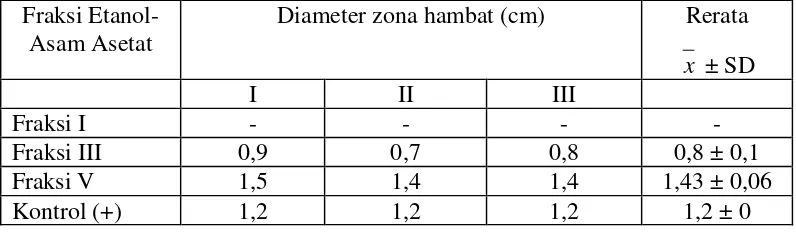
Tabel II. Rerata Diameter Zona Hambat Fraksi Kloroform-Etanol-Asam Asetat dari Ekstrak Etanol-Asam Asetat Kulit Batang Kemiri Terhadap Staphylococcus aureus
Fraksi Etanol-Asam Asetat
Diameter zona hambat (cm) Rerata
x ± SD
Melihat hasil yang didapat, fraksi aktif dari fraksi kloroform-etanol-asam asetat dari ekstrak etanol-asam asetat kulit batang kemiri adalah fraksi V yang memiliki rerata diameter zona hambat lebih besar dari fraksi I dan fraksi III dengan rerata diameter zona hambat sebesar 1,43 cm. Karena diameter zona hambat fraksi aktif lebih besar daripada diameter zona hambat kontrol positif, maka fraksi aktif ini berpotensi untuk dikembangkan.
I. Uji Kualitatif Fraksi Aktif Dengan Metode KLT
garam alkaloid menjadi alkaloid bebas yang larut dalam pelarut non polar yakni kloroform. Pada tahap ini, akan didapatkan dua lapisan cairan, yakni untuk uji alkaloid tersier dan alkaloid kuaterner. Untuk uji KLT, pelarut yang digunakan adalah air karena apabila digunakan DMSO (pelarut yang digunakan pada uji potensi antibakteri) akan sulit menguap sehingga akan memperlama pada saat pengeringan dan kemungkinan besar akan menimbulkan pengekoran setelah proses elusi. Hal ini kemungkinan disebabkan karena adanya pengotor dalam DMSO sehingga menyebabkan bercak tampak mengekor. Pengembangan dilakukan dua kali. Pengembangan pertama berjarak 5 cm dan pengembangan kedua berjarak 10 cm. Tujuan dilakukan pengembangan sebanyak dua kali agar senyawa dapat terpisah dengan baik dilihat dari bercak KLT yang terpisah jelas. Pembanding yang digunakan adalah piridin hasil sintesis. Pembanding dan fraksi tidak ditotolkan dalam satu plat karena setelah dilakukan pengembangan bercak kromatogram piridin memiliki hasil yang melebar sehingga dikhawatirkan bercak kromatogram piridin dan bercak kromatogram fraksi akan menumpuk. Identifikasi senyawa hasil KLT dilakukan dengan sinar UV 254, UV 365 dan pereaksi warna CAS.
Tabel III. Hasil Identifikasi Senyawa Alkaloid Kuaterner Fraksi Kloroform– Etanol - Asam Asetat (90 : 5 : 5) Dari Ekstrak Etanol-Asam Asetat dengan Fase Gerak Kloroform– Etanol - Asam Asetat (60:20:20)
Deteksi Nama Senyawa Rf
UV 254 UV 365 CAS
Alkaloid kuaterner 0,56 Terjadi pemadaman
Tak tampak
Berwarna coklat kekuningan
Piridin 0,47 Terjadi
pemadaman
Tak tampak
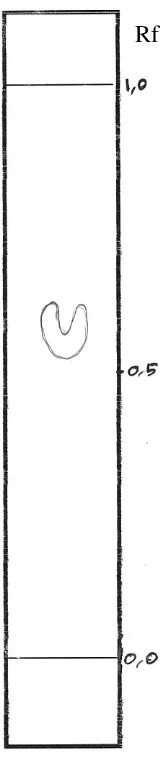
Rf
Gambar 2. Kromatogram Alkaloid Kuaterner Fraksi Aktif [Kloroform : Etanol : Asam Asetat (90 : 5 : 5)] dari Ekstrak Etanol-Asam Asetat Kulit Batang Kemiri (Aleurites moluccana L. Willd) Fase diam : silika gel G 254
Fase gerak : kloroform : etanol : asam asetat (60:20:20)
Tabel IV. Hasil Identifikasi Senyawa Alkaloid Tersier Fraksi Kloroform – Etanol - Asam Asetat (90 : 5 : 5) Dari Ekstrak Etanol-Asam Asetat dengan Fase Gerak Kloroform – Etanol - Asam Asetat (60:20:20)
Deteksi Nama Senyawa Rf
UV 254 UV 365 CAS
Alkaloid tersier 0,57 Terjadi pemadaman
Tak tampak
Berwarna coklat kekuningan
Piridin 0,47 Terjadi
pemadaman
Tak tampak
Tak tampak
Rf
Gambar 3. Kromatogram Alkaloid Tersier Fraksi Aktif [Kloroform : Etanol : Asam Asetat (90 : 5 : 5)] dari Ekstrak Etanol-Asam Asetat Kulit Batang Kemiri (Aleurites moluccana L. Willd) Fase diam : silika gel G 254
Fase gerak : kloroform : etanol : asam asetat (60:20:20)
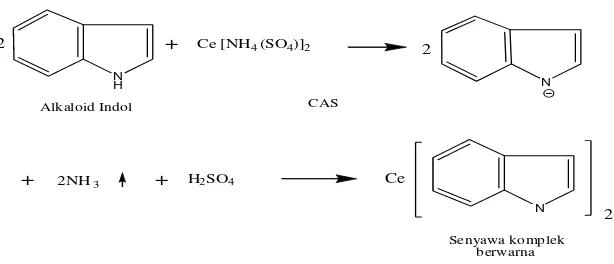
(Cordell, 1981), karenanya piridin memiliki sifat penarik elektron yang lebih kuat dibandingkan alkaloid indol. Piridin akan lebih menstabilkan cincin aromatisnya sehingga sulit memberikan PEB untuk membentuk kompleks. Pereaksi CAS dapat menimbulkan warna (kuning-jingga) pada alkaloid indol, namun itu tergantung pada gugus kromofor yang terdapat pada alkaloid tersebut, juga pada struktur alkaloid (Cordell, 1981). Jadi dapat disimpulkan bahwa alkaloid yang terkandung di dalam fraksi kloroform-etanol-asam asetat dari fraksi etanol-asam asetat kulit batang kemiri bukan alkaloid piridin dan kemungkinan adalah alkaloid indol. Ini dapat dilihat pada hasil uji KLT bercak kromatogram menimbulkan warna coklat kekuningan pada penyemprotan dengan pereaksi CAS. Warna ditimbulkan karena adanya ikatan antara logam berat dengan pereaksi semprot (logam Ce pada CAS) dengan alkaloid membentuk senyawa kompleks (gambar 5).
N
+
piridin CAS
Ce[NH4(SO4)]2 tidak bereaksi
tidak terbentuk kompleks warna
2NH3
Gambar 5. Reaksi Pembentukan Senyawa Kompleks oleh Alkaloid Indol dengan Pereaksi CAS
Dari hasil kromatografi, dapat disimpulkan bahwa alkaloid tersier lebih bersifat non polar daripada alkaloid kuaterner. Ini dapat dilihat dari nilai Rf yang didapat. Nilai Rf alkaloid tersier lebih besar (0,57) daripada nilai Rf alkaloid kuaterner (0,56). Ini disebabkan karena alkaloid tersier lebih terikat pada fase gerak daripada fase diam. Karena adanya perbedaan struktur alkaloid tersier dan kuaterner (gambar 6) (pada alkaloid kuaterner terdapat N+)menyebabkan alkaloid kuaterner bersifat lebih elektronegatif dibandingkan alkaloid tersier sehingga alkaloid kuaterner bersifat lebih polar dibandingkan alkaloid tersier.
N
..
N
+
alkaloid tersier
alkaloid kuaterner
J. Uji Potensi Antibakteri Senyawa Aktif dari Fraksi Aktif Terhadap Staphylococcus aureus Dengan Metode Bioautografi Kontak
menunjukkan hasil negatif. Fraksi kloroform-etanol-asam asetat (90:5:5) dari ekstrak etanol-asam asetat kulit batang kemiri tidak berpotensi sebagai antibakteri terhadap S.aureus.
Tabel V. Hasil Uji Potensi Antibakteri Fraksi Aktif (fraksi V) Terhadap Staphylococcus aureus dengan Metode Bioautografi Kontak
NAMA SENYAWA ZONA HAMBAT
Kontrol positif (piridin) Pada nilai Rf 0,47
Alkaloid kuaterner -
BAB V
KESIMPULAN DAN SARAN A. KESIMPULAN
1. Fraksi I [kloroform : etanol (95:5)] tidak mempunyai potensi antibakteri terhadap Staphylococcus aureus, fraksi kloroform : etanol : asam asetat (90:8:2), dan fraksi kloroform : etanol : asam asetat (90:5:5) dari ekstrak etanol-asam asetat kulit batang kemiri mempunyai potensi antibakteri terhadap
Staphylococcus aureus.
2. Fraksi kloroform-etanol-asam asetat (90:5:5) adalah fraksi aktif dari ekstrak etanol-asam asetat kulit batang kemiri (Aleurites moluccana L. Willd) yang berperan sebagai antibakteri terhadap Staphylococcus aureus.
3. Senyawa yang terdapat dalam fraksi kloroform-etanol-asam asetat (90:5:5) antibakteri Staphylococcus aureus kemungkinan adalah alkaloid indol.
4. Senyawa golongan alkaloid yang terdapat dalam fraksi kloroform-etanol-asam asetat (90:5:5) tidak berpotensi sebagai antibakteri terhadap Staphylococcus aureus dengan uji secara bioautografi kontak.
B. SARAN
1. Perlu dilakukan ekstraksi kulit batang kemiri menggunakan metode ekstraksi atau fraksinasi yang lain.
2. Perlu dilakukan penelitian mengenai senyawa lain yang terkandung dalam fraksi V dari ekstrak etanol asam asetat serbuk kulit batang kemiri yang berpotensi sebagai antibakteri terhadap Staphylococcus aureus.
DAFTAR PUSTAKA
Anonim, 1986a, Sediaan Galenik, 8-9, 5-12, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 1986b, Medicinal Herb Index In Indoesia, 115, PT. EISAI, Indonesia.
Anonim, 1993, Dasar-dasar Pemeriksaan Mikrobiologi, 27, 110-114, Bagian Mikrobiologi Fakultas Kedokteran UGM, Yogyakarta.
Anonim, 1995, Materia Medika Indonesia, Jilid IV, 10, 14, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 2006, Piperin, a Phytochemical Potentiator of Ciprofloxacin against Staphylococcus aureus, http://aac.asm.org/cgi/content/full/50/2/810. Diakses pada 27 September 2006.
Anonim, 2006, Antimicrobial Activity Studies on some Piperidine and Pyrolidine Substituted Halogenobenzene Derivates, http://www.ingentaconnect.com/ content/tandf/genz/2006/00000021/00000002/art00012?crawber=true. Diakses pada 21 September 2006.
Arief, A., 1996, Tanaman Obat Pilihan, Cetakan I, 129-130, Yayasan Sidowayah, Jakarta.
Brunetom, J., 1994, Pharmacognosy Phytochemistry Medicinal Plants, 2nded, 791, Lavoiser Publishing inc, New York.
Choma, I., 2005, The Use of Thin-Layer Chromatography with Direct Bioautography for Antimicrobial Analysis, http//www.lcgceurope.com /lcgceurope/ articel/ articel Detail. Diakses pada 19 Septembar 2005. Cordell, Geoffrey, A., 1981, Introduction to Alkaloids; A Biogenetic Approach, 8,
11, 17-18, University of Illionois, United State of America.
Duke, J. A., 1999, Dr. Duke’s Phytochemical and Ethnobotanical Databases, Taxon: Aleurites moluccana (L.) Willd, http://www.ars-grin.gov/cgi-bin/duke/ethnobot.pl, Diakses pada 03 Mei 2006.
Gritter, R. J., 1991, Pengantar Kromatografi, 9-10, 17-18, 160, 163, 165, 169, Penerbit ITB, Bandung.
Hutapea, J. R., dkk, 1993, Inventaris Tanaman Obat Indonesia, 23, Depertemen Kesehatan RI Badan Penelitian Dan Pengembangan Kesehatan, Jakarta. Jawets, E., Melnick, J. L., dan Adelberg, E. A., 1996, Mikrobiologi Untuk Profesi
Kesehatan (Review Medical Mikrobiology), diterjemahkan oleh H. Tonang, , Editor Bonang, Edisi XVI, 239, Kedokteran EGC, Jakarta.
Jawets, E., Melnick, J. L., dan Adelberg, E. A., 1996, Medical Mikrobiology, diterjemahkan oleh Edi Nugroho, Edisi XX, 214, Kedokteran EGC, Jakarta.
Kardono, I., Areanti, N., Dewiyanti, I., dan Basuki, T., 2003, Selected Medical Plant Monographic dan Description, 56-63, PT Gramedia Indonesia Jakarta.
Melinda, 2005, Potensi Antibakteri Fraksi Etil Asetat dan Fraksi Etanol Kulit Batang Kemiri (Aleurites moluccana L. Willd) Terhadap Staphylococcus aureus, Skripsi, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta. Mulja, M., dan Suharman, 1995, Analisis Instrumental, 225-227, Airlangga
Univercity Press, Surabaya.
Mursyidi, A., 1990, Analisis Metabolit Sekunder, cetakan pertama, 63-71, Pusat Antar Universitas Bioteknologi Universitas Gadjah Mada, Yogyakarta. Roberts, Margaret, F., and Wink, Michael, 1998, Alkaloid: Biochemistry, Ecology,
and Medicinal Applications, 87-105, 416, 421-423, Plenum Press, New York.
Robinson, T., 1995, Kandungan Organik Kimia Tumbuhan Tinggi, diterjemahkan oleh Kosasih Padmawinata, 281, 284, Penerbit ITB, Bandung.
Samuelsson, G., 1999, Drugs of Natural Origin, Edisi IV, 15, Apotekarsocieteten, Sweden.
Sastrohamidjojo, H., 1985, Kromatografi, Edisi II, Cetakan I, 1, 34-35, Liberty, Yogyakarta.
Stahl, E., 1969, Thin Layer Chromatography a Laboratory Handbook, 2nd Ed, 4– 17, 568, Springer-Verlag Berlin, New York.