UJI AKTIVITAS AN
ANTIBAKTERI FRAKSI N-HEKSANA, K L KULIT BUAH MANGGIS (Garcinia mangost PStaphylococcus aureusRESISTEN AMOK
SKRIPSI
Disusun untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
UJI AKTIVITAS AN
ANTIBAKTERI FRAKSI N-HEKSANA, K L KULIT BUAH MANGGIS (Garcinia mangost PStaphylococcus aureusRESISTEN AMOK
SKRIPSI
Disusun untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
v
HALAMAN PERSEMBAHAN
“Saya belajar untuk hidup dan
bukan hidup untuk belajar”
“TERJADILAH PADAKU SETURUT
KEHENDAK-MU”
Kupersembahkan untuk keluargaku tercinta,
Bapak Ignasius Sukoco,
Ibu Maria Goretti Gayatri,
Simbah Sardi dan Simbah Romelah,
Adik Cicilia Dias Sukmaningtyas,
vi
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas
segala rahmat dan berkat, kasih dan sayang, serta pimpinan dan tuntunan sehingga
penulis dapat menyelesaikan penelitian skripsi yang berjudul “Uji Aktivitas Antibakteri Fraksi N-Heksana, Kloroform dan Etanol Kulit Buah Manggis (Garcinia mangostana L.) terhadap Staphylococcus aureus Resisten Amoksisilin”dengan baik.
Penulis menyadari bahwa selama penyusunan skripsi ini penulis tidak
lepas dari bantuan, doa, arahan, dukungan, kritik dan saran yang sangat
membangun. Pada kesempatan ini penulis ingin mengucapkan terima kasih
sebesar-besarnya kepada:
1. Bapak Ipang Djunarko, M. Sc., Apt. selaku Dekan Fakultas Farmasi
Universitas Sanata Dharma.
2. Bapak Prof. Dr. C. J. Soegihardjo, Apt. dan Ibu Agustina Setiawati, M. Sc.,
Apt. selaku Dosen Pembimbing yang selalu memberikan arahan, evaluasi serta
kritik dan saran mulai dari pembuatan proposal penelitian hingga penulisan
skripsi ini selesai.
3. Bapak Yohanes Dwiatmaka, M. Si. dan Ibu Damiana Sapta Candrasari, M. Sc.
selaku Dosen Penguji.
4. Ibu Maria Dwi Budi Jumpowati, S. Si., atas masukan dan arahan dalam bidang
vii
5. Bapak Mukminin, Bapak Wagiran, Bapak Heru, Bapak Kayat dan Bapak
Parlan serta semua laboran yang telah membantu selama proses penelitian di
laboratorium.
6. Christiana Destia Anggraeni atas bantuannya selama penelitian di
laboratorium, baik tenaga maupun ide-ide cemerlangnya, serta motivasi.
7. Teman-teman Farmasi Sains dan Teknologi 2010 atas doa dan dukungan.
8. Semua pihak yang tidak dapat penulis sebutkan satu per satu atas semua
bantuan, dukungan dan doa selama penelitian dan penyusunan skripsi.
Penulis menyadari bahwa masih banyak kekurangan dalam naskah skripsi
ini dengan segala keterbatasan yang ada. Oleh karena itu, penulis membuka diri
terhadap segala kritik dan saran yang membangun untuk kemajuan diri dan ilmu
pengetahuan.
ix
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
PERNYATAAN PERSETUJUAN PUBLIKASI ... iv
HALAMAN PERSEMBAHAN ... v
PRAKATA ... vi
PERNYATAAN KEASLIAN KARYA ... viii
DAFTAR ISI ... ix
A. Latar Belakang ... 1
1. Rumusan masalah ... 3
2. Keaslian penelitian ... 4
3. Manfaat penelitian ... 4
B. Tujuan Penelitian... 5
x
A. Staphylococcus aureus ... 6
B. Amoksisilin dan Resistensinya ... 7
C. Buah Manggis (Garcinia mangostanaL.) ... 9
D. Ekstraksi ... 10
E. Uji Aktivitas Antibakteri ... 11
F. Landasan Teori ... 12
G. Hipotesis ... 13
BAB III. METODOLOGI PENELITIAN ... 14
A. Jenis dan Rancangan Penelitian ... 14
B. Variabel dan Definisi Operasional ... 14
1. Variabel penelitian ... 14
2. Definisi operasional ... 15
C. Bahan Penelitian ... 16
D. Alat Penelitian ... 16
E. Tata Cara Penelitian ... 16
1. Pengumpulan bahan kulit manggis ... 16
2. Pembuatan serbuk simplisia kulit buah manggis ... 17
3. Pembuatan fraksi n-heksana, kloroform dan etanol kulit buah manggis ... 17
4. Penentuan nilai kadar hambat minimum (KHM) Staphylococcus aureus sebelum dan sesudah perlakuan resistensi dengan metode dilusi padat... 19
xi
6. Pembuatan media resistensi dalam tabung ... 20
7. Pembuatan suspensi bakteri uji ... 20
8. Orientasi konsentrasi fraksi n-heksana, kloroform dan etanol kulit buah manggis... 21
9. Uji aktivitas antibakteri fraksi n-heksana, kloroform dan etanol kulit buah manggis dengan metode difusi sumuran ... 21
F. Analisis Data ... 22
BAB IV. HASIL DAN PEMBAHASAN ... 23
A. Determinasi dan Pengumpulan Tanaman ... 23
B. Pembuatan Serbuk Simplisia Kulit Buah Manggis ... 23
C. Pembuatan Fraksi n-Heksana, Kloroform dan Etanol Kulit Buah Manggis ... 24
D. Identifikasi Bakteri ... 25
E. Pembuatan Staphylococcus aureus Resisten Amoksisilin dengan metode adaptif gradual ... 26
F. Pembuatan Suspensi Bakteri Uji ... 32
G. Uji Aktivitas Antibakteri Fraksi n-Heksana, Kloroform dan Etanol Kulit Buah Manggis dengan Metode Difusi Sumuran ... 32
1. Uji aktivitas antibakteri fraksi n-heksana kulit buah manggis dengan metode difusi sumuran ... 35
xii
3. Uji aktivitas antibakteri fraksi etanol kulit buah manggis dengan
metode difusi sumuran ... 41
BAB V. KESIMPULAN DAN SARAN ... 46
A. Kesimpulan ... 46
B. Saran ... 46
DAFTAR PUSTAKA ... 47
LAMPIRAN ... 49
xiii
DAFTAR TABEL
Halaman
Tabel I. Penimbangan bobot tetap fraksi etanol ... 22
Tabel II. Hasil penentuan MIC sebelum perlakuan resistensi ... 24
Tabel III. Hasil penentuan MIC setelah perlakuan resistensi ... 27
Tabel IV. Diameter zona hambat yang dihasilkan seri konsentrasi fraksi
n-heksana, kontrol negatif dan kontrol positif ... 31
Tabel V. Hasil t-test diameter zona hambat seri konsentrasi fraksi
n-heksana, kontrol negatif dan kontrol positif ... 32
Tabel VI. Diameter zona hambat yang dihasilkan seri konsentrasi fraksi
kloroform, kontrol negatif dan kontrol positif ... 33
Tabel VII. Hasil t-test diameter zona hambat seri konsentrasi fraksi
kloroform, kontrol negatif dan kontrol positif ... 35
Tabel VIII. Diameter zona hambat yang dihasilkan seri konsentrasi fraksi
etanol, kontrol negatif dan kontrol positif ... 37
Tabel IX. Hasil t-test diameter zona hambat seri konsentrasi fraksi etanol,
xiv
DAFTAR GAMBAR
Halaman
Gambar 1. Buah manggis (Garcinia mangostanaL.) ... 9
Gambar 2. Skema fraksinasi serbuk kulit manggis ... 18
Gambar 3. Struktur amoksisilin ... 29
Gambar 4. Perlakuan resistensi hari ke-10 ... 30
Gambar 5. Perbandingan media uji dengan kontrol pertumbuhan dan kontrol media pada penentuan nilai KHM ... 31
Gambar 6. Strukturcefotaxime ... 34
Gambar 7. Uji difusi sumuran fraksi kloroform ... 39
xv
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Sertifikat hasil ujiStaphylococcus aureusATCC 25923 ... 49
Lampiran 2. Surat pengesahan determinasi tanaman manggis (Garcinia mangostanaL.) ... 50
Lampiran 3. Hasil penentuan MIC sebelum perlakuan resistensi ... 51
Lampiran 4. Hasil penentuan MIC setelah perlakuan resistensi ... 52
Lampiran 5. Proses ekstraksi dan hasil evaporasi ketiga fraksi ... 53
Lampiran 6. Seri konsentrasi fraksi ... 54
Lampiran 7. Perhitungan konsentrasi amoksisilin perlakuan resistensi dengan metode adaptif gradual ... 55
Lampiran 8. Hasil uji aktivitas antibakteri fraksi n-heksana, kloroform dan etanol terhadap Staphylococcus aureus resisten amoksisilin dengan metode difusi sumuran ... 56
Lampiran 9. Hasil pengukuran diameter zona hambat fraksi n-heksana, kloroform dan etanol ... 58
Lampiran 10. Hasil perhitungan statistik zona hambat fraksi n-heksana ... 59
Lampiran 11. Hasil perhitungan statistik zona hambat fraksi kloroform ... 82
xvi
INTISARI
Staphylococcus aureus merupakan penyebab penyakit infeksi yang cukup mematikan. Pengobatan yang selama ini dilakukan menggunakan antibiotik lini pertama seperti amoksisilin. Namun dalam perkembangannya, telah ditemukan suatu mekanisme resistensi dari S. aureus karena adanya enzim penisilinase yang
dapat memecah cincin β-laktam amoksisilin. Manggis diperkenalkan sebagai suatu agen antimikroba baru karena senyawa kandungannya memiliki aktivitas antibakteri yang cukup potensial.
Penelitian ini merupakan penelitian eksperimental murni dengan analisis data menggunakanone wayANOVA dan uji kebermaknaan denganPost hoc test. Resistensi terhadap amoksisilin diawali dengan penentuan nilai Kadar Hambat Minimum(KHM) sebelum dan sesudah perlakuan resistensi selama satu bulan. Uji aktivitas antibakteri fraksi n-heksana, kloroform dan etanol kulit buah manggis terhadap Staphylococcus aureus resisten amoksisilin dilakukan dengan uji difusi sumuran.
Hasil penelitian menunjukkan nilai KHM S. aureus terhadap amoksisilin setelah perlakuan resistensi sebesar 16µg/mL, meningkat 160 kali dari nilai KHM awal. Bakteri hasil perlakuan resistensi kemudian digunakan untuk menguji aktivitas antibakteri ketiga fraksi ekstrak kulit buah manggis. Ketiga fraksi menunjukkan adanya aktivitas antibakteri terhadap bakteriStaphylococcus aureus
resisten amoksisilin. Fraksi n-heksana dan kloroform menunjukkan zona radikal, sedangkan fraksi etanol menunjukkan zona iradikal pada daerah sekitar sumuran.
xvii
ABSTRACT
Staphylococcus aureus is the cause of deadly infectious disease. The treatment which has been carried out using the first-line antibiotics is amoxicillin. But in its development, has found a resistance mechanism of S. aureus due to penicillinase enzymes that can break down the β-lactam ring. Mangosteen is introduced as a new antimicrobial agents because it has so many compounds that considerably potential antibacterial activity.
This research is purely experimental study using one-way ANOVA and post hoc test as the data analysis. Resistance begins with the determination of Minimum Inhibitory Concentration (MIC) values against amoxicillin before and after resistance treatment for a month. Antibacterial activity test for n-hexane, chloroform and etanol fraction from mangosteen rind against amoxicillin resistant
Staphylococcus aureuscarried by diffusion test.
The result showed MIC values of S. aureus against amoxicillin after resistance treatment at 16µg/mL, increased 160 times from the initial MIC values. The bacteria after resistance treatment then used to test the antibacterial activity of the three fractions of mangosteen peel extract. The three fractions showed antibacterial activity against Staphylococcus aureus resistant amoxicillin. N-hexane and chloroform fraction showed radical zone, while ethanol fraction showed irradical zone around the well.
1
BAB I PENGANTAR
A. Latar Belakang
Staphylococcus aureusmerupakan bakteri penyebab infeksi yang berat. S.
aureus dalam beberapa dekade yang lalu menjadi penyebab infeksi yang cukup
luas dan menyerang pembuluh darah, kulit, jaringan lunak, dan sampai pneumonia
(Lowy, 1998 in Ugwu, 2009). S. aureus juga penyebab kematian yang cukup
banyak ditemukan. Infeksi akibat S. aureusdilaporkan sejumlah 170 kasus dalam
kurun waktu dua tahun dengan insidensi sebesar 33,9 kasus/100.000/tahun.
Tingkat kematiannya juga tinggi, sebesar 19,1 % dalam 28 hari dengan angka
kematian populasi per tahun 5,9/100.000 (Jacobsson, 2009).
Pengobatan terhadap penyakit infeksi bakteri yang selama ini digunakan
manusia disebut sebagai agen antibakteri atau sering disebut sebagai antibiotik.
Antibiotik adalah senyawa organik sintetik atau yang terdapat secara alami yang
menghambat atau menghancurkan bakteri tertentu, biasanya pada konsentrasi
rendah (Brooks, 2007). Masyarakat dewasa ini sering menjadikan antibiotik
sebagai rujukan pengobatan bagi penyakit-penyakit yang dialaminya. Penggunaan
antibiotik secara tidak tepat di masyarakat sering menimbulkan permasalahan
yang baru muncul setelah penggunaan yang kronis.
Permasalahan yang kini muncul tidak hanya pada pengobatan infeksi,
tetapi pada resistensi yang ditimbulkan oleh S. aureus sendiri. Penisilin
tetapi ada S. aureus tertentu yang sudah resisten dan prevalensinya meningkat
dalam waktu singkat. Resistensi ini telah menjadi pandemik pada tahun 1950-an
dan awal 1960-an (DeLeo, 2009).
Kasus resistensi terhadap pengobatan antibiotik pada pasien tidak
serta-merta disebabkan oleh resistensi pasien, tetapi disebabkan juga oleh bakteri itu
sendiri. Bakteri ini diserang dan dibunuh oleh antibiotik, namun karena
pemejanan yang terlampau sering dan pada jangka waktu yang lama
menyebabkan bakteri sudah beradaptasi sehingga antibiotik tidak berefek. Selain
dari proses adaptasi, bakteri tertentu juga sudah memiliki mekanisme resistensi
terhadap jenis antibiotik tertentu, misalnyaStaphylococcus yang resisten terhadap
penisilin G menghasilkan β-laktamase yang dapat menghancurkan obat aktif (Brooks, 2007). Resistensi ini kemudian menjadi suatu perhatian khusus untuk
dapat menemukan suatu teknik pengobatan baru yang dapat membunuh bakteri
resisten.
Manggis (Garcinia mangostanaL.) merupakan salah satu buah tropis yang
saat ini banyak dibicarakan dan diteliti khasiatnya. Manggis digunakan secara
tradisional sebagai phytomedicine di Asia Tenggara untuk pengobatan trauma,
diare, infeksi dan infeksi kulit, serta masalah gastrointestinal (Priyaet al., 2010).
Ekstrak buah manggis memiliki aktivitas antioksidan, antitumor,
antialergi, anti-inflamasi, antibakteri, dan antiviral. Senyawa yang berperan di
dalamnya adalah xanthone dari kulit buahnya. Senyawa xanthone ditemukan
dapat melawan beberapa bakteri, seperti S. aureus, P. aeruginosa, Salmonella
(antibakteri) yang potensial dari manggis dapat dijadikan suatu agen antimikroba
dan terobosan baru untuk terapiS. aureusyang resisten.
Penelitian sebelumnyamenemukan bahwa α-mangostin adalah kandungan senyawa yang cukup besar dalam kulit buah manggis. Kandungan senyawa ini
dapat terekstrak secara efektif dalam pelarut dengan kepolaran menengah, atau
bisa dikatakan semipolar (Pothitirat, Chomnawang, and Gritsanapan, 2010).
Proses ekstraksi tersebut dapat dimaksimalkan dengan penggunaan pelarut
bertingkat kepolarannya.
Penelitian ini merupakan uji aktivitas antibakteri dengan penekanan pada
bakteri S. aureus yang resisten amoksisilin. Bakteri S. aureus yang sudah dibuat
resisten diujikan pada hasil fraksinasi kulit buah manggis. Aktivitas antibakteri
ditunjukkan dengan zona hambat pada pertumbuhan di media dengan masa
inkubasi 24 jam. Tingkat potensi ditunjukkan dari besar zona hambat dalam difusi
sumuran.
1. Rumusan masalah
a. Berapa Kadar Hambat Minimum (KHM) bakteri Staphylococcus aureus
setelah perlakuan resistensi terhadap amoksisilin?
b. Apakah fraksi n-heksana, kloroform dan etanol kulit buah manggis
memiliki aktivitas antibakteri terhadap Staphylococcus aureus resisten
2. Keaslian penelitian
Sejauh penelusuran penulis, belum ada penelitian sejenis yang pernah
dilakukan. Penelitian sebelumnya yang terkait dengan aktivitas antibakteri
terhadapStaphylococcus aureusdari senyawa tanaman manggis antara lain :
a. Antioxidant and Antimicrobial Activities of Crude Extracts from Mangosteen
(Garcinia mangostanaL.) Parts and Some Essential Oilsoleh Palakawonget.
al.(2010).
b. Aktivitas Antibakteri Ekstrak Kulit Buah Manggis (Garcinia mangostana L.)
serta Kandungan Senyawa Aktifnya oleh Putra (2010).
c. Antimicrobial Activity of Pericarp Extract of Garcinia mangostanaLinn.oleh
Priyaet. al.(2010).
3. Manfaat penelitian
a. Manfaat teoritis. Penelitian ini diharapkan mampu menambah informasi
ilmu pengetahuan yang berguna bagi pengembangan obat antibakteri dari
tanaman dan menambah khasanah ilmu pengetahuan mengenai
pemanfaatan dan pengembangan aktivitas antibakteri dari tanaman
manggis, khususnya kulit buah manggis.
b. Manfaat praktis. Penelitian ini diharapkan mampu menambah pengetahuan
masyarakat mengenai kegunaan kulit buah manggis yang dapat
B. Tujuan Penelitian
1. Mengetahui Kadar Hambat Minimum (KHM) bakteri Staphylococcus aureus
setelah perlakuan resistensi terhadap amoksisilin.
2. Mengetahui aktivitas antibakteri fraksi n-heksana, kloroform dan etanol kulit
6
BAB II
PENELAAHAN PUSTAKA
A. Staphylococcus aureus
Staphylococcus aureus temasuk dalam famili Micrococcaceae dan
merupakan bakteri pyogenic cocci yang dapat menyebabkan infeksi supuratif
(infeksi diserai nanah). Bakteri ini berbentuk bulat atau bola dan koloninya seperti
anggur sehingga dinamakan Staphylococcus dan dinamakan aureus karena
warnanya yang kuning emas seperti matahari (Radji, 2010).
S. aureus dapat menetap di hidung, kulit dan saluran cerna sebagai flora
normal. Namun, S. aureus ini juga merupakan bakteri patogen yang dapat
menyebabkan penyakit berupa infeksi oportunistik, keracunan makanan pada
saluran cerna, renjat toksik, infeksi kulit, scalded skin syndrome dan pneumonia
pada saluran napas. S. aureus bersifat Gram-positif anaerob fakultatif penghasil
enzim katalase. S. aureus dapat tumbuh karena melakukan respirasi aerob atau
fermentasi menghasilkan asam laktat. Bakteri ini dapat tumbuh pada 15-400C dan
NaCl 15% (Radji, 2010).
S. aureus adalah bakteri yang memiliki daya tahan paling kuat dan
memiliki faktor virulensi yang cukup banyak. Protein permukaan yang
dimilikinya dapat mempermudah kolonisasi pada inang, toksinnya dapat merusak
jaringan sel inang sehingga akan memperparah penyakit yang timbul, dan bakteri
ini memiliki gen resistensi terhadap antimikroba tertentu sehingga bakteri kebal
S. aureus dapat menimbulkan penyakit melalui dua mekanisme, yaitu
kemampuan untuk memperbanyak diri dan dapat tersebar luas di jaringan serta
kemampuan memproduksi enzim dan toksin ekstraseluler. Infeksi yang
disebabkan oleh kemampuannya memperbanyak diri menjadi masalah yang cukup
signifikan di rumah sakit dan fasilitas kesehatan lainnya karena dapat
menyebabkan manifestasi seperti endokarditis, osteomyelitis dan pneumonia
(World Health Organization, 2004).
B. Amoksisilin dan Resistensinya
Penisilin didapatkan dari kapang genus Penicillium. Kelompok antibiotik
ini memiliki struktur dasar yang khas dengan adanya cincin tiazolidin melekat
pada cincin β-laktam yang membawa gugus amino bebas. Amoksisilin termasuk keluarga penisilin dengan kelebihan pada absorpsinya yang lebih baik dan kadar
dalam darah yang lebih tinggi (Brooks, 2007).
Antibiotik golongan ini dapat teraktivasi melawan bakteri bila terikat di
reseptor PBP(Penicillin Binding Protein). Setelah terikat, sintesis peptidoglikan
dihambat bersamaan dengan dihambatnya transpeptidase akhir. Adanya inaktivasi
inhibitor enzim autolitik pada dinding sel akan menyebabkan perlahan-lahan
dinding sel bakteri akan lisis dan menyebabkan kematian bakteri (Brooks, 2007).
Resistensi antimikroba adalah kemampuan dari mikroba, yaitu bakteri,
virus, parasit, atau fungi, untuk tumbuh dengan adanya senyawa kimia (obat) yang
secara normal akan membunuh atau menurunkan pertumbuhannya. Bakteri
non-resisten berkembang biak dan adanya pemberian obat (senyawa antimikroba)
kelompok non-resisten, tetapi dengan adanya pemberian obat tidak menyebabkan
bakteri mati dan tetap terus berkembang biak (NIAID, 2009).
Resistensi bakteri terhadap amoksisilin (dan golongan penisilin lainnya)
terbagi dalam beberapa kategori, antara lain :
1. Produksi β-laktamase yang dapat menghancurkan cincin β-laktam amoksisilin.
2. Ketiadaan reseptor PBP/perubahan reseptor PBP sehingga amoksisilin
tidak dapat diikat.
3. Aktivasi enzim autolitik dinding sel gagal sehingga hanya terjadi
inhibisi tanpa membunuh bakteri.
4. Tidak dapat menyintesis peptidoglikan karena sintesis dinding sel aktif
diperlukan untuk kerja amoksisilin (Brooks, 2007).
Bakteri yang terbukti resisten terhadap golongan penisilin adalah genus
Staphylococcusyang termasuk kategori satu. Staphylococcusdapat menghasilkan
β-laktamase sehingga pemberian antibiotik golongan penisilin sudah tidak efektif
C. Buah Manggis (Garcinia mangostanaL.)
Kedudukan tanaman manggis dalam sistematika (taksonomi) tumbuhan
berdasarkan Rukmana (2003) diklasifikasikan sebagai berikut.
Kingdom : Plantae (tumbuh-tumbuhan)
Divisi : Spermatophyta (tumbuhan berbiji)
Subdivisi : Angiospermae (berbiji tertutup)
Kelas : Dicotyledonae (biji berkeping dua)
Ordo : Guttiferales
Famili : Guttiferae
Genus :GarciniaL.
Spesies :Garcinia mangostanaL.
Gambar 1. Buah manggis (Garcinia mangostanaL.)
Manggis merupakan pohon hutan. Tinggi dapat mencapai kurang lebih 20
meter. Pertumbuhannya lambat, daun muda muncul 1-2 kali setahun sebab akar
sampingnya hanya sedikit. Tanaman manggis dapat hidup pada dataran rendah
hingga ketinggian 600 m dpl dengan tipe iklim basah. Kulit kayu dapat digunakan
untuk ramuan obat tradisional penyakit perut. Kulit buah mengandung zat kimia
Senyawa hasil isolasi G. mangostana menunjukkan ada 14 senyawa
kandungan, antara lain : 8-hydroxycudraxanthone, mangostingone [7-methoxy
-2-(3-methyl-2-butenyl)-8-(3-methyl-2-oxo-3-butenyl)-1, 3, 6-trihydroxyxanthone],
cudraxanthone G, 8-deoxygartanin, garcimangosone B, garcinone D, garcinone
E, gartanin, 1-isomangostin, α-mangostin, γ-mangostin, mangostinone,
smeathxanthoneA dantovophyllin(Jung, 2006).
D. Ekstraksi
Ekstraksi merupakan suatu upaya pemisahan senyawa yang diinginkan
dari suatu campuran penyusun yang lainnya. Hal yang paling sering dilakukan
adalah menggunakan pelarut, tetapi bisa juga dengan cara mekanis. Cara mekanis
ini dilakukan dengan pemerasan, atau memberikan gaya tertentu agar senyawa
yang diinginkan tadi dapat terpisah dari campurannya (Pudjaatmaka, 2002).
Menurut Harborne (cit. Dewi, 2010), pada umumnya zat terekstrak yang
diinginkan bersifat tidak larut atau larut sedikit dalam suatu pelarut tetapi akan
lebih mudah larut dalam pelarut lain. Metode ekstraksi yang tepat akan
menghasilkan rendemen yang lebih banyak dan ditentukan oleh sifat kandungan
senyawa dan kandungan air dari bahan yang akan diekstrak.
Maserasi termasuk salah satu metode ekstraksi yang dilakukan dengan
merendam bagian tumbuhan dalam pelarut yang sesuai. Perendaman dilakukan
selama periode waktu tertentu, mulai dari beberapa jam hingga tiga minggu,
E. Uji Aktivitas Antibakteri
Penentuan sensitivitas bakteri patogen terhadap obat-obatan antimikroba
dapat dilakukan dengan salah satu dari dua metode utama : dilusi atau difusi.
Metode-metode tersebut dapat dilakukan untuk memperkirakan potensi antibiotik
dalam sampel maupun sensitivitas mikroorganisme dengan menggunakan
organisme uji standar yang tepat dan sampel obat tertentu untuk perbandingan
(Brooks, 2007).
Teknik difusi cakram digunakan oleh sebagian besar peneliti untuk tes
rutin aktivitas antimikroba. Sebuah cakram kertas saring diberikan suatu
antimikroba dengan konsentrasi dan volume tertentu, dan diletakkan di media
agar yang telah diinokulasikan organisme uji. Antimikroba berdifusi dari cakram
ke media, lalu menghambat pertumbuhan organisme uji sejauh jarak dari cakram
yang menunjukkan sensitivitas organisme uji. Strain yang rentan terhadap
antimikroba tersebut dihambat sejauh jarak tertentu dari cakram, sedangkan yang
resisten memiliki zona hambat yang lebih kecil (Cheesbrough,2006).
Teknik dilusi dapat mengukur Kadar Hambat Minimum (KHM) dan Kadar
Bunuh Minimum (KBM). Teknik dilusi dikerjakan dengan cara menambahkan
senyawa antimikroba ke dalam media agar atau kaldu (broth). Organisme uji yang
telah distandarisasi kemudian ditambahkan. Setelah inkubasi selama satu hari,
KHM dinyatakan sebagai konsentrasi terendah antimikroba diperlukan untuk
mencegah pertumbuhan yang terlihat sedangkan KBM adalah konsentrasi
Bakteri hanya akan tumbuh di area di mana konsentrasi antibiotik sangat
rendah untuk menghambat pertumbuhan bakteri. Pada akhir masa inkubasi, plate
diperiksa adanya inhibisi dari pertumbuhan bakteri dengan mengukur diameter
zona hambat di sekeliling kertas cakram (paper disk). Secara umum, zona hambat
yang lebih besar mengindikasikan senyawa antibiotik yang lebih aktif melawan
bakteri (Lee, 2009).
F. Landasan Teori
Staphylococcus aureus merupakan penyebab infeksi yang cukup banyak
dan mendapat perhatian khusus di dunia. S. aureus ini membawa pada suatu
insidensi penyakit yang cukup banyak dan mematikan. Penyakit infeksi yang
ditimbulkannya antara lain infeksi kulit, diare, masalah pencernaan dan sampai
pneumonia. Titik berat pada S. aureus adalah karakteristiknya yang memiliki
penisilinase dapat menimbulkan suatu mekanisme resistensi terhadap obat
antimikroba lini pertama, khususnya antibiotik golongan β-laktam.
Manggis telah banyak diteliti sebagai suatu pengobatan yang cukup ampuh
melawan berbagai penyakit, salah satunya antibakteri. Banyak penelitian
menyebutkan bahwa manggis memiliki aktivitas antibakteri melawan beberapa
penyakit, termasuk pada bakteri S. aureus. Manggis potensial untuk
dikembangkan sebagai agen antibakteri.
Pengujian aktivitas antibakteri dilihat data zona hambat yang diperoleh
dari pengujian secara difusi sumuran terhadap bakteriS. aureus yang sudah dibuat
G. Hipotesis
1. Kadar hambat minimum (KHM) bakteri Staphylococcus aureus meningkat
setelah perlakuan resistensi terhadap amoksisilin.
2. Fraksi n-heksana, kloroform dan etanol kulit buah manggis memiliki aktivitas
14
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental murni dengan
rancangan penelitian acak lengkap pola satu arah. Penelitian dilakukan di
Laboratorium Mikrobiologi dan Laboratorium Farmakognosi-Fitokimia, Fakultas
Farmasi Universitas Sanata Dharma, Yogyakarta.
B. Variabel dan Definisi Operasional
1. Variabel penelitian
a. Variabel bebas : bakteri S. aureus sebelum dan sesudah perlakuan
resistensi amoksisilin dan berbagai kadar fraksi n-heksana, kloroform serta
etanol kulit buah manggis (%).
b. Variabel tergantung : KHM (µg/mL) dan diameter zona hambat
pertumbuhanStaphylococcus aureus(mm) setelah perlakuan resistensi.
c. Variabel pengacau terkendali, yaitu : media penanaman bakteri (MHA),
suhu inkubasi (370C) dan lama inkubasi (24 jam), kepadatan suspensi
bakteri uji setara dengan larutan standar Mc Farland 0,5 (1,5.108
CFU/mL), diameter sumuran (8 mm).
d. Variabel pengacau tak terkendali : umur tanaman dan waktu panen
2. Definisi operasional
a. Fraksi n-heksana, kloroform dan etanol kulit buah manggis adalah fraksi
yang dihasilkan dari proses maserasi dengan ketiga pelarut secara
berurutan yang berasal dari kulit buah tanaman manggis.
b. Bakteri resisten adalah bakteri Staphylococcus aureus yang masih
bertahan hidup setelah dikulturkan beberapa kali selama satu bulan pada
media mengandung amoksisilin di bawah konsentrasi KHM secara adaptif
gradual.
c. Kontrol pelarut dalam penelitian ini adalah DMSO 100% (fraksi
n-heksana dan kloroform) dan aquadest steril (fraksi etanol) yang digunakan
sebagai pelarut ekstrak serta pembanding.
d. KHM (Kadar Hambat Minimal) adalah konsentrasi amoksisilin terendah
yang masih dapat menghambat pertumbuhan Staphylococcus aureus
resisten amoksisilin.
e. Zona hambat adalah daerah yang menunjukkan adanya penurunan
pertumbuhan atau tidak adanya pertumbuhan bakteri Staphylococcus
aureus di sekitar lubang sumuran, menunjukkan kepekaan mikroba
terhadap ketiga fraksi kulit buah manggis dan kecepatan berdifusi ketiga
fraksi dalam media.
f. Metode difusi secara sumuran adalah metode yang digunakan untuk
mengukur daya hambat ketiga fraksi terhadap Staphylococcus aureus
C. Bahan Penelitian
Kulit buah tanaman manggis diperoleh dari Manukan, Sleman,
Yogyakarta, n-heksana (PT. Bratachem), kloroform (PT. Bratachem), etanol 70%
(CV. Progo Mulyo), kultur murniStaphylococcus aureus yang didapat dari Balai
Kesehatan Yogyakarta, media MHA (Mueller Hinton Agar) dan MHB (Mueller
Hinton Broth) dari Merck, larutan standar Mc Farland 0,5 (1,5.108 CFU/mL),
aquadest steril (PT. Otsuka), dimetil sulfoksida (DMSO) dari Merck, amoksisilin
injeksi (PT. Phapros) dancefotaximeinjeksi (PT. Phapros).
D. Alat Penelitian
Oven (Memmert), incubator (Heraeus), autoklaf, Microbiological Safety
Cabinet, shaker (Optima), rotary vacuum evaporator (Buchi Labortechnik AG
CH-9230), waterbath (Memmert), jangka sorong (Vernier Caliper), timbangan
digital, ayakan, kertas saring, tabung reaksi, cawan petri, jarum ose, vortex,
pelubang sumuran, mikropipet (Socorex), tabung eppendorf, alat-alat gelas
(PYREX, dari Laboratorium Mikrobiologi Fakultas Farmasi Sanata Dharma
Yogyakarta).
E. Tata Cara Penelitian 1. Pengumpulan bahan kulit buah manggis
Kulit buah manggis diperoleh dari daerah Manukan, Sleman, Yogyakarta.
Kriteria kulit buah yang digunakan dalam penelitian ini adalah kulit buah dari
2. Pembuatan serbuk simplisia kulit buah manggis
Kulit buah manggis yang telah dikumpulkan dicuci bersih, kemudian
dikeringkan sampai kering dengan ciri kulit buah menjadi keras dan terasa dingin.
Setelah itu kulit buah diserbuk menggunakan penggiling kopi dan diayak
menggunakan ayakan nomor 18.
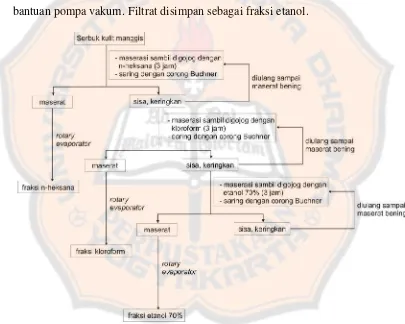
3. Pembuatan fraksi n-heksana, kloroform dan etanol kulit buah manggis
Sebanyak 25 g serbuk kulit buah manggis dimasukkan labu Erlenmeyer
dan direndam dalam n-heksana sampai semua serbuk terendam dan terbasahi.
Setelah serbuk terbasahi, n-heksana ditambahkan sampai setinggi ±1,5-2 cm dari
permukaan atas serbuk. Kemudian digojog dengan shaker pada suhu kamar
selama 3 jam dengan putaran 160 rpm dan disaring menggunakan kertas saring
dan corong Buchner dengan bantuan pompa vakum. Filtrat disimpan sebagai
fraksi n-heksana. Proses ekstraksi diulang kembali (remaserasi) sampai semua
senyawa terekstrak ditandai dengan pelarut yang mendekati bening. Serbuk kulit
manggis dikeringanginkan dari pelarut n-heksana. Setelah kering, serbuk
dimasukkan kembali dalam labu Erlenmeyer dan direndam dengan kloroform
sampai terbasahi dan terendam. Setelah serbuk terbasahi, kloroform ditambahkan
sampai setinggi ±1,5-2 cm dari permukaan atas serbuk. Kemudian digojog dengan
shaker pada suhu kamar selama 3 jam dengan putaran 160 rpm dan disaring
menggunakan kertas saring dan corong Burchner dengan bantuan pompa vakum.
Filtrat disimpan sebagai fraksi kloroform. Proses ekstraksi diulang kembali
mendekati bening. Serbuk kulit manggis dikeringanginkan dari pelarut kloroform.
Setelah kering, serbuk dimasukkan kembali dalam labu Erlenmeyer dan direndam
dengan etanol 70% sampai terbasahi dan terendam. Setelah serbuk terbasahi,
etanol 70% ditambahkan sampai setinggi ±1,5-2 cm dari permukaan atas serbuk.
Kemudian digojog denganshakerpada suhu kamar selama 3 jam dengan putaran
160 rpm dan disaring menggunakan kertas saring dan corong Buchner dengan
bantuan pompa vakum. Filtrat disimpan sebagai fraksi etanol.
Gambar 2. Skema fraksinasi serbuk kulit manggis
Ketiga filtrat kemudian diuapkan pelarutnya menggunakanvacuum rotary
evaporatorsampai berkurang jumlah pelarutnya dengan suhu 500C untuk fraksi
n-heksana dan kloroform, 600C untuk fraksi etanol. Evaporasi kemudian dilanjutkan
tetap, yaitu selisih penimbangan dari dua kali penimbangan berturut-turut setelah
pemanasan di atas waterbath selama satu jam tidak lebih dari 0,5 mg tiap gram
sisa yang ditimbang.
4. Penentuan nilai kadar hambat minimum (KHM) Staphylococcus aureus sebelum dan sesudah perlakuan resistensi dengan metode dilusi padat
Media MHA steril cair suhu ± 40-500C dengan volume tertentu, sesuai
konsentrasi akhir amoksisilin yang diinginkan, ditambahkan sejumlah amoksisilin
yang telah dilarutkan dalam aquadest steril dan digojog. Kemudian ditambahkan 1
mL suspensi bakteri uji yang telah disetarakan dengan larutan standar Mc Farland
0,5 dan digojog. Selanjutnya, dituang dalam cawan petri steril secara pour plate
dan diinkubasi selama 24 jam secara terbalik pada suhu 370C. Pertumbuhan
bakteri ditandai dengan keruhnya media. Nilai KHM dapat ditentukan dengan
membandingkan kejernihan media yang ditambahkan amoksisilin berbagai
konsentrasi dengan kontrol media tanpa bakteri dan kontrol pertumbuhan bakteri
secara visual. Media uji konsentrasi tertentu yang menunjukkan kejernihan
kemudian dilakukan uji penegasan untuk meyakinkan bahwa konsentrasi tersebut
adalah KHM. Uji penegasan dilakukan dengan menginokulasikan bakteri dari
media uji yang jernih pada media steril yang baru secara streak plate. KHM
merupakan konsentrasi terendah yang mampu menghambat pertumbuhan bakteri,
ditunjukkan dengan masih tumbuhnya bakteri pada bekas goresan. Kontrol media
dibuat dengan cara menuangkan media MHA steril cair tanpa penambahan bakteri
uji pada cawan petri steril dan dibiarkan hingga memadat. Kontrol pertumbuhan
± 40-500C dan digojog. Kemudian dituang ke dalam cawan petri steril secara pour
plate.
5. Pembuatan Staphylococcus aureus resisten amoksisilin dengan metode adaptif gradual
Sebanyak 120 µL larutan amoksisilin konsentrasi 10 µg/mL ditambahkan
ke dalam sejumlah media MHA steril cair dengan suhu ± 40-500C sehingga
didapatkan konsentrasi akhir amoksisilin dalam media sebesar 0,08 µg/mL
(konsentrasi substandar di bawah 0,1 µg/mL). Kultur murni bakteri
Staphylococcus aureussebanyak 1 mL diinokulasikan ke media MHA yang telah
ditambahkan amoksisilin, dan diinkubasikan selama 24 jam. Bakteri yang dapat
hidup/tumbuh dikulturkan lagi dengan teknik goresan (streak) pada media
resistensi dalam tabung dengan konsentrasi substandar bertingkat. Langkah
tersebut diulangi sampai satu bulan. Bakteri yang dapat hidup sampai inkubasi
terakhir menjadi bakteri stok untuk langkah selanjutnya.
6. Pembuatan media resistensi dalam tabung
Media MHA yang telah disterilisasi dibiarkan agak dingin kira-kira
40-500C. Media ditambahkan sejumlah amoksisilin tertentu sesuai dengan
konsentrasi akhir yang diinginkan. Tabung dibiarkan dalam posisi miring sampai
memadat. Simpan di dalam almari es sampai digunakan.
7. Pembuatan suspensi bakteri uji
Suspensi bakteri uji dibuat dari bakteri stok Staphylococcus aureus,
tercampur merata. Kekeruhan disetarakan dengan larutan standar Mc Farland 0,5
(1,5.108CFU/ml).
8. Orientasi konsentrasi fraksi n-heksana, kloroform dan etanol kulit buah manggis
Ketiga fraksi yang akan diuji disiapkan dalam berbagai tingkatan
konsentrasi. Pelarut fraksi n-heksana dan kloroform adalah DMSO sedangkan
pelarut fraksi etanol adalah aquadest steril. Konsentrasi DMSO yang digunakan
diuji pada DMSO 5%, 10%, 50% dan 100% yang telah disiapkan sebelumnya
dengan aquadest steril. Konsentrasi DMSO yang dapat melarutkan fraksi
n-heksana dan kloroform dengan baik dipilih sebagai pelarut fraksi. Variasi
konsentrasi ketiga fraksi uji yang paling besar ditentukan sampai pelarut sukar
melarutkan fraksi. Kemudian dari konsentrasi yang paling besar tersebut
ditentukan empat konsentrasi di bawahnya sebesar setengah dari konsentrasi
sebelumnya.
9. Uji aktivitas antibakteri fraksi n-heksana, kloroform dan etanol kulit buah manggis dengan metode difusi sumuran
Metode yang digunakan adalah metode double layer dengan lapisan
bawah merupakan media tanpa perlakuan apapun (base layer agar) dan lapisan
atas merupakan media yang telah diinokulasikan suspensi bakteri uji (seed layer
agar).
Sebanyak 10 ml MHA steril dituang ke dalam cawan petri steril dan
dibiarkan memadat. Kemudian 1 ml suspensi bakteri uji diinokulasikan dalam 15
memadat. Lubang dibuat menggunakan pelubang sumuran no. 4, dibuat 7 lubang
sumuran pada media yang telah memadat sebagai tempat fraksi n-heksana (juga
kloroform dan etanol) kulit buah manggis dengan berbagai variasi konsentrasi,
kontrol positif dan kontrol pelarut. Pembuatan lubang hanya menembus lapisan
atas, lapisan bawah digunakan sebagai alas supaya fraksi tidak menembus pada
dasar cawan petri.
Fraksi n-heksana, kloroform, dan etanol kulit buah manggis dengan 5
variasi konsentrasi (1,5625%; 3,125%; 6,25%; 12,5%; 25%) dimasukkan pada
lubang sumuran yang tersedia, kontrol positif yang digunakan adalah cefotaxime
yang telah dilarutkan dalam aquadest steril dengan konsentrasi 100 µg/mL dan
kontrol pelarut yang digunakan adalah DMSO untuk fraksi n-heksana dan
kloroform serta aquadest steril untuk fraksi etanol. Volume yang diinokulasikan
adalah 50µl. Diinkubasi selama 24 jam, kemudian diamati dan diukur diameter
zona hambat yang dihasilkan.
F. Analisis Data
Analisis data menggunakan analisis statistik ANOVA satu arah untuk
mengetahui perbedaan hasil diameter zona hambat tiap konsentrasi senyawa uji
dengan kontrol negatif, kemudian dilanjutkan dengan ujipost hoc,uji variansi dan
23
BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi dan Pengumpulan Tanaman
Kulit buah manggis diperoleh dari daerah Manukan, Sleman, Yogyakarta,
dalam bentuk kulit buah segar. Kulit buah yang dipilih adalah kulit dari buah yang
sudah matang (masak) pohon. Kulitnya tebal dan berwarna merah keunguan.
Kebenaran tanaman yang digunakan dibuktikan dengan proses determinasi
mengacu pada United States Department of Agriculture, Agricultural Research
Service (USDA/ARS) (2010). Determinasi ini dilakukan untuk membuktikan
bahwa kulit buah yang digunakan dalam penelitian ini benar berasal dari tanaman
manggis. Berdasarkan determinasi yang dilakukan, didapatkan bahwa tanaman
yang dipakai dalam penelitian adalah benarGarcinia mangostanaL.
B. Pembuatan Serbuk Simplisia Kulit Buah Manggis
Kulit buah yang telah dikumpulkan dicuci terlebih dahulu untuk
menghilangkan pengotor yang masih mungkin ada. Kulit buah yang sudah bersih
kemudian dikeringkan hingga kering ditandai dengan keras dan tidak terasa
dingin. Proses penyerbukan kemudian dilakukan menggunakan penggiling kopi
hingga terbentuk serbuk halus. Penyerbukan ini berfungsi untuk meningkatkan
luas permukaan kontak dengan pelarut, sehingga saat proses ekstraksi dapat
C. Pembuatan Fraksi n-Heksana, Kloroform dan Etanol Kulit Buah Manggis
Serbuk kulit buah manggis yang telah siap kemudian diekstraksi
menggunakan tiga pelarut yang berbeda. Pelarut yang digunakan yaitu : n-heksana
(nonpolar), kloroform (semipolar), dan etanol 70% (polar). Penggunaan tiga
pelarut yang berbeda kepolarannya ini diharapkan dapat mengekstrak senyawa
yang lebih banyak dan terjadi fraksinasi dalam ketiga pelarut tersebut sesuai
kepolaran senyawa yang terkandung di dalamnya.
Proses ekstraksi ini sendiri dibantu dengan penggojogan dengan alat
shaker. Penggojogan ini bertujuan agar seluruh serbuk dapat kontak dengan
pelarut dan senyawa dapat terekstrak. Penggojogan juga membantu mempercepat
ekstraksi sehingga waktu ekstraksi lebih singkat dibandingkan jika serbuk hanya
direndam. Ekstraksi dengan metode seperti ini dapat disebut sebagai ekstraksi
mekanik.
Ekstraksi pertama dilakukan dengan pelarut n-heksana dengan harapan
memperoleh senyawa-senyawa nonpolar yang terkandung dalam kulit buah
manggis. Serbuk kulit buah manggis terlebih dahulu dibasahi dengan pelarut. Jika
sudah terbasahi seluruhnya, ditambahkan pelarut sampai ketinggian pelarut ±2 cm
dari permukaan serbuk pada labu Erlenmeyer. Penggojogan dilakukan selama tiga
jam dan kemudian disaring menggunakan kertas saring dengan bantuan pompa
vakum. Pompa vakum ini membantu penarikan pelarut dan juga pengeringan
serbuk karena sebelum diberikan pelarut yang sama untuk kedua kalinya, serbuk
harus dipastikan kering (bebas dari pelarut). Ekstraksi dihentikan dan diganti
pelarut pada proses ekstraksi sebelumnya mendekati bening yang menandakan
bahwa seluruh senyawa telah tersekstrak.
Filtrat yang didapatkan setelah penyaringan dipekatkan terlebih dahulu
menggunakan vacuum rotary evaporator. Suhu yang digunakan pada proses
evaporasi filtrat n-heksana dan kloroform adalah 500C, sedangkan pada etanol
adalah 600C karena titik didih etanol lebih tinggi daripada kedua pelarut
sebelumnya. Bila setelah proses pemekatan masih tersisa filtrat yang cukup
banyak, pemekatan bisa dibantu dengan waterbath. Filtrat dimasukkan dalam
cawan porselin dan dipanaskan dengan waterbath sampai diperoleh bobot tetap.
Bobot tetap adalah selisih penimbangan dari dua kali penimbangan berturut-turut
setelah pemanasan di atas waterbathselama satu jam tidak lebih dari 0,5 mg tiap
gram sisa yang ditimbang.
Tabel I. Penimbangan bobot tetap fraksi etanol
Keterangan Bobot (g) Selisih bobot
(mg)
Selisih bobot (mg) Bobot sisa (g)
Penimbangan awal 78,8235 -
-1 jam pemanasan 78,7778 45,7 0,58
2 jam pemanasan 78,7625 15,3 0,19
D. Identifikasi Bakteri
Bakteri uji yang digunakan dalam penelitian ini adalah Staphylococcus
aureus ATCC 25923 yang diperoleh dari Laboratorium Balai Kesehatan
Yogyakarta. Keaslian kultur murni ini dibuktikan dengan sertifikat hasil uji
E. PembuatanStaphylococcus aureusResisten Amoksisilin dengan Metode Adaptif Gradual
Staphylococcus aureus yang dibuat resisten terhadap antibiotik
amoksisilin diperlakukan dengan pemaparan amoksisilin terhadap bakteri
tersebut. Pemaparan dilakukan setiap hari selama jangka waktu satu bulan.
Peningkatan kepekaan atau resistensi pada S. aureus dicek dengan menguji
kenaikan nilai Kadar Hambat Minimum (KHM)-nya. KHM adalah konsentrasi
amoksisilin terendah yang dapat menghambat pertumbuhan bakteri, sedangkan
KBM adalah konsentrasi amoksisilin terendah yang dapat membunuh bakteri.
Uji pendahuluan yang harus dilakukan sebelum proses pemaparan
amoksisilin adalah menentukan nilai KHM. Nilai KHM inilah yang digunakan
sebagai dasar pemilihan berbagai konsentrasi perlakuan resistensi. KHM
ditentukan menggunakan metode dilusi padat. Parameter yang diamati adalah
kejernihan pada media yang telah diberi amoksisilin dan bakteri uji setelah 24 jam
inkubasi. Pada konsentrasi tertentu bakteri akan memperlihatkan tidak adanya
pertumbuhan bakteri sehingga media terlihat jernih seperti kontrol media.
Konsentrasi ini kemudian dicurigai sebagai KHM atau KBM dan harus dilakukan
streak penegasan untuk melihat konsentrasi tersebut termasuk KHM atau KBM.
Bekas goresan jarum ose yang masih menunjukkan adanya pertumbuhan bakteri
dinyatakan sebagai nilai KHM, sedangkan apabila tidak menunjukkan
pertumbuhan bakteri dinyatakan sebagai nilai KBM.
Penentuan nilai KHM dilakukan pada rentang konsentrasi 0,1 µg/mL; 0,25
µg/mL; dan 0,5 µg/mL. Ketiga konsentrasi ini menunjukkan kejernihan media,
terkecil diduga sebagai nilai KHM, kemudian dilakukanstreak penegasan ketiga
replikasi dari konsentrasi ini. Hasil streak penegasan menunjukkan masih ada
bakteri yang tumbuh pada bekas goresan. Hal ini menunjukkan pada konsentrasi
0,1 µg/mL adalah nilai KHMS. aureusterhadap amoksisilin.
Hasil ini masih perlu ditegaskan dengan menurunkan konsentrasi
amoksisilin yang diberikan. Uji yang kedua menggunakan konsentrasi 0,08
µg/mL; 0,1 µg/mL; dan 0,15 µg/mL. Hasil menunjukkan adanya kejernihan media
pada konsentrasi 0,15 µg/mL sehingga dilakukan streak penegasan. Streak
penegasan menunjukkan tidak ada bakteri yang tumbuh pada bekas goresan
sehingga disimpulkan konsentrasi ini sebagai KBM dan konsentrasi 0,1 µg/mL
sebelumnya sebagai KHM.
Penentuan nilai KHM S. aureus terhadap amoksisilin sebelum perlakuan
resistensi menghasilkan nilai sebesar 0,1µg/mL yang menurut Clinical and
Laboratory Standards Institute (CLSI) Vol. 32 (2012) termasuk kategori sensitif
terhadap amoksisilin (≤ 0,25 µg/mL), sehingga konsentrasi amoksisilin yang dipilih dalam perlakuan resistensi sebesar 0,08 µg/mL; 0,085 µg/mL; dan 0,09
µg/mL. Ketiga konsentrasi ini dilakukan bertahap selama satu bulan.
Tabel II. Hasil penentuan KHM sebelum perlakuan resistensi
Keterangan Replikasi I Replikasi II Replikasi III
Kontrol pertumbuhan ++++
Konsentrasi 0,08µg/mL ++ ++ +++
Konsentrasi 0,1µg/mL - -
-Konsentrasi 0,15µg/mL - -
-Konsentrasi 0,25µg/mL - -
-Konsentrasi 0,5µg/mL - -
-Kontrol media
Tabel II menunjukkan bahwa nilai KHM adalah 0,1 µg/mL. Konsentrasi
yang dipilih untuk perlakuan resistensi berada di bawah KHM, yaitu 0,08 µg/mL;
0,085 µg/mL; dan 0,09 µg/mL. Pada perlakuan resistensi pertama kali, digunakan
teknik pour plate untuk menanam bakteri. Amoksisilin yang ditambahkan ke
dalam media sebanyak 120µL dari stok larutan konsentrasi 10µg/mL sehingga
didapat konsentrasi amoksisilin dalam media sebesar 0,08 µg/mL. Sedangkan
pada perlakuan hari selanjutnya hingga satu bulan digunakan teknik streak plate
pada media MHA yang telah ditambahkan amoksisilin konsentrasi tertentu.
Konsentrasi amoksisilin ditingkatkan setiap 10 hari pemaparan.
Media resistensi yang digunakan adalah media MHA yang telah dibagi ke
dalam tabung-tabung reaksi bertutup sesuai dengan volume yang dibutuhkan
(volume total media dikurangi volume amoksisilin yang ditambahkan).
Amoksisilin ditambahkan setelah proses sterilisasi media dan volumenya
disesuaikan dengan konsentrasi amoksisilin akhir yang diinginkan (0,08 µg/mL;
0,085 µg/mL; dan 0,09 µg/mL).
Pembuatan media tidak bisa dilakukan sekaligus untuk perlakuan
subkultur satu bulan sebab mempertimbangkan stabilitas amoksisilin dan juga
kemungkinan kontaminasi media. Walaupun media ini disimpan dalam almari
pendingin, tetap ada kemungkinan kontaminasi yang timbul sehingga hanya
dilakukan pembuatan media untuk maksimal lima hari pemakaian.
Penggunaan antibiotik yang berlebihan sering menjadi penyebab
timbulnya resistensi dari bakteri (Graham, 2000 cit. Dzen, 2005). Pada proses
berulang setiap hari sehingga bakteri melakukan adaptasi dan masih dapat hidup
dengan adanya amoksisilin. Bakteri bereproduksi dan menyebar dengan secara
cepat dan efisien. Bakteri dapat beradaptasi terhadap lingkungannya dan berubah
sifatnya demi bertahan hidup. Jika sesuatu menghentikan kemampuannya untuk
tumbuh, seperti antimikroba, genetiknya bisa berubah agar tetap hidup (NIAID,
2009).
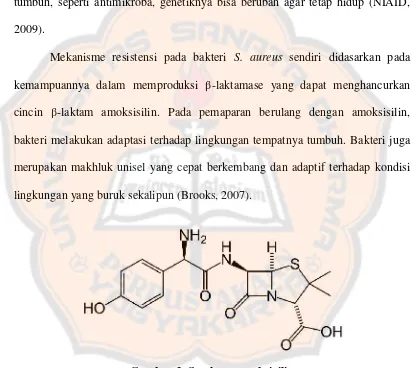
Mekanisme resistensi pada bakteri S. aureus sendiri didasarkan pada
kemampuannya dalam memproduksi β-laktamase yang dapat menghancurkan
cincin β-laktam amoksisilin. Pada pemaparan berulang dengan amoksisilin,
bakteri melakukan adaptasi terhadap lingkungan tempatnya tumbuh. Bakteri juga
merupakan makhluk unisel yang cepat berkembang dan adaptif terhadap kondisi
lingkungan yang buruk sekalipun (Brooks, 2007).
Gambar 3. Struktur amoksisilin
Bakteri yang masih dapat tumbuh sampai akhir perlakuan resistensi
ditumbuhkan dalam media kaya nutrisi tanpa amoksisilin sebagai stok untuk uji
aktivitas terhadap ketiga fraksi ekstrak kulit buah manggis. Stok ini selalu baru
dan dipersiapkan 24 jam sebelum uji aktivitas agar bakteri yang diuji berumur
Gambar 4. Perlakuan resistensi hari ke-10
Pada akhir perlakuan resistensi, diperlukan juga penentuan nilai KHM
untuk mengecek apakah telah terjadi kenaikan nilai KHM dan bakteri dapat
dinyatakan sudah resisten terhadap amoksisilin. KHM didapatkan juga dengan
metode dilusi padat. Pada penentuan KHM yang pertama diuji konsentrasi 14
µg/mL; 16 µg/mL; dan 18 µg/mL. Hasil menunjukkan pada replikasi ketiga,
bakteri masih tumbuh pada media sehingga perlu adanya kenaikan konsentrasi uji.
Penentuan KHM yang kedua dipilih konsentrasi dengan rentang yang lebih jauh,
yaitu 16 µg/mL; 20 µg/mL; dan 24 µg/mL. Ketiga konsentrasi tersebut
memperlihatkan tidak ada bakteri yang tumbuh setelah inkubasi. Oleh karena itu
pada konsentrasi terkecil, 16 µg/mL, dilakukan streak penegasan dan terlihat
masih adanya bakteri yang tumbuh sehingga konsentrasi ini dinyatakan sebagai
Menurut CLSI Vol.32 (2012), S. aureus dikatakan resisten terhadap
amoksisilin apabila nilai KHM ≥ 0,5µg/mL. Berdasarkan penentuan KHM akhir, didapatkan nilai KHM S. aureus sebesar 16µg/mL. Hal ini menunjukkan bahwa
telah terjadi peningkatan nilai KHM 160 kali dari nilai KHM awal dan dapat
disimpulkanS. aureus telah menjadi resisten terhadap amoksisilin. Bakteri inilah
yang kemudian dilakukan subkultur dan dijadikan stok bakteri untuk langkah
selanjutnya.
Tabel III. Hasil penentuan KHM setelah perlakuan resistensi
Keterangan Replikasi I Replikasi II Replikasi III
Kontrol pertumbuhan ++++
Konsentrasi 16µg/mL - -
-Konsentrasi 20µg/mL - -
-Konsentrasi 24µg/mL - -
-Kontrol media
-Keterangan: (+) = keruh, ada pertumbuhan bakteri (-) = bening, tidak ada pertumbuhan bakteri
Gambar 5. Perbandingan media uji (bawah) dengan kontrol pertumbuhan (kiri atas) dan kontrol media (kanan atas) pada penentuan nilai KHM
Kontrol Media Kontrol
Pertumbuhan
F. Pembuatan Suspensi Bakteri Uji
Bakteri uji perlu dipersiapkan dan disesuaikan jumlah koloninya agar
terlihat pertumbuhannya seragam dan reprodusibel tiap perlakuan. Suspensi
bakteri uji dipersiapkan secara langsung (direct) sebelum perlakuan. Suspensi
bakteri uji ini disetarakan dengan larutan standar Mac Farland 0,5 yang jumlah
koloninya setara dengan 1,5x108 CFU/mL. Proses penyetaraan ini hanya
menggunakan visual dengan parameter kekeruhan.
G. Uji Aktivitas Antibakteri Fraksi n-Heksana, Kloroform dan Etanol Kulit Buah Manggis dengan Metode Difusi Sumuran
Bakteri S. aureus yang telah dinyatakan resisten kemudian digunakan
sebagai bakteri uji pada uji aktivitas ketiga fraksi ekstrak kulit buah manggis. Uji
aktivitas antibakteri ini dilakukan dengan metode difusi sumuran. Metode ini
dipilih dengan mempertimbangkan kepolaran fraksi dan pelarut yang digunakan
sebagai pelarut fraksi. Fraksi n-heksana dan kloroform dapat larut dalam DMSO
(nonpolar) sedangkan fraksi etanol dapat larut dalam aquadest (polar), sehingga
metode yang cocok untuk semua fraksi adalah difusi sumuran.
DMSO dipilih sebagai pelarut bagi fraksi n-heksana dan kloroform karena
dapat melarutkan kedua fraksi lebih baik dibanding pelarut lainnya berdasarkan
orientasi. DMSO juga aman bagi bakteri sebab tidak menunjukkan adanya zona
hambat ketika diujikan pada bakteri S. aureus yang telah resisten amoksisilin.
Konsentrasi DMSO yang digunakan adalah 100% berdasarkan orientasi kelarutan
dan difusi sumuran pada bakteri. Orientasi kelarutan menguji DMSO pada
dengan aquadest steril pada bakteri uji dengan metode difusi sumuran. Hasil
orientasi ini menunjukkan bahwa semua variasi konsentrasi DMSO tidak
menimbulkan zona hambat sehingga aman bagi bakteri uji. Konsentrasi 100%
inilah yang dapat melarutkan kedua fraksi dan tetap tidak menimbulkan zona
hambat.
Uji aktivitas antibakteri dengan metode difusi sumuran digunakan untuk
melihat aktivitas antibakteri ketiga fraksi dengan parameter zona hambat yang
dihasilkan. Zona hambat sendiri menunjukkan adanya daerah penghambatan
pertumbuhan bakteri di sekitar sumuran tempat mendifusikan ketiga fraksi. Zona
hambat sendiri tidak selalu sebagai zona jernih karena terkadang penghambatan
masih menunjukkan adanya bakteri yang tumbuh tetapi pertumbuhannya lebih
tipis/sedikit daripada bagian yang tidak terdifusi. Pelubang sumuran yang
digunakan memiliki diameter lubang sebesar 8 mm.
Kontrol yang digunakan dalam difusi sumuran ini ada empat, yaitu kontrol
kontaminasi media, kontrol pertumbuhan bakteri uji, kontrol negatif/pelarut yang
digunakan untuk melarutkan fraksi dan kontrol positif. Kontrol kontaminasi media
bertujuan untuk melihat apakah media yang digunakan sudah steril. Kontrol
pertumbuhan bakteri uji bertujuan untuk melihat pertumbuhan normal pada media
tanpa perlakuan dan mengecek apakah bakteri uji dapat tumbuh baik dalam media
yang digunakan. Kontrol negatif/pelarut bertujuan untuk melihat apakah pelarut
yang digunakan dalam melarutkan fraksi juga memiliki aktivitas antibakteri
karena dalam uji ini, aktivitas antibakteri ketiga fraksi akan dibandingkan dengan
yang digunakan di pasaran sebagai terapi bagi penyakit yang diakibatkan bakteri
yang sudah resisten amoksisilin. Antibiotik yang digunakan adalah cefotaxime
(100µg/mL) yang selanjutnya juga dibandingkan zona hambatnya dengan
aktivitas antibakteri ketiga fraksi. Konsentrasi cefotaxime didapatkan dari
orientasi besarnya zona hambat yang dihasilkan ketika diuji dengan bakteri uji.
Cefotaxime adalah antibiotik generasi ketiga dari golongan sefalosporin.
Atibiotik golongan sefalosporin memiliki kemiripan struktur, mekanisme aksi,
spektrum dan farmakologi dengan penisilin. Keduanya berasal dari jamur dan
modifikasi sintetis.Cefotaximebanyak digunakan untuk infeksi Gram negatif dan
juga melawan S. pneumoniae, khususnya strain S. pneumoniae yang resisten
terhadap penisilin. Antibiotik ini juga mampu melawan, baik Streptococci
maupun organisme Gram negatif (Prince, 2004). Kemampuan cefotaxime dalam
melawan bakteri resisten penisilin menjadi dasar dipilihnya antibiotik ini sebagai
kontrol positif.
Gambar 6. Strukturcefotaxime
Pemilihan kontrol positif ini juga mempertimbangkan antibiotik yang
menyerupai obat yang beredar di pasaran, maka ekstrak ini dimungkinkan
menjadi pilihan alternatif pengganti obat.
Hasil diameter zona hambat yang didapat tiap seri konsentrasi dan kedua
kontrol diolah secara statistik menggunakan program R versi 3.1.0. Normalitas
distribusi data diuji dengan uji Shapiro-Wilk dan homogenitas data diuji dengan
uji Levene. Distribusi data yang normal dan homogen kemudian dilanjutkan
dengan ANOVA untuk selanjutnya dilakukan uji variansi dan uji t (ujipost hoc).
1. Uji aktivitas antibakteri fraksi n-heksana kulit buah manggis dengan metode difusi sumuran
Fraksi n-heksana yang diuji terlebih dulu disiapkan dalam berbagai seri
konsentrasi. Seri konsentrasi yang digunakan bertingkat dari 1,5625%; 3,125%;
6,25%; 12,5%; dan 25%. Seri konsentrasi ini dipilih berdasarkan orientasi pelarut.
Berdasarkan orientasi kelarutan fraksi, jumlah fraksi maksimum yang dapat larut
sebesar 25 mg dalam 100 µL DMSO (seri konsentrasi 25%).Seri konsentrasi yang
paling besar inilah kemudian menentukan empat konsentrasi di bawahnya. Empat
konsentrasi di bawahnya ditentukan sebesar setengah dari konsentrasi
sebelumnya. Pelarut yang digunakan adalah dimetil sulfoksida (DMSO) karena
berdasarkan orientasi, DMSO dapat membantu melarutkan dan mendifusikan
fraksi. Pembuatan seri konsentrasi ini dilakukan dalam eppendorf sebab rendemen
yang dihasilkan sedikit dan hanya digunakan sebanyak 50µL tiap lubang sumuran.
Tabel IV. Diameter zona hambat yang dihasilkan seri konsentrasi fraksi n-heksana, kontrol negatif dan kontrol positif
Kelompok Rerata ± SD
Diameter zona hambat (mm)
Konsentrasi 1,5625% 9 ± 0,19 Konsentrasi 3,125% 9 ± 0,24 Konsentrasi 6,25% 9 ± 0,30 Konsentrasi 12,5% 9 ± 0,40 Konsentrasi 25% 11 ± 0,53 Kontrol positif 17 ± 0,85
Kontrol negatif 8
* Diameter sumuran = 8 mm; n=3
Data diameter zona hambat yang diperoleh kemudian diuji normalitasnya
dengan Uji Shapiro-Wilk. Uji tersebut menunjukkan bahwa data terdistribusi
normal, kecuali pada kontrol negatif hasilnyaerrorkarena zona hambat sebesar 0
mm pada ketiga replikasi. Namun dalam uji ini, kontrol negatif dianggap normal
karena memang termasuk salah satu bahan pembanding terhadap seri konsentrasi
fraksi n-heksana. Uji normalitas diikuti dengan Uji Levene untuk melihat
homogenitas data. Uji ini menunjukkan bahwa data yang didapat homogen.
Kemudian dilanjutkan dengan ANOVA yang menghasilkan Pr(>F) sebesar
1,69x10-11.
Ujipost hocdilakukan untuk melihat apakah antar seri konsentrasi dengan
kontrol positif dan kontrol negatifnya berbeda bermakna atau tidak. Uji ini
dilakukan setelah ANOVA. Uji ini terdiri dari dua uji, yaitu Uji variansi dan Uji t.
Hasil uji variansi mendasari perhitungan pada uji t. Data uji post hoc yang
Tabel V. Hasilt-testdiameter zona hambat seri konsentrasi fraksi n-heksana, kontrol negatif dan kontrol positif
Kons
Keterangan : BB=berbeda bermakna; BTB=berbeda tidak bermakna
Data tabel V menunjukkan bahwa diameter zona hambat seri konsentrasi
fraksi n-heksana berbeda bermakna secara statistik terhadap kontrol positif
maupun kontrol negatif. Jika dibandingkan dengan kontrol negatif, seluruh seri
konsentrasi memiliki perbedaan daya hambat yang bermakna sebab kontrol
negatif sendiri tidak menghasilkan daya hambat. Pada kontrol positif, terlihat
adanya perbedaan yang bermakna dari daya hambatnya yang lebih besar daripada
perlakuan seri konsentrasi.
Seri konsentrasi fraksi n-heksana 25% secara statistik memiliki perbedaan
bermakna dengan konsentrasi seri yang lainnya. Hal ini menunjukkan bahwa pada
konsentrasi di bawah 25% tidak ada perbedaan daya hambat yang signifikan atau
bisa dikatakan sama walaupun zona hambat yang dihasilkan makin besar seiring
meningkatnya konsentrasi. Jika dibandingkan dengan kontrol positif maupun
tetapi zona hambatnya masih lebih kecil daripada kontrol positif. Bisa
disimpulkan bahwa seri konsentrasi 25% dapat menghambat pertumbuhan S.
aureusresisten amoksisilin tetapi tidak lebih baik daripada kontrol positif.
2. Uji aktivitas antibakteri fraksi kloroform kulit buah manggis dengan metode difusi sumuran
Fraksi kloroform dibuat dalam berbagai seri konsentrasi yang sama
dengan fraksi n-heksana dan dilarutkan dalam DMSO (1,5625%; 3,125%; 6,25%;
12,5%; 25%). Seri konsentrasi fraksi kloroform juga dibuat dalam eppendorf
mengingat penggunaannya yang tidak terlalu banyak untuk satu kali perlakuan.
Data diameter zona hambat yang dihasilkan disajikan dalam tabel VI.
Tabel VI. Diameter zona hambat yang dihasilkan seri konsentrasi fraksi kloroform, kontrol negatif dan kontrol positif
Kelompok Rerata ± SD
Diameter zona hambat (mm)
Konsentrasi 1,5625% 12 ± 0,23 Konsentrasi 3,125% 12 ± 0,22 Konsentrasi 6,25% 12 ± 0,23 Konsentrasi 12,5% 13 ± 0,09 Konsentrasi 25% 12 ± 0,52 Kontrol positif 18 ± 0,53
Kontrol negatif 8
* Diameter sumuran =8 mm; n=3
Data diameter zona hambat yang diperoleh kemudian diuji normalitasnya
dengan Uji Shapiro-Wilk. Uji tersebut menunjukkan bahwa data terdistribusi
normal, kecuali pada kontrol negatif hasilnyaerrorkarena zona hambat sebesar 0
mm pada ketiga replikasi. Namun dalam uji ini, kontrol negatif dianggap normal
karena memang termasuk salah satu bahan pembanding terhadap seri konsentrasi
fraksi kloroform. Uji normalitas diikuti dengan Uji Levene untuk melihat
Kemudian dilanjutkan dengan ANOVA yang menghasilkan Pr(>F) sebesar
2,05x10-13.
Gambar 7. Uji difusi sumuran fraksi kloroform (a:kontrol positif; b:kontrol negatif; c:konsentrasi 1,5625%; d:konsentrasi 3,125%; e:konsentrasi 6,25%;
f:konsentrasi 12,5%; g:konsentrasi 25%)
Ujipost hocdilakukan untuk melihat apakah antar seri konsentrasi dengan
kontrol positif dan kontrol negatifnya berbeda bermakna atau tidak. Uji ini
dilakukan setelah ANOVA. Uji ini terdiri dari dua uji, yaitu Uji Variansi dan Uji
t. Hasil uji variansi mendasari perhitungan pada uji t. Data uji post hoc yang
didapatkan disajikan dalam tabel VII.
Data tabel VII menunjukkan bahwa diameter zona hambat seri konsentrasi
fraksi kloroform berbeda bermakna secara statistik terhadap kontrol positif
maupun kontrol negatif. Jika dibandingkan dengan kontrol negatif, seluruh seri
konsentrasi memiliki perbedaan daya hambat yang bermakna sebab kontrol
adanya perbedaan yang bermakna dari daya hambatnya yang lebih besar daripada
perlakuan seri konsentrasi.
Tabel VII. Hasilt-testdiameter zona hambat seri konsentrasi fraksi kloroform, kontrol negatif dan kontrol positif
Kons
Keterangan : BB=berbeda bermakna; BTB=berbeda tidak bermakna
Seri konsentrasi fraksi kloroform 12,5% secara statistik memiliki
perbedaan bermakna dengan konsentrasi seri yang lainnya. Hal ini menunjukkan
bahwa pada konsentrasi di bawah dan di atas 12,5% tidak ada perbedaan daya
hambat yang signifikan atau bisa dikatakan sama. Hal ini juga menunjukkan
bahwa pada konsentrasi yang lebih besar (25%) tidak selalu daya hambat makin
besar. Daya hambat yang didapatkan tidak berbeda bermakna sehingga dalam
penggunaannya kelak dipilih konsentrasi yang lebih rendah sebab bahan yang
dibutuhkan tidak banyak dan tetap memiliki daya hambat yang baik.
Seri konsentrasi 12,5% memiliki perbedaan yang bermakna jika
dibandingkan dengan kontrol positif maupun kontrol negatif. Jika dibandingkan
daya hambatnya lebih kecil sehingga bisa dikatakan memiliki aktivitas
penghambatan pertumbuhan S. aureus resisten amoksisilin tetapi tidak lebih baik
daripada kontrol positif.
3. Uji aktivitas antibakteri fraksi etanol kulit buah manggis dengan metode difusi sumuran
Fraksi etanol yang akan diuji terlebih dulu disiapkan dalam berbagai seri
konsentrasi. Seri konsentrasi yang digunakan bertingkat dari 1,5625%; 3,125%;
6,25%; 12,5%; dan 25%. Pelarut yang digunakan adalah aquadest steril.
Pembuatan seri konsentrasi ini dilakukan dalam eppendorf sebab hanya digunakan
sebanyak 50µL tiap lubang sumuran. Pembuatan ini juga dilakukan hanya untuk
satu perlakuan tanpa penyimpanan mengingat stabilitasnya selama penyimpanan
karena akan terjadi endapan dan sulit untuk larut kembali. Data diameter zona
hambat yang dihasilkan disajikan dalam tabel VIII.
Tabel VIII. Diameter zona hambat yang dihasilkan seri konsentrasi fraksi etanol, kontrol negatif dan kontrol positif
Kelompok Rerata ± SD
Diameter zona hambat (mm)
Konsentrasi 1,5625% 8
Konsentrasi 3,125% 10 ± 1,14 Konsentrasi 6,25% 12 ± 0,96 Konsentrasi 12,5% 14 ± 1,08 Konsentrasi 25% 17 ± 1,72 Kontrol positif 18 ± 1,32
Kontrol negatif 8
* Diameter sumuran = 8 mm; n=3
Data diameter zona hambat yang diperoleh kemudian diuji normalitasnya
dengan Uji Shapiro-Wilk. Pada konsentrasi 1,5625% zona hambat tidak
ditemukan (zona hambat=0) sehingga pada perhitungan statistik data ini