AKTIVITAS ANTIMIKROB BAKTERIOSIN ASAL Lactobacillus
plantarum TERHADAP BERBAGAI BAKTERI PATOGEN
SELAMA PENYIMPANAN SUHU DINGIN
SKRIPSI
KHAIRUL BARIYAH
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2012
RINGKASAN
Khairul Bariyah D14070044. 2007. Aktivitas Antimikrob Bakteriosin asal Lactobacillus plantarum terhadap Berbagai Bakteri Patogen selama Penyimpanan Suhu Dingin. Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Dr. Irma Isnafia Arief S.Pt., M.Si. Pembimbing Anggota : Zakiah Wulandari S.TP., M.Si.
Masalah keamanan pangan masih merupakan kendala utama dalam produk makanan. Mutu dan keamanan pangan perlu diperhatikan karena dapat membahayakan kesehatan bagi konsumen. Alternatif dalam mengatasi masalah tersebut adalah dengan pengolahan dan pengawetan. Metode pengawetan yang telah banyak diaplikasikan adalah penambahan bahan pengawet pada makanan, baik bahan pengawet alami maupun yang sintetis. Pemilihan bahan pengawet yang sangat dianjurkan adalah bahan pengawet alami. Beberapa isolat asal daging seperti
Lactobacillus plantarum 1A5, 1B1, 2B2 dan 2C12 telah mampu menunjukkan aktivitas antimikrob melalui uji antagonistik terhadap bakteri patogen.
Penelitian ini bertujuan mempelajari aktivitas antimikrob plantarisin asal L. plantarum 1A5, 1B1, 2B2, dan 2C12 melalui sensitivitas plantarisin selama penyimpanan suhu dingin (10 °C) terhadap bakteri patogen yaitu Salmonella enteritidis ser. Typhimurium ATCC 14028, Eschericia coli ATCC 25922, Staphylococcus aureus ATCC 25923, Pseudomonas aeruginosa ATCC 27853 dan
Bacillus cereus. Penyimpanan di suhu dingin yang dilakukan selama 15 hari, melalui uji antagonistik dengan metode difusi sumur terhadap kelima bakteri indikator.
Proses karakterisasi diawali dengan pemeriksaan kemurnian isolat bakteri asam laktat dan bakteri patogen indikator melalui metode pewarnaan Gram. Proses selanjutnya yaitu memproduksi plantarisin1A5, 1B1, 2B2 dan 2C12 melalui tahapan purifikasi meliputi purifikasi parsial dengan menggunakan amonium sulfat, dialisis, dan purifikasi dengan menggunakan kromatografi pertukaran kation. Keempat galur
L. plantarum ditumbuhkan pada media de Man Rogosa and Sharpe broth (MRSB) yang disuplementasi dengan yeast extract (YE) 3%, lalu diinkubasi selama 20 jam, kemudian disentrifugasi pada kecepatan 10.000 rpm untuk mendapatkan supernatan antimikrob. Supernatan antimikrob disaring menggunakan membran saring Sartorius untuk mendapatkan supernatan bebas sel, yang kemudian pH supernatant dinetralkan menjadi 5,8 – 6,2. Proses purifikasi parsial siap dilakukan dengan menjenuhkan larutan dengan menggunakan amonium sulfat 80%. Presipitat plantarisin didapat dan didialisis dengan menggunakan membran dialisis. Proses dialisis akan menghasilkan plantarisin kasar, kemudian plantarisin kasar dimurnikan dengan teknik kromatografi pertukaran kation untuk memperoleh plantarisinmurni.
Hasil penelitian menunjukkan bahwa plantarisin asal galur L. plantarum 1A5, 1B1, 2B2, dan 2C12 setelah mengalami penyimpanan suhu dingin selama 15 hari masih mempunyai aktivitas antimikrob terhadap bakteri patogen indikator. Hal ini menunjukkan bahwa keempat plantarisin asal galur L. plantarum masih aktif setelah mengalami penyimpanan suhu dingin (10 °C).
Kata-kata kunci: L. plantarum, plantarisin, uji antagonistik, penyimpanan dingin
ABSTRACT
Antimicrobial Activity of Bacteriocins Produced by Lactobacillus plantarum against Patogenic Bacterias during Store at Cold Temperature
Bariyah, K., I.I. Arief and Z. Wulandari
Bacteriocins are antimicrobial substances produced by lactic acid bacteria (LAB) which can be used as a natural preservative. The preservative method which commonly used in storage under temperature of 4-10 °C. This method does not guarantee that it can inhibit the bacterial growth, such as psikrofil bacteria which still active on the refri temperature. The aim of this research was to study the stability of antimicrobia bacteriocins produced by L. plantarum 1A5, 1B1, 2B2, and 2C12 through its sensitivity during store at cold temperature (10 °C) againts the pathogenic bacteria that consists of Salmonella enteritidis ser. Typhimurium ATCC 14028, E. coli ATCC 25922, S. aureus ATCC 25923, P. aeruginosa ATCC 27853, and B. cereus. Plantaricin that was used is the result of cation exchange chromatography purification. Storage duration for 15 days and testing was done in intervals of 5 days. The antagonistic assay showed the antimicrobial activity against the pathogenic bacteria. The results showed that plantaricin 1A5, 1B1, 2B2, and 2C12 during cold storage temperature is still effective to be used for antagonistic assay to the pathogen indicator bacteria. Plantaricin of the four strains is able to inhibit bacterial growth indicators. Plantaricins has been stored for 15 days still have antimicrobial activity. This showed that the four plantaricins remained active after storage for 15 days at cool temperatures (10 °C).
AKTIVITAS ANTIMIKROB BAKTERIOSIN ASAL Lactobacillus
plantarum TERHADAP BERBAGAI BAKTERI PATOGEN
SELAMA PENYIMPANAN SUHU DINGIN
KHAIRUL BARIYAH D14070044
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2012
Judul : Aktivitas Antimikrob Bakteriosin Asal Lactobacillus plantarum terhadap Berbagai Bakteri Patogen Selama Penyimpanan Suhu Dingin Nama : Khairul Bariyah
NIM : D14070044
Menyetujui,
Pembimbing Utama, Pembimbing Anggota,
(Dr. Irma Isnafia Arief, S.Pt., M.Si.) NIP: 19750304 199903 2 001
(Zakiah Wulandari, S.TP., M.Si) NIP: 19750207 199802 2 001
Mengetahui : Ketua Departemen
Ilmu Produksi dan Teknologi Peternakan
(Prof. Dr. Cece Sumantri, M.Agr.Sc.) NIP : 19591212 198603 1004
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 20 September 1988 dari pasangan Bapak Husen dan Ibu Hasunah. Penulis merupakan anak ke empat dari empat bersaudara.
Penulis mengenal pendidikan formal di Taman Kanak-Kanak Rawdhatul Athfal pada tahun 1994 – 1995 kemudian melanjutkan ke pendidikan dasar pada tahun 1995–2001 di Madrasah Ibtidaiyah Al-Khairiyah Jakarta. Penulis melanjutan sekolah tingkat menengah pertama pada tahun 2001–2004 di Madrasah Tsanawiyah Al-Khairiyah Jakarta dan pendidikan lanjutan menengah atas pada tahun 2004–2007 di Madrasah Aliyah Al-Khairiyah Jakarta. Penulis diterima sebagai mahasiswa pada Program Studi Ilmu Produksi dan Teknologi Peternakan. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor melalui jalur undangan Seleksi Masuk IPB (USMI) pada tahun 2007.
Penulis aktif menjadi anggota Badan Eksekutif Mahasiswa (BEM), panitia Dekan Cup dan Panitia Masa Perkenalan Fakultas serta menjadi asisten praktikum mata kuliah Pengolahan Daging pada tahun 2009-2010 selama mengikuti pendidikan di IPB. Penulis adalah penerima Beasiswa BCA pada tahun 2009-2011.
Penulis melakukan penelitian selama enam bulan, sebagai salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Peternakan, Institut Pertanian Bogor. Penelitian yang dilakukan Penulis berjudul “Aktivitas Antimikrob Bakteriosin asal
Lactobacillus plantarum terhadap Berbagai Bakteri Patogen selama Penyimpanan Suhu Dingin”, di bawah bimbingan Dr. Irma Isnafia Arief, S.Pt, M.Si. dan Zakiah Wulandari S.TP, M.Si.
KATA PENGANTAR
Assalamua’alaikum wr.wb. “Alhamdulillah hirobil’alamin Penulis panjatkan kehadirat Allah SWT atas segala limpahan nikmat dan rahmat-Nya sehingga penulisan skripsi ini dapat diselesaikan. Shalawat dan salam tak lupa Penulis ucapkan kepada jujungan Nabi kita Muhammad SAW.
Penulis juga mengucapkan terima kasih kepada seluruh pihak yang telah memberi dukungan, baik secara moril maupun materil hingga skripsi yang berjudul “Aktivitas Antimikrob Bakteriosin asal L. plantarum terhadap Berbagai Bakteri Patogen selama Penyimpanan Suhu Dingin” ini dapat diselesaikan untuk memenuhi salah satu syarat memperoleh gelar Sarjana Peternakan pada Fakultas Peternakan Institut Pertanian Bogor.
Skripsi ini terkait dengan pengkajian lebih dalam mengenai substrat antimikrob yang dihasilkan bakteri asam laktat L. plantarum 1A5, 1B1, 2B2 dan 2C12 berupa plantarisin murni. Aktivitas plantarisin murni 1A5, 1B1, 2B2 dan 2C12 mampu menghambat pertumbuhan lima bakteri patogen indikator setelah melalui proses purifikasi parsial ammonium sulfat, dialisis dan kromatografi pertukaran kation pada perlakuan penyimpanan selama 15 hari pada suhu dingin. Komponen aktif yang bekerja sebagai antimikrob pada plantarisin murni 1A5, 1B1, 2B2, dan 2C12 merupakan komponen protein.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Besar harapan penulis agar skripsi ini dapat bermanfaat bagi seluruh pihak, khususnya dalam peningkatan keamanan pangan di Indonesia melalui biopreservatif alami. Saran dan kritik yang membangun sangat bermanfaat bagi Penulis.
Bogor, April 2012
Penulis
vii DAFTAR ISI
Halaman
RINGKASAN ……….. i
ABSTRACT ………... ii
LEMBAR PERNYATAAN ………... iii
LEMBAR PENGESAHAN ………... iv
RIWAYAT HIDUP ………... v
KATA PENGANTAR ………... vi
DAFTAR ISI ……… vii
DAFTAR TABEL ……… xi DAFTAR GAMBAR ………... x DAFTAR LAMPIRAN ……… xi PENDAHULUAN ……… 1 Latar Belakang ………. 1 Tujuan ……….. 2 TINJAUAN PUSTAKA ……….. 3
Bakteri Asam Laktat ……… 3
L. plantarum ………. 4
Bakteriosin ………... 4
Bakteri Patogen ……… 5
E. coli ….……….………... 6
Salmonella enteritidis ser. Typhimurium….………..…... 7
S. aureus ……….………... 7
P. aeruginosa ……….………... 8
B. cereus ………... 8
MATERI DAN METODE ……… 10
Lokasi dan Waktu ………. 10
Materi ………... 10
Prosedur ………. 10
Pemeriksaan Kemurnian Bakteri Asam Laktat ………… 10
Produksi Supernatan Bebas Sel Netral Asal Isolat L. plantarum 1A5, 1B1, 2B2 dan 2C12 ……. 11
Purifikasi Parsial dengan Menggunakan Presipitat Amonium Sulfat ……….. 13
Dialisis ………... 13
Purifikasi dengan Menggunakan Kromatografi Pertukaran Kation ………. 13
Karakteristik Plantarisin ……… 14
viii Aktivitas Antimikroba Terhadap Bakteri Patogen dan
Pembusuk Makanan (Salmonellaenteritidis ser. Typhimurium ATCC 14028, E. coli ATCC 25922, S. aureus ATCC 25923, P. aeruginosa ATCC 27853dan B.
cereus) ……….. 14
Rancangan dan Analisis Data ..………. 15
HASIL DAN PEMBAHASAN ……… 18
Pemeriksaan Kemurnian Isolat Bakteri Asam Laktat dan Bakteri Patogen Indikator ………. 18
Morfologi Sel ………... 18
Produksi Plantarisin ………... 22
Pengujian Konsentrasi Protein Plantarisin ………... 24
Pengaruh Lama Penyimpanan Plantarisin Murni Galur 1A5, 1B1, 2B2 dan 2C12 melalui Aktivitas Penghambatan Antimikrob pada Suhu Dingin ……….. 26
Pengujian Plantarisin terhadap Bakteri S. aureus ATCC 25923 .…………… 26
Pengujian Plantarisin terhadap Bakteri Salmonella enteritidis ser.Thypimurium ATCC 14028……... 28
Pengujian Plantarisin terhadap Bakteri P. aeruginosa ATCC 27853 ………. 29
Pengujian Plantarisin terhadap Bakteri E. coli ATCC 25922 ……... 30
Pengujian Plantarisin terhadap Bakteri B. cereus .…... 31
KESIMPULAN DAN SARAN ……… 33
Kesimpulan ………... 33
Saran ………. 33
UCAPAN TERIMA KASIH ……… 34
DAFTAR PUSTAKA ……….. 35
ix DAFTAR TABEL
Nomor Halaman
1. Penggunaan Padatan Amonium Sulfat ……… 12 2. Karakteristik L. plantarum 1A5, 1B1, 2B2 dan 2C12 serta Bakteri
Patogen Indikator Berdasarkan Uji Morfologi dan Pewarnaan Gram
………. 19
3. Kondisi pH Supernatan Bebas Sel dan Supernatan Netral .………. 23 4. Hasil Uji Antagonistik Supernatan Netral terhadap Bakteri Patogen
Indikator ………. 23
5. Konsentrasi Protein Plantarisin Asal L. plantarum pada Presipitat Plantarisin, Plantarisin Kasar dan Plantarisin Murni………...
25 6. Diameter Zona Hambat Plantarisin Asal Empat Galur L.plantarum
Selama Penyimpanan terhadap Bakteri S. aureus ATCC 25923 pada
Suhu Dingin (10 ºC)……… 26 7. Diameter Zona Hambat Plantarisin Asal Empat Galur L.plantarum
Selama Penyimpanan terhadap Bakteri Salmonella enteritidis ser.
Thypimurium ATCC 14028 pada Suhu Dingin (10 ºC) ………. 28 8. Diameter Zona Hambat Plantarisin Asal Empat Galur L.plantarum
Selama Penyimpanan terhadap Bakteri P. aeruginosa ATCC 27853
pada Suhu Dingin (10 ºC) ………... 29 9. Diameter Zona Hambat Plantarisin Asal Empat Galur L.plantarum
Selama Penyimpanan terhadap Bakteri E. coli ATCC 25922 pada
Suhu Dingin (10 ºC) …... 30 10. Diameter Zona Hambat Plantarisin Asal Empat Galur L.plantarum
Selama Penyimpanan terhadap Bakteri B. cereus pada Suhu Dingin
x DAFTAR GAMBAR
Nomor Halaman
1. Morfologi dan Hasil Pewarnaan Gram L. plantarum 1A5, 1B1,
2B2 dan 2C12 ………... 20 2. Morfologi dan Pewarnaan Gram Bakteri Indikator (S. aureus
ATCC 25923, Salmonella enteritidi ser.Typhimurium ATCC 14028, P. aeruginosa ATCC 27853, E. coli ATCC 25922 dan B.
xi DAFTAR LAMPIRAN
Nomor Halaman
1. Uji Kruskal-Wallis Diameter Zona Hambat Supernatan Netral L. plantarum terhadap Bakteri Indikator ………... 39 2. Uji Pembandingan Berganda Kruskal-Wallis Diameter Zona Hambat
Supernatan Netral L. plantarum terhadap Bakteri Indikator
……… 39
3. Uji Kruskal-Wallis Diameter Zona Hambat Supernatan Netral Asal
Empat Galur L. plantarum ………... 39 4. Uji Pembandingan Berganda Kruskal-Wallis Diameter Zona Hambat
Supernatan Netral Asal Empat Galur L. plantarum ……….. 40 5. Analisis Ragam Diameter Zona Hambat Plantarisin Asal Empat
Galur L. Plantarum selama Penyimpanan berbeda (H0-H15) terhadap
S. aureus ATCC 25923 pada Suhu Dingin (10 °C) .…... 40 6. Hasil Uji Tukey Konfrontasi Plantarisin Asal Empat Galur L.
plantarum selama Penyimpanan berbeda (H0-H15) terhadap S.
aureus ATCC 25923 pada Suhu Dingin (10 °C) .…... 40 7. Uji Kruskal Wallis Diameter Zona Hambat Plantarisin Asal Empat
Galur L. plantarum Selama Penyimpanan Berbeda (H0-H15)
terhadap Salmonella enteritidis ser.Thypimurium ATCC 14028 pada
Suhu Dingin (10 °C) ………... 41 8. Uji Kruskal Wallis Diameter Zona Hambat Plantarisin Asal L.
Plantarum Selama Penyimpanan Berbeda (H0-H15) terhadap
Salmonella entritidis ser. Thypimurium ATCC 14028 pada Suhu Dingin (10 °C) ……….. 41 9. Analisis Ragam Diameter Zona Hambat Plantarisin Asal Empat
Galur L. Plantarum Selama Penyimpanan Berbeda (H0-H15) terhadap P. aeruginosa ATCC 27853 pada Suhu Dingin (10 °C) …... 42 10. Hasil Uji Tukey Konfrontasi Plantarisin Asal Empat Galur L.
Plantarum Selama Penyimpanan Berbeda (H0-H15) terhadap P.
aeruginosa ATCC 27853 pada Suhu Dingin (10 °C) ……….. 42 11. Analisis Ragam Diameter Zona Hambat Plantarisin Asal Empat
Galur L. Plantarum Selama Penyimpanan Berbeda (H0-H15)
terhadap E. coli ATCC 25922 pada Suhu Dingin (10 °C) …………... 43 12. Hasil Uji Tukey Konfrontasi Plantarisin L. Plantarum Selama
Penyimpanan Berbeda (H0-H15) terhadap E. coli ATCC 25922 pada Suhu Dingin (10 °C) ………... 43
xii 13. Hasil Uji Tukey Konfrontasi Plantarisin Asal 4 Galur L. Plantarum
terhadap E. coli ATCC 25922 pada Suhu Dingin (10 °C) …………
43 14. Analisis Ragam Diameter Zona Hambat Plantarisin Asal Empat
Galur L. Plantarum Selama Penyimpanan Berbeda (H0-H15) terhadap B. cereus pada Suhu Dingin (10 °C) .………... 44 15. Hasil Uji Tukey Konfrontasi Plantarisin Asal Empat Galur L.
Plantarum Selama Penyimpanan Berbeda (H0-H15) terhadap B. cereus pada Suhu Dingin (10 °C) ………... 44 16. Tahapan Pembuatan Buffer Kalium Fosfat ……… 45 17. Gambar Konfrontasi Plantarisin Terhadap Bakteri Indikator …... 46
1 PENDAHULUAN
Latar Belakang
Masalah keamanan pangan (food safety) masih merupakan kendala utama dalam produk makanan. Mutu dan keamanan pangan perlu diperhatikan karena dapat membahayakan kesehatan bagi konsumen. Mikroorganisme patogen yang sering terdapat di dalam bahan pangan diantaranya Salmonella enteritidis ser. Typhimurium, E. coli, S. aureus, P. aeruginosa, dan B. cereus. Bakteri patogen tersebut beresiko menimbulkan penyakit bahkan kematian. Alternatif dalam mengatasi masalah tersebut adalah dengan pengolahan dan pengawetan pangan.
Metode pengawetan yang telah banyak diaplikasikan adalah penambahan bahan pengawet pada makanan, baik bahan pengawet sintetis maupun alami. Penggunaan pengawet sintetis dapat menyebabkan kemungkinan toksin akibat residu yang masih aktif, bahaya mikroorganisme yang resisten dan dapat menimbulkan infeksi pada konsumen. Penggunaan pengawet kimia yang dapat diserap bahan organik mengakibatkan efektivitas bahan pengawet alami berupa antimikrob yang dihasilkan oleh bakteri asam laktat berkurang. Penggunaan bahan pengawet alami lebih berpotensi untuk diaplikasikan sebagai pengganti pengawet sintetis.
Bakteriosin merupakan salah satu substansi antimikrob yang dihasilkan bakteri asam laktat dan memiliki aktivitas antagonistik, baik bakteriostatik maupun bakterisidal. Bakteriosin berpotensi digunakan sebagai bahan pengawet pangan alami yang aman untuk dikonsumsi, karena zat aktif yang terdapat dalam bakteriosin adalah protein yang dapat didegradasi oleh enzim proteolitik. Galur L. plantarum
1A5, 1B1, 2B2, dan 2C12 diketahui menghasilkan suatu senyawa antimikrob sebagai bakteriosin yang dapat menghambat pertumbuhan bakteri patogen di dalam bahan pangan.
Pendinginan merupakan salah satu metode pengawetan bahan pangan. Suhu pendinginan yang umum digunakan yaitu suhu refrigerator 4 – 10 °C. Metode pengawetan ini belum menjamin pertumbuhan bakteri pada bahan pangan, seperti golongan bakteri psikrofil terhambat. Penambahan bakteriosin dalam bahan pangan yang disimpan pada suhu dingin diharapkan mampu menjadi alternatif solusi dari kasus tersebut. Penelitian ini menggunakan suhu penyimpanan 10 °C karena
2 penyimpanan makanan di refrigerator. Plantarisin galur L. plantarum 1A5, 1B1, 2B2 dan 2C12 diharapkan masih memiliki aktivitas antimikrob selama penyimpanan suhu dingin (10 °C).
Tujuan
Penelitian ini bertujuan mempelajari aktivitas antimikrob bakteriosin asal L. plantarum 1A5, 1B1, 2B2 dan 2C12 melalui sensitivitas plantarisin selama penyimpanan di suhu dingin (10 °C) terhadap bakteri patogen yaitu Salmonella enteritidis ser. Typhimurium ATCC 14028, E. coli ATCC 25922, S. aureus ATCC 25923, B. cereus dan P. aeruginosa ATCC 27853.
3 TINJAUAN PUSTAKA
Bakteri Asam Laktat
Sifat yang terpenting dari bakteri asam laktat adalah memiliki kemampuan untuk memfermentasi gula menjadi asam laktat. Berdasarkan tipe fermentasi, bakteri asam laktat terbagi menjadi homofermentatif dan heterofermentatif. Kelompok homofermentatif menghasilkan asam laktat sebagai produk utama dari fermentasi gula, sedangkan kelompok heterofermentatif menghasilkan asam laktat dan senyawa lain yaitu CO2, etanol, asetaldehid, diasetil. Bakteri yang termasuk ke dalam bakteri
asam laktat adalah famili Lactobacillaceae, yaitu Lactobacillus, dan famili
Streptococcoceae, terutama Leuconostoc, Streptococcus dan Pediococcus. Streptococcus, Pediococcus dan beberapa spesies Lactobacillus bersifat homofermentatif, sedangkan Leuconostoc dan spesies Lactobacillus yang lain bersifat heterofermentatif (Fardiaz, 1992).
Bakteri asam laktat termasuk mikroorganisme yang aman jika ditambahkan dalam pangan karena bersifat tidak toksik dan tidak menghasilkan toksin. Bakteri ini secara luas didistribusikan pada susu, daging segar, sayuran dan produk-produk hasil olahan. Bakteri asam laktat juga disebut sebagai biopreservatif karena dapat menghambat pertumbuhan bakteri patogen dan mampu membawa dampak positif bagi kesehatan manusia (Smid dan Gorris, 2007).
Bakteriosin banyak diteliti karena berpotensi sebagai pengawet makanan alami dan dapat diaplikasikan di bidang farmasi. Beberapa jenis bakteriosin mempunyai spektrum yang luas dan mempunyai aktivitas menghambat terhadap pertumbuhan beberapa patogen makanan seperti Listeria monocytogenes dan S. aureus. Bakteri asam laktat didefinisikan sebagai bakteri pembentuk asam laktat dalam metabolisme karbohidrat dan terdiri atas berbagai macam kelompok bakteri Gram positif (Frazier dan Westhoff, 1998). Satu atribut penting dari bakteri asam laktat adalah memiliki kemampuan memproduksi komponen antimikrob, berupa bakteriosin yang potensial menjadi biopreservatif menggantikan pengawet kimiawi pada bahan makanan untuk memperpanjang umur simpan produk. Kemampuan bakteriosin sebagai biopreservatif dicapai dengan efek penghambatan terhadap mikroorganisme patogen yang berbahaya (Savadogo et al., 2006).
4 L. plantarum
L. plantarum merupakan salah satu jenis BAL (Bakteri Asam Laktat) homofermentatif dengan temperatur optimal lebih rendah dari 37 oC (Frazier dan Westhoff, 1998). L. plantarum berbentuk batang dan tidak bergerak (non motil). Bakteri ini memiliki sifat katalase negatif, aerob atau fakultatif anaerob, cepat mencerna protein, tidak mereduksi nitrat, toleran terhadap asam dan mampu memproduksi asam laktat. L. plantarum dalam media agar, membentuk koloni berukuran 2 – 3 mm, berwarna putih opaque, conveks dan dikenal sebagai bakteri pembentuk asam laktat (Kuswanto dan Sudarmadji, 1988). L. plantarum mampu merombak senyawa kompleks menjadi senyawa yang lebih sederhana dengan hasil akhir yaitu asam laktat. Menurut Buckle et al. (2007) asam laktat dapat menghasilkan pH yang rendah pada substrat sehingga menimbulkan suasana asam. Pertumbuhan L. plantarum dapat menghambat kontaminasi mikrooganisme patogen dan penghasil racun karena memiliki kemampuan untuk menghasilkan asam laktat dan menurunkan pH substrat. Selain itu bakteri asam laktat dapat menghasilkan hidrogen peroksida yang dapat berfungsi sebagai antibakteri. L. plantarum juga mempunyai kemampuan menghasilkan bakteriosin yang berfungsi sebagai zat antibiotik (Jenie dan Rini, 1995).
L. plantarum 1A5, 1B1, 2B2 dan 2C12 merupakan isolat indigenus yang diisolasi dari daging sapi lokal Indonesia (Arief et al., 2008). Senyawa antimikrob tersebut dapat menghambat pertumbuhan bakteri patogen E. coli, Salmonella enteritidis ser. Typhimurium, S. aureus. P. aeruginos dan B. cereus. Senyawa antimikrob yang diproduksi Lactobacillus sp. 1A5, 1B1, 2B2 dan 2C12 mengandung bakteriosin.
Bakteriosin
Bakteriosin adalah antibakteri protein kelompok heterogen yang berbeda dalam spektrum aktivitas, pola kerja, berat molekul, asal genetik, dan sifat biokimia (Omar et al., 2006). Bakteriosin umumnya dihasilkan oleh Bakteri Asam Laktat (BAL), yang memproduksi asam laktat sebagai produk utama metabolisme. Asam laktat memiliki kemampuan menghambat pertumbuhan mikroba dalam makanan, sehingga meningkatkan keamanan dan daya simpan pangan (Usmiyati et al., 2009).
5 Bakteriosin merupakan substansi protein, umumnya mempunyai berat molekul kecil serta memiliki aktivitas sebagai bakterisidal dan bakteriostatik. Pengujian bakteriosin dapat menggunakan metode difusi sumur, dengan indikator terdapat zona hambat di sekitar sumur. Diameter zona hambat yang terbentuk dapat berupa diameter zona bening di sekeliling sumur yang menunjukkan sifat bakterisidal (membunuh bakteri) maupun diameter zona semu yang merupakan sifat bakteriostatik (menghambat pertumbuhan mikroba). Bakteriosin merupakan protein atau peptida pada bakteri yang menunjukkan aksi bakterisidal ataupun bakteriostatik terhadap spesies yang umumnya berkerabat dekat namun terdapat pula beberapa jenis bakteriosin dapat menunjukkan spektrum yang lebih luas (Jimenez-diaz, 1993).
Sifat antagonistik bakteriosin telah banyak dimanfaatkan dalam bidang biopreservatif pangan, karena memiliki kemampuan menghambat bakteri Gram positif atau Gram negatif. Banyak bakteriosin dapat secara bakterisidal melawan spesies-spesies dan strain yang berkerabat dekat dengan bakteriosin tersebut, namun beberapa bakteriosin dapat secara efektif melawan banyak bakteri dari spesies dan genus yang berbeda (Ray dan Bhunia, 2008). Saat ini bakteriosin sudah mulai diterapkan sebagai salah satu biopreservatif karena bersifat alami dan tidak menyebabkan efek negatif pada konsumen. Molekul protein bakteriosin mengalami degradasi oleh enzim proteolitik dalam pencernaan manusia sehingga tidak membahayakan. Bakteriosin telah digunakan di negara maju sebagai biopreservatif pada bahan pangan karena memiliki kemampuan menghambat bakteri perusak dan patogen, serta tidak meninggalkan residu yang menimbulkan efek negatif pada manusia (Usmiyati et al., 2009).
Bakteri Patogen
Bakteri patogen merupakan mikroorganisme yang dapat menyebabkan penyakit. Bakteri tertentu dapat menyebabkan penyakit pada manusia. Beberapa jenis penyakit tersebut dapat dipindahkan melalui pangan, diantara penyakit yang disebabkan kerusakan pangan yaitu keracunan makanan, kolera dan tifus (Gaman dan Sherrington, 1992). Bakteri yang tumbuh di dalam bahan pangan terbagi menjadi dua yaitu bakteri pembusuk yang dapat menyebabkan kerusakan makanan dan bakteri patogen penyebab penyakit pada manusia. Jumlah bakteri pembusuk umumnya lebih dominan dibandingkan dengan bakteri patogen. Beberapa mikroba
6 yang diamati sebagai bakteri pembusuk dan patogen pada produk fermentasi adalah dari famili Enterobactericeae (Fardiaz, 1992).
Terdapat dua cara bakteri dapat menularkan penyakit pada manusia yaitu 1) intoksikasi, yaitu makanan mengandung toksin yang dihasilkan bakteri yang tumbuh di dalam makanan tersebut, dan 2) infeksi, yaitu penyakit yang disebabkan bakteri masuk ke dalam tubuh melalui makanan yang telah terkontaminasi dan ada reaksi dari tubuh terhadap keberadaan atau metabolit-metabolit yang dihasilkan bakteri selama tumbuh di dalam tubuh (Frazier dan Westhoff, 1998). Bakteri secara umum dibedakan menjadi dua bagian berdasarkan sifat pewarnaan Gram yaitu Gram positif dan Gram negatif. Bakteri Gram positif adalah bakteri yang memberi respon berwarna biru keunguan jika dilakukan uji pewarnaan Gram, sedangkan Gram negatif memberikan respon warna merah jika dilakukan uji pewarnaan Gram (Tortora et al., 2006).
E. coli
Bakteri ini merupakan bakteri Gram negatif. E. coli secara normal terdapat di dalam alat-alat pencernaan manusia dan hewan. Bakteri ini memiliki ciri-ciri umum yaitu bergerak, berbentuk batang, bersifat fakultatif anaerob dan termasuk golongan
Enterobacteriaceae. Suatu serotipe tertentu bersifat enterophatogenic dan dikenal sebagai penyebab diare pada bayi. Organisme ini berada di dapur dan tempat-tempat persiapan bahan pangan melalui bahan baku kemudian masuk ke makanan yang telah dimasak melalui tangan. Masa inkubasi bakteri ini yaitu selama 1 – 3 hari dan gejala-gejala yang muncul menyerupai gejala-gejala-gejala-gejala keracunan bahan pangan yang tercemar
Salmonella atau disentri (Buckle et al, 2007).
E. coli merupakan salah satu spesies jenis Escherichia dan disebut koliform fekal karena ditemukan di saluran usus hewan dan manusia, sehingga sering terdapat di dalam feses. Bakteri ini sering digunakan sebagai indikator kontaminasi kotoran (Fardiaz, 1992). E. coli dapat tumbuh optimum pada pH 7 – 7,5 dengan pH minimum 4 dan pH maksimum 8,5. Bakteri ini sensitif terhadap panas dan pada makanan yang mengalami pemanasan. Suhu optimum untuk pertumbuhan bakteri Escherichia coli
7 Salmonella enteritidis ser.Typhimurium
Salmonella merupakan bakteri Gram negatif. Salmonella memiliki ciri-ciri yaitu berbentuk batang, bergerak dan mempunyai tipe metabolisme yang bersifat fakultatif anaerob. Salmonella termasuk kelompok bakteri Enterobacteriaceae.
Salmonella telah dibedakan secara serologis dan diberi nama khusus. Salmonella typhimurium, Salmonella agona, dan Salmonella panama hanya sebagian kecil dari berbagai jenis mikroorganisme penyebab keracunan bahan pangan tipe gastroenteritis yang sudah lama dikenal. Salmonella penyebab gastroenteritis ditandai oleh gejala-gejala yang umumnya nampak 12 – 13 jam setelah makan bahan pangan yang tercemar. Gejala-gejala tersebut adalah berak-berak (diarrhea), sakit kepala, muntah-muntah, dan demam dan dapat berakhir selama 1-7 hari. Tingkat kematian kurang dari 1%, tetapi jumlah ini dapat meningkat pada anak-anak, orang tua, atau orang yang lemah. Tempat terdapatnya jenis mikroorganisme ini adalah pada alat-alat pencernaan hewan dan burung, baik yang telah diternakkan ataupun yang masih liar. Keracunan pangan karena Salmonella terutama berhubungan dengan daging sapi dan ayam yang baru dimasak, namun dapat beracun karena sesuatu hal yaitu pemasakan serta pengolahan yang kurang sempurna sebelum dikonsumsi (Buckle et al., 2007).
Salmonella sp. tumbuh pada tingkat keasaman antara 4,5 – 5,4 dengan pH optimumnya sekitar 7. Nilai pH minimum bervariasi tergantung pada suhu inkubasi, komposisi media, aw dan jumlah sel. Pada pH kurang dari 4,0 dan lebih dari 9,0
Salmonella akan mati secara perlahan (Adam dan Moss, 2007). S. aureus
S. aureus merupakan bakteri Gram positif. S. aureus memiliki ciri-ciri yaitu berbentuk bola berkelompok seperti buah anggur, bakteri ini tidak bergerak, fakultatif anaerob dan banyak tumbuh pada produk-produk yang mengandung NaCl sampai 16%. Produk-produk bahan pangan yang telah dimasak atau diasinkan, dengan organisme-organisme yang telah rusak karena pemanasan atau pertumbuhannya terhambat karena konsentrasi garam, sel-sel S. aureus dapat terus berkembang mencapai tingkat yang membahayakan. Gejala-gejala dari keracunan bahan pangan yang tercemar S. aureus adalah yang bersifat intoksikasi. Pertumbuhan organisme ini dalam bahan pangan menghasilkan racun enterotoksin yang apabila
8 termakan dapat menyebabkan serangan mendadak yaitu kekejangan pada perut dan muntah-muntah yang hebat (Buckle et al,. 2007).
Kebanyakan galur S. aureus bersifat patogen dan memproduksi enterotoksin yang tahan panas, ketahanan panas bakteri ini melebihi sel vegetatifnya. Beberapa galur, terutama yang bersifat patogenik, memproduksi koagulase (menggumpalkan plasma), bersifat proteolitik, lipolitik dan betahomolitik. Spesies lain yaitu
Staphylococcus epidermidis, biasanya tidak bersifat patogen dan merupakan flora normal yang terdapat pada kulit tangan dan hidung (Fardiaz, 1992). Suhu minimum pertumbuhan Staphylococcus aureus adalah 6 – 7 °C, suhu maksimum 45,5 °C, sedangkan suhu optimum pertumbuhan adalah 35 – 37 °C. Nilai pH optimum adalah 7 – 7,5 dengan kisaran pH 4 – 9,8. Bakteri ini memproduksi pigmen kuning sampai orange (Fardiaz, 1992).
P. aeruginosa
Pseudomonas merupakan salah satu jenis dalam kelompok
Pseudomonadaceae yang sering menimbulkan kebusukan makanan. Bakteri ini bersifat motil dengan flagella polar. Sifat-sifat penting Pseudomonas yang mempengaruhi pertumbuhan pada makanan adalah (1) umumnya mendapatkan sumber karbon dari senyawa yang bukan karbohidrat, (2) dapat menggunakan senyawa-senyawa nitrogen sederhana, (3) kebanyakan spesies tumbuh baik pada suhu rendah (bersifat psikrofilik, mesofilik dengan suhu optimum relatif rendah), kecuali P. aeruginosa dan P. fluorescens yang dapat tumbuh pada suhu 37 °C, (4) memproduksi senyawa-senyawa yang bau busuk, (5) dapat mensintesa faktor-faktor pertumbuhan dan vitamin, (6) beberapa spesies bersifat proteolitik (memecah protein) dan lipolitik (memecah lemak) dan pektinolitik (memecah pektin), (7) pertumbuhan pada posisi aerobik berjalan dengan cepat, dan biasanya membentuk lender, (8) tidak tahan terhadap panas dan keadaan kering, oleh karena itu mudah dibunuh dengan proses pemanasan dan pengeringan (Fardiaz, 1992).
B. cereus
Spesies Bacillus ada yang mempunyai sifat proteolitik kuat, sedang atau tidak bersifat proteolitik. Salah satu spesies yang bersifat proteolitik yaitu B. cereus, yang memproduksi enzim proteolitik bersifat menyerupai rennin sehingga dapat
9 menggumpalkan susu. Beberapa spesies Bacillus juga bersifat lipolitik (memecah lipid), sedangkan yang lain tidak bersifat lipolitik (Fardiaz, 1992).
Bakteri Bacillus merupakan Gram positif. B. cereus memiliki ciri-ciri berbentuk batang, bergerak, dapat membentuk spora, bersifat fakultatif anaerob dan tersebar secara luas dalam tanah dan air. Organisme ini sampai saat ini belum dapat dikatakan sebagai bakteri patogenik. Sejumlah keracunan akibat tercemarnya bahan pangan dengan bakteri ini banyak ditemukan pada daging saus berempah dan nasi goreng. Kemampuan Bacillus membentuk spora memungkinkan mikroorganisme ini tetap hidup pada operasi pengolahan dengan pemanasan. Gejala-gejala keracunan bahan pangan yang tercemar karena bakteri ini termasuk diare, sakit perut dan kadang muntah-muntah, tetapi belum jelas apakah ini merupakan suatu bentuk keracunan bahan pangan yang bersifat intoksikasi atau infeksi (Buckle et al., 2007).
10 MATERI DAN METODE
Lokasi dan Waktu
Penelitian ini dilaksanakan di Laboratorium Terpadu Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan Institut Pertanian Bogor. Kegiatan Penelitian dilaksanakan selama enam bulan dari April sampai September 2011.
Materi
Bahan-bahan yang digunakan dalam penelitian ini adalah isolat indigenus bakteri asam dari daging sapi lokal Indonesia yaitu L. plantarum 1A5, 1B1, 2B2 dan 2C12 serta bakteri indikator Salmonellaenteritidis ser. Typhimurium ATCC 14028,
E. coli ATCC 25922, S. aureus ATCC 25923, P. aeruginosa ATCC 27853 dan B. cereus, media De Man Rogosa and Sharpe Broth (MRSB), De Man Rogosa Sharp
Agar (MRSA), Yeast Extract (YE) 3%, NaCl 1%, NaOH 1 N, ammonium sulfat,
buffer kalium fosfat, resin SP Sepharose – Fast flow, media Mueller Hinton Agar
(MHA), Bacto Agar (BA), dan aquadest.
Alat-alat yang digunakan dalam penelitian ini adalah tabung reaksi, jarum Ose, cawan petri, tabung Erlenmeyer, membran saring Sartorius, gelas ukur, pipet volumetrik, mikro pipet, sentrifuse, incubator, refrigerator, membran dialisis, vortex, alumunium foil, kapas, bunsen, alkohol 70%, kertas saring, plastik PE, plastik wrap, oven, otoklaf, pH meter, neraca digital dan jangka sorong.
Prosedur
Pemeriksaan Kemurnian Bakteri Asam Laktat (Pelczar dan Chan, 2005)
Kultur starter yang telah diisolasi dari daging sapi pada penelitian sebelum- nya dikonfirmasi kembali untuk memastikan kemurnian kultur dengan cara ditumbuhkankan pada media De Man Rogosa Sharp Agar (MRSA) dengan metode
striking dan diinkubasi pada suhu 37 °C selama 24 jam, kemudian diambil satu koloni yang dianggap sebagai koloni bakteri asam laktat dan dimasukkan ke De Man Rogosa Sharp Broth (MRSB). Kultur ini disebut kultur stok. Setiap kultur stok dilakukan penyegaran pada media MRSB sebelum dilakukan pengujian. Sebanyak satu ml kultur diinokulasikan ke dalam media MRSB. Kultur kemudian diinkubasi pada suhu 37 °C selama 24 jam yang hasil ini disebut kultur kerja. Kultur kerja ini
11 yang digunakan untuk mengkonfirmasi bakteri uji. Uji yang dilakukan adalah uji pewarnaan Gram.
Pewarnaan Gram (Hadioetomo, 1990). Sampel bakteri dari koloni yang homogeny
dioleskan pada kaca objek kemudian difiksasi panas. Satu ose bakteri kemudian diteteskan dengan kristal violet selama satu menit, diratakan, dibilas dengan akuades dan dikering udarakan. Setelah kering, olesan bakteri diteteskan iodium dan diratakan kembali, kering udara selama dua menit, kemudian dibilas akuades dan ditiriskan. Preparat dicuci dengan pemucat warna yaitu alkohol 95% setetes demi setetes selama 30 detik, kemudian dicuci segera dengan akuades dan ditiriskan. Setelah kering, preparat diteteskan minyak imersi dan diamati di bawah mikroskop untuk melihat bentuk dan warna dinding sel setelah dilakukan pewarnaan. Bakteri yang termasuk dalam kelompok Gram positif akan menunjukkan warna ungu, sedangkan kelompok bakteri Gram negatif akan menunjukkan warna merah safranin. Produksi Supernatan Netral Asal Isolat L. plantarum 1A5, 1B1, 2B2 dan 2C12 (Todorov dan Dicks, 2005)
Sebanyak 500 ml media MRS-broth ditambah yeast extrack 3% dan NaCl 1% diinokulasikan dengan 10% (v/v) kultur L. plantarum. Terdapat empat galur L. plantarum yang digunakan untuk diperoleh bakteriosin yaitu L. plantarum 2C12, 1A5, 1B1, dan 2B2 yang telah disegarkan, selanjutnya diinkubasi pada suhu 37 °C selama 20 jam. Setelah selesai diinkubasi, L. plantarum disimpan pada refrigerator
suhu 4 °C selama dua jam dan dilakukan sentrifugasi pada kecepatan 10.000 rpm selama 20 menit suhu 4 °C. Setelah selesai, dilakukan penyaringan dengan menggunakan membran saring Sartorius berdiameter 0,22 µm yang selanjutnya supernatan bebas sel dari setiap galur L. plantarum dinetralkan menjadi pH 5,8 – 6,2 dengan menggunakan 1 N NaOH. Pengecekan pH menggunakan kertas lakmus dan pH meter dengan kalibrasi dua kali yaitu pH 7 dan pH 4. Supernatan bebas sel yang telah dinetralkan kemudian dilakukan uji antagonistik terhadap bakteri patogen
Salmonella ATCC 14028, E. coli ATCC 25922, S. aureus ATCC 25923, B. cereus
dan P. aeruginosa ATCC 27853. Pengujian ini dilakukan untuk mengetahui aktivitas penghambatan supernatan bebas sel galur 1A5, 1B1, 2B2 dan 2C12 pada bakteri patogen indikator.
12
Tabel 1. Penggunaan Padatan Ammonium Sulfat (% Penjenuhan)
Awal % 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100 Konsentrasi Akhir dari Padatan Ammonium Sulfat (g) / 1000 ml
0 10.6 13.4 16.4 19.4 22.6 25.8 29.1 32.6 36.1 39.8 43.6 47.6 51.6 55.9 60.3 65.0 69.7 10 5.3 8.1 10.9 13.9 16.9 20.0 23.3 26.6 30.1 33.7 37.4 41.2 45.2 49.3 53.6 58.1 62.7 20 0 2.7 5.5 8.3 11.3 14.3 17.5 20.7 24.1 27.6 31.2 34.9 38.7 42.7 46.9 51.2 55.7 25 0 2.7 5.6 8.4 11.5 14.6 17.9 21.1 24.5 28.0 31.7 35.5 39.5 43.6 47.8 52.2 30 0 2.8 5.6 8.6 11.7 14.8 18.1 21.4 24.9 28.5 32.3 36.2 40.2 44.5 48.8 35 0 2.9 5.7 8.7 11.8 15.1 18.4 21.8 25.8 29.6 32.9 36.9 41.0 45.3 40 0 2.9 5.8 8.9 12.0 15.3 18.7 22.2 26.3 29.6 33.5 37.6 41.8 45 0 3.0 5.9 9.0 12.3 15.6 19.0 22.6 26.3 30.2 34.2 38.3 50 0 3.0 6.0 9.2 12.5 15.9 19.4 23.5 26.8 30.8 34.8 55 0 3.1 6.1 9.3 12.7 16.1 20.1 23.5 27.3 31.2 60 0 3.1 6.2 9.5 12.9 16.8 20.1 23.9 27.9 65 0 3.2 6.3 9.7 13.2 16.8 20.5 24.4 70 0 3.2 6.5 9.9 13.4 17.1 20.9 75 0 3.3 6.6 10.1 13.7 17.4 80 0 3.4 6.7 10.3 13.9 85 0 3.4 6.8 10.5 90 0 3.4 7.0 95 0 3.5 100 0 Sumber : Simpson (2006)
13
Purifikasi Parsial dengan Menggunakan Presipitasi Ammonium Sulfat (Todorov dan Dicks, 2005)
Supernatan antimikrob yang telah disaring steril ditambahkan serbuk ammonium sulfat sebanyak 80% secara bertahap (20%, 40%, 60%, dan 80%) untuk menghasilkan endapan protein, kemudian dihomogenkan secara perlahan pada suhu 4 oC selama dua jam (Abo Amer, 2007). Tahapan ini dilakukan untuk menghasilkan endapan protein yang selanjutnya disebut presipitat bakteriosin. Presipitat dikoleksi pada tabung steril. Pengecekan protein dari presipitat bakteriosin diamati dengan menggunakan spektrofotometer UV-Vis pada absorbansi 280 nm.
Dialisis. Dialisis dilakukan dengan tujuan untuk desalting atau menghilangkan garam ammonium sulfat yang masih bercampur dengan presipitat bakteriosin. Buffer yang digunakan adalah buffer kalium fosfat pH 6,8 (campuran KH2PO4 dan K2HP04) dengan
perbandingan 1 : 1.000 (1 bagian presipitat dan 1.000 bagian buffer). Dialisis dilakukan dengan menggunakan membran dialisis berdiameter 20 pada buffer kalium fosfat selama 12 jam, dan dilakukan penggantian buffer sebanyak dua kali (2 dan 4 jam) pada suhu 4 °C. Setelah selesai, didapatkan ekstrak kasar bakteriosin. Pengecekan protein plantarisin hasil dialisis diamati menggunakan spektrofotometer UV-Vis pada panjang gelombang 280 nm.
Purifikasi dengan Menggunakan Kromatographi Pertukaran Kation (Hata et al., 2010)
Kolom diisi dengan resin SP Sepharose – fast flow. Buffer yang digunakan adalah buffer kalium fosfat pH 6,8. Kolom terlebih dahulu dipasangkan pada penjepit Bunsen kemudian buffer dituangkan ke dalam kolom. Setelah itu buffer dibuang secara perlahan. SP Sepharose secara perlahan dengan menggunakan pipet Pasteur dimasukkan ke dalam kolom, dan diusahakan supaya tidak ada udara (gas) yang masuk ke dalam kolom. Selanjutnya resin akan menjadi gel. Kemudian di atas resin diberikan buffer dan kolom disimpan pada refrigerator (4 °C).
Plantarisin hasil dialisis dimasukkan ke dalam kolom secara perlahan-lahan, dan di bawah kolom diberikan tabung penampung eluent yang keluar dari kolom. Eluent
pertama adalah buffer, sedangkan yang berikutnya adalah sampel plantarisin murni. Kecepatan alir yang diberikan adalah 0,8 ml/menit. Setelah selesai, dilakukan pencucian
14
dengan buffer kembali dan ditampung untuk mengambil eluent yang terikat pada gel (resin). Semua dilakukan pada suhu dingin (4 °C). Setelah selesai dalam beberapa tabung koleksi didapatkan eluent yang berisi plantarisin murni. Plantarisin murni disimpan pada suhu dingin (4 °C) dan protein plantarisin murni diukur dengan menggunakan spektrofotometer yang selanjutnya plantarisin murni siap untuk dianalisis sifat dan karakteristiknya.
Karakteristik Plantarisin (Hata et al., 2010)
Ketahanan terhadap Suhu. Uji ketahanan terhadap suhu sangat penting untuk mengetahui karakteristik aktivitas plantarisin sebagai antimikrob yang dapat diaplikasikan pada berbagai kondisi penanganan dan pengolahan pangan. Plantarisin murni hasil kromatografi kolom diuji ketahanannya setelah mengalami penyimpanan selama 15 hari yaitu 0, 5, 10, dan 15 hari pada suhu refrigerator (10 °C). Ketahanan terhadap suhu dilihat dengan menguji aktivitas antimikrob plantarisin murni hasil perlakuan lama penyimpanan dengan metode sumur. Zona hambat (baik zona bening maupun zona semu) yang terdapat disekitar sumur pada cawan yang berisikan bakteri patogen dan pembusuk, menunjukkan bahwa plantarisin tersebut masih memiliki aktivitas antagonistik selama penyimpanan terhadap bakteri patogen.
Aktivitas Antimikrob Plantarisin terhadap Bakteri Patogen dan Pembusuk Makanan (Salmonella enteritidis ser. Typhimurium ATCC 14028, E. coli ATCC 25922, S. aureus ATCC 25923, P. aeruginosa ATCC 27853, dan B. cereus).
Plantarisin murni hasil kromatografi kolom disiapkan dengan melarutkan 1:1 (v/v) plantarisin dengan buffer kalium fosfat. Metode yang digunakan adalah metode difusi sumur (Savadogo et al., 2006). Bakteri indikator (Patogen dan pembusuk makanan) sebanyak 106 cfu/ml yang berumur 24 jam diinokulasikan ke dalam cawan yang selanjutnya dituangkan media konfrontasi yaitu Mueller Hinton agar (MHA) sebanyak 15 – 20 ml. Setelah agar mengeras dan dingin, dibuat sumur pada cawan pada diameter lima mm.
Sumur yang telah dibuat, kemudian ke dalam sumur dituangkan 50 µl plantarisin murni kemudian cawan disimpan dalam refrigerator selama 2 jam untuk memberikan kesempatan plantarisin berdifusi kedalam agar. Setelah itu cawan diinkubasi pada suhu 37 °C selama 24 jam. Zona bening yang terbentuk disekitar sumur menandakan bahwa
15
plantarisin mampu menghambat bakteri indikator. Selanjutnya dilakukan pengukuran diameter zona bening (mm).
Rancangan dan Analisis Data
Rancangan dan analisis data meliputi perlakuan dan model statistik rancangan penelitian. Rancangan dan analisis data yang digunakan pada penelitian ini meliputi produksi plantarisin, uji antagonistik plantarisin murni 1A5, 1B1, 2B2, dan 2C12 terhadap bakteri indikator selama penyimpanan suhu dingin.
Produksi Plantarisin
Nilai pH supernatan bebas sel netral dan konsentrasi protein plantarisin, analisis data dilakukan secara deskriptif. Rancangan percobaan yang digunakan untuk peubah hasil uji antagonistik supernatan bebas sel netral L. plantarum. adalah rancangan acak lengkap (RAL) faktorial dengan perlakuan 4 x 5 dan ulangan sebanyak tiga kali. Faktor perlakuan adalah galur L. plantarum, dengan empat taraf perlakuan yaitu galur 1A5, 1B1, 2B2, dan 2C12 dan lima bakteri patogen indikator. Analisis data dilakukan secara statistik. Model statistik rancangan acak lengkap (RAL) faktorial adalah sebagai berikut.
Yijk = µ + Pi + Yj + PYij + €ijk
Keterangan :
Yijk = Variabel respon akibat bakteri patogen indikator ke-i dan supernatan bebas
sel ke- j pada ulangan ke-k. µ = Nilai tengah umum.
Pi = Pengaruh perlakuan bakteri patogen indikator ke-i, i = 1, 2, 3, 4, 5
Yj = Pengaruh perlakuan jenis supernatan bebas sel ke-j, j = 1, 2, 3, 4
PYij= Pengaruh interaksi antara bakteri patogen indikator ke-i dengan jenis
supernatan bebas sel ke- j
€ij = Pengaruh galat perlakuan ke-i dan ke-j, terhadap ulangan ke-k, k = 1, 2, 3
Peubah yang diamati adalah diameter zona hambat hasil uji antagonistik dari supernatan bebas sel asal berbagai strain L. plantarum dengan bakteri patogen indikator
Salmonella enteritidis ser. Typhimurium ATCC 14028, E. coli ATCC 25922, S. aureus
16
memenuhi uji asumsi dianalisis dengan menggunakan analisa ragam yaitu uji parametrik dan bila hasil yang diperoleh nyata maka dilanjutkan uji banding dengan menggunakan uji Tukey (Steel dan Torrie, 1995). Jika data tidak memenuhi asumsi, maka data dianalisis menggunakan uji Kruskal – Wallis (uji non parametrik), bila hasil yang diperoleh menunjukkan pengaruh yang nyata pada non parametrik maka dilanjutkan dengan uji pembanding berganda (Mattjik dan Sumertajaya, 2002). Pengolahan data dilakukan dengan menggunakan software Minitab14 dan Statistix8. Stabilitas Aktivitas Plantarisin selama Penyimpanan Suhu Dingin (10 °C)
Rancangan percobaan yang digunakan adalah rancangan faktorial dengan rancangan dasar rancangan acak lengkap (RAL) 4 x 4. Faktor perlakuan yang pertama adalah lama penyimpanan yang berbeda (0, 5, 10 dan 15 hari) pada suhu dingin (10 °C) dan faktor perlakuan kedua adalah plantarisin asal L. plantarum galur yang berbeda (1A5, 1B1, 2B2, dan 2C12). Ulangan dilakukan sebanyak tiga kali. Model statistik rancangan faktorial dengan rancangan dasar RAL adalah sebagai berikut.
Yijk = µ + Pi + Yj + PYij + €ijk
Keterangan :
Yijk = Variabel respon akibat pengaruh lama penyimpanan ke-i dan plantarisin
ke- j pada ulangan ke-k. µ = Nilai tengah umum.
Pi = Pengaruh perlakuan lama penyimpanan ke-i, i = 1, 2, 3, 4
Yj = Pengaruh perlakuan jenis plantarisin ke-j, j = 1, 2, 3, 4
PYij = Pengaruh interaksi antara lama penyimpanan ke-i dengan jenis plantarisin
ke-j.
€ij = Pengaruh galat perlakuan ke-i dan ke-j, terhadap ulangan ke-k, k = 1, 2, 3
Peubah yang diamati adalah diameter zona hambat hasil uji antagonistik dari plantarisin murni asal berbagai galur L. plantarum hasil purifikasi parsial dengan perlakuan lama penyimpanan yang berbeda yang dilakukan terhadap bakteri indikator
Salmonella enteritidis ser. Typhimurium ATCC 14028, E. coli ATCC 25922, S. aureus
ATCC 25923, P. aeruginosa ATCC 27853, dan B. cereus, sebagai kontrol adalah plantarisin yang tidak mengalami penyimpanan (0 hari). Data yang didapat jika
17
memenuhi uji asumsi dianalisis dengan menggunakan analisa ragam yaitu uji parametrik dan bila hasil yang diperoleh nyata maka dilanjutkan uji banding dengan menggunakan uji Tukey (Steel dan Torrie, 1995). Jika data tidak memenuhi asumsi, maka data dianalisis menggunakan uji Kruskal – Wallis (uji non parametrik), bila hasil yang diperoleh menunjukkan pengaruh yang nyata pada non parametrik maka dilanjutkan dengan uji pembanding berganda (Mattjik dan Sumertajaya, 2002). Model statistik uji Tukey adalah sebagai berikut:
w = qα (p,fe) x (KTG/r)1/2 Keterangan :
qα = Taraf uji yang digunakan (95% atau 99%) p = Jumlah taraf perlakuan
fe = Derajat bebas (db) galat KTG = Kuadrat tengah galat r = Jumlah ulangan
18
HASIL DAN PEMBAHASAN
Hasil yang diperoleh pada penelitian ini diawali dengan pemeriksaan karakteristik morfologi dan kemurnian isolat bakteri yang digunakan. Isolat bakteri yang digunakan adalah BAL indigenous daging sapi yaitu bakteriosin asal L. plantarum
1A5, 1B1, 2B2 dan 2C12 serta bakteri patogen indikator yang terdiri atas bakteri
Salmonella enteritidis ser. Typhimurium ATCC 14028, E. coli ATCC 25922, S. aureus
ATCC 25923, B. cereus, dan P. aeruginosa ATCC 27853. Karakteristik morfologis yang diamati meliputi bentuk dan susunan sel-sel bakteri secara mikroskopik, dilakukan dengan bantuan pewarnaan Gram.
Pemeriksaan Kemurnian Isolat Bakteri Asam Laktat dan Bakteri Patogen Indikator
Pemeriksaan kemurnian Bakteri Asam Laktat (BAL) merupakan cara untuk memastikan bahwa bakteri yang akan diuji merupakan kultur murni BAL hasil isolasi dengan mengetahui karakteristik masing-masing kultur berdasarkan sifat yang tampak pada setiap bakteri. Karakteristik tersebut berdasarkan profil fenotip seperti berdasarkan dinding sel bakteri melalui pewarnaan Gram serta bentuk dari masing-masing isolat BAL yang sudah diisolasi sebelumnya dari daging sapi yang beredar di Bogor (Hidayati, 2006).
Morfologi Sel
Konfirmasi bakteri uji yang selanjutnya diuji adalah morfologi sel. Sebanyak empat BAL dan lima bakteri patogen indikator dikarakterisasi berdasarkan morfologi selnya untuk mengetahui bentuk bakteri dari masing-masing isolat menggunakan mikroskop. Fardiaz (1992) menyatakan bahwa berdasarkan bentuk morfologinya bakteri dibagi menjadi tiga golongan yaitu golongan batang (basil), bulat (kokus), dan golongan spiral.
Hasil pengamatan morfologi sel empat isolat BAL yaitu 1A5, 1B1, 2B2 dan 2C12 adalah bakteri dengan bentuk batang (basil) dengan susunan tunggal atau pendek. Isolat ini merupakan kelompok bakteri asam laktat genus Lactobacillus (Fardiaz, 1992). Menurut Buckle et al (2007), bakteri E. coli, Salmonella dan P. aeruginosa tergolong bakteri Gram negatif karena memiliki ciri-ciri morfologi yaitu berbentuk batang, bergerak, dan bersifat fakultatif anaerob. Bakteri S. aureus merupakan bakteri Gram
19
positf dengan ciri-ciri morfologi yaitu berbentuk kokus dan berkelompok menyerupai buah anggur, tidak bergerak, dan tidak berspora (Holt et al., 1994). B. cereus juga merupakan bakteri Gram positif dengan ciri-ciri morfologi yaitu berbentuk batang dan merupakan bakteri gram positif yang memiliki spora (Ray, 2000). Karakteristik keempat isolat BAL dan bakteri patogen indikator dapat dilihat pada Tabel 2.
Tabel 2. Karakteristik L. plantarum 1A5, 1B1, 2B2 dan 2C12 serta Bakteri Patogen Indikator Berdasarkan Uji Morfologi dan Pewarnaan Gram
Bakteri Pewarnaan Gram Morfologi Bentuk dan Susunan
L. plantarum 1A5 Positif Batang, susunan tunggal dan berkoloni rantai pendek
L. plantarum 1B1 Positif Batang, susunan tunggal dan berkoloni rantai pendek
L. plantarum 2B2 Positif Batang, susunan tunggal dan
berkoloni rantai pendek
L. plantarum 2C12 Positif Batang, susunan tunggal dan
berkoloni rantai pendek
Salmonella enteritidis ser.
Typhimurium ATCC 14028 Negatif Batang tunggal dan berkoloni
E. coli ATCC 25922 Negatif Berbentuk batang, bergerak
S. aureus ATCC 25923 Positif Bulat tunggal dan berkoloni seperti buah anggur
P. aeruginosa ATCC 27853 Negatif Batang, susunan tunggal dan berkoloni rantai pendek
B. cereus Positif
Batang, susunan tunggal dan berkoloni serta terdapat kantung spora
Pewarnaan Gram merupakan metode uji untuk mengetahui makromolekul dinding sel setiap isolat bakteri uji dan bakteri indikator. Bakteri berdasarkan reaksi pewarnaan Gram dibedakan menjadi bakteri Gram positif dan Gram negatif. Sebanyak empat isolat bakteri asam laktat dan lima bakteri patogen indikator dilakukan pengujian pewarnaan Gram. Pewarnaan Gram dimaksudkan untuk mengetahui karakteristik morfologis dan kemurnian kultur bakteri yang digunakan. Karakteristik morfologis
20
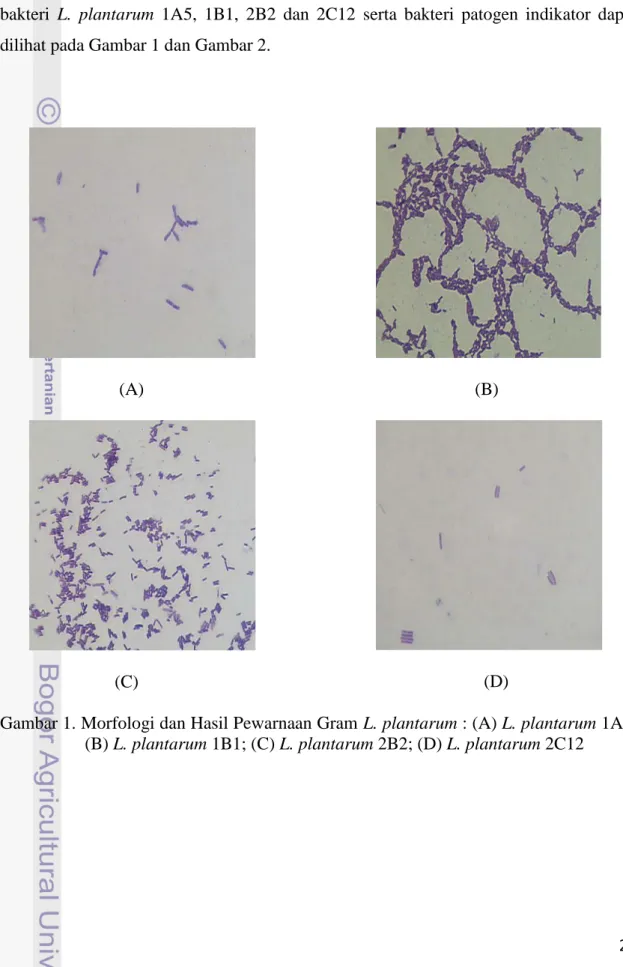
bervariasi dari panjang dan ramping sampai kokobacilus pendek (Pelczar dan Chan, 2005). Hasil pengamatan morfologi dan pewarnaan Gram secara mikroskopis dari bakteri L. plantarum 1A5, 1B1, 2B2 dan 2C12 serta bakteri patogen indikator dapat dilihat pada Gambar 1 dan Gambar 2.
(A) (B) (C) (D)
Gambar 1. Morfologi dan Hasil Pewarnaan Gram L. plantarum : (A) L. plantarum 1A5; (B) L. plantarum 1B1; (C) L. plantarum 2B2; (D) L. plantarum 2C12
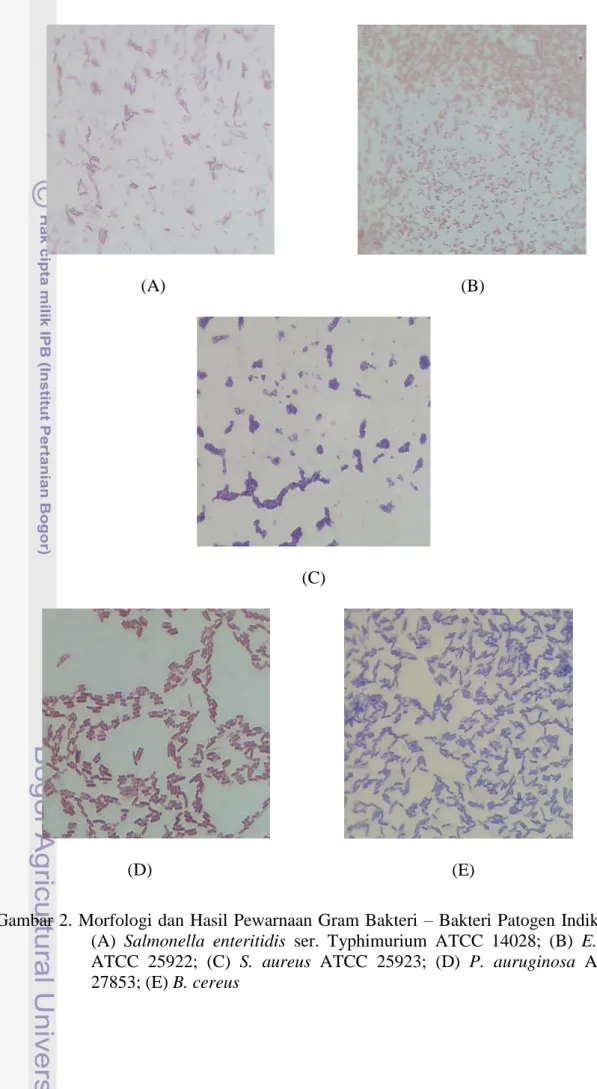
21 (A) (B) (C) (D) (E)
Gambar 2. Morfologi dan Hasil Pewarnaan Gram Bakteri – Bakteri Patogen Indikator: (A) Salmonella enteritidis ser. Typhimurium ATCC 14028; (B) E. coli
ATCC 25922; (C) S. aureus ATCC 25923; (D) P. auruginosa ATCC 27853; (E) B. cereus
22
Hasil yang diperoleh berdasarkan pewarnaan Gram, ternyata bakteri L. plantarum 1A5, 1B1, 2B2 dan 2C12 serta bakteri patogen indikator S. aureus ATCC 25923 dan B. cereus yang digunakan merupakan bakteri Gram positif. Hal ini disebabkan keenam bakteri ini tetap mempertahankan warna ungu Kristal violet meskipun telah diberi alkohol 95% dan zat warna lain yaitu safranin. Bakteri
Salmonella enteritidis ser. Typhimurium ATCC 14028, E. coli ATCC 25922 dan P. aeruginosa ATCC 27853 merupakan Gram negatif. Hal ini disebabkan ketiga bakteri tersebut tidak dapat mempertahankan warna ungu Kristal violet setelah diberi alkohol 95% dan bakteri ini menyerap warna merah yang berasal dari zat warna safranin. Produksi Plantarisin
Produksi plantarisin dilakukan dengan menggunakan inducer berupa kombinasi NaCl 1% dan yeast extract 3% dengan media pertumbuhan kultur menggunakan MRS broth. Tabel 3 menunjukkan kondisi pH awal dari supernatan bebas sel dan kondisi pH supernatan bebas sel yang telah dinetralkan menggunakan NaOH 1N. Berdasarkan nilai pH pada Tabel 3 supernatan antimikrob yang telah dihasilkan dari media produksi dengan inducer berada pada kondisi asam. Kondisi asam tersebut disebabkan oleh adanya asam-asam organik yang terbentuk sebagai metabolit primer dari bakteri asam laktat. Asam organik tersebut mempunyai spektrum penghambatan yang luas terhadap mikroorganisme yaitu dengan cara menyerang dinding sel, membran sel, metabolisme enzim, sistem sintesis protein maupun secara genetik (Smid dan Gorris, 2007).
Asam-asam organik yang terdapat di dalam supernatan antimikrob L. plantarum
dapat menutupi aktivitas plantarisin yang terbentuk saat akan menghambat bakteri indikator pada uji antagonistik. Asam-asam organik dihilangkan dengan cara dilakukan penambahan buffer (NaOH 1N) agar supernatan antimikrob tersebut mencapai pH 5,8 – 6,2. Hal ini bertujuan untuk mengurangi pengaruh asam organik yang terdapat pada supernatan antimikrob sehingga diharapkan dapat mengoptimalkan kerja plantarisin yang terbentuk. Kondisi pH dari supernatan antimikrob L. plantarum 1A5, 1B1, 2B2, dan 2C12 pada media MRS broth dapat dilihat pada Tabel 3.
23
Tabel 3. Kondisi pH Supernatan Bebas Sel (pH awal) dan Supernatan Netral
Plantarisin asal galur
Lactobacillus plantarum pH awal pH setelah dinetralkan
1A5 4,01 ± 0,04 6,11 ± 0,34
1B1 3,94 ± 0,11 5,87 ± 0,12
2B2 4,00 ± 0,02 6,17 ± 0,31
2C12 3,98 ± 0,01 6,04 ± 0,16
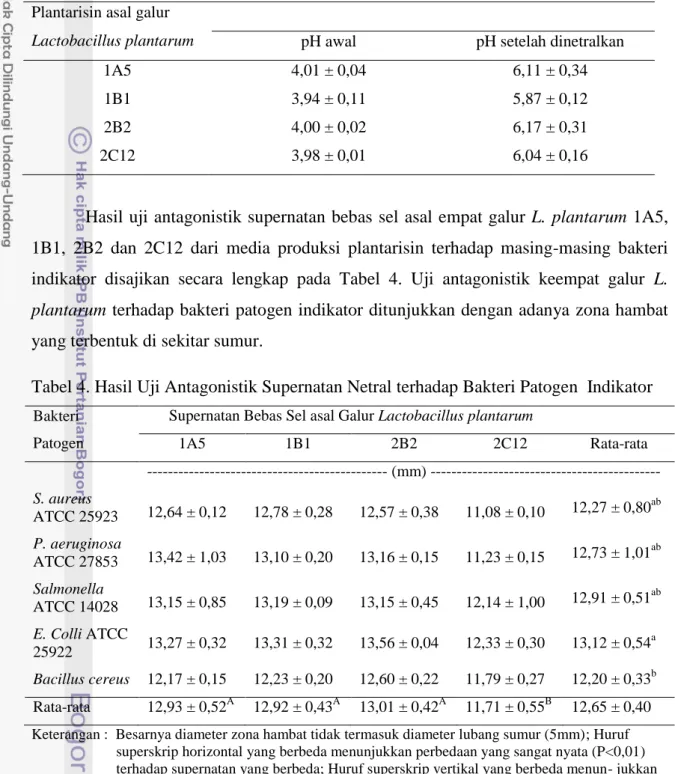
Hasil uji antagonistik supernatan bebas sel asal empat galur L. plantarum 1A5, 1B1, 2B2 dan 2C12 dari media produksi plantarisin terhadap masing-masing bakteri indikator disajikan secara lengkap pada Tabel 4. Uji antagonistik keempat galur L. plantarum terhadap bakteri patogen indikator ditunjukkan dengan adanya zona hambat yang terbentuk di sekitar sumur.
Tabel 4. Hasil Uji Antagonistik Supernatan Netral terhadap Bakteri Patogen Indikator
Bakteri Patogen
Supernatan Bebas Sel asal Galur Lactobacillus plantarum
1A5 1B1 2B2 2C12 Rata-rata --- (mm) --- S. aureus ATCC 25923 12,64 ± 0,12 12,78 ± 0,28 12,57 ± 0,38 11,08 ± 0,10 12,27 ± 0,80 ab P. aeruginosa ATCC 27853 13,42 ± 1,03 13,10 ± 0,20 13,16 ± 0,15 11,23 ± 0,15 12,73 ± 1,01 ab Salmonella ATCC 14028 13,15 ± 0,85 13,19 ± 0,09 13,15 ± 0,45 12,14 ± 1,00 12,91 ± 0,51 ab E. Colli ATCC 25922 13,27 ± 0,32 13,31 ± 0,32 13,56 ± 0,04 12,33 ± 0,30 13,12 ± 0,54 a Bacillus cereus 12,17 ± 0,15 12,23 ± 0,20 12,60 ± 0,22 11,79 ± 0,27 12,20 ± 0,33b Rata-rata 12,93 ± 0,52A 12,92 ± 0,43A 13,01 ± 0,42A 11,71 ± 0,55B 12,65 ± 0,40
Keterangan : Besarnya diameter zona hambat tidak termasuk diameter lubang sumur (5mm); Huruf superskrip horizontal yang berbeda menunjukkan perbedaan yang sangat nyata (P<0,01) terhadap supernatan yang berbeda; Huruf superskrip vertikal yang berbeda menun- jukkan perbedaan yang sangat nyata (P<0,01) terhadap bakteri patogen yang berbeda
Berdasarkan Tabel 4, supernatan bebas sel netral asal empat galur L. plantarum
terhadap bakteri patogen indikator setelah diuji statistik menunjukkan perbedaan yang sangat nyata (P<0,01) antara jenis patogen dan jenis superanatan bebas sel. Terdapat perbedaan yang sangat nyata antara supernatan bebas sel galur 1A5, 1B1 dan 2B2
24
dengan supernatan bebas sel galur 2C12. Supernatan bebas sel galur 2C12 menghasilkan rataan zona hambat yang paling rendah dibandingkan dengan supernatan asal galur lain. Hal ini dapat dikatakan bahwa 2C12 kurang efektif digunakan untuk uji antagonistik terhadap kelima bakteri patogen indikator. Diameter zona hambat supernatan bebas sel juga dipengaruhi oleh jenis bakteri patogen indikator, terdapat perbedaan yang sangat nyata diameter zona hambat yang dihasilkan keempat supernatan antara bakteri E. coli ATCC 25922 dengan bakteri B.cereus.
Pengamatan secara deskriptif menunjukkan bahwa supernatan asal empat galur
L. plantarum dapat menghambat pertumbuhan bakteri indikator Gram negatif (E. coli
ATCC 25922, Salmonella enteriditis ser. Typhimurium ATCC 14028, P. aeruginosa
ATCC 27853). Hasil ini dikuatkan oleh pernyataan Smaoui et al. (2010) bahwa bakteriosin yang dihasilkan oleh Lactobacillus plantarum sp. TN635 dapat menghambat pertumbuhan bakteri Gram negatif (Salmonella enterica ATCC43972, Pseudomonas aeruginosa ATCC 49189, Hafnia sp. and Serratia sp.) dan Candida tropicalis R2 CIP203 yang termasuk jamur (fungi) patogen.
Pengujian Konsentrasi Protein Plantarisin
Plantarisin murni diperoleh dari beberapa tahapan, diantara tahapan yang digunakan yaitu tahap purifikasi. Tahap purifikasi terdiri atas purifikasi parsial yang menggunakan ammonium sulfat dan dialisis, serta purifikasi menggunakan kromatografi pertukaran kation. Hasil dari tahapan purifikasi menggunakan ammonium sulfat disebut presipitat plantarisin dan hasil dari tahap dialisis disebut plantarisin kasar, sedangkan hasil dari purifikasi menggunakan kromatografi pertukaran kation disebut plantarisin murni.
Pengujian ini dilakukan bertujuan untuk mengetahui konsentrasi protein dari presipitat plantarisin, plantarisin kasar dan plantarisin murni, sehingga dapat dilihat perbedaan konsentrasi protein dari ketiga bentuk plantarisin tersebut. Pengujian protein ini menggunakan spektrofotometer dengan panjang gelombang (λ) 280. Konsentrasi protein dari ketiga tahapan tersebut dapat dilihat pada Tabel 5.
25
Tabel 5. Konsentrasi Protein Plantarisin Asal L. plantarum pada Presipitat Plantarisin, Plantarisin Kasar dan Plantarisin Murni.
Plantarisin asal galur L. plantarum
Konsentrasi Protein Presipitat
plantarisin
Plantarisin kasar Plantarisin murni --- (mg/ml) --- 1A5 24,08 ± 0,50 56,65 ± 0,79 32,43 ± 1,80 1B1 24,61 ± 1,95 71,20 ± 0,90 37,22 ± 0,70 2B2 15,62 ± 2,79 44,60 ± 4,86 15,27 ± 1,64 2C12 3,41 ± 1,38 0,97 ± 0,13 10,65 ± 0,02
Berdasarkan Tabel 5, hasil kuantitatif presipitat plantarisin, plantarisin kasar dan plantarisin murni, secara deskriptif dapat dikatakan bahwa nilai rataan konsentrasi protein plantarisin kasar lebih tinggi dibandingkan presipitat plantarisin terhadap ketiga plantarisin asal galur L. plantarum 1A5, 1B1, dan 2B2. Presipitat plantarisin merupakan hasil dari purifikasi parsial dengan konsentrasi yang tinggi namun masih mengandung garam mineral yang digunakan untuk mengendapkan protein. Proses dialisis atau proses pencucian yang bertujuan untuk menghilangkan pengotor pada permukaan partikel-partikel protein sehingga dapat menghasilkan plantarisin kasar dengan konsentrasi protein yang lebih tinggi dari presipitat plantarisin (Day dan Underwood, 2002). Nilai konsentrasi protein plantarisin kasar galur L. plantarum 2C12 cenderung lebih rendah dari ketiga galur lainnya. Konsentrasi protein plantarisin kasar 2C12 mengalami penurunan setelah tahap dialisis. Hal ini dapat disebabkan masih terdapat pengaruh media MRSB di dalam presipitat plantarisin dan pada saat didialisis banyak yang keluar. Proses purifikasi plantarisin dengan menggunakan kromatografi pertukaran kation akan menghasilkan sejumlah fraksi plantarisin murni yang konsentrasi proteinnya berbeda-beda. Fraksi dengan konsentrasi protein yang tidak terlalu tinggi dipilih sebagai sampel untuk melakukan pengujian karakterisasi plantarisin terhadap lamanya penyimpanan suhu dingin.
Konsentrasi protein plantarisin murni jika dibandingkan dengan plantarisin kasar memiliki konsentrasi yang lebih rendah. Hal ini disebabkan konsentrasi protein yang dihasilkan oleh plantarisin kasar tidak hanya berasal dari plantarisin namun ada sumber
26
penghasil protein lain yaitu masih terdapat media MRSB yang memiliki kandungan pepton dan yeast extract. Konsentrasi protein keempat plantarisin murni yang diperoleh cukup tinggi, sehingga keempat plantarisin tersebut dapat digunakan untuk uji selanjutnya yaitu pengujian 1A5, 1B1, 2B2, dan 2C12 terhadap ketahanan suhu dingin (10 °C).
Pengaruh Lama Penyimpanan Plantarisin Murni Galur 1A5, 1B1, 2B2 dan 2C12 melalui Aktivitas Penghambatan Antimikrob pada Suhu Dingin (10 °C)
Aktivitas penghambatan keempat plantarisin asal galur L. plantarum selama 15 hari pada suhu 10 °C diamati untuk mengetahui stabilitas plantarisin 1A5, 1B1, 2B2, dan 2C12 selama penyimpanan suhu dingin. Stabilitas aktivitas penghambatan ditentukan melalui diameter zona hambat (berupa zona bening atau zona semu) yang dihasilkan terhadap kelima bakteri patogen indikator (S. aureus ATCC 25923,
Salmonella enteritidis ser. Thyphimurium ATCC 14028, P. aeruginosa ATCC 27853,
E. coli ATCC 25922 dan B. cereus).
S. aureus ATCC 25923. Stabilitas aktivitas penghambatan plantarisin murni asal L. plantarum 1A5, 1B1, 2B2 dan 2C12 terhadap bakteri indikator S. aureus yang disimpan selama 15 hari pada suhu dingin (10 °C) dapat dilihat pada Tabel 6.
Tabel 6. Diameter Zona Hambat Plantarisin Asal Empat Galur L. Plantarum selama Penyimpanan terhadap S. aureus ATCC 25923 pada Suhu Dingin (10 °C)
Plantarisin asal Galur L. plantarum Perlakuan H-0 H-5 H-10 H-15 --- (mm) --- 1A5 8,63 ± 0,45 9,40 ± 0,73 9,67 ± 1,45 10,10 ± 0,47 1B1 9,18 ± 1,11 8,81 ± 0,44 10,16 ± 1,79 9,98± 1,79 2B2 8,11 ± 0,53 8,84 ± 0,86 9,26 ± 0,79 9,70 ± 2,33 2C12 10,48 ± 0,92 6,93 ± 0,22 10,43± 0,92 8,52 ± 0,44 Rata-rata 9,10 ± 1,02ab 8,50 ± 1,08b 9,88 ± 0,52a 9,57 ± 0,72ab
Keterangan : Besarnya diameter zona hambat sudah termasuk diameter lubang sumur (5 mm); Huruf superskrip yang berbeda menunjukkan perbedaan yang nyata (P< 0,05)
Penyimpanan plantarisin murni asal empat galur yaitu 1A5, 1B1, 2B2, dan 2C12 yang disimpan pada suhu dingin selama 15 hari, setelah diujikan pada bakteri S. aureus