FASA BENDA JENIS FASE
Tahap yang berbeda dapat digambarkan sebagai berbagai negara materi seperti gas , cair , padat , plasma atau kondensat Bose-Einstein . Berguna mesophases antara padat dan cair bentuk negara-negara lain dari materi.
Tahap yang berbeda juga ada dalam keadaan tertentu materi. Seperti ditunjukkan dalam diagram untuk paduan besi, ada beberapa fase untuk kedua negara padat dan cair. Fase juga dapat dibedakan berdasarkan kelarutan seperti dalam polar (hidrofilik) atau non-polar (hidrofobik)
Campuran air (cairan polar) dan minyak (cairan non-polar) secara spontan akan terpisah menjadi dua tahap. Air memiliki sangat rendah kelarutan (tidak larut) dalam minyak, dan minyak memiliki kelarutan yang rendah dalam air. Kelarutan adalah jumlah maksimum zat terlarut yang dapat larut dalam pelarut sebelum zat terlarut berhenti untuk membubarkan dan tetap dalam fase terpisah. Campuran A dapat memisahkan menjadi lebih dari dua fase
Gambar 1.1 diagram fase Besi-karbon , menunjukkan kondisi yang diperlukan untuk membentuk fase yang berbeda
cair dan konsep pemisahan fasa meluas ke padatan, yaitu, padatan dapat membentuk larutan padat atau mengkristal menjadi fase kristal berbeda. Pasangan logam yang saling larut dapat membentuk paduan , sedangkan pasangan logam yang saling larut tidak bisa.
Sebanyak delapan fase cair bercampur telah diamati. fase cair Saling bercampur terbentuk dari air (fasa air), pelarut organik hidrofobik, perfluorokarbon ( fase fluorous ), silikon, beberapa logam yang berbeda, dan juga dari fosfor cair. Tidak semua pelarut organik yang tercampur sepenuhnya, misalnya campuran etilena glikol dan toluena dapat terpisah menjadi dua fase organik yang berbeda.
Fase tidak perlu makroskopik memisahkan secara spontan. Emulsi dan koloid adalah contoh dari kombinasi pasangan fase bercampur yang tidak terpisah secara fisik.
KESETIMBANGAN FASA
banyak komposisi akan membentuk fase tunggal yang seragam, tetapi tergantung pada suhu dan tekanan bahkan zat tunggal dapat terpisah menjadi dua atau lebih tahap yang berbeda. Dalam setiap fase, sifat yang seragam tetapi antara dua fase sifat berbeda.
Air dalam botol tertutup dengan ruang udara di atasnya membentuk sistem dua fase. Sebagian besar air dalam fasa cair, di mana ia dipegang oleh daya tarik bersama dari molekul air. Bahkan pada molekul kesetimbangan terus bergerak dan, sesekali, sebuah molekul dalam fase cair keuntungan energi kinetik yang cukup untuk melepaskan diri dari fase cair dan memasuki fase gas. Demikian juga, setiap sekali-sekali molekul uap bertabrakan dengan permukaan cairan dan mengembun menjadi cairan. Pada kesetimbangan, penguapan dan kondensasi proses persis menyeimbangkan dan tidak ada perubahan bersih dalam volume kedua fase.
Pada suhu kamar dan tekanan, tabung air mencapai keseimbangan ketika udara di atas air memiliki kelembaban sekitar 3%. Persentase ini meningkat karena suhu naik. Pada 100 ° C dan tekanan atmosfer, keseimbangan tidak tercapai sampai udara adalah 100% air. Jika cairan tersebut dipanaskan sedikit lebih dari 100 ° C, transisi dari cair ke gas akan terjadi tidak hanya di permukaan, tetapi di seluruh volume cairan: air mendidih.
JUMLAH FASE
Gambar 1.2 Sebuah diagram fase khas untuk bahan tunggal-komponen, menunjukkan padat, cair dan gas fase. Garis hijau padat menunjukkan bentuk biasa dari garis fase cair-padat. Garis hijau putus -putus menunjukkan perilaku anomali air ketika tekanan meningkat. The tiga titik dan titik kritis akan ditampilkan
sebagai titik-titik merah.
Untuk komposisi tertentu, hanya fase-fase tertentu yang mungkin pada diberikan temperatur dan tekanan. Jumlah dan jenis fase yang akan membentuk sulit untuk memprediksi dan biasanya ditentukan oleh eksperimen. Hasil percobaan tersebut dapat diplot dalam diagram fasa .
Diagram fasa ditampilkan di sini adalah untuk sistem komponen tunggal. Dalam sistem yang sederhana ini, yang fase yang mungkin hanya bergantung pada tekanan dan temperatur . Tanda-tanda menunjukkan titik di mana dua atau lebih fase dapat hidup berdampingan dalam keseimbangan. Pada suhu dan tekanan dari tanda-tanda, hanya akan ada satu fase pada kesetimbangan.
Dalam diagram, garis biru menandai batas antara cair dan gas tidak berlanjut tanpa batas waktu, tetapi berakhir pada titik yang disebut titik kritis . Sebagai suhu dan tekanan mendekati titik kritis, sifat-sifat cairan dan gas menjadi semakin lebih mirip. Pada titik kritis, cairan dan gas menjadi tidak dapat dibedakan. Di atas titik kritis, tidak ada lagi cair dan gas fase terpisah: hanya ada fase cairan generik disebut sebagai fluida superkritis . Dalam air, titik kritis terjadi pada sekitar 647 K (374 ° C atau 705 ° F) dan 22,064 MPa .
Sebuah fitur yang tidak biasa dari diagram fasa air adalah bahwa garis fase padat-cair (digambarkan dengan garis putus-putus hijau) memiliki kemiringan negatif. Untuk zat yang paling, kemiringan positif sebagaimana dicontohkan oleh garis hijau gelap. Fitur ini tidak biasa air terkait dengan es memiliki kerapatan yang lebih rendah daripada air cair. Peningkatan tekanan mendorong air ke fase kepadatan lebih tinggi, yang menyebabkan leleh.
Menarik lain meskipun fitur yang tidak biasa dari diagram fase adalah titik di mana garis fase padat-cair memenuhi garis fase-gas cair. Persimpangan ini disebut sebagai titik tripel . Pada titik tripel, ketiga fase dapat hidup berdampingan.
Eksperimen, garis fase relatif mudah untuk memetakan karena saling ketergantungan suhu dan tekanan yang terjadi ketika beberapa tahapan bentuk. Lihat aturan fase Gibbs ' . Pertimbangkan alat uji yang terdiri dari sebuah silinder tertutup dan terisolasi dengan baik dilengkapi dengan piston. Dengan pengisian jumlah yang tepat air dan menerapkan panas, sistem dapat dibawa ke setiap titik di wilayah gas dari diagram fasa. Jika piston secara perlahan diturunkan, sistem akan melacak kurva peningkatan suhu dan tekanan di dalam wilayah gas dari diagram fasa. Pada titik di mana cairan mulai mengembun, arah suhu dan tekanan kurva tiba-tiba akan berubah untuk menelusuri sepanjang garis fase sampai semua air telah kental.
KESETIMBANGAN ZAT PADAT-CAIR Perhatikan grafik di bawah ini:
(atau jumlah k alor yang diberik an pada k ecepatan k onstan) Gambar 1.3 kurva titik didih senyawa tertentu
Ketika sampel padat dipanaskan, maka temperatur akan naik hingga zat padat mulai mencair. Jika pemanasan terus dilakukan maka zat padat tersebut akan terus mencair pada suhu yang konstan, yang kemudian dikenal sebagai titik leleh, Tm. Penambahan kalor diserap
sebagai kalor latent fusi, Hf , yaitu energi yang dibutuhkan untuk menganggu kisi kristal. Setelah seluruh zat padat mencair, maka suhu akan naik namun dengan kecepatan yang berbeda. Hal ini dikarenakan kapasitas kalor dari zat cair berbeda dengan zat padat.
Jika proses tersebut dibalik, maka kita akan mendapatkan kurva pendinginan yang tidak persis sama dengan kurva pemanasan.
(atau jumlah k alor yang hilang pada k ecepatan k onstan)
Gambar 1.3 kurva titik beku senyawa tertentu
Te
m
pe
ra
tur
waktu
Pendinginan zat cairPembekuan zat cair
Kristal pertama terbentuk
Seluruh zat cair telah membeku Pendinginan zat padat
supercooled Tm Zat padat mencair Pemanasa n zat padat
Zat padat mulai mencair
Seluruh zat padat telah mencair Pemanasan zat cair
Te
m
pe
ra
tur
waktu
TmSebelum kristal pertama terbentuk, temperatur akan turun hingga dibawah kesetimbangan titik beku, kejadian ini disebut supercooling. Tingkat supercooling bervariasi, tergantung pada sifat senyawa, laju pendinginan dan adanya pengotor yang akan menjadi inti pada pembentukan kristal.
Titik lebur pada padatan murni selalu tajam (rentangan suhunya kecil) dan berfungsi untuk mengidentifikasinya. Jika suatu zat yang bukan murni,maka zat tersebut akan meleleh lebih dari kisaran temperatur. Perubahan volume pada kasus peleburan maupun pembekuan relative kecil oleh karena itu pengaruh tekanan selalu diabaikan.
Gambar 1.4 alat sederhana untuk menentukan titik leleh. menutup dari posisi sampel
Suatu sample dimasukan ke dalam gelas berdinding kapiler , dan termometer dipasang dengan jarak yang dekat dan dipanaskan tidak lebih dari 10 per menit. Perpindahan panas harus disediakan dengan melakukan pergerakan yang baik, kapiler yang berdinding tipis, dan laju pemanasan yang begitu pelan di daerah titik lebur.
Termometer tidak akan dipercaya kecuali jika kalibrasinya sudah tepat. Untuk termometer air raksa, perbaikan thermometer adalah, ∆T :
∆T = 0,000154 l (t-n)
Dimana 0.000154 adalah koefisien ekspansi linear dari air raksa di dalam sebuah gelas tabung, l merupakan panjang kolum yang diketahui dalam derajat, t merupakan temperatur yang diperhatikan, n merupakan rata-rata dari suhu yang diketahui.
Kesetimbangan Cair-Gas.
Semua molekul dalam cairan berada dalam gerakan konstan, sehingga menghasilkan tekanan internal dan kecenderungan untuk melepaskan diri dari cairan. Tekanan uap cairan adalah ukuran dari kecenderungan melepaskan diri dan tekanan yang akan diamati dalam fase uap jika cairan murni ditempatkan dalam ruang yang terevakuasi dan diperbolehkan untuk memenuhi kesetimbangan (terjadi kesetimbangan). Jika suatu ruangan mengandung gas lain, tekanan total meliputi tekanan uap cairan, dan kami berbicara tentang tekanan parsial setiap komponen. Tekanan uap cairan merupakan sifat dari cairan dan tidak tergantung pada komposisi fase uap dalam kontanya. Namun hal tersebut tidak tergantung pada komposisi fase cair (lihat di bawah). Karena tekanan uap adalah hasil dari gerakan molekul, kita harapkan tekanan uap meningkat dengan adanya peningkatan suhu. Gambar 2-4 menunjukkan bagaimana tekanan uap dari perubahan cair dengan suhu yang khas. Jika tekanan uap sama atau lebih besar dari dari tekanan eksternal, cairan akan mendidih secepat panas laten penguapan, dapat diberikan sampai cairan tersebut benar-benar menguap, atau sampai suatu kesetimbangan terjadi antara cairan dan uap.
CAIR GAS
Suhu di mana tekanan uap pada satu atmosfer (760 torr) adalah titik didih normal, namun, titik didih pada tekanan apapun yang diberikan oleh kurva pada gambar 2-4. Kurva ini juga memisahkan dua daerah: kombinasi dari tekanan eksternal dan suhu di sebelah kiri baris (misalnya, titik A) adalah di daerah di mana fase cair adalah bentuk stabil. Titik C adalah di daerah di mana fase gas adalah bentuk stabil. Titik B dan titik lainnya pada baris memberikan kondisi hanya untuk yang dua fase dapat hidup berdampingan dalam keseimbangan.
Untuk cairan murni, kurva suhu tekanan uap dinyatakan oleh persamaan Clapeyron, dikembangkan oleh Emile Clapeyron pada tahun 1834.
=
Dimana Δ V adalah perbedaan antara volume yang ditempati oleh satu mol substansi dalam fase gas dan fase cair. Volume cairan sangat kecil dibandingkan dengan volume gas, sehingga Δ V ≈ V, volume gas. Jika kita juga menganggap bahwa uap adalah gas ideal, maka
Dengan demikian, kita dapat mensubtitusikan RT / P untuk Δ V dalam persamaan 2-2 x P atau dT Integrasi ini menghasilkan
+const (2-3)
atau
( ) (2-4)
pada rentang suhu yang lebih dari cukup, Hv adalah konstan dan dapat ditentukan dari kemiringan plot dari data (misalnya, Tabel 2-1) sesuai dengan persamaan 2-3, seperti yang ditunjukkan pada gambar 2-5. Sekali kita memiliki nilai Hv, persamaan 2-4 berguna untuk menghitung tekanan uap, P2, pada suhu T2 dari nilai yang diketahui, P1, pada suhu lain T1.
Contoh/Permasalan 2-2
Berapa kalor dari proses penguapan dan tekanan uap untuk pentane pada suhu 25°C? data dari table 2-1 digambarkan dalam gambar 2-5, dimana kemiringannya adalah
Gambar 2-5
Grafik tekanan uap dan suhu untuk n-pentana berdasarkan persamaan 2-3
deg, memberikan nilai untuk 6400 kal/mol. Dari grafik, tekanan uap pada 25°C ( ⁄ ) adalah 500 torr, atau dengan menggunakan persamaan 2-4 dan nilai untuk 20°C, didapatkan ( ) Table 2-1 (Tekanan uap Parafin dalam Torr)
Contoh / Soal 2_3
Berapa titik didih dari n-pentana pada 760 torr dan pada 100 torr? Melalui persamaan 2-4 kita mempunyai:
= -
dan dengan nilai torr n-pentane 760 pada 40° C, maka
= -
= -
dari gambar 2-5 titik didih yang sesuai adalah 310° dan 260°.
Pada tekanan rendah ,titik didih tidak hanya pada suhu yang lebih rendah, tetapi juga perubahan cepat dengan adanya perubahan tekanan. Senyawa yang sensitif terhadap panas sering disaring pada suhu di bawah titik didih normal mereka dengan mengurangi tekanan di dalam aparat seperti yang ditunjukkan pada gambar 2-6.
Gambar 2-6 (a) aparatus untuk distiling pengurangan tekanan. (b) pengaruh tekanan pada titik didih dari dua senyawa yang akan dipisahkan
Sebuah campuran senyawa A dan B, yang titik didihnya juga diberikan pada Gambar 2-6, akan lebih mudah dipisahkan dengan distilasi pada tekanan rendah karena perbedaan titik didih mereka lebih besar. Ada batas praktis untuk melakukan distilasi pada tekanan berkurang, yaitu, waktu yang diperlukan karena tingkat penurunan penguapan. Waktu yang diperlukan untuk menyaring 1 gram zat pada berbagai tekanan diberikan pada Tabel 2-2:
Kesetimbangan Padat-Gas. Kecenderungan melepaskan diri dari dalam
molekul padat biasanya sangat rendah dibandingkan dengan cairan. Namun
demikian, tekanan uap tidak ada (kira-kira 10
-26torr untuk membawa logam
pada suhu kamar) dan itu tergantung pada temperatur dengan cara yang sama
seperti persamaan Clapeyron.
log P =
+ konstanta
(2-5)
Dimana ΔH
sadalah panas laten sublimasi. Tekanan uap dari tipe padat sebagai
fungsi temperatur ditunjukkan pada Gambar 2-7.
Secara umum, tekanan uap padat, kurang dari fase cair, dan kurva
tekanan-temperatur lebih curam.
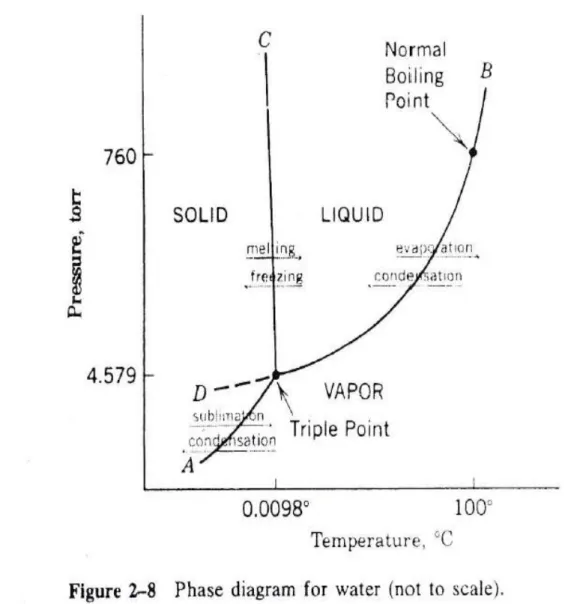
Diagram Fasa. Hal ini digunakan untuk menjelaskan tiga jenis fasa
transisi dalam grafik tunggal, yang disebut diagram fasa. Sebagai contoh,
diagram fasa air yang diberikan pada gambar 2-8.
Kurva A, memisahkan daerah padat dan uap yang stabil, memberikan
tekanan uap pada zat padat sebagai fungsi temperatur. Jika tekanan uap zat
padat kurang dari ini, maka akan menyublim. Jika tekanan lebih besar, uap akan
mengembun. Demikian pula kurva B antara cairan dan daerah uap,
menggambarkan tekanan uap pada cairan sebagai fungsi temperatur.
Bagian
garis pada kurva (kurva D) memberikan keterangan tekanan uap dari cairan
super dingin,. Kurva C menunjukkan titik leleh dari fungsi tekanan. Itu sangat
dekat dengan garis vertikal yang mempunyai slope negatif karena air sedikit
mengembang pada keadaan es.
Untuk memberikan fungsi suhu dan tekanan, pada diagram fase
menunjukkan fase padat berada pada titik kesetimbangan. Jika fakta-fakta
tersebut dikombinasikan dengan tekanan dan suhu pada kurva, dua fase akan
bertemu pada kesetimbangan. Ini merupakan kombinasi yang unik dimana
terjadi perpotongan kurva, triple point, dimana tiga fase dapat bertemu.
Kesetimbangan Padat-Cair pada Campuran
Titik leleh zat murni digambarkan "tajam". Hal itu disebabkan karena transisi keseluruhan dari padat ke cair terjadi pada suhu tunggal. (dalam kenyataannya, suhu leleh kisaran 0,5 sampai 1,0 dianggap tajam). Untuk substansi tidak murni (campuran), titik leleh terjadi pada rentang suhu seperti yang ditunjukkan pada gambar 2.9. Secara umum, titik leleh zat tidak murni lebih rendah dibandingkan dengan zat murni dan mempunyai jarak lebur yang lebih besar.
Titik beku campuran
Kita dapat melihat titik beku melalui kurva tekanan uap. mari kita perhatikan sistem terisolasi yang terdiri dari kapur barus padat dan cair pada titik leleh 1790C. kurva tekanan uap untuk sistem kamper murni adalah garis yang solid A dan B dalam gambar.
Melting range Liquid heating Solid heating Tm Te mp er atu re Time VAPOR LIQUID SOLID P re ss u re Temperature, 0C C B A 1790 1750
Sejumlah kecil naftalena yang ditambahkan pada sistem akan larut dalam kapur barus cair. Konsentrasi molekul kapur barus di permukaan cairan berkurang dari sebelum menambahkan naftalena tersebut. Sebagai akibatnya, laju penguapan kapur barus cair menurun secara proporsional dan tekanan uapnya menurun. Garis putus-putus C, pada gambar 2-10 memberikan tekanan uap kapur barus cair yang mengandung sejumlah kecil naphthalena. Perpindahan aktual dari kurva C dari kurva B pertama kali diselidiki oleh FM Raoult pada tahun 1887 menemukan hukum Raoult yang menyatakan bahwa tekanan uap, Pc, dari pelarut (dalam hal ini champhor) dalam suatu larutan sama
dengan tekanan uap dari pelarut murni dalam larutan:
(2-6)
Fraksi mol adalah ukuran konsentrasi dan sama dengan jumlah mol substansi yang diberikan dibagi dengan jumlah total mol semua zat dalam fase yang sama.
Pada gambar 2-8, persimpangan dua kurva tekanan uap, A dan B atau A dan C, dalam gambar 2-10, menentukan titik beku. Sementara itu, penambahan campuran akan menurunkan titik beku pada cairan tersebut.
Kesimpulan yang jelas adalah bahwa perubahan titik beku, ∆H, berbanding lurus dengan jumlah naftalena menambahkan. jika kita mengukur konsentrasi sebagai molalitas (mol zat terlarut per 1000 gr pelarut), konstanta proporsionalitas disebut konstanta penurunan titik beku, Kf. Untuk larutan encer, persamaan sederhana dijelaskan perilaku ini.
(2-7)
Dimana m adalah molalitas zat terlarut. nilai Kf hanya bergantung pada sifat pelarut dan tidak
pada zat yang terlarut. nilai Kf untuk beberapa pelarut yang diberikan dalam tabel 2-3. jika diketahui
berat suatu zat terlarut dilarutkan dalam sejumlah diketahui pelarut, penentuan penurunan titik beku akan menghasilkan molalitas larutan dari berat molekul zat terlarut dapat dihitung. Sekalipun, secara sederhana dalam penentuan prinsip yang tepat membutuhkan ketelitian yang besar.
LIQUID VAPOR Xc = 1.00, Xv = 0 Xc = 0.99, Xv = 0.01 P re ss u re Temperature, 0C SOLID Xc = 0.98, Xv = 0.02 Xc = 0.97, Xv = 0.03
Pelarut Ttitik Beku, 0C Kf, deg/mol Asam asetat 17 −3.9 Benzena 5.4 −5.12 Kapur barus 179 −38.0 Etilena dibromida 10.1 −11.8 Naftalena 80 −6.8 Air 0 −1.86
dalam memperlakukan titik beku campuran, biasanya kita mengasumsikan bahwa fase cair homogen, yaitu, cairan keduanya bercampur. Namun substansi dua padat mungkin atau tidak mungkin membentuk fase homogen. fase padat yang komposisinya adalah sama, untuk diskusi ini, yang disebut larutan padat. beberapa campuran padat mampu membentuk larutan padat homogen sementara lainnya tetap sebagai campuran dari dua zat padat murni
Jika Naftalen murni 80oC dan ditambahkan kapur barus, sama seperti menambahkan naftalen untuk kapur barus murni. Kedua efek digabungkan dalam gambar 2-12, di mana titik leleh diplot sebagai fungsi dari komposisi mol% dari fase cair.
Bagaimana kita bisa menggunakan grafik ini?
1. Titik Leleh dari senyawa murni diberikan pada sumbu masing-masing sebesar 100% kapur barus dan 100% naftalena, titik A dan B.
2. Kurva AE memberikan titik beku awal kapur barus mengandung sejumlah naftalen. Contoh: campuran cairan yang mengandung 20% naftalena mulai membeku pada 117oC, titik C
3. Kurva BE menunjukkan titik beku naftalen yang mengandung berbagai jumlah kamfer.
4. Kurva AE dan BE yang memotong titik E menunjukkan komposisi campuran yang memiliki kemungkinan titik beku terendah, disebut titik pendingin atau eutectic point (dari bahasa Yunani yang berarti “mudah dilelehkan”)
5. Jika campuran cairan mengandung 20% naftalen (titik D) didinginkan (kurva DC), kristal kamfer murni akan terbentuk ketika suhunya mencapai 117oC. Pendinginan lebih lanjut akan menyebabkan kamfer murni tambahan menjadi memadat. Fase liquid kemudian menjadi kaya dalam naftalen dan titik bekunya menurun sepanjang kurva CE. Ketika titik E dicapai, cairan sisanya (sekarang berada di komposisi eutektik) membeku. Ketika semua cairan telah membeku, komposisi padatannya harus, tentu saja, menjadi sama seperti komposisi campuran cairan aslinya, 20% naftalen. Pendinginan lebih lanjut ditunjukkan oleh garis FG.
6. Memanaskan campuran padatan yang mengandung 20% naftalena akan mengikuti kebalikan tersebut dari (poin 5) di atas.pada suhu 32,3˚C proporsi eutektik (58% kamper - 42% naftalena) dari padat akan mencair sampai tidak ada naftalena padat tetap.Suhu tetap tetap pada 32,3˚C selama itu mencair dari eutektik tersebut. Maka kapur barus yang tersisa mencair, secara bertahap mengurangi konsentrasi naftalena dalam lelehan cairan dan dengan demikian meningkatkan titik leleh selama EC. Kurva pemanasan untuk proses ini ditunjukan pada gambar 2-13.
7. Campuran eutektik memiliki titik lebur yang tinggi dan titik beku yang tinggi. Dengan demikian titik lebur yang tinggi tidak selalu membuktikan senyawa murni. Bagaimanapun, penambahan sejumlah kecil senyawa murni baik untuk campuran eutektik akan menaikkan titik leleh, dimana penambahan sejumlah kecil senyawa murni baik untuk senyawa murni lainnya akan menurunkan titik leleh.
Identifikasi oleh titik leleh. Titik leleh yang tajam dari senyawa murni berfungsi sebagai alat identifikasi. Namun senyawa organik murni yang jarang memiliki jangkauan leleh kurang dari 0,3 sampai 0,5. dengan demikian, beberapa senyawa mungkin pada dasarnyamemiliki titik leleh yang sama dan bisa bingung. sampel murni dari senyawa yang diduga memungkinkan identifikasi lebih positif. bagian yang tidak diketahui adalah campuran diambil. titik leleh campuran semua campuran tersebut akan diturunkan kecuali bila dua senyawa identik.
Kesetimbangan Cair-uap untuk campuran biner
Pertimbangkanlah suatu campuran n-hexane (A) dan n-heptane (B). Molekul A akan memaksakan tekanan uap tertentu, PA , yang akan lebih sedikit daripada jika cairan yang murni A, memiliki tekanan uap PAo. . Seperti juga, molekul B akan memaksakan tekanan uap PB yang lebih kecil daripada PBo. Seperti yang diberikan oleh hukum Raoult (persamaan 2-6).
PA = XAPA PB = XBPB
P = Pa + PB = XA PAo + XB PBo
Dimana XA dan XB adalah mol fraksi A dan B dalam larutan cair dan P adalah total tekanan dalam fasa uap diatas cairan. Hukum ini hanya berlaku untuk larutan ideal. Larutan ideal adalah salah satu yang mematuhi hukum Raoult. Tingkah laku ideal adalah yang paling mungkin untuk diamati jika kedua komponen secara kimiawi serupa. Untuk contoh, campuran kita dari dua pafin, n-heksana dan n-heptana, mempunyai tingkah laku ideal seperti yang diperlihatkan dalam gambar 2-14.
Lebih sering hubungan linier dinyatakan dalam persamaan 2-8 dan 2-9 hanya berlaku untuk larutan yang sangat encer dan bahkan kemudian hanya untuk komponen utama pelarut. dalam hal ini tekanan uap dari Pa zat terlarut sering menuruti hukum henry yang dirumuskan oleh william henry pada 1804
PA=kXA
Dimana k adalah konstanta empiris yang ditentukan di dalam area, dimana XA mendekati nol. data untuk gambar 2-14 berkaitan dengan suhu konstan. dalam gambar 2-15 tekanan uap total. data untuk gambar 2-14 berkaitan dengan suhu konstan. dalam gambar 2-15 tekanan uap total untuk campuran n-heksana dan n-heptana diplot terhadap komposisi campuran
kelompok kurva menunjukkan pengaruh suhu. persimpangan setiap kurva dengan garis putus-putus horizontal pada 760 torr memberikan suhu didih campuran sesuai yang merupakan solusi yang 2,5 mol% heptana akan mendidih pada 70 derajat selsius, 46 mol% heptana akan mendidih pada 80 derajat selsius dan 78% mol heptana pada 90 derajat selsius. jika kita memiliki garis yang lebih pada grafik, kita bisa menemukan titik didih dari setiap campuran n-heksana dan n-heptana lebih informatif untuk plot titik didih sendiri sebagai fungsi dari komposisi pada tekanan konstan torr 760. Juga, ini adalah sama pentingnya dengan mempertimbangkan komposisi uap yang keluar dari larutan. biarkan Xa dan Xb mewakili fraksi mol heksana dan heptana dalam fase uap di mana juga ada hubungan yang sederhana antara tekanan parsial dan komposisi
PA / PT = YA dan PB/PT =YB
PA / PB = YA / YB = XA PAo / XB PBo = a XA / XB Dimana a disebut dengan relative volatility
Rasio tekanan uap jenuhnya adalah PA /PB . jika komponen A adalah komponen yang lebih mudah menguap, maka Pa> Pb, sehingga YA / YB harus lebih besar dari XA / XB. yang merupakan prinsip dasar dari sebuah fraksi distilasi-yaitu, bahwa dalam proses merebus solusi, uap menjadi diperkaya dalam lebih dalam komponen volatil.
penambahan uap yang terbentuk adalah fungsi relatif dari tekanan uapdari dua komponen. Destilasi tunggal dari larutan tidak dapat menghasilkan produck yang murni, pemahaman tentang proses penambahna adalah dasar pembelajaran dari fraksional destilasi.
BUBBLE CAP COLUMN
Kolom Buble-cap. Penjelasan lebih baik dijelaskan dengan percobaan yang dilakukan dalam kolom bubble cap, seperti digambarkan pada Gambar 2-18. Campuran dipanaskan dalam pot (wadah yang paling dasar) titik didihnya 00C. Uap melewati pelat 1 dan dibelokkan dan dikondensasikan oleh buble cap. Piring 1 dipertahankan pada titik didih campuran yang terkandung dalamnya, yaitu, tentu saja, sedikit lebih rendah dibandingkan dengan campuran asli yang masih dalam pot (wadah yang paling dasar). Uap yang terbentuk di piring 1 dikondensasikan pada
Gambar 2-18
buble cap di pelat 2, dan seterusnya sampai ke kolom atas. Kelebihan cairan setiap lempeng mengalir melalui tabung lalu mengalir ke pelat berikutnya. Kondensor ditempatkan di bagian atas kolom. Ketika sistem telah mencapai elquilibrium, komposisi uap dan cairan di pelat masing-masing sesuai dengan langkah-langkah yang diambil dalam gambar 2-17. Dengan demikian, uap di setiap lempeng secara progresif semakin diperkaya dalam komponen yang lebih mudah menguap.
Dengan menambahkan dalam jumlah lapisan pelat yang sesuai, memungkin untuk memisahkan dua komponen untuk setiap tingkat kemurnian. Namun demikian, penambahan pelat memerlukan lebih banyak campuran yang akan terangkat dalam kolom. Begitu setiap produk dikeluarkan dari bagian atas kolom, keseimbangan akan terganggu dan efek ini segera
Plate No
3
4 2 1Y
B,4X
B,4Y
B,3XB,3
YB,2
X
B,2Y
B,1X
B,1Y
B,0X
B,0T
3T
4T
2T1
T
T0
terjadi ke kolom di bawahnya. Setiap perubahan dari hasil kesetimbangan akan membuat pemisahan kurang efektif. Oleh karena itu, perlu untuk membuat persamaan antara bidang yang diinginkan per satuan waktu seluruhnya, dan kemurnian. Jumlah efektif pelat adalah sama dengan jumlah langkah pengayaan teoritis, dan ini selalu kurang dari jumlah yang sebenarnya dari pelat dalam kolom.
Jumlah pelat secara teoritis (n) dapat dihitung dengan campuran A dan B yang murni yang mengadung konsentrasi dan untuk memberikan derajat kemurnian yang dapat dihitung dengan persamaan volatilitas relatif (α). uap pertama dalam pelat melalui tahap vaporasi adalah atau
Ketika uap dari pelat pertama menguap konsentrasinya tidak berubah. Maka . Dan ketika menguap dari pelat pertama
Setelah n pelat , dan n+1 pengulangan penguapan-pendinginan
atau
Ketika uap dalam pelat nth didinginkan .komposisi zat dalam distilat , sehingga dan Persamaan ini disebut dengan persamaan Fenske.
Contoh/ Problem 2-6
Berapa banyak pelat secara teoritis yang dibutuhkan untuk memperkaya campuran equi-molar dari benzena dan toluena (α = 2.47 ) sehingga destilat yang terakhir mengandung XA.f
(benzena) = 0,995? = *(
) +
4,9 plates. Tidak termasuk pelat destilasi dan kondensor akhir.
Pada praktiknya, setidaknya 6 pelat akan dibutuhkan untuk pemisahan (separation). Untuk pendekatan yang kasar, mari kita asumsikan (1) bahwa pemisahan yang “baik” harus menghasilkan produk di atas dari kolom dengan komposisi setidaknya 95% komponen yang kurang mudah menguap, (2) bahwa campuran yang khas/tertentu memiliki titik didih rata rata 150oC dan (3) bahwa kolom dioperasikan dengan total reflux. Sehingga untuk campuran biner dengan komponen murni yang memiliki titik didih berbeda dengan ∆Tb, jumlah minimal dari pelat yang dibutuhkan untuk pemisahan yang “baik” dipaparkan dalam table 2-4. Secara sederhana kolom yang terbongkar jarang memiliki lebih dari satu pelat yang secara teoritis, meskipun pelat destilasi sendiri juga melengkapi satu plate.
Tabel 2-4 Jumlah dari pelat secara teoritis yang dibutuhkan untuk membuat pemisahan yang baik
∆Tb, OC Jumlah dari pelat
108 1 72 2 36 5 20 10 10 20 2 100
[After K.B Wiberg, Laboratory Technique in Organic Chemistry, McGraw-Hill, New York, 1960, p.44]
Perbandingan Refluk
Kondensasi uap berlangsung di bagian atas setiap kolom, dan kondensat yang baik ditarik kembali sebagai produk atau kembali ke kolom.Perbandingan antara jumlah kembali ke yang ditarik kembali disebut perbandingan refluks, R, yang dapat berbeda dari nol sampai tak terhingga.Untuk keperluan industri skala besar, nilai yang rendah dari R (sering kurang dari satu) yang diinginkan dalam rangka meningkatkan hasil distilat. Untuk kegunaan analitis, nilai besar R dibutuhkan (10 sampai 50 adalah kolom) untuk mempertahankan kondisi dekat dengan equlibrium dan dengan demikian untuk mendapatkan pemisahan yang lebih baik. Rasio refluks mungkin sudah ditetapkan oleh geometri kepala kolom atau dapat bervariasi dalam beberapa kolom dengan menyesuaikan posisi take-off, atau dengan
mengubah posisi kran, mungkin dengan alat pengatur waktu otomatis. Sebagai aturan praktis, rasio refluks harus kira-kira sama dengan jumlah pelat dalam kolom.
Kolom Fraksionasi
Dalam prakteknya, kolom tutup karet tidak nyaman untuk pekerjaan laboratorium. Hasil panen terlalu kecil dibandingkan dengan sejumlah besar bahan yang terkandung dalam kolom, dengan kata lain kolom tutup karet memiliki throughput kecil dengan perampokan besar. Sebuah pendekatan dari terjadinya peristiwa fenomena di kolom tutup karet dapat dicapai dengan memasukkan sekat, proyeksi, atau berbagai jenis bahan kemasan longgar atau keropos dalam kolom terbuka.Uap yang demikian kental dan sebagian revaporized sebanyak yang mereka melewatkan kolom, dan ada aliran kondensat terus menerus kembali ke bawah kolom.Jika kolom ini terisolasi dengan baik, suhu secara bertahap akan menurun ke arah atas kolom.Efektivitas kolom tersebut tergantung pada banyak faktor, seperti desain kemasan, kontrol suhu, panjang kolom dan tingkat di mana produk akan dihapus. Untuk mengukur efisiensi kolom di bawah kondisi operasi, kita membandingkan hasil (tingkat pemisahan) yang diperoleh dari kolom yang diberikan dengan yang diharapkan dari sebuah kolom gelembung-cap yang ideal memberikan gelar yang sama pemisahan.Jumlah pelat sebenarnya dalam kolom yang sesuai penutup karet difnes jumlah "pelat teoritis" di kolom yang diberikan. Sebuah penjelasan setara dengan jumlah pelat theretical adalah jumlah langkah yang diperlukan dalam didih diagram titik-komposisi untuk mencapai tingkat yang sama pemisahan, satu pemisahan kesetimbangan dicapai pada setiap pelat teoritis. Unit dasar efisiensi tinggi setara dengan pelat teoritis, HETP atau H, yang sama dengan panjang dari kolom dibagi dengan jumlah pelat teoritis. Perlu dicatat bahwa jumlah pelat teoritis, dan H, tergantung pada sifat campuran yang akan dipisahkan. Kami akan kembali ke konsep teoritis plat banyak waktu dalam diskusi ekstraksi dan kromatografi.
Jenis Kolom Fraksionasi
Beberapa jenis kolom yang umum digunakan akan dijelaskan secara singkat. (Gambar 2-19)
Gambar 2-19 Jenis Kolom Fraksinasi
Sebuah kolom Vigreux terdiri dari sebuah tabung kaca yang telah menjorok secara teratur dengan proyeksi memperluas ke dalam dan sedikit ke bawah. Ini mungkin terisolasi dengan pita asbes atau selae dalam jaket vakum. Itu adalah murah dan memungkinkan throughput yang relatif tinggi dengan perampokan rendah. Sebuah kolom Vigreux jauh lebih baik daripada tabung polos kosong, tapi yang terbaik itu masih agak tidak efisien.
Sebuah tabung gelas dikemas dengan potongan-potongan berbentuk tidak teratur bahan adalah salah satu formms paling umum dari kolom fraksionasi. Kaca atau logam heliks menawarkan permukaan yang besar untuk equilibrium yang baik antara uap dan cair. Heliks logam memberikan kolom lebih efisien daripada kaca, tetapi tidak dapat digunakan dengan campuran korosif. Sebuah kolom dikemas dengan tembaga atau stainless steel spons adalah variasi mengejutkan baik dan sangat murah. Hal ini cukup untuk banyak distilasi laboratorium sederhana.
Sebuah kolom tabung konsentris terdiri dari lurus, seragam diameter ban persis berpusat dalam tabung luar presisi-bore. Uap melewati ruang anular (~ 75 mm) antara tabung sementara cairan menurun mengalir menuruni dinding. Daerah yang tinggi terhadap volume memberikan efisiensi yang sangat baik dengan perampokan yang sangat rendah.
Kolom pita berputar dirancang untuk kinerja optimal. Strip memutar kawat kasa dimasukkan ke dalam tabung dan berputar pada 2000-3500 rpm. Sebuah perampokan sangat rendah dicapai karena kelebihan cairan dilemparkan ke dinding tabung yang memungkinkan untuk menguras bebas.
Data kinerja yang umum diberikan dalam Tabel 2-5. Batas-batas yang diberikan adalah perkiraan untuk operasi biasa.
Tabel 2-5. Data kinerja kolom fraksionasi Jenis Throughput ml/min Holdup ml/plate HETP. cm Vigreux 5-10 0.5-2 7-12 Kaca Heliks 2-7 0.7-1 3-5 Logam Heliks 1-5 0.2-0.5 1.0-1.5 Tabung Konsentris 0.5-2 0.02-0.03 0.5-1.0 Pita berputar 3-5 0.01-0.03 1-3
LARUTAN NON IDEAL
Ketika larutan menampilkan tekanan uap total yang lebih besar dari perkiraan oleh hukum Raoult, dapat dikatakan bahwa itu menunjukkan deviasi positif. Molekul-molekul dari setiap zat tampaknya lebih memilih jenis mereka sendiri dan memiliki kecenderungan normal besar untuk terpisah dari campuran. Larutan yang demikian memiliki titik didih rendah yang tidak normal. Mungkin contoh yang paling terkenal adalah etanol-air, titik didih-komposisi diagram ditunjukkan pada Gambar 2-20. Sebuah titik didih minimal diamati dengan komposisi 95,6% (b/b) etanol. Di sebelah kiri minimum ini, air adalah komponen yang lebih mudah menguap, dan ke kanan, etanol adalah lebih tidak stabil. Suatu larutan yang mengandung etanol 95,6% memiliki titik didih terendah dan dikenal sebagai campuran azeotrop (campuran dari dua atau lebih komponen yang memiliki titik didih yang konstan) karena tidak dapat dipisahkan dengan distilasi saja.
Gambar 2-20. Titik didih-komposisi Diagram untuk sistem etanol-air.
Jika tekanan uap campuran lebih rendah dari yang diperkirakan oleh hukum Raoult, larutan memiliki deviasi negatif. Campuran ini menunjukkan titik didih tinggi yang tidak normal, sebagaimana dicontohkan oleh sistem aseton-kloroform yang ditunjukkan pada Gambar 2-21. Perilaku ini diprediksi bahwa setiap kali dua komponen bereaksi dalam beberapa cara satu sama lain (pembentukan molekul kompleks longgar). Komposisi larutan
% H2O 95,6% ETHANOL 100 0 78.15 78.3
yang tersisa di panci masih selalu mendekati yang mendidih sesuai dengan titik didih maksimum dan kemudian dengan komposisi konstan. Ini juga merupakan suatu azeotrop, contoh nya konstan-didih asam klorida yang mendidih pada 108,6⁰C pada 1 atmosfer dengan komposisi 20,2% (6N) HCl.
Gambar 2-21. Titik didih-komposisi Diagram untuk sistem aseton-kloroform.
Tidak diragukan bahwa lebih banyak azeotropes dari pada yang telah diakui karena mereka sering terjadi dengan komposisi hampir 100% dari salah satu komponen. Tidak ada cara untuk memprediksi terjadinya suatu priori. Beberapa kasus yang khas diberikan pada Tabel 2-6.
Tabel 2-6. Campuran azeotrop yang khas.
A. Dengan Titik Didih Minimum
Kandungan, % Titik Didih dari Kandungan
Murni, ⁰C Titik Didih Minimum, ⁰C
66.7 Benzene 33.3 Isopropanol } 71.9 100% acetone 100% chloroform 64.5 61.2 80%
11.7 tert-Butanol 88.3 Air } 79.9 44 Methanol 56 Etil Asetat } 62.3 Table 2-6. (lanjutan)
A. Dengan Titik Didih Maksimum
Kandungan, % Titik Didih dari Kandungan
Murni, ⁰C Titik Didih Maksimum, ⁰C
31.3 Asam Asetat 68.7 Triethylamine } 162 77 Asam Format 23 Air } 107.1 42 Fenol 58 Anilin } 186.2