Syarat Tumbuh Tanaman Cabai
Tanaman cabai dapat ditanam mulai dari ketinggian permukaan laut hingga 13.000 m. Tanaman ini memerlukan cuaca yang panas untuk pertumbuhannya. Suhu siang yang ideal untuk pertumbuhan tanaman cabai rata-rata adalah 20oC hingga 25oC. Pertumbuhan tanaman meningkat ketika suhu malam tidak melebihi 20oC. Bunga tidak terbuahi pada suhu udara di bawah 16°C atau di atas 32°C karena produksi tepung sari yang tidak baik. Pembungaan dan pembuahan akan optimum pada suhu antara 20oC dan 25oC (Rubatzky dan Yamaguchi 1997).
Cabai tidak menghendaki curah hujan yang tinggi atau iklim yang basah, karena pada keadaan tersebut tanaman akan mudah terserang penyakit, terutama yang disebabkan oleh cendawan. Curah hujan yang baik untuk pertumbuhan tanaman cabai adalah sekitar 600-1250 mm per tahun (Sumarni 1996).
Tanaman cabai dapat tumbuh pada berbagai jenis tanah, asal drainase dan aerasi tanah cukup baik. Bila diharapkan panen yang lebih cepat, cabai sebaiknya ditanam pada tanah lempung berpasir. Bila diharapkan panen lebih lambat cabai lebih cocok ditanam pada tanah yang lebih berat atau tanah liat. Tanah juga harus mengandung cukup bahan organik, unsur hara, dan air, serta bebas dari gulma, nematoda dan bakteri layu. Tingkat kemasaman (pH) tanah: 5.5-6,8 merupakan keadaan yang baik untuk tanaman cabai (Knott dan Deanon 1970; Knott 1962, diacu dalam Sumarni 1996). Keadaan pH tanah sangat penting karena erat kaitannya dengan ketersediaan unsur hara dalam tanah. Apabila ditanam pada tanah yang mempunyai pH lebih dari 7, tanaman cabai akan menunjukkan gejala klorosis, yakni tanaman kerdil dan daun menguning yang disebabkan oleh kekurangan unsur hara besi (Fe). Sebaliknya, pada tanah yang ber-pH kurang dari 5, tanaman cabai juga akan tumbuh kerdil, karena kekurangan unsur hara kalsium (Ca) dan magnesium (Mg) atau keracunan alumunium (Al) dan mangan (Mn) (Knott 1962, diacu dalam Sumarni 1996).
Tanah yang paling ideal untuk tanaman cabai adalah yang mengandung bahan organik sekurang-kurangnya 1.5% dan mempunyai pH 6.0-6.5. Suhu tanah juga merupakan faktor penting karena sangat erat hubungannya dengan penyerapan unsur hara oleh tanaman. Hasil penelitian menunjukkan bahwa
peningkatan suhu tanah dari 13.3oC menjadi 14.4°C dapat meningkatkan produksi buah cabai (Knott dan Deanon 1970, diacu dalam Sumarni, 1996).
Biologi Tanaman Cabai
Cabai termasuk tanaman dikotil berbentuk semak, batangnya berkayu, tipe percabangannya tegak atau menyebar dengan karakter yang berbeda-beda tergantung spesiesnya. Struktur perakarannya diawali dari akar tunggang yang sangat kuat, yang bercabang-cabang ke samping dengan akar rambut. Pola pertumbuhannya vegetatif berupa percabangan-percabangan dikotomi dari batang utama dan tunas-tunas lateralnya. Daun cabai merupakan daun tunggal dengan helai daun berbentuk bulat telur lebar atau lanset. Daun berwarna hijau atau hijau tua, tumbuh pada tunas-tunas samping berurutan, pada batang utama dan tunggal tersusun secara spiral (Rubatzky dan Yamaguchi 1997).
Bunga tanaman cabai umumnya bersifat tunggal dan tumbuh pada ujung ruas, serta merupakan bunga sempurna (hermaprodit). Mahkota bunga berwarna putih atau ungu tergantung kultivarnya, helaian mahkota bunga berjumlah lima atau enam helai. Diameter mahkota bunga antara 8 – 15 mm, tergantung pada spesiesnya. Pada dasar bunga terdapat daun buah berjumlah lima helai, kadang-kadang bergerigi. Setiap bunga memiliki satu putik (stigma), dengan kepala putik berbentuk bulat. Terdapat lima sampai delapan helai benang sari dengan kepala sari berbentuk lonjong, berwarna biru keunguan (Greenleaf 1986; Kusandriani 1996).
Pada saat bunga mekar, kotak sari masak dan dalam waktu relatif singkat tepung sari keluar mencapai kepala putik dengan perantaraan serangga atau angin. Tepung sari berbentuk lonjong, terdiri dari tiga segmen, berwarna kuning mengkilat. Dalam satu kotak sari berkembang sekitar 11.000 sampai 18.000 butir tepung sari. Tepung sari umumnya mempunyai ukuran hampir sama antar kultivar (Kusandriani 1996).
Ukuran buah cabai beragam dari pendek sampai panjang, sedangkan ujungnya runcing atau tumpul. Bentuk buah umumnya memanjang. Kedudukan buah adalah buah tunggal pada masing-masing ruas (ketiak daun) atau kadang-kadang fasciculate. Permukaan kulit dan warna buah bervariasi dari halus sampai bergelombang, warna mengkilat sampai kusam, hijau, kuning, coklat atau
kadang-kadang ungu pada waktu muda dan menjadi merah waktu matang (Greenleaf 1986; Kusandriani 1996).
Buah cabai berongga dengan jumlah rongga bergantung pada kultivarnya. Di dalam rongga buah terdapat plasenta tempat melekatnya biji. Ukuran rongga buah berbeda-beda tergantung ukuran buah. Daging buah renyah, tetapi kadang-kadang lunak tergantung pada kultivarnya. Buah mengandung banyak biji yang terletak di dalam buah, melekat pada plasenta. Umumnya biji cabai berwarna putih kekuningan berbentuk ginjal dan keras, kecuali biji C. pubescens yang berwarna hitam (Kusandriani 1996).
Cabai termasuk tanaman yang menyerbuk sendiri, meskipun demikian penyerbukan silang dapat terjadi di lapangan, terutama oleh serangga dan angin. Di antara kultivar-kultivar cabai terdapat perbedaan dalam hal letak kepala putik terhadap kotak sari yang disebut heterostyly. Persilangan sering terjadi pada bunga yang memiliki tangkai putik (stylus) yang panjang dan kepala putik (stigma) yang lebih tinggi daripada kotak sari. Penyerbukan sendiri terjadi pada bunga yang memiliki tangkai putik yang pendek, sehingga letak kepala putik lebih rendah daripada kotak sari (Greenleaf 1986; Kusandriani 1996).
Protogyny, yaitu fase dimana putik mencapai masa siap dibuahi (receptive) sebelum tepung sari (pollen) masak, terjadi pada beberapa spesies cabai. Hal ini penting dalam mencegah terjadinya penyerbukan silang untuk menjaga kemurnian varietas cabai (Kusandriani 1996).
Kemampuan bersilang antar spesies (species crossability) bervariasi, walaupun semua populasi alami adalah diploid dengan jumlah kromosom 2n = 2x = 24. Namun demikian, pada persilangan antar spesies tertentu terdapat halangan (barrier) (Greenleaf 1986; Kusandriani 1996).
Hama dan Penyakit Tanaman Cabai
Hama dan penyakit adalah kendala biologis yang sering dihadapi dalam usahatani cabai. Hama yang paling sering merugikan meliputi trip (Thrips parvispinus Karny), tungau (Polyphagotarsonemus latus Banks.) dan kutu daun (Myzus parsicae Sulz. dan Aphis gossypii) (Rubatzky dan Yamaguchi 1997). Penyakit yang sangat merugikan dan merupakan kendala biologis terpenting adalah antraknosa yang disebabkan oleh cendawan Colletotrichum capsici dan C
gloeosporioides. Patogen ini mulai menyerang saat buah menjelang matang dan seringkali menjadi penyakit pascapanen (Black et al. 1991).
Selain cendawan, patogen lain yang seringkali sangat merugikan usahatani cabai adalah virus (Black et al. 1991). Diketahui terdapat sekitar 45 jenis virus yang dapat menyerang tanaman cabai (Duriat 1996b). Berbeda dengan antraknosa yang serangan awalnya terjadi pada buah, virus terutama menyerang bagian vegetatif tanaman. Oleh karena itu serangan virus pada perkembangan awal tanaman dapat menyebabkan kerugian hingga 100% (Green dan Kim 1991).
Virus sebagai Patogen Tanaman
Virus adalah satu unit molekul asam nukleat yang biasanya terbungkus dalam protein atau lipoprotein pembungkus, berukuran sangat kecil, dapat berreplikasi hanya di dalam sel inang yang sesuai, dan berkemampuan menyebabkan penyakit (Matthews 1991). Dari 2000 virus yang telah diketahui, seperempatnya dapat menyerang dan menyebabkan penyakit pada tumbuhan. Virus menyebabkan penyakit tidak dengan cara mengkonsumsi sel atau membunuhnya dengan toksin, tetapi dengan menggunakan substansi sel inang, mengisi ruangan dalam sel dan mengganggu proses dan komponen seluler, yang selanjutnya mengacaukan metabolisme sel dan menyebabkan kondisi dan substansi sel abnormal yang mengganggu fungsi dan kehidupan sel atau organisme (Agrios 1997).
Virus masuk ke dalam jaringan tumbuhan antara lain melalui luka yang dibuat secara mekanik atau oleh vektor atau masuk ke dalam ovule bersama tepung sari yang terinfeksi. Infektivitas virus sangat ditentukan oleh bagian asam nukleatnya, yang pada sebagian besar virus tumbuhan berupa RNA. Beberapa jenis virus tumbuhan membutuhkan enzim RNA transkriptase untuk memperbanyak diri dan menginfeksi. Kemampuan RNA virus memproduksi baik RNAnya sendiri maupun protein tertentu, menunjukkan bahwa RNA membawa faktor genetik tertentu (Matthews 1991; Bos 1994).
lnfeksi tanaman oleh virus terjadi jika virus mampu memperbanyak diri di dalam sel awal yang terinfeksi dan mampu pindah dari sel yang satu ke sel yang lain sehingga menyebar secara sistemik di dalam jaringan tanaman (Mathews 1991). Perpindahan virus di dalam sel tanaman melalui plasmodesmata yang
merupakan penghubung antar sel. Perpindahan melalui plasmodesmata tersebut terjadi antara lain dengan bantuan movement proteins (MPs) yang berfungsi meningkatkan ukuran plasmodesmata dan mengikat RNA virus untuk melewati plasmodesmata. Adanya MPs tersebut menyebabkan virus dapat melewati plasmodesmata walaupun diameter virus lebih besar daripada diameter plasmodesmata. Sebagian besar virus dapat dengan cepat terangkut dalam jarak jauh melalui floem. Apabila virus telah masuk ke dalam floem, maka selanjutnya virus tersebut dengan cepat menuju titik tumbuh atau menuju daerah pemanfaatan bahan makanan seperti umbi dan rhizome (Agrios 1997; Mathews 1991).
Chilli Veinal Mottle Virus (ChiVMV)
Chilli veinal mottle virus (ChiVMV) adalah virus paling penting yang menyerang cabai di Asia subtropis dan tropis, dimana virus ini terdapat di 10 dari 11 negara yang disurvei (AVRDC 2002). Hasil survei lapangan yang dilakukan Taufik et al. (2005a) pada 11 lokasi yang menyebar di Jawa dan Sulawesi Selatan membuktikan bahwa penyebaran ChiVMV di Indonesia cukup luas. Virus ini selalu ditemukan pada setiap pertanaman cabai yang diamati.
ChiVMV tergolong ke dalam genus Potyvirus, famili Potyviridae. Potyvirus merupakan kelompok terbesar diantara virus-virus yang menyerang tanaman (Agrios 1997). Partikel virus berbentuk filamen, tidak beramplop dan lentur. Panjang partikel 750 sampai 765 nm dan diameter 12 sampai 13 nm (Siriwong et al. 1995, diacu dalam CABI 2000). Genom ChiVMV merupakan utas tunggal RNA dan genom diekspresikan sebagai poliprotein, dengan berat molekul sekitar 9.7 kb (Hull 2002). ChiVMV membentuk badan inklusi yang berbentuk cakra (pinwheel) (Hull 2002; Samad 1986, diacu dalam Lee et al. 1994).
ChiVMV dapat ditularkan secara mekanik, melalui penyambungan dan serangga vektor. Serangga yang menjadi vektor bagi ChiVMV adalah A. craccivora, A. gossypii, A. spiraecola, M. persicae, Toxoptera citricidus, Hysteroneura setariae, dan Rhopalosiphum maydis. ChiVMV bersifat non persisten dan tidak dapat ditularkan melalui benih (Ong et al. 1978, diacu dalam Ang 1995; Ong et al. 1979, diacu dalam Murayama et al. 1998).
ChiVMV memiliki kisaran inang yang cukup luas, meliputi gulma dan tanaman dari famili Solanaceae, seperti C annuum, C. frutescens, C. chinensis, N.
tabaccum, N. glutinosa, N. megalosiphon, N. benthamiana, N. sylvestris, Physalis floridana, P. minima, Datura stramonium, D. metel, L. esculentum, Nicandra physalodes, Petunia hybrida, dan S. melongena (CABI 2000). Infeksi ChiVMV pada fase pertumbuhan awal mengurangi ukuran daun yang diikuti dengan distorsi, serta produksi buahnya lebih sedikit dan lebih kecil (Shah dan Khalid, 2001). Selain itu, akibat infeksi virus ini telah dilaporkan dapat menyebabkan kehilangan hasil lebih dari 50 % di Malaysia (Ong et al.1979, 1980, diacu dalam Shah dan Khalid 2001). AVRDC (2003) bahkan melaporkan bahwa kehilangan hasil akibat infeksi ChiVMV bisa mencapai 100%. Ong et al. (1980), diacu dalam Ang (1995) melaporkan bahwa ChiVMV tidak hanya mengurangi keseluruhan hasil, tetapi juga kualitas dari buah cabai.
ChiVMV dapat menimbulkan gejala yang bervariasi pada daun tanaman cabai yang terinfeksi. Gejala pada daun cabai dapat berupa bercak berwarna hijau tua yang tidak beraturan (belang) dan penebalan tulang daun, permukaan daun tidak rata, daun menjadi lebih kecil dan kadang diikuti dengan malformasi daun serta tanaman menjadi kerdil (Siriwong et al 1995, diacu dalam Taufik et al. 2005b). Keparahan penyakit pada tanaman tergantung pada kultivar dan waktu infeksi (Chiemsombat dan Kittipakorn 1996; CABI 2000).
Pemuliaan untuk Ketahanan Tanaman terhadap Virus
Secara umum ada tiga metode yang biasa digunakan untuk mengendalikan virus. Pertama, menghilangkan sumber inokulum di lapangan diantaranya dengan cara melakukan eradikasi tanaman yang telah terinfeksi virus, dan membersihkan gulma yang menjadi inang virus. Kedua, mencegah atau menghambat penyebaran virus dari satu pertanaman ke pertanaman lain. Karena virus sebagian besar ditularkan oleh serangga, maka pencegahan penyebaran virus dapat dilakukan dengan mengendalikan serangga vektor, baik secara kimiawi maupun biologis. Ketiga adalah dengan menggunakan kultivar tahan (Harrison 1987).
Diantara berbagai metode pengendalian virus tersebut, penggunaan kultivar tahan adalah yang paling baik. Di samping memberikan kepastian pengendalian virus yang lebih baik, metode ini merupakan yang paling murah, aman, tidak mencemari lingkungan, tidak memerlukan ketrampilan khusus bagi petani dan dapat mengendalikan virus kapanpun mulai menyerang (Hooker 1983; Frasser
1992). Namun demikian, oleh karena virus umumnya memiliki kisaran inang yang sangat luas, penggunaan kultivar tahan harus dibarengi dengan metode pengendalian lain, seperti pembersihan gulma inang virus dan pengendalian serangga vektor (Palukaitis et al.).
Tanaman yang tahan terhadap virus adalah tanaman yang mampu menghambat replikasi dan penyebaran virus di dalam tanaman atau perkembangan gejala (Russell 1981). Tahan adalah karakter tanaman yang berkebalikan dari rentan, dan dapat dikelompokkan menjadi sangat tahan, tahan, dan rentan. Ketahanan ini dapat diwujudkan sebagai kemampuan tanaman untuk membatasi perkembangan virus dalam sel tertentu sehingga virus tidak menyebar ke sel-sel yang lain (Greenleaf 1986; Matthews 1991). Matthews (1991) juga menyatakan bahwa mekanisme ketahanan dalam tanaman dapat berupa penghambatan dalam penyebaran virus dari: 1) sel yang terinfeksi ke sel sekitarnya (penyebaran antar sel), 2) sel parenkima ke jaringan pengangkut (penyebaran antar jaringan), dan 3) jaringan pengangkut ke sel parenkima daun baru (penyebaran antar organ tanaman).
Ketahanan tanaman terhadap virus dapat dikelompokkan menjadi tiga tipe, yaitu ketahanan non-inang (non-host resistance), ketahanan kultivar, dan ketahanan terinduksi (Fraser 1987). Ketahanan non-inang adalah bila seluruh individu dari suatu spesies tidak dapat terinfeksi oleh suatu jenis virus tertentu. Spesies tersebut memang bukan inang bagi virus yang dimaksud. Ketahanan kultivar adalah kultivar tertentu tahan terhadap virus yang dapat menginfeksi kultivar lain dalam spesies tersebut. Sedangkan ketahanan terinduksi adalah ketahanan yang muncul pada suatu spesies rentan akibat terinduksi oleh suatu kondisi tertentu, seperti ketahanan yang timbul akibat proteksi silang strain atau jenis virus lain. Di antara ketiga tipe ketahanan tersebut, hanya ketahanan kultivar saja yang dapat bermanfaat bagi program pemuliaan.
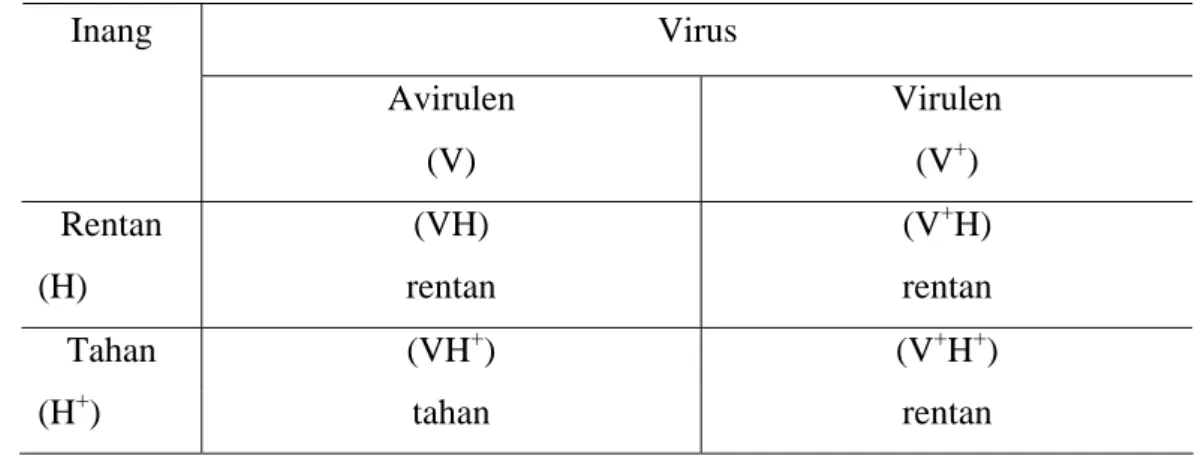
Konsep ketahanan terhadap penyakit diungkapkan oleh Flor pada tahun 1942 melalui hipotesis gene for gene (Plank Van der 1986). Dalam konsep ini dikemukakan bahwa setiap gen yang mengendalikan sifat tahan pada tanaman inang memiliki pasangan gen komplementer yang mengendalikan sifat virulensi pada patogen. Tanaman inang menunjukkan reaksi tahan jika gen yang
mengendalikan sifat tahan pada tanaman inang berpasangan dengan gen avirulen patogen. Bila patogen memiliki gen virulen pada pasangan tersebut, maka inang akan menunjukkan reaksi rentan (Plank Van der 1986; Fehr 1987) . Interaksi inang dan virus dapat digambarkan dalam model interaksi seperti pada Tabel 1. Tabel 1. Interaksi antara gen tanaman inang dan gen virus
Virus Inang Avirulen (V) Virulen (V+) Rentan (H) (VH) rentan (V+H) rentan Tahan (VH+) (V+H+) (H+) tahan rentan
sumber: van der Plank, 1968
Respon tahan hanya terjadi jika inang tahan berinteraksi dengan virus avirulen. Respon rentan terjadi jika inang rentan berinteraksi dengan virus avirulen atau virulen, atau inang tahan berinteraksi dengan virus virulen.
Fraser (1992) menyatakan bahwa alel resisten dominan sempurna umumnya berkaitan dengan mekanisme lokalisasi virus yang melibatkan lesio lokal. Alel dominan atau resesif tidak sempurna memungkinkan virus menyebar ke seluruh tanaman, tetapi menghambat multiplikasi virus atau perkembangan gejala. Sedangkan alel resesif penuh mungkin berkaitan dengan kekebalan.
Tahapan yang penting dalam program pemuliaan tanaman untuk menghasilkan varietas yang tahan terhadap penyakit adalah mendapatkan sumber ketahanan dan menentukan pola pewarisan sifat ketahanan tanaman inang serta sifat genetik dan interaksi antara inang dengan patogen (Hayes dan Johnson 1971; Allard 1960; Russel 1981). Tahapan tersebut dapat dilaksanakan dengan baik jika pengkajian dilakukan pada lingkungan epidemik bagi patogen, baik dalam laboratorium, rumah kaca maupun di lapang. Masalah yang sering dihadapi adalah: 1) penentuan dan penilaian ketahanan, 2) identifikasi genetik dari sifat ketahanan yang melibatkan interaksi gen yang tidak sealel, kaitan gen, serta adanya bermacam-macam strain virus.
Penentuan dan penilaian ketahanan diperlukan untuk membedakan antara tanaman yang tahan dan rentan secara tepat. Untuk keperluan tersebut maka dalam setiap pengujian dan seleksi ketahanan tanaman perlu diusahakan terciptanya kondisi lingkungan epidemik yang mampu memberikan kondisi epifitotik patogen (Russell 1981).
Metode yang umum dilakukan untuk membuat kondisi seluruh tanaman yang teruji terinfeksi virus adalah melakukan inokulasi buatan. Hal yang perlu diperhatikan untuk mendapatkan keberhasilan inokulasi buatan adalah: 1) inokulum harus tetap bermutu tinggi, 2) penerapan inokulasi sedapat mungkin diusahakan seragam untuk setiap tanaman, 3) kondisi lingkungan pada saat inokulasi dan dalam jangka waktu inkubasi harus sesuai bagi pertumbuhan parasit yang bersangkutan, dan 4) tanaman inang yang akan diuji harus bebas dari penyakit lain dan harus dalam keadaan fisiologik yang cocok untuk terjadinya infeksi atau serangan patogen (Green 1991).
Tanaman tahan dan tanaman rentan dapat dibedakan dengan mudah jika ketahanan dikendalikan oleh satu atau dua gen mayor. Pada keadaan tersebut ragam ketahanan akan menunjukkan sebaran terputus atau diskontinyu. Seringkali pada ketahanan yang dikendalikan oleh banyak gen, tidak ada perbedaan yang jelas antara individu tanaman tahan dan tanaman rentan dalam populasi yang bersegregasi dan ragam ketahanan tersebut akan menunjukkan sebaran yang kontinyu dengan perubahan perbedaan ketahanan yang kecil. Oleh karena itu Russell (1981) menyatakan sangat penting sekali untuk melakukan pengukuran atau pendugaan terhadap besarnya intensitas serangan dengan sistem pemberian nilai skor atas gejala yang muncul (indeks penyakit).
Varietas tanaman yang tahan virus dapat dirakit melalui seleksi plasma nutfah dan persilangan antar tetua terpilih. Sifat tahan ini dapat berasal dari varietas yang berbeda, varietas komersial, spesies liar sekerabat, spesies lain dalam satu genus, atau genus lain (Kallo 1988; Niks et al. 1993). Dalam upaya tersebut diperlukan adanya beberapa persyaratan yang harus dipenuhi antara lain: (1) diantara tanaman yang dibudidayakan, terdapat genotipe yang tahan terhadap virus, (2) gen yang mengendalikan sifat tahan virus ini sebaiknva tidak terpaut
dengan sifat agronomis yang tidak diinginkan, dan (3) pemindahan gen dari tanaman tahan ke tanaman penerima harus dapat dilakukan melalui hibridisasi.
Evaluasi genotipe dan kultivar cabai untuk ketahanan terhadap ChiVMV telah banyak dilakukan, dan dilaporkan adanya genotipe-genotipe atau kultivar yang memiliki potensi untuk digunakan sebagai sumber gen ketahanan terhadap ChiVMV (Green dan Kim 1994; Duriat et al. 1995a,1995b; Ang 1995; Dolores 1995; Chiemsombat dan Kittipakorn 1995, Sulyo et al. 1995).
Transfer gen ketahanan terhadap virus dari genotipe donor ke genotipe penerima umumnya dilakukan melalui seri persilangan silang balik. Persilangan antar varietas dalam satu spesies adalah yang paling mudah karena memiliki tingkat keberhasilan yang tinggi. Apabila sifat yang diharapkan berada pada spesies lain maka perlu dilakukan persilangan antar spesies. Salah satu hal yang sering menjadi kendala adalah adanya inkompatibilitas antar spesies yang cukup tinggi (Greenleaf 1986).
Agar program pemuliaan yang dilakukan menjadi efektif, pola pewarisan karakter dimaksud terlebih dahulu harus diketahui. Informasi tentang ada tidaknya efek maternal, aksi dan jumlah gen pengendali, serta nilai duga heritabilitas adalah sangat penting. Karakter yang pewarisannya dikendalikan oleh efek maternal menandakan bahwa gen pengendali karakter tersebut berada di luar inti (Mather dan Jink 1982). Ada tidaknya efek maternal dapat diuji dengan membandingkan data pengamatan pada F1 dan F1-resiprok (F1R).
Apabila terdapat pewarisan sitoplasmik atau pengaruh tetua betina maka keturunan persilangan resiproknya masing-masing akan berbeda, dan keturunannya hanya memperlihatkan ciri dari tetua betina (Gardner et al. 1991), sehingga untuk mempelajari pola pewarisannya antara keturunan F1 dan F1R-nya
tidak dapat digabung, karena segregasi populasi F2-nya akan berbeda dan
menyimpang dari hukum Mendel. Sebaliknya, apabila tidak terdapat pewarisan secara sitoplasmik atau pengaruh tetua betina, persilangan resiproknya akan memberikan hasil yang sama, sehingga antara keturunan F1 dan F1R-nya dapat
digabungkan.
Petr dan Frey (1966) menggunakan pendugaan terhadap nilai potensi rasio (hp) untuk mengetahui apakah suatu karakter dikendalikan oleh gen dominan atau
resesif. Potensi rasio adalah nisbah selisih nilai tengah kedua tetua (mid parent) dari rata-rata populasi F1 terhadap nilai tengah kedua tetua (mid parent) dari
rata-rata tetua tertinggi. Mather dan Jink (1982) mengemukakan bahwa aksi gen dominan atau resesif dapat juga diketahui melalui besaran nilai pendugaan parameter genetik dominan [h].
Aksi gen dominan atau resesif sangat menentukan dalam pelaksanaan metode silang balik (back cross). Pada karakter yang dikendalikan oleh gen resesif, diperlukan uji progeni pada setiap tahapan seleksi karena individu yang mengandung gen ketahanan tidak dapat dipisahkan langsung pada populasi silang balik yang dihasilkan Pada karakter yang dikendalikan oleh gen dominan, maka individu tahan dapat langsung diseleksi dari populasi silang balik tanpa harus melalui uji progeni (Halloran et al. 1979; Fehr 1947).
Penampilan karakter suatu tanaman dapat digolongkan menjadi dua kelompok, yaitu karakter kualitatif dan karakter kuantitatif (Poehlman 1987). Karakter-karakter kualitatif umumnya dikendalikan oleh sedikit gen (monogenic ataupun oligogenic) yang dicirikan dengan sebaran fenotipe pada generasi F2-nya
diskontinyu, pengaruhnya secara individu mudah dikenali (gen mayor), cara pewarisannya sederhana, tidak atau sedikit dipengaruhi lingkungan, sehingga memiliki nilai duga heritabilitas yang tinggi, dan penyidikan pengaruh gen dapat dilakukan dengan genetika Mendel (Allard 1961; Fehr 1987, Poehlman 1987). Karakter-karakter kuantitatif umumnya dikendalikan oleh banyak gen (poligenic) yang dicirikan dengan variasi fenotipik pada generasi F2-nya menyebar normal
(kontinyu) dengan pembagian kelas fenotip yang perbedaannya tidak jelas dan sulit diidentifikasi karena pengaruh masing-masing gen secara individu terhadap ekspresi suatu sifat adalah kecil (gen minor) dan bersifat kumulatif, ekspresinya sangat dipengaruhi oleh lingkungan, sehingga memiliki nilai duga heritabilitas yang rendah (Allard 1961; Fehr 1987; Poehlman 1987).
Pendugaan awal apakah suatu karakter dikendalikan oleh gen mayor, gen minor atau keduanya sekaligus dilakukan melalui pengamatan sebaran frekuensi pada populasi F2. Sebaran frekuensi F2 diskret menandakan bahwa karakter
dimaksud dikendalikan oleh gen mayor. Sebaran terusan satu puncak dan normal menandakan gen pengendali adalah gen minor. Sedangkan bila membentuk
sebaran terusan dengan dua puncak atau lebih, maka karakter tersebut dikendalikan oleh beberapa gen mayor dan gen minor sekaligus (Fehr 1987)
Analisis genetik untuk karakter yang dikendalikan oleh gen mayor biasanya dilakukan dengan analisis genetika Mendel, yaitu membandingkan nisbah frekuensi fenotipik hasil pengamatan pada populasi F2 terhadap nisbah Mendel,
atau nisbah fenotipik tertentu dengan uji Chi-Kuadrat (Fehr 1987; Crowder 1993). Untuk keperluan ini fenotipe pada populasi F2 dikelompokkan ke dalam
kelas-kelas tertentu sesuai dengan jumlah kelas-kelas dalam nisbah pembanding. Pendekatan ini menghasilkan dugaan jumlah dan aksi gen yang bersegregasi untuk karakter yang dipelajari.
Tidak semua turunan yang bersegregasi dapat dipisahkan ke dalam kategori-kategori tertentu yang nyata dengan rasio yang sederhana. Variasi rasio Mendel dijelaskan dengan dasar interaksi gen, yaitu: pengaruh satu alel dengan alel lainnya pada lokus yang sama (intra alelik) dan pengaruh satu gen pada satu lokus terhadap gen pada lokus yang lainnya (inter alelik).
Persilangan yang melibatkan satu pasangan alel (interaksi alel-alel pada lokus yang sama), berdasarkan hukum Mendel, dapat memberikan konsekuensi rasio fenotipik keturunan F2 hasil hibridisasi sebagai berikut (Strickberger 1972):
(1) 3:1 (satu gen bersifat dominan sempurna atau satu gen dengan aksi gen alel ganda), (2) 1:2:1 (satu gen bersifat dominan sebagian), dan (3) 1:2 (satu gen dengan aksi gen lethal).
Persilangan yang melibatkan dua pasang alel yang memberikan pengaruh pada penampilan karakter yang sama (interalelik), berdasarkan hukum segregasi dan kombinasi secara bebas dari Mendel, akan memberikan konsekuensi rasio fenotipik keturunan F2 hasil hibridisasi sebagai berikut (Strickberger 1972):
(1) 9:3:3:1 (dua pasang gen bersifat dominan sempurna; fenotipe baru dihasilkan dari interaksi di antara homozigos dominan maupun resesif)
(2) 9:3:4 (dua pasang gen bersifat dominan sempurna, tetapi satu pasang gen bila berada dalam keadaan homozigot resesif akan memberikan pengaruh kepada pasangan yang lain).
(3) 9:7 (dua pasang gen bersifat dominan sempurna, tetapi keduanya bila berada dalam keadaan homozigot resesif akan saling memberikan pengaruh).
(4) 12:3:1 (dua pasang gen bersifat dominan sempurna, tetapi satu pasang gen bila berada dalam keadaan homozigot dominan akan memberikan pengaruh kepada pasangan yang lain).
(5) 15:1 (dua pasang gen bersifat dominan sempurna, tetapi keduanya bila berada dalam keadaan homozigot resesif akan saling memberikan pengaruh).
(6) 13:3 (dua pasang gen bersifat dominan sempurna, tetapi satu pasang gen bila berada dalam keadaan dominan akan memberikan pengaruh kepada pasangan gen ke-dua, dan pasangan gen ke-dua bila berada dalam keadaan homozigot resesif akan memberikan pengaruh kepada pasangan gen pertama).
(7) 9:6:1 (dua pasang gen bersifat dominan sempurna; interaksi di antara pasangan dominan akan memunculkan fenotipe baru).
(8) 7:6:3 (dua pasang gen, dengan satu pasang gen bersifat dominan sempurna dan pasangan gen yang lain bersifat dominan sebagian; pasangan gen yang pertama jika berada dalam keadaan homozigos resesif akan memberikan pengaruh kepada pasangan gen ke-dua).
(9) 6:3:3:4 (dua pasang gen, dengan satu pasang gen bersifat dominan sempurna dan pasangan gen yang lain bersifat dominan sebagian; masing-masing bila berada dalam keadaan homozigot resesif saling memberikan pengaruh, dan bila kedua pasangan gen hadir bersama dalam keadaan homozigos resesif, pasangan gen ke-dua akan memberikan pengaruh pada pasangan gen pertama).
(10) 7:4:3:2 (dua pasang gen, dengan satu pasang gen bersifat dominan sempurna dan pasangan gen yang lain bersifat dominan sebagian; fenotipe heterozigot gen dominan sebagian sama dengan homozigot resesif pada pasangan gen dominan sempurna, dan menimbulkan suatu pengaruh aditif bila keduanya muncul bersama).
(11) 1:2:2:1:4:1:2:2:1 (dua pasang gen bersifat dominan sebagian dan menimbulkan pengaruh aditif untuk setiap bagian gen dominan).
Nilai duga heritabilitas adalah parameter yang sangat penting dalam pemuliaan karena sangat berpengaruh terhadap keefektifan seleksi. Heritabilitas
didefinisikan sebagai proporsi total variabilitas yang disebabkan oleh faktor genetik terhadap variabilitas fenotipik suatu karakter (Allard 1960; Fehr 1987; Crowder 1993). Heritabilitas tipe ini dikenal sebagai heritabilitas arti luas (broad sense heritability) (h2bs), dan dihitung sebagai nisbah ragam genetik terhadap
ragam fenotipe.
Kontribusi genetik suatu individu merupakan nilai kumulatif dari komponen genetik aditif, komponen genetik dominan dan komponen interaksi (epistasis). Komponen genetik aditif merupakan komponen yang dapat tetap diwariskan, karena itu karakter-karakter yang memiliki proporsi komponen aditif yang besar sangat diharapkan dalam bidang pemuliaan. Falconer (1989) merumuskan heritabilitas sebagai proporsi ragam genetik aditif terhadap ragam fenotip, yang menggambarkan seberapa besar suatu karakter diwariskan ke keturunannya. Heritabilitas tipe ini dikenal sebagai heritabilitas arti sempit (narrow sense heritability) (h2ns), dan dihitung sebagai nisbah ragam genetik aditif terhadap
ragam fenotip (Falconer 1989).
Heritabilitas bukan merupakan besaran yang konstan. Besarnya nilai duga heritabilitas sangat bergantung pada metode pendugaan yang digunakan. Beberapa metode yang biasa digunakan meliputi: metode pendugaan komponen ragam, metode regresi tetua dan keturunan, dan metode pendugaan ragam lingkungan secara tidak langsung (Fehr 1987). Metode lain, yang biasa digunakan untuk menduga heritabilitas arti sempit, adalah dengan menggunakan populasi silang balik (Warner 1952). Klasifikasi tinggi rendahnya heritabilitas suatu karakter ditentukan oleh tinggi rendahnya nilai duga yang diperoleh. Menurut Stansfield (1983), heritabilitas dianggap rendah bila h2 < 0.2, sedang bila 0.2 ≤ h2 ≤ 5 0.5, dan tinggi bila h2> 0.5.
Apapun metode yang digunakan, ada beberapa asumsi yang harus dipenuhi untuk mendapatkan nilai duga heritabilitas yang akurat. Asumsi tersebut meliputi: 1) tidak ada interaksi non-alelik, 2) tidak ada interaksi genetik x lingkungan, 3) tidak ada interaksi antar gen, dan 4) ragam lingkungan pada populasi F2 dan silang
balik adalah sama (Warner 1952). Tidak terpenuhinya asumsi-asumsi menghasilkan nilai duga heritabilitas yang bias terlalu tinggi atau terlalu rendah.
Uji Skala (Scaling Test) dan Uji Skala Gabungan (Joint Scaling Test) adalah metode yang dapat digunakan untuk menguji ada tidaknya interaksi non-alelik (epistasis) ataupun interaksi genetik x lingkungan melalui pengujian kesesuaian model aditif - dominan (Singh dan Chaudary 1979; Mather dan Jink 1982). Hubungan nilai tengah antar generasi yang mengikuti model aditif-dominan merupakan indikasi tidak ada interaksi non-alelik ataupun interaksi genetik x lingkungan.
Uji skala gabungan juga dapat digunakan untuk melacak model genetik yang sesuai, sekaligus menduga nilai parameter nilai tengah generasi (m), parameter genetik aditif [d], dominan [h], interaksi genetik aditif x aditif [i], interaksi genetik aditif x dominan [j], dan interaksi dominan x dominan [1]. Berdasarkan nilai duga parameter genetik tersebut dapat diketahui komponen genetik yang mempengaruhi hubungan nilai tengah antar generasi (Mather dan Jink 1982).