AKTIVITAS BAKTERI PENGOKSIDASI AMONIUM ISOLAT ASR1 DAN ASR2 ASAL TAMBAK UDANG PADA SUMBER KARBON DAN SALINITAS YANG BERBEDA
Oleh :
TIKA TRESNAWATI G34102061
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2006
AKTIVITAS BAKTERI PENGOKSIDASI AMONIUM ISOLAT ASR1 DAN ASR2 ASAL TAMBAK UDANG PADA SUMBER KARBON DAN SALINITAS YANG BERBEDA
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Oleh :
TIKA TRESNAWATI G34102061
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2006
ABSTRAK
TIKA TRESNAWATI. Aktivitas Bakteri Pengoksidasi Amonium ASR1 dan ASR2 Asal Tambak Udang Pada Sumber Karbon dan Salinitas yang Berbeda. Dibimbing oleh IMAN RUSMANA dan TRI WIDIYANTO.
Proses oksidasi amonium atau nitrifikasi merupakan salah satu proses yang dapat digunakan dalam usaha perbaikan kualitas air tambak udang melalui pendekatan biokondisioner. Proses ini dapat dilakukan pada kondisi autotrof dan heterotrof. Kedua kondisi tersebut dibedakan berdasarkan substrat yang digunakan oleh bakteri sebagai sumber karbonnya. Habitat estuaria seperti tambak udang memiliki kondisi salinitas yang berfluktuasi, hal ini membuat aktivitas bakteri nitrifikasi dipengaruhi oleh tingkat salinitas.
Hasil pengamatan menunjukkan bahwa isolat ASR1 dan ASR2 dapat mengoksidasi amonium pada kondisi autotrof dengan karbonat sebagai sumber karbon dan pada kondisi heterotrof dengan glukosa, gliserol, asetat dan suksinat sebagai sumber karbon. Penurunan konsentrasi amonium yang terjadi disebabkan oleh penggunaan hasil senyawa oksidasi amonium sebagai sumber nitrogen dan sumber energi. Isolat ASR1 menunjukkan bahwa aktivitas oksidasi tertinggi adalah pada media dengan gliserol sebagai sumber karbon dengan persentase amonium yang dioksidasinya sebesar 83 %. Isolat ASR 2 menunjukkan bahwa aktivitas oksidasi amonium tertinggi adalah pada media dengan suksinat sebagai sumber karbon dengan persentase amonium yang dioksidasinya sebesar 98 %. Hasil pengamatan pada uji selanjutnya yaitu uji optimasi salinitas dengan salinitas 0, 5, 10, 15 dan 20 ppt yang menggunakan isolat ASR2 dengan suksinat sebagai sumber karbon memperlihatkan bahwa tingkat salinitas sebesar 20 ppt adalah yang tertinggi dalam tingkat salinitas uji untuk proses oksidasi amonium.
ABSTRACT
TIKA TRESNAWATI. Ammonium Oxidize Activity of ASR1 and ASR2 Bacterial Isolated From Shrimp Pond on Different Carbon Sources and Range of Salinity. Supervised by IMAN RUSMANA and TRI WIDIYANTO.
Nitrification process can be used as bioconditioning process in shrimp pond to improve water quality. Nitrification or ammonium oxidation is generally conducted by autotrophic and heterotrophic bacteria. Both of the process can be determinated from type of carbon sources used as a substrate. In estuary ecosystem such as shrimp ponds, salinity can be fluctuated, so that it can influence the nitrification process.
This result shows that ASR1 and ASR2 isolates were able to oxidize ammonium autotrophically with carbonate as carbon source and heterotrophically with glucose, glycerol, acetate, succinate as carbon sources. Ammonium concentration was decreased up to seven days of incubation in all carbon source treatments. The declining of ammonium concentration was due to the utilization of ammonium as nirogen and energy source through nitrification process. The highest nitrification activity of ASR1 isolate was found in the medium using glycerol as carbon source with the percentage of oxidated ammonium up to 83 %. And the highest nitrification activity of ASR2 isolate was found in the medium using glycerol as carbon source with the percentage of oxidated ammonium up to 98 %. The highest nitrification activity of ASR2 using succinate as carbon source in range salinity 0, 5, 10, 15, 20 ppt was found in 20 ppt.
Judul Skripsi : Aktivitas Bakteri Pengoksidasi Amonium Isolat ASR1 dan ASR2 Asal Tambak Udang pada Sumber Karbon dan Salinitas yang Berbeda
Nama : Tika Tresnawati NIM : G34102061
Menyetujui :
Pembimbing I, Pembimbing II,
Dr. Ir. Iman Rusmana, Msi. Dr. Tri Widiyanto, Msi.
NIP 131956713 NIP 320005966
Mengetahui :
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, MS. NIP 131473999
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 01 Nopember 1984 sebagai anak pertama dari dua bersaudara, dengan ayah Suparman dan ibu Heni Suyeni.
Pada tahun 2002 penulis lulus dari SMU Negeri 3 Bogor dan pada tahun yang sama diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Institut Pertanian Bogor (IPB) melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB).
Selama mengikuti perkuliahan di Departemen Biologi FMIPA IPB, penulis aktif menjadi asisten praktikum mata kuliah Biologi Dasar pada tahun ajaran 2005/2006, asisten praktikum mata kuliah Fisiologi Tumbuhan pada tahun ajaran 2005/2006, asisten praktikum mata kuliah Mikrobiologi Dasar pada tahun 2006/2007 dan asisten praktikum Ilmu Lingkungan pada tahun ajaran 2006/2007.
Pada bulan Juli-Agustus 2004 penulis melaksanakan praktik magang di Laboratorium Kultur Jaringan Tanaman (BrMC), Biotrop, Tajur. Pada bulan Juni-Juli 2005 penulis melaksanakan Praktik Lapangan di PT Unitex, dengan topik Manajemen Perusahaan, Manajemen Produksi dan Sistem Pengolahan Limbah PT Unitex, Tbk.
Penulis juga pernah mengikuti Program Kreativitas Mahasiswa (PKM) yang diadakan di Malang pada bulan Juli 2006 sebagai Penyaji Tingkat Nasional dan memenangkan medali setara emas bidang presentasi dengan judul karya tulis Isolasi Bakteri Amilolitik Toleran pH 9 Asal Tanah dari Taman Wisata Alam Situ Gunung, Sukabumi.
PRAKATA
Segala puji dan syukur penulis panjatkan kepada Allah SWT karena atas rahmat dan karuniaNya sehingga karya ilmiah ini dapat diselesaikan. Karya ilmiah ini disusun berdasarkan hasil penelitian dari bulan Januari 2006 sampai Juni 2006 dengan judul Aktivitas Bakteri Pengoksidasi Amonium Isolat ASR1 dan ASR2 Asal Tambak Udang Pada Sumber Karbon dan Salinitas yang Berbeda.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu penyusunan karya ilmiah ini, terutama kepada Dr. Ir. Iman Rusmana, Msi. dan Dr. Tri Widiyanto, Msi. selaku pembimbing selama penulis melakukan penelitian dan penyusunan karya ilmiah serta kepada Dr. Ir. Ence Darmo Jaya S.,Msi yang telah banyak memberi saran dan petunjuknya. Selain itu penulis mengucapkan terima kasih kepada seluruh pegawai Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB yaitu Mba Heni, Bu Kokoy, Pak Endang, dan Pak Jaka atas kerjasamanya selama penelitian.
Ungkapan terima kasih untuk sahabat-sahabat Biologi 39 atas kebersamaannya. Terima kasih yang tak terhingga kepada mama, bapak, Citra serta keluarga besar Harjo Pawiro dan Sunarya atas segala doa, dukungan serta kasih sayangnya, juga pada Riza Firmansyah untuk perhatian yang diberikan selama masa-masa sulit hingga hari ini.
Semoga karya ilmiah ini bermanfaat dan menambah wawasan bagi setiap pembacanya.
Bogor, November 2006
DAFTAR ISI
Halaman
DAFTAR TABEL ...vii
DAFTAR GAMBAR ...vii
DAFTAR LAMPIRAN ...vii
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian... 1
Waktu dan Tempat Penelitian ... 1
BAHAN DAN METODE Bahan ... 1
Metode ... 1
Penyiapan kultur induk ... 1
Uji Pengaruh Modifikasi Sumber Karbon Terhadap Aktivitas Oksidasi Amonium... 2
Uji Pengaruh Salinitas Terhadap Aktivitas Oksidasi Amonium ... 2
Analisis Kadar Amonium ... 2
Analisis Kadar Nitrit ... 2
Analisis Kadar Nitrat ... 2
HASIL DAN PEMBAHASAN Pemurnian dan Peremajaan Isolat ... 2
Uji Pengaruh Modifikasi Sumber Karbon Terhadap Aktivitas Oksidasi Amonium... 2
Uji Pengaruh Salinitas Terhadap Aktivitas Oksidasi Amonium ... 5
SIMPULAN ... 6
SARAN ... 6
DAFTAR PUSTAKA ... 7
DAFTAR TABEL
Halaman
1 Oksidasi amonium dengan menghasilkan nitrit, nitrat dan gas N20 oleh isolat ASR 1 setelah inkubasi selama tujuh hari pada sumber C berbeda ...4 2 Oksidasi amonium dengan menghasilkan nitrit, nitrat dan gas N20 oleh isolat ASR 2 setelah inkubasi selama tujuh hari sumber C berbeda ...4 3 Oksidasi amonium dengan menghasilkan nitrit, nitrat dan gas N20 oleh isolat ASR 2 setelah inkubasi selama tujuh hari pada tingkat salinitas berbeda dengan suksinat sebagai sumber C ...6
DAFTAR GAMBAR
Halaman
1 Pertumbuhan isolat ASR 1 selama tujuh hari inkubasi pada sumber karbon yang
berbeda...3 2 Pertumbuhan isolat ASR 2 selama tujuh hari inkubasi pada sumber karbon yang
berbeda...3 3 Penurunan kadar senyawa NH4+ oleh isolat ASR 1 pada sumber karbon yang
berbeda...3 4 Penurunan kadar senyawa NH4+ oleh isolat ASR 2 pada sumber karbon yang
berbeda...4 5 Pertumbuhan isolat ASR 2 selama tujuh hari inkubasi pada media suksinat dengan tingkat salinitas yang berbeda ...5 6 Penurunan kadar senyawa NH4+ oleh isolat ASR 2 media suksinat dengan tingkat salinitas yang berbeda ...5
DAFTAR LAMPIRAN
Halaman
1 a Konsentrasi senyawa amonium pada media kontrol pengujian aktivitas amonium pada isolat ASR 1 ...9 b Konsentrasi senyawa amonium pada media kontrol pengujian aktivitas amonium pada isolat ASR 2 ...9 c Konsentrasi senyawa amonium pada media kontrol pengujian aktivitas amonium isolat ASR 2 dengan suksinat sebagai sumber karbon pada tingkat salinitas
berbeda...10 2 Cara perhitungan persentase produk samping (berupa gas N2O atau senyawa nitrogen untuk proses asimilasi sel)...11
PENDAHULUAN
Latar Belakang
Kegagalan dalam budidaya udang sering disebabkan oleh turunnya kualitas air dan tanah tambak selama pemeliharaan (Mustafa et al 2001). Penumpukan bahan organik hasil degradasi sisa pakan secara anaerob dan ekskresi udang akan meningkatkan produksi senyawa yang beracun bagi udang antara lain amonium dan nitrit, sehingga laju pertumbuhan udang rendah (Miyamoto et al 1983). Penumpukan bahan organik juga dapat mengurangi wilayah layak huni bagi kehidupan udang dan mempengaruhi efisiensi oksigenasi dalam air media (Adiwidjaya et al 2001). Cara untuk mengatasi kondisi tersebut adalah melalui pendekatan ekofisiologi dengan didukung oleh teknologi untuk mencapai suatu tingkat produksi udang yang maksimal.
Salah satu metode bioremediasi untuk memperbaiki kualitas air dan tanah tambak adalah dengan menggunakan agen biokondisioner, yang dapat mengkondisikan senyawa kimia yang bersifat toksik menjadi bentuk lain yang tidak toksik dengan menggunakan aktivitas mikroorganisme (Sugama 2002). Bioremediasi senyawa nitrogen yang tidak diinginkan dalam perairan tambak seperti amonium dan nitrit dapat menggunakan bantuan aktivitas bakteri-bakteri pengoksidasi amonium atau disebut juga bakteri nitrifikasi (Rusmana 2003a).
Nitrifikasi merupakan proses oksidasi biologi yang mengubah amonium menjadi nitrat, yang terjadi melalui dua tahapan reaksi (Laanbroek et al 1994 ). Pada tahap pertama proses tersebut terjadi oksidasi amonium (NH4+) dari bentuk yang tereduksi sehingga menghasilkan senyawa antara yang lebih teroksidasi yaitu nitrit (NO2-) dan selanjutnya mengubah nitrit menjadi nitrat (NO3-) (Madigan et al 2003). Bakteri yang berperan pada proses nitrifikasi pada umumnya adalah bakteri genus Nitrosomonas dan Nitrobacter. Bakteri ini mendapatkan energi untuk penyusunan, pengaturan sel dan pertumbuhannya dari oksidasi senyawa nitrogen terutama amonium (Imamudin 1999).
Proses oksidasi amonium dilakukan oleh bakteri secara autotrof dan heterotrof (Atlas & Bartha 1998). Perbedaan kedua kondisi ini adalah pada substrat yang digunakan oleh bakteri sebagai sumber karbon. Bakteri nitrifikasi kemoautotrof dapat menggunakan CO2 atau karbonat sebagai sumber karbon. Nitrifikasi heterotrof dapat menggunakan senyawa asetat sebagai sumber karbon seperti yang terjadi pada Nitrobacter dalam kondisi kemoorganotrof (Madigan et al 2003). Lingkungan dasar tambak yang bersifat anaerob menghasilkan senyawa asetat dan suksinat dari
proses fermentasi, yang selanjutnya senyawa asetat dan suksinat dapat digunakan sebagai sumber karbon untuk bakteri nitrifikasi heterotrof. Selain senyawa tersebut, sumber karbon yang dapat digunakan oleh bakteri nitrifikasi heterotrof adalah format, gliserol dan glukosa (Atlas & Bartha 1998).
Faktor yang mempengaruhi proses nitrifikasi selain sumber karbon adalah konsentrasi NH4+, NO2-, oksigen terlarut, kelembaban, temperatur, derajat keasaman, senyawa penghambat, dan salinitas (Blackburn & Sorensen 1985). Lingkungan perairan tambak merupakan habitat estuaria, memiliki kondisi salinitas yang berfluktuasi sehingga aktivitas bakteri nitrifikasi dipengaruhi oleh tingkat salinitas (Somville 1983).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh modifikasi sumber karbon dan perbedaan tingkat salinitas terhadap aktivitas optimum oksidasi amonium pada isolat terseleksi, yang diharapkan dapat digunakan sebagai dasar ilmiah dalam pembuatan kultur mikrob yang aplikatif dalam perbaikan kualitas air tambak.
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Januari 2006 sampai dengan Juni 2006 di Laboratorium Mikrobiologi, Departemen Biologi FMIPA IPB, Bogor.
BAHAN DAN METODE
Bahan
Bahan yang digunakan adalah bakteri nitrifikasi asal tambak udang isolat ASR 1 dan ASR 2 koleksi Laboratorium Mikrobiota Pusat Penelitian Limnologi LIPI, Cibinong, Bogor. Metode
Penyiapan kultur induk
Media cair nitrifikasi yang digunakan memiliki komposisi (g/l) sebagai berikut Na2HPO4 11.02 g, NaH2PO4 0.7 g, MgCl2.6H2O 0.1 g, FeCl3.6H2O 0.014 g, CaCl2.2H2O 0.18 g, NH4 Cl 0.1 g, EDTA 0.2 g, dan 1 l akuades dengan tingkat salinitas sebesar 2 % dan pH 7. Media padat nitrifikasi dibuat dengan menambahkan 18 g/l agar. Langkah awal pembuatan kultur induk adalah dengan pemurnian dan peremajaan isolat. Pemurnian isolat dilakukan dengan mengambil satu lup isolat dari media pengkayaan kemudian digores secara kuadran pada media nitrifikasi padat yang selanjutnya diinkubasi pada suhu ruang (28-31˚C) selama 3 hari. Kultur induk dapat dibuat dengan mengambil satu lup isolat, dan diinokulasikan kedalam erlenmeyer yang berisi 50 ml media cair dengan konsentrasi
amonium ± 5000 µM. Kultur diinkubasi di atas inkubator berpenggoyang dengan kecepatan 110 rpm pada suhu ruang (28-31˚C) selama 3 hari.
Uji Pengaruh Modifikasi Sumber Karbon Terhadap Aktivitas Oksidasi Amonium
Sebanyak 2 ml kultur induk ditumbuhkan pada 50 ml media nitrifikasi dengan modifikasi sumber karbon yaitu karbonat, glukosa, asetat, suksinat dan gliserol. Konsentrasi amonium media ± 5000 µM, kemudian diinkubasi selama tujuh hari diatas inkubator berpenggoyang dengan kecepatan 110 rpm pada suhu ruang (28-31˚C). Masing-masing perlakuan dilakukan sebanyak 3 kali ulangan. Kontrol masing-masing perlakuan merupakan media dengan perlakuan sumber karbon namun tidak diinokulasikan isolat bakteri kedalamnya.
Pengukuran pertumbuhan sel dan aktivitas oksidasi amonium dilakukan pada hari ke-0, 2, 3, 5, 7. Pengukuran pertumbuhan sel dilakukan melalui analisa kerapatan optik (OD) menggunakan spektrofotometer pada panjang gelombang 550 nm. Pengukuran aktivitas oksidasi amonium dilakukan melalui analisis kadar amonium, nitrit dan nitrat pada medium (Greenberg et al 1992). Sebanyak 10 ml kultur isolat diendapkan dengan menggunakan sentrifuge Heraus Labofuge 200 pada kecepatan 4500 rpm selama 15 menit. Selanjutnya filtrat di analisis kadar amonium, nitrit dan nitratnya.
Jumlah amonium yang dioksidasi dari media diperoleh dengan menghitung selisih kadar amonium awal dengan kadar amonium saat analisis. Setelah didapatkan isolat terbaik dengan sumber karbon terbaik, dilakukan tahap selanjutnya yaitu pengaruh perlakuan salinitas terhadap aktivitas oksidasi amonium.
Uji Pengaruh Tingkat Salinitas Terhadap Aktivitas Oksidasi Amonium
Sebanyak 2 ml kultur induk isolat terbaik yaitu ASR2 ditumbuhkan pada 50 ml media dengan suksinat sebagai sumber karbon. Tingkat salinitas yang digunakan adalah 0, 5, 10, 15, 20 ppt. Pembuatan kadar salinitas dilakukan dengan melarutkan sebanyak 20 gram NaCl dalam 1000 ml, sebagai contoh untuk 20 ppt. Pengukuran pertumbuhan sel dan aktivitas oksidasi amonium dilakukan seperti langkah pada perlakuan sumber karbon.
Analisis Kadar Amonium
Uji kadar amonium dilakukan dengan cara diambil sebanyak 5 ml filtrat hasil pengendapan ditambah dengan 0.2 ml fenol alkohol, kemudian dikocok dan didiamkan selama 1 menit. Setelah itu, ditambahkan 0.2 ml Nitroprusid dan dikocok kembali, lalu ditambahkan 0.5 ml campuran hipoklorit dan
asam sitrat (1:4), kemudian didiamkan selama 1 jam dan diukur OD pada panjang gelombang 640 nm (Greenberg et al 1992). Nilai absorban yang diperoleh dikonversi menggunakan standar hingga diperoleh satuan dalam konsentrasi (µM). Jumlah amonium yang dioksidasi dari media diperoleh dari mengurangi kadar amonium awal dengan kadar amonium saat analisis.
Analisis Kadar Nitrit
Uji kadar nitrit dilakukan dengan cara diambil sebanyak 5 ml filtrat hasil pengendapan dengan 0.1 ml sulfanilamid, kemudian dikocok dan didiamkan selama 2-8 menit. Setelah itu, ditambahkan 0.1 ml NED (Naftalen Etilen Diamin), di kocok kembali , kemudian didiamkan selama 0.5 jam dan diukur OD pada panjang gelombang 540 nm (Greenberg et al 1992).
Analisis Kadar Nitrat
Uji kadar nitrat dilakukan dengan cara diambil sebanyak 2 ml filtrat hasil pengendapan ditambah dengan 0.2 ml brusin, kemudian dikocok. Setelah itu, ditambahkan 4 ml asam sulfat pekat lalu didiamkan selama 0.5 jam dan diukur OD pada panjang gelombang 420 nm (Greenberg et al 1992).
HASIL DAN PEMBAHASAN
Pemurnian dan Peremajaan Isolat
Isolat ASR 1 dan ASR 2 ditumbuhkan pada media nitrifikasi autotrof dengan waktu inkubasi selama satu minggu. Ciri morfologi dari isolat ASR 1 adalah bentuk koloni bulat, gram negatif, elevasi cembung dan berwarna kuning keputihan, sedangkan isolat ASR 2 memiliki bentuk koloni bulat, gram positif, elevasi timbul dan berwarna kuning tua (Widiyanto 2006). Isolat merupakan hasil isolasi dari tambak udang tradisional di Serang, Banten.
Uji Pengaruh Modifikasi Sumber Karbon Terhadap Aktivitas Oksidasi Amonium
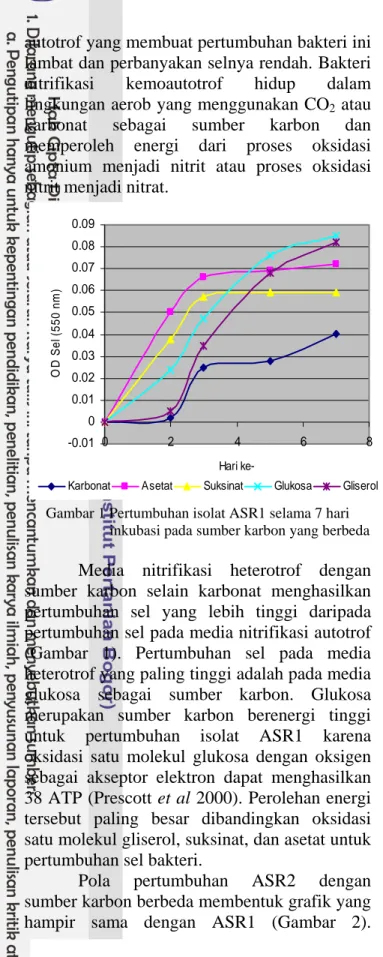
Pola pertumbuhan isolat nitrifikasi ASR1 dengan sumber karbon yang berbeda dapat dilihat pada Gambar 1. Umumnya pertambahan jumlah sel pada setiap perlakuan lebih banyak bila dibandingkan dengan kontrol (Lampiran 1). Kontrol juga dapat dijadikan sebagai indikator terjadi atau tidaknya kontaminasi terhadap media yang digunakan. Pertumbuhan ASR1 dengan media karbonat sebagai sumber karbon menunjukkan OD sel paling rendah jika dibandingkan dengan pertumbuhan pada media yang menggunakan sumber karbon yang lain.
William et al (1998) menyatakan bahwa media karbonat merupakan media nitrifikasi
autotrof yang membuat pertumbuhan bakteri ini lambat dan perbanyakan selnya rendah. Bakteri nitrifikasi kemoautotrof hidup dalam lingkungan aerob yang menggunakan CO2 atau karbonat sebagai sumber karbon dan memperoleh energi dari proses oksidasi amonium menjadi nitrit atau proses oksidasi nitrit menjadi nitrat.
-0.01 0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0.08 0.09 0 2 4 6 Hari ke-O D S e l ( 550 n m ) 8
Karbonat Asetat Suksinat Glukosa Gliserol
Pertumbuhan sel paling rendah ditunjukkan pada media karbonat sebagai sumber karbon yaitu dengan media pertumbuhan kondisi autotrof sedangkan yang tertinggi adalah pada media glukosa sebagai sumber karbon pada kondisi heterotrof. Pertumbuhan ASR1 dan ASR2 pada media heterotrof, khususnya media glukosa, sekitar 24-48 jam pada media nitrifikasi padat dan 48-72 jam pada media nitrifikasi cair, sedangkan untuk media autotrof dengan sumber karbon karbonat membutuhkan waktu lebih lama, yaitu sekitar 3 hari pada media nitrifikasi padat, dan 7 hari pada media nitrifikasi cair (Purnamasari 2004).
Gambar 1 Pertumbuhan isolat ASR1 selama 7 hari inkubasi pada sumber karbon yang berbeda
Media nitrifikasi heterotrof dengan sumber karbon selain karbonat menghasilkan pertumbuhan sel yang lebih tinggi daripada pertumbuhan sel pada media nitrifikasi autotrof (Gambar 1). Pertumbuhan sel pada media heterotrof yang paling tinggi adalah pada media glukosa sebagai sumber karbon. Glukosa merupakan sumber karbon berenergi tinggi untuk pertumbuhan isolat ASR1 karena oksidasi satu molekul glukosa dengan oksigen sebagai akseptor elektron dapat menghasilkan 38 ATP (Prescott et al 2000). Perolehan energi tersebut paling besar dibandingkan oksidasi satu molekul gliserol, suksinat, dan asetat untuk pertumbuhan sel bakteri.
Pola pertumbuhan ASR2 dengan sumber karbon berbeda membentuk grafik yang hampir sama dengan ASR1 (Gambar 2).
0 0.02 0.04 0.06 0.08 0.1 0.12 0 2 4 6 Hari ke-OD S e l ( 5 5 0 n m ) 8
Karbonat Asetat Suksinat Glukosa
Isolat ASR1 mampu tumbuh dan melakukan aktivitas oksidasi amonium pada media modifikasi sumber karbon dengan kondisi autotrof maupun heterotrof. Hal ini ditunjukkan oleh penurunan konsentrasi amonium, dimana senyawa amonium dioksidasi menjadi senyawa N-nitrit dan selanjutnya menjadi N-nitrat. Gambar 3 memperlihatkan bahwa aktivitas oksidasi amonium terbaik adalah pada media gliserol dengan persentase amonium yang dioksidasi sebesar 83 %, dan diikuti oleh media glukosa sedangkan yang terendah adalah pada media karbonat sebagai
sumber karbon. 0 1000 2000 3000 4000 5000 6000 7000 0 2 4 6 8 Hari ke-A m oni um ( µ M )
Karbonat Asetat Suksinat Glukosa Gliserol
Gambar 3 Penurunan kadar senyawa NH4+ oleh isolat ASR1 pada sumber karbon yang berbeda
Oksidasi molekul gliserol menghasilkan piruvat. Untuk mendapatkan energi, bakteri dapat menggunakan piruvat sebagai donor elektron dan nitrit sebagai penerima elektron (Rusmana 2003b). Nitrit didapatkan dari proses oksidasi amonium sebagai senyawa antara atau senyawa intermediet yang selanjutnya dioksidasi menjadi nitrat, sehingga proses oksidasi amonium dibutuhkan oleh bakteri dengan sumber karbon gliserol dalam mendapatkan energi.
Persentase nitrat yang diakumulasi oleh ASR1 pada media gliserol setelah inkubasi selama tujuh hari paling rendah jika dibandingkan dengan nitrat hasil akumulasi
Gambar 2 Pertumbuhan isolat ASR2 selama 7 hari pada sumber karbon yang berbeda
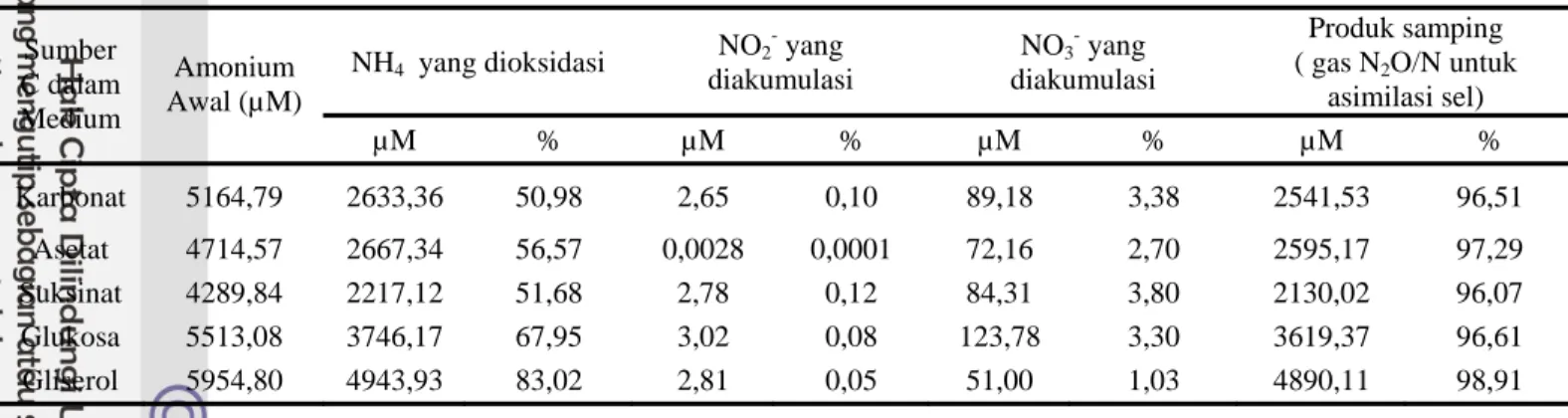
Tabel 1 Oksidasi Amonium dengan menghasilkan nitrit, nitrat dan gas N2O oleh isolat ASR 1 setelah inkubasi selama 7 hari pada sumber C berbeda NH4 yang dioksidasi NO2 yang diakumulasi NO3- yang diakumulasi Produk samping ( gas N2O/N untuk
asimilasi sel) Sumber C dalam Medium Amonium Awal (µM) µM % µM % µM % µM % Karbonat 5164,79 2633,36 50,98 2,65 0,10 89,18 3,38 2541,53 96,51 Asetat 4714,57 2667,34 56,57 0,0028 0,0001 72,16 2,70 2595,17 97,29 Suksinat 4289,84 2217,12 51,68 2,78 0,12 84,31 3,80 2130,02 96,07 Glukosa 5513,08 3746,17 67,95 3,02 0,08 123,78 3,30 3619,37 96,61 Gliserol 5954,80 4943,93 83,02 2,81 0,05 51,00 1,03 4890,11 98,91
Tabel 2 Oksidasi Amonium dengan menghasilkan nitrit, nitrat dan gas N2O oleh isolat ASR 2 setelah inkubasi selama 7 hari pada
sumber C berbeda
sumber karbon lain (Tabel 1). Bakteri pengoksidasi amonium yang menggunakan nitrit sebagai penerima elektron terakhir, menghasilkan gas N2O dan gas NO sehingga tidak terbentuk nitrat (Hagopian & Riley 1998). Isolat ASR2 memiliki aktivitas oksidasi amonium paling tinggi pada media suksinat. Potensial redoks suksinat yang rendah menyebabkan bakteri kesulitan untuk mendapatkan energi sehingga pertumbuhan selnya lebih rendah dibandingkan pada media heterotrof lain (White 2000). Bakteri yang sulit mendapatkan energi dari oksidasi suksinat menjadikan oksidasi amonium sebagai proses utama untuk pertumbuhan bakteri, hal ini menyebabkan tingginya kadar amonium yang dioksidasi. Seperti yang ditunjukkan pada gambar 4, kadar amonium yang terdapat dalam media suksinat pada hari ke 7 hampir mendekati 0. 0 1000 2000 3000 4000 5000 6000 0 2 4 6 Hari ke-A m oni um 8 (µ M )
Karbonat Asetat Suksinat Glukosa Gliserol
Gambar 4 Penurunan kadar senyawa NH4+ oleh isolat ASR2 pada sumber karbon yang berbeda
NH4 yang dioksidasi NO2- yang diakumulasi NO3- yang diakumulasi
Produk samping ( gas N2O/N untuk asimilasi sel) Sumber C dalam Medium Amonium Awal (µM) µM % µM % µM % µM % Karbonat 4793,07 3292,83 68,69 1,87 0,056 67,30 2,04 3223,65 97,89 Asetat 5300,25 4455,99 84,07 2,12 0,047 90,46 2,03 4363,40 97,92 Suksinat 4818,55 4765,86 98,90 0,70 0,014 132,07 2,77 4633,08 97,21 Glukosa 5100,56 4729,61 92,72 1,19 0,025 93,90 1,98 4634,51 97,98 Gliserol 5107,37 4619,99 90,45 1,01 0,021 92,61 2,00 4526,36 97,97
Isolat ASR1 dan ASR2 memperlihatkan bahwa glukosa sebagai sumber karbon merupakan media pertumbuhan yang aktivitasnya cukup tinggi dalam mengoksidasi amonium (Gambar 3 dan 4). OD sel bakteri yang tumbuh dalam media glukosa selama inkubasi berjumlah paling banyak dibandingkan dengan media lain. Hal ini menunjukkan bahwa peningkatan sel bakteri sebanding dengan peningkatan aktivitas oksidasi amonium. Faktor utama yang dapat mempengaruhi kecepatan proses nitrifikasi adalah konsentrasi mikroba nitrifikasi. Jumlah mikroba nitrifikasi tersebut dapat dicerminkan dengan waktu generasi mikroba yang berhubungan dengan jumlah energi yang dibutuhkan selama proses oksidasi (Laraspendi 2004).
Jika dibandingkan dengan media suksinat dan gliserol, media glukosa bukan merupakan media yang aktivitasnya paling tinggi untuk mengoksidasi amonium. Bakteri yang memanfaatkan sumber karbon berenergi tinggi seperti glukosa melakukan aktivitas oksidasi amonium menjadi nitrit dan nitrat, diduga sebagai lintasan untuk memperoleh energi ketika bakteri tidak memperoleh energi yang cukup dari oksidasi senyawa karbon.
Persentase produk samping yang dihasilkan karena proses nitrifikasi ini cukup tinggi pada semua media (Tabel 1 & 2). Presentase produk samping dapat diketahui dengan menggunakan perhitungan (Lampiran 2). Produk samping dari reaksi oksidasi amonium ini dapat berupa gas N2O atau dapat juga digunakan sebagai senyawa nitrogen yang terlibat dalam metabolisme bakteri pengoksidasi amonium setelah diasimilasi oleh
sel. Isolat ASR1 dan ASR2 dapat menghasilkan N2O selama proses nitrifikasi autotrof maupun heterotrof. Pada lingkungan perairan estuaria seperti lingkungan tambak, penghasil utama senyawa N2O berasal dari proses nitrifikasi. King & Nedwell (1985) menjelaskan bahwa produksi N2O meningkat secara proporsional dengan menurunnya konsentrasi amonium karena proses oksidasi.
Tabel 1 dan 2 memperlihatkan bahwa N-Nitrit yang terbentuk sangat sedikit, hal ini karena nitrit bersifat reaktif, tidak stabil dan merupakan senyawa peralihan dari oksidasi amonium menjadi nitrat.
Nitrat yang diakumulasi oleh media glukosa sebagai media nitrifikasi heterotrof lebih tinggi jika dibandingkan dengan media karbonat sebagai media nitrifikasi autotrof. Barraclough dan Puri (1994) menyatakan bahwa produksi nitrat selalu tinggi pada media nitrifikasi heterotrof dengan atau tanpa perlakuan senyawa inhibitor. Nitrifikasi autotrof dengan media karbonat sebagai sumber karbon menghasilkan aktivitas nitrifikasi yang rendah. Proses nitrifikasi kemoautotrof yang terdapat di alam yaitu pada sedimen akuatik dihambat oleh banyak senyawa kimia. Senyawa penghambat proses nitrifikasi diantaranya adalah nitrapyrin (Blackburn & Sorensen 1985), allylthiourea (Hauck 1980 diacu dalam Feliatra 2000). Hal ini menjelaskan bahwa proses nitrifikasi autotrof di alam memiliki aktivitas yang tidak cukup tinggi.
Uji selanjutnya yaitu uji optimasi salinitas digunakan isolat ASR2 dengan suksinat sebagai sumber karbon karena persentase amonium yang dioksidasinya lebih tinggi daripada persentase amonium yang dioksidasi oleh isolat ASR1 dengan sumber karbon gliserol. ASR1 mengoksidasi amonium sebesar 83% dengan gliserol sebagai sumber karbon didalam media , sedangkan ASR2 mengoksidasi amonium sebesar 98% dengan suksinat sebagai sumber karbon didalam media. Uji Pengaruh Tingkat Salinitas Terhadap Aktivitas Oksidasi Amonium
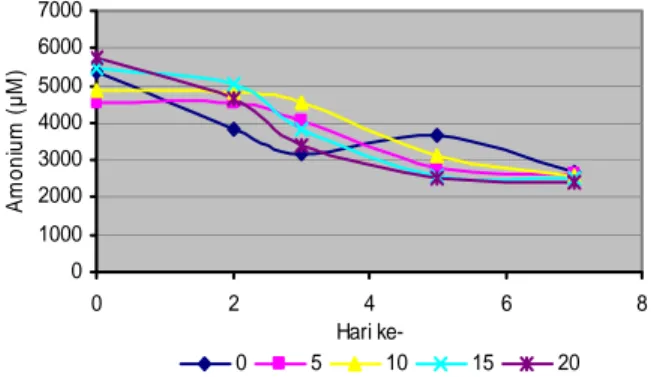
Dari hasil pengamatan dan perhitungan terhadap OD sel terlihat bahwa pola pertumbuhan isolat ASR2 hampir sama untuk setiap perlakuan salinitas (gambar 5). Pertumbuhan isolat ASR2 terbaik terdapat pada media suksinat dengan salinitas 20 ppt. Pertambahan jumlah sel tidak terlihat nyata pada setiap perlakuan. Pertumbuhan sel maksimum yaitu pada saat bakteri berada pada fase log atau eksponensial yang terjadi antara hari ke-0 sampai hari ke-2, sedangkan pada hari ke-3 sampai hari ke -7 pertumbuhan bakteri sudah memasuki fase stasioner yang diperlihatkan dengan jumlah sel pada fase ini cenderung konstan. Hal ini diduga karena
adanya kompetisi dalam penggunaan makanan, sementara jumlah nutrien yang tersedia sudah
mulai berkurang. 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0 2 4 6 Hari ke-O D S e l ( 5 50 nm ) 8 0 5 10 15 20
Gambar 5 Pertumbuhan isolat ASR 2 selama inkubasi 7 hari pada media suksinat dengan tingkat
salinitas yang berbeda
Adaptasi isolat ASR2 terhadap media suksinat dengan salinitas tinggi maupun rendah cukup baik. Isolat ASR2 dapat hidup dan menyesuaikan diri dengan kisaran salinitas yang beragam. Daerah tambak yang merupakan lingkungan estuaria biasanya memungkinkan terjadi fluktuasi salinitas. Bakteri yang dapat tumbuh pada salinitas yang tinggi merupakan halofilik obligat, sedangkan ASR2 selain tumbuh pada salinitas tinggi juga dapat tumbuh pada salinitas rendah sehingga dapat dikatakan bahwa isolat ASR2 bukan merupakan bakteri halofilik obligat.
Kenaikan aktivitas oksidasi amonium berbanding lurus dengan kenaikan salinitas (Gambar 6). Dapat terlihat bahwa semakin tinggi salinitas maka semakin tinggi pula tingkat oksidasi amonium walaupun kenaikannya tidak terlalu signifikan.
0 1000 2000 3000 4000 5000 6000 7000 0 2 4 6 Hari ke-A m oni um ( µ M ) 8 0 5 10 15 20
Gambar 6 Penurunan kadar senyawa NH4+ oleh isolat ASR 2 media suksinat dengan tingkat salinitas yang berbeda
Salinitas di estuaria berkisar antara 0.5-35 ppm (Kennish 1994 diacu dalam Wahyono 2002). Salinitas ini dapat bervariasi tergantung dari perbandingan antara limpasan air dari darat, masukkan air hujan dan penguapan. Perubahan salinitas musiman di estuaria biasanya merupakan akibat perubahan penguapan musiman dan perubahan aliran air tawar musiman.
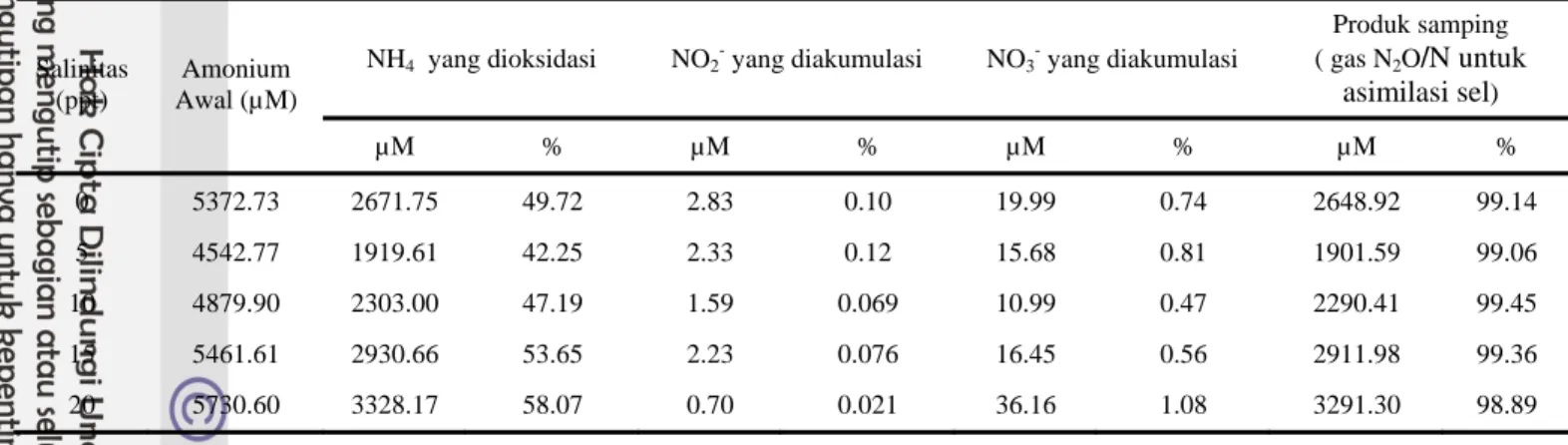
Tabel 3 Oksidasi Amonium dengan menghasilkan nitrit, nitrat dan gas N2O oleh isolat ASR 2 setelah inkubasi selama 7 hari pada tingkat salinitas berbeda dengan suksinat sebagai sumber C
NH4 yang dioksidasi NO2- yang diakumulasi NO3- yang diakumulasi
Produk samping ( gas N2O/N untuk asimilasi sel) Salinitas (ppt) Amonium Awal (µM) µM % µM % µM % µM % 0 5372.73 2671.75 49.72 2.83 0.10 19.99 0.74 2648.92 99.14 5 4542.77 1919.61 42.25 2.33 0.12 15.68 0.81 1901.59 99.06 10 4879.90 2303.00 47.19 1.59 0.069 10.99 0.47 2290.41 99.45 15 5461.61 2930.66 53.65 2.23 0.076 16.45 0.56 2911.98 99.36 20 5730.60 3328.17 58.07 0.70 0.021 36.16 1.08 3291.30 98.89
Henriksen dan Kemp (1988) dalam Feliatra (2000), mengemukakan bahwa bakteri nitrifikasi di lingkungan laut akan beradaptasi dengan fluktuasi salinitas untuk mencapai habitat pertumbuhannya.
Peningkatan salinitas seperti peningkatan tekanan, berhubungan dengan mekanisme reproduktif normal dari sel. Sel mampu tumbuh tetapi tidak mampu untuk membelah. Populasi bakteri yang lebih banyak memungkinkan aktivitas nitrifikasi lebih tinggi (Purnamasari 2004). Sehingga pertumbuhan sel yang cenderung tetap karena peningkatan salinitas menyebabkan laju nitrifikasi yang tetap juga.
Salinitas mempengaruhi enzim amonia reduktase dalam dinding sel. Jika kisaran salinitas diperluas lagi maka memungkinkan penurunan aktivitas nitrifikasi, karena tingginya salinitas menyebabkan enzim tersebut menjadi tidak stabil (Bock et al 1989).
Mekanisme bakteri untuk hidup pada salinitas tinggi adalah dengan cara mengadaptasikan tekanan osmotik komponen intraseluler agar sama dengan tekanan osmotik ekstraselnya. Selain itu sel bakteri harus mempunyai komponen konsentrasi garam yang rendah dalam sitoplasmanya (Oren 1999 diacu dalam Feliatra 2000).
Dari hasil pengamatan yang didapatkan, aktivitas oksidasi amonium yang dilakukan oleh ASR2 paling tinggi adalah pada media dengan salinitas 20 ppt. Data ini berbeda dengan data yang dilaporkan oleh Rysgaard et al (1999) yang menyebutkan bahwa laju nitrifikasi menurun hingga 50 % dengan meningkatnya salinitas dari 0 sampai dengan 10 %. Hal ini diduga disebabkan oleh perbedaan isolat dan sumber karbon yang digunakan pada uji tersebut. Isolat ASR2 diisolasi dari perairan tambak tradisional yang sudah diketahui bahwa sumber karbon yang optimal untuk proses oksidasi amonium untuk isolat ini adalah suksinat, sedangkan isolat yang digunakan Rysgaard et al (1999) adalah isolat dari sedimentasi estuaria yang belum dilakukan uji optimasi sumber karbon terhadapnya.
Tabel 3 menjelaskan bahwa persentase nitrit yang diakumulasi oleh ASR2 pada salinitas 0 ppt cukup tinggi. Menurut Nursyirwani (2000) aktivitas bakteri pengoksidasi amonium tinggi pada salinitas yang rendah, sedangkan persentase nitrat yang terbanyak dihasilkan oleh aktivitas pengoksidasi nitrit pada 20 ppt, sehingga lingkungan dengan salinitas yang tinggi cocok untuk mengoptimalkan aktivitas bakteri pengoksidasi nitrit. Nitrat yang lebih banyak memperlihatkan bahwa air tambak telah distabilkan karena keberadaan oksigen sehingga dapat melakukan proses nitrifikasi.
SIMPULAN
Sumber karbon dan salinitas memberikan pengaruh terhadap aktivitas bakteri pengoksidasi amonium. ASR1 memiliki aktivitas oksidasi amonium paling tinggi pada media gliserol sebagai sumber karbon dengan persentase amonium yang dioksidasi adalah sebesar 83%. Aktivitas oksidasi amonium isolat ASR2 paling tinggi adalah pada media suksinat sebagai sumber karbon dengan persentase amonium yang dioksidasi adalah sebesar 98%. Kelangsungan hidup isolat ASR2 terhadap perbedaan salinitas menjelaskan bahwa untuk sementara, isolat ASR2 dapat menyesuaikan diri dengan tumbuh dan melakukan aktivitas nitrifikasi pada tingkat salinitas yang diuji adalah tingkat salinitas 20 ppt, sehingga perlu dilakukan uji yang sama pada salinitas yang lebih tinggi.
SARAN
Perlu dilakukan karakterisasi lebih lanjut terhadap tingkat salinitas yang lebih tinggi dan sumber karbon yang lain untuk mendapatkan aktivitas oksidasi amonium yang lebih optimal sehingga dapat diaplikasikan dalam memaksimalkan proses biokondisioner lingkungan perairan tambak udang.
DAFTAR PUSTAKA
Adiwidjaya. 2001. Penyesuaian arah kincir dan penerapan parit internal untuk efisiensi oksigenasi pada budidaya udang windu sistem resirkulasi tertutup [Ulasan]. Natur Indonesia III : 40-46.
Atlas RM, Bartha R. 1998. Microbial ecology fundamentals and application. Ed ke-4. California: Benjamin/Cummings Science Pub.
Barraclough D, Puri G. 1995. The use of 15N pool dilution and enrichment to separate the heterotrophic and autotrophic pathways of nitrification. Soil Biol Biochem 27: 17-22.
Blackburn HT, J Sorensen. 1985. Nitrogen cycling in coastal marine environment. Dept. Ecology and Genetic. University of Aarhus: Denmark.
Bock E, Koops HP, Harms H. 1989. Nitrifying bacteria. Di dalam Schlegel HG, Bowein B (Editor). Autotrophic bacteria. Springer Verlag: New York.
Feliatra. 2000. Penggunaan salinitas pada isolat bakteri nitrifikasi yang diisolasi dari perairan tambak Bengkalis. J Natur Indonesia III: 32-38.
Greenberg AE, Clesceri LS, Eaton AD. Editor. 1992. Standart Metods for Examination of Water and Wastewater. 18th Edition. Publication Office American Public Health Association: Washington DC.
Hagopian DS, Riley JG. 1998. A closer look at the bacteriology of nitrification. Aquaculture Engineering 18: 223-224.
Imamudin H, Agustiyani D. 1999. Kultivasi bakteri nitrifikasi dari lumpur aktif. Puslitbang Biologi LIPI. Bogor. [Laporan teknis]
King D, Nedwell DB. 1985. The influence of nitrate concentration upon the end products of nitrate dissimilation by bacteria in anaerobic salt marsh sediment. FEMS Microbiol Ecol 31: 23-28.
Laanbroek HJ, Bodelier, PLE & Gerards S. 1994. Oxygen consumption kinetics of Nitrosomonas europaea and Nitrobacter hamburgensis grown in mixed continuous cultures at different oxygen concentrations. Arch. Microbiol. 161: 156-162.
Laraspendi G. 2004. Kajian Penurunan Nitrogen Amonia pada Proses Nitrifikasi dalam Pengolahan Limbah Cair Industri Perikanan. Bogor: Fakultas Teknologi Pertanian. Institut Pertanian Bogor.
Madigan MT, Martinko JM, Parker J. 2003. Brock Biology of Microorganisms. America: Pearson Education, Inc.
Millamena O. 1990. Organic pollution resulting from excess feed and metabolite build-up:
effect on Penaeus monodon postlarvae. Aquaculture engineering 9: 143 – 150. Mustafa et al. 2001. Pemanfaatan bakteri
pengurai bahan organik asal tanah gambut pada tanah dari tambak udang intensif. J Penelitian Perikanan Indones 7:31- 40. Nursyirwani. 2000. Aktivitas Bakteri Nitrifikasi
pada Konsentrasi Substrat dan Salinitas Berbeda. Pekanbaru: Lembaga Penelitian Universitas Riau.
Paerl HW. 1998. The N cycles. In Techniques in microbial ecology. Burlage et al. (Ed). Oxford: Oxford University Pr.
Prescott LM, Harley JP, Klein DA. 2000. Microbiology. 5th Edition. Prentice Hall: New Jersey.
Purnamasari W. 2004. Isolasi dan seleksi bakteri pengoksidasi amonium asal tambak udang.[skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam. Institut Pertanian Bogor.
Rusmana I. 2003a. Reduksi nitrat disimilatif pada bakteri: Isu lingkungan dan penerapannya. Hayati 4: 158-160.
Rusmana I. 2003b. Nitrous oxide formation in bacteria. J Microbiol Indones 8: 63-66. Rysgaard S, et al. 1999. Effects of salinity on
NH4+ absorbtion capacity, nitrification, and denitrification in Danish estuarine sediments. Estuaries: 22 (1) 21- 30. [Abstract].
Somville M. 1983. Use of nitrifying activity measurements for describing the effect of salinity on nitrification in Scheldt Estuary. App Environ Microbial. 424-426.
Sugama K. 2002. Status budidaya udang
introduksi serta prospek pengembangannya dalam tambak air
tawar. Warta Penelt Perikan Indones 8 : 19-22.
Wahyono. 2002. Karakteristik Nitrat Nitrit dan Amonia dalam Proses Percampuran di Perairan Muara Sungai Bengawan Solo Gresik Jawa Timur Periode Juli-Desember 2001. Bogor: Fakultas Studi Ilmu Kelautan. Institut Pertanian Bogor. White D. 2000. The Physiology and
Biochemistry of Prokaryot. New York : Oxford University Press.
Widiyanto T. 2006. Seleksi Bakteri Nitrifikasi dan Denitrifikasi untuk Bioremediasi di Tambak Udang. Institut Pertanian Bogor. Bogor. [Disertasi]
William EH et al. 1998. Molecular analisis of bacterial communities in a three-compartement granular activated sludge system indicates community level control by incompatile nitrification processes. Appl and Envir Microbiol 64: 2528-2532.
Lampiran 1(a) Konsentrasi senyawa amonium pada media kontrol pengujian aktivitas oksidasi amonium (nitrifikasi) pada isolat ASR1
0 1000 2000 3000 4000 5000 6000 0 2 4 6 8 Hari ke-Am o n iu m (µ M )
Karbonat Asetat Suksinat Glukosa Gliserol
Lampiran 1(b) Konsentrasi senyawa amonium pada media kontrol pengujian aktivitas oksidasi amonium (nitrifikasi) pada isolat ASR2
0 1000 2000 3000 4000 5000 6000 0 2 4 6 Hari ke-A m oni u m ( µ M ) 8
Karbonat Asetat Suksinat Glukosa Gliserol
Lampiran 1(c) Konsentrasi senyawa amonium pada media kontrol pengujian aktivitas oksidasi amonium isolat ASR2 dengan suksinat sebagai sumber karbon pada tingkat salinitas berbeda
0 1000 2000 3000 4000 5000 6000 7000 0 2 4 6 Hari ke-Am o n iu m ( µ M ) 8 0 5 10 15 20
Lampiran 2 Cara Perhitungan Persentase Produk Samping (Berupa N2O atau Senyawa Nitrogen Untuk Proses Asimilasi Sel)
Perhitungan :
% Amonium yang dioksidasi = µM Amonium yang dioksidasi X 100 % µM Amonium awal
% Nitrit yang diakumulasi = µM Nitrit yang diakumulasi X 100 % µM Amonium yang dioksidasi
% Nitrat yang diakumulasi = µM Nitrat yang diakumulasi X 100 % µM Amonium yang dioksidasi
% Produk samping = µM Amonium yang dioksidasi - µM Nitrit -µM Nitrat X 100 % µM Amonium yang dioksidasi