DAN PA 198 DENGAN PERANTARA
Agrobacterium tumefaciens GV 2260
ADE NENA NURHASANAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
tumefaciens GV 2260
ABSTRAKADE NENA NURHASANAH. Penyisipan Gen Fitase pada Tebu (Saccharum
officinarum) PS 851 dan PA 198 Dengan Perantara Agrobacterium tumefaciens GV 2260. Dibimbing oleh AGUS PURWITO dan DWI
ANDREAS SANTOSA.
Fitase mampu mengkatalisis hidrolisis senyawa fitat (myo-inositol hexakisphosphate) menjadi myo-inositol dan fosfat inorganik. Fitat merupakan bentuk penyimpanan fosfat yang paling banyak dalam tanah dan tanaman dan tidak dapat dimanfaatkan oleh tanaman. Transfromasi pada tebu (Saccharum officinarum) dengan gen fitase diharapkan mampu meningkatkan penggunaan P oleh tanaman dan meningkatkan hasil. Regenerasi merupakan tahapan penting dalam transformasi. PS 851 and PA 198 menunjukan pertumbuhan tunas dan daun yang baik pada media MS dengan penambahan 1 ppm NAA + 1 ppm BAP. Media terbaik untuk induksi dan pertumbuhan akar PS 851 adalah media MS dengan penambahan auksin 0.5 ppm NAA + 0.5 ppm IBA dan arang aktif, sedangkan untuk PA 198 pada media MS dengan auksin 0.2 ppm NAA + 0.25 ppm IBA dan arang aktif. Transformasi ini dilakukan pada kalus embriogenik tebu dengan metode modifikasi Santosa (2004). PS 851 menghasilkan sekitar 140 kalus yang dapat tumbuh pada media seleksi, sementara PA 198 hanya 20 kalus. Regenerasi kalus PS 851 yang telah ditransfromasi tumbuh menjadi planlet sekitar 129 dan hanya 105 planlet yang dapat dipindah ke media tanah. Beberapa tanaman transforman tersebut memiliki aktifitas fitase yang tinggi dibanding dengan tanaman nontransforman. Gen fitase terdeteksi pada klon PST 851-5 dengan menggunakan teknik PCR (Polymerase Chain Reaction).
Halaman
DAFTAR ISI ... iii
DAFTAR TABEL ... iv DAFTAR GAMBAR ... v DAFTAR LAMPIRAN ... vi PENDAHULUAN ... 1 TINJAUAN PUSTAKA TanamanTebu ... 3 Gen Fiatse ... 4 Agrobacterium tumefaciens ... 6 Vektor Plasmid ... 9 Kultur in-vitro ... 10 Analisis Molekuler ... 12
BAHAN DAN METODE Tempat dan Waktu Pelaksanaan ... 14
Bahan dan Alat ... 14
Metode Penelitian ... 15
Sterilisasi Eksplan ... 15
Percobaan 1. Regenerasi Tebu ... 15
Optimasi Media Tunas ... 15
Optimasi Media Akar ... 16
Percobaan 2. Transformasi Tebu ... 17
Uji Aktifitas Enzim Fitase ... 18
Isolasi Total DNA dan Analisis PCR ... 19
HASIL DAN PEMBAHASAN Sterilisasi Eksplan ... 20
Percobaan 1. Regenerasi Kalus ... 21
Optimasi Media tunas ... 21
Optimasi Media Akar ... 27
Percobaan 2. Transformasi Kalus Tebu ... 30
Uji Aktifitas Fitase ... 33
No. Halaman 1. Rata-rata jumlah tunas kultur in- vitro tebu varietas PS 851 pada
minggu ke-3 sampai minggu ke-5 ... 21
2. Rata-rata jumlah tunas kultur in- vitro tebu varietas PA198 pada minggu ke-3 sampai minggu ke-5... 22
3. Rata-rata jumlah daun kultur in- vitro tebu varietas PS 851 pada minggu ke-3 sampai minggu ke-5... 23
4. Rata-rata jumlah daun kultur in-vitro tebu varietas PA198 pada minggu ke-3 sampai minggu ke-5 ... 24
5. Rata-rata jumlah akar kultur in-vitro tebu varietas PS 851... 27
6. Rata-rata panjang (cm) akar kultur in-vitro tebu varietas PS 851... 27
7. Rata-rata jumlah akar kultur in-vitro tebu varietas PA 198... 28
8. Rata-rata Panjang (cm) akar kultur in- vitro tebu varietas PA 198 28 9. Hasil transformasi tebu dengan gen fitase... ... ... 30 10. Hasil uji aktifitas fitase tebu transforman dan nontransforman 33
No. Halaman 1. Komposisi Media LB ... 41
2. Komposisi Media MS untuk Induksi Kalus dan Regenerasi ... 42 3. Komposisi Media Transformasi Metode Modifikasi ... 43
Latar belakang
Tebu merupakan salah satu komoditas penting pada bidang perkebunan di wilayah tropis dan subtropis termasuk Indonesia. Hampir sekitar 65% produksi gula di dunia berasal dari tebu. Selain untuk produksi gula, tebu juga dapat dimanfaatkan untuk industri farmasi, industri pangan, industri lain yang menggunakan bahan dari hasil industri gula seperti untuk pakan ternak, pabrik kertas dan sebagai bahan baku produksi biofuel (etanol).
Prospek pasar gula di Indonesia cukup baik karena permintaan gula dalam negeri cukup tinggi. Hal ini dapat diketahui dari semakin tingginya impor gula yang dilakukan pemerintah. Meskipun produksi gula nasional mengalami peningkatan pada tahun terakhir yaitu dari 1.63 juta ton pada tahu 2003 menjadi 2.01 juta ton hingga akhir giling 2004 namun produksi tersebut tidak mampu mencukupi kebutuhan gula nasional sekitar 3.4 juta ton (Wiliarto, 2005).
Adanya ketidakseimbangan antara konsumsi dan produksi gula disebabkan oleh rendahnya produktifitas tebu dan ketidakefisienan industri gula nasional serta peningkatan jumlah penduduk yang mengkonsumsi gula. Akibat lain dari peningkatan jumlah penduduk adalah terjadinya pergeseran pertanaman tebu dan pertanaman lainnya.
Penanaman tebu pada lahan yang produktifitasnya rendah menimbulkan ketidakefisienan pemupukan terutama P. P yang diberikan pada tanaman biasanya tidak semuanya diserap dan digunakan dalam proses metabolisme. Beberapa bagian P tersebut akan disimpan dalam bentuk P organik (senyawa fitat). Dan jika pemupukan P terjadi secara berlebiham maka akumulasi senyawa fitat pun akan tinggi sehingga tanah tidak mampu lagi menyediakan P untuk diserap tanaman. Penggunaan varietas yang efisien dalam pemanfaatan P dapat dilakukan agar produktifitas tebu tinggi meskipun ditanam pada lahan yang relatif miskin hara P.
Perakitan varietas secara konvensional melalui program persilangan telah banyak dilakukan. Namun hasil yang diperoleh sulit untuk diperkirakan dan waktu yang dibutuhkan untuk memperoleh hasil silangan cukup lama. Proses perakitan lain yang dapat dilakukan adalah penyisipan gen asing yang berguna ke
dalam sel tanaman. Pada tanaman tebu, dengan proses ini diharapkan gen yang disisipkan tersebut terekspresi sehingga diperoleh varietas baru dengan produktifitas tinggi dan mampu meningkatkan bobot tebu dan rendemen gula.
Fitase merupakan suatu enzim yang mampu merombak fitat – senyawa organik yang menyimpan unsur fosfat dalam sel tanaman – menjadi ester yang berfosfat rendah dan melepaskan unsur fosfat inorganik. Unsur tersebut dapat dimanfaatkan tanaman untuk sintesis klorofil sehingga dapat meningkatkan fotosintesis dan metabolisme dalam tanaman yang secara tidak langsung dapat meningkatkan rendemen tebu. Fitase juga mampu meningkatkan ketersediaan hara mineral lain di dalam jaringan tanaman. Jika fitase dilepaskan ke lingkungan perakaran, akan terjadi peningkatan persediaan hara mineral di perakaran dan tanaman menjadi lebih efisien dalam pemanfaatan pupuk.
Proses transfer fitase ke dalam tanaman tebu dilakukan secara tidak langsung dengan menggunakan Agrobacterium tumefaciens. Telah banyak diketahui strain dari Agrobacterium tumefaciens yang dapat digunakan untuk memasukkan gen tunggal yang ada pada T-DNA dari plasmid Ti menuju genom tanaman. Cara ini banyak dilakukan karena tingkat keberhasilan dan kestabilan gen yang tinggi.
Dalam proses transformasi genetik penumbuhan jaringan tanaman tebu secara in-vitro untuk memperoleh kalus merupakan hal yang penting. Dalam metode kultur in-vitro ini terdapat beberapa hal yang perlu diperhatikan diantaranya komposisi media tumbuh, eksplan (genotipe tanaman) dan perimbangan zat pengatur tumbuh.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan tebu transforman yang mengandung gen fitase dan mendapatkan media yang sesuai untuk regenerasi tebu baik yang transforman ataupun tidak transforman.
Tanaman Tebu
Tebu (Saccharum officinarum) diduga berasal dari Papua Nugini. Budidaya tebu pertama kali dilakukan di India dan kemudian menyebar ke China, Arab dan Eropa. Selanjutnya tebu yang termasuk famili Gramineae ini dibudidayakan sebagai tanaman budidaya komersial di hampir 60 negara yang menyebar luas di lima benua. Tebu merupakan bahan baku penting dan mendukung pertumbuhan produksi gula, alkohol, furfural dextrans dan lainnya. Beberapa senyawa farmasi alami berasal dari tebu, selain itu bidang pertanian dan industri yang membutuhkan produk dari proses produksi gula juga sering memanfaatkan tebu misalnya untuk pakan ternak, pembuatan makanan, produksi kertas dan bahan bakar (Gustavo et al., 1998).
Produktifitas tanaman tebu tergantung pada rendemen yang akan diolah menjadi gula atau produk lainnya. Rendemen ini merupakan glukosa yang dihasilkan dari proses fotosintesis di daun dan ditranslokasikan ke seluruh bagian batang tebu (Wiliarto, 2005). Peningkatan rendemen ini dapat dilakukan melalui pemanfaatan teknologi dalam budidaya tanaman dan penggunaan bibit yang baik.
Sementara itu, ploidi tebu yang tinggi (2n = 36-170), fertilitas yang rendah, luasnya interaksi genotipe tanaman dengan lingkungan membuat pemuliaan tradisional dan penelitian genetik menjadi sulit (Gallo-Meagher dan Irvine, 1996). Kultivar tebu komersial, hibrida poliploidi yang kompleks, merupakan tanaman utama yang banyak terdapat di wilayah tropis (Blanco et al., 1997). Sebenarnya teknik pemuliaan tanaman tradisional, bersamaan dengan pendekatan bioteknologi klasik secara ekstensif telah digunakan untuk meningkatkan produksi tanaman dengan menyeleksi varietas yang telah diperbaiki yang lebih produktif dan resisten terhadap hama dan penyakit (Gustavo et al. 1998).
PS 851 merupakan varietas unggul merupakan hasil persilangan antara PS 57 (varietas unggul yang dilepas P3GI tahun 1985) dengan B 37172 (varietas introduksi dari Barbados, Amerika Latin). PS 851 mempunyai perkecambahan baik dengan sifat pertumbuhan awal dan pembentukan tunas yang serempak,
berbatang tegak, diameter sedang, berbunga jarang, kadar sabut sekitar 14%. Daun tua mudah lepas dan tanaman tegak memberikan tingkat potensi rendemen tinggi. Kondisi tanah subur dengan kecukupan air sangat membantu pertumbuhan pemanjangan batang yang normal (Sugiyarta, 5 Januari 2007, komunikasi pribadi).
Teknik perbanyakan tanaman secara aseksual merupakan suatu pendekatan yang mempunyai potensi dalam memanipulasi sistem tanaman pada tingkat sel. Beberapa spesies merespon terhadap satu atau lebih dari pendekatan-pendekatan ini, sementara tanaman lain, termasuk tebu, lebih sulit (Heinz et al., 1977). Selain itu tebu mempunyai karakteristik monokotil yang menarik untuk proses perbaikan sifat melalui transformasi genetik.
Pada awal perkembangannya, gen yang ditransfer ke dalam tanaman adalah gen-gen yang berfungsi dalam teknik transfer atau memiliki kemampuan sebagai sekuen pengendali (promotor) dalam mengendalikan ekspresi suatu gen di dalam sel tanaman. Dalam perkembangannya selanjutnya, gen yang ditransfer adalah gen-gen yang mengendalikan karakter-karakter yang mempunyai nilai ekonomi tinggi pada tanaman (Aswidinoor, 1990). Perkembangan sistem transfer gen ini akan sangat mendukung usaha untuk mengintroduksi gen agronomik yang penting sehingga menghasilkan kultivar tebu yang unggul (Gallo-Meagher dan Irvine, 1996).
Gen Fitase
Gen fitase yang akan disisipkan ke dalam tanaman tebu merupakan gen yang menghasilkan enzim fitase. Enzim ini secara alamiah dapat ditemukan dalam tanaman dan mikroorganisme, khususnya fungi. Peranan fitase dalam setiap organisme berbeda-beda. Di dalam tanaman, fitase terinduksi selama perkecambahan untuk membantu pertumbuhan benih dengan Pi dan tanaman dengan myo-inosotol bebas, yang merupakan faktor penting untuk pertumbuhan. Fitase mampu mengkatalisis hidrolisis monoester fosfat dari asam fitat (myo-inositol heksa fosfat) (Wyss et al., 1999). Hidrolisis fitat oleh fitase akan menghasilkan myo-inositol fosfat yang rendah dan fosfat in-organik (Andrea et al., 2000). Hidrolisis fosfomonoester dalam sistem biologi merupakan proses
yang penting. Hal ini berkaitan dengan metabolisme energi, regulasi metabolit dan berbagai signal transduksi. Selain itu hidrolisis fitat juga dapat melepaskan kation seperti K+, Mg2+, Zn2+ dan Ca2+ yang terikat pada asam fitat (Kerovuo et al., 2000).
Menurut IUPAC-IUB (Cole, 2001), terdapat dua jenis enzim fitase, yaitu : a. 3-fitase (EC3.1.3.8) yang mengkatalisis reaksi myo-inosotol
heksakisfosfat + H2O → myo-inositol – 1, 2, 4, 5, 6 – pentakisfosfat + Pi
b. 6-fiates (EC3.13.26) yang mengkatalisis reaksi myo-inositolheksakisfosfat + H2O → myo-inositol – 1, 2, 3, 4, 5, – pentakisfosfat + Pi
Jenis 3-fitase umumnya terdapat pada mikrob, 6-fitase dapat dijumpai pada biji-bijian (Cosgrove, 1980) tapi 6- fitase juga dapat dihasilkan oleh E. coli (Greiner et al., 1993).
Sumber fitase sangat beragam, mulai dari berbagai jenis mikrob, tanaman, hingga jaringan hewan mamalia. Beberapa jenis tanaman yang sudah diketahui memproduksi fitase diantaranya adalah kacang hijau (Phaseolus vulgaris), kedelai, gandum, padi, cickpea (Cicer artricum) dan vicia faba. Pada legum dan sereal, fitase dapat ditemukan dalam benih atau biji (Kyriakidis et al., 1998; Rutgersson et al., 1997; Platt dan Cook, 1991; Lolas dan Markakis, 1997; Cosgrove, 1980). Fitase yang terdapat pada kedelai tidak sama dengan fitase pada jagung dan mikrob (Carla et al., 2001).
Beberapa fitase telah diperbanyak dan dikarakterisasi termasuk fitase fungi dari Aspergillus niger, fitase bakteri dari Escherichia coli dan fitase mamalian (Kerovuo et al., 2000). Fitase lain yang telah ditemukan antara lain dari Pseudomonas sp (Irving dan Cosgrove, 1970), Enterobacter sp (Fraon et al., 1996), Aspergillus oryzae (Schimizu, 1993) dan Bacillus subtilis (natto) N-77 (Schimizu, 1992). Produksi fitase yang telah banyak diteliti secara mendalam adalah pada E. coli dan Saccharomyces cerevisiae (Grainer, 2004).
Menurut Maga (1982) fitat merupakan bentuk utama fosfat yang tersimpan dan jumlahnya lebih dari 80% total fosfor yang terdapat dalam sereal dan legum. Banyaknya senyawa fitat dalam tanaman berpengaruh langsung terhadap fosfor yang tersedia bagi tanaman. Kelebihan fosfat akan disimpan dalam bentuk asam fitat, sehingga pemupukan yang berlebihan dapat meningkatkan kadar fitat dalam
tanaman. Walaupun sumber fosfor dalam tanah mineral cukup banyak namun tanaman masih mengalami kekurangan fosfor. Pasalnya, sebagian besar fosfor terikat secara kimia oleh untsur lainmenjadi senyawa yang sulit larut dalam air. Mungkin hanya 1 % fosfor yang dapat dimanfaatkan tanaman (Novizan, 2002).
Bentuk P dalam tanah umumnya berupa P organik dan P inorganik. P organik dalam tanah terdiri dari residu yang tidak terdekomposisi, mikrob, dan bahan organik. Sementara P inorganik biasanya berikatan dengan Al, Fe dan Ca, merupakan senyawa yang mudah larut dan tersedia bagi tanaman. Fosfor harus ditambahkan ke dalam tanah sehingga mampu memenuhi kebutuhan P untuk pertumbuhan dan produksi yang optimum. Umumnya P cepat berubah menjadi bentuk yang tidak larut dan tidak tersedia bagi tanaman. Perubahan bentuk P ini sangat tergantung dari pH dan unsur yang terikat seperti Al, Fe dan Ca (Sharpley et.al., 2003). Ketersediaan fosfor dalam tanah ditentukan oleh banyak faktor, tetapi yang paling penting adalah pH tanah.
Menurut Santosa (2004) ekspresi gen fitase pada tebu diharapkan mampu membuat tebu lebih efisien dalam memanfaatkan fosfat, sehingga menurunkan penggunaan P, sedang jaringan tebu dan produk samping industri gulanya dapat dimanfaatkan untuk pakan ternak.
Agrobacterium tumefaciens
Pada tahun 1992, Bower dan Birch telah berhasil membuat tanaman tebu transgenik dari sel suspensi dan kalus embriogenik yang ditransformasi dengan teknik biolistik. Metode lain untuk transformasi tebu yang stabil melalui elektroporasi dari jaringan meristematik dan sel kalus embriogenik. Pengembangan tanaman resisten herbisida yang mengandung gen bar dan berasal dari varietas komersial Nco. 310 melalui transformasi biolistik juga telah berhasil dilakukan (Gallo-Meagher dan Irvine, 1996).
Transformasi tanaman dengan bantuan Agrobacterium tumefaciens, bakteri patogen tanaman yang hidup dalam tanah, adalah metode yang paling banyak digunakan untuk menyisipkan gen asing ke dalam sel tanaman dan kemudian meregenerasikannya menjadi tanaman transgenik (Gustavo et al., 1998). Agrobacterium tumefaciens merupakan penyebab crown gall, suatu
penyakit pada tanaman dikotil yang ditandai dengan fenotipe tumor pada bagian tanaman yang terinfeksi. (Zupan dan Zambryski, 1995). Kemampuan untuk menyebabkan penyakit ini berhubungan dengan gen penginduksi tumor (tumor inducing/Ti) dalam sel bakteri (Sheng dan Citovsky, 1996).
Tumor yang tumbuh tersebut menunjukan hasil ekspresi dari gen yang disandi oleh suatu segmen DNA bakteri yang ditransfer dan terintegrasi secara stabil ke dalam genom tanaman. Segmen DNA tersebut merupakan suatu segmen kopi yang disebut T (transfer) -DNA. T-DNA ini mengandung 2 tipe gen : pertama, gen onkogenik yang menyandi enzim yang terlibat dalam sintesis auksin dan sitokinin dan bertanggungjawab terhadap pembentukan tumor. Kedua, gen yang menyandi enzim untuk sintesis opin (Gustavo et al., 1998). Opin dipergunakan sebagai bahan makanan bagi bakteri penyebab tumor ini. Dengan demikian, bakteri ini membuat manipulasi genetik alamiah untuk menciptakan niche ekologi yang tergantung pada tanaman yang ditumpanginya. Dalam hal ini opin dapat disebut sebagai mediator kimiawi parasitisme bagi tanaman (Megia, 1993).
Agrobacterium memiliki tiga komponen utama yang berperanan dalam proses transfer DNA ke dalam sel tanaman (Sheng dan Citovsky, 1996). Komponen pertama adalah daerah T-DNA, yaitu fragmen yang ditransfer ke dalam sel tanaman. T-DNA terletak dalam plasmid Ti (200 kb) dari Agrobacterium. Menurut Gustavo et al. (1998) T-DNA diapit oleh 25 bp sekuen berulang yang bertindak sebagai suatu sinyal elemen cis pada alat transfer. Menurut Zupan dan Zambrisky (1995) elemen cis ini disebut sebagai border. Bagian yang berada di antara border tersebut akan ditransfer ke sel tanaman. Karena itu, coding region dari wild type T-DNA dapat diganti dengan sekuen DNA lain tanpa mempengaruhi proses transfer T-DNA dari Agrobacterium ke tanaman (Sheng and Citovsky, 1996).
Proses transfer T-DNA yang dimediasi oleh produk yang disandi oleh bagian dari daerah virulen (vir) yang juga berada dalam plasmid Ti. Daerah vir ini merupakan komponen kedua dari Agrobacterium dan berukuran 35 kb. Gen-gen vir ini merupakan produk yang secara langsung terlibat dalam proses
pembentukan T-DNA dan transfer gen, yang diatur sehingga ekspresi hanya terjadi pada sel tanaman yang memiliki jaringan luka, dari target yang diinfeksi.
Pada daerah vir terdapat suatu regulon yang terorganisir dalam 6 operon yang sangat esensial selama transfer T-DNA berlangsung (vir A, vir B, vir D, vir G) atau untuk peningkatan efisiensi transfer (vir C dan vir E) (Zupan dan Zambryski, 1995) dan 2 operon yang tidak esensial (vir F dan vir H) (Gustavo et al., 1998). Jumlah gen pada setiap operon berbeda-beda. Vir A, vir G dan vir F hanya mempunyai satu gen, vir E, vir C dan vir H mempunyai 2 gen, sementara vir D dan vir B mempunyai 4 dan 11 gen secara berurutan. Operon yang terekspresi secara konstitutif adalah vir A dan vir G (Gustavo et al., 1998). Jika ada induser, vir A dan vir G terekspresi secara konstitutif dan mengaktifkan operon lainnya. Induser yang telah dikarakterisasi dan paling efektif adalah fenolik monosiklik seperti asetosiringon (Sheng and Citovsky, 1996). Vir A akan mendeteksi senyawa fenolik kecil yang dilepaskan oleh bagian luka pada tanaman yang dihasilkan dari proses autofosforilasi. Proses fosforilasi vir A terhadap vir G mengarah pada aktifasi transkripsi dari gen vir (Zupan dan Zambryski, 1995). Selain induser, kondisi pH juga dapat mempengaruhi ekspresi dari gen vir. pH optimum untuk gen vir berkisar antara 5-5.8.
Komponen ketiga dari Agrobacterium adalah gen chromosomal virulence (chv) yang terdiri atas chvA, chvB, pscA (atau exoC) dan att. Perbedaan kromosom ini menentukan elemen genetik yang ditunjukan dengan peranan fungsional dalam pelekatan A. tumefaciens ke dalam sel tanaman dan koloni bakteri. Loki chvA dan chvB, terlibat dalam sintesis dan sekresi B-1.2 glukan, chvE dibutuhkan untuk peningkatan gula pada induksi gen vir dan kemotaksis bakteri, lokus pscA (exoC) berperanan dalam sintesis siklus glukan dan asam sukinoglikan dan lokus att terlibat dalam protein yang berada di permukaan sel (Gustavo et al., 1998).
Berdasarkan sifat alamiah Agrobacterium tersebut, pada dasawarsa terakhir telah diupayakan pemindahan gen komersial untuk tanaman monokotil dengan cara menyisipkan gen tersebut ke daerah T-DNA. Biasanya proses transfer gen dilakukan dengan menambahkan senyawa-senyawa fenolik seperti asetosiringon.
Vektor Plasmid
Plasmid merupakan fragmen DNA independen yang membawa sebagian informasi genetik tertentu, seperti resisten terhadap antibiotik tertentu atau karakter genetik lainnya. Banyak bakteri yang mengandung plasmid. Plasmid dapat ditransmisikan dari satu bakteri ke bakteri lain atau dari lingkungan ke bakteri inang, dan proses ini disebut sebagai transformasi. Plasmid juga dapat menggabungkan sekuen DNA-nya dengan sekuen DNA dari organisme lain, dan menghasilkan sebuah “plasmid rekombinan”. Rekombinan ini digunakan dalam bioteknologi untuk membawa DNA yang menyandi subtansi tertentu, misalnya pengatur pertumbuhan, ke dalam bakteri.
Plasmid Ti yang berukuran sangat besar sekitar 200 kb menjadi masalah utama dalam penyisipan T-DNA. Ukuran yang besar tersebut menyulitkan dalam manipulasi dan menentukan tempat pemotongan yang khas pada plasmid Ti. Secara umum terdapat 2 macam strategi dalam menyisipkan DNA, yaitu sistem vektor co-integrasi dan vektor ganda (Cramer dan Radin, 1990).
Pada umumnya vektor yang digunakan untuk tanaman dikotil maupun monokotil adalah vektor ganda. Dengan menggunakan vektor ganda penyisipan gen lebih mudah, karena vektor mengandung batas T-DNA berukuran jauh lebih kecil dari plasmid Ti yang sesungguhnya. Ukuran plasmid yang kecil ini memungkinkan adanya sisi enzim restriksi yang unik dan penyisipan gen yang lebih banyak (Loedin, 1994).
Plasmid yang akan digunakan adalah plasmid pBINPI-IIECS yang merupakan hasil kontruksi dan modifikasi. Plasmid ini didapatkan melalui kerjasama antara Federal Research Centre for Nutrition, Centre for Molecular Biology Jerman dan Fakultas Pertanian IPB. pBINPI-IIECS dapat digunakan sebagai vektor bagi tanaman tebu dengan ukuran 900 pasang basa (bp) (Santosa, in press) dengan konstruk gen kaset sebagai berikut:
EcoRI Asp7 18 BamHI/BglII Salt HindIII
CaMV 35S SP phy ECL03375
OSC nptII Kan R
Plasmid ini mempunyai beberapa kelebihan diantaranya jumlah salinan dalam E. coli besar, mempunyai ori sehingga plasmid dapat bereplikasi pada E. coli dan Agrobacterium serta membawa gen penyeleksi antibiotik nptII yang menyandi enzim neomysin phosphotransferase yang resisten terhadap kanamisin. Kanamisin berguna sebagai penyeleksi di tingkat tanaman (Brown, 1996).
Kultur In-vitro
Dalam metode transformasi untuk memperoleh tanaman transgenik umumnya dilakukan regenerasi dari jaringan atau sel yang diisolasi dan telah ditransfromasi. Regenerasi ini dilakukan secara in-vitro sehingga media dan lingkungan pertumbuhannya dapat dimanipualsi untuk menjamin tingginya frekuensi regenerasi. Tingginya frekuensi regenerasi memudahkan proses transfer genetik. Tujuan utamanya untuk menghasilkan sejumlah sel yang dapat beregenerasi sehingga dapat diakses untuk transfer gen. Rendahnya tingkat regenerasi dapat menghambat produksi tanaman transgenik tebu dengan pendekatan-pendekatan tersebut. Proses regenerasi ini merupakan tahapan yang sulit dalam transformasi.
Berdasarkan penelitian sebelumnya, Gallo-Meagher dan Irvine (1996) menyatakan bahwa beberapa tanaman kelompok Poaceae, dalam proses regenerasinya tergantung pada genotip, namun setiap kultivar tebu yang digunakan dalam penelitiannya dapat diregenerasikan dari kalus in-vitro. Kultur kalus tebu juga dapat menjaga kemampuan regenerasinya untuk waktu yang cukup lama. Meskipun demikian, pengkulturan kalus yang berulang-ulang dapat menyebabkan terjadinya variasi somaklonal. Pendapat yang sama dikatakan Ingelbrecht et al. (1999) bahwa beberapa anggota Poaceae sulit diregenerasikan,
CaMV35S SP Phy OCS RB LB Npt II Kan EcoRI Asp718 BamHI/BgIII Salt HindIII
namun beberapa kultivar tebu yang telah diuji mampu menghasilkan kalus yang dapat diregenerasikan. Transformasi untuk memperbaiki tanaman tebu dengan gen tertentu, seperti resistensi terhadap virus, dapat dilakukan dengan bantuan teknik kultur in-vitro.
Ketika dikulturkan secara in-vitro, kebutuhan kimia dan fisika tanaman harus dipenuhi melalui pengaturan media pertumbuhan dan lingkungan eksternal (cahaya, suhu dan lain-lain). Media tumbuh menyediakan semua ion mineral yang dibutuhkan untuk pertumbuhan dan perkembangan. Pada beberapa kasus, media juga harus menyediakan bahan organik tambahan seperti asam amino dan vitamin. Beberapa kultur sel tanaman, karena tidak berfotosinetsis, juga membutuhkan tambahan sumber karbon dalam bentuk gula (terutama sukrosa).
Susunan media yang dibutuhkan dalam kultur jaringan berbeda-beda, tergantung pada sumber eksplan dan tahap perbanyakan dari bahan tanaman yang dikulturkan. Demikian pula, pemilihan media cair dan media padat tergantung pada sumber dan tujuan dari kultur. Media kultur jaringan umumnya terdiri dari garam-garam mineral, sumber karbohidrat, vitamin, zat pengatur tumbuh dan senyawa-senyawa organik komplek seperti air kelapa, sari tomat, ekstrak ragi dan lain-lain (Beyl, 2000).
Kemampuan kalus untuk beregenerasi sangat ditentukan oleh media dan komposisi zat pengatur tumbuh dalam media. Zat pengatur tumbuh merupakan komponen kritikal dalam menentukan alur perkembangan sel tanaman. Zat pengatur tumbuh yang biasa digunakan adalah hormon tanaman atau hormon sintetik yang sesuai. Auksin merupakan salah satu zat pengatur tumbuh yang dapat mempengaruhi tingkat pembelahan dan perluasan sel. Pada konsentrasi yang rendah auksin dapat menstimulasi proses tersebut, tetapi pada konsentrasi yang tinggi pengaruh auksin dapat menghambat proses tersebut. Zat pengatur tumbuh lain yang banyak digunakan dalam kultur sel atau jaringan adalah sitokinin. Sitokinin lebih berperan dalam pembelahan sel daripada perpanjangan sel, dan dapat menghambat senesen (Forbes and Watson, 1992).
Terdapat bukti bahwa pemberian sitokinin eksogen dapat meningkatkan pembuatan protein tanaman. Pemberian sitokinin akan meningkatkan kecepatan pembuatan RNA (tRNA, rRNA dan mRNA), melalui pengaruhnya terhadap
peningkatan enzim chromatin bound RNA polymerase. Sitokinin juga bekerja pada pasca transkripsi dengan mendorong pembentukan polisom dan/atau mengaktifkan polisom sedemikian rupa sehingga dapat mengaktifkan mRNA yang tidak ditranslasi (Wattimena, 1990).
Dalam kultur tanaman tebu, hampir semua laboratorium menggunakan media modifikasi Murashige and Skoog (MS) dengan 3 mg/l 2.4-dichlorpphenoxy acetic acid (2.4-D) untuk induksi kalus. Penambahan air kelapa dan mio-inositol pada media merupakan hal yang esensial untuk stimulasi pembentukan kalus yang efisien. Sementara modifikasi dengan penambahan 1 mg/l kinetin, 1 mg/l naphthalene acetic acid (NAA) dan 400 mg/l kasein hidrolisat (CH) mendukung induksi diferensiasi tanaman dari kalus (Naik, 2001).
Untuk membantu regenerasi tebu transgenik yang mengandung gen bar Gallo-Meagher dan Irvine (1996) menggunakan media MS yang mengandung 1mg/l 2.4-dichlorpphenoxy acetic acid dan 1 mg/l bialaphos [2-amino-4(Hydroxymethylphosphinyl butanoic acid)]. Media perakarannya menggunakan 2 mg/l indole-3-butyric acid (IBA) dengan 3 mg/l bialaphos.
Penelitian lain yang dilakukan Ananda (2004) menunjukan bahwa media optimum untuk regenerasi kalus tebu yang telah ditransformasi dengan gen fitase adalah media MS dengan penambahan NAA 2 ppm, 1.3 ppm kinetin dan vitamin (thiamin-hydrochloride, biotin, pyridoxine- hydrochloride dan myo-inositol) 0.3 ppm.
Analisis Molekuler Tanaman Transgenik
Integrasi gen sisipan pada tanaman transgenik dapat dianalisis secara molekular dengan menggunakan teknik PCR (Polymerase Chain Reaction). Sejak ditemukannya teknik ini pada tahun 1980-an, PCR banyak digunakan untuk berbagai keperluan. Keuntungan analisis ini antara lain; cepat, DNA yang diperlukan sedikit, dapat dilakukan pada tahap dini dan teknik isolasi DNA-nya sederhana (Brown, 1996).
Kinerja PCR didasarkan pada penggunaan sepasang primer (primer forward dan reserve), yang akan didisain berdasarkan sekuen arbitrary atau sekuen spesifik yang mengapit segmen DNA yang akan diamplifikasi.
Kadang-kadang sekuen arbitrary atau sekuen spesifik yang sama dapat digunakan untuk primer forward dan primer reserve. PCR yang berdasarkan markernya dapat diklasifikasi menjadi dua tipe, yaitu menggunakan satu primer dan menggunakan sepasang primer (Gupta et al., 2002).
Amplifikasi DNA terjadi karena adanya enzim polimerase tahan panas yang dihasilkan oleh bakteri thermofilik, Thermus aquaticus. Hal-hal yang menentukan keberhasilan amplifikasi antara lain desain primer dan suhu yang digunakan. Sekuen primer yang tepat memungkinkan amplifikasi hanya terjadi pada fragmen spesifik dan tepat. Primer khusus bersifat komplemen terhadap DNA target. Semakin pendek ukuran primer (8-mer) maka semakin tidak spesifik fragmen yang dihasilkan. Sebaliknya jika primer semakin panjang (20-mer) maka fragmen yang akan dihasilkan semakin spesifik. Ukuran primer yang lebih besar dari 30-mer jarang sekali digunakan. DNA target yang diamplifikasi biasanya tidak lebih dari 3 kb, dengan ukuran ideal kurang dari 1 kb (Brown, 1996).
Tahap awal amplifikasi, utas ganda yang akan digunakan sebagai cetakan didenaturasi dengan suhu 94°C agar ikatan hidrogen pada utas ganda terlepas dan menjadi utas tunggal. Kemudian suhu diturunkan untuk proses annealing. Penurunan suhu dilakukan supaya primer menempel pada cetakan DNA. Suhu yang dibutuhkan untuk annealing ini tergantung pada sekuen dan panjang primer. Jika pasangan G-C pada primer lebih banyak daripada A-T maka suhu yang digunakan bisa lebih tinggi. Umumnya suhu annealing berkisar antara 40-60°C. Setelah tahap annealing ini suhu dinaikkan menjadi 72-74°C untuk proses pemanjangan (ekstensi) sehingga memungkinkan enzim polimerase bekerja (Dale dan Malcolm, 2002).
Selain PCR, aktifitas enzim fitase dapat diukur dengan menggunakan metode Greiner (unpublish). Uji aktifitas enzim ini dilakukan untuk memperkuat hasil analisis PCR. Pengukuran aktifitas fitase melalui besarnya ortofosfat yang lepas dari senyawa fitat dilakukan pada ekstrak kalus atau jaringan tanaman dengan menggunakan spektrofotometer pada panjang gelombang 355 nm.
Tempat dan Waktu Pelaksanaan
Penelitian dilakukan di Laboratorium Kultur Jaringan Departemen Budidaya Pertanian dan Laboratorium Mikrobiologi dan Bioteknologi Lingkungan Pusat Penelitian Lingkungan Hidup (PPLH) Institut Pertanian Bogor,
Indonesian Center for Biodiversity and Biotechnology (ICBB) dan Saraswanti Indo Genetech (SIG). Pelaksanaan penelitian dimulai September 2004.
Bahan dan Alat
Bahan tanaman yang digunakan untuk transformasi dan regenerasi adalah kalus tebu dengan varietas PS 851 dan PA198. Plasmid rekombinan yang digunakan adalah pBIN PI-IIEC yang membawa gen fitase dan marka seleksi kanamisin yang telah ditransfer ke dalam Agrobacterium tumefaciens GV 2260
(Santosa et al., in press).
Bahan untuk media tanam antara lain media induksi kalus dan media regenerasi yang komposisi medianya terdapat pada lampiran 2. Media untuk pertumbuhan kultur A. tumefaciens adalah media LB dengan komposisi terdapat
pada lampiran 1. Sementara komposisi media transformasi yang terdiri dari MS yang ditambah kasein hidrolisat, MS dengan anti oksidan dan media seleksi terdapat pada lampiran 3. Bahan lain yang digunakan adalah bahan untuk isolasi DNA, antara lain 250 mM NaOH, 250 mM HCl dan sampel buffer (500 mM Tris-HCl, 0.25% (v/v) Triton X-100.
Alat yang digunakan pada penelitian ini diantaranya pinset, botol kultur, skalpel, laminar air flow, pisau, bunsen, autoklaf, rak kultur, lemari es, plastik,
karet, inkubator, sentrifuse, tabung eppendorf, mikropipet, mikrofilter, tip, mortar dan penumbuk, sarung tangan, perangkat elektroforesis, alat PCR, air steril dan spektrofotometer.
Metode Penelitian Sterilisasi Eksplan
Pada percobaan ini digunakan eksplan dari bagian daun muda yang masih menggulung dari tanaman tebu yang berumur 3 bulan. Eksplan tersebut dicelupkan atau disemprot dengan alkohol 70% kemudian dibakar di atas nyala api. Pembakaran dilakukan sambil membuka dan membuang lapisan daun hingga diperoleh bagian yang berwarna merah muda. Selanjutnya eksplan dipotong dengan ukuran 2-3 mm. Potongan eksplan tersebut ditanam pada media MS I, modifikasi dengan penambahan 2.4-D 3 mg/L, kinetin 0.2 mg/L dan vitamin, dengan menggunakan pinset steril, masing-masing botol diisi 5-6 potong eksplan. Kemudian ditutup dengan plastik dan diikat dengan karet. Proses sterilisasi ini dilakukan dalam laminar air flow yang aseptik. Botol-botol yang telah diisi
eksplan disimpan di ruang inkubasi yang gelap.
Selama inkubasi (1 bulan) dilakukan pemeliharaan dengan menyemprotkan alkohol pada botol-botol tersebut untuk mencegah kontaminasi. Setelah masa inkubasi diharapkan terbentuk kalus dengan struktur yang kompak dan mampu berproliferasi sehingga dapat disubkulturkan pada media MS I yang lain atau media diferensiasi, yaitu MS II.
Percobaan 1. Regenerasi Tebu
Regenerasi kalus yang dilakukan pada penelitian ini disusun secara faktorial dengan Rancangan Acak Lengkap (RAL). Penelitian ini terbagi dalam 2 tahap, yaitu : (1) optimasi media diferensiasi tunas PS 851, PA 198 dan (2) optimasi media perakaran dengan perlakuan pemberian arang aktif pada media.
Optimasi Media Tunas
Tahap optimasi media regenerasi tunas PS 851, PA 198 menggunakan Rancangan Acak Lengkap faktorial 4 x 4 dengan 5 ulangan. Macam perlakuan kombinasi dari auksin dan sitokinin pada media. Sitokinin yang digunakan adalah BAP yang terdiri dari 4 taraf (0.5 ppm, 1 ppm, 1.5 ppm dan 2 ppm). Auksin terdiri dari 4 taraf, yaitu 2.4-D (1 ppm, 2 ppm) dan NAA (1 ppm, 2 ppm) sehingga pada tahap ini terdapat 16 kombinasi dan 64 satuan percobaan. Kalus diinkubasi pada
kondisi terang dengan suhu 28 °C selama 6 minggu. Pengamatan dilakukan terhadap jumlah tunas yang tumbuh dan jumlah daun tiap tunas. Model rancangan yang digunakan adalah :
Yijk = μ + αi + βj + (αβ)i j + ε i jk
μ = nilai rataan umum
αi = pengaruh auksin pada media regenerasi ke-i ( 2.4-D 1 ppm dan 2
ppm, NAA 1 ppm dan 2 ppm)
βj = pengaruh BAP pada media regenerasi ke-j (0.5 ppm, 1 ppm, 1.5
ppm dan 2 ppm)
(αβ)i j = pengaruh auksin pada media regenerasi ke-i, BAP pada media
regenerasi ke-j.
ε i jk = pengaruh galat auksin pada media regenerasi ke-i, BAP pada
media regenerasi ke-j, ulangan ke-k.
Optimasi Media Akar
Tahap optimasi media perakaran PS 851 dan PA 198 menggunakan Rancangan Acak Lengkap faktorial 4x2 dan 5 ulangan. Macam perlakuan terdiri dari 4 taraf perlakuan auksin, yaitu: 0.2 mg/l NAA + 0.25 mg/l IBA; 0.2 mg/l NAA + 0.50 mg/l IBA; 0.5 mg/l NAA + 0.25 mg/l IBA; 0.5 mg/l NAA + 0.50 mg/l IBA dan perlakuan arang aktif yang terdiri dari 3 taraf (0 dan 2 gr/l ). Pada tahap ini terdapat 8 kombinasi dan 40 satuan percobaan. Pengamatan dilakukan terhadap jumlah dan panjang akar. Model rancangan yang digunakan adalah :
Yijk = μ + αi + βj + (αβ)i j + ε i jk
μ = nilai rataan umum
αi = pengaruh perlakuan auksin ke-i
βj = pengaruh arang aktif pada media perakaran ke-j (0%, 5%, 10%)
(αβ)i j = pengaruh perlakuan auksin ke-i dan arang aktif pada media
perakaran ke-j
ε i jk = pengaruh galat kalus ke-i, air kelapa pada media regenerasi ke-j,
Percobaan 2. Transformasi Tebu
Plasmid pBINPI-IIECS memiliki promotor kimera CaMV 35S, gen fitase dari E. coli K12 dan OCS enhancer untuk ekspresi di tanaman. Selain itu vektor
tersebut dilengkapi dengan protease inhibitor II signal peptide. Konstruk vektor
tersebut telah berada dalam Agrobacterium tumefaciens GV2260 (Santosa et al., in press) yang kemudian digunakan untuk transformasi tebu pada penelitian ini.
Kalus embriogenik dipotong menjadi 2-3 mm, diinkubasi pada media 15 ml MScd cair dalam kondisi gelap, digoyang pada kecepatan 60 rpm selama 1 minggu. Tujuh jam sebelum kokultivasi 75 μl antioksidan (lampiran 3.) ditambahkan pada media. Selanjutnya mempersiapkan satu koloni Agrobacterium tumefaciens dalam cawan media dan bakteri tersebut ditumbuhkan pada media
LB dan 1 ml/l rif (100 mg/l) sampai diperoleh OD620 = 0.6 kemudian didapatkan
peletnya dengan cara melakukan sentrifugasi pada 2000 xg selama 10 menit. Pelet yang didapatkan dicuci dengan MScd cair (lampiran 3.) kemudian disentrifugasi selama 10 menit dengan kecepatan 2000 xg. Pelet ditambah MScd yang mengandung antioksidan dan diresuspensi. Kalus yang telah disiapkan diinokulasi dengan 0.5 – 0.75 ml suspensi bakteri (OD578 = 0.2) selama 5-10 menit
pada suhu ruang kemudian kalus dipindahkan ke kertas saring yang steril untuk menghilangkan suspensi bakteri dan kalus dipindahkan pada 30 ml MS yang mengandung 0.5 mg/l kasein hidrolisat, 100 mg/l asetosiringon, dan 50 mg/l kanamisin dalam 250 ml erlenmeyer, diinkubasi pada 28 °C, ruang gelap, dan digoyang 60 rpm selama 2 hari. Jika terdapat pertumbuhan Agrobacterium, media
diganti dengan yang baru. Setelah proses ko-kultivasi kalus dicuci dengan air steril sebanyak 2 kali dan dikeringkan pada kertas saring steril, kemudian ditransfer pada 25 ml MS yang mengandung 0.5 g/l kasein hidrolisat dan 1000 mg/l sefotaksim, inkubasi pada suhu 28 °C, ruang gelap, dan digoyang selama 2 jam pada kecepatan 60 rpm, selanjutnya kalus ditransfer kembali pada 30 ml MS yang mengandung 0.5 mg/l kasein hidrolisat dan 500 mg/l sefotaksim, diinkubasi pada suhu 28 °C, ruang gelap, dan digoyang selama 2 hari pada kecepatan 60 rpm (jika ada pertumbuhan media diganti dengan yang baru sampai tidak ada pertumbuhan) (Santosa et al., 2004). Setelah proses pencucian kalus ditransfer
ppm kanamisin. Prosedur ini merupakan metode modifikasi berdasarkan penelitian yang dilakukan sebelumnya (Ananda, 2004).
Uji Aktifitas Enzim Fitase
Metode yang digunakan adalah metode Greiner (2005) yang memanfaatkan spektrofotometer pada panjang gelombang 355 nm dan selanjutnya dihitung dengan menggunakan rumus sebagai berikut :
ΔE = Esampel – Eblanco ; Σ = 8.7 cm2 μmol-1; t = 30 menit
Volume total = 2000 μl dan volume enzim = 50 μl
0.1 gram kalus dihaluskan dalam mortar dengan 0.1 M Na-acetat untuk mengektraksi fitase. Sampel diinkubasi pada pH 5.0 dan suhu 4°C selama 3 jam sambil dikocok atau digoyang. Sampel disentrifugasi pada kecepatan 9000 x g dan supernatan yang diperoleh yang digunakan untuk mengukur aktifitas enzim fitase. Kemudian dibuat buffer yang mengandung 1.5 mM lnsP6 menggunakan
0.1 M Na-acetat dengan total volume 350 μl dan pH 4.5.
Supernatan hasil ektraksi kalus (sebagai sumber enzim kasar) dimasukan ke dalam buffer sebanyak 50 μl, diinkubasi selama 30 menit. Selanjutnya untuk menghentikan reaksi larutan AAM (aceton : 5N; asam sulfat : 10mM; amonium molibdat : 10 mM, 2:1:1 v/v) dimasukan sebanyak 1.5 ml, ditambahkan asam sitrat 100 μl dan diukur dengan spektrofotometer pada panjang gelombang 355 nm.
Isolasi Total DNA dan Analisis PCR
Isolasi DNA genom dilakukan dengan menggunakan metode Santosa et al., (2004). Jaringan daun sebanyak 2 mg digerus dalam mortar ditambah 200 µl
larutan TE dan 500 µl larutan buffer ekstraksi DAS-I, kemudian sampel dimasukkan ke dalam tabung 1,5 ml dan diinkubasi dalam es selama 5 menit. Larutan yang mengandung kloroform dan isoamil alkohol (24:1) dimasukan ke dalam larutan sampel yang telah diinkubasi. Sampel disentrifugasi dengan
U = ΔE . Volume total ml Σ.t Volume enzim
kecepatan 13000 rpm selama 10 menit. Supernatan diambil dan dipindahkan ke dalam tabung baru dan ditambah dengan isopropanol sebanyak 0.54 x volume sampel. Kemudian sampel disentrifigasi dengan kecepatan 13000 rpm selama 10 menit. Supernatan dibuang dan peletnya dicuci dengan alkohol 70% sebanyak 200 µl. Sampel disentrifugasi dengan kecepatan 13000 rpm selama 2 menit. Supernatan dibuang sementara pelet dikeringanginkan selama 15-30 menit atau sampel benar-benar kering. Setelah kering sample ditambah denga 50 µl larutan TE. DNA tersebut dapat disimpan dalam lemari es dengan suhu 4°C sebelum digunakan.
Analisis PCR ini dilakukan berdasarkan Santosa et al. (2004) untuk
mengetahui integrasi gen pada tanaman dengan menggunakan primer spesifik untuk gen fitase. Primer tersebut adalah EC1 : 5’-CA GGC TCT ATC CGC TAA TCG – 3’ dan EC3 : 5’ –GG CGC GGT GGG GCA ATA ATC -3’. Prinsip metode yang digunakan adalah mengamplifikasi fragmen DNA yang telah diisolasi dengan menggunakan teknik PCR. Program termalnya untuk setiap reaksi diatur sebagai berikut : denaturasi awal pada suhu 95 °C selama 10 menit, denaturasi pada suhu 95 °C selama 30 detik, annealing pada 54 °C selama 30
detik dan pemanjangan pada 72 °C selama 3 menit, pemanjangan terakhir dilakukan pada 72 °C selama 15 detik. Volume tiap reaksi dicampur dengan 20 μl larutan yang mengandung 7.5 μl dd H2O, 12.5 μl larutan master mix; P1 dan P2 masing-masing 1.5 μl dan 2 μl template DNA. Reaksi dijalankan pada mesin PCR sebanyak 40 siklus. Produk PCR sebanyak 5 μl digunakan untuk elektroforeisis pada gel agarose 2%. Hasil elektroforeisis diamati dan difoto di atas UV
Sterilisasi Eksplan
Pada proses transformasi gen fitase dari E. coli ini dipindahkan ke tebu melalui kalus sehingga diperlukan kalus sebagai bahan utama. Kalus diperoleh dengan sterilisasi eksplan daun tebu yang masih menggulung. Pemilihan kalus akan berpengaruh pada saat transformasi. Kalus yang digunakan adalah kalus embriogenik yang mampu melakukan proliferasi dengan baik dan friabel.
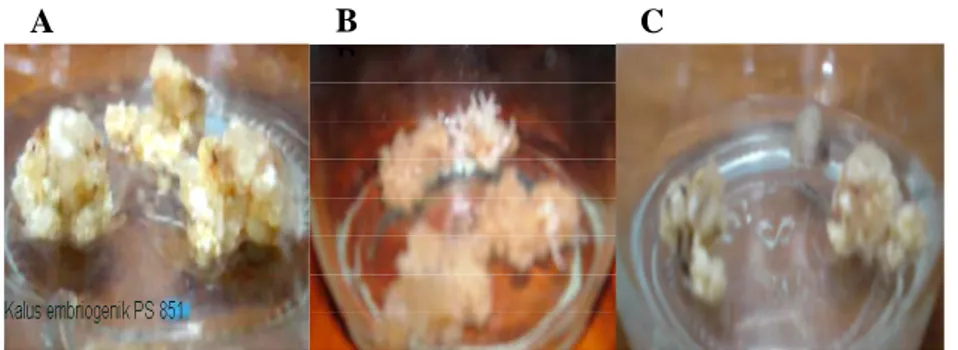
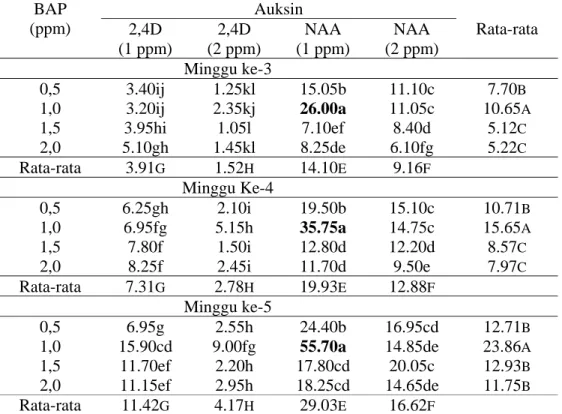
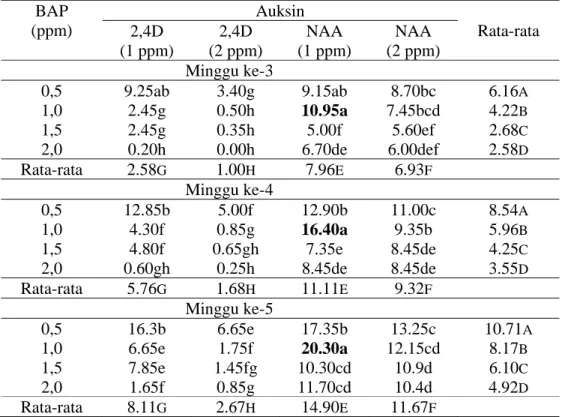
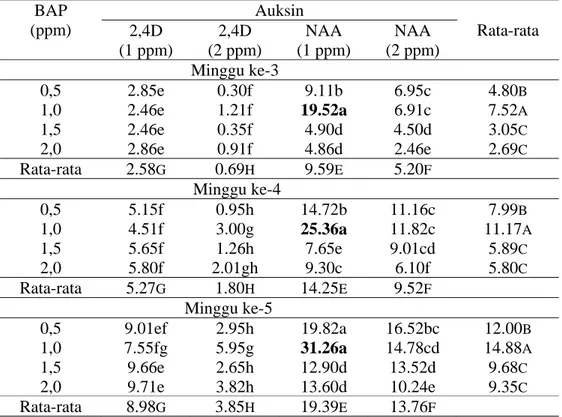
Kedua varietas yang digunakan untuk transformasi ini memiliki kemampuan untuk membentuk kalus yang berbeda. Varietas PS 851 merupakan varietas yang mudah membentuk kalus, tidak menghasilkan kalus yang berlendir dan tidak mudah mengalami pencoklatan sehingga kalus embriogenik mudah didapatkan. Sementara varietas PA 198 menghasilkan kalus yang berlendir dan memerlukan waktu yang lebih lama untuk membentuk kalus embriogenik. Sub kultur harus dilakukan untuk memisahkan kalus dengan lendir. Kalus dari varietas ini pun mudah mengalami pencoklatan. Perbedaan kalus yang dihasilkan kedua varietas tersebut terlihat pada gambar 1.
Gambar 1. Bentuk kalus yang dihasilkan dari kedua varietas A. Kalus embrigenik PS 851; B. Kalus yang alami pencoklatan; C. Kalus PA 198 (berlendir).
Regenerasi Kalus
Optimasi media regenerasi dilakukan terlebih dahulu pada kalus non transforman dari kedua varietas. Media yang dianggap paling baik untuk regenerasi kalus non transforman dapat digunakan sebagai media regenerasi untuk kalus transforman.
A B
B
Optimasi Media Tunas
Jumlah tunas varietas PS 851 dapat dilihat pada tabel 1. Penambahan auksin, BAP dan interkasi dari keduanya berpengaruh nyata terhadap pertumbuhan tunas. Konsentrasi BAP yang sesuai untuk pembentukan tunas varietas PS 851 adalah 1 ppm. Pembentukan tunas pada media dengan penambahan NAA lebih baik dibanding 2,4D dengan konsentrasi optimum 1 ppm. Media MS dengan penambahan 1 ppm NAA dan 1 ppm BAP merupakan media optimum untuk pembentukan dan pertumbuhan tunas varietas PS 851. Sedangkan media yang ditambah dengan 2 ppm 2,4D dan 2 ppm BAP menunjukkan pertumbuhan tunas yang lambat.
Tabel 1. Rata-rata Jumlah Tunas Kultur In-Vitro Tebu Varietas PS 851 minggu ke-3 sampai ke-5
BAP (ppm) Auksin Rata-rata 2,4D (1 ppm) 2,4D (2 ppm) NAA (1 ppm) NAA (2 ppm) Minggu ke-3 0,5 3.40ij 1.25kl 15.05b 11.10c 7.70B 1,0 3.20ij 2.35kj 26.00a 11.05c 10.65A 1,5 3.95hi 1.05l 7.10ef 8.40d 5.12C 2,0 5.10gh 1.45kl 8.25de 6.10fg 5.22C Rata-rata 3.91G 1.52H 14.10E 9.16F Minggu Ke-4 0,5 6.25gh 2.10i 19.50b 15.10c 10.71B 1,0 6.95fg 5.15h 35.75a 14.75c 15.65A 1,5 7.80f 1.50i 12.80d 12.20d 8.57C 2,0 8.25f 2.45i 11.70d 9.50e 7.97C Rata-rata 7.31G 2.78H 19.93E 12.88F Minggu ke-5 0,5 6.95g 2.55h 24.40b 16.95cd 12.71B 1,0 15.90cd 9.00fg 55.70a 14.85de 23.86A 1,5 11.70ef 2.20h 17.80cd 20.05c 12.93B 2,0 11.15ef 2.95h 18.25cd 14.65de 11.75B Rata-rata 11.42G 4.17H 29.03E 16.62F
Ket : 1. nilai-nilai yang diikuti oleh huruf kecil yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
2. nilai-nilai yang diikuti oleh huruf besar yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
Tabel 2. Rata-rata Jumlah Tunas Kultur In-Vitro Tebu Varietas PA198 minggu ke-3 sampai ke-5
BAP (ppm) Auksin Rata-rata 2,4D (1 ppm) 2,4D (2 ppm) NAA (1 ppm) NAA (2 ppm) Minggu ke-3 0,5 9.25ab 3.40g 9.15ab 8.70bc 6.16A 1,0 2.45g 0.50h 10.95a 7.45bcd 4.22B 1,5 2.45g 0.35h 5.00f 5.60ef 2.68C 2,0 0.20h 0.00h 6.70de 6.00def 2.58D Rata-rata 2.58G 1.00H 7.96E 6.93F Minggu ke-4 0,5 12.85b 5.00f 12.90b 11.00c 8.54A 1,0 4.30f 0.85g 16.40a 9.35b 5.96B 1,5 4.80f 0.65gh 7.35e 8.45de 4.25C 2,0 0.60gh 0.25h 8.45de 8.45de 3.55D Rata-rata 5.76G 1.68H 11.11E 9.32F Minggu ke-5 0,5 16.3b 6.65e 17.35b 13.25c 10.71A 1,0 6.65e 1.75f 20.30a 12.15cd 8.17B 1,5 7.85e 1.45fg 10.30cd 10.9d 6.10C 2,0 1.65f 0.85g 11.70cd 10.4d 4.92D Rata-rata 8.11G 2.67H 14.90E 11.67F
Ket : 1. nilai-nilai yang diikuti oleh huruf kecil yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
2. nilai-nilai yang diikuti oleh huruf besar yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
Pada tabel 2. dapat dilihat pertumbuhan tunas dipengaruhi oleh penambahan auksin, BAP dan interaksi kedua hormon tersebut. Untuk pertumbuhan tunas varietas PA 198 penambahan 0.5 ppm BAP pada media mampu menghasilkan jumlah tunas yang tinggi. Penambahan NAA pada media menunjukkan pembentukan tunas lebih tinggi dibanding penambahan 2,4D. Konsentrasi NAA yang menghasilkan jumlah tunas yang tinggi adalah 1 ppm. Jumlah tunas tertinggi terlihat pada media MS dengan penambahan 1 ppm NAA dan 1 ppm BAP. Untuk media yang ditambah dengan 2 ppm 2,4D dan 2 ppm BAP menunjukkan jumlah tunas yang rendah karena pertumbuhan kalus semakin membesar.
Tabel 3. Rata-rata Jumlah Daun Kultur In-Vitro Tebu Varietas PS 851 minggu ke-3 sampai ke-5 BAP (ppm) Auksin Rata-rata 2,4D (1 ppm) 2,4D (2 ppm) NAA (1 ppm) NAA (2 ppm) Minggu ke-3 0,5 2.85e 0.30f 9.11b 6.95c 4.80B 1,0 2.46e 1.21f 19.52a 6.91c 7.52A 1,5 2.46e 0.35f 4.90d 4.50d 3.05C 2,0 2.86e 0.91f 4.86d 2.46e 2.69C Rata-rata 2.58G 0.69H 9.59E 5.20F Minggu ke-4 0,5 5.15f 0.95h 14.72b 11.16c 7.99B 1,0 4.51f 3.00g 25.36a 11.82c 11.17A 1,5 5.65f 1.26h 7.65e 9.01cd 5.89C 2,0 5.80f 2.01gh 9.30c 6.10f 5.80C Rata-rata 5.27G 1.80H 14.25E 9.52F Minggu ke-5 0,5 9.01ef 2.95h 19.82a 16.52bc 12.00B 1,0 7.55fg 5.95g 31.26a 14.78cd 14.88A 1,5 9.66e 2.65h 12.90d 13.52d 9.68C 2,0 9.71e 3.82h 13.60d 10.24e 9.35C Rata-rata 8.98G 3.85H 19.39E 13.76F
Ket : 1. nilai-nilai yang diikuti oleh huruf kecil yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
2. nilai-nilai yang diikuti oleh huruf besar yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
Pembentukan daun varietas PS 851 dipengaruhi oleh penambahan auksin, BAP dan interaksi dari kedua hormon tersebut.Jumlah daun dari varietas tersebut dapat dilihat pada tabel 3. Konsentrasi 1 ppm BAP pada media menghasilkan jumlah daun yang tinggi. Penambahan konsentrasi BAP lebih dari 1 ppm menunjukkan pengaruh yang tidak berbeda nyata terhadap jumlah daun. Media yang ditambah NAA menghasilkan jumlah daun lebih tinggi dibanding 2,4D dengan konsentrasi optimum 1 ppm. Jumlah daun tertinggi terlihat pada media dengan penambahan 1 ppm NAA dan 1 ppm BAP.
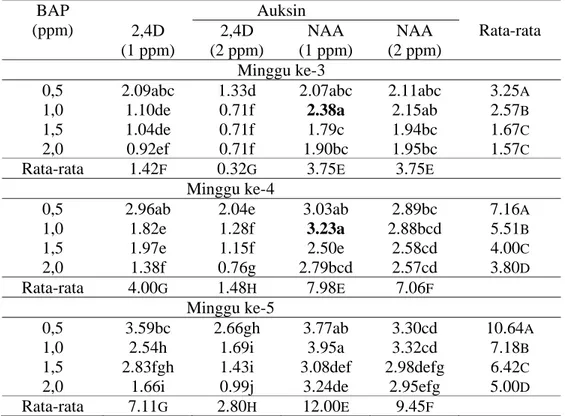
Tabel 4. Rata-rata Jumlah Daun Kultur In-Vitro Tebu Varietas PA 198 minggu ke-3 sampai ke-5 BAP (ppm) Auksin Rata-rata 2,4D (1 ppm) 2,4D (2 ppm) NAA (1 ppm) NAA (2 ppm) Minggu ke-3
0,5 2.09abc 1.33d 2.07abc 2.11abc 3.25A
1,0 1.10de 0.71f 2.38a 2.15ab 2.57B
1,5 1.04de 0.71f 1.79c 1.94bc 1.67C
2,0 0.92ef 0.71f 1.90bc 1.95bc 1.57C
Rata-rata 1.42F 0.32G 3.75E 3.75E
Minggu ke-4
0,5 2.96ab 2.04e 3.03ab 2.89bc 7.16A
1,0 1.82e 1.28f 3.23a 2.88bcd 5.51B 1,5 1.97e 1.15f 2.50e 2.58cd 4.00C 2,0 1.38f 0.76g 2.79bcd 2.57cd 3.80D Rata-rata 4.00G 1.48H 7.98E 7.06F Minggu ke-5 0,5 3.59bc 2.66gh 3.77ab 3.30cd 10.64A 1,0 2.54h 1.69i 3.95a 3.32cd 7.18B
1,5 2.83fgh 1.43i 3.08def 2.98defg 6.42C
2,0 1.66i 0.99j 3.24de 2.95efg 5.00D
Rata-rata 7.11G 2.80H 12.00E 9.45F
Ket : 1. nilai-nilai yang diikuti oleh huruf kecil yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
2. nilai-nilai yang diikuti oleh huruf besar yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
Tabel 4. menunjukkan pengaruh hormon auksin, BAP dan interaksinya berpengaruh nyata terhadap pembentukan daun varietas PA 198. Pada media dengan konsentrasi 0.5 ppm BAP menghasilkan jumlah daun yang tinggi. Penambahan NAA pada media menunjukkan jumlah daun yang lebih tinggi dibanding dengan 2,4D. Konsentrasi optimum NAA untuk pembentukan daun adalah 1 ppm. Jumlah daun terbanyak dari kedua varietas terlihat pada media MS dengan penambahan 1 ppm NAA dan 1 ppm BAP.
Respon kedua varietas pada pembentukan daun terhadap perlakuan 2,4D dan NAA tidak jauh berbeda dengan responnya pada saat pembentukan tunas. NAA lebih besar pengaruhnya terhadap pembentukan daun. Sementara penambahan BAP dengan konsentrasi lebih dari 1 ppm menunjukan pembentukan daun yang menggulung dan keriting. Media optimum untuk pembentukan daun pada kedua varietas dalah 1 ppm NAA dan 1 ppm BAP.
Media tunas optimum varietas PS 851 dan PA 198 adalah media MS dengan penambahan 1 ppm NAA dan 1 ppm BAP. Pertumbuhan tunas dan pembentukan daun dari varietas PS 851 lebih baik dibanding dengan varietas PA 198 (gambar 2). Setiap varietas memiliki kemampuan regenerasi yang berbeda-beda. Kemampuan regenerasi ini dipengaruhi oleh sifat genetik dari varietas tersebut.
Gambar 2. Regenerasi kalus pada media tunas. A. Varietas PS 851 pada media MS dengan 1ppm NAA+0.5 ppm BAP; B. Varietas PS 851pada media MS dengan 1ppm NAA+1 ppm BAP; C. Varietas PS 851 pada media MS dengan 2ppm NAA+ 2 ppm BAP; D. Varietas PA 198 pada media MS dengan 1 ppm NAA+ 0.5 ppm BAP dan E. Varietas PA 198 pada media MS dengan 1 ppm NAA+ 1 ppm BAP.
Dua jenis auksin yang digunakan memberi pengaruh yang sangat berbeda. Pertumbuhan tunas dari kalus lebih banyak dan berkembang pada media dengan jenis auksin, NAA. Sementara pertumbuhan tunas yang lambat terlihat pada media dengan penambahan auksin, 2,4D, terutama pada konsentrasi 2 ppm. Sama halnya dengan pembentukan daun, pada media dengan jenis auksin NAA pertumbuhan daun lebih baik dibanding dengan jenis auksin 2,4D.
B A
D E
Auksin memiliki peranan yang cukup besar dalam kultur jaringan tergantung pada struktur kimia dan konsentrasi auksin tersebut serta jaringan yang akan dikulturkan. Penambahan auksin, 2,4D, menghambat pembentukan tunas dan memacu pertumbuhan kalus, walaupun 2,4D ini dikombinasikan dengan sitokinin berupa BAP. Menurut Klerk (2003) 2,4D merupakan jenis auksin yang kuat untuk pembentukan kalus dan embrio somatik. Namun 2,4D juga termasuk jenis auksin yang lemah untuk pembentukan akar adventif dan mampu menghambat pembentukan tunas aksilar. Sedangkan pada perlakuan auksin dengan menggunakan NAA tingkat pembentukan dan pertumbuhan tunas lebih tinggi dibandingkan dengan 2,4D. NAA dengan konsentrasi yang rendah mampu memacu pembentukan tunas.
Perlakuan konsentrasi BAP pada media berpengaruh terhadap pertumbuhan tunas dan pembentukan daun. BAP termasuk jenis sitokinin stabil yang mudah diserap jaringan. BAP mampu memacu pertumbuhan tunas aksilar, memulihkan pengaruh buruk dari auksin pada tunas dan menghambat pertumbuhan akar (Klerk, 2003). Penambahan BAP dengan konsentrasi tinggi dapat menyebabkan tunas kecil yang tumbuh dan daun yang menggulung (Gaba, 2005).
Interaksi sitokinin dan auksin merupakan hal penting dalam mengontrol proses pertumbuhan dan perkembangan tanaman yang diperbanyak secara in-vitro. Auksin dan sitokinin secara bersama-sama mampu memacu diferensiasi floem dan silem. Nisbah konsentrasi auksin dan sitokinin pada media mempengaruhi pertumbuhan organ yang akan terbentuk. Menurut Gaba (2005) berdasarkan penelitian Skoog dan Miller (1957) kombinasi auksin dan sitokinin pada konsentrasi rendah menunjukan aktifitas yang tinggi. Kemudian pada konsentrasi intermediet kedua zat pengatur tumbuh tersebut melakukan aktifitas secara terpisah. Pada konsentrasi tinggi auksin dan sitokinin akan saling mempengaruhi sehingga dapat mengurangi pengaruh dari masing-masing zat dan menyebabkan terbentuknya kalus. Peningkatan jumlah tunas dan jumlah daun mempengaruhi peningkatan produksi auksin pada bagian ujung tunas. Auksin yang dihasilkan pada meristem tunas akan ditranslokasikan ke bagian bawah tanaman untuk mendorong pembentukan akar (Farid, 2003).
Winata (1987) melaporkan bahwa pada perbanyakan tebu secara in-vitro, zat pengatur tumbuh yang ditambahkan pada media inisiasi untuk organogenesis kalus adalah auksin 1 ppm dan sitokinin 1 ppm. Sementara Mamun et al. (2004) menyatakan 1.5 ppm NAA dan 0.5 ppm BAP yang ditambahkan pada media menunjukan hasil yang optimum untuk pertumbuhan tunas dan daun tebu. Berdasarkan penelitian Farid (2003) dihasilkan media optimum untuk pembentukan tunas pada varietas PS 81362 adalah 1.5 ppm IBA dan 0.5 ppm BAP.
Optimasi Media Perakaran
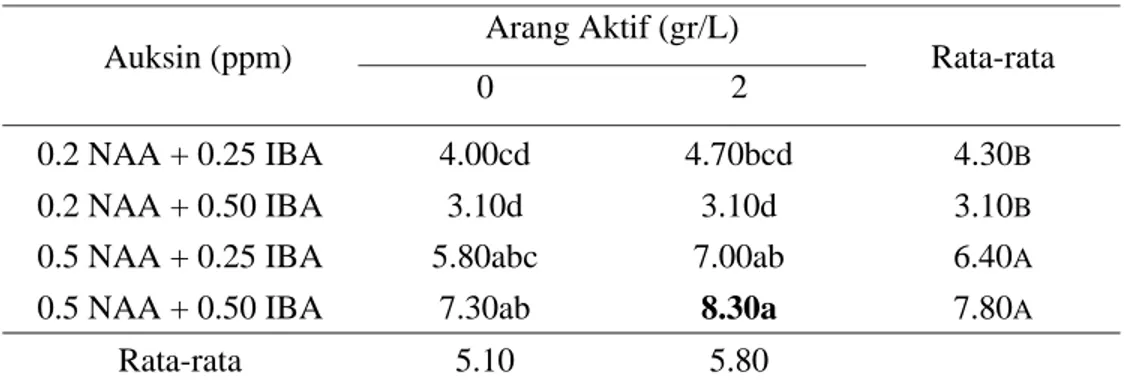
Tabel 5. Rata-rata Jumlah Akar Kultur In-Vitro Tebu Varietas PS 851
Auksin (ppm) Arang Aktif (gr/L) Rata-rata
0 2
0.2 NAA + 0.25 IBA 4.00cd 4.70bcd 4.30B
0.2 NAA + 0.50 IBA 3.10d 3.10d 3.10B
0.5 NAA + 0.25 IBA 5.80abc 7.00ab 6.40A
0.5 NAA + 0.50 IBA 7.30ab 8.30a 7.80A
Rata-rata 5.10 5.80
Ket : 1. nilai-nilai yang diikuti oleh huruf kecil yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
2. nilai-nilai yang diikuti oleh huruf besar yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
Tabel 6. Rata-rata Panjang Akar (cm) Kultur In-Vitro Tebu Varietas PS 851
Auksin (ppm) Arang Aktif (gr/L) Rata-rata
0 2
0.2 NAA + 0.25 IBA 0.62c 2.79b 1.70B
0.2 NAA + 0.50 IBA 0.33c 3.40b 1.86B
0.5 NAA + 0.25 IBA 0.83c 6.08a 3.45B
0.5 NAA + 0.50 IBA 1.08c 6.28a 3.68B
Rata-rata 0.57F 3.71E
Ket : 1. nilai-nilai yang diikuti oleh huruf kecil yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
2. nilai-nilai yang diikuti oleh huruf besar yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
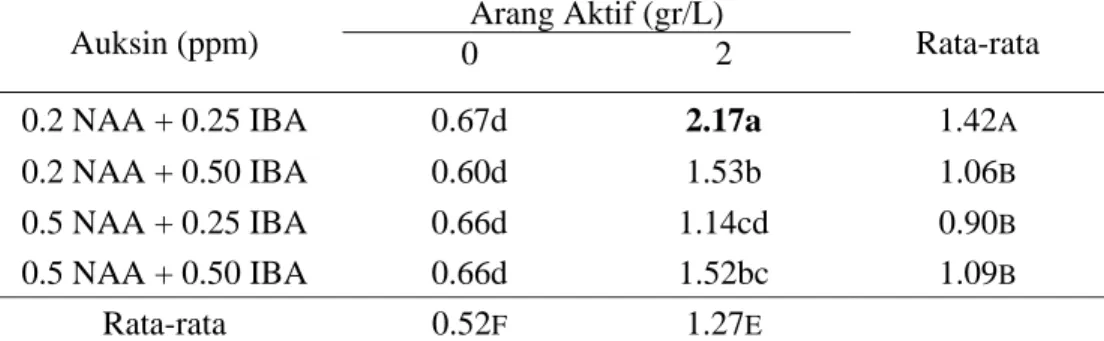
Pengaruh perlakuan auksin dan arang aktif terhadap jumlah akar dari tebu vaietas PS 851 dapat dilihat pada tabel 5 dan 6. Penambahan kombinasi auksin, NAA dan IBA, berpengaruh nyata terhadap jumlah dan panjang akar. Arang aktif yang ditambahkan pada media tidak berpengaruh nyata terhadap jumlah akar namun berpengaruh nyata terhadap panjang akar. Kombinasi konsentrasi auksin dan interaksinya dengan arang aktif mempengaruhi jumlah dan panjang akar. Media optimum untuk pertumbuhan akar varietas PS 851 adalah media MS dengan penambahan 0.2 ppm NAA + 0.25 ppm IBA dan arang aktif. Sedangkan tabel 7 dan 8 menunjukkan bahwa perlakuan kombinasi konsentrasi auksin, arang aktif dan interaksi dari keduanya berpengaruh nyata terhadap jumlah dan panjang akar dari varietas PA 198. Pertumbuhan dan perkembangan akar yang baik terlihat pada media MS dengan 0.2 ppm NAA + 0.25 ppm IBA dan arang aktif.
Tabel 7. Rata-rata Jumlah Akar Kultur In-Vitro Tebu Varietas PA198
Auksin (ppm) Arang Aktif (gr/L) Rata-rata
0 2
0.2 NAA + 0.25 IBA 4.70d 12.40a 8.55A
0.2 NAA + 0.50 IBA 4.20d 7.80b 6.00B
0.5 NAA + 0.25 IBA 4.90d 7.70b 6.30B
0.5 NAA + 0.50 IBA 5.40c 7.00b 6.20B
Rata-rata 4.80F 6.98E
Ket : 1. nilai-nilai yang diikuti oleh huruf kecil yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
2. nilai-nilai yang diikuti oleh huruf besar yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
Tabel 8. Rata-rata Panjang Akar (cm) Kultur In-Vitro Tebu Varietas PA198 Auksin (ppm) 0 2 Arang Aktif (gr/L) Rata-rata
0.2 NAA + 0.25 IBA 0.67d 2.17a 1.42A
0.2 NAA + 0.50 IBA 0.60d 1.53b 1.06B
0.5 NAA + 0.25 IBA 0.66d 1.14cd 0.90B
0.5 NAA + 0.50 IBA 0.66d 1.52bc 1.09B
Rata-rata 0.52F 1.27E
Ket : 1. nilai-nilai yang diikuti oleh huruf kecil yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
2. nilai-nilai yang diikuti oleh huruf besar yang sama tidak berbeda nyata pada taraf 0.05 uji Duncan
Respon kedua varietas pada media akar dengan parameter jumlah dan panjang akar menunjukkan perbedaan. Pada varietas PS 851 pembentukan dan pertumbuhan akar yang paling tinggi pada media dengan penambahan 0.5 ppm NAA +0.50 ppm IBA dan arang aktif 2gr/L, sedangkan varietas PA 198 pada media dengan penambahan 0.2 ppm NAA + 0.25 ppm IBA dan arang aktif 2 gr/L. Perbedaan ini terjadi karena kemampuan regenerasi yang berbeda dari kedua varietas. Pertumbuhan akar dari kedua varietas dapat dilihat pada gambar 3.
Pada media perakaran banyak digunakan zat pengatur tumbuh jenis auksin. Auksin dapat menghasilkan kalus dan akar serta mempengaruhi proses perpanjangan batang. Umumnya IAA (0.6-60 µM), IBA (2.5-15 µM) dan/atau NAA (0.25-6 µM) yang digunakan untuk memacu pertumbuhan akar secara in-vitro. Semua jenis auksin tersebut tidak memiliki efisiensi yang sama dalam pembentukan akar sehingga penggunaan jenis auksin tidaklah penting. Karena konsentrasi dari auksin tersebut yang lebih berpengaruh terhadap pembentukan akar. Konsentrasi auksin yang tinggi dibutuhkan untuk pembentukan akar, tetapi dapat juga memberi pengaruh negatif terhadap tanaman seperti terhambatnya pertumbuhan akar dan terganggunya perkembangan tanaman selanjutnya (Gaba, 2005). Menurut Sugiyarta (1999) dalam Ananda (2004) dosis auksin rendah atau sedang akan menyebabkan pembentukan akar dominan, tetapi bila pada konsentrasi tinggi pemebentukan akar akan terganggu.
Arang aktif biasanya digunakan untuk mengabsorpsi pigmen coklat dan hitam atau senyawa fenolik yang muncul dari eksplan. Arang aktif juga bermanfaat untuk mengabsorbsi senyawa organik lain seperti zat pengatur tumbuh, vitamin, zat besi dan zinc chelate. Hal ini dapat mengurangi pengaruh zat pengatur tumbuh yang berlebihan pada saat eksplan dipindah ke media tanpa zat pengatur tumbuh. Menurut Tiel et al. (2006) bahwa penambahan arang aktif dapat mengurangi kandungan senyawa fenolik dan mencegah terjadinya akumulasi auksin Untuk proses pembentukan dan pertumbuhan akar, arang aktif mampu mengubah cahaya menjadi gelap di sekitar media. Gelapnya media memacu pembentukan dan pertumbuhan akar (Beyl, 2000).
Berdasarkan penelitian Mamun et al. (2004) bahwa penggunaan arang aktif dan 0.5 mg/L NAA + 0.5 mg/L IBA pada media MS untuk induksi akar menunjukkan performa yang baik di bandingkan dengan media induksi akar yang tanpa menggunakan arang aktif. Menurut Naik (2001) induksi perakaran akan tercapai pada media MS dengan 0.05 mg/L NAAdan 0.2 mg/L IBA.
Gambar 3. Pertumbuhan akar A dan B. Akar PS 851 ditanam pada media MS dengan 0.5ppm NAA+0.5ppm IBA dan arang aktif; C. Akar PA 198 pada beberapa kombinasi auksin dengan arang aktif. D. Akar PA 198 pada media 0.2 ppm NAA+0.5 ppm IBA tanpa arang aktif.
Transformasi Pada Kalus Tebu
Tabel 9. Hasil Transformasi Tanamana Tebu dengan Gen Fitase
Var Rata-rata jumlah kalus transformasi Jumlah ko-kultivasi Jumlah kalus ko-kultivasi Jumlah kalus hasil transforman Jumlah kalus lolos seleksi kanamisin Jumlah kalus pada media regenerasi Jumlah planlet di lapang PS 851 15 11 165 150 140 129 105 PA 198 10 9 90 40 20 0 0
Tabel 7 menunjukkan bahwa kalus varietas PS 851 yang berhasil di transformasi sekitar 150 dari 165 jumlah kalus yang diko-kultivasi. Pada proses pencucian jumlah kalus menjadi berkurang. Penurunan jumlah kalus terus terjadi hingga tahap regenerasi, akibat proses seleksi pada media kanamisin dan terhambatnya pertumbuhan kalus pada media regenerasi. Jumlah kalus yang lolos seleksi media kanamisin sekitar 140 dan yang berhasil diregenerasikan sebanyak
A B
129 kalus. Untuk varietas PA 198 hanya 40 kalus yang berhasil ditransfromasi dari 90 kalus yang diko-kultivasi akibat proses pencucian kalus dari bakteri. Jumlah kalus yang lolos media seleksi pun tidak mampu tumbuh pada media regenerasi sehingga belum diperoleh planlet transforman. Bentuk kalus hasil transformasi dari kedua varietas dapat dilihat pada gambar 4.
Menurut Santosa et al. (2004) proses transformasi tebu sangat dipengaruhi oleh beberapa faktor, diantaranya adalah: pertama, varietas tebu yang digunakan. Setiap varietas tebu memiliki kemampuan yang berbeda-beda dalam membentuk kalus. Pencoklatan pada kalus dapat menghambat pertumbuhan dan berpengaruh pada saat kalus mengalami transformasi. Kedua, proses sub-kultur. Kalus yang dihasilkan dari eksplan harus mendapat media baru setelah tiga minggu penanaman. Namun kalus yang mengalami sub-kultur beberapa kali akan memiliki kemampuan pertumbuhan yang rendah.
Gambar 4. Kalus hasil transformasi yang ditanam pada media seleksi kanamisin.
Pada planlet transforman PS 851 yang tumbuh pada media regenerasi terlihat adanya perbedaan warna daun : albino, kuning, belang-belang (putih hijau atau kuning hijau) dan hijau (gambar 5). Perbedaan warna daun ini diduga akibat terintegrasinya transgen secara acak dalam genom tanaman. Menurut Kumar dan Matthias (2002) mengatakan bahwa transgen yang dimasukan ke dalam genom tanaman dapat terintegrasi secara acak, jumlah kopi transgennya tidak dapat diprediksi, umumnya berupa sekuen yang berulang-ulang sehingga mampu
menghapus ekspresi dan dapat menimbulkan terjadinya pemotongan pada transgen tersebut. Bagian sisi integrasi memiliki pengaruh yang sangat besar terhadap ekspresi transgen. Sifat yang diturunkan dan faktor ektrinsik dapat memicu timbulnya metilasi dan mereduksi kestabilan ekspresi transgen. Sehingga penyisipan transgen dapat menyebabkan munculnya fenotipe yang tidak diinginkan. Jumlah planlet transforman yang berhasil diaklimatisasi sekitar 105 planlet. Planlet yang albino tidak mampu tumbuh pada saat aklimatisasi. Beberapa tanaman tebu yang mampu tumbuh di lapang dapat dilihat pada gambar 6.
Gambar 5. Planlet PS 851 transforman pada media MS dengan 1ppm NAA+1ppm BAP. A. warna daun kuning; B. warna daun hijau muda; C. dan D. warna daun; E. warna daun belang hijau putih dan hijau kuning.
Gambar 6. Tanaman PST 851 yang berhasil ditanam di lapang. A
E D C
Uji Aktifitas Enzim Fitase
Tabel 8. Hasil Uji Aktifitas Enzim Fitase dari Daun Tanaman Tebu Tranforman dan Non Transforman
Varietas Aktifitas Enzim Fitase (U/ml) Hasil Uji PCR
PA 198 0.081 - PA 198 0.064 bd PA 198 0.071 bd PS 851 0.047 - PS 851 0.059 bd PS 851 0.057 bd PST 851- 1 0,148 + PST 851- 2 0,063 bd PST 851- 3 0,069 bd PST 851- 4 0,078 bd PST 851- 5 0,128 ++ PST 851- 6 0,042 bd PST 851- 7 0,068 bd PST 851- 8 0,059 bd PST 851- 9 0,071 bd PST 851- 10 0,053 bd PST 851- 11 0,063 bd PST 851- 12 0,088 bd PST 851- 13 0,076 bd PST 851- 14 0,102 bd PST 851- 15 0,096 bd PST 851- 16 0,122 + PST 851- 17 0,111 bd PST 851- 18 0,099 bd PST 851- 19 0,101 bd PST 851- 20 0,134 + PST 851- 21 0,084 bd PST 851-22 0,087 bd PST 851-23 0,079 bd PST 851-24 0,062 bd PST 851-25 0.073 bd PST 851-26 0.103 bd PST 851-27 0.099 bd PST 851-28 0.119 bd PST 851-29 0.097 bd PST 851-30 0.060 bd
Pada tabel 8. terlihat bahwa tanaman yang tidak ditransformasi aktifiats enzim fitasenya masih dapat diukur. Aktifitas fitase pada tanaman hasil transformasi, PST 851, lebih tinggi dibanding dengan tanaman PS 851. Rata-rata aktifitas fitase PST 851 sekitar 0.12 U/ml, sedangkan tanaman PS 851 rata-rata aktifitas fitasenya hanya 0.054 U/ml. Aktifitas fitase tertinggi terlihat pada tanaman PST 851-1, yaitu: 0.148 U/ml.
Data tersebut menunjukkan terjadinya peningkatan aktifitas fitase pada tanaman yang telah ditransfromasi sekitar 40-60% . Pada tanaman PA 198 rata-rata aktifitas fitasenya 0.072 U/ml. Untuk tanaman PA 198 hasil tranfromasi aktifitas fitasenya belum dapat diukur karena belum diperoleh planlet atau tanaman yang transfroman.
Tinggi rendahnya nilai aktifitas enzim fitase ini menunjukan kerja enzim fitase dalam mengkatalisis proses hidrolisis senyawa fitat. Fitase berfungsi sebagai enzim yang mengkatalisis proses perombakan senyawa fitat. enzim merupakan protein yang unik dan sangat selektif terhadap substrat dan produk akhir dari sutau reaksi kimia. Suatu enzim dapat bekerja dengan baik jika memperoleh substrat yang tepat (Applegate dan Rosaline, 2004). Aktifitas fitase pada tanaman PST 851 meningkat karena adanya substrat yang tepat untuk enzim fitase tersebut sehingga fitase dapat bekerja sesuai fungsinya. Substrate yang digunakan oleh fitase ini adalah senyawa fitat yang banyak terdapat dalam tanah dan tanaman.
Perombakan senyawa fitat oleh enzim fitase menyebabkan lepasnya ikatan unsur fosfor dari senyawa fitat sehingga fosfor tersebut bisa digunakan oleh tanaman untuk proses metabolisme. Pi dan fosfoester yang terlepas dari senyawa fitat dapat memacu terjadinya proses respirasi, fosforilasi dan reaksi lain yang terkait dengan kedua proses tersebut (Marschner, 1995).
Analisis PCR
Pengujian lain yang dapat dilakukan untuk membuktikan bahwa gen fitase yang disisipkan terintegrasi dalam genom tanaman adalah Polymerase Chain Reaction (PCR) Isolasi DNA dilakukan pada jaringan daun dari tanaman yang memiliki nilai aktifitas enzim yang tinggi.
Hasil PCR menunjukan bahwa gen fitase yang berasal dari DNA tanaman PST 851-5 dapat diamplifikasi oleh primer EC1 dan EC3. Hal ini terlihat dari munculnya pita yang berukuran 900 bp, sesuai dengan pita yang ada pada kontrol positif (K+) yang berasal dari plasmid pBIN PI-IIEC. Dengan demikian dapat dikatakan bahwa tanaman PST 851-5 telah tersisip gen fitase.
Gambar 3. Elektroforeisis hasil PCR beberapa varietas tanaman tebu (1) V4 (PSJT-9441); (2) V6 (PSJT 9441); (K+) Kontrol positif pBIN PI-IIEC; (K-) Kontrol negatif tanaman non transforman; (3) PST 851-5; (M) Marker 1 Kb plus ladder; (4) Kalus CB 6979 pBIN I ECS.
900 bp
1000 bp
Simpulan :
1. Keberhasilan transformasi dipengaruhi oleh kondisi kalus. Varietas PS 851 memiliki kemampuan untuk membentuk kalus embriogenik sehingga tingkat keberhasilan transformasi hingga tahap seleksi mencapai 85%. Sedangkan kalus varietas PA 198 yang berlendir menyulitkan pencucian kalus dari bakteri saat proses transfromasi. Kalus varietas ini yang berhasil hingga tahap seleksi sekitar 20%. Jumlah planlet transfroman yang berhasil diregenerasi dan diaklimatisasi untuk varietas PS 851 sebanyak 105. Sementara untuk varietas PA 198 belum diperoleh planlet transforman. 2. Media regenerasi tunas yang sesuai untuk varietas PS 851 dan PA 198
adalah media MS dengan penambahan 1 ppm NAA dan 1 ppm BAP. Sementara untuk media perakaran kedua varietas memberi respon yang berbeda. Varietas PS 851 lebih sesuai dengan media MS yang ditambah 0.5 mg/l NAA+0.5 mg/l IBA dan 2 gr/l arang aktif. Sedangkan PA 198 menunjukan pertumbuhan akar yang baik pada media MS dengan 0.2 mg/l NAA+0.25mg/l IBA dan 2 gr/l arang aktif.
3. Aktifitas enzim fitase pada beberapa tanaman PST 851 lebih tinggi daripada PS 851 dengan rata-rata 0.12 U/ml.
4. PST 851-5 yang memiliki aktifitas enzim fitase tinggi diuji dengan Polymerase Chain Reaction (PCR). Pita pada gel elektroforeisis yang muncul dengan ukuran 900 bp menunjukan bahwa gen fitase yang disisipkan terintegrasi dalam genom tanaman.
Saran :
Tanaman PST 851 yang telah ditanam di lapang perlu pengujian dengan PCR dan pengujian ekspresi spesifik gen fitase sehingga dapat dipastikan tanaman-tanaman tersebut transgenik.
Ananda RR. W.U. 2004. Studi transformasi pada tebu dengan perantara Agrobacterium tumafaciens GV 2260 (pMA) serta regenerasi kalus transgenik. [Tesis]. Sekolah Pasca Sarjana Institut Pertanian Bogor. 63 hal. Andrea, T et al. 2000. Optimization of the catalytic properties of Aspergillus
fumigatus based on the three-dimensional structure. Protein Science 9: 1304-1311.
Aswidinoor, H. 1990. Rekayasa genetika. Di dalam: Harran, S. dan Ansari, N. (ed). Bioteknologi Pertanian 2. Pusat Antar Universitas Institut Pertanian Bogor.
Beyl, CA. (2000) Getting started with tissue culture-media preparation, sterile technique, and laboratory equipment. p. 21-38. Di dalam : Gray, D.J. Plant Tissue Culture Concept and Laboratory Exercise. CRC Press. United State of America.
Blanco, M. et al.1997. Protein change associated with plant regeneration in embryogenic calli of sugarcane (Saccharum sp.). Plant Cell and Organ Culture 51: 153-158.
Bower, R and Birch, RG.1992. Transgenic sugarcane plant via microprojectile bombardment. Plant J. 2:409-416.
Brown, TA. 1996. Gene cloning and introduction. Chapman & Hall.
Carla, EH. dan Grabau, EA. 2001. A novel phytase with sequence similarity to purple acid phosphatases is expressed in cotyledones of germinating soybean seedling. Plant Physiology.126: 1598-1608.
Chengalrayan, K. and Gallo-Meagher, M.. 2001. Effect of various growth regulators on shoot regeneration of sugarcane. In Vitro Cel. Dev. Bio.- Plant 37 : 434-439.
Cole. 2001. www.phytase.net. (7 Oktober 2002).
Cosgrove, D.J. 1980. Inositol phospates. their chemistry, biochemistry and physiology. Elsevier Scientific Publishing Company. New York.
Cramer, C.L. and D.N. Radin. 1990. Molecular biology of plant. Di dalam : Nakas J. P. and C. Hagedorn (eds). Biotechnology of Plant Microbes Interaction. Mc Graw Publishing Company. New York. P1-49.