1
PENDAHULUAN
Manusia dewasa dengan kebutuhan energi 10000 kJ per hari mengkonsumsi oksigen sebanyak 660 g setiap hari. Sebanyak 90 – 95 % dari oksigen yang dikonsumsi diubah menjadi molekul air yang tidak berbahaya oleh pernapasan mitokondrial, sedangkan 5 – 10 % dari oksigen yang dikonsumsi tersebut mengalami reduksi univalen dan divalen menjadi spesi oksigen reaktif seperti ion superoksida (O2•-), hidrogen peroksida (H2O2) dan hidroksil radikal (OH•). Apabila usia rata – rata manusia adalah 70 tahun, maka seumur hidupnya manusia dapat mengkonsumsi oksigen sebanyak 17000 kg dan menghasilkan spesi oksigen reaktif sebanyak 800 – 1700 kg (Esterbauer, 1993).
Spesi oksigen reaktif berfungsi sebagai mediator dalam komunikasi antar sel dalam tubuh manusia. Namun produksi spesi oksigen reaktif yang berlebih dapat menyebabkan stress oksidatif, penurunan fungsi sel, maupun apoptosis dan nekrosis (Nordberg and Arnér, 2001). Terdapat perlawanan enzimatis alami dari tubuh untuk menangani kerusakan akibat spesi oksigen reaktif, salah satunya melalui enzim superoksida dismutase (SOD).
Superoksida dismutase merupakan enzim yang mengkatalis reaksi dismutasi ion superoksida menjadi hidrogen peroksida dan oksigen melalui reaksi oksidasi dan reduksi. SOD. Reaksi dismutase ion superoksida oleh SOD dapat diperjelas oleh reaksi berikut (Fee and Bull, 1986):
Mn+ + O2•- M(n-1)+ + O2 M(n-1)+ + O2•- + 2H+ Mn+ + H2O2
Ion logam yang berada pada inti enzim berperan dalam reaksi reduksi oksidasi tersebut, serta menjadi dasar klasifikasi isozim SOD. Pada manusia, terdapat tiga bentuk isozim SOD yakni SOD yang terletak di sitoplasma, mitokondria, serta ekstrasel. Bentuk isozim SOD pada sitoplasma dan cairan ekstrasel memiliki inti logam Cu dan Zn (Noor et. al., 1992) sedangkan isozim SOD pada mitokondria memiliki inti Mn.
Mutasi gen SOD1 yang mengkode CuZnSOD pada manusia dapat menyebabkan timbulnya penyakit degeneratif saraf Familial Amyotrophic Lateral Sclerosis (FALS). Defisiensi dari
enzim SOD diduga memiliki kaitan dengan timbulnya berbagai jenis kanker, penyakit Parkinson, Alzheimer dan beberapa kelainan saraf lain (Noor et. al., 1992).
Pada penelitian ini telah dilakukan penapisan aktivitas enzim SOD terhadap bakteri asal Indonesia. Penapisan akan dilakukan prinsip spektrofotometri terhadap sampel ektrak protein total dari bakteri yang direaksikan dengan NBT dan riboflavin. Riboflavin yang terpapar cahaya dapat memproduksi ion superoksida yang menghasilkan warna biru jika direaksikan dengan NBT, sebaliknya jika SOD yang bereaksi maka akan timbul warna bening. Aktivitas SOD berbanding terbalik dengan intensitas warna yang dihasilkan. Semakin tinggi konsentrasi SOD maka warna biru semakin memudar, dengan kata lain absorbansi akan semakin rendah (Chen and Pan, 1996).
Terhadap bakteri yang memiliki aktivitas SOD tertinggi dilakukan identifikasi spesies melalui amplifikasi gen 16S rDNA, urutan nukleotida dari gen 16S rDNA ditentukan dengan Sequencing atau penentuan urutan nukleotida. Hasil penentuan nukleotida dikonfirmasi dengan bantuan program Basic Local Alignment Search Tools (BLAST) dari
National Centre of Biotechnological Information (NCBI) hingga didapatkan identitas
3 BAB I
TINJAUAN PUSTAKA
1.1 Radikal Bebas
Istilah radikal bebas merujuk ke atom maupun semua gugus atom yang memiliki satu atau lebih elektron tak berpasangan. Jumlah elektron ganjil mengakibatkan tidak semua elektron dapat berpasangan. Radikal bebas adalah senyawa yang tidak bermuatan namun bersifat sangat reaktif karena keberadaan elektron tak berpasangan tersebut. Suatu radikal bebas biasanya dijumpai sebagai zat antara yang sulit diisolasi, berusia pendek, sangat reaktif dan berenergi tinggi. Radikal bebas digambarkan dengan sebuah titik yang melambangkan elektron tak berpasangan (Fessenden, 1986).
1.1.1 Pembentukan Radikal Bebas
Reaksi pembentukan radikal bebas merupakan suatu reaksi bertahap. Tahap – tahap pembentukan radikal bebas adalah tahap permulaan (inisiasi), tahap perambatan (propagasi) dan tahap pengakhiran (terminasi) (Fessenden, 1986).
Tahap inisiasi merupakan tahap pembentukkan awal radikal bebas. Dalam proses klorinasi metana, tahap inisiasi merupakan pemaksapisahan (cleavage) homolitik molekul Cl2 menjadi dua radikal bebas klor. Energi yang diberikan untuk reaksi ini bersumber dari sinar ultraviolet maupun pemanasan pada suhu sangat tinggi. Reaksi yang terjadi (Fessenden, 1986):
Cl – Cl + 58 kkal/mol hv atau kalor 2Cl• Reaksi (1) Radikal bebas klor yang terbentuk akan mengawali sederetan reaksi yang menyebabkan pembentukan radikal bebas baru. Pada tahap propagasi awal pada proses klorinasi metana, radikal bebas klor merebut sebuah atom hidrogen dari molekul metana sehingga terbentuk radikal bebas metil dan HCl. Kemudian radikal bebas metil yang telah terbentuk dapat merebut sebuah atom klor dari molekul Cl2 sehingga terbentuk klorometan dan sebuah radikal klor. Reaksi yang terjadi adalah sebagai berikut (Fessenden, 1986):
Tahap 1 : CH4 + Cl• •CH3 + HCl Reaksi (2) Tahap 2 : •CH3 + Cl2 CH3Cl + Cl• Reaksi (3)
Reaksi propagasi dapat berlangsung terus menerus dan menghasilkan produk radikal yang bervariasi. Jumlah siklus propagasi serta panjang rantai yang terbentuk bergantung kepada besar energi yang menyebabkan reaksi berjalan. Karena keberulangan reaksi propagasi, maka suatu reaksi radikal bebas dapat menghasilkan produk yang bervariasi. Hal ini disebabkan oleh energi radikal bebas yang tinggi tersebut, sehingga sifatnya tidak selektif terhadap pemilihan perebutan hidrogen dalam pembentukan radikal bebas baru (Fessenden, 1986).
Siklus propagasi dapat terputus oleh reaksi terminasi yang ditandai dengan molekul – molekul radikal bebas yang bergabung sehingga tidak lagi terdapat elektron tak berpasangan. Reaksi terminasi disebut juga reaksi pemusnahan radikal bebas. Pada reaksi klorinasi metana, reaksi terminasi terjadi ketika radikal klor bergabung dengan radikal bebas metil menjadi senyawa klorometan. Reaksi yang terjadi adalah sebagai berikut (Fessenden, 1986):
Cl• + •CH3 CH3Cl Reaksi (4)
1.2 Spesi oksigen reaktif
Manusia dewasa dengan berat lebih kurang 70 kg dengan kebutuhan energi per hari sebesar 10000 kJ mengkonsumsi 660 g molekul O2. 90 – 95 % dari molekul O2 yang dikonsumsi diubah menjadi molekul air yang tidak berbahaya oleh respirasi pada mitokondria, sedangkan 5 – 10% dari molekul tersebut mengalami reduksi univalen dan divalen sehingga dihasilkan spesi oksigen reaktif (SOR). Apabila rata – rata usia hidup manusia adalah 70 tahun, maka dalam periode hidupnya manusia dapat mengkonsumsi 17000 kg molekul O2 dan menghasilkan molekul - molekul spesi oksigen reaktif sebanyak 800 hingga 1700 kg (Esterbauer, 2006).
Spesi oksigen reaktif meliputi beberapa molekul reaktif derivat oksigen, misalnya ion superoksida (O2•-), hidrogen peroksida (H2O2), radikal bebas hidroksil (OH•), serta nitrat oksida (NO). Spesi oksigen reaktif merupakan senyawa yang telah diketahui berfungsi sebagai mediator dalam rangkaian penghantaran sinyal antar sel serta sebagai regulator
faktor transkripsi (Thannickal, et .al., 2000). Namun produksi spesi oksigen reaktif yang berlebih dapat menyebabkan stress oksidatif, kehilangan fungsi sel, hingga kematian sel, baik melalui apoptosis maupun nekrosis. Senyawa spesi oksigen reaktif yang dengan reaktivitas tinggi adalah yang berbentuk radikal bebas, karena satu elektron tak berpasangan yang dimilikinya mampu berikatan dengan protein, lipid dan lipoprotein, serta asam nukleat. Reaksi pembentukan spesi oksigen reaktif dapat dipersingkat dalam reaksi berikut (Nordberg and Arnés, 2001):
e- e- e- e
-O2 O2•- H2O2 OH• + OH• H2O Reaksi (5)
2H+ 2H+
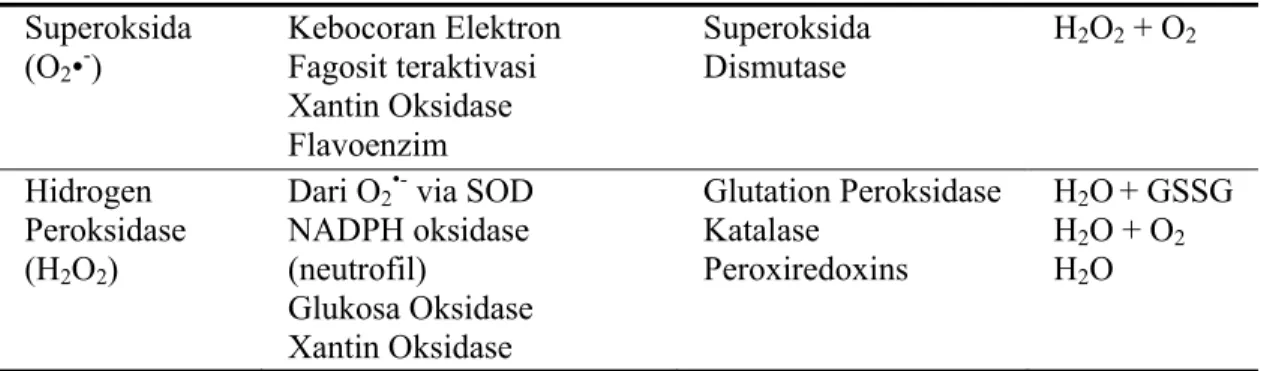
Terdapat mekanisme alami tubuh yang mampu mengatasi kerusakan yang timbul akibat senyawa – senyawa ini yakni dengan perlawanan enzimatis. Enzim – enzim alami yang diproduksi tubuh mampu mengubah spesi oksigen reaktif menjadi lebih tidak berbahaya. Jenis - jenis perlawanan enzimatis terhadap spesi oksigen reaktif dapat dilihat pada Tabel 1.1 (Nordberg and Arnés, 2001).
1.2.1 Kerusakan Biologis Akibat Spesi Oksigen Reaktif
Akibat dari reaktivitasnya, spesi oksigen reaktif cenderung mengakibatkan kerusakan pada sel sehingga terkadang bersifat toksik, mutagenik bahkan karsinogenik. Senyawa dalam sel yang menjadi target spesi oksigen reaktif diantaranya DNA, lipid dan protein (Nordberg and Arnés, 2001).
Tabel 1.1 Perlawanan Enzimatis Terhadap Spesi Oksigen Reaktif Spesi Oksigen
Reaktif Sumber Utama
Perlawanan
Enzimatis Produk Superoksida
(O2•-) Kebocoran Elektron Fagosit teraktivasi Xantin Oksidase Flavoenzim Superoksida Dismutase H2O2 + O2 Hidrogen Peroksidase (H2O2)
Dari O2•- via SOD NADPH oksidase (neutrofil) Glukosa Oksidase Xantin Oksidase Glutation Peroksidase Katalase Peroxiredoxins H2O + GSSG H2O + O2 H2O
Tabel 1.1 (Lanjutan) Spesi Oksigen
Reaktif Sumber Utama
Perlawanan
Enzimatis Produk Hidroksil
Radikal (OH•)
O2•- / H2O2 via transisi metal (Fe & Cu) Nitrat Oksida
(NO) Nitrat Oksida Sintase Glutathion / TrxR GSNO
Beberapa penelitian telah membuktikan bahwa spesi oksigen reaktif bersifat mutagenik karena menyebabkan modifikasi kimiawi dari DNA. Perubahan yang tejadi meliputi pemotongan DNA, taut-silang antara DNA dan protein, oksidasi basa purin pada struktur DNA, dan lain sebagainya. Jenis spesi oksigen reaktif yang umumnya mengakibatkan kerusakan DNA tersebut adalah radikal hidroksil (OH•). Apabila sistem perbaikan DNA tidak mampu melakukan regenerasi DNA yang rusak dengan cepat, maka dapat terjadi mutasi akibat pemasangan basa yang salah pada replikasi. Hal ini menjelaskan penyebab prevalensi kanker yang tinggi pada individu - individu yang sering mengalami stress oksidatif (Nordberg and Arnés, 2001).
Asam lemak tak jenuh merupakan target umum dari penyerangan radikal bebas, akibat jumlah ikatan rangkap yang banyak. Reaksi oksidasi asam lemak oleh radikal bebas adalah penyebab utama pembentukan plak aterosklerosis. Mekanisme pembentukan plak aterosklerosis diawali oleh oksidasi low-density lipoprotein (LDL), kemudian dilanjutkan dengan reaksi fagositosis LDL teroksidasi oleh sel-sel fagosit sehingga dihasilkan sel busa yang terakumulasi pada bagian subendotelial pembuluh darah. Akumulasi sel busa dapat memicu luka pada pembuluh darah yang menyebabkan pembentukan plak yang mempersempit pembuluh darah. Dengan demikian pencegahan atau penanggulangan terhadap oksidasi lipid oleh radikal bebas dapat memberi pengaruh besar terhadap penanganan penyakit kardiovaskular (Nordberg and Arnés, 2001).
Pada protein, kerusakan yang timbul akibat serangan radikal bebas tidak separah pada DNA dan lipid. Serangan radikal bebas pada protein jarang terjadi kecuali apabila terjadi akumulasi radikal bebas pada sel. Akan tetapi beberapa penelitian menunjukkan bahwa spesi oksigen reaktif dapat bereaksi dengan beberapa jenis asam amino yang mengakibatkan protein terdenaturasi dan kehilangan fungsinya. Asam amino yang
memiliki kecenderungan mengalami penyerangan oleh radikal bebas adalah asam amino yang memiliki residu sulfur atau selenium (Nordberg and Arnés, 2001).
1.2.2 Kegunaan Spesi Oksigen Reaktif dalam Tubuh
Di dalam tubuh, spesi oksigen reaktif memiliki peran sebagai regulator fungsi sel dan molekul pembawa sinyal pada komunikasi antar sel. Hal ini disebabkan oleh senyawa – senyawa sitokin dan faktor – faktor pertumbuhan yang mampu menghasilkan spesi oksigen reaktif pada beberapa jenis sel yang berbeda. Enzim – enzim antioksidan yang menginhibisi spesi oksigen reaktif dapat memblok sinyal maupun efek fisiologi yang dihasilkan oleh sitokin maupun faktor pertumbuhan tadi. Penambahan senyawa oksidan secara eksogen juga dibuktikan mampu menghasilkan jalur pensinyalan termediasi sitokin atau faktor pertumbuhan tersebut (Thannickal et. al., 2000). Selain itu, akibat kemampuannya dalam perusakan molekul biologis, spesi oksigen reaktif juga diduga memiliki kaitan dalam mekanisme apoptosis (Tan et. al., 1998)
1.2.3 Ion Superoksida (O2•-)
Ion superoksida merupakan senyawa radikal tidak terlalu reaktif karena kemampuannya dalam menembus lipid membran rendah, sehingga ketika sudah diproduksi ion superoksida terjebak dalam kompartemen dimana ion tersebut diproduksi (Nordberg and Arnés, 2001). Walau demikian, banyak studi yang difokuskan kepada eliminasi ion superoksida karena merupakan senyawa awal yang dihasilkan dari reaksi rantai pembentukan senyawa – senyawa spesi oksigen reaktif, untuk lebih jelasnya lihat reaksi (5).
Pembentukan superoksida terjadi secara spontan terutama pada lingkungan aerob yang kaya akan elektron, misalnya di sekeliling membran dalam mitokondria atau di lingkungan dimana rantai respirasi sel terjadi. Ion superoksida dihasilkan oleh oksigen molekuler yang mengalami adisi satu buah elektron yang berasal dari kebocoran rantai elektron. Ion superoksida juga dihasilkan secara endogen oleh flavoenzim xantin oksidase yang teraktivasi saat reperfusi iskemik. Enzim lain yang memproduksi ion superoksida adalah lipooksigenase dan siklooksigenase (Nordberg and Arnés, 2001). Dua buah molekul superoksida dapat mengalami dismutasi menjadi hidrogen peroksida dan molekul oksigen, terjadinya reaksi ini dapat dipercepat oleh keberadaan enzim superoksida dismutase.
1.3 Antioksidan
Antioksidan merupakan senyawa yang dibutuhkan oleh semua makhluk hidup yang mengkonsumsi oksigen sebagai mekanisme pertahanan dalam mengatasi kerusakan akibat spesi oksigen reaktif. Antioksidan merupakan senyawa yang memiliki potensi oksidasi tinggi sehingga lebih cenderung bereaksi dengan spesi oksigen reaktif terlebih dahulu sebelum spesi oksigen reaktif bereaksi dengan molekul – molekul biologis dalam tubuh yang dapat mengakibatkan kerusakan atau penurunan fungsi molekul – molekul biologis tersebut1.
Secara umum mekanisme kerja antioksidan dapat dikelompokkan menjadi: (1) antioksidan preventif, yang dapat menurunkan laju reaksi inisiasi dalam pembentukan radikal bebas, dan (2) antioksidan pemutus rantai, yang dapat menghentikan reaksi propagasi dalam pembentukan radikal bebas. Yang termasuk dalam antioksidan preventif misalnya katalase, atau enzim peroksidase lain dan pengkelat ion logam seperti EDTA, sedangkan yang termasuk dalam antioksidan pemutus rantai misalnya superoksida dismutase dan vitamin E (Murray et. al., 1996). Antioksidan di dalam tubuh manusia dapat diklasifikasikan menjadi 2 jenis, yakni antioksidan enzimatis dan nonenzimatis. Yang termasuk antioksidan enzimatis misalnya superoksida dismutase, katalase, dan glutation peroksidase, sedangkan yang termasuk antioksidan nonenzimatis misalnya vitamin E dan vitamin C1.
1.3.1 Antioksidan Enzimatis
Katalase merupakan enzim dengan logam (Fe) yang berfungsi dalam proses katalitik enzim tersebut. Katalase merupakan antioksidan yang mengkatalis perubahan hidrogen peroksida (H2O2) menjadi air (H2O) dan oksigen (O2). Di dalam tubuh, katalase banyak terdapat pada hati dan eritrosit1, sedangkan di dalam sel katalase banyak ditemukan pada peroksisom (Nordberg and Arnés, 2001). Ketidakseimbangan antara superoksida dismutase dan katalase dapat mengakibatkan penumpukan hidrogen peroksida yang dengan cepat dapat berubah menjadi ion radikal hidroksil (OH•) yang lebih berbahaya dan lebih reaktif1.
Seperti katalase, glutation peroksidase juga merupakan antioksidan yang mengkatalis perubahan hidrogen peroksida (H2O2) menjadi air (H2O) dan oksigen (O2). Ketidaksetimbangan antara superoksida dismutase dan enzim ini juga dapat menyebabkan
penumpukan hidrogen peroksida. Akan tetapi, berbeda dengan katalase, enzim glutation peroksidase membutuhkan bantuan logam selenium (Se) dalam menjalankan fungsi katalitiknya1.
1.3.2 Antioksidan Nonenzimatis
Vitamin E atau tokoferol merupakan antioksidan yang memiliki peran dalam menghentikan proses peroksidasi lipid. Karena bersifat lipofilik, vitamin E berperan sebagai antioksidan pada sisi lipofil membran sel. Keberadaan gugus hidroksil pada tokoferol (tokoferol-OH) memungkinkan transfer atom hidrogen dengan satu elektron tak berpasangan ke senyawa radikal bebas sehingga dibentuk radikal tokoferol (tokoferol-O•). Vitamin C atau asam askorbat yang berada dalam lingkungan memungkinkan terjadinya reaksi lanjutan dengan tokoferol-O• menghasilkan dehidroaskorbat (radikal lemah) dan tokoferol. Akibat reaksi tersebut terbentuk kembali tokoferol yang fungsional, sedangkan dehidroaskorbat dapat mengalami reaksi lanjutan sehingga vitamin C terbentuk kembali1.
Vitamin C merupakan antioksidan nonenzimatis larut air. Sebagai senyawa pereduksi, vitamin C berperan sebagai antioksidan dengan menyumbangkan elektron pada senyawa radikal bebas sehingga dihasilkan senyawa radikal dehidroaskorbat. Vitamin C merupakan antioksidan yang dapat bereaksi dengan radikal hidroksil serta berperan dalam regenerasi vitamin E pada membran. Manusia tidak dapat mensintesis vitamin C karena tidak mampu memproduksi enzim L-gulakolakton oksidase, oleh karena itu diperlukan asupan vitamin C dari luar1.
1.4 Superoksida Dismutase
Superoksida dismutase (SOD) merupakan enzim yang mengkatalis proses dismutasi ion superoksida (O2•-) menjadi molekul air (H2O) dan oksigen (O2). Produksi SOD merupakan salah satu mekanisme antioksidan enzimatik bagi tiap sel terpapar oksigen. Sisi aktif yang bertanggung jawab terhadap terjadinya reaksi dismutasi ion superoksida pada SOD adalah inti logam yang merupakan kofaktor protein SOD. Ion logam yang menjadi kofaktor SOD merupakan logam dengan nilai valensi 2 atau lebih. Berikut adalah reaksi antara superoksida dismutase dan ion superoksida (O2•-) (Fee and Bull, 1986) :
Mn+ + O2•- M(n-1)+ + O2 Reaksi (6) M(n-1)+ + O2•- + 2H+ Mn+ + H2O2 Reaksi (7)
1.4.1 Klasifikasi SOD
SOD dapat diklasifikasikan menurut ion logam kofaktor dari SOD. Hingga kini, telah ditemukan empat isozim SOD yakni CuZnSOD, FeSOD, MnSOD dan NiSOD. SOD ditemukan pada organisme eukariot dan prokariot. Pada organisme eukariot, SOD terdapat pada sitosol dan mitokondria, sedangkan pada prokariot SOD juga berada pada bagian periplasma membran sel (Cannio et. al., 2000).
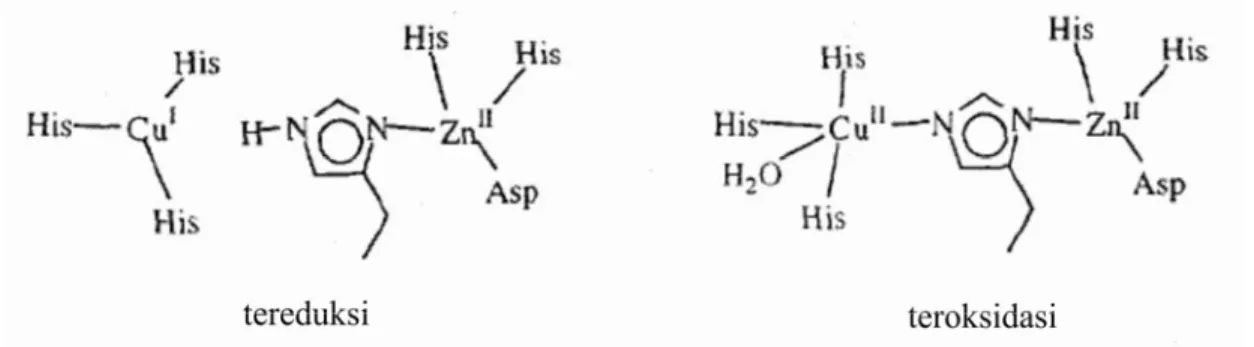
CuZnSOD merupakan SOD yang memiliki kofaktor berupa logam tembaga dan seng (lihat Gambar 1.1). CuZnSOD adalah SOD yang pertama kali diisolasi oleh manusia dan hingga kini telah diisolasi dari berbagai sumber seperti ragi, bayam, hati ayam maupun darah sapi. Pada organisme eukariotik umumnya CuZnSOD terdapat dalam sitosol maupun cairan ekstrasel (Noor R, et. al, 2002). Enzim CuZnSOD yang diisolasi dari Escherichia coli bersifat lebih stabil daripada CuZnSOD yang diisolasi dari mikroorganisme eukariot lain. (Imlay and Imlay, 1996)
Gambar 1.1 Struktur protein CuZnSOD dalam keadaan tereduksi dan teroksidasi (Cabelli et. al., 1998).
Hasil analisis urutan asam amino CuZnSOD yang diisolasi dari E. coli menunjukkan bahwa terdapat leader region, daerah ujung amino (Lys-Arg pada posisi 2 dan 3), daerah 16 asam amino hidrofobik, serta sisi pemotongan Ala-Ala yang menunjukkan bahwa CuZnSOD merupakan protein periplasma (Imlay dan Imlay, 1996). Struktur kuartener protein CuZnSOD terdiri dari dua subunit protein (homodimer) dan memiliki bobot molekul lebih kurang 32500 Da. Masing - masing subunitnya distabilkan oleh jembatan disulfida antar rantai dan keduanya dihubungkan oleh ikatan nonkovalen (Cabelli et. al., 1998).
MnSOD merupakan SOD yang memiliki kofaktor berupa logam mangan sedangkan kofaktor pada FeSOD adalah logam besi. Kedua SOD ini diproduksi oleh mikroorganisme prokariot dan eukariot (Whittaker, 2003). FeSOD dan MnSOD merupakan protein yang terdiri dari dua buah subunit yang masing – masing berukuran 22 kDa (Cannio et. al., 2000). Walaupun memiliki struktur protein yang mirip, aktivitas kedua SOD ini akan menurun apabila dilakukan penukaran antara logam satu dengan yang lainnya (Cabelli et.
al., 1998).
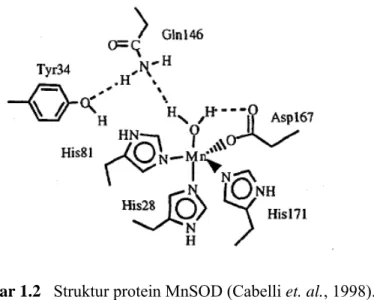
Subunit MnSOD terdiri dari dua domain yakni ujung amino dan karboksil. Pada ujung amino, terdapat dua residu asam amino histidin yang berinteraksi dengan atom Mn, sedangkan pada ujung karboksil, dua asam amino yang berinteraksi dengan atom Mn adalah aspartat dan histidin (Cabelli et. al., 1998). Struktur protein MnSOD dapat dilihat pada Gambar 1.2.
Gambar 1.2 Struktur protein MnSOD (Cabelli et. al., 1998).
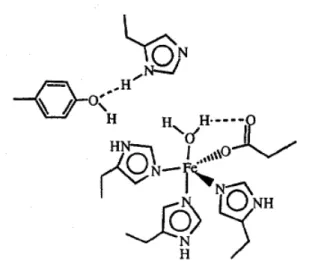
Pada FeSOD, situs aktif berinteraksi dengan glutamin pada MnSOD, dimana glutamin seharusnya berikatan hidrogen dengan alanin atau histidin yang berinteraksi dengan kofaktor logam. Pada FeSOD, glutamin tidak mengalami ikatan hidrogen dengan alanin atau histidin yang berinteraksi dengan kofaktor logam. Akibat kurang bermaknanya perbedaan antara kedua protein ini, selektivitas kofaktor logam rendah pada pembuatan MnSOD atau FeSOD secara rekombinan dengan penambahan garam logam (Cabelli et.
Gambar 1.3 Struktur protein FeSOD (Cabelli,et.al., 1998)
NiSOD adalah isozim SOD dengan kofaktor logam nikel yang ditemukan pada beberapa spesies Streptomyces. Enzim NiSOD memiliki empat subunit yang masing – masing berukuran 13,4 kDa. Dari analisis komposisi asam amino, urutan nukleotida pada ujung amino, dan karakter imunologinya, diketahui bahwa NiSOD adalah kelompok isozim yang berbeda dari CuZnSOD, FeSOD maupun NiSOD (Cannio et. al., 2000).
1.4.2 Konjugasi Logam
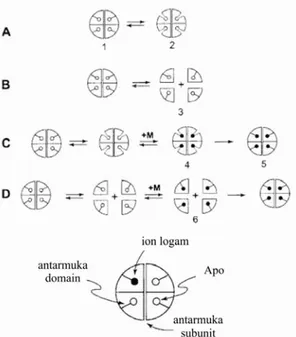
Mekanisme konjugasi logam pada molekul SOD telah diketahui secara in vitro menggunakan SOD termofilik rekombinan yang berasal dari Thermus thermophilus. Pada prosedur purifikasi tanpa perlakuan pemanasan, SOD rekombinan yang diekspresikan pada bakteri E. coli diperoleh dalam bentuk apoprotein yang tidak memiliki kofaktor logam walaupun telah ditambahkan garam – garam logam. Diduga hal ini terjadi karena proses konjugasi logam pada SOD rekombinan yang berasal dari T. thermophilus harus terjadi pada lingkungan bersuhu sama dengan suhu lingkungan pertumbuhan bakteri tersebut, yakni 75°C (Whittaker, 2003).
Proses konjugasi logam pada MnSOD diduga terjadi dengan dua cara, yakni melalui pembukaan domain serta disosiasi subunit. Telah diketahui sebelumnya bahwa MnSOD merupakan protein tetramer yang tiap subunitnya terdiri dari dua domain (Whittaker, 2003). Proses tersebut dapat dilihat pada Gambar 1.4.
Gambar 1.4 Hipotesis mekanisme konjugasi logam pada MnSOD. Pada (A) terjadi proses pembukaan domain, sedangkan proses yang terjadi pada (B) pemisahan subunit. Pada (C) dan (D) ditunjukkan konjugasi logam melalui pembukaan domain dan pemisahan subunit (Whittaker, 2003).
1.4.3 Penggunaan SOD
Beberapa penelitian menunjukkan bahwa SOD (terutama bentuk CuZnSOD) memiliki aktivitas fisiologi dan potensi terapetik yang cukup baik. CuZnSOD berpengaruh pada penyakit – penyakit peradangan seperti FALS, penyakit Parkinson, penyakit Alzheimer, demam berdarah, kanker, Down’s syndrome, katarak dan beberapa patologi saraf lain. (Noor et. al., 2002). Penelitian lain menunjukkan bahwa overekspresi dari MnSOD dapat menekan pembentukan tumor (Zhao et. al., 2001).
Terdapat beberapa sediaan SOD yang telah diproduksi untuk pengobatan, yakni Orgotein, Pegorgotein dan Sudismase. Orgotein merupakan sediaan CuZnSOD yang berasal dari hati sapi. Bobot molekul Orgotein adalah 33000 Da. Rute penggunaan Orgotein adalah injeksi intramuskular sebagai agen antiinflamasi, sebagai pengobatan untuk efek samping yang ditimbulkan akibat radioterapi. Pegorgotein merupakan Orgotein yang terpegilasi. Tujuan pegilasi adalah untuk memperpanjang efek dan mengurangi resiko timbulnya reaksi hipersensitifitas. Pegorgotein digunakan sebagai terapi pada pasien cedera kepala parah untuk membantu meningkatkan perbaikan saraf dan menurunkan resiko kematian. Sudismase merupakan produksi rekombinan dari N-asetil SOD manusia yang mengandung kofaktor tembaga dan seng (Sweetman, 2005).
Penggunaan lain dari senyawa ini diantaranya adalah CuZnSOD dan MnSOD efektif digunakan dalam pengobatan luka bakar akibat gas mostar (mustard gas) pada Perang Dunia I. Pada terapi luka bakar akibat gas mostar, CuZnSOD atau MnSOD diinjeksikan secara intraperitonial atau intalesi. Telah dilakukan pula studi terapi gen pada tikus untuk pengobatan oxidant-injury. Tikus dewasa yang disuntikkan adenovirus pengkode gen CuZnSOD manusia dan cDNA katalase secara intratrakeal mampu menghasilkan enzim CuZnSOD dan katalase manusia (Noor et. al., 2002). Penggunaan SOD secara topikal juga terbukti dapat menurunkan fibrosis yang diakibatkan oleh terapi radiasi pada kanker payudara (Campana, 2004).
Telah dilakukan penelitian terhadap profil farmakokinetik dari SOD manusia rekombinan rhSOD) pada 32 sukarelawan sehat dengan rute pemberian injeksi intravena bolus dengan rentang dosis antara 1 hingga 45 mg/kg bobot badan. Analisis dengan model nonkompartemen menunjukkan bahwa waktu paruh rhSOD adalah 4 jam untuk dosis 3 – 45 mg/kg bobot badan (Tsao et. al., 1991). Penelitian profil farmakokinetik dari SOD sapi juga telah dilakukan melalui rute pemberian injeksi intramuskular dengan dosis 4 hingga 32 mg/kg bobot badan, 2 hingga 3 kali seminggu. Dari penelitian ini, didapatkan hasil dosis optimal SOD sapi adalah antara 30 hingga 200 μg / kg bobot badan. Pada studi ini juga dibandingkan profil farmakokinetik antara enkapsulasi SOD sapi dalam liposom dengan SOD sapi tanpa enkapsulasi. SOD sapi terenkapsulasi memiliki karakteristik farmakokinetik yang lebih baik, yakni peningkatan waktu paruh dan peningkatan waktu pelepasan SOD sapi bebas. Melalui penelitian ini juga diketahui bahwa walaupun SOD sapi merupakan protein asing, baik bentuk terenkapsulasinya maupun bentuk bebasnya dapat ditoleransi dengan baik dan tidak menghasilkan efek toksik (Jadot et. al., 1995).
1.5 Identifikasi Spesies dengan 16S rDNA
Ribosom organisme prokariot merupakan organ sel berukuran 70S dan terdiri dari 2 subunit berukuran 30S dan 50S. Huruf S di belakang angka 30, 50 dan 70 menyatakan konstanta Svedberg, yakni satuan koefisien sentrifugasi. Subunit 50S mengandung rRNA berukuran 16S dan protein sebanyak 21 buah, sedangkan subunit 30S mengandung rRNA berukuran 5S dan 23S, serta protein sebanyak 34 buah (Madigan and Martinko, 2006).
Gen 16S rDNA terletak pada DNA kromosom organisme prokariot yang mengkode komponen ribosom 16S rRNA yang dapat digunakan sebagai daerah sidik jari antar spesies. Dalam biologi, tujuan mempelajari gen 16S rDNA tidak hanya untuk mengetahui identitas organisme prokariot, melainkan juga untuk mengukur perubahan evolusi dan keterkaitan filogenetiknya (Madigan and Martinko, 2006). Komponen polinukleotida lain yang menyusun ribosom yaitu 5S dan 23S sebenarnya juga dapat digunakan sebagai daerah sidik jari, namun karena ukuran 5S yang terlalu kecil dan 23S yang terlalu besar, maka subunit 16S dipilih sebagai alat penanda sidik jari.
Terdapat beberapa kelebihan dari gen 16S rDNA yang menjadikannya layak sebagai area sidik jari. Pertama, gen 16S rDNA berukuran cukup besar untuk dapat digunakan sebagai pembeda antar spesies, 16S rDNA juga mempunyai peran yang konstan dalam sel, terdistribusi secara universal pada seluruh organisme prokariot, dan memiliki beberapa daerah lestari yang dapat digunakan sebagai pembeda antar spesies (Madigan and Martinko, 2006).
Gen 16S rDNA merupakan daerah lestari yang diapit oleh dua daerah yang universal. Karena daerah universal ini merupakan daerah yang sama pada seluruh organisme prokariot, maka melalui daerah ini dapat dirancang sepasang primer yang bisa dipergunakan untuk mengamplifikasi gen 16S rDNA yang berasal dari berbagai spesies (Madigan and Martinko, 2006). Skema gen 16S rDNA dapat dilihat pada Gambar 1.5.
Gambar 1.5 Skema Gen 16S rDNA. Tanda ( ) menunjukkan lokasi primer dan orientasinya, tanda ( ) menunjukkan daerah lestari (urutan sama pada seluruh bakteri), tanda ( ) menunjukkan daerah di antara primer2.
1.6 Penentuan Urutan Nukleotida
Penentuan urutan nukleotida yang sekarang umum dilakukan menggunakan metode dideoksi Sanger. Pada metode Sanger, penentuan urutan nukleotida dilakukan dengan
menggunakan prinsip PCR mengunakan enzim DNA polimerase. Enzim DNA polimerase akan menambahkan basa deoksiribonukleosida trifosfat (dNTP) dengan arah 5’ ke 3’ pada primer yang digunakan. Selain itu ke dalam campuran reaksi juga ditambahkan dideoksiribonukleosida trifosfat (ddNTP) yang tidak memiliki gugus hidroksil pada 3’, melainkan gugus hidrogen yang tidak dikenali oleh enzim DNA polimerase, akibatnya reaksi terhenti dan dihasilkan fragmen – fragmen DNA. Hasil penentuan urutan nukleotida kemudian dianalisis dengan elektroforesis agarosa yang dilakukan secara bersamaan pada empat sumur. Elektroforesis dilakukan pada konsentrasi agarosa yang sangat tinggi sehingga cukup sensitif untuk mendeteksi perbedaan satu basa pada pita – pita yang tersusun. Masing – masing sumur mewakili fragmen yang diakhiri dengan basa adenin, guanin, timin atau sitosin. Dengan membandingkan posisi pita elektroforesis fragmen – fragmen DNA pada keempat sumur tersebut, maka urutan nukleotida dapat diketahui (Madigan and Martinko, 2006).
Berkat kemajuan teknologi, prosedur penentuan urutan DNA sekarang menjadi lebih singkat dan terotomatisasi. Reaksi dilangsungkan dalam satu tabung yang juga berisi ddNTP yang menghasilkan sinyal berbeda untuk basa berbeda, hasil reaksi kemudian dielektroforesis pada satu sumur saja yang menunjukkan sinyal – sinyal berbeda untuk tiap basa. Dengan metode ini, sumur sepanjang 20 cm dapat digunakan untuk memisahkan 300 basa dengan kecepatan 80 basa per jam. Melalui metode hifenasi, hasil elektroforesis kemudian divisualisasikan sehingga diperoleh kromatogram yang juga menunjukkan urutan nukleotida (Ansorge et. al., 1987).