INTISARI
Penelitian ini bertujuan untuk membuktikan adanya pengaruh ekstrak etanol daun Artocarpus altilis (Park.) Fosberg dalam penurunan kadar glukosa darah pada tikus jantan Wistar yang terinduksi streptosozin. Penelitian ini bersifat eksperimental murni dengan rancangan acak lengkap pola searah. Penelitian ini menggunakan 16 ekor tikus jantan Wistar, umur 1,5-2 bulan, dan berat 120-160 g. Kelompok I merupakan kontrol basal yang diberikan akuades dari hari ke-1 hingga hari ke-7. Kelompok II merupakan kontrol pankreotoksik streptozotosin dosis 40 mg/kgBB secara intraperitonial yang diinduksi pada hari ke-1 dan hari ke-2 hingga hari ke-7 diberikan akuades. Kelompok III merupakan kontrol negatif CMC Na dengan konsentrasi 0,5% secara per oral diberikan dari hari ke-1 hingga hari ke-7. Kelompok IV merupakan kelompok perlakuan ekstrak etanol daun Artocarpus altilis (Park.) Fosberg dosis 50 mg/kgBB yang diberikan 3 hari sebelum diinduksi streptozotosin dan pemberian ekstrak dilanjutkan hingga hari ke-7secara per oral, serta pada hari ke-1 diinduksi streptozotosin 40 mg/kgBB secara intraperitonial. Hasil dilihat berdasarkan kadar glukosa darah pada hari 0, 4, dan 7, serta histologis pankreas pada hari ke-14. Kadar glukosa darah yang diperoleh di analisis menggunakan mean ± SD. Berdasarkan data yang diperoleh, ekstrak etanol daun Artocarpus altilis (Park.) Fosberg dosis 50 mg/kgBB tidak memiliki pengaruh penurunan kadar glukosa darah pada tikus jantan Wistar terinduksi streptozotosin 40 mg/kgBB.
ABSTRACT
The aim of study research were prove the decrease levels of blood glucose effect of ethanol extract Artocarpus altilis (Park.) Fosberg in male Wistar induced streptozotocin. The research was pure experimental research with randomized complete direct sampling design. This research use 16 male Wistar rats, attain the age 1.5-2 month, and 120-10 gram weight. Group I is the basal control was given aquadest on 1st days until 7th days . Group II is the streptozotocin pancreotoxin control dose 40 mg/kgBB intraperitonial induce on first day and 2nd days until 7th days given aquadest. Group III is negative control CMC Na with 0.5% concentration orraly from 2nd days until 7th days. Group IV is a treatment group for ethanolic extract of Artocarpus altilis (Park.) Fosberg leaves with dose 50 mg/kgBB given 3 days prior to induced streptozotocin and extract continue until 7th days orally, as well as on the first day induced streptozotocin 40 mg/kgBB intraperitoneal. For pancreotoxic control group, animals were given streptozotocin at the first day. Results based on blood glucose levels seen on days 0, 4, and 7, as well as histological pancreas on day 14. Blood glucose levels were obtained in the analysis using mean ± SD. Based on the data that obtained, the ethanol extract of Artocarpus altilis (Park.) Fosberg seed at dose of 50 mg/kgBB does not have effect decreased levels of blood glucose in Wistar male rats induced by streptozotocin 40 mg/kgBB.
i
PENGARUH PEMBERIAN EKSTRAK ETANOL DAUN SUKUN (Artocarpus altilis (Park.) Fosberg.) PADA TIKUS TERINDUKSI
STREPTOZOTOSIN
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Anggun Amalia Margita (108114029)
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
Karya ini kupersembahkan untuk :
Allah SWT sebagai ungkapan syukur dan pujianku
Papa & Mama tersayang
Kakak-kakakku & Adikku
vii
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala berkat dan
pertolongan-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul
“Pengaruh Pemberian Ekstrak Etanol Daun Sukun (Artocarpus altilis (Park.)
Fosberg.) pada Tikus Terinduksi Streptozotosin”. Skripsi ini disusun sebagai salah
satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
Dalam penelitian ini dan penyusunan skripsi ini tentunya tidak terlepas
dari bantuan berbagai pihak. Oleh karena itu, dalam kesempatan ini penulis ingin
mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Dekan Universitas Sanata Dharma.
2. Bapak Ipang Djunarko, M.Sc., Apt. selaku Dosen Pembimbing yang
telah bersedia membimbing, mengoreksi, memberi dukungan, dan saran
mulai dari awal persiapan hingga akhir penyusunan skripsi ini.
3. Ibu drh. Sitarina Widyarini, MP, Ph.D., selaku Dosen Pembimbing
kedua yang telah bersedia membimbing, mengoreksi, memberi
dukungan, dan saran mulai dari awal persiapan hingga akhir penyusunan
skripsi ini.
4. Bapak Prof. Dr. C. J. Soegihardjo, Apt, selaku Dosen Penguji yang
bersedia memberikan saran dan kritik selama penyusunan skripsi.
5. Ibu Phebe Hendra, M.Si., Apt., Ph.D., selaku Dosen Penguji yang
viii
6. Ibu Phebe Hendra M.Si., Apt., Ph.D., selaku Dosen Pembimbing
Akademik yang telah mendampingi dan mendukung penulis selama
menekuni studi di Fakultas Farmasi Universitas Sanata Dharma
Yogyakarta.
7. Ibu Dr. Sri Hartati Yuliani, M.Si., Apt., selaku Kepala Laboratorium
Fakultas Farmasi Universitas Sanata Dharma yang telah memberikan
ijin penggunaan fasilitas laboratorium guna penelitian skripsi ini.
8. Laboran Pak Parjiman, Pak Heru, Paka Kayat, Pak Wagiran, Pak Parlan,
Pak Kunto, Mas Bimo, dan Pak Mus yang telah banyak membantu
menyediakan fasilitas yang dibutuhkan untuk melakukan penelitian ini.
9. Seluruh staff karyawan dan pengajar Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta
10.Bapak drh. Sugiyono, M. Sc., selaku Dosen Fakultas Kedokteran Hewan
Universitas Gadjah Mada yang telah memberikan saran dan membantu
dalam melakukan penelitian.
11.Niang Ratna, Kakak-kakakku Evie Christanti Oktarina dan Anggara Eka
Nugraha, serta adikku Orchida Vidia Nadira, atas semangat, dukungan,
dan doa yang diberikan kepada penulis selama penulis menjalani masa
perkuliahan.
12.Chatarina Serafina Ika Wijayanti, Therezita Sahita Laksmi, dan Inggrid
Roswita Tokan, yang telah berjuang bersama penulis dalam penyusunan
skripsi ini yang merupakan syarat penulis untuk mendapat gelar Sarjana
ix
13.Puspita Sari Dewi sebagai sahabat yang telah memberikan dukungan,
saran dan bantuan selama penulis menjalani masa perkuliahan.
14.Teman-teman tercinta Ella Puspitasari, Kak Dolorosa Lintang Suminar,
Catharina, dan Tirzayana atas persahabatan, kebersamaan dan suka duka
yang dijalani selama ini.
15.Teman-teman FST A angkatan 2010 dan semua teman farmasi USD
khusunya angkatan 2010.
16.Semua pihak yang tidak dapat disebutkan satu per satu oleh penulis yang
telah membantu selama proses penyusunan skripsi ini berlangsung.
Peneliti menyadari bahwa skripsi ini masih jauh dari kesempurnaan,
karena itu penulis menerima kritik dan saran yang membangun dan bermanfaat
khususnya bagi pengembangan ilmu pengetahuan, sehingga dapat menjadi
acuan-acuan untuk penelitian selanjutnya. Semoga tulisan ini dapat memberikan manfaat
khususnya di bidang farmasi, serta semua pihak baik mahasiswa, lingkungan
akademis, maupun masyarakat.
Yogyakarta, 20 November 2014
x
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... v
PERNYATAAN KEASLIAN KARYA ... vi
xi
BAB II. PENELAHAAN PUSTAKA... 6
A. Uraian Tanaman Artocarpus altilis (Park.) Fosberg ... 6
xii
1. Metode enzimatik ... 19
2. Metode kondensasi dengan gugus amina ... 20
3. Metode oksidasi-reduksi ... 20
H. Streptozotosin ... 20
I. Landasan Teori ... 23
J. Hipotesis ... 24
BAB III. METODE PENELITIAN... 25
A. Jenis dan Rancangan Penelitian ... 25
B. Variabel dan Definisi Operasional ... 25
1. Variabel utama ... 25
4. Pembuatan ekstrak etanol daun Artocarpus altilis (Park.) Fosberg ... 31
5. Penetapan kadar air serbuk daun Artocarpus altilis (Park.) Fosberg ... 31
xiii
7. Pembuatan suspensi CMC Na 0,5% ... 32
8. Pembuatan dapar Na sitrat 50 mM pH 4,5 ... 32
9. Penetapan dosis streptozotosin ... 33
10. Induksi hiperglikemia pada tikus ... 33
11. Pengukuran kadar glukosa darah ... 33
12. Desain dan perlakuan penelitian ... 34
13. Pengumpulan sampel ... 35
14. Pembuatan slide histologi pankreas ... 35
F. Analisis Hasil ... 38
BAB IV. HASIL DAN PEMBAHASAN ... 40
A. Hasil Determinasi Serbuk Daun Artocarpus altilis (Park.) Fosberg ... 40
B. Penetapan Kadar Air Serbuk Daun Artocarpus altilis (Park.) Fosberg... 40
C. Penetapan Bobot Tetap Ekstrak Etanol Artocarpus altilis (Park.) Fosberg 41 D. Penentuan Dosis Pankreotoksik Streptozotosin ... 42
E. Pengaruh Pemberian Ekstrak Etanol Artocarpus altilis (Park.) Fosberg .... 43
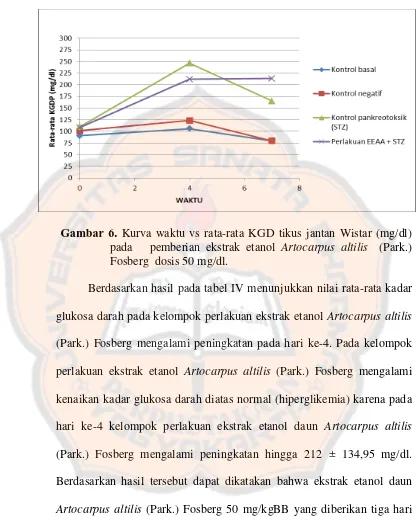
1. Kadar glukosa darah ... 43
2. Berat badan ... 48
F. Pemeriksaan Histologis Pankreas ... 49
1. Gambaran histologis kelompok kontrol basal ... 50
2. Gambaran histologis kelompok kontrol negatif CMC Na 0,5% ... 51
xiv
4. Gambaran histologis kelompok perlakuan ekstrak etanol Artocarpus
altilis (Park.) Fosberg dosis 50 mg/kgBB ... 54
G. Rangkuman Pembahasan... 55
BAB V. KESIMPULAN DAN SARAN ... 58
A. Kesimpulan ... 58
B. Saran ... 58
DAFTAR PUSTAKA ... 59
LAMPIRAN ... 64
xv
DAFTAR TABEL
Tabel I. Kriteria Penegakan untuk penderita diabetes melitus ... 18
Tabel II. Isi pereaksi enzim Glucose GOD-PAP ... 27
Tabel III. Volume bahan untuk pengukuran kadar glukosa ... 33
Tabel IV. Peningkatan rata-rata KGD (mg/dl) tikus jantan galur Wistar
pada hari ke-0, 4, dan 7. ... 45
Tabel V. Berat badan tikus jantan Wistar (mg/dl) pada kelompok
perlakuan hari ke- 0, 4, 7, kontrol basal, kontrol CMC, dan kontrol pankreotoksik 50 mg/kgBB (n=4) ... 48
Tabel VI. Persentase kerusakan sel Islet Langerhans pankreas tikus
pada keempat kelompok dengan pengecatan Hematoksili Eosin ... 50
Tabel VII. Hasil penetapan kadar air serbuk daun Artocarpus altilis
(Park.) Fosberg ... 69
Tabel VIII. Hasil bobot pengeringan ekstrak etanol daun Artocarpus
altilis (Park.) Fosberg ... 69
Tabel IX. Hasil rendemen ekstrak etanol daun Artocarpus altilis (Park.)
Fosberg ... 70
Tabel X. Data penimbangan berat badan tikus pada kelompok basal,
kontrol negatif, kontrol pankreotoksik, dan kontrol perlakuan EEAA ... 71
Tabel XI. Data pengukuran kadar glukosa darah tikus pada kelompok
xvi
DAFTAR GAMBAR
Gambar 1. Anatomi pankreas ... 10
Gambar 2. Foto mikroskopik eksokrin pankreas ... 11
Gambar 3. Foto mikroskopik endokrin pankreas. ... 12
Gambar 4. Struktur streptozotosin ... 20
Gambar 5. Skema Pengaruh Pemberian Ekstrak Etanol Artocarpus altilis (Park.) Fosberg ... 39
Gambar 6. Kurva waktu vs rata-rata KGD tikus jantan Wistar (mg/dl) pada pemberian ekstrak etanol Artocarpus altilis (Park.) Fosberg dosis 50 mg/dl ... 46
Gambar 7. Kurva waktu vs rata-rata berat badan tikus pada kelompok kontrol basal, kontrol negatif, kontrol pankreotoksik, dan perlakuan EEAA ... 48
Gambar 8. Foto mikroskopik organ pankreas tikus kelompok kontrol basal perbesaran 400x ... 50
Gambar 9. Foto mikroskopik organ pankreas tikus kelompok kontrol negatif CMC Na 0,5% perbesaran 400x ... 51
Gambar 10. Foto mikroskopik organ pankreas tikus kelompok kontrol pankreotoksik streptozotosin 40 mg/kgBB perbesaran 400x ... 53
xvii
DAFTAR LAMPIRAN
Lampiran 1. Surat pengesahan Medical and Health Researc Ethics
Committe (MHREC) ... 65
Lampiran 2. Surat pengesahan determinasi serbuk daun Artocarpus altilis (Park.) Fosberg ... 66
Lampiran 3. Daun Artocapus alitilis (Park.) Fosberg ... 67
Lampiran 4. Foto serbuk daun Artocarpus altilis (Park.) Fosberg ... 67
Lampiran 5. Foto ekstrak etanol daun Artocarpus altilis (Park.) Fosberg ... 68
Lampiran 6. Foto suspensi ekstrak etanol daun Artocarpus altilis (Park.) Fosberg dalam CMC-Na 1% ... 68
Lampiran 7. Nekropsi Tikus ... 68
Lampiran 8. Penetapan kadar air serbuk daun Artocarpus altilis (Park.) Fosberg ... 69
Lampiran 9. Bobot pengeringan ekstrak etanol daun Artocarpus altilis (Park.) Fosberg ... 69
Lampiran 10. Hasil rendemen ekstrak etanol daun Artocarpus altilis (Park.) Fosberg ... 70
Lampiran 11. Data penimbangan berat badan tikus jantan Wistar ... 71
Lampiran 12. Data pengukuran kadar glukosa darah tikus jantan Wistar ... 72
Lampiran 13. Hasil pembacaan histopatologi organ pankreas tikus ... 73
xviii
INTISARI
Penelitian ini bertujuan untuk membuktikan adanya pengaruh ekstrak
etanol daun Artocarpus altilis (Park.) Fosberg dalam penurunan kadar glukosa
darah pada tikus jantan Wistar yang terinduksi streptosozin.
Penelitian ini bersifat eksperimental murni dengan rancangan acak lengkap pola searah. Penelitian ini menggunakan 16 ekor tikus jantan Wistar, umur 1,5-2 bulan, dan berat 120-160 g. Kelompok I merupakan kontrol basal yang diberikan akuades dari hari ke-1 hingga hari ke-7. Kelompok II merupakan kontrol pankreotoksik streptozotosin dosis 40 mg/kgBB secara intraperitonial yang diinduksi pada hari ke-1 dan hari ke-2 hingga hari ke-7 diberikan akuades. Kelompok III merupakan kontrol negatif CMC Na dengan konsentrasi 0,5% secara per oral diberikan dari hari ke-1 hingga hari ke-7. Kelompok IV merupakan
kelompok perlakuan ekstrak etanol daun Artocarpus altilis (Park.) Fosberg dosis
50 mg/kgBB yang diberikan 3 hari sebelum diinduksi streptozotosin dan pemberian ekstrak dilanjutkan hingga hari 7 secara per oral, serta pada hari ke-1 diinduksi streptozotosin 40 mg/kgBB secara intraperitonial. Hasil dilihat berdasarkan kadar glukosa darah pada hari 0, 4, dan 7, serta histologis pankreas pada hari ke-14. Kadar glukosa darah yang diperoleh di analisis menggunakan mean ± SD.
Berdasarkan data yang diperoleh, ekstrak etanol daun Artocarpus altilis
(Park.) Fosberg dosis 50 mg/kgBB tidak memiliki pengaruh penurunan kadar glukosa darah pada tikus jantan Wistar terinduksi streptozotosin 40 mg/kgBB.
xix
ABSTRACT
The aim of study research were prove the decrease levels of blood
glucose effect of ethanol extract Artocarpus altilis (Park.) Fosberg in male Wistar
induced streptozotocin.
The research was pure experimental research with randomized complete direct sampling design. This research use 16 male Wistar rats, attain the age 1.5-2 month, and 120-10 gram weight. Group I is the basal control was given
aquadest on 1st days until 7th days . Group II is the streptozotocin pancreotoxin
control dose 40 mg/kgBB intraperitonial induce on first day and 2nd days until 7th
days given aquadest. Group III is negative control CMC Na with 0.5%
concentration orraly from 2nd days until 7th days. Group IV is a treatment group
for ethanolic extract of Artocarpus altilis (Park.) Fosberg leaves with dose 50
mg/kgBB given 3 days prior to induced streptozotocin and extract continue until
7th days orally, as well as on the first day induced streptozotocin 40 mg/kgBB
intraperitoneal. For pancreotoxic control group, animals were given streptozotocin at the first day. Results based on blood glucose levels seen on days 0, 4, and 7, as well as histological pancreas on day 14. Blood glucose levels were obtained in the analysis using mean ± SD.
Based on the data that obtained, the ethanol extract of Artocarpus
altilis (Park.) Fosberg seed at dose of 50 mg/kgBB does not have effect decreased levels of blood glucose in Wistar male rats induced by streptozotocin 40 mg/kgBB.
1
BAB I PENGANTAR A. Latar Belakang
Diabetes adalah sekelompok penyakit metabolik yang ditandai dengan
hiperglikemi akibat cacat pada sekresi insulin, kerja insulin, atau keduanya yang
disertai dengan penurunan metabolisme karbohidrat, lemak dan protein.
Hiperglikemi kronik diabetes berhubungan dengan kerusakan jangka panjang,
disfungsi, dan kegagalan berbagai organ, terutama mata, ginjal, saraf, jantung, dan
pembuluh darah (American Diabetes Association, 2007; Craig, Hattersley, and
Donaghue, 2009).
Diabetes melitus terdiri dari beberapa tipe, yaitu diabetes tipe 1, diabetes
tipe 2, diabtes gestasional, dan diabetes tipe lainnya. Diabetes melitus tipe 1 biasa
disebut dengan insulin-dependent diabetes ini disebabkan destruksi sel beta (sel )
penghasil insulin pada pulau Langerhans pankreas. Diabetes melitus tipe 2 biasa
disebut non-insulin dependent terjadi karena kesalahan dalam produksi insulin,
resistensi terhadap insulin, atau berkurangnya sensitivitas sel terhadap insulin
yang melibatkan reseptor di membran (Holt & Hanley, 2007).
Organ tubuh yang menghasilkan insulin adalah pankreas. Apabila lebih
dari 70% sel pankreas mengalami kerusakan maka akan menimbulkan
disfungsi yang menyebabkan diabetes melitus (McPhee and William, 2007).
Kerusakan sel pankreas dapat disebabkan oleh karena faktor genetik, infeksi
oleh kuman, faktor nutrisi, zat diabetogenik, pembentukan spesies oksigen reaktif
Diabetes melitus merupakan salah satu penyakit yang sering ditemukan
di dunia khususnya di Indonesia. Berdasarkan hasil penelitian yang dilakukan
Wild, Roglic, Green, Sicree, and King (2004) diperoleh bahwa prevalensi
diabetes untuk semua kelompok umur di seluruh dunia diperkirakan 2,8% pada
tahun 2000 dan 4,4% pada 2030. Perkiraan terakhir menunjukkan ada 171 juta
orang di dunia dengan diabetes pada tahun 2000 dan diproyeksikan meningkat
menjadi 366 juta pada tahun 2030. Di Indonesia sendiri diperkirakan bahwa pada
tahun 2030 prevalensi diabetes mellitus mencapai 21,3 juta orang.
Dengan semakin meningkatnya prevalensi penderita diabetes dan minat
masyarakat pada penggunaan bahan alam sebagai obat tradisional semakin meluas.
Berbagai macam ramuan obat dari alam yang sudah digunakan oleh nenek
moyang kita sejak dulu kala kini mendapat perhatian besar. Penelitian dan
pengujian terhadap sejumlah tumbuhan yang berkhasiat untuk pengobatan banyak
dilakukan oleh para ahli. Hal ini dikarenakan penggunaan bahan alam sebagai
obat tradisonal umumnya tidak menimbulkan efek samping yang berarti seperti
yang sering terjadi pada pengobatan kimiawi. Selain itu, obat tradisional mudah
diperoleh, harga murah, dan dapat di tanam sendiri sebagai Tanaman Obat
Keluarga (TOGA) (Latief, 2012).
Salah satu tanaman yang digunakan secara empiris adalah daun sukun
(Artocarpus altilis). Berdasarkan penelitian Marianne, Yoandani, and Rosnani
(2011) ekstrak etanol daun sukun memiliki kandungan alkaloid, flavonoid, tanin,
and J. Mojzis (2008) menunjukkan bahwa senyawa flavonoid merupakan senyawa
aktif yang berperan sebagai antidiabetes. Salah satu turunan flavonoid yang
terkandung dalam daun sukun adalah kuersetin dan artoindonesianin (Ramadhani,
2009). Kuersetin memiliki efek perlindungan pada pankreas yang diinduksi
streptozotosin dengan mengurangi stress okasidatif dengan menghambat
peroksida lipid dan secara tidak langsung meningkatkan produksi antioksidan
endogen (Adewole, 2007; Coskun, 2005).
Dari uraian diatas, penelitian ini dilakukan menggunakan ekstrak
etanol daun Artocarpus altilis (Park.) Fosberg karena etanol termasuk ke dalam
pelarut polar, sehingga dapat menarik senyawa golongan flavonoid (kuersetin)
yang merupakan salah satu senyawa polar yang berperan dalam memproteksi
organ pankreas (Marianne, dkk, 2011).
1. Permasalahan
Berdasarkan latar belakang di atas, dapat dirumuskan permasalahan
sebagai berikut :
a. Apakah pemberian ekstrak etanol daun Artocarpus altilis (Park.) Fosberg.
dosis 50 mg/kgBB memiliki pengaruh terhadap penurunan kadar glukosa
darah pada tikus yang terinduksi streptozotosin ?
b. Apakah pemberian ekstrak etanol daun Artocarpus altilis (Park.) Fosberg.
dosis 50 mg/kgBB memiliki pengaruh memperbaiki gambaran histologis
2. Keaslian penelitian
1) Telah dilakukan pengujian daun Artocarpus altilis (Park.) Fosberg.yang
dilakukan oleh Ermin, dkk (1991) yang melaporkan bahwa daun sukun
efektif mengobati penyakit seperti liver, hepatitis, pembesaran limpa,
jantung, ginjal, tekanan darah tinggi dan kencing manis karena
mengandung fenol, kuersetin dan champorol.
2) Menurut Nublah (2011) dengan pembebanan glukosa monohidrat dosis
tunggal sebelum diberikan ekstrak air dan ekstrak etil asetat daun sukun
dapat menurunkan kadar glukosa darah meskipun belum sebanding
dengan glibenklamid.
3) Berdasarkan penelitian yang dilakukan oleh Gustina (2012) membuktikan
bahwa ekstrak etanol dan etil asetat berupa flavonoid daun sukun dapat
menghambat enzim α-glukosidase, sehingga berpotensi sebagai
antidiabetes.
Sejauh penelusuran penulis, penelitian tentang pencegahan hiperglikemi pada
ekstrak etanol daun sukun (Artocarpus altilis (Park.) Fosberg.) yang
terinduksi streptozotosin pada tikus jantan galur wistar belum pernah
dilakukan.
3. Manfaat penelitian
a. Manfaat teoritis. Penelitian ini diharapkan dapat memberikan sumbangan
ilmu khususnya ilmu kefarmasian mengenai pengaruh pemberian ekstrak
etanol daun Artocarpus altilis (Park.) Fosberg. dan dampaknya terhadap
b. Manfaat praktis. Penelitian ini diharapkan dapat memberikan informasi
mengenai pengaruh penggunaan tanaman Artocarpus altilis (Park.)
Fosberg. sebagai tanaman alternatif pencegahan diabetes melitus.
B. Tujuan Penelitian 1. Tujuan umum
Penelitian ini bertujuan untuk membuktikan adanya pengaruh penurunan
kadar glukosa darah pada pemberian ekstrak etanol daun Artocarpus altilis
(Park.) Fosberg pada dosis 50 mg/kgBB pada tikus terinduksi streptozotosin.
2. Tujuan khusus
Tujuan penelitian ini secara khusus adalah untuk :
a. Mengetahui pengaruh penurunan kadar glukosa darah pada pemberian
ekstrak etanol daun Artocarpus altilis (Park.) Fosberg dosis 50
mg/kgBB berdasarkan pengukuran kadar glukosa darah pada tikus
terinduksi streptozotosin.
b. Mengetahui pengaruh pemberian ekstrak etanol Artocarpus altilis
(Park.) Fosberg dosis 50 mg/kgBB berdasarkan gambaran histologi
6
BAB II
PENELAAHAN PUSTAKA
A. Uraian Tanaman Artocarpus altilis (Park.) Fosberg. 1. Habitat dan morfologi
Tumbuhan sukun (Artocarpus altilis (Park.) Fosberg) memiliki tinggi
rata-rata 12-15 meter. Tumbuhan sukun dapat tumbuh baik sepanjang tahun
di daerah tropis basah dan beriklim penghujan. Tanaman sukun memiliki
batang yang besar, bergetah dan bercabang banyak. Daun tanaman sukun
kaku, tebal, dan memiliki bentuk oval sampai lonjong. Ukuran daun sukun
bervariasi, satu pohon memiliki ukuran daun dengan panjang 20-60 cm, lebar
20-40 cm, dan panjang tangkai daun 3-7 cm. Pada bagian ujung daun
meruncing, bagian pangkalnya membulat, dan tepi daun berlekuk meyirip.
Permukaan daun bagian atas licin, warnanya hijau mengkilap, sedangkan
bagian permukaan bawah daun kasar, berbulu dan berwarna kusam. Posisi
daun menyebar menghadap ke atas dengan jarak antar daun bervariasi antar
2-10 cm. Bunga tanaman sukun berkelamin tunggal tetapi berumah satu.
Bunganya keluar dari ketiak daun pada ujung cabang dan ranting. Bunga
jantan berbentuk tongkat panjang berwarna kuning, dan bunga betina
berbentuk bulat bertangakai pendek. Buah sukun terbentu dari keseluruhan
jambak bunga. Buah sukun berbentuk bulat dan sedikit membujur. Biji buah
sukun berbentuk ginjal dan berwarna hitam dengan panjang 3-5 cm. tanaman
sukun memiliki akar tunggang yang dalam dan akar samping yang dangkal
2. Klasifikasi
Kingdom : Plantae
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Urticales
Famili : Moraceae
Genus : Artocarpus
Spesies : Artocarpus altilis (Parkinson) Fosberg (Pitojo, 1992).
3. Kandungan
Tanaman sukun mengandung beberapa senyawa kimia seperti
alkaloid, flavon dan flavanon (Raman, Sudhahar, and Anandarajagopal,
2012), tanin, fenolik, glikosida, saponin, steroid, terpenoid dan antraquinon
(Sidsesha, Nataraju., dan Bannikuppe, 2011). Berdasarkan penelitian yang
dilakukan Syah, Achmad, Bakhriar, Hakim, Juliawaty, dan Latip (2006)
ditemukan dua turunan senyawa geranil dari dihidrokalkon dan flavanon,
yaitu 2-geranil-2’,4’,3’, 4’-tetrahidroksihidro-kalkon dan 8-geranil-4’,
5,7-trihidroksi flavanon. Serta senyawa rutin dan kuersetin (Pham, An, Mai and
Le, 2011).
4. Nama daerah
Dari berbagai negara, yaitu breadfruit (English), arbre à pain(French),
árboldel pan (Spanish), Brotfruchtbaum (German), rimas (Philippines),
bia/nimbalu(Solomon Islands), beta (Vanuatu), ulu (Hawaii, Samoa), uru
(Tahiti and SocietyIslands), kuru (Cook Islands), mei/mai (Micronesia, Tonga,
Marquesas), lemai(Mariana Islands) and mos (Kosrae) (Ragone, 1997). Nama
daerah dari sukun adalah Sakon (Aceh), Hatopul (Batak), Bakara (Makasar),
Suku (Nias), Sukun (Sunda), Sukun (Jawa), Suun (Ambon) (Heyne, 1987).
5. Manfaat
Pada masyarakat Indonesia umumnya, sukun biasa digunakan sebagai
obat tradisional yang dapat mengobati berbagai penyakit seperti sirosis hati,
hipertensi, dan diabetes melitus (Mustafa, 1998). Secara tradisional air
rebusan daun sukun dilaporkan dapat mengobati penyakit kulit, menurunkan
tekanan darah, menyembuhkan penyakit asma, hepar, dan juga ginjal (Syah,
et al., 2006).
B. Ekstraksi
Ekstraksi merupakan proses penarikan zat yang dapat larut dari bahan
yang tidak dapat larut dengan pelarut cair (Direktorat Jenderal Pengawasan Obat
dan Makanan Republik Indonesia, 1986). Ekstraksi dengan menggunkan metode
maserasi merupakan cara ekstraksi (penyarian) sederhana yang dilakukan dengan
cara merendam serbuk dalam cairan penyari selama beberapa hari pada
temperatur kamar dan terlindung dari cahaya sambil diaduk (Badan Pengawasan
Obat dan Makanan Republik Indonesia, 2005). Maserasi digunakan untuk
penyarian simplisia yang mengandung zat aktif yang mudah larut dalam cairan
penyari. Cairan penyari yang dapat digunakan dalam proses maserasi, yaitu air,
dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif sehingga
zat aktif menjadi larut. Adanya perbedaan konsentrasi antara larutan zat aktif di
dalam sel dengan di luar sel menyebabkan larutan yang terpekat didesak keluar
(Direktorat Jenderal Pengawasan Obat dan Makanan Republik Indonesia, 1986).
Ekstrak merupakan sediaan kental yang diperoleh dengan mengekstraksi
senyawa aktif dari simplisia nabati atau simplisia hewani menggunkan pelarut
yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau
serbuk yang tersisa diperlakukan sedemikian rupa sehingga memenuhi standar
baku yang telah ditetapkan (Badan Pengawasan Obat dan Makanan Republik
Indonesia, 2005).
C. Pankreas
Pankreas memiliki berat sekitar 60 gram, panjang sekitar 12-15 cm,
berwarna abu-abu, dan berada di regio epigastrik dan hipokondriak rongga
abdomen. Pankreas terdiri atas bagian kepala yang luas yang berada di
lengkungan duodenum, badan berada di belakang lambung, dan ekor yang sempit
berada di depan ginjal kiri dan menyentuh lompa (Nurachmah dan Rida, 2010).
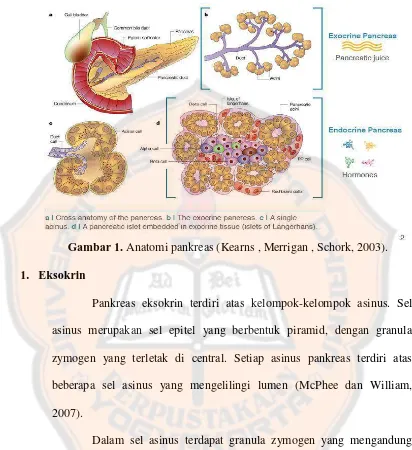
Pankreas adalah sebuah kelenjar yang memiliki fungsi endokrin yang
menghasilkan hormon-hormon (insulin, glukagon, dan somatostatin) dan eksokrin
yang menghasilkan enzim-enzim pankreas (amilase, peptidase, dan lipase) (lihat
gambar 1). Pankreas eksokrin mengandung banyak asinus yang mengeluarkan
getah pankreas ke dalam duodenum melalui ductus pankreaticus. Sedangkan,
pankreas endokrin terdiri atas banyak pulau Langerhans (McPhee and William,
Gambar 1. Anatomi pankreas (Kearns , Merrigan , Schork, 2003).
1. Eksokrin
Pankreas eksokrin terdiri atas kelompok-kelompok asinus. Sel
asinus merupakan sel epitel yang berbentuk piramid, dengan granula
zymogen yang terletak di central. Setiap asinus pankreas terdiri atas
beberapa sel asinus yang mengelilingi lumen (McPhee dan William,
2007).
Dalam sel asinus terdapat granula zymogen yang mengandung
enzim pencernaan. Jumlah granula zymogen di dalam sel bervariasi, lebih
banyak sewaktu puasa dan berkurang setelah makan. Getah pankreas
merupakan kombinasi dari sel asinar dan sekresi sel duktus. Sifat getah
pankreas ini basa yang berperan penting dalam menetralkan asam lambung
yang memasuki duodenum bersama makanan dari lambung (McPhee dan
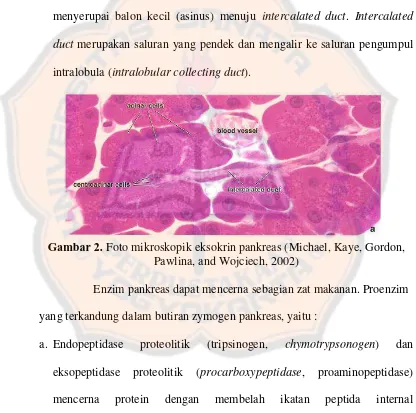
Pada gambar 2 merupakan gambar mikroskopik eksokrin
pankreas. Dari gambar terlihat empat bagian penyusun dari eksokrin, yaitu
acinar cells, centroacinar cells, intercalated duct, dan blood vessel.
Centroacinar cells tersambung dengan intercalated ducts yang terletak di
luar acinar cells. Struktur dari acinar cells dan centroacinar cells
menyerupai balon kecil (asinus) menuju intercalated duct. Intercalated
duct merupakan saluran yang pendek dan mengalir ke saluran pengumpul
intralobula (intralobular collecting duct).
Gambar 2. Foto mikroskopik eksokrin pankreas (Michael, Kaye, Gordon, Pawlina, and Wojciech, 2002)
Enzim pankreas dapat mencerna sebagian zat makanan. Proenzim
yang terkandung dalam butiran zymogen pankreas, yaitu :
a. Endopeptidase proteolitik (tripsinogen, chymotrypsonogen) dan
eksopeptidase proteolitik (procarboxypeptidase, proaminopeptidase)
mencerna protein dengan membelah ikatan peptida internal
(endopeptidases) atau dengan membelah asam amino dari karboksil atau
b. Enzim amilolitik (alfa-amilase) mencerna karbohidrat dengan membelah
hubungan glikosidik polimer glukosa.
c. Lipase mencerna lemak dengan membelah ikatan ester trigliserida,
menghasilkan asam lemak bebas,
d. Enzim nucleolytik (deoxyribonuclease dan ribonuklease) mencerna asam
nukleat, memproduksi mononucleotides (Michael, et al.,2002)
2. Endokrin
Pulau Langerhans adalah mikroorgan endokrin multihormon dari
pankreas, menempati 20% volume pankreas. membentuk 1-2% berat
pankreas. Pada manusia ada 1-2 juta pulau Langerhans. Pulau Langerhans
banyak di dalam kauda dibandingkan korpus dan kaput (Ganong,1995).
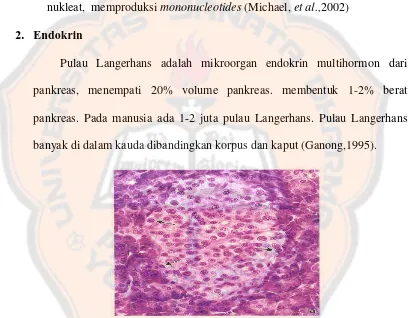
Gambar 3. Foto mikroskopik endokrin pankreas (Michael, et al.,2002) Pada gambar diatas (gambar 3) merupakan gambar mikroskopik dari
endokrin pankreas yang terdiri dari Pulau Langerhans yang berbentuk bulat
dengan berbagai ukuran yang dikelilingi oleh sel asinus eksokrin. Pulau
Langerhans biasanya lebih besar dari asinus dan terlihat lebih padat seperti
Kelenjar pankreas yang tersebar berada dalam kelompok sel-sel khusus
yang disebut pulau pankreas (Langerhans). Pulau ini tidak memiliki duktus
(saluran) sehingga hormon berdifusi secara langsung ke dalam darah. Ada
tiga jenis pulau Langerhans, yaitu sel yang menyekresi glukagon, sel
yang menyekresi insulin, dan sel yang mensekresi somatostatin. Kelenjar
pankreas mensekresi hormon insulin dan glukagon, yang pada dasarnya
berhubungan dengan pengendalian kadar glukosa darah (Nurachmah dan
Rida, 2010).
D. Jenis Kerusakan Pankreas
1. Pankreatitis akut
Pankreatitis akut adalah suatu sindrom klinis yang terjadi akibat
peradangan akut dan autodigesti destruktif pankreas dan jaringan didekat
pankreas. Pankreatitisi akut dapat disebabkan oleh trauma, metabolik, infeksi,
herediter, racun dan toksin, obat, vaskular, mekanis, idiopatik, dan dua
penyakit tersering yang berkaitan dengan pankreatitis akut adalah
penyalahgunaan alkohol dan penyakit saluran empedu (McPhee and William,
2007).
2. Pankreatitis kronik
Pankreatitis kronik adalah penyakit kambuhan yang menimbulkan
nyeri abdomen hebat, insufisiensi pankreas eksokrin dan endokrin, kelainan
duktus yang parah, dan klasifikasi pankreas. Pankreatitis kronik disebabkan
oleh penyalahgunaan alkohol, obstruksi duktus (mis, batu empedu), pankreas
hiperlipidemia, obat, trauma, autoimun, herediter, fibrosis kistik
(mukovidosis), dan idiopatik (McPhee and William, 2007).
3. Infusiensi pankreas
Infusiensi eksokrin pankreas adalah sindrom maldigesti akibat
kelainan yang mengganggu efektivitas aktivitas enzim pankreas. Karena
lipase pankreas sangat penting untuk mencerna lemak, ketiadaan enzim ini
menyebabkan stearotea (terbentuknya tinja berlemak, berjumlah besar, dan
berwarna terang). Penyebab maldigesti pada infusiensi pankreas aksokrin
mencakup pankreatitis kronik, fibrosis kistik, kanker pankreas,
gastrektomiparsial atau total, dan reseksi pankreas (McPhee and William,
2007).
4. Karsinoma pankreas
Secara mikroskopis, 90% kanker pankreas adalah adenokarsinoma;
sisanya adalah karsinoma adenoskuamosa, anaplastik, atau sel asinus. Kanker
pankreas cenderung menyebar ke jaringan sekitar, yang menginvasi
organ-organ tetangga di sepanjang fasia perineural, dan menimbulkan nyeri hebat,
dan melalui limfe dan aliran darah, yang menimbulkan metstatis ke kelenjar
limfe regional, hati dan tempat-tempat jauh lainnya. Kausa penyakit ini tidak
diketahui. Sebagian besar kasus kanker pankreas bersifat sporadik; sejumlah
kecil (3%) terjadi pada pasien dengan predisposisi herediter. Penyakit ini 6
kali lebih sering pada wanita pengidap diabetes ketimbang dibandingan yang
diabetes pria) dan 2,5-5 kali lebih sering pada perokok (McPhee and William,
2007).
5. Diabetes melitus
Diabetes melitus adalah suatu kumpulan gejala yang timbul pada
seseorang yang disebabkan oleh adanya peningkatan kadar gula darah akibat
dari kekurangan insulin, baik absolut maupuan relatif (Cahyono, 2008).
E. Diabetes Melitus 1. Definisi
Diabetes Mellitus adalah penyakit yang disebabkan oleh gangguan
metabolik yang ditandai dengan hiperglikemi. Diabetes terjadi karena cacat
pada sekresi insulin, kerja insulin atau keduanya. Diabetes dapat
menyebabkan komplikasi kronis yang mengakibatkan kerusakan berbagai
organ, terutama mata, ginjal, saraf, jantung dan pembuluh darah (Scobie,
2007).
Diabetes adalah suatu penyakit tunggal dimana merupakan kelompok
sindrom heterogen yang ditandai dengan poliuri (banyak kencing), polidipsi
(banyak minum) dan polifagi (banyak makan) (Lanywati, 2006) yang disertai
dengan peningkatan kadar glukosa darah atau hiperglikemia dengan kriteria
diagnostik mencakup glukosa plasma puasa 126 mg/dL, gejala diabetes
plus glukosa plasma sewaktu 200 mg/dL, atau kadar glukosa plasma 200
mg/dL setelah pemberian 75 g glukosa per oral (uji toleransi glukosa)
(McPhee and William, 2007). Pada tikus kadar glukosa normal, yaitu 50-135
2. Klasifikasi
a. Diabetes tipe 1
Diabetes tipe 1 (insulin-dependent diabetes mellitus (IDDM))
ditandai dengan kerusakan sel yang menyebabkan kerusakan insulin
absolut yang biasanya terjadi pada anak-anak (Scobie, 2007).
Pada diabetes tipe 1 kerusakan sel disebabkan karena adanya
destruksi imunologis yang selektif terhadap sel pulau Langehans yang
diperantai oleh limfosit T. Limfosit T supresor CD8 diduga sebagai sel
utama yang bertanggung jawab dalam kerusakan sel . Destruksi
autoimun sel merupakan suatu proses yang diperkirakan diperantarai
oleh sitokin (McPhee and William, 2007). Gangguan autoimun yang
terkait dengan diabetes tipe 1, yaitu penyakit Celiac, Addison,
hipotiroidisme, dan anemia pernisiosa (Watkins, 2003).
b. Diabetes tipe 2
Diabetes tipe 2 (non-insulin-dependent diabetes mellitus
(NIDDM)) disebabkan oleh gangguan sekresi insulin karena fungsi sel
yang abnormal. Ada beberapa penyebab dari gangguan sekresi insulin
dalam DM tipe 2 dengan beberapa kelainan yang telah terbukti
mengganggu keseimbangan antar neogenesis dan apoptosis. Studi klinis
pada manusia dan hewan membuktikan tentang konsep glukotoksisitas,
dimana ketinggian kadar glukosa plasma dengan berkurangnya sel
juga dapat menyebabkan gangguan pada sel . Pasien dengan DM tipe 2
menunjukkan respon berkuranganya incretin glucagon-like peptide
(GLP)-1 dalam merespon glukosa oral, sementara administrasi GLP-1
meningkatkan respon sekresi insulin postprandial dan dapat
mengembalikan glikemia mendekati normal (Scobie, 2007).
Komplikasi yang dapat timbul akibat diabetes melitus, yaitu
gangguan pembuluh darah besar (makroangiopati), atherosklerosis,
infark miokardium, diabetes retinopati, diabetes neuropati, dan diabetes
nefropati (Price and Loraine, 1997)
c.Diabetes gestasional
Diabetes gestasional adalah intoleransi glukosa pada saat
kehamilan yang dapat disebabkan oleh diabtes tipe 1 atau tipe 2.
Penurunan toleransi glukosa terjadi selama kehamilan normal, terutama
diketahui pada trisemester ketiga. Kriteria untuk mendiagnosis toleransi
glukosa abnormal pada kehamilan belum disepakati di seluruh dunia
(Scobie, 2007).
d. Diabetes melitus lain-lain
Diabetes mellitus jenis lainnya, kejadiannya dikaitkan dengan
adanya kelainan genetic, yaitu Maturity Onset Diabetes of Youth
(MODY) yang dikarakteristikan oleh adanya gangguan sekresi insulin
yang sedikit atau bahkan tanpas disertai resistensi insulin. Pasien yang
mengalami MODY akan mengalami hiperglikemia pada usia dini
3. Diagnosis
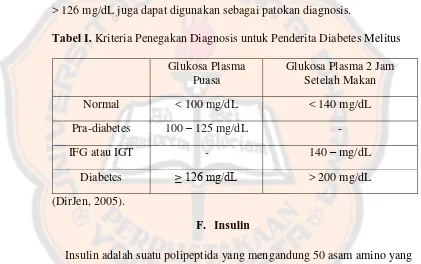
Diagnosis klinis umumnya akan dipikirkan apabila ada keluhan
khas DM. Tabel I menunjukkan kriteria untuk menyatakan seseorang
menderita diabetes melitus. Apabila ada keluhan khas, hasil pemeriksaan
kadar glukosa darah sewaktu > 200 mg/dL sudah cukup untuk
menegakkan diagnosis DM. Hasil pemeriksaan kadar glukosa darah puasa
> 126 mg/dL juga dapat digunakan sebagai patokan diagnosis.
Tabel I. Kriteria Penegakan Diagnosis untuk Penderita Diabetes Melitus Glukosa Plasma
Insulin adalah suatu polipeptida yang mengandung 50 asam amino yang
merupakan hormon yang disekresi oleh pankreas yang memiliki fungsi utama
untuk menurunkan kadar nutrien darah, glukosa, asam amino dan asam lemak
(Nurachman dan Rida, 2010).
Insulin menimbulkan efek dengan bekerja pada otot, hati , dan jaringan
lemak. Sekresi insulin dipengaruhi oleh beberapa faktor, yaitu peningkatan
glukosa plasma, peningkatan asam amino plasma, peningkatan GIP
penurunan aktivitas simpatik, dan penurunan plasma epineprin (Stanfield,
2011).
Pada saat kadar glukosa plasma meningkat akibat dari glukosa diangkut
ke dalam aliran darah dari saluran pencernaan menyebabkan terjadinya
peningkatan sekresi insulin oleh beta sel pankreas (Stanfield, 2011).
Pengangkutan glukosa dalam aliran darah dilaksanakan oleh suatu transporter
glukosa yang disebut GLUT. Ada enam bentuk GLUT, yaitu GLUT-1,
GLUT-2, GLUT-3, GLUT-4, GLUT-5, dan GLUT-6. GLUT-1 berfungsi
untuk memindahkan glukosa menembus sawar darah otak, GLUT-2 berfungsi
untuk memindahkan glukosa yang masuk ke sel ginjal dan usus ke aliran
darah sekitar melalui pembawa kontrasporter, GLUT-3 berfungsi untuk
pengangkut utama glukosa ke dalam neuron, dan GLUT-4 bertanggun jawab
atas sebegian besar penyerapan glukosa pada mayoritas sel tubuh . GLUT-4
bekerja hanya setelah berikatan dengan insulin (Sherwood, 2009).
G. Metode Penetapan Kadar Glukosa Darah 1. Metode enzimatik
Prinsip dari metode ini adalah enzim glukosa oksidase (GOD) akan
mengoksidasi glukosa oleh udara (O2) menjadi asam glukonat dan hidrogen
peroksida. Hidrogen peroksida akan bereaksi dengan 4-amino-antipirin dan
fenol yang dikatalis oleh enzim peroksidase membentuk senyawa kuinonimin
Reaksi yang terjadi :
Glukosa + O2 + 2 H2O GOD asam glukonat + H2O2
2 H2O2 + 2,4-dikloro phenol + 4-aminoantipirin PAP quinonimine + 4H2O
(Anonim, 2012).
2. Metode kondensasi dengan gugus amina
Prinsip dari metode ini adalah aldose akan dikondensasikan dengan
orto-toloidin dalam suasana asam dan setelah dipanaskan akan
menghasilkan larutan yang berwarna hijau (Widowati, Dzulkarnain, dan
Sa’roni, 1997).
3. Metode oksidasi - reduksi
Penetuan kadar glukosa darah pada metode ini dilakukan dengan cara
dioksidasi menggunakan oksidan ferrisianida. Oksida ini direduksi
menjadi ferrosianida oleh glukosa dalam suasana basa dengan pemanasan,
kemudian kelebihan ferri ditritasi secara iodometri (Widowati,
Dzulkarnain, dan Sa’roni, 1997).
H. Streptozotosin
Gambar 4. Struktur streptozotosin (Lenzen, 2008).
Sterptozotosin (STZ) ( Gambar 4) adalah suatu senyawa
menyebabkan kerusakan sel pankreas, sehingga terjadi hiperglikemi (Lenzen,
2008). Streptozotosin berbentuk bubuk, berwarna kuning pucat yang dapat
digunakan untuk menginduksi diabetes tipe 1 maupun diabetes tipe 2 pada hewan
uji (Etuk, 2005).
Dosis sterptozotosin yang biasa digunkan dalam menginduksi diabetes
mellitus tipe 1 yaitu 40-60 mg/kgBB (intravena) dan lebih dari 40 mg/kgBB
(intraperitonial). Pemberian streptozosin secara berulang dapat menginduksi
diabetes mellitus tipe 1 yang diperantai sistem imun. Pada diabetes tipe 2
streptozotosin dapat diinduksi dengan dosis 100 mg/kgBB intravena atau
intraperitoneal pada tikus yang berumur 2 hari kelahiran (Nugroho, 2006). Pada
penelitian yang dilakukan oleh Astuti, Mulyani, Laksmindra dan Sismindari
(2001) pemberian streptozotosin sebesar 40 mg/kgBB dengan dosis tunggal pada
tikus Sprague Dawley memberikan respon yang stabil dan penurunan insulin yang
lebih cepat dibandingkan dengan dosis 60 mg/kgBB.
Streptozotosin masuk ke dalam sel pankreas melalui transporter
glukosa (GLUT2) dan menyebabkan alkilasi DNA melalui gugus nitrosourea
yang mengakibatkan kerusakan sel pankreas. Peningkatan ATP
dephosphorylation setelah penginduksian streptozotosin mengakibatkan
terbentuknya substrat untuk xanthine oxidase sehingga pembentukan radikal
superoksida. Akibatnya, hidrogen peroksida dan radikal hidroksil juga dihasilkan.
Selain itu, streptozotosin membebaskan sejumlah oksida nitrat yang menghambat
aktivitas akonitase dan berpartisipasi dalam kerusakan DNA. Sebagai hasil dari
penelitian yang dilakukan oleh Pathak, Helge, Vladmir and Daan (2008)
streptozotosin secara selektif akan menghambat aktivitas enzim O-G1cNAse yang
bersama-sama dengan O-G1cNAc transferase bertanggung jawab dalam
perpindahan O-G1cNAc dari protein. Akibaranya terjadi O-glikosilasi protein
intraseluler dengan adanya N-methylnitroso mengakibatkan sel mengalami
apoptosis, sehingga memberi efek toksik pada sel pankreas yang mengakibatkan
regulasi kadar produksi insulin menurun dan regulasi kadar glukosa darah menjadi
terganggu.
Degradasi sel yang terjadi akan terlihat 2-4 hari setelah pemberian
streptzotosin akibat adanya pembengkakan pada pankreas dapat dilihat dari
terjadinya peningkatan kadar glukosa darah (Akbarzadeh, et al., 2007).
Pemberian streptozotosin untuk menginduksi diabetes melitus lebih efektif
I. Landasan Teori
Pankreas merupakan bagian dari sistem pencernaan yang bertugas
membuat dan mengeluarkan enzim pencernaan ke dalam usus, dan juga organ
endokrin yang bertugas membuat dan mengeluarkan hormon ke dalam darah
untuk mengontrol metabolisme energi dan penyimpanan seluruh tubuh
(Longnecker, 2014).
Kerusakan pada pankreas dapat menyebabkan terjadinya diabetes mellitus.
Diabetes mellitus merupakan sekelompok penyakit metabolik yang ditandai oleh
hiperglikemia akibat cacat sekresi insulin dan peningkatan resistensi seluler
terhadap insulin (Anonim,2009)
Sukun (Artocarpus altilis (Parkinson) Fosberg) merupakan tumbuhan tropik
yang memilki kandungan saponin, polifenol, asam hidrosianat, asetilkolin, tanin,
riboflavin, fenol dan kuersetin. Daun sukun dapat mengobati beberapa penyakit
seperti liver, hepatitis, ginjal, hipertensi, dan salah satunya diabetes melitus.
Menurut Chandrika, et al., 2006 dengan dosis 50 mg/kgBB pada pemberian
ekstrak air panas daun Artocarpus heterophyllus dapat memberikan efek
antihiperglikemik pada tikus.
Pankreas dapat dirusak dengan peninduksian senyawa tertentu, seperti
aloksan dan streptozotosin. Streptozotosin merupakan salah satu senyawa yang
secara selektif merusak sel sehingga menyebabkan terganggunya sekresi insulin
yang mengakibatkan glukosa dalam tubuh semakin meningkat sehingga
dilakukan ekstrak etanol daun sukun mengandung flavanoid yang memiliki
aktivitas sebagai antioksidan, dimana antioksidan merupakan suatu senyawa yang
dapat mengikat radikal bebas sehingga kerusakan sel-sel pankreas dapat
dihambat dan juga mampu meregenerasi sel-sel pankreas yang rusak sehingga
defisiensi insulin dapat diatasi, serta dapat memperbaiki sensitifitas reseptor
insulin sehingga hiperglikemi dapat dicegah (Marianne, dkk, 2011).
J. Hipotesis
1. Ekstrak etanol daun Artocarpus altilis (Park.) Fosberg. dosis 50 mg/kgBB
memiliki pengaruh terhadap penurunan kadar glukosa darah pada tikus jantan
Wistar yang terinduksi streptozotosin.
2. Ekstrak etanol daun Artocarpus altilis (Park.) Fosberg. dosis 50 mg/kgBB
memiliki pengaruh terhadap gambaran histologi pankreas pada tikus jantan
25
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental murni dengan
rancangan penelitian acak lengkap pola searah. Penelitian ini dilakukan di
Laboratorium Farmakognosi-Fitokimia dan Farmakologi-Toksikologi Fakultas
Farmasi Universitas Sanata Dharma.
B. Variabel dan Definisi Operasional
Variabel-variabel yang digunakan adalah sebagai berikut :
1. Variabel utama
a. Variabel bebas. Variabel bebas dalam penelitian ini adalah perlakuan pada
hewan uji ( dosis ekstrak etanol daun Artocarpus altilis (Park.) Fosberg).
b. Variabel tergantung. Variabel tergantung dalam penelitian ini yaitu :
1. Kadar glukosa darah tikus jantan Wistar.
2. Hasil histologis pankreas tikus jantan Wistar.
2. Variabel pengacau
a. Variabel pengacau terkendali. Variabel pengacau terkendali dalam
penelitian ini adalah jenis kelamin, galur, berat badan, umur dari hewan
uji, jumlah asupan makanan, dan waktu pencuplikan darah. Hewan uji
yang digunakan adalah tikus jantan Wistar dengan berat badan 120-160 g
intraperitonial, ekstrak etanol daun Artocarpus altilis (Park.) Fosberg.
secara per oral.
b. Variabel pengacau tak terkendali. Variabel pengacau tak terkendali dalam
penelitian ini adalah keadaan patologis dari hewan uji yang digunakan,
stabilitas streptozotosin, dan kondisi tanah.
3. Definisi operasional
a. Daun Artocarpus altilis (Park.) Fosberg. adalah daun segar berwarna hijau,
tidak berlubang dan tidak terlalu tua dan muda (diambil daun yang berada
tidak dipangkal dan diujung batang) yang diperoleh pada bulan November
2013 dari Desa Sewon, Bantul, Yogyakarta.
b. Ekstrak etanol daun Artocarpus altilis (Park.) Fosberg. adalah sediaan
pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia daun
Artocarpus altilis (Park.) Fosberg. menggunakan metode ekstraksi.
Metode ekstraksi yang digunakan adalah maserasi dengan pelarut etanol
96%. Proses ekstraksi dilakukan selama 7 hari.
c. Berat badan tikus adalah ukuran badan tikus dalam sisi berat yang
ditimbang menggunakan timbangan. Ukuran ini yang dipakai untuk
menilai keadaan gizi pada tikus. Perhitungan yang diperoleh dapat
dijadikan penanda dari kondisi hipoglikemik pada tikus.
d. Kadar glukosa darah tikus adalah banyaknya glukosa di dalam darah tikus.
Pengukuran kadar glukosa darah tikus menggunakan metode GOD-PAP.
Dimana tikus dikatakan hiperglikemia apabila kadar glukosa darah 11,1
e. Gambaran hitologis pankreas adalah gambaran keadaan dari struktur
jaringan organ pankreas secara detail dengan menggunakan mikroskop.
Gambaran histologis pankreas akan mengalami perubahan apabila
terinduksi streptozotosin.
C. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah sebagai berikut:
1. Bahan utama
a. Hewan uji yang digunakan, yaitu tikus jantan Wistar, dengan umur 6-8
minggu, berat badan 120-160 g yang diperoleh Laboratorium Hayati
Imono Universitas Sanata Dharma Yogyakarta.
b. Bahan uji yang digunakan adalah daun Artocarpus altilis (Park.) Fosberg.
yang diperoleh dari desa Sewon, Bantul, Daerah Istimewa Yogyakarta.
2. Bahan kimia
a. Senyawa penginduksi (kontrol positif pankreotoksik) berupa
streptozotosin (STZ) merk Nacalai dari BIOZATIC yang diperoleh dari
Laboratorium Farmakologi FMIPA Unversitas Islam Indonesia
Yogyakarta.
b. Etanol 96 % sebagai pelarut dalam ekstraksi daun Artocarpus altilis
(Park.) Fosberg. yang diperoleh dari CV. General Labora, Yogyakarta.
c. Pereaksi untuk pengukuran glukosa darah yang digunakan adalah enzim
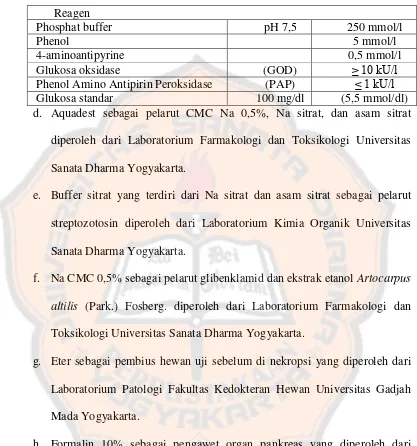
Tabel II. Isi pereaksi enzim Glucose GOD-PAP
Phenol Amino Antipirin Peroksidase (PAP) ≤ 1 kU/l
Glukosa standar 100 mg/dl (5,5 mmol/dl)
d. Aquadest sebagai pelarut CMC Na 0,5%, Na sitrat, dan asam sitrat
diperoleh dari Laboratorium Farmakologi dan Toksikologi Universitas
Sanata Dharma Yogyakarta.
e. Buffer sitrat yang terdiri dari Na sitrat dan asam sitrat sebagai pelarut
streptozotosin diperoleh dari Laboratorium Kimia Organik Universitas
Sanata Dharma Yogyakarta.
f. Na CMC 0,5% sebagai pelarut glibenklamid dan ekstrak etanol Artocarpus
altilis (Park.) Fosberg. diperoleh dari Laboratorium Farmakologi dan
Toksikologi Universitas Sanata Dharma Yogyakarta.
g. Eter sebagai pembius hewan uji sebelum di nekropsi yang diperoleh dari
Laboratorium Patologi Fakultas Kedokteran Hewan Universitas Gadjah
Mada Yogyakarta.
h. Formalin 10% sebagai pengawet organ pankreas yang diperoleh dari
Laboratorium Patologi Fakultas Kedokteran Hewan Universitas Gadjah
Mada Yogyakarta.
i. Alkohol absolut 80%, dan 95% sebagai cairan dehidran yang diperoleh
dari Laboratorium Patologi Fakultas Kedokteran Hewan Universitas
j. Xylol sebagai clearing agent dan pewarnaan H&E yang diperoleh dari
Laboratorium Patologi Fakultas Kedokteran Hewan Universitas Gadjah
Mada Yogyakarta.
k. Parafin sebagai bahan impregnasi yang diperoleh dari Laboratorium
Patologi Fakultas Kedokteran Hewan Universitas Gadjah Mada
Yogyakarta.
l. Harris-Hematoxyline sebagai pewarna dalam pewarnaan H&E yang
diperoleh dari Laboratorium Patologi Fakultas Kedokteran Hewan
Universitas Gadjah Mada Yogyakarta.
m. Acid Alkohol sebagai larutan untuk pewarnaan H&E yang diperoleh dari
Laboratorium Patologi Fakultas Kedokteran Hewan Universitas Gadjah
Mada Yogyakarta.
n. Eosin sebagai larutan untuk pewarnaan H&E yang diperoleh dari
Laboratorium Patologi Fakultas Kedokteran Hewan Universitas Gadjah
Mada Yogyakarta.
D. Alat dan Instrument Penelitian
Alat yang digunakan dalam penelitian ini adalah sebagai berikut :
Mesin penyerbuk (Retsch), oven (Memmert), ayakan dengan nomor mesh 40,
timbangan analitik (OHAUSS), maserator, waterbath, hot plate, evaporator
(BUCHI), aluminium foil, moisture balance (HG5 Hologen Moisture Analyzer),
seperangkat alat gelas berupa Erlenmeyer, beaker gelas, gelas ukur, labu ukur,
cawan porselin, pengaduk (Pyrex Iwaki Glass), spuit injeksi, spuit injeksi oral,
efendorf, mikrovitalab (Microlab 200, Merck), micro haematocrit tubes, vortex
(Genie Wilten), timbangan tikus (OHAUSS), mortir dan stamper, stopwatch,
tabung reaksi, embedding casette, pisau skalpel No 22-24, balok kayu, mikrotom,
coverglass, inkubator, tabung film, silet, tissue embedding console, bunsen,
cetakan pagoda, balok kayu (ukuran 3 cm x 1 cm x 1 cm), mikrotom, panangas,
gelas obyek, gelas penutup, staining jar, corong gelas, lap, stop watch, kotak
preparat dan mikroskop, magnetic stirer, kertas saring, akuades dalam botol
semprot, styrofoam, jarum, mikrotip, label, keranjang preparat dan refrigerator.
E. Tata Cara Penelitian 1. Determinasi tanaman sukun
Determinasi daun sukun (Artocarpus altilis (Park.) Fosberg.) mengikuti
Bihrmann’s Caudiciforms dan Taxonomy, serta dilakukan di Laboratorium
Sistematika Tumbuhan, Fakultas Biologi, Universitas Gadjah Mada, Yogyakarta.
2. Pengumpulan bahan
Daun Artocarpus altilis (Park.) Fosberg. diperoleh dari desa Sewon,
Bantul, Yogyakarta. Daun yang diambil adalah daun segar berwarna hijau, tidak
berlubang dan tidak terlalu tua dan muda (diambil daun yang berada tidak
dipangkal dan diujung batang).
3. Pembuatan simplisia
Pembuatan simplisia daun Artocarpus altilis (Park.) Fosberg. yang telah
dikumpulkan, dicuci dengan air mengalir, kemudian ditiriskan pada sinar
matahari, untuk meniadakan air pada daun. Selanjutnya, daun dikeringkan
menggunakan mesin penyerbuk di LPPT Universitas Gadjah Mada. Kemudian
serbuk diayak menggunakan ayakan dengan nomor 40 mesh.
4. Pembuatan ekstrak etanol daun Artocarpus altilis (Park.) Fosberg
Pembuatan ekstrak etanol daun sukun dilakukan dengan cara menyari
simplisia daun Artocarpus altilis (Park.) Fosberg. dengan derajat kehalusan 40
mesh. Serbuk seberat 100 g direndam dengan 75 ml pelarut etanol 96% di dalam
erlenmeyer selama 5 hari terlindung dari cahaya dan dilakukan pengadukan
setiap hari. Kemudian serbuk diremaserasi lagi dengan 25 ml pelarut etanol 96%
selama 2 hari, di tempat sejuk, terlindung dari cahaya dan dilakukan pengadukan
setiap hari. Setelah dimaserasi dan diremaserasi, hasil maserasi dan remaserasi
disaring dengan kertas saring. Hasil saringan kemudian dievaporasi dengan
evaporator pada suhu 50ºC, kemudian dipindahkan ke cawan porselin yang telah
ditimbang sebelumnya, dengan maksud untuk mempermudah perhitungan
rendemen ekstrak kental yang akan diperoleh. Selanjutnya, ekstrak kental didalam
cawan porselin diuapkan di waterbath dengan suhu 50oC kemudian dimasukkan
dalam oven untuk diuapkan dengan suhu 50oC agar mendapatkan ekstrak etanol
daun sukun dengan bobot ekstrak yang tetap.
5. Penetapan kadar air serbuk daun Artocarpus altilis (Park.) Fosberg.
Penetapan kadar dilakukan dengan cara susut pengeringan. Sebanyak 5,0 g
serbuk daun Artocarpus altilis ditimbang dan kemudian serbuk dimasukkan ke
dalam alat moisture balance pada suhu 105º C selama 15 menit dan kemudian
dalam alat moisture balance. Selisih tersebut merupakan kadar air serbuk yang
diteliti.
6. Dosis ekstrak etanol Artocarpus altilis (Park.) Fosberg.pada penelitian
Dosis ekstrak etanol Artocarpus altilis (Park.) Fosberg. yang digunakan
adalah 50 mg/kgBB. Dosis ini mampu memberikan efek hipoglikemik pada tikus
dengan pemberian ekstrak air panas daun Artocarpus heterophyllus yang
mempunyai famili yang sama Artocarpus altilis (Park.) Fosberg. (famili
Moraceae) (Chandrika et al, 2006).
7. Pembuatan suspensi CMC Na 0,5%
Serbuk CMC ditimbang sebanyak 0,5 g, kemudian dilarutkan dengan
akuades yang telah dipanaskan sebelumnya. Diaduk sambil dipanaskan di atas hot
plate hingga semua serbuk larut, kemudian ad 100 ml dengan akuades.
8. Pembuatan dapar Na Sitrat 50 mM pH 4,5
Na sitrat ditimbang sejumlah 14,705 g, kemudian ditambahkan akuades
hingga 1 liter. Ditimbang juga asam sitrat 10,507 g ditambahkan akuades ad 1
liter. Dilakukan proses titrasi Na sitrat dengan menggunakan asam sitrat hingga
diperoleh pH 4,5 yang diukur dengan menggunakan pH-meter.
a. Asam sitrat
50 mM = 0,05 molar
Molar = 0,05 molar / 1 liter (Mr asam sitrat = 210,14)
Asam sitrat = 10,507 g dalam 1 liter
b. Na sitrat
50 mM = 0,05 molar
Molar = 0,05 molar / 1 liter (Mr Na sitrat = 294,1)
9. Penetapan dosis streptozotosin
Dosis STZ yang digunakan adalah dosis yang mampu meningkatkan
kadar glukosa darah tikus Sparague Dawley jantan berdasarkan penelitian
sebelumnya oleh Astuti, dkk. (2001), yaitu sebesar 40 mg/kgBB.
10.Induksi hiperglikemia pada tikus
Tikus dikatakan hiperglikemia jika kadar glukosa darah ≥ 200 mg/dL.
Pada hari ke-0, kadar glukosa darah diukur dengan metode GOD-PAP,
kemudian tikus kelompok positif pankreotoksik pada hari ke-1 diinduksi
dengan STZ dosis 40 mg/kgBB (single dose) yang sebelumnya telah
dilarutkan dengan buffer Na sitrat pH 4,5 dan diinjeksi secara intraperitonial.
Kelompok perlakuan diinduksi STZ dosis 40 mg/kgBB pada hari ke-1 dan
dilanjutkan dengan memberikan ekstrak etanol Artocarpus altilis (Park)
Fosberg dosis 50 mg/kgBB hingga hari ke-7. Hari ke-0, 4 dan 7 kadar
glukosa darah diukur dengan menggunakan metode GOD-PAP.
11.Pengukuran kadar glukosa darah
a. Pembuatan serum. Darah tikus diambil melalui sinus orbitalis mata pada
mata dan ditampung dalam tabung efendrof, kemudian disentrifugasi
dengan kecepatan 5000 rpm selama 15 menit dan diambil serumnya.
b. Pengukuran kadar glukosa. Alat yang digunakan dalam mennganalisis
kadar glukosa darah adalah mikrovitalab. Kadar glukosa dinyatakan dalam
mg/dl. Pengukuran kadar glukosa serum dilakukan di Laboratorium
Anatomi Fisiologi Manusia - Biokimia Fakultas Farmasi Universitas
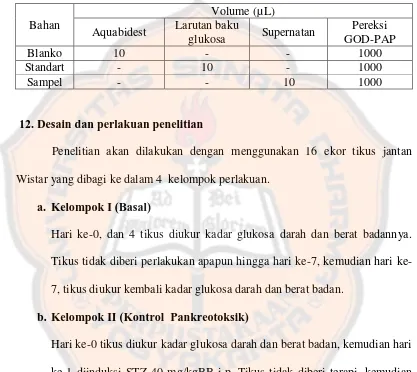
bahan seperti pada tabel III., kemudian divortex dan dibaca serapannya
setelah didiamkan selama 20 menit (operating time) pada suhu 20-25ºC.
Tabel III. Volume bahan untuk pengukuran kadar glukosa
Bahan
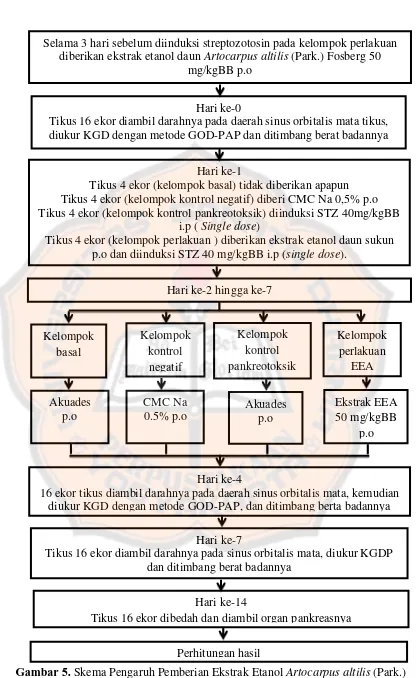
12.Desain dan perlakuan penelitian
Penelitian akan dilakukan dengan menggunakan 16 ekor tikus jantan
Wistar yang dibagi ke dalam 4 kelompok perlakuan.
a. Kelompok I (Basal)
Hari ke-0, dan 4 tikus diukur kadar glukosa darah dan berat badannya.
Tikus tidak diberi perlakukan apapun hingga hari 7, kemudian hari
ke-7, tikus diukur kembali kadar glukosa darah dan berat badan.
b. Kelompok II (Kontrol Pankreotoksik)
Hari ke-0 tikus diukur kadar glukosa darah dan berat badan, kemudian hari
ke-1 diinduksi STZ 40 mg/kgBB i.p. Tikus tidak diberi terapi, kemudian
hari ke-4, dan 7 diukur kembali kadar glukosa darah dan berat badan.
c. Kelompok III (Negatif)
Hari ke-0 tikus diukur kadar glukosa darah dan berat badan, kemudian hari
ke-1 diberi CMC Na dengan dosis 50 mg/kgBB. Tikus tidak diinduksi
streptozotosin, kemudian hari ke-4 dan 7 diukur kembali kadar glukosa
d. Kelompok IV (Perlakuan)
Hari ke-0, tikus diukur kadar glukosa darah dan berat badan yang tiga hari
sebelumnya diberikan ekstrak daun Artocarpus altilis (Park.) Fosberg. 50
mg/kgBB p.o., kemudian hari ke-1 diinduksi streptozotosin 40 mg/kgBB
i.p. dan hari ke-1 hingga hari ke-7 diberikan ekstrak etanol daun
Artocarpus altilis (Park.) Fosberg. 50 mg/kgBB p.o. Kemudian hari ke-4
dan 7. Hari Tikus diukur kembali kadar glukosa darah dan berat
badannya.
13. Pengumpulan sampel
Tikus yang akan digunakan untuk penelitian, diukur berat badannya
sebelum diukur kadar glukosa darahnya. Pengambilan darah dilakukan melalui
sinus orbitalis mata pada mata, diambil darahnya dan diukur menggunakan
mikrovitalab dengan metode enzimatik GOD-PAP (hari ke-0 , 4 dan 7). Pada hari
ke-14, tikus di bedah dan diambil pankreasnya untuk di amati gambaran histologi
pankreas tikus.
14.Pembuatan slide histologi pankreas a. Trimming
Trimming dilakukan setelah proses fikasasi dengan melakukan pemotongan
jaringan setebal kurang lebih 4 mm dengan orientasi sesuai dengan organ
yang akan dipotong.setelah dilakukan pemotongan jaringan diletakkan
b. Dehidration
Dehidrasi jaringan dilakukan menggunakan “tissue processor” untuk
mengeluarkan air yang terkandung dalam jaringan, dengan menggunakan
cairan dehidran alkohol 80%, 95%, dan alkohol absolut. Cairan dehidran ini
kemudian dibersihkan dari dalam jaringan dengan menggunakan reagen
pembersih (clearing agent) dengan menggunkan xylol. Reagen pembersih
kemudian diganti dengan parafin dengan cara penetrasi ke dalam jaringan,
proses ini disebut impregnasi.
c. Embedding
Setelah proses dehidrasi, jaringan yang ada di dalam embedding cassette
dipindah ke dalam base mold. Kemudian diisi dengan parafin cair dan
diletakkan pada blok kayu ukuran 3x3 cm atau pada embedding cassette.
Jaringan yang sudah dilekatkan pada balok kayi atau cassette disebut blok.
Fungsi dari balok kayu atau cassette adalah untuk pemegang pada saat blok
dipotong pada mikrotom.
d. Cutting
Cutting adalah pemotongan jaringan yang sudah didehidrasi dengan
menggunakan mikrotom.
Metode :
1. Orientasi blok pada mikrotom
Blok diletakkan sejajar memanjang dengan pisau. Jaringan yang keras
harus diletakkan di bagian atas. Kemudian sediakan cukup ruangan