II.TINJAUAN PUSTAKA
2.1. Hypothenemus hampei Ferrari (Coleoptera: Curculionidae)
Penggerek buah kopi, Hypothenemus hampei (Ferrari) (Coleoptera:
Curculionidae) pertama kali ditemukan di Uganda tahun 1867. Hama ini
kemudian menyebar ke berbagai areal pertanaman kopi di dunia. Di Indonesia, H.
hampei pertama kali ditemukan tahun 1909 di perkebunan Lampegan, Jawa Barat
yaitu menyerang tanaman kopi jenis Liberika. Penyebaran hama ini di Indonesia
diduga melalui pemasukan kopi dari Uganda (Sulistyowati, 1992; Susilo, 2008).
1. Biologi H. hampei
Penggerek buah kopi mengalami 4 (empat) tahap perkembangan yaitu
stadium telur, larva, pupa dan dewasa (imago). Seluruh stadia telur, larva dan
pupa berada di dalam buah kopi. Imago betina meninggalkan buah ketika semua
jaringan buah habis dimakan untuk melanjutkan bertelur di buah lain (Barrera,
1994 dalam Damon, 2000).
Hasil penelitian Benavides et al. (2012) menunjukkan kumbang betina
masuk ke dalam buah kopi dan menggerek di dalam biji kopi untuk bertelur 2-3
butir per hari sampai 20 hari. Menurut Barrera (1994) dalam Damon (2000)
imago betina dapat meletakkan telur antara 31-119 butir pada satu buah kopi yang
matang. Namun Kalshoven (1981) menyatakan bahwa imago betina H. hampei
dapat meletakkan telur sekitar 70 butir selama hidupnya. Menurut Direktorat
Jenderal Perkebunan (2011) telur diletakkan di dalam biji kopi, menetas dan
berkembang didalamnya sampai buah kopi matang baik yang masih di pohon
maupun yang gugur di tanah. Setiap buah diserang oleh satu ekor imago betina
berlangsung hingga 20 hari (Jaramillo et al. 2006). Hasil penelitian Damon (2000)
menunjukkan pada suhu 270C lama stadium telur berkisar 4 hari.
Larva tidak bertungkai dan mempunyai kepala yang agak jelas, berwarna
putih dan pada bagian mulut berwarna coklat. Lama stadium larva berkisar 10-26
hari dengan masa prapupa 2 hari. Larva jantan mengalami pergantian kutikula
satu kali sedangkan betina dua kali (Direktorat Jenderal Perkebunan, 1996).
Pupa berwarna putih dengan panjang 1,9 mm dan lebar 0,74 mm
(Direktorat Jenderal Perkebunan, 1996). Masa pupa berlangsung antara 5-11 hari.
Namun menurut Damon (2000) pada suhu 270C masa pupa berlangsung selama 7
hari.
Imago merupakan kumbang berwarna hitam kecoklatan. Warna antena dan
tungkai lebih muda dibanding warna badan. Badan berbentuk agak bulat pendek
dan ditutupi oleh bulu-bulu. Kumbang betina berukuran panjang 1,7 mm dan lebar
0,6-0,7 mm. Kumbang jantan berukuran panjang 1,2 mm dan lebar 0,6 mm.
Imago betina bisa terbang, sedangkan jantan tidak. Imago betina terbang sore hari
mulai pukul 16.00 sampai 18.00 (Prastowo et al. 2010). Kumbang betina H.
hampei memiliki daya jangkau hingga mencapai jarak sejauh 345 m,
menggunakan sayap dan dapat juga dibantu angin (Damon, 2000).
Kumbang-kumbang yang baru terbentuk di dalam buah akan melakukan
perkawinan sesamanya (sibling). Rasio antara kumbang betina dan kumbang
jantan sekitar 10:1 (Susilo, 2008; Prastowo et al. 2010). Sedangkan menurut
Direktorat Jenderal Perkebunan 1996 perbandingan betina dan jantan adalah 20:1.
Setelah proses kawin kumbang betina akan meninggalkan buah untuk mencari
jantan akan tinggal di dalam buah. Aktivitas infestasi dilakukan pada sore hari.
Kumbang H. hampei mampu bertahan lebih dari 5 bulan di dalam buah, baik
pada buah yang masih melekat di pohon maupun buah yang sudah gugur (Susilo,
2008).
Siklus hidup H. hampei bervariasi. Siklus tahunan H. hampei sangat
terkait dengan tanaman kopi dan panen. Pada musim kering, imago betina
semi-aktif dalam buah menunggu hujan untuk merangsang munculnya buah baru agar
dapat memulai siklus berikutnya (Damon, 2000).
Menurut Direktorat Jenderal Perkebunan 1996 perkembangan sejak telur
sampai dewasa memerlukan waktu antara 25-35 hari dengan rata-rata 27,5 hari.
Dalam satu tahun dapat terjadi sekitar 8-10 generasi. Kumbang jantan hidup
antara 50-75 hari, sementara betina antara 100-150 hari (Benavides et al. 2012).
Menurut Kalshoven (1981) imago betina hidup selama 55 hari (maksimum 95
hari). Bila terdapat buah hijau di lapangan, betina dapat hidup selama 65 hari dan
maksimum 115 hari dan mengurangi produksi telur menjadi 35 butir.
Hasil penelitian Damon (2000) menunjukkan bahwa siklus hidup
H. hampei berkisar 28-34 hari. Namun imago jantan dapat hidup selama 20-87
hari sedangkan betina rata-rata selama 157 hari. Daya hidup yang lama bagi
kumbang H. hampei tersebut memungkinkan infestasi dapat dilakukan pada
periode panen berikutnya. Buah-buah yang tidak terpanen atau pun buah yang
2. Gejala Serangan dan Kerusakan
Hypothenemus hampei hanya menyerang buah kopi muda dan tua, tetapi
tidak menyerang daun, cabang atau batang. Imago betina penggerek buah kopi
menyerang buah dari umur delapan minggu setelah berbunga hingga musim panen
(>32 minggu). Kumbang betina ini membuat lubang ke dalam buah kopi mulai
ujung buah baik biji yang masih di pohon maupun yang telah jatuh ke tanah dan
membuat jalur gerekan ke dalam biji kopi untuk menyimpan telur. Larva juga
makan di dalam biji kopi (Bittenbender et al. 2013). Lubang gerekan berbentuk
bulat dengan diameter 1 mm dan umumnya dijumpai pada ujung buah (Gambar
1). Lubang ini kadang-kadang sukar dilihat karena sering tertutupi oleh kotoran
dari gerekan kumbang. Buah kopi yang terserang H. hampei akan berlubang
(Direktorat Jenderal Perkebunan, 1996).
Menurut Wiryadiputra (1994) H. hampei umumnya menyerang buah kopi
yang bijinya (endosperma) telah mengeras, namun biji kopi yang belum
mengeraspun yang telah berdiameter lebih dari 5 mm juga kadang-kadang
diserang. Buah-buah yang bijinya masih lunak umumnya tidak digunakan sebagai
tempat berkembang biak tetapi hanya digerek untuk mendapatkan makanan
sementara dan selanjutnya ditinggalkan lagi. Kerusakan yang ditimbulkan pada
serangan demikian kadang justru lebih berat, karena buah menjadi tidak
berkembang, berubah warna menjadi kuning kemerahan dan akhirnya gugur.
Serangan pada buah yang bijinya telah mengeras akan berakibat penurunan
jumlah dan mutu hasil. H. hampei makan dan bereproduksi di dalam endosperma
endokarp dalam kondisi optimal hingga 8 jam (Damon, 2000;
Jaramillo et al. 2006).
Terdapat tiga jenis kerusakan yang telah dilaporkan: 1) Jatuhnya buah
muda dengan cepat; 2) Meningkatkan kerentanan buah matang terhadap infeksi
jamur dan bakteri; dan 3) Penurunan hasil dan mutu kopi, sehingga mengurangi
pendapatan petani. Penggerek buah kopi dapat menyebabkan kehilangan hasil
30-35% dengan 100% kerusakan buah pad a saat panen. Walaupun sudah terserang
H. hampei sebesar 100%, biji kopi masih dapat djual atau masih memiliki nilai
ekonomi sehingga kehilangan hasil dapat ditekan. Kerusakan mungkin lebih besar
jika panen tertunda (Damon, 2000).
Kerusakan yang disebabkan oleh H. hampei terutama menyebabkan
pengurangan hasil kopi karena gugurnya buah, kurangnya bobot buah dan
penurunan kualitas kopi hingga pengurangan harga jual. Diperkirakan bahwa ada
penurunan 55% berat biji yang diserang H. hampei, namun penurunan berat dari
total produksi kopi sekitar 18%. H. hampei juga menyerang buah muda (berumur
kurang dari 20 minggu setelah berbunga) yang mengakibatkan gugurnya 32%
buah muda. Selanjutnya, H. hampei menyebabkan kehilangan hasil 40-80% pada
infestasi serangan 90%. Hal ini berarti serangan H. hampei pada biji kopi tidak
langsung mengakibatkan biji kopi tidak dapat dijual namun masih memiliki nilai
ekonomi sehingga nilai kehilangan hasil dapat ditekan. Peraturan pemasaran
internasional tidak memungkinkan kopi yang memiliki kerusakan 1,5% oleh
serangga untuk diekspor, dengan demikian harga kopi di negara-negara produsen
Gambar 1. Gejala serangan H. hampei pada buah kopi
3. Faktor-faktor yang Mempengaruhi Perkembangan H. hampei
Dinamika populasi dan pola infestasi oleh H. hampei erat kaitannya
dengan faktor iklim seperti curah hujan dan kelembaban relatif serta fisiologi
kopi tanaman. Isi bahan kering dari endosperm adalah faktor yang paling penting
menentukan serangan H. hampei dan kecepatan penetrasi ke dalam buah kopi.
Biji dengan <20 % kandungan bahan kering yang baik ditinggalkan setelah
serangan awal atau imago betina menunggu dalam lubang gerekan eksokarp
sampai endosperm memiliki jumlah akumulasi isi bahan kering yang cukup
untuk pengembangan keturunannya. Imago jantan tinggal bersama larva di
dalam buah dan tidak meninggalkan buah (Jaramillo et al. 2006).
Pertanaman kopi dengan penaung yang berlebihan (gelap) mendukung
perkembangan H. hampei lebih baik bila dibandingkan pertanaman dengan
kondisi penaung kurang (terbuka). Pada pertanaman dengan penaungan rapat,
dilaporkan bahwa buah yang terinfestasi H. hampei 5 kali lebih banyak dan
perkembangan H. hampei lebih cepat dibandingkan pada pertanaman dengan
penaungan kurang (terbuka). Demikian juga pertanaman yang pembuahannya
Infestasi pertama terjadi dalam buah yang melekat pada ranting tapi
reproduksi terus terjadi dalam buah yang jatuh ke tanah dan biji panen selama
kelembaban sesuai. Suhu optimum untuk perkembangan H. hampei berkisar
25-26oC sedangkan kelembaban optimum yang dibutuhkan berkisar antara 90-95%
(Baker et al. 1994 dalam Susilo, 2008).
4. Teknik Pengendalian
Strategi berbeda diperlukan untuk mengendalikan H. hampei seperti kultur
teknis, konservasi musuh alami dan pemanfaatan musuh alami eksotis serta
patogen serangga (Benavides et al. 2012). Strategi-strategi ini tercakup dalam
konsep Pengendalian Hama Terpadu (PHT). Dalam kasus H. hampei program
PHT telah didefinisikan sebagai penggunaan seri tindakan pengendalian untuk
mengurangi populasi H. hampei ke tingkat di bawah ambang kerusakan ekonomis
sehingga produksi kopi petani dapat diekspor secara kompetitif (Benavides et al.
2012).
Pengendalian secara kultur teknis dilakukan terutama bertujuan untuk
memutus daur hidup H. hampei. Teknik yang dilakukan antara lain melakukan
petik bubuk, lelesan dan racutan. Petik bubuk adalah panen awal untuk memetik
buah kopi yang terserang. Lelesan adalah mengambil semua buah yang jatuh di
tanah agar tidak menjadi sumber hama. Racutan adalah memanen semua buah
kopi yang masih ada di pohon meskipun masih hijau dan belum masak sampai
akhir panen (Rahardjo, 2013).
Komponen kultur teknis lain antara lain penyiangan, pemupukan,
pemangkasan produksi dan sanitasi bagian tanaman yang tidak produktif serta
pengolahan tanah ringan dapat mempertahankan lengas tanah lebih tinggi
sehingga dapat meningkatkan pertumbuhan tanaman. Salah satu manfaat
pemangkasan adalah mempermudah masuknya cahaya, mengurangi serangan
hama dan penyakit tanaman serta mempermudah pengendalian hama dan penyakit
(Rosmahani et al. 2005; Prastowo et al. 2010).
Pengutipan buah secara manual digabung dengan sanitasi buah yang jatuh
ke tanah sangat efektif di Kolombia untuk mengendalikan H. hampei, namun
biaya tenaga kerja sangat mahal. Mengingat tingginya biaya pengutipan
buah-buah yang jatuh di atas tanah maka diperlukan metode alternatif seperti
penggunaan nematoda entomopatogen untuk mengendalikan H. hampei yang
terdapat di dalam buah-buah yang jatuh di atas tanah (Manton et al. 2012).
Banyak musuh alami dari H. hampei yang telah dilaporkan seperti
parasitoid, predator dan patogen (nematoda dan jamur). Penyemprotan jamur
entomopatogen Beauveria bassiana telah lama diketahui dapat mengendalikan
serangan H. hampei (Damon, 2000; Benavides et al. 2012).
Parasitoid pertama yang dilaporkan dalam literatur adalah Prorops
nasuta. P. nasuta dapat diproduksi secara massal dengan menggunakan buah kopi
yang terinfestasi H. hampei. Parasitoid lain adalah Cephalonomia stephanoderis
yang merupakan ektoparasitoid larva dan pupa H. hampei. C. stephanoderis dapat
menyebabkan tingkat parasitisme mendekati 50% (Vega et al. 2009; Burbano et
2. Nematoda Entomopatogen
2.2.1. Nematoda Entomopatogen Steinernematidae
Nematoda entomopatogen dari keluarga Steinernematidae digunakan
sebagai agens hayati terhadap serangga di bidang pertanian. Nematoda
entomopatogen ini dianggap berpotensi sebagai agens hayati karena
patogenisitasnya (Muthulakshmi et al. 2012).
Steinernema spp. adalah jenis nematoda entomopatogen yang banyak
digunakan sebagai agens hayati hama. Steinernema jantan mempunyai panjang
tubuh 1.000-1.900 μm, lebar 90-200 μm, panjang stoma 4,5-7 μm, lebar stoma 4-5
μm, panjang ekor 19-27 μm, panjang spikula 72-89 μm, gubernakulum 57-70 μm,
panjang mucron 2,8-4,5 μm. Steinernema betina, panjang tubuh 3020-3972 μm,
lebar 153-192 μm, panjang stoma 7-12 μm, lebar stoma 5,0-8,5 μm, panjang ekor
30-47 μm, lebar vulva 49-54 μm. Stadia juvenil infektif memiliki panjang tubuh
500-570 μm, lebar 15-25 μm, panjang ekor 47-54 μm (Stock, 1993).
2.2.2. Potensi Nematoda sebagai Agens Hayati
Nematoda adalah sejenis cacing sederhana, tidak berwarna, tidak beruas,
dapat hidup bebas dan biasanya berukuran mikroskopis. Nematoda dapat
bertindak sebagai predator atau parasit. Namun ada juga nematoda yang
menguntungkan yang menyerang serangga hama dalam tanah, tidak merusak
tanaman, hewan maupun manusia sehingga dapat dimanfaatkan sebagai agens
hayati disebut dengan nematoda entomopatogen.
Nematoda entompatogen (NEP) pertama kali ditemukan oleh Gotthold
Steiner di Jerman pada tahun 1923 yang diberi nama Steinernema kraussei.
menginfeksi kumbang Jepang Papillia japonica di New Jersey, sehingga
steinernema tersebut diberi nama S. glaseri. Glaser pulalah yang pertama berhasil
membiakkan secara axenic (tanpa bakteri simbion). Nematoda entomopatogen
telah dirilis secara luas, tidak mempunyai efek negatif pada serangga nontarget
dan dianggap sangat aman untuk lingkungan (Miles et al. 2012).
Seperti halnya agens hayati lainnya yaitu golongan jamur, bakteri dan
virus, nematoda entomopatogen memiliki potensi besar untuk dimanfaatkan
sebagai insektisida hayati karena sangat aktif mencari serangga inang sasaran
sehingga dapat digunakan untuk mengendalikan hama-hama yang berada di dalam
jaringan tanaman. Di Indonesia, pemanfaatan nematoda entomopatogen dalam
mengendalikan berbagai jenis hama yang menyerang kuncup bunga, biji, bunga,
buah, daun maupun hama yang hidup di dalam tanah telah banyak diteliti dan
dikembangkan khususnya untuk komoditi pangan dan hortikultura. Potensi ini
tentunya dapat dimanfaatkan untuk mengendalikan hama-hama yang menyerang
tanaman-tanaman perkebunan. Di samping itu pemanfaatan nematoda
entomopatogen untuk mengendalikan hama tanaman dapat mengurangi dampak
negatif dari penggunaan pestisida sintetik, karena bersifat spesifik menyerang
serangga-serangga yang menjadi hama tanaman (Nugrohorini, 2012).
Menurut Koppenhöfer (2007) nematoda entomopatogen dapat digunakan
untuk mengendalikan berbagai jenis serangga dari beberapa ordo antara lain
Coleoptera, Diptera, Lepidoptera, Orthoptera, Blattodea dan Siphonaptera.
Kelompok serangga ordo Coleoptera yaitu dari famili Curculionidae,
Chrysomelidae dan Scarabaeidae. Kelompok Diptera yaitu dari famili
Orthoptera yaitu dari famili Gryllotalpidae dan kelompok Blattodea dari famili
Blattellidae.
Salah satu famili nematoda entomopatogen yang berpotensi tinggi sebagai
agens hayati yaitu dari famili Steinernematidae. Nematoda ini membunuh
serangga dengan bantuan bakteri yang dibawa dalam saluran pencernaannya
(Xenorhabdus berasosiasi dengan genus Steinernema spp. (Boemare, 2002 dalam
Nugrohorini, 2012; Muthulakshmi et al. 2012). Sampai sekarang telah
diidentifikasi 33 spesies dari genus Steinernema (Koppenhofer & Fuzi, 2003;
Peters, 1996 dalam Nugrohorini, 2012).
Telah banyak dilaporkan mengenai keberhasilan penggunaan nematoda
entomopatogen jenis Steinernema spp. Di Eropa dan Amerika Serikat, S. feltiae
atau S. carpocapsae berhasil mengendalikan serangga hama Otiorhynchus
sulcatus pada strawberry. Di Indonesia, Steinernema spp. dapat mengendalikan
hama Hypothenemus hampei (83%), Crocidolomia binotalis (77%) dan
Spodoptera litura (87%) (Sulistyanto, 1999). Di Sulawesi Tengah penggunaan
nematoda dengan konsentrasi 600 ji/2 ml air efektif mematikan 83,4% ulat
bawang S. exigua dalam waktu 6 hari (Kamariah et al. 2013).
Manton et al. (2012) melaporkan bahwa aplikasi 2500 ji/ml
S. carpocapsae di dalam cawan petri berdiameter 10 cm mampu mematikan 100%
larva dan 45% kumbang H. hampei dalam 3 (tiga) hari. Serangga yang mati
kemudian diletakkan dalam white trap dan diamati setelah 6-7 hari untuk
mengetahui populasi nematoda yang terdapat didalamnya. Diperoleh populasi
nematoda dalam tubuh satu kumbang dan satu larva masing-masing berkisar 60
menunjukkan bahwa S. carpocapsae memiliki potensi mengendalikan H. hampei.
Suspensi Steinernema sp. konsentrasi 4.600 ji/ml yang disemprotkan pada
kontainer seluas 133 cm2 dengan kelembaban relatif 70% dan suhu 200C selama 8
hari menyebabkan rerata mortalitas larva dan imago sebesar 23,7 dan 26,6%
dengan konsentrasi 4.600 ji.ml. Aplikasi Steinernema terhadap buah kopi
terinfestasi H. hampei di kebun kopi selama 7 hari menghasilkan rerata mortalitas
17,1 dan 4,7% untuk masing-masing larva dan imago. Seluruh stadium dapat
dikendalikan oleh nematoda ini dengan mortalitas tertinggi adalah pada stadium
larva.
Hasil pengujian Jaramillo et al. (2013) menunjukkan nilai LD50 lalat bibit
Delia platura pada tanaman bayam di Bogota sebesar 1.514 ji/larva. Adiroubane
et al. (2010) menguji beberapa konsentrasi nematoda S. siamkayai terhadap larva
S. litura. Diketahui bahwa tidak ada kematian larva S. litura pada 12 jam setelah
aplikasi bahkan pada dosis tertinggi sekalipun yaitu 50 ji/larva. Nilai LD50 pada
24, 36 dan 48 jam setelah aplikasi ji nematoda S. siamkayai terhadap larva instar 3
S. litura sebesar 49,76, 34,59 dan 22,93 ji/larva. Nilai LD50 yang dicobakan
menurun seiring waktu aplikasi yang meningkat. Pada dosis terendah (10 ji/larva)
nilai LT50 sangat tinggi selain itu LT50 akan menurun dan kerentanan larva
meningkat seiring dosis yang meningkat. Diperoleh nilai LT50 untuk instar 3 larva
S. litura pada dosis 10, 20, 30, 40 dan 50 ji/larva masing-masing 71,64, 53,64,
43,78, 33,55 dan 26,11 jam. Sedangkan nilai LT50 larva instar 3, 5 dan prapupa
pada dosis 50 ji/serangga uji adalah 26,11, 25,48 dan 13,20 jam. Selain itu
dinyatakan pula bahwa nilai LT50 lebih tinggi dan kerentanan S. litura terhadap S.
melaporkan bahwa mortalitas maksimum yang disebabkan oleh nematoda S.
carpocapsae terhadap larva P. xylostella adalah 88% pada 24 jam dan suhu 250C
kemudian meningkat menjadi 100% pada 48 dan 72 jam. Meningkatnya tingkat
populasi nematoda dan waktu pemaparan (dalam jam) akan meningkatkan
mortalitas larva P. xylostella.
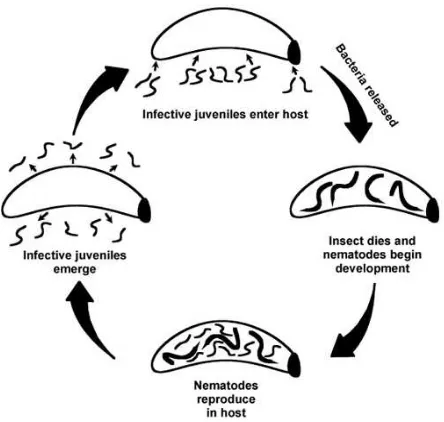
2.2.3. Siklus Hidup Nematoda Entomopatogen
Siklus hidup sebagian besar nematoda meliputi stadia telur, 4 (empat)
tahap juvenil dan stadia dewasa (Gambar 2). Nematoda mengalami perkembangan
dari telur, juvenil, kemudian menjadi dewasa. Pada umumnya mengalami empat
kali pergantian kulit sebelum dewasa. Pergantian kulit terjadi di dalam telur, di
lingkungan luar, dan di dalam tubuh serangga inangnya. Juvenil ketiga merupakan
juvenil infektif atau “dauer” yang merupakan satu-satunya stadia yang hidup
bebas. Juvenil infektif mampu bertahan di dalam tanah di tempatnya menyerang
dan menginfeksi serangga hama sasarannya (Poinar, 1990). Dalam kondisi yang
optimal, Steinernematidae membutuhkan 3-7 hari untuk menyelesaikan satu
siklus hidup dalam inangnya dari telur menjadi telur kembali. Lamanya infeksi
Steinernematidae hingga juvenil keluar dari inangnya membutuhkan waktu sekitar
Gambar 2. Diagram siklus hidup nematoda entomopatogen secara umum (gambar oleh David Shapiro-Ilan) Sumber : Miles et al. (2012)
2.2.4. Mekanisme Infeksi Nematoda Entomopatogen
Efektivitas Steinernema sp. dalam pengendalian hama berbeda tergantung
patogenitasnya, sedangkan patogenitas dipengaruhi oleh mekanisme infeksi.
Infeksi Steinernema sp. dilakukan oleh stadium larva instar III atau juvenil
infektif III (Ji III) yang masuk melalui mulut, anus, spirakel atau penetrasi
langsung melalui membran intersegmental integumen yang lunak. Setelah berada
di dalam haemocoel serangga, bakteri simbion yang dibawa akan dilepaskan ke
dalam hemolimfa untuk berkembangbiak dan memproduksi toksin yang
mematikan (Nugrohorini, 2012).
Umumnya, beberapa nematoda akan menginfeksi satu serangga inang.
Juvenil infektif menembus tubuh rongga serangga, biasanya melalui lubang tubuh
alami termasuk mulut, anus, atau lubang pernapasan (spirakel). Sekali berada di
dalam rongga tubuh dari inangnya, juvenil infektif melepaskan bakteri yang
hidup bersimbiosis dalam usus nematoda. Hubungan nematoda-bakteri sangat
dan hanya bakteri Photorhabdus yang dapat hidup dengan Heterorhabditidae.
Bakteri tidak akan dapat masuk ke dalam tubuh serangga tanpa bantuan nematoda
entomopatogen yang mempenetrasi tubuh serangga inang. Interaksi antara bakteri
simbion dan nematoda entomopatogen tidak dapat dipisahkan dan merupakan
syarat mutlak antara keduanya (Sulistyanto, 1999).
Hubungan nematoda dengan bakteri simbionnya memberikan beberapa
keuntungan yaitu dapat membunuh inang dengan cepat secara septicemia,
menyediakan nutrisi yang cocok, membuat lingkungan yang cocok bagi
perkembangan dan reproduksi nematoda. Bakteri simbion juga mampu
memproduksi senyawa antibiotik (bakteriosin) yang dapat menghambat
perkembangan mikroorganisme sekunder yang ada dalam tubuh serangga inang.
Sedangkan fungsi nematoda entomopatogen bagi bakteri adalah melindungi
bakteri dari kondisi ekstrim dalam tanah dan melindungi bakteri dari
kemungkinan adanya protein anti bakteri yang dikeluarkan oleh serangga inang.
Sekali dilepaskan ke inang, bakteri berkembang biak dengan cepat dan
menyiapkan kondisi yang optimal untuk pertumbuhan dan reproduksi nematoda di
dalam serangga. Pada kondisi yang optimal dapat menyebabkan serangga inang
mati dalam waktu 24 hingga 48 jam (Kaya & Gaugler, 1993; Chaerani et al.;
2007; Miles et al. 2012).
Nematoda makan dari bakteri yang dilepaskannya dalam jaringan
inangnya. Setelah beberapa hari di dalam inangnya, nematoda berubah ke tahap
dewasa. Nematoda dewasa ini menghasilkan ratusan ribu juvenil baru. Keturunan
ini mungkin mengalami beberapa siklus hidup dalam satu inang. Ketika inang
yang muncul dari kutikula inangya, pindah ke tanah, dan memulai mencari inang
baru. Sebuah pelindung kutikula terluar mengelilingi juvenil infektif,
melindunginya dari lingkungan dan dari predator. Dengan kondisi yang ideal,
Steinernema muncul 6-11 hari setelah infeksi awal dan Heterorhabditis muncul
12-14 hari setelah infeksi awal (Kaya & Koppenhöfer, 1999). Jangka waktu
hidup juvenil infektif dalam tanah belum diketahui. Sementara di tanah mereka
bisa menjadi mangsa invertebrata dan mikroorganisme (Miles et al. 2012).
Hanya nematoda dalam tahap juvenil infektif akan bertahan hidup di
dalam tanah dan akan menemukan dan menembus serangga hama. Juvenil infektif
nematoda entomopatogen mencari inang mereka di tanah melalui dua strategi
(foraging behaviour) yaitu "menyerang" (hunter) dan "menjelajah" (ambusher).
Strategi ambusher memiliki perilaku diam dan menunggu sampai inang berada di
dekatnya dan kemudian baru menyerang. Contoh nematoda entomopatogen yang
memiliki perilaku ambusher adalah Steinernema carpocapsae dan S. scapterisici.
Strategi menjelajah mempunyai kecenderungan untuk menyebar di seluruh tanah
dalam mencari inang. Strategi ini adalah aktif mencari dan mengejar serangga
inang, strategi ini digunakan untuk menginvasi inang yang diam. Strategi ini
dikarakterisasikan dengan motilitas yang tinggi dan distribusi aktif ke seluruh
profil tanah, kemampuan untuk orientasi, dan penggantian lokasi pencarian
setelah kontak inang. Contoh nematoda yang memiliki perilaku ini adalah
Heterorhabditis bacteriophora, H. indicus, S. glaseri, dan S. riobravis.
Steinernema feltiae melakukan perpaduan dari kedua strategi tersebut (Campbell
Seluruh generasi Steinernematidae dihasilkan oleh jantan dan betina
(gonochorisism) (Kaya & Gaugler, 1993). Larva serangga akan menjadi coklat tua
kemerahan jika terinfeksi oleh Heterorhabditis dan berwarna coklat muda jika
terinfeksi oleh Steinernema. Warna tubuh serangga ini mengindikasikan warna
yang dihasilkan oleh bakteri mutualistik yang berada di dalam tubuh inangnya
(Kaya & Gaugler, 1993; Chaerani et al. 2007).
Umumnya, potensi nematoda entomopatogen sebagai agens hayati dinilai
dari kematian inangnya. Efikasi nematoda sering diperkirakan dengan LC50.
Efisiensi invasi nematoda yaitu persentase juvenil infektif yang menyerang dan
menetap di tubuh inangnya telah diusulkan sebagai alternatif untuk LC50 sebagai
ukuran keberhasilan nematoda. Epsky & Capinera (1994) menguji S. carpocapsae
strain Meksiko terhadap larva instar terakhir Spodoptera frugiperda dan diperoleh
nilai LC50 4-91 ji per larva. Persentase invasi berkisar 1-28% untuk infeksi
tunggal (satu larva) dan 11-31% per 6 larva pada konsentrasi 10-100 ji. Diketahui
bahwa tidak ada strain nematoda atau inang yang memiliki pola nyata dalam
efisiensi invasi dan tidak ada hubungan antara dugaan nilai LC50 dan efisiensi
invasi.
Caroli et al. (1996) telah menguji tingkat penetrasi (persentase inokulum ji
awal yang menyerang serangga uji) sebagai indikator infektifitas nematoda
entomopatogen. Beberapa kombinasi inang-parasit-substrat dievaluasi untuk
tingkat penetrasi. Empat strain Steinernema yaitu Steinernema carpocapsae, S.
glaseri, S. feltiae, S. riobravis dan dua strain Heterorhabditis bacteriophora diuji
dalam suatu bioassay kontak terhadap beberapa serangga diantaranya Spodoptera
uji dan peringkat nematoda untuk infektifitas berbeda sesuai dengan serangga
yang diuji. Hal ini menghasilkan tingkat penetrasi yang berbeda antara strain
nematoda. Persentase nematoda yang masuk pada S. exigua yang diinokulasi
S. carpocapsae dengan konsentrasi 200 ji/ml mencapai 20%.
Infektifitas nematoda sebagai ukuran dari mortalitas serangga bervariasi
menurut spesies dan subspesies serangga maupun strain nematoda dipengaruhi
oleh faktor abiotik terutama suhu. Suhu mempengaruhi mobilitas nematoda,
reproduksi dan perkembangannya Infeksi, reproduksi dan perkembangan S.
carpocapsae yang diaplikasikan ke larva Galleria mellonella terjadi lebih cepat
pada suhu 20-240C. S. carpocapsae menginvasi dan mematikan larva G.
mellonella lebih cepat pada suhu antara 8 dan 160C (Saunders & Webster, 1999).
Oguzoglu & Ozer (2007) melaporkan bahwa S. feltiae memiliki suhu optimum
pada 250C dalam menginfeksi larva G. mellonella. Waktu kontak yang lebih lama
juga menghasilkan efisiensi infeksi yang lebih tinggi. Mortalitas larva uji
mencapai 94% setelah 90 jam kontak, 86% setelah 72 jam dan 68% setelah 48
jam. Penggunaan wadah kontak antara nematoda dan inangnya yaitu cawan petri
yang lebih kecil juga meningkatkan efisiensi invasi.
Menurut Sims et al. (1992) infektifitas nematoda dapat dipengaruhi oleh
beberapa parameter biologi meliputi: perilaku nematoda, tingkat aktivitas,
kemampuan menemukan inang, dan kemampuan mempenetrasi inang. Hal lain
yang mungkin mempengaruhi infektifitas nematoda adalah jumlah bakteri per