PERCOBAAN IV
Judul Percobaan : KURVA TITRASI
Tujuan : Membuat kurva titrasi dari berbagai macam larutan
Hari / tanggal : Senin / 11 November 2008.
Tempat : Laboratorium Kimia PMIPA FKIP Unlam Banjarmasin.
I. DASAR TEORI
Konsentrasi ion H+ dan konsentrasi ion OH- dalam air, larutan asam atau basa merupakan bilangan yang sangat kecil. Oleh sebab itu seorang ahli kimia yang bernama Sorensen menggunakan suatu konsep yang disebut konsep pH (“p” berarti potensial dan “H” adalah simbol untuk hidrogen). pH didefinisikan secara matematika sebagai berikut :
pH = - log [H+] (aq)
Unsur air murni yang tidak asam dan tidak basa yaitu netral maka : H+
(aq) = 10-7 dan
pH = - log 10-7
= 7
Kalau larutan bersifat asam maka harga pH lebih kecil dari pada 7. kalau larutan itu mengandung zat yang bersifat basa, misalnya NaOH, maka harga pH lebih besar dari pada 7.
Selama proses titrasi pH larutan berubah perlahan-lahan, tetapi di daerah titik kesetaraan perubahan pH sangat besar. Itulah sebabnya sajian grafik volume penitran terhadap pH sangat penting. Sajian grafik itu disebut kurva titrasi.
Konsentrasi ion H+ dan konsentrasi ion OH- dalam air, larutan asam atau basa merupakan bilangan yang sangat kecil. Oleh karena itu seorang ahli kimia bernama Sorensen menggunakan suatu konsep yang disebut konsep pH (“P” berarti potensial dan “H” berarti hidrogen).
6 0
dapat dikalibrasikan dengan suatu larutan yang pH nya telah diketahui. Suatu alat yang didasarkan pada kondisi tersebut dinamakan pH meter.
pH meter adalah suatu rangkaian alat elektronik yang dilengkapi suatu elektroda kaca. Bila elektroda kaca ini dimasukkan ke dalam larutan akan timbul beda potensial yang dakibatkan oleh adanya ion H+ dalam larutan dalam jumlah yang besar. Ini ditunjukkan dengan angka yang menyatakan pH larutan tersebut alat ini mengukur berdasarkan perbedaan relatif konsentrasi ion H+. Untuk menggunakan alat ini cukup mencelupkan elektrodanya ke dalam larutan yang diukur, dan secara otomatis jarum penunjuk atau angka digital akan menunjukkan harga pH yang diukur. pH meter dapat digunakan untuk mengikuti titrasi asam basa.
Titrasi asam basa merupakan cara yang cepat dan mudah untuk menentukan jumlah senyawa-senyawa yang bersifat asam dan basa.
Asam Netral Basa
Trayek Perubahan Warna
Titrasi asam basa dapat dianggap sebagai interaksi pasangan asam-basa berpasangan menurut teori Bronsted-Lowry, yaitu:
Asam1 + Basa2 Basa1 + Asam2
Bila titrasi dilakukan dalam pelarut air, maka perpindahan proton dinyatakan melalui molekul air. Akibatnya persamaan umum untuk titrasi asam-basa dalam pelarut air ditulis sebagai persamaan reaksi antara ion hidronium dan ion hidroksida yakni:
H3O+ + OH- H2O + H2O
Titrasi Asam Kuat dengan Basa Kuat
Asam kuat dan basa kuat mengalami reaksi alih proton yang sempurna dengan air, yang menyebabkan terbentuknya ion hidronium dan ion hidroksida.
Asam + H2O → Basa + H3O+ Basa + H2O → Asam + OH
-Oleh karena itu, titrasi asam kuat dengan basa kuat dapat disingkat menjadi reaksi antara ion hidronium dan ion hidroksida sebagai berikut:
Created By: Ummu hani
H3O+ + OH- → H2O + H2O
Jalannya titrasi secara teoritis dihitung dari persamaan kesetimbangan massa dan tetapan kesetimbangan. Caranya akan dilukiskan dengan membuat kurva teoritis.
Harga pH sebelum mulai titrasi pH = -log [HCl]
Harga pH sebelum titik ekivalen pH = -log [HCl]sisa Harga pH pada saat titik ekivalen pH = ½ pKw = 7
Harga pH sesudah titik ekivalen pH = pKw + log [NaOH]sisa
Titrasi Asam Lemah dengan Basa Kuat
Titrasi asam lemah lebih sulit dan lebih rumit dari pada titrasi asam kuat dengan basa kuat. Daerah kesetaraannya lebih sempit, sehingga persyaratan titrasi hanya dapat dilihat secara tepat dari kurva teoritis:
Harga pH sebelum mulai titrasi pH = - log (Ka.[HA]1/2
Harga pH sebelum ekivalen
pH = pKa + log Asam G
Harga pH sesudah ekivalen
pH = pKw + log [NaOH]sisa
Titrasi asam-basa poliprotik
Bila ada dua pasang atau lebih asam-basa berpasangan, maka perhitungan konsentrasi akan makin sulit.
6 0
poliprotik dibuat dengan mendempetkan kurva-kurva titrasi masing-masing pasangan asam basa tersebut. Untuk H3PO4, pasangan-pasangan asam-basa yang akan diperhitungkan adalah H3PO4/ H2PO4-, H2PO4-/ HPO42-, H3PO42-/PO43-. Titrasi H3PO4 dengan larutan baku NaOH berlangsung menurut persamaan reaksi berikut:
H3PO4 + OH- H2PO4- + H2O pKa1 = 2,1 H2PO4- + OH- HPO42- + H2O pKa1 = 7,2 HPO42- + OH- PO43- + H2O pKa1 = 12,4
Membuat kurva titrasi ini banyak manfaatnya, karena pada satu pihak kurva itu mudah dibuat, dan pada pihak lain banyak simpulan penting dapat ditarik dari kurva ini. Ketelitian penentuan dapat dinilai, indikator yang sesuai dapat dipilih dan persyaratan lain dapat dipilih sehingga diperoleh proses titrasi yang sempurna.
II. ALAT DAN BAHAN
Created By: Ummu hani
pH
Alat – alat yang digunakan yaitu :
- pH meter 1 buah
- Pengaduk 1 buah
- Gelas kimia 50 ml 1 buah
- Pipet tetes 1 buah
- Standar besi 1 buah
- Elektroda 1 buah
- Gelas ukur 10 mL 1 buah
Bahan - bahan yang digunakan yaitu : - HCl 0,1 M
- CH3COOH 0,1 M
- NaOH 0,1 M
III. PROSEDUR KERJA
1. Mencelupkan elektroda ke dalam 25 mL 0,1 M HCl, mengukur pH
larutan itu.
2. Menambahkan 5 mL NaOH sampai 20 mL. Apabila dekat dengan
titik akhir maka dengan penambahan sedikit NaOH, pH akan berubah secara cepat, jadi setelah penambahan 20 mL melakukan penambahan dengan 0,5 mL sampai jumlah penambahan mencapai 30 mL. Mengaduk sesudah setiap penambahan.
3. Mengulangi percobaan dengan 25 mL larutan asam asetat dengan penambahan 2 mL sampai 30 mL.
4. Sesudah dua percobaan, mencuci elektroda-elektroda dengan air dan menyimpan elektroda tersebut dengan mencelupkan ke dalam air.
6 0
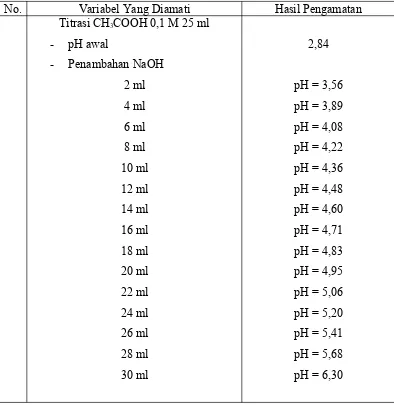
Tabel hasil titrasi asam lemah dengan basa kuat
No. Variabel Yang Diamati Hasil Pengamatan
Titrasi CH3COOH 0,1 M 25 ml
- pH awal
- Penambahan NaOH
2 ml 4 ml 6 ml 8 ml 10 ml 12 ml 14 ml 16 ml 18 ml 20 ml 22 ml 24 ml 26 ml 28 ml 30 ml
2,84
pH = 3,56 pH = 3,89 pH = 4,08 pH = 4,22 pH = 4,36 pH = 4,48 pH = 4,60 pH = 4,71 pH = 4,83 pH = 4,95 pH = 5,06 pH = 5,20 pH = 5,41 pH = 5,68 pH = 6,30
Tabel hasil titrasi asam kuat dengan basa kuat
6 0
Pada percobaan ini yaitu menitrasi larutan HCl dengan larutan standar NaOH. Jika larutan asam ditambahkan dengan larutan basa maka pH larutan akan naik. Titrasi asam basa ini dilakukan secara alkalimetri yaitu yang menjadi bahan titran adalah dari golongan basa (NaOH) yang merupakan basa kuat, yang ditambahkan setetes demi setetes ke dalam larutan HCl (asam kuat), penambahan secara bertahap dengan volume bervariasi dalam larutan HCl akan menunjukkan pH yang naik secara signifikan. Tujuan pada percobaan ini adalah untuk mengetahui perubahan pH larutan HCl setiap penambahan NaOH dengan volume yang bervariasi.
Penambahan NaOH akan memperbanyak konsentrasi ion OH- dalam
larutan, semakin banyak konsentrasi ion OH- maka semakin basa larutan ([OH-] >[H+]). pH larutan basa lebih dari 7, pH larutan asam kurang dari 7, larutan netral mempunyai pH = 7.
Pada kurva titrasi HCl dengan NaOH terlihat bahwa pada permulaan titrasi pH berubah secara perlahan – lahan, karena pelarutnya air yang bertindak sebagai molekul ikut serta dalam kesetimbangan dengan proton yang menunjukkan kerja penyangga oleh pasangan asam basa H3O+/H2O didaerah titik ekivalen pH berubah dengan tajam, sedikit penitran yang ditambahkan kedalam larutan ini menyebabkan peningkatan yang besar. Peningkatan pH yang sangat tajam terjadi pada penambahan 23,5 mL NaOH pH naik secara tajam yaitu yang awalnya 3,10 menjadi 10,07. Hal ini menunjukkan bahwa pada penambahan NaOH sebanyak 23,5 mL ini mulai tercapai titik ekivalen. Setelah titik ekivalen perubahan pH relatif kecil. Hal ini disebabkan oleh kerja penyangga yang berperan yaitu pasangan H2O/OH-.
Titik ekivalen berdasarkan perhitungan terjadi pada saat penambahan 25 mL NaOH 0,1 M karena pada saat ini mol HCl dan NaOH tepat habis bereaksi. Sedangkan pada titik sesudah ekivalen pH akan menjadi pH basa karena NaOH yang ditambahkan terus mengakibatkan ion OH- dalam larutan menjadi lebih banyak daripada ion H+. Sedangkan pada penambahan 23,5 mL titrasi belum mencapai titik ekivalen .ini berbeda
dengan hasil percobaan yang mana pada volume 23,5 mL mulai menunjukkan titik ekivalen. Hal ini mungkin terjadi karena konsentrasi dan volume larutan belum tepat dengan yang ditentukan.
Reaksi yang terjadi adalah:
HCl + NaOH NaCl + H2O
CH3COOH + NaOH
Pada percobaan ini merupakan titrasi antara asam lemah dengan basa kuat. CH3COOH merupakan asam lemah yang apabla dilarutkan dalam air akan mengalami disosiasi dengan pembentukan ion hidrogen sebagai satu – satunya ion positif. Reaksi ionisasi asam lemah dan basa kuat merupakan reaksi kesetimbangan dan tetapan kesetimbangan masing – masing disebut tetapan ionisasi asam (Ka). Harga Ka menyatakan ukuran kekuatan asam., makin kecil harga Ka makin sedikit jumlah yang terionisasi berarti asam semakin lemah dan sebaliknya. Karena CH3COOH hanya melepaskan satu atom H, maka CH3COOH akan memiliki satu titik ekivalen dan mempunyai satu nilai Ka.
Berdasarkan hasil pengamatan pH awal CH3COOH adalah 2,84 sedangkan pada perhitungan adalah 3. Pada perhitungan berdasarkan percobaan pH pada penambahan 30 mL NaOH hanya 6,30 sehingga titik ekivalen pada percobaan belum tercapai.
Pada kurva dapat dilihat bahwa pH berdasarkan perhitungan sangat berbeda dengan pH berdasarkan percobaan, pada perhitungan terdapat titik ekivalen dengan pH sebesar 9.
Reaksi yang terjadi adalah:
CH3COOH + NaOH CH3COONa + H2O
6 0
ditambahkan akan menghabiskan komponen larutan penyangga itu maka pHnya akan berubah drastis.
VI. KESIMPULAN
1. Titik ekivalen diperoleh pada saat asam dan basa habis bereaksi. 2. Titrasi antara asam kuat dan basa kuat mencapai ekivalen pada saat pH
= 7
3. Pada titrasi asam lemah dengan basa kuat ada satu titik ekivalen karena memiliki satu harga ka.
4. Pada titrasi asam lemah dan basa kuat akan terbentuk larutan buffer yang terjadi sebelum tercapai titik ekivalen.
VII. DAFTAR PUSTAKA
Purba, Michael. 2004. Kimia Untuk SMA Kelas XI. Jakarta:Erlangga. Rivai, Harrizul. 1995. Asas Pemeriksaan Kimia. Jakarta:UI-Press. S, Syukri. 1999. Kimia Dasar 2. Bandung : ITB.
Tim dosen praktikum kimia fisika. 2008. Petunjuk Praktikum Kimia Fisika. Banjarmasin:FKIP UNLAM. (tidak dipublikasikan)
LAMPIRAN
Created By: Ummu hani
Kurva Titrasi HCl 0,1 M dengan
Penambahan NaOH
0 2 4 6 8 10 12 14
0 10 20 30 40
Volume NaOH pH
PERHITUNGAN
Titrasi HCl 0,1 M dengan NaOH 0,1 M
Kurva Titrasi CH
3COOH 0,1 M dengan
Penambahan NaOH
0 2 4 6 8 10 12 14
0 10 20 30 40
Volume NaOH pH
6 0
Diketahui: Volume HCl = 25 mL [HCl] = 0,1 M [NaOH] = 0,1 M
Ditanya : pH awal dan pH penambahan NaOH …? Jawab :
a. pH awal
pH awal = -log [HCl] pH = - log 0,1 = 1 b. pH sebelum titik ekivalen
1. Penambahan 5 mL NaOH 0,1 M
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) Mula-mula : 2,5 mmol 0,5 mmol
Bereaksi : 0,5 mmol 0,5 mmol 0,5 mmol 0,5 mmol
Setimbang : 2,0 mmol - 0,5 mmol 0,5 mmol
[H+] = [HCl]sisa = x M
mL
mmol 6,66 10 2
30 0 ,
2
pH = -log [H+] = -log 6,66 x 10-2 pH = 2-log 6,66 = 2-0,823 = 1,177 2. Penambahan 10 mL NaOH 0,1 M
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) Mula-mula : 2,5 mmol 1,0 mmol
Bereaksi : 1,0 mmol 1,0 mmol 1,0 mmol 1,0 mmol
Setimbang : 1,5 mmol - 1,0 mmol 1,0 mmol
[H+] = [HCl]sisa = x M
mL
mmol 4,28 10 2
35 5 ,
1
pH = -log [H+] = -log 4,28 x 10-2 pH = 2-log 4,28 = 2-0,63 = 1,37
3. Penambahan 15 mL NaOH 0,1 M
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) Mula-mula : 2,5 mmol 1,5 mmol
Bereaksi : 1,5 mmol 1,5 mmol 1,5 mmol 1,5 mmol
Setimbang : 0,45 mmol - 2,05 mmol 2,05 mmol
6 0
Setimbang : 0,35 mmol - 2,15 mmol 2,15 mmol
[H+] = [HCl]sisa = x M
Setimbang : 0,25 mmol - 2,25 mmol 2,25 mmol
[H+] = [HCl]sisa = x M
11. Penambahan 23,5 mL NaOH 0,1 M
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) Mula-mula : 2,5 mmol 2,35 mmol
Bereaksi : 2,35 mmol 2,35 mmol 2,35 mmol 2,35 mmol
Setimbang : 0,15 mmol - 2,35 mmol 2,35 mmol
6 0
pH = -log [H+] = -log 2,04 x 10-3 pH = 3-log 2,04 = 3-0,3 = 2,7
13. Penambahan 24,5 mL NaOH 0,1 M
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) Mula-mula : 2,5 mmol 2,45 mmol
Bereaksi : 2,45 mmol 2,45 mmol 2,45 mmol 2,45 mmol
Setimbang : 0,05 mmol - 2,45 mmol 2,45 mmol
[H+] = [HCl]sisa = x M
mL
mmol 1 10 3
5 , 49
05 ,
0
pH = -log [H+] = -log 1x 10-3 pH = 3-log 1= 3-0 = 3
c. pH pada saat titik ekivalen pada penambahan 25 mL NaOH 0,1 M
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) Mula-mula : 2,5 mmol 2,5 mmol
Bereaksi : 2, 5 mmol 2,5 mmol 2,5 mmol 2,5 mmol
Setimbang : - - 2,5 mmol 2,5 mmol
Pada saat titik ekivalen pada titrasi asam kuat dengan basa kuat pH = ½ pKw = 7
d. pH sesudah ekivalen
1. Penambahan 25,5 mL NaOH 0,1 M
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) Mula-mula : 2,5 mmol 2,55 mmol
Bereaksi : 2,5 mmol 2,50 mmol 2,5 mmol 2,5 mmol
Setimbang : - 0,05 mmol 2,5 mmol 2,5 mmol
[OH-] = [NaOH]sisa = x M
mL
mmol 9,9 10 4
5 , 50
05 ,
0
pOH = -log [OH-] = -log 9,9 x 10-4 pOH = 4-log 9,9 = 4-0,99 = 3,01 pH = 14 – pOH = 14 – 3,01 = 10,99
2. Penambahan 26 mL NaOH 0,1 M
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) Mula-mula : 2,5 mmol 2,60 mmol
Bereaksi : 2,5 mmol 2,50 mmol 2,5 mmol 2,5 mmol
Setimbang : - 0,1 mmol 2,5 mmol 2,5 mmol
[OH-] = [NaOH]sisa = x M
mL
mmol 1,96 10 3
51 1 ,
0
pOH = -log [OH-] = -log 1,96 x 10-3 pOH = 3-log 1,96 = 3-0,29 =2,71 pH = 14 – pOH = 14 – 2,71 = 11,29
3. Penambahan 26,5 mL NaOH 0,1 M
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) Mula-mula : 2,5 mmol 2,65 mmol
Bereaksi : 2,5 mmol 2,50 mmol 2,5 mmol 2,5 mmol
Setimbang : - 0,15 mmol 2,5 mmol 2,5 mmol
[OH-] = [NaOH]sisa =
pOH = -log [OH-] = -log 2,9 x 10-3 pOH = 3-log 2,9 = 3-0,46 =2,54 pH = 14 – pOH = 14 – 2,54 = 11,46
4. Penambahan 27 mL NaOH 0,1 M
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) Mula-mula : 2,5 mmol 2,70 mmol
Bereaksi : 2,5 mmol 2,50 mmol 2,5 mmol 2,5 mmol
6 0
10. Penambahan 30 mL NaOH 0,1 M
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) Mula-mula : 2,5 mmol 3,0 mmol
Bereaksi : 2,5 mmol 3,0 mmol 2,5 mmol 2,5 mmol
Setimbang : - 0,5 mmol 2,5 mmol 2,5 mmol
[OH-] = [NaOH]sisa = x M
mL
mmol 3
10 09 , 9 55
5 ,
0
pOH = -log [OH-] = -log 9,09 x 10-3 pOH = 3-log 9,09 = 3-0,9 =2,04 pH = 14 – pOH = 14 – 2,04 = 11,96
Titrasi CH3COOH 0,1 M dengan NaOH 0,1 M
Diketahui: = [CH3COOH] = 0,1 M Ka CH3COOH = 10-5 V CH3COOH = 25 mL [NaOH] = 0,1 M
Ditanya : pH awal dan pH penambahan NaOH …?
Jawab :
a. pH awal
[H+] = 7,5 10 3 0,1
4
3PO x x
H x
Ka
= 10-3 M
pH = -log [H+] = -log 10-3 pH = 3
b. pH sebelum titik ekivalen
1. Penambahan 2 mL NaOH 0,1 M
CH3COOH(aq) + NaOH(aq) → CH3COONa (aq) + H2O(l) Mula-mula : 2,5 mmol 0,2 mmol
Bereaksi : 0,2 mmol 0,2 mmol 0,2 mmol 0,2 mmol
6 0
10. Penambahan 20 mL NaOH 0,1 M
CH3COOH(aq) + NaOH(aq) → CH3COONa (aq) + H2O(l)
11. Penambahan 22 mL NaOH 0,1 M
pH = -log 0,136 x 10-5 pH = 5 – log 0,136 = 5,87
12. Penambahan 24 mL NaOH 0,1 M
CH3COOH(aq) + NaOH(aq) → CH3COONa (aq) + H2O(l) Mula-mula : 2,5 mmol 2,4 mmol
Bereaksi : 2,4 mmol 2,4 mmol 2,4 mmol 2,4 mmol
Setimbang : 0,1 mmol - 2,4 mmol 2,4 mmol
[H+] =
mL mmol
mL mmol
x G
a Ka
49 4
, 2
49 1
, 0
10 5 , 7 3
[H+] = 4,17 x 10-7 M pH = -log 4,17 x 10-7 pH = 7 – log 4,17 = 6,38
c. pH pada saat titik ekivalen pada penambahan 25 mL NaOH 0,1 M
CH3COOH(aq) + NaOH(aq) → CH3COONa (aq) + H2O(l) Mula-mula : 2,5 mmol 2,5 mmol
Bereaksi : 2,5 mmol 2,5 mmol 2,5 mmol 2,5 mmol
Setimbang : - - 2,5 mmol 2,5 mmol
d. pH sesudah ekivalen
1. Penambahan 26 mL NaOH 0,1 M
CH3COOH(aq) + NaOH(aq) → CH3COONa (aq) + H2O(l) Mula-mula : 2,5 mmol 2,6 mmol
6 0
2. Penambahan 28 mL NaOH 0,1 M
CH3COOH(aq) + NaOH(aq) → CH3COONa (aq) + H2O(l)
3. Penambahan 30 mL NaOH 0,1 M
FLOWCHART PERCOBAAN IV
KURVA TITRASI
25 mL 0,1 M HCl
mencelupkan elektroda kedalamnya mengukur pH
menambahkan 5 mL NaOH sampai 20 mL mengaduk
Larutan HCl
menambahkan 0,5 mL sampai jumlah penambahan 30 mL NaOH 0,1 M mengaduk
mengukur pH setelah penambahan