I. Pendahuluan
Bagian pendahuluan tesis ini memberikan latar belakang pentingnya penelitian tentang deteksi virus Infectious Myonecrosis (IMNV) pada udang vaname (Litopenaeus vannamei). Ditegaskan dampak ekonomi signifikan dari penyakit IMNV terhadap industri perikanan Indonesia, khususnya budidaya udang. Pendahuluan juga menjelaskan masalah utama, yaitu keterbatasan metode deteksi dini IMNV yang akurat dan efisien, serta ketergantungan pada kit komersial yang mahal. Penelitian ini diposisikan sebagai solusi untuk mengatasi masalah tersebut dengan mengembangkan metode real time RT-PCR yang lebih terjangkau dan andal. Tujuan penelitian dijabarkan secara jelas, menekankan pengembangan qRT-PCR untuk deteksi dan kuantifikasi IMNV, karakterisasi molekuler isolat lokal, penentuan limit deteksi, dan kloning gen ORF1 sebagai kontrol positif. Manfaat penelitian dijelaskan sebagai kontribusi penting bagi pengembangan metode diagnostik yang efisien dan berkelanjutan, serta untuk pencegahan penyebaran penyakit IMNV.
1.1 Latar Belakang
Sub-bab ini memberikan konteks penelitian dengan memaparkan pentingnya industri perikanan, khususnya budidaya udang vaname di Indonesia. Dijelaskan dampak negatif penyakit IMNV terhadap produksi dan ekonomi, serta perlunya deteksi dini untuk pencegahan dan pengendalian penyakit. Sub-bab ini juga menyoroti keterbatasan metode diagnostik yang ada dan perlunya alternatif yang lebih efisien dan terjangkau, seperti pengembangan qRT-PCR. Ini memperkenalkan masalah dan kebutuhan penelitian dalam konteks yang lebih luas, sehingga pembaca dapat memahami urgensi penelitian ini.
1.2 Perumusan Masalah
Sub-bab ini mengidentifikasi permasalahan utama yang dihadapi dalam deteksi IMNV, yaitu keterbatasan metode deteksi dini yang akurat dan efisien, khususnya untuk mendeteksi infeksi subklinis. Dijelaskan kelemahan metode nested RT-PCR yang bersifat kualitatif dan ketergantungan pada kit komersial qRT-PCR yang mahal. Permasalahan ini dijabarkan dengan jelas untuk mengarahkan fokus penelitian pada pengembangan metode qRT-PCR alternatif yang lebih terjangkau dan memiliki sensitivitas tinggi, termasuk penyediaan kontrol positif yang terstandarisasi.
1.3 Tujuan Penelitian
Sub-bab ini menjabarkan tujuan penelitian secara spesifik dan terukur. Tujuan utama adalah pengembangan teknik qRT-PCR untuk deteksi dan kuantifikasi IMNV pada udang vaname. Tujuan khusus meliputi deteksi dan karakterisasi molekuler isolat IMNV lokal, penentuan limit deteksi metode qRT-PCR dan nested RT-PCR, aplikasi kedua metode tersebut pada sampel klinis dan subklinis, serta kloning gen ORF1 untuk menghasilkan kontrol positif. Tujuan-tujuan ini dirancang untuk menjawab permasalahan yang telah diidentifikasi sebelumnya.
1.4 Manfaat Penelitian
Sub-bab ini menjelaskan manfaat praktis dan akademis dari penelitian. Manfaat praktis meliputi pengembangan metode diagnostik yang lebih efisien, terjangkau, dan andal untuk mendeteksi IMNV, yang akan membantu dalam pencegahan dan pengendalian penyakit pada budidaya udang. Manfaat akademis meliputi kontribusi pada pemahaman karakteristik molekuler IMNV di Indonesia, serta pengembangan metode qRT-PCR yang dapat diaplikasikan secara luas. Ini menunjukkan nilai tambah penelitian baik dari sisi aplikatif maupun ilmiah.
1.5 Hipotesis Penelitian
Sub-bab ini mengemukakan hipotesis yang akan diuji dalam penelitian. Hipotesis pertama berkaitan dengan kekerabatan molekuler isolat IMNV lokal dengan isolat dari negara lain. Hipotesis kedua berkaitan dengan kemampuan qRT-PCR untuk mendeteksi IMNV pada udang vaname dengan infeksi subklinis. Hipotesis ini memberikan arah dan kerangka kerja untuk analisis data dan interpretasi hasil penelitian. Ini menunjukkan pendekatan ilmiah yang sistematis dalam penelitian.
II. Tinjauan Pustaka
Bagian tinjauan pustaka memberikan landasan teoritis untuk penelitian. Tinjauan ini mencakup aspek biologi udang vaname, karakteristik virus IMNV (struktur, genom, patogenesis), gejala klinis infeksi IMNV, epidemiologi dan transmisi virus, serta berbagai metode diagnostik yang telah ada, termasuk in situ hibridisasi, nested RT-PCR, dan real time RT-PCR. Bagian ini menyajikan pemahaman yang komprehensif tentang IMNV dan metode deteksinya, yang menunjukkan relevansi dan kontribusi penelitian ini terhadap perkembangan ilmu pengetahuan di bidang virologi perikanan.
2.1 Udang Vaname (Litopenaeus vannamei)
Sub-bab ini membahas aspek biologi udang vaname yang relevan dengan penelitian, termasuk morfologi, fisiologi, sistem imun, dan budidaya. Informasi ini penting untuk memahami konteks infeksi IMNV pada udang dan memilih strategi sampling yang tepat. Sub-bab ini menyediakan basis pengetahuan tentang inang yang menjadi target penelitian.
2.2 Infectious Myonecrosis
Sub-bab ini memberikan tinjauan lengkap tentang virus IMNV, meliputi sejarah penemuan, etiologi, struktur virus, susunan genom, gejala klinis infeksi, epidemiologi, dan transmisi virus. Ini memberikan dasar pemahaman tentang agen patogen yang menjadi fokus penelitian. Pembahasan yang mendalam tentang karakteristik IMNV sangat penting untuk memahami mekanisme infeksi dan pengembangan metode deteksi yang efektif.
2.3 Diagnosis IMNV dengan Teknik Molekuler
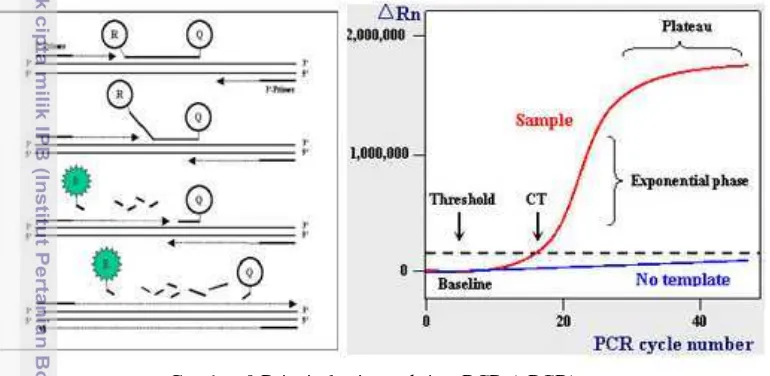
Sub-bab ini membahas berbagai metode diagnostik IMNV yang telah ada, khususnya metode molekuler seperti in situ hibridisasi, nested RT-PCR, dan real time RT-PCR. Dibandingkan kelebihan dan kekurangan masing-masing metode, dan dijelaskan mengapa real time RT-PCR dipilih sebagai metode utama dalam penelitian ini. Sub-bab ini menunjukkan landasan ilmiah untuk pemilihan metode yang digunakan dalam penelitian.
III. Metode
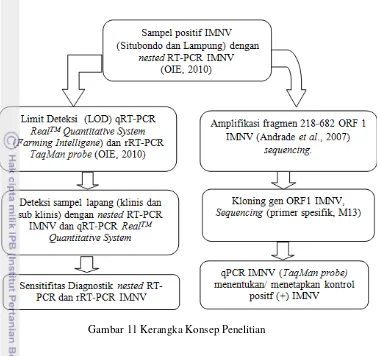
Bagian metode menjelaskan secara detail prosedur penelitian yang dilakukan, mulai dari pengambilan sampel, ekstraksi RNA, sintesis cDNA, karakterisasi molekuler (sekuensing), penentuan limit deteksi nested RT-PCR dan real time RT-PCR, analisis sensitivitas diagnostik, hingga kloning gen ORF1 IMNV. Dijelaskan secara rinci bahan, alat, dan prosedur yang digunakan, sehingga penelitian dapat direplikasi oleh peneliti lain. Ini memastikan transparansi dan validitas metodologi penelitian.
3.1 Bahan dan Alat
Sub-bab ini mencantumkan secara rinci semua bahan dan alat yang digunakan dalam penelitian, termasuk jenis dan spesifikasi bahan kimia, reagen, dan peralatan laboratorium yang diperlukan. Informasi ini penting untuk memastikan reproduksibilitas penelitian.
3.2 Prosedur Penelitian
Sub-bab ini menjelaskan secara langkah demi langkah prosedur penelitian yang dilakukan, mulai dari pengambilan sampel udang hingga analisis data. Penjelasan yang detail dan sistematis penting untuk memastikan kejelasan dan validitas metodologi.
3.3 Analisis Data
Sub-bab ini menjelaskan bagaimana data penelitian dianalisis, termasuk metode statistik yang digunakan. Penjelasan yang jelas dan rinci penting untuk memastikan keabsahan dan validitas hasil penelitian.
IV. Hasil dan Pembahasan
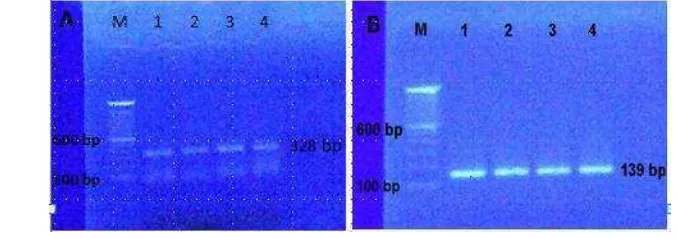
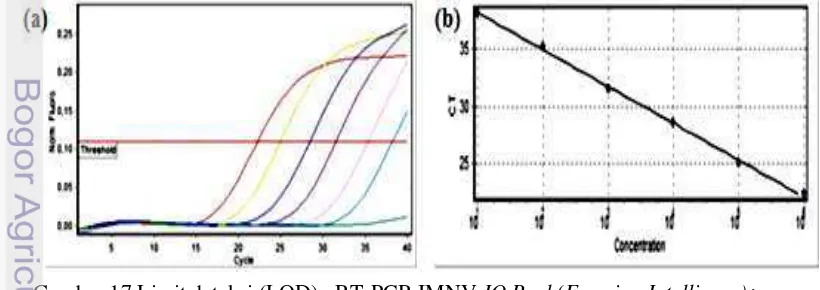
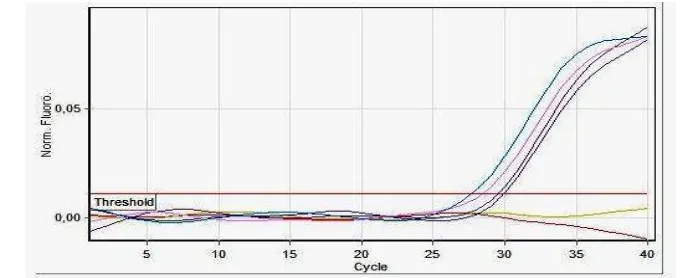
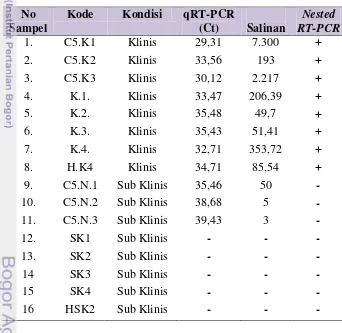
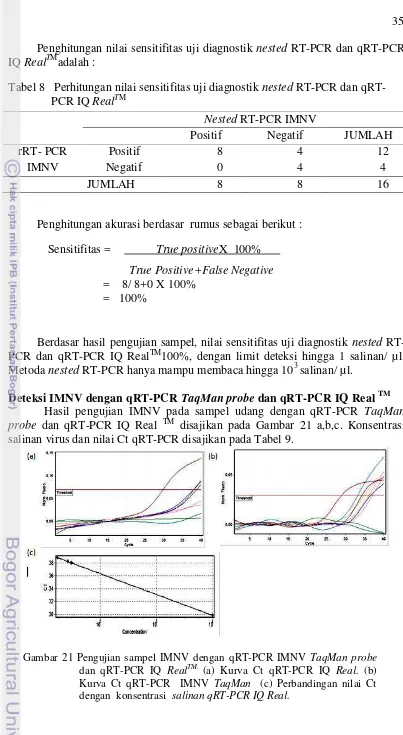
Bagian hasil dan pembahasan menyajikan temuan penelitian secara sistematis dan memberikan interpretasi yang mendalam terhadap hasil yang diperoleh. Hasil penelitian disajikan dalam bentuk tabel dan gambar, kemudian dibahas secara komprehensif, menghubungkannya dengan tinjauan pustaka dan tujuan penelitian. Pembahasan ini mencakup analisis kekerabatan molekuler isolat IMNV, limit deteksi metode qRT-PCR dan nested RT-PCR, sensitivitas diagnostik, dan keberhasilan kloning gen ORF1. Diskusi ini menunjukkan kemampuan peneliti dalam menganalisis data dan menarik kesimpulan yang bermakna.
4.1 Hasil
Sub-bab ini menyajikan hasil penelitian secara faktual, terstruktur, dan objektif, menggunakan tabel dan gambar yang relevan. Data mentah dan hasil analisis disajikan dengan jelas dan akurat untuk mendukung pembahasan lebih lanjut. Kejelasan penyajian data mentah sangat penting untuk mendukung argumen dan kesimpulan penelitian.
4.2 Pembahasan
Sub-bab ini memberikan interpretasi mendalam terhadap hasil penelitian yang telah disajikan sebelumnya. Pembahasan menghubungkan hasil dengan tujuan penelitian, tinjauan pustaka, dan hipotesis yang diajukan. Argumentasi yang logis dan didukung oleh bukti empiris penting untuk memastikan validitas kesimpulan penelitian. Penjelasan yang komprehensif dan kritis terhadap implikasi hasil penelitian sangat penting untuk menunjukkan kemampuan analisis dan sintesis peneliti.
V. Simpulan dan Saran
Bagian kesimpulan merangkum temuan utama penelitian dan menjawab pertanyaan penelitian yang diajukan. Kesimpulan yang ringkas, jelas, dan objektif penting untuk menyimpulkan hasil penelitian secara keseluruhan. Bagian saran memberikan rekomendasi untuk penelitian selanjutnya, berdasarkan temuan dan keterbatasan penelitian ini. Saran ini menunjukkan kesadaran peneliti akan keterbatasan penelitian dan arahan untuk penelitian selanjutnya.
5.1 Simpulan
Sub-bab ini memberikan ringkasan singkat dari temuan utama penelitian, menjawab pertanyaan penelitian, dan mendukung kesimpulan yang telah dibuat berdasarkan data dan analisis yang telah dilakukan sebelumnya.
5.2 Saran
Sub-bab ini memberikan beberapa saran untuk penelitian selanjutnya, berdasarkan temuan dan keterbatasan penelitian ini. Saran dapat berupa pengembangan metode yang lebih baik, perluasan cakupan penelitian, atau penelitian lanjutan untuk mengkaji aspek-aspek yang belum tercakup dalam penelitian ini.
VI. Daftar Pustaka
Bagian ini berisi daftar pustaka yang lengkap dan akurat, yang mengacu pada semua sumber yang dikutip dalam tesis. Daftar pustaka yang lengkap dan sesuai dengan pedoman penulisan ilmiah menunjukkan integritas akademik peneliti.
VII. Lampiran
Bagian lampiran berisi data pendukung yang relevan, seperti hasil sekuensing, gambar tambahan, dan data mentah. Lampiran ini memberikan informasi tambahan yang dapat digunakan untuk memverifikasi hasil penelitian.