PENGEMBANGAN
REAL TIME
RT-PCR DAN KARAKTERISASI
MOLEKULER UNTUK DETEKSI
INFECTIOUS MYONECROSIS
VIRUS
(IMNV)
PADA UDANG VANAME (
Litopenaeus vannamei
)
ZAKIYAH WIDOWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pengembangan Teknik real time RT-PCR dan Karakterisasi Molekuler untuk Deteksi Infectious Myonecrosis Virus (IMNV) pada Udang Vaname (Litopenaeus vannamei) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2013
Zakiyah Widowati
RINGKASAN
ZAKIYAH WIDOWATI. Pengembangan Teknik real time RT-PCR Dan Karakterisasi Molekuler Untuk Deteksi Infectious Myonecrosis Virus (IMNV) pada Udang Vaname (Litopenaeus vannamei). Dibimbing oleh SURACHMI SETIYANINGSIH dan FACHRIYAN H PASARIBU.
Infeksi myonecrosis pada udang vaname (Litopenaeus vannamei) oleh virus IMN berkontribusi pada penurunan total produksi udang di Indonesia pada kurun waktu enam tahun terakhir ini. Infeksi myonekrosis disebabkan oleh virus dari famili Totiviradae, berukuran 40 nm, merupakan virus dsRNA, memiliki 7560 nukleotida dengan pola infeksi bersifat kronis, persisten dan progresif. Deteksi dini IMNV pada budidaya udang vaname diperlukan untuk penanganan selanjutnya. Penelitian ini bertujuan untuk deteksi dan karakterisasi molekuler IMNV, dan deteksi IMNV pada udang dengan gejala klinis dan sub-klinis infeksi IMNV dengan real time RT-PCR. Sampel udang vaname diperoleh dari tambak di Situbondo dan Lampung selama bulan April - Oktober 2012. Gejala klinis infeksi myonecrosis pada sampel udang vaname berupa hilangnya transparansi pada jaringan otot dan nekrosis pada ruas abdomen ke-6. Gejala klinis tersebut mengindikasikan status klinis udang vaname pada tahap infeksi awal IMNV.
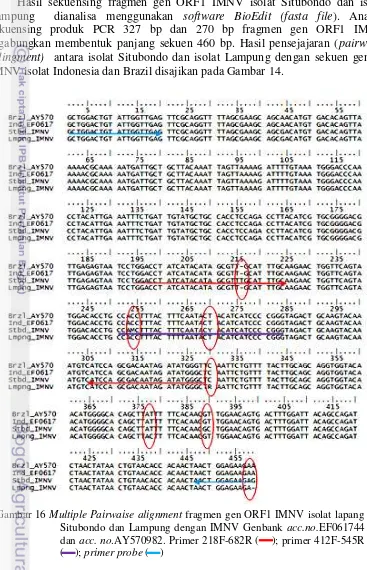
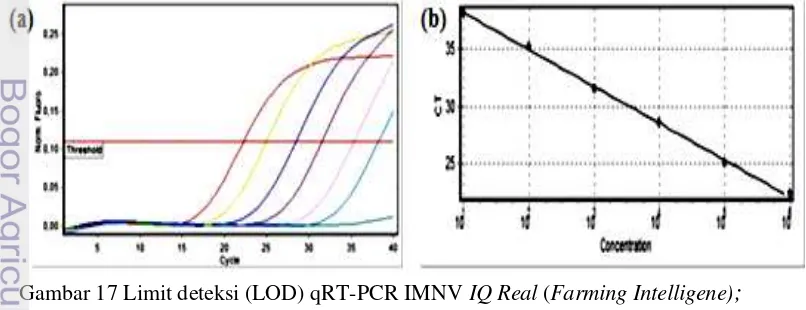
Karakteristik molekuler basa nukleotida fragmen gen ORF1 IMNV (fragmen 218-682) isolat lapang Situbondo dan isolat lapang Lampung menunjukkkan kemiripan 99% dengan genom IMNV isolat Indonesia (GenBank aksesi no EF061744) maupun IMNV isolat Brasil (GenBank aksesi no.AY570982). Limit deteksi qRT-PCR IQ Real hingga <101 salinan/ µl, dan metoda nested RT-PCR memiliki limit deteksi 103 salinan/µl.
Hasil pengujian pada keseluruhan sampel klinis dan sub-klinis dengan real time RT-PCR IMNV dan nested RT-PCR menunjukkan sensitifitas diagnostik qRT-PCR dengan IQ RealTM adalah 100%. Deteksi IMNV pada keseluruhan sampel udang sub klinis menunjukkan hasil negatif IMNV dengan nested RT-PCR, dan positif IMNV pada kisaran 3-50 salinan RNA virus per µl total RNA dengan qRT-PCR IQ Real.
Perbandingan Real time RT-PCR antara IQ Real dan TaqMan probe menunjukkan Taqman probe mampu mendeteksi IMNV pada jumlah salinan virus terkecil dan memiliki sensitifitas yang setara dengan kit qRT-PCR IQ Real, sehingga metoda ini bisa menjadi metoda alternatif untuk deteksi IMNV dengan real time RT-PCR.
Konstruksi plasmid DNA rekombinan yang mengandung fragmen gen ORF1 IMNV menunjukkan kemiripan 99% dengan fragmen gen ORF1 IMNV telah berhasil dilakukan. Plasmid DNA rekombinan IMNV ini merupakan sumber gen tak terbatas untuk penyediaan fragmen RNA ORF 1 IMNV sebagai kontrol positif untuk pengembangan deteksi IMNV dengan teknik real time RT-PCR secara menyeluruh.
SUMMARY
ZAKIYAH WIDOWATI. Developmentof real time RT-PCR And Molecular Characterization for Detection of Infectious Myonecrosis Virus (IMNV) on Whiteleg Shrimp (Litopenaeus vannamei). Supervised by SURACHMI SETIYANINGSIH and FACHRIYAN H PASARIBU.
Myonecrosis infection in Whiteleg shrimp (Litopenaeus vannamei) causes decline in total shrimp production in Indonesia over the past six years. Myonecrosis infections caused by viruses of the family Totiviradae, size 40 nm, a dsRNA virus, has 7560 nucleotides with a pattern of chronic infection, persistent and progressive infection. Early detection IMNV on Whiteleg shrimp cultivation is necessary for further handling. This study aimed to develope qRT-PCR assay for IMNV, spesifically to detect characterize of local IMNV isolates, determine the limit of detection and diagnostic sensitivity of the assay, and clone the ORF1 gene fragment into plasmid.
Whiteleg shrimp samples were collected from farms in Lampung and Situbondo during April to October 2012. Clinical signs of infection myonecrosis were loss of transparency in the muscle tissue and necrosis of the 6th abdominal segment, which indicate early stages of myonecrosis infection. Nucleotide sequence analyses clone of Lampung and Situbondo isolates obtained in this study in comparison to Brazil (GenBank accession no.AY570982) and previous Indonesian isolated showed 99% similarity on average. Detection of IMNV utilizing qRT-PCR techniques resulted in the limit detection of 101 copies RNA per µl total RNA for qRT-PCR (TaqMan probe and IQ Real) and 103 copies RNA per µl total RNA for nested RT-PCR method.
Investigation on diagnostic sensitivity of PCR techniques done on number clinical and sub clinical samples showed that qRT-PCR are more sensitive than nested PCR. Both IQ RealTM and TaqMan probe have comparable sensitivity in IMNV detection indicating that this in house developed qRT-PCR test could be used as alternative methods to IQ RealTM kit in Indonesia.
Recombinant DNA plasmid containing IMNV ORF1 gene fragment was constructed. This IMNV plasmid could serve as a continuous source fragment ORF1 RNA for preparation of positive control for the the developing IMNV detection techniques by real time RT-PCR.
.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi Medik
PENGEMBANGAN
REAL TIME
RT-PCR DAN KARAKTERISASI
MOLEKULER UNTUK DETEKSI
INFECTIOUS MYONECROSIS
VIRUS (IMNV)
PADA UDANG VANAME (
Litopenaeus vannamei
)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini adalah deteksi penyakit udang dengan teknik molekuler dengan judul Pengembangan Teknik real time RT-PCR Dan Karakterisasi Molekuler Untuk Deteksi Infectious Myonecrosis Virus (IMNV) pada Udang vaname (Litopenaeus vannamei), diajukan untuk
memenuhi syarat penyelesaian tugas akhir Program Magister Sains (S2) pada Program Studi Mayor Mikrobiologi Medik, Sekolah Pasca Sarjana IPB.
Tesis ini diharapkan dapat memberikan informasi pencegahan infeksi Myonecrosis pada udang vaname melalui deteksi dini IMNV dengan teknik molekuler real time RT-PCR, sehingga penyebaran penyakit myonecrosis pada udang vaname dapat dicegah.
Pada kesempatan ini Penulis menyampaikan rasa hormat dan ucapan terima kasih yang sebesar-besarnya kepada :
1. Ibu drh Surachmi Setiyaningsih Ph.D selaku ketua Komisi Pembimbing, yang telah bersedia membimbing penulis sebelum, dan selama berlangsungnya penelitian hingga penyusunan tulisan ini.
2. Bapak Prof Dr drh Fachriyan H Pasaribu, selaku Anggota Komisi Pembimbing dan Ketua Program Studi Pascasarjana Mikrobiologi Medik, atas masukan dan saran selama penelitian ini berlangsung.
3. Ibu Dr Sri Nuryati SPi MSi, selaku Penguji Luar Komis Pembimbing. 4. Pusat Pendidikan Kelautan dan Perikanan (Pusdik KKP), selaku pemberi
beasiswa pendidikan di Sekolah Pasca Sarjana IPB.
5. Bapak Ir Asep D Koswara MSi, selaku kepala Balai Uji Standar Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan (BUSKI-PM). 6. Ibu Nurlaila SPi MP beserta teman-teman di laboratorium BUSKI-PM, atas
bantuannya selama penelitian berlangsung di laboratorium BUSKI-PM. 7. Ibu Puji selaku manajer tambak PT. Primanusa Jaya AbadiLampung,
rekan-rekan di BBAP Situbondo dan BBAP Jepara, atas bantuannya dalam memberikan sampel dalam penelitian ini.
8. Ir. Irman Adirahardja, suami dan sahabat yang senantiasa memberi semangat bagi penulis untuk menyelesaikan penelitian dan tulisan ini. 9. Anakku Nabila Chairunissa, Rifatghani Panatahusna dan Raffirabbani
Panatamahdi, atas segala doa dan kasih sayangnya semoga usaha penulis dapat menginspirasi mereka untuk lebih semangat dalam menuntut ilmu. 10. Seluruh keluarga, saudara, sahabat dan semua pihak tidak dapat disebutkan
satu persatu, atas segala doa dan dukungannya selama penelitian dan penyusunan tesis ini berlangsung.
Tiada kesempurnaan di dunia ini kecuali milik Allah SWT, oleh karenanya penulis mengharapkan kritik dan saran yang membangun untuk penulisan karya ilmiah selanjutnya. Semoga karya ilmiah ini dapat bermanfaat bagi pembacanya.
Bogor, Januari 2013
DAFTAR ISI
Gejala Klinis Infeksi IMNV pada Udang Vaname 10 Epidemiologi dan Transmisi Virus Myonecrosis 12
Diagnosis IMNV dengan Teknik Molekuler 12
In Situ Hibridisasi 13
Loop Mediated Isothermal Amplification 14
Polymerase Chain reaction dan Real Time PCR 14
Teknik DNA rekombinan dan Kloning 17
METODE 19
Bahan 19
Sampel udang vaname 19
Bahan dan primer untuk nested RT-PCR dan real time RT-PCR 19
Bahan untuk kloning dan sekuensing 20
Alat 20
Prosedur 21
Desain dan Kerangka Konsep Penelitian 21
Ekstraksi RNA dan Sintesis cDNA 22
Menentukan Fragmen Gen ORF 1 IMNV 23
Karakterisasi Molekuler (Sekuensing) 24
Limit Deteksi nested RT-PCR dan real time RT-PCR IMNF 24 Sensitifitas diagnostik nested RT-PCR dan qRT-PCR IMNV pada sampel udang vaname (klinis dan sub klinis) 25
Kloning fragmen gen ORF1 IMNV 25
Seleksi koloni, kultur dan isolasi plasmid DNA rekombinan IMNV 26
Sekuensing plasmid DNA rekombinan IMNV 27
Analisis Data 27
HASIL DAN PEMBAHASAN 28
Hasil 28
Deteksi fragmen gen ORF1 IMNV 28
Sekuensing isolat lapang Situbondo dan Lampung 30 Limit deteksi (LOD) qRT-PCR IQ RealTM, qRT-PCR Taqman
probe,dan nested RT-PCR IMNV 31
Sensitifitas diagnostik nested RT-PCR dan qRT-PCR IQ Real IMNV pada sampel udang vaname (klinis dan sub klinis) 33 Deteksi IMNV dengan qRT-PCR TaqMan probe dan qRT-PCR IQ
Real 35
Kloning fragmen gen ORF1 IMNV sebagai kandidat kontrol positif 36
Pembahasan 39
SIMPULAN DAN SARAN 44
Simpulan 44
Saran 44
DAFTAR PUSTAKA 45
LAMPIRAN 49
DAFTAR TABEL
1. Primer dan probe yang digunakan untuk deteksi virus IMN dengan
nested RT-PCR dan qRT-PCR TaqMan probe 20
2. Formulasi bahan amplifikasi nested RT-PCR IMNV dan amplifikasi
fragmen gen ORF1 IMNV wilayah 218-682. 23
3. Formulasi bahan dan profil amplifikasi qRT-PCR TaqMan probe (OIE,2010) dan kit IQ-Real REALTM IMNV Quantitative System
(Farming Intelligene) 25
4. Analisis sensitiftas diagnostik qRT-PCR dengan nested RT-PCR
IMNV . 27
8. Perhitungan nilai sensitifitas uji diagnostik nested RT-PCR dan
qRT-PCR IQ RealTM 35
9. Konsentrasi salinan dan nilai Ct qRT-PCR IQ RealTM dan qRT-PCR
TaqMan probe 36
10. Konsentrasi plasmid DNA rekombinan IMNV 36
11. Nilai Ct plasmid DNA rekombinan IMNV (pIMNV) dengan qPCR 2006). (A) Virus dalam fraksi gradien sukrosa; (B) Virus dimurnikan dalam fraksi gradien Cesium klorida, dan diwarnai asam fosfotungstat
2% 8 perut ditandai warna putih buram; b= Nekrosis pada ruas abdomen ke-6 (atas) dibandingkan dengan udang normal (bawah) 11 7. Infeksi Myonecrosis pada jaringan otot udang vaname (L.vannamei)
mana probe berhibridisasi dengan target IMNV (pewarna Bismarck
brown counterstain pada uji ISH IMNV) 14
8. Pita 328 bp pada first step RT-PCR IMNV primer 4587F-4914R menghasilkan pita (da Silva et al., 2011)kerja real time PCR (qPCR) 16
9. Prinsip kerja real time PCR (qPCR) 16
10. Plasmid rekombinan pDrive Cloning Vector 18
11. Kerangka Konsep Penelitian 22
12. Seleksi dan pembiakan bakteri E.coli(a) Seleksi koloni; (b) Pemurnian koloni; (c) biakan koloni pada LB cair; (d) inkubasi 37ºC dalam
16. Multiple Pairwaise alignment fragmen gen ORF1 IMNVisolat lapang Situbondo dan Lampung dengan IMNV Genbank acc.no.EF061744 dan acc. no.AY570982. Primer 218F-682R ; primer 412F-545R ;
primer probe 30
17. Limit deteksi (LOD) qRT-PCR IMNV IQ Real (Farming Intelligene); (a) Standar kurva nilai curve threshold (Ct); (b) Nilai konsentrasi
salinan dan nilai Ct 31
18. Limit Deteksi (LOD) qRT-PCR IMNV dengan TaqMan probe 33 19. Limit analitik pada serial pengenceran sampel C5 dengan nested
RT-PCR IMNV (OIE, 2010); M (marker 100 bp), line 1: Kontrol positif
21. Pengujian sampel IMNV dengan qRT-PCR IMNV TaqMan probe dan qRT-PCR IQ RealTM. (a) Kurva Ct qRT-PCR IQ Real. (b) Kurva Ct qRT-PCR IMNV TaqMan (c) Perbandingan nilai Ct dengan
konsentrasi salinan qRT-PCR IQ Real. 35
22. Plasmid DNA rekombinan IMNV (pIMNV); M (marker100 bp); line 1-8: pIMNV 218-545 (327 bp); line 7-8 : pIMNV 412-545 (270 bp). 37 23. Kurva nilai Ct plasmid DNA rekombinan (pIMNV) pengujian rPCR
IMNV TaqMan probe 38
24. Peta plasmid DNA rekombinan IMNV (pIMNV) 327 bp pada pDrive
DAFTAR LAMPIRAN
1. BLAST NCBI IMNV isolat lapang Lampung ... 49
2. BLAST NCBI IMNV isolat lapang Situbondo ... 50
3. Alignment plasmid DNA rekombinan IMNV ... 50
4. BLAST NCBI plasmid rekombinan IMNV ... 50
5. Data elektrogram fragmen basa nukleotida F 218 IMNV ... 53
6. Data elektrogram fragmen basa nukleotida R 545 IMNV ... 55
7. Data elektrogram fragmen basa nukleotida F 412 IMNV ... 57
PENDAHULUAN
Latar Belakang
Budidaya udang berkembang pesat dalam kurun waktu 30 tahun terakhir (Lightner, 2005) dan salah satu agribisnis andalan yang mampu menghasilkan pendapatan rutin hingga $10 milliar dalam ekspor komoditi udang sebagai komoditi utama perikanan pada perdagangan internasional. Namun demikian sejak tahun 1980 industri budidaya udang terpengaruh oleh setidaknya 4 pandemik virus yang menyebabkan kerugian ekonomi yang sangat besar yaitu White Spot Syndrome Virus (WSSV), Taura SyndromeVirus (TSV), Infectious hypodermal and hematopoietic necrosis virus (IHHNV) and Yellow Head Virus (YHV) (Lightner,2005; da Silva et al., 2011).
Budidaya udang berkontribusi besar terhadap total ekspor produk perikanan Indonesia. Kementerian Kelautan dan Perikanan masih menempatkan udang sebagai komoditas andalan perikanan budidaya. Produksi udang yang terdiri dari udang vaname (Litopenaeus vannamei) dan udang windu (Penaeus monodon) diproyeksikan naik sebesar 74,75% dari 400,3 ribu ton pada tahun 2010 menjadi 699 ribu ton pada tahun 2014 (Fardiansyah, 2011). Perkembangan produksi udang vaname secara nasional selama empat tahun terakhir kurang begitu baik dan cenderung fluktuatif, salah satunya disebabkan adanya serangan penyakit yang menurunkan produksi udang pertahunnya rata-rata sebesar 32,83% (Fardiansyah, 2011). Menurunnya pasokan udang nasional mengakibatkan harga udang melambung tinggi sehingga menjadi pemicu harga udang Indonesia tidak kompetitif dan sulit bersaing dengan produk Thailand.
Salah satu virus yang mematikan benur dan induk udang adalah Infectious Myonecrosis Virus (IMNV). Infeksi myonecrosis (IMN) adalah salah satu penyakit viral pada budidaya udang, muncul pertama kali di Brazil sejak Agustus 2002 (Poulos et al., 2006; Andrade et al., 2007). Wabah penyakit IMNV terjadi di Brazil tahun 2004 pada budidaya udang vaname. Di Indonesia serangan IMNV menyebabkan kematian tinggi pada budidaya udang vaname, dengan gejala mirip dengan yang dilaporkan di Brazil (Senapin et al., 2007). Kemunculan IMNV terdeteksi pertama kali di Situbondo pada tahun 2006, dan dalam kurun waktu Januari-Desember 2009 telah menyebar ke Jawa Timur, Bali, Lombok dan Lampung. Jawa Barat dan Banten positif IMNV pada bulan November – Desember 2009 (Sutanto, 2010). Penyebaran IMNV terjadi secara vertikal dari benur yang terinfeksi dari induknya, dan menyebar secara horisontal melalui perairan maupun distribusi antar area induk dan benur (post larva) udang vaname untuk keperluan budidaya.
Gejala klinis yang ditimbulkan oleh infeksi IMNV adalah hilangnya transparansi pada jaringan otot akibat nekrosis. Infeksi lanjutan ditandai dengan nekrosis pada jaringan otot khususnya di bagian distal abdomen udang. Perubahan nekrosis jaringan otot dari warna putih suram menjadi merah (seperti udang rebus) menyebabkan mortalitas udang hingga 70% (Andrade et al., 2008).
2
kerusakan jaringan yang ditimbulkan oleh infeksi IMNV tersebut. Peneguhan diagnosa infeksi IMNV dilakukan dengan teknik molekuler melalui in Situ Hibridisasi maupun metoda nested reverse trancription polymerase chain reaction (nested RT-PCR IMNV). Dalam pemilihan metoda uji untuk diagnosa IMNV harus mempertimbangkan sensitifitas dan spesifisitas, tujuan pemeriksaan, sampling (stadia hidup, kecukupan sampel, preservasi dan target jaringan) serta tujuan diagnosis itu sendiri (presumptif atau diagnosa konfirmatif) (OIE, 2010; da Silva et al., 2011).
Nested RT-PCR IMNV merupakan metoda diagnosa yang sensitif tetapi hasil pengujiannya bersifat kualitatif. Metoda ini belum dapat mendeteksi jumlah salinan virus (kuantitatif) didalam jaringan (da Silva et al., 2011). Menentukan jumlah virus dalam jaringan inang yang terinfeksi menjadi aspek yang sangat penting dalam pemantauan penyakit udang, khususnya yang berkaitan dengan deteksi infeksi virus pada individu yang tidak menunjukkan gejala klinis (Tang dan Lightner, 2001). Namun kendala dalam kuantifikasi virus pada udang adalah kurangnya sistem kultur sel udang, akibatnya dibutuhkan metoda deteksi langsung yang dapat mengukur rendahnya jumlah salinan virus didalam jaringan yang terinfeksi tanpa melalui propagasi virus melalui teknik kultur sel (Tang dan Lightner, 2001; de Silva et al., 2011). Metoda real time RT-PCR (qRT-PCR) dapat mendeteksi jumlah salinan virus dalam jaringan (Bowers et al., 2008). Sensitifitas pengujian qRT-PCR lebih tinggi karena mampu mendeteksi virus IMN dalam jumlah sedikit hingga 10 salinan/ µl RNA, sedangkan nested RT-PCR hanya mampu mendeteksi virus IMN sedikitnya 1500 salinan pada sampel dengan jumlah salinan virus yang tinggi (Andrade et al., 2007)
Monitoring kesehatan udang merupakan salah satu upaya pengendalian penyakit myonecrosis. Deteksi dini infeksi IMNV pada budidaya udang vaname sangat diperlukan untuk penanganan selanjutnya. Ketepatan pengambilan sampel jaringan dan pemilihan metoda deteksi penyakit IMNV yang memiliki sensitifitas dan spesifisitas tinggi menentukan keberhasilan diagnosa. nested RT-PCR adalah metoda diagnosa IMNV secara kualitatif, menjadi kendala dalam deteksi dini infeksi IMNV (sub klinis). Penelitian deteksi dan karakterisasi molekuler serta pengembangan teknik qRT-PCR untuk deteksi infectious myonecrosis virus (IMNV) pada udang vaname (Litopenaeus vannamei) perlu dilaksanakan sebagai diagnosa infeksi dini IMNV pada udang vaname (L.vannamei) sub klinis. Kekerabatan molekuler virus IMN Situbondo dan Lampung dengan virus IMN isolat Indonesia dan Brazil diharapkan dapat menentukan kompatibilitas primer PCR dalam deteksi IMNV, disamping untuk pengembangan teknik qRT-PCR melalui penyediaan kontrol positif IMNV berupa plasmid DNA rekombinan IMNV.
Perumusan Masalah
3 demikian infeksi dini IMNV masih sulit dideteksi dengan metoda nested RT-PCR ini.
Metoda real time RT-PCR (qRT-PCR) adalah pengembangan uji molekuler (PCR) untuk deteksi IMNV secara kuantitatif, dapat menjadi alternatif sebagai perangkat deteksi dini infeksi IMNV pada budidaya udang vaname. Kuantifikasi salinan virus pada qRT-PCR memerlukan kontrol positif yang terukur jumlah salinan virusnya. Ketersediaan kit komersial untuk pengujian qRT-PCR IMNV memiliki beberapa kelebihan seperti adanya kontrol positif yang telah terukur salinan virusnya, sehingga keseluruhan sampel yang diuji dapat dikuantifikasi dengan adanya kontrol positif tersebut. Kelebihan lainnya adalah kit komersial mudah digunakan, sehingga mempercepat proses pengujian IMNV. Ketergantungan pada kit untuk pengujian IMNV memunculkan kekurangan lainnya seperti harga kit yang mahal, kontinuitas kit dalam jangka panjang, dan urutan nukleotida virus yang tidak diketahui wilayah targetnya sesuai desain primer kit tersebut. Ketergantungan pada kit komersial untuk pengujian IMNV dengan qRT-PCR mendorong pengembangan real time RT-PCR IMNV dengan TaqMan probe menggunakan desain primer dari daerah gen ORF1 IMNV (Andrade et al., 2007; OIE, 2010).
Penyebaran penyakit IMNV di Indonesia sejak tahun 2006 memungkinkan terjadinya mutasi gen virus myonecrosis dari isolat asalnya (Brazil) maupun isolat awal munculnya di Indonesia. Karakterisasi kekerabatan molekuler virus IMN isolat lapang Situbondo dan Lampung dengan isolat IMNV yang terdaftar di GenBank (aksesi no.AY570982 dan no.EF061744) sangat penting untuk dilaksanakan, mengingat perubahan urutan basa daerah ORF1 IMNV sangat berpengaruh pada sensitifitas uji dengan qRT-PCR IMNV TaqMan probe.
Tujuan Penelitian
Secara umum penelitian ini bertujuan untuk mengembangkan teknik qRT-PCR untuk deteksi dan kuantifikasi virus infectious myonecrosis (IMNV) pada udang vaname (L.vannamei). Adapun tujuan khusus penelitian ini meliputi :
a. Deteksi dan karakterisasi molekuler IMNV isolat Lampung dan Situbondo. b. Menentukan limit deteksi (LOD) rRT PCR IMNV dengan IQ REALTM dan
nested RT-PCR IMNV.
c. Aplikasi qRT-PCR dan nested RT-PCR IMNV untuk diagnosa penyakit IMNV pada sampel udang vaname dengan status klinis dan subklinis. d. Kloning fragmen gen ORF1 IMNV sebagai kandidat kontrol positif
qRT-PCR IMNV TaqMan Probe.
Manfaat Penelitian
4
untuk deteksi IMNV. Kemampuan qRT-PCR IMNV mendeteksi IMNV secara kuantitatif, dapat diaplikasikan untuk deteksi IMNV pada seleksi induk udang vaname sebelum pemijahan berlangsung, sehingga transmisi virus IMN secara vertikal dapat dihindarkan. Pengembangan metoda uji qRT-PCR IMNV TaqMan probe menjadi pilihan metoda alternatif dalam upaya mengurangi ketergantungan terhadap kit komersial untuk deteksi IMNV dengan real time RT-PCR.
Hipotesis Penelitian
1. Kekerabatan molekuler IMNV Situbondo dan Lampung lebih besar dengan isolat Indonesia dibanding isolat Brazil.
5
TINJAUAN PUSTAKA
Udang Vaname (Litopenaeus vannamei)
Litopenaeus vannamei, biasa disebut sebagai udang putih atau udang vaname, masuk kedalam famili Penaeidae. Klasifikasi udang vaname menurut Boone (1931) dalam Effendi (1997) adalah sebagai berikut :
Kingdom : Animalia Subkingdom : Metazoa Filum : Arthropoda Subfilum : Crustacea Kelas : Malacostraca Subkelas : Eumalacostraca Super ordo : Eucarida Famili : Penaeidae Genus : Litopenaeus
Spesies : Litopenaeus vannamei
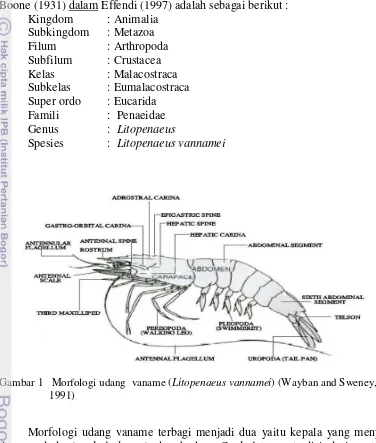
Gambar 1 Morfologi udang vaname (Litopenaeus vannamei) (Wayban and Sweney, 1991)
6
(pleopod). Pada ujung ruas keenam terdapat ekor kipas 4 lembar dan satu telson berbentuk runcing (Wayban dan Sweeney, 1991) (Gambar 1).
Tubuh udang vaname memiliki carapace transparan (bening) dengan butir-butir pigmen biru pada sitoplasma yang mendominasi tubuh udang sehingga terkadang udang terlihat berwarna kebiru-biruan (kromatofor) Pada udang betina, gonad pada awal perkembangannya berwarna keputih-putihan dan berubah menjadi coklat keemasan atau kehijauan. Udang vaname dewasa bertelur di laut terbuka, dan pada satdia postlarva akan bermigrasi ke pantai hingga stadia juvenil (Briggs et al., 2004). Organ dalam udang vaname lainnya yang dapat diamati adalah usus yang mengarah ke anus terletak di ujung ruas keenam. (Haliman dan Adijaya, 2005). Udang vaname digolongkan pada hewan pemakan segala (omnivora) namun cenderung ke dalam kelompok karnivora karena pemakan crustacea kecil dan polychaeta (Hendrajat, 2003). Secara alami udang vaname bersifat nocturnal aktif mencari makan pada saat intesitas cahaya berkurang, dan bersifat kanibalisme pada saat terdapat udang vaname lain yang lemah terutama saat moulting dan sakit (Fegan 2003).
Sistim pertahanan tubuh pada kelompok krustasea (avertebrata).adalah sistem imun non spesifik. Imunitas avertebrata tidak berdasarkan imunoglobulin dan interaksi subpopulasi limfosit, karena tidak memproduksi antibodi spesifik atau antibodi pada krustasea sangat sedikit (Ratcliffe, 1985). Imunitas avertebrata dipengaruhi oleh interaksi sel fagositosis dengan patogen, bersamaan dengan sejumlah faktor humoral seperti lisosim (Ratcliffe, 1985). Pertahanan krustasea sebagian besar berdasarkan pada aktifitas sel darah atau hemosit. Sel ini bisa menghilangkan partikel asing pada tubuh krustasea akuatik melalui aktifitas fagositosis atau enkapsulasi (Söderhäl dan Cerenius, 1992). Hemosit penting untuk menghilangkan partikel asing yang masuk ke tubuh udang. Terdapat tiga tipe hemosit pada hemolim udang yaitu sel hialin, semi granular dan granular, dan ketiganya memiliki morfologi dan fungsi sel masing-masing (Söderhäl dan Cerenius, 1992).
7 (Boyd dan Clay, 2002). Tingginya tingkat kelulusan hidup karena benih udang vaname dapat diperoleh dari induk yang telah didomestikasi sehingga benur yang dihasilkan tingkat kanibalismenya rendah. Benur udang vaname sudah ada yang bersifat SPF (Spesific Pathogen Free) yaitu benur yang bebas dari beberapa jenis penyakit (patogen) contohnya adalah udang vaname yang tahan terhadap infeksi White spot syndrome virus (WSSV), meskipun ditemukan beberapa kasus udang yang terinfeksi (Soto et al., 2001). Perilaku abnormal udang sering menjadi penanda awal terjadinya stress atau timbulnya masalah penyakit. Petani atau pembudidaya udang akan segera mengambil tindakan jika terjadi perubahan pada pola makan udang, gerakan berenang atau agregasi yang tidak biasa, bahkan aktivitas predator disekitar kolam pemeliharaan dapat menjadi penanda terjadinya infeksi penyakit pada udang tersebut (FAO, 2001).
Infectious Myonecrosis
Sejarah Infeksi Myonecrosis
Infeksi myonecrosis (IMNV) adalah penyakit viral yang berkembang lambat tetapi bersifat kumulatif. Mortalitas yang ditimbulkan mencapai 70% pada budidaya udang vaname (Litopenaeus vannamei) di Brazil dan Indonesia (Puthawibool et al., 2009 ). Infeksi myonecrosis mucul pada budidaya udang vaname di laut dan perairan payau. Wabah penyakit ini dikaitkan dengan beberapa kondisi stress fisik dan lingkungan (salinitas dan temperatur yang ekstrim, penangkapan dengan jaring, rendahnya kualitas pakan), dan disebabkan oleh adanya penularan dari udang yang telah terinfeksi myonecrosis (OIE, 2012).
8
Setelah terjadinya wabah di Indonesia, infeksi IMNV dilaporkan menyebar ke wilayah Asia di pulau Hainan (Republic of China) dan Thailand bagian selatan (OIE, 2010). Berdasar pengujian terhadap sampel udang vanamedari beberapa negara di Asia seperti Indonesia, Thailand, Malaysia, Taiwan, Vietnam, India dan China hingga pertengahan tahun 2011, hanya sampel udang yang berasal dari Indonesia yang positif terinfeksi IMNV (Senapin et al., 2011). Gejala klinis berupa warna putih pada jaringan otot yang dijumpai pada sampel udang dari ketujuh negara kecuali dari Indonesia kemungkinan besar bukan karena infeksi IMNV melainkan adanya syndrome kejang otot (muscle cramp syndrome) akibat lingkungan atau salah penanganan udang sehingga terjadi stress pada udang (Senapin et al., 2011).
Etiologi
Struktur Virus
IMNV merupakan virus tidak beramplop, berbentuk icosahedral berdiameter 40 nm dan termasuk kedalam famili Totiviridae (Nibert et al., 2007; Poulos et al., 2006; Tang et al., 2008). Virus IMN pada fraksi sukrosa dilihat bentuknya menggunakan transmisi mikroskop elektron (Gambar 2). Partikel virus berbentuk icosahedral, tidak beramplop, memiliki panjang genom 7560 bp (Paulos et al., 2006).
Gambar 2 Virus IMN dilihat dengan Transmisi Mikroskop Elektron (TEM), pada berbagai fraksi gradien (skala garis 100 nm ) (Poulos et al., 2006). (A) Virus dalam fraksi gradien sukrosa; (B) Virus dimurnikan dalam fraksi gradien Cesium klorida, dan diwarnai asam fosfotungstat 2%
9
(Tang et al., 2008; Ghabrial, 2008).Oleh karenanya dapat disimpulkan bahwa tonjolan pada virus IMNV berkontribusi terhadap virulensi dan pola spesifik patogenesis (Tang et al., 2008).
Susunan Genom
Genom Virus IMN adalah RNA untai ganda (double stranded) yang terdiri dari 7560 nukleotida (Senapin et al., 2007; OIE, 2010).Genom virus ini terdiri dari 2 extended open reading frame (ORF) yang berbeda, ORF1 di frame 1 (136-4953) dan ORF 2 di frame 3 (nt 5241-7451) (Nibert, 2007; Tang et al., 2008). ORF1 (1605 aa) mengkode protein 179 kDa termasuk sekuen N terminal pada MCP. Pada ORF 2 menyandi protein 85 kDa yang terdiri dari serangkaian karakteristik dari RNA-dependent RNA polymerase (RdRp) (Nibert, 2007). Pengkodean protein kapsid totivirus biasanya dimulai dari awal ORF1 (Gambar 4). Sedangkan virus IMNV berbeda dengan totivirus pada umumnya, karena wilayah pengkode protein kapsid dimulai dari pertengahan ORF1 (Poulos et al., 2006). Hal ini menunjukkan kemungkinan bahwa setengah ORF1 IMNV dapat menyandikan RNA binding protein (Poulos et al.,2006). Kemungkinan MCP IMNV telah berkembang dan berbagi peran dalam proses masuknya kedalam sel dengan serat kompleks. Jika anggota lain dari family Totiviridae dikaitkan dengan laten, infeksi avirulen pada inang, namun sebaliknya IMNV dikaitkan dengan infeksi yang mematikan pada udang penaeid (Lightner et al., 2004; Poulos et al., 2006).
Gambar 4 Sketsa Genom IMNV (Nibert , 2007; Tang et al., 2008)
Hasil sequencing genome IMNV Indonesia secara penuh 7,5 kb (Gen.Bank accs.no. EF061744) menunjukkan 99,6% identik dengan IMNV dari Brazil (GenBank.AY570982.1) (Senapin et al., 2007). Analisis filogeni (Gambar 5) berdasarkan RNA-dependent RNA polymerase (RdRp) menunjukkan IMNV memiliki kemiripan dengan Giardia lamblia virus (GLV) yang merupakan bagian dari famili Totiviridae (Poulos et al., 2006). Sebagian besar anggota famili
10
Totiviridae memiliki kekurangan dalam mentransmisikan virion melalui media ekstraseluler dalam siklus hidupnya (Lightner et al., 2004a; Tang et al, 2008). Pada umumnya penyebarannya secara vertikal didalam sel atau horizontal dengan hypa 1 mastomiasis kecuali GLV dan IMNV, dan IMNV merupakan satu-satunya virus dari famili Totiviridae yang diketahui menyebabkan penyakit pada inangnya (Tang et al., 2008).
Gambar 5 Filogeni IMNV . Kedekatan IMNV dengan GLV virus sekitar 80% (Poulos et al., 2006)
Gejala Klinis Infeksi IMNV pada Udang Vaname
Gejala klinis penyakit IMNV pada udang vaname adalah nekrosis ekstensif berwarna putih pada jaringan otot, khususnya pada bagian punggung dan ekor (Gambar 6), timbulnya warna putih pada jaringan otot menyerupai warna udang rebus/udang yang dimasak (Puthawibool et al.,2009; OIE,2010). IMNV dapat menginfeksi hampir sebagian besar jenis udang penaeid, khususnya udang vaname (L.vannamei) yang menyebabkan mortalitas udang yang tinggi sehingga menimbulkan kerugian yang sangat besar (Lightner et al., 2004b). IMNV dapat menimbulkan kematian hingga 60% pada stadia yuwana (juvenile) 2-3 gram dan udang dewasa hingga ukuran 12 gram. Hasil penelitian menunjukkan bahwa IMNV dapat menginfeksi udang Penaeus stylirostris dan Penaeus monodon namun tidak menyebabkan kematian pada udang (Tang et al., 2005).
11 penangkapan dengan castnetting, pemberian pakan, perubahan salinitas secara mendadak dan faktor pemicu stress lainnya (OIE, 2012).
Berbagai tingkat nekrosis jaringan otot perut udang oleh infeksi IMNV (Gambar 6), terlihat sebagai perubahan warna perut, buram keputihan (Gambar 6a). Nekrosis jaringan otot di sepanjang perut abdomen khususnya pada ruas abdomen keenam (panah) terlihat putih dibandingkan dengan udang normal (Gambar 6b) dimana transparasi jaringan terlihat jelas (Poulos et al., 2006). Infeksi IMNV yang menonjol lainnya adalah nekrosis ekstensif diwilayah otot lurik yang ditandai hilangnya transparansi (buram) adalah terjadinya nekrosis pada ruas perut (distal abdomen) dan ekor kipas udang (Poulos et al., 2006; Lightner et al., 2004). Sifat infeksi IMNV adalah kronis progresif dan persisten, secara perlahan-lahan penyakit ini menyebabkan kematian kumulatif 40% hingga 70% (Poulos et al., 2006; OIE, 2012).
Gambar 6 Gejala klinis infeksi IMNV (Poulos et al., 2006). a= Nekrosis otot perut ditandai warna putih buram; b= Nekrosis pada ruas abdomen ke-6 (atas) dibandingkan dengan udang normal (bawah)
Infeksi buatan IMNV terhadap udang vaname ukuran rata-rata 1gr/ ekor selama 52 hari paska infeksi (post infection/ p.i) menunjukkan kematian hingga 100% (Andrade et al., 2007). Kematian awal dijumpai pada hari ke 8 p.i, dan jumlah kematian udang yang diinfeksi meningkat hingga hari ke 40 p.i. Rata-rata waktu kematian 50% (lethal time50/ LT50) pada uji coba infeksi buatan tersebut adalah 43 p.i (Andrade et al., 2007). Senapin et al (2005) menginfeksi 3 jenis udang L.vannamei, L.stylirostris, dan P.monodon dengan inokulum yang berisi virion murni IMNV melalui injeksi. Gejala klinis berupa lesi putih pada jaringan otot di bagian ekor terlihat pada udang L.vannamei dan L.stylirostris. Perkembangan gejala klinis sangat lambat, muncul gejala setelah 7 hari p.i dan lesi dijumpai setelah 13 hari p.i. Selama 4 minggu paska infeksi IMNV berlangsung, udang P.monodon tidak menunjukkan gejala klinis dikarenakan tingginya pigmen pada exoskeleton yang menutupi lesi (Senapin et al., 2005).
12
sel organ limfoid berbentuk speroid dan organ limfoid berbentuk speroid ektopik yang ditemukan di hemoceal dan jaringan lunak terutama di lumen jantung dan sekitar tubula kelenjar antenna (Lightner et al., 2004).
Epidemiologi dan Transmisi Virus Myonecrosis
Wabah penyakit IMNV pada budidaya udang vaname dilaporkan pertama kali tahun 2002 di wilayah bagian Piauí (Timur laut Brazil) (Lightner et al., 2004a,b; Poulos et al., 2006; Pinheiro et al., 2007). Selama musim penghujan bulan Januari hingga Maret, penyakit IMNV menyebar ke wilayah-wilayah yang bersebelahan, hingga tahun 2004 seluruh budidaya udang di wilayah timur laut Brazil terinfeksi myonecrosis termasuk wilayah Pernambuco (Pinheiro et al., 2007). Kematian akibat infeksi IMNV ini rata-rata 35-55% pada udang ukuran 12 gr, dan menyebabkan kerugian hingga US$ 20 juta ditahun 2003 (Nunes et al., 2004 dalam Pinheiro el al., 2007). Infeksi myonecrosis pertama kali di Indonesia terjadi pada tahun 2006 di Situbondo, Jawa Timur (Senapin et al., 2007; OIE, 2012). Selanjutnya wabah myonecrosis menyebar ke Jawa Barat, Sumatera, Bangka, Kalimantan Barat, Sulawesi Selatan, Bali, Lombok, dan Sumbawa (Sutanto, 2011; OIE, 2012). Negara-negara Asia tenggara lainnya belum melaporkan kejadian infeksi myonecrosis (Senapin et al., 2011; OIE, 2012).
Prevalensi infeksi IMN pada wilayah enzootik IMNV di area budidaya udang vaname (L.vannamei) mencapai 100% (Andrade et al., 2007; Nunes et al., 2004). Suhu dan salinitas berperan sebagai faktor predisposisi terjadinya wabah penyakit IMNV (Nunes et al., 2004). Penyebaran virus myonecrosis kemungkinan terjadi karena transmisi virus melalui air (horisontal) dan transmisi virus secara vertikal dari induk ke keturunannya (OIE, 2012). Berdasar struktur partikelnya, virus myonecrosis tidak beramplop seperti virus TSV, sehingga memungkinkan virus tersebut akan berada di usus dan tinja burung laut yang memakan udang mati atau udang sekarat di area tambak yang epizootik IMN. Selanjutnya virus akan menyebar di area tambak tersebut melalui tinja atau bangkai udang muntahan (Vanpatten et al.,2004). Penularan virus myonecrosis secara horisontal lainnya melalui kanibalisme, dimana udang vaname yang terinfeksi dan lemah akan menepi dan dimangsa oleh udang lain (kanibalisme) yang menyebabkan terjadinya transmisi virus antar udang (Lightner, 2011; Poulos et al, 2006). Populasi udang vaname yang bertahan hidup setelah infeksi IMNV atau udang vaname yang berasal dari daerah epizootik IMNV kemungkinan akan membawa virus hidup (OIE, 2012), dan berpotensi menularkan virus IMN secara transmisi vertikal melalui induk (keturunan). Mekanisme penularan infeksi IMNV secara vertikal masih bersifat dugaan berdasar kondisi di lapangan, sehingga belum dapat diketahui apakah transmisi virus melalui mekanisme transovarial atau oleh kontaminasi permukaan telur yang baru dikeluarkan oleh induknya (OIE, 2012).
Diagnosis IMNV dengan Teknik Molekuler
13 melalui pengamatan gejala klinis yang menyertai infeksi virus myonecrosis, pemeriksaan mikroskopis dengan melihat perubahan jaringan (histopatologi), pengamatan preparat basah (wet mounts) dan metoda pengujian berdasar deteksi molekuler (Lightner, 2011; Lightner et al., 2004; Poulos et al., 2006). Deteksi IMNV berdasar reaksi antigen antibodi telah dikembangkan oleh Kunanopparat et al., (2011) menggunakan 3 antibodi monoklonal (mAbs) yang berasal dari protein capsid IMNV, namun pengujian dengan kombinasi ketiga mAbs tersebut sensitifitasnya lebih rendah sepuluh kali lipat dibandingkan pengujian IMNV dengan nested RT-PCR (OIE, 2012).
Metoda pengujian IMNV berdasar deteksi molekuler yang telah dipublikasikan adalah dengan in-situ hibridisasi (ISH), nested RT-PCR dan kuantitatif real time (r)RT-PCR(Andrade et al., 2007; Poulos et al., 2006;Tang et
al., 2005). Teknik molekuker lain untuk pengujian IMNV adalah dengan reverse transcription loop mediated isothermal amplification (RT-LAMP) yang dikembangkan oleh Puthawibol et al., (2009). Dari keseluruhan metoda deteksi IMNV tersebut yang menjadi gold standar adalah nested RT-PCR dan real time RT-PCR IMNV (OIE, 2012), dikarenakan sensitifitas dibandingkan teknik molekuler lainnya. Beberapa teknik molekuler yang digunakan untuk pengujian IMNV adalah sebagai berikut :
In Situ Hibridisasi
Hibridisasi adalah proses perpasangan basa antara polinukleotida utas tunggal yang komplententer, digunakan untuk mendeteksi sekuens spesifik dalam campuran asam nukleat yang kompleks. Deteksi ini memiliki spesifisitas yang tinggi karena ketepatan deteksi didasarkan atas kesamaan runutan nukleotikda antara pelacak dan genom virus yang diketahui (Akin, 2001). Satu molekul adalah probe dari sekuen tertentu. DNA probe adalah protein pelacak target gen dan digunakan untuk mencari molekul yang memiliki sekuen komplementer dalam campuran DNA. DNA probe yang telah dilabel akan berkomplementasi dengan target melalui hibridisasi sehingga dapat mendeteksi keberadaan gen tertentu (Furuya et al., 2006)
14
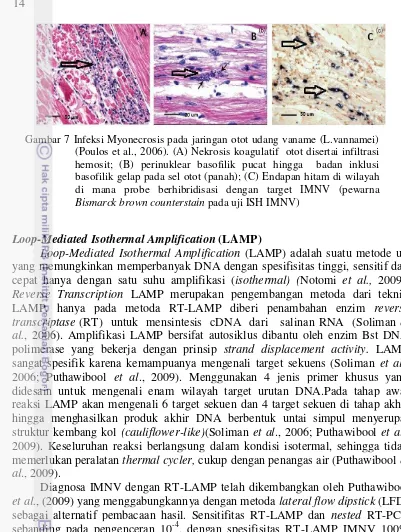
Gambar 7 Infeksi Myonecrosis pada jaringan otot udang vaname (L.vannamei) (Poulos et al., 2006). (A) Nekrosis koagulatif otot disertai infiltrasi hemosit; (B) perinuklear basofilik pucat hingga badan inklusi basofilik gelap pada sel otot (panah); (C) Endapan hitam di wilayah di mana probe berhibridisasi dengan target IMNV (pewarna Bismarck brown counterstain pada uji ISH IMNV)
Loop-Mediated Isothermal Amplification (LAMP)
Loop-Mediated Isothermal Amplification (LAMP) adalah suatu metode uji yang memungkinkan memperbanyak DNA dengan spesifisitas tinggi, sensitif dan cepat hanya dengan satu suhu amplifikasi (isothermal) (Notomi et al., 2009). Reverse Transcription LAMP merupakan pengembangan metoda dari teknik LAMP, hanya pada metoda RT-LAMP diberi penambahan enzim reverse transcriptase (RT) untuk mensintesis cDNA dari salinan RNA (Soliman et al., 2006). Amplifikasi LAMP bersifat autosiklus dibantu oleh enzim Bst DNA polimerase yang bekerja dengan prinsip strand displacement activity. LAMP sangat spesifik karena kemampuanya mengenali target sekuens (Soliman et al., 2006; Puthawibool et al., 2009). Menggunakan 4 jenis primer khusus yang didesain untuk mengenali enam wilayah target urutan DNA.Pada tahap awal reaksi LAMP akan mengenali 6 target sekuen dan 4 target sekuen di tahap akhir hingga menghasilkan produk akhir DNA berbentuk untai simpul menyerupai struktur kembang kol (cauliflower-like)(Soliman et al., 2006; Puthawibool et al., 2009). Keseluruhan reaksi berlangsung dalam kondisi isotermal, sehingga tidak memerlukan peralatan thermal cycler, cukup dengan penangas air (Puthawibool et al., 2009).
Diagnosa IMNV dengan RT-LAMP telah dikembangkan oleh Puthawibool et al., (2009) yang menggabungkannya dengan metoda lateral flow dipstick (LFD) sebagai alternatif pembacaan hasil. Sensitifitas RT-LAMP dan nested RT-PCR sebanding pada pengenceran 10-4, dengan spesifisitas RT-LAMP IMNV 100% (Puthawibool et al., 2009). Hasil pembacaan RT LAMP IMNV dengan gel agarose, LFD maupun pewarnaan dengan SYBR Green menunjukkan hasil yang tidak berbeda (Puthawibool et al., 2009)
Polymerase Chain Reaction (PCR) dan real time PCR
15 dan Russel, 2001). Metoda PCR tersebut sangat sensitif sehingga dapat digunakan untuk melipatgandakan satu molekul DNA. Dengan menggunakan metoda PCR dapat diperoleh pelipatgandaan suatu fragmen DNA (110 bp, 5x 10-19 mol) sebesar 200.000 kali setelah dilakukan 20 siklus reaksi selama 220 menit (Yuwono, 2006).
Persyaratan dalam penggunaan metoda PCR salah satunya adalah harus mengetahui bagian tertentu sekuen DNA yang akan dilipatgandakan terlebih dahulu sebelum proses pelipatgandaan tersebut. Sekuen yang diketahui tersebut penting untuk menyediakan primer, yaitu sekuen oligonukleotida pendek yang berfungsi mengawali sintesis rantai DNA.Untuk menjalankan suatu reaksi PCR dibutuhkan empat komponen utama yaitu : DNA cetakan (fragmen DNA yang akan dilipatgandakan), oligonukleotida primer yaitu suatu sekuen oligonukleotida pendek (15-25 basa nukleotida)yang digunakan untuk mengawali sintesis rantai DNA, deoksiribonukleotida trifosfat (dNTP) yang terdiri atas dATP, dCTP, dGTP, dTTP dan yang terakhir adalah enzim DNA polimerase yaitu enzim yang melakukan katalisis reaksi sintesis rantai DNA (Yuwono, 2006). Deteksi produk akhir PCR dengan gel elektroforesis sehingga lebih dikenal sebagai PCR end point atau hasil pengujian baru terlihat setelah selesai keseluruhan tahapan tersebut(Sambrook dan Russell, 2001).
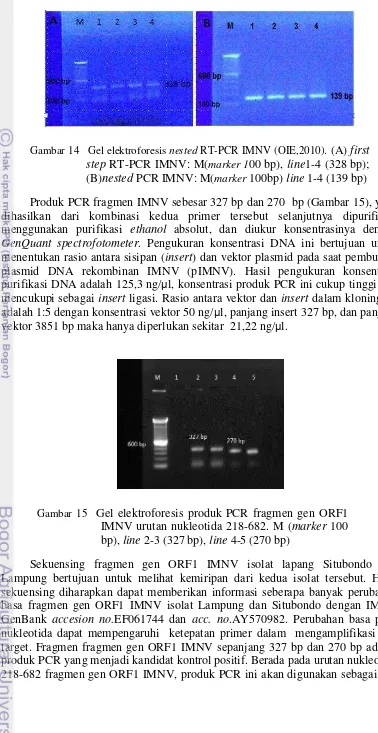
Nested RT-PCR direkomendasikan oleh OIE (2012) sebagai metoda uji untuk deteksi dengan menggunakan 2 pasang primer yang menghasilkan produk produk PCR 328 bp dan 139 bp (da Silva et al., 2011; OIE, 2012). Produk amplifikasi nested RT-PCR IMNV dianalisa dengan gel agar (Gambar 8). Meskipun memiliki sensitifitas dan spesifisitas yang tinggi sebagai metoda diagnosa IMNV, tetapi hasil analisa metoda PCR ini hanya bersifat kualitatif saja dan tidak dapat mendeteksi salinan virus secara kuantitatif (da Silva et al., 2011).
Gambar 8 Pita 328 bp pada first step RT-PCR IMNV dengan primer 4587F-4914R (da Silva et al., 2011)
16
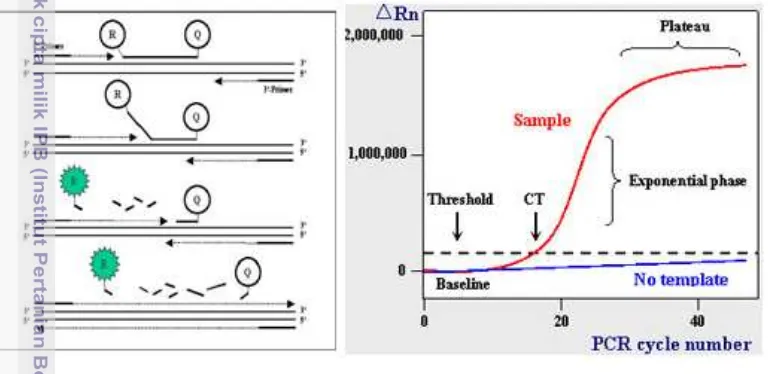
Bahan yang digunakan pada qPCR sama dengan bahan yang digunakan pada pengujian dengan PCR konvensional, hanya ditambahkan pewarna fluoresensi yang biasa disebut probe atau reporter. Prinsip kerja qPCR adalah mendeteksi dan mengkuantifikasi reporter fluoresensi. Sinyal fluoresensi akan meningkat seiring dengan bertambahnya produk PCR dalam reaksi. Dengan mencatat jumlah emisi fluoresensi pada setiap siklus, reaksi selama fase eksponensial dapat dipantau (Dorak, 2006) (Gambar 9). Peningkatan produk PCR yang signifikan pada fase eksponensial berhubungan dengan jumlah inisiasi gen target. Makin tinggi tingkat ekspresi gen target maka deteksi emisi fluoresensi makin cepat terjadi (Dorak, 2006).
Gambar 9 Prinsip kerja real time PCR (qPCR)
17
Teknik DNA rekombinan dan Kloning
Secara alami, proses rekombinasi dapat terjadi sehingga memungkinkan suatu gen dapat berpindah dari satu organisme ke organisme lain. Persitiwa tersebutbiasanya terjadi diantara organisme yang memiliki kekerabatan yang dekat.Dengan kemajuan teknologi molekuler, perpindahan gen dapat terjadi meskipunantara organisme yang tidak memiliki hubungan kekerabatan. Teknik penggabungan molekul DNA dikenal sebagai teknik DNA rekombinan. Teknologi DNA rekombinan atau rekayasa genetika merupakan suatu upaya perbanyakan gen tertentu didalam suatu sel yang bukan sel alaminya sehingga sering pula dikatakan sebagai kloning gen. Teknologi ini adalah pembentukan kombinasi materi genetik yang baru dengan cara penyisipan molekul DNA kedalam suatu vektor sehingga memungkinkan untuk terintegrasi dan mengalami perbanyakan di dalam suatu sel organisme yang lain yang berperan dalam sel inang (Yuwono, 2006).
Tahapan pembuatan DNA rekombinan dimulai dari ligasi, transformasi kedalam sel inang, dan seleksi koloni hasil transformasi. Pembuatan rekombinan DNA memerlukan dua macam enzim yaitu enzim restriksi yang berfungsi memotong molekul DNA dan enzim ligase yang berfungsi menggabungkan molekul DNA (Glick dan Pasternak, 2003). Tahapan dalam pembuatan DNA rekombinan dimulai dari klon DNA target atau DNA asing yang secara enzimatis dipotong dan digabungkan (ligasi) kedalam DNA lain (kloning vektor : plasmid) sehingga menghasilkan molekul DNA rekombinan (DNA Construct).
Teknik pembuatan DNA rekombinan lainnya adalah dengan kloning TA. Kloning TA merupakan subkloning yang tidak menggunakan enzim restriksi, lebih mudah dan lebih cepat daripada sub kloning tradisional sebelumnya. Teknik ini bergantung pada kemampuan adenin (A) dan timin (T) yang merupakan pasangan basa komplementer pada fragmen DNA yang berbeda untuk berhibridisasi, dan dengan adanya enzim ligase maka keduanya akan terligasi. Produk PCR biasanya diamplifikasi menggunakan enzim Taq polimerase. Taq polimerase memiliki 3’ ke 5’ kegiatan proofreading, dan dengan probabilitas tinggi akan menambahkan satu overhang 3’ adenin (A) pada setiap akhir produk PCR. Produk PCR yang disisipkan akan dikloning kedalam vektor linier yang telah dilengkapi dengan 3’ overhang timin (T). Pada kit yang telah dikomersialisasikan umumnya telah menyediakan vektor dan reagen PCR yang mempercepat ligasi. Penggunaan pDrive sebagai vektor kloning dalam bentuk linier dengan overhang U disetiap ujungnya untuk memudahkan berhibridisasi dengan produk PCR.
18
Salah satu plasmid rekombinan adalah plasmid universal cloning (pUC) yang didesain agar screening rekombinan plasmid lebih efektif dengan menonaktifkan gen galaktosidase yang menghasilkan enzim β-galaktosidase (Ross, 2005).
Gambar 10 Plasmid rekombinan pDrive Cloning Vector
Disamping telah disisipi gen resisten antibiotik, plasmid pUC juga membawa fragmen DNA bakteriofag. Fragmen ini bertanggung jawab pada sintesis langsung Ơ peptida dari ơ-galaktosida yaitu enzim yang berperan dalam memecah galaktosa. Gen Lac-Z memproduksi ơ-galaktosida yang digunakan oleh bakteri dalam metabolisme laktosa (lac+).Bakteri rekombinan (rekayasa) bersifat lac-, dimana mereka tidak dapat memproduksi α-peptid dalam β-galaktosidase sehingga bakteri tersebut tidak mampu mencerna laktosa. Selanjutnya vektor plasmid yang mengandung Lac+ dimasukkan kedalam sel bakteri atau biasa disebut transformasi, sehingga secara fenotip sel bakteri mengalami perubahan menjadi lac+. Transformasi sel merubah koloni bakteri menjadi biru (manifestasi perubahan genetik sel bakteri) pada saat dibiakkan pada media LB yang mengandung ampicilin dan X-gal plus IPTG (bahan yang menginduksi aktivitas
19
METODE
Bahan
Sampel udang vaname
Sampel diperoleh dari dua lokasi tambak yang berbeda yaitu di daerah Situbondo dan Lampung. Sampel udang terinfeksi IMNV diperoleh dari Balai Budidaya Air Payau (BBAP) Situbondo, berupa fiksatif organ udang yang dikoleksi dari tambak udang vaname yang terinfeksi IMNV. Sampel udang vaname terinfeksi IMNV dari Situbondo digunakan untuk deteksi fragmen gen ORF1 IMNV untuk keperluan pembuatan DNA rekombinan IMNV. Aplikasi qRT-PCR IMNV menggunakan sampel udang vaname yang berasal dari Lampung. Sampel udang vaname diambil dari tambak udang di wilayah Lampung Selatan,berukuran 16-17 gram/ekor. Kriteria sampel yang diambil adalah udang vaname yang memiliki gejala klinis dan udang vaname yang tidak menunjukkangejala klinis terinfeksi IMNV (sub klinis).
Bahan dan Primer untuk nested RT-PCR dan real time RT-PCR
Ekstraksi RNA diperoleh dari organ target infeksi IMNV yaitup pleopod, dan jaringan otot khususnya pada ruas abdomen ke-6 udang vaname. Organ tersebut diekstraksi menggunakan Silica extraction solutionTM(Farm Intelligence) untuk mendapatkan ekstrak RNA. Selanjutnya hasil ekstraksi disimpan pada deep freezer -70ºC saat belum digunakan. Pada pembuatan kontrol positif berupa plasmid DNA rekombinan IMNV, ekstrak RNA disintesis terlebih dahulu menjadi cDNA menggunakan primer spesifik IMNV 218F. Sintesis cDNA menggunakan kit ImProm-II RTSystem (PromegaTM).
Pengujian IMNV dengan teknik nested RT-PCR menggunakan 2 pasang primer yang dibuat berdasar urutan basa nukleotida wilayah ORF1 IMNV yaitu 4587F-4914R untuk amplifikasi pertama (first step) dan primer 4725F-4863R untuk nested PCR (OIE 2010). Pengujian ini menggunakan 2 (dua) jenis bahan amplifikasi berupa access quick RT-PCR untuk one step RT-PCR dan GoTaq Green Master Mix (PromegaTM) untuk nested PCR. Salinan pada RT-PCR berupa ekstrak RNA, sedangkan salinan untuk nested PCR berupa produk PCR dari first step RT-PCR. Analisa produk PCR menggunakan gel agarose 1,5% (w/v) dengan pewarna SYBR safe (Invitrogen).
20
Metoda qRT-PCR IMNV TaqMan probe memerlukan kontrol positif IMNV yang terkuantifikasi. Desain primer untuk pembuatan plasmid DNA rekombinan IMNV (IMNVpl) dari wilayah ORF1 IMNV pada urutan nukleotida 218-682.Keseluruhan desain primer untuk pengujian IMNV dengan nested RT-PCR maupun dengan qRT-PCR IMNVTaqMan probedisajikan pada Tabel 1.
Tabel 1 Primer dan probe yang digunakan untuk deteksi virus IMN dengan nested RT-PCR dan qRT-PCR TaqMan probe
Primer Sekuen (5’ - 3’) Referensi
4587 F CGACGCTGCTAACCATACAA First RT-PCR
OIE (2010)
4914 R ACTCGGCTGTTCGATCAAGT
4725 F CGACGCTGCTAACCATACAA Nested PCR
OIE (2010)
4863 R AGCGCTGAGTCCAGTCTTG
218 F GCTGGACTGTATTGGTTGAG Andrade et al., (2007)
682 R AACCAAGTTCTTCTTCTCCAGTT
412 F GGACCTATCATACATAGCGTTTGCA RT-PCR IMNV
TaqMan probe (Qiagen). Urutan nuklelotida IMNV yang akan disisipkan pada vektor kloning adalah sepanjang 464 bp, menggunakan primer 218F – 682R (Andrade et al., 2007). Proses ligasi menggunakan pDrive Cloning vector, dilanjutkan transformasi ke dalam sel kompeten QIAGEN EZ Competent Cells (F'::Tn10(Tcr) proA+B+ lacIqZΔM15 recA1 end A1 hsdR17 (rK12 – mK12 +) lac glnV44 thi-1 gyrA96 relA1).Seleksi koloni rekombinanbakteri E.coliyang telah disisipi vektor plasmidmenggunakan media tumbuh Luria Bertani (LB) agar yang mengandungAmpicilin 1000µg/ml, Xgal dan IPTG. Media LB agar tanpa penambahan Xgal dan IPTG digunakan untuk pemurnian bakteri rekombinan E.coli hasil seleksi koloni. Perbanyakan bakteri E.coli menggunakan media LB cair yang telah ditambahkan Ampicilin.
Purifikasi plasmid bakteri E.coli menggunakan bahan QIAprep® Spin Miniprep Kit (Qiagen). Purifikasi hasil amplifikasi untuk keperluan sekuensing menggunakan ethanol absolut (Sambrook dan Russel, 2001).
Sekuensing menggunakan bahanBig Dye Reaction MixTM(AB Applied Biosystem), hasil purifikasi produk PCR cycle sequencing ditambahkan HI-DI Formamidesebelum digunakan sebagai cetakan. Sekuensing plasmid DNA rekombinan IMNV menggunakan primer spesifik IMNV dan primer promotor vektor. Sesuai dengan vektor plasmid yang digunakan, untuk melihat ketepatan insersi gen target dalam vektor plasmid digunakan primer F-SP6 promoter (5'CATTTAGGTGACACTATAG3’) dan primer R-T7promoter (5' GTAATAC GA CTCACTATAG3’)
Alat
21 ml, serta tip mikro berbagai ukuran (0,5-10 μl, 10-100 μl, 20-200 μl, 100-1000 μl). Peralatan laboratorium yang digunakan disesuaikan dengan kegiatan yang dilaksanakan. Peralatan untuk ekstraksi RNA diantaranya adalah disecting set, pipet mikro, thermal block, micro centrifuge, vortex mixer, dan deep freezer untuk penyimpanan hasilnya. Reaksi amplifikasi berlangsung dalam mesin thermal cyler ABI GeneAmp 9700 (Applied BioSystem), deteksi produk PCR menggunakan mesin elektroforesis set dan visualisasi gel dengan UV doc (UVITEC). Real time RT-PCR menggunakan mesin real time PCR Rotor-Gene Q (Qiagen). Sekuensing menggunakan metoda Sanger dalam mesin sequencer ABI 3130 Genetic Analyser (Applied BioSystem).
Isolasi dan perbanyakan bakteri E.coli memerlukan peralatan glass were khususnya cawan petri dan tabung reaksi, jarum ose, dan inkubator untuk inkubasi bakteri E.coli dalam media LB agar setelah proses transformasi. Bakteri E.coli hasil seleksi koloni ditumbuhkan pada media LB cair dan memerlukan shaking incubator untuk inkubasi, agar pertumbuhannya merata.
Prosedur
Waktu dan Tempat Penelitian
Penelitian berlangsung dari bulan April hingga November 2012. Sampel udang vaname (L.vannamei) yang telah diuji positif IMNV berasal dari BBAP Situbondo, dikirimkan sebagai kandidat gen target yang akan diinsersikan pada pembuatan plasmid DNA rekombinan IMNV.Sampel udang vaname yang akan diuji dengan real time RT-PCR IMNV adalah sampel udang yang berasal dari area tambak di kabupaten Pesawaran, Lampung Selatan. Sampel udang vaname dari Lampung dikoleksi pada kurun waktu antara bulan Mei hingga Oktober 2012.
Identifikasi gen target dilaksanakan di laboratorium Virologi, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan Institus Pertanian Bogor (IPB). Kloning, sekuensingdan optimasi real time RT-PCR IMNV dilaksanakan di laboratorium Balai Uji Standar Karantina Ikan Jakarta.
Desain dan Kerangka Konsep Penelitian
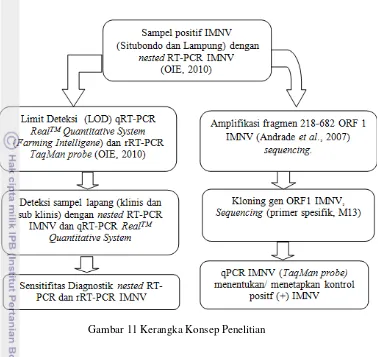
Pengembangan Teknik real time RT-PCR Dan Karakterisasi Molekuler Untuk Deteksi Infectious Myonecrosis Virus (IMNV) pada Udang vaname(Litopenaeus vannamei) didesain melalui beberapa tahapan :
1. Menentukan gen target ORF1 IMNV dengan nested RT-PCR (OIE,2010) dan karakterisasi molekuler,
2. Menentukan LOD IQ RealTMQuantitative System (FarmingIntelligene), 3. Membandingkan sensitifitas pengujian qRT-PCR IMNV dan nested
RT-PCR IMNV pada sampel udang vaname dengan status klinis dan sub klinis terinfeksi IMNV.
22
Gambar 11 Kerangka Konsep Penelitian
Ekstraksi RNA dan Sintesis cDNA
Ekstraksi RNA menggunakan Silica extraction solutionTM(Farming Intelligence). Sampel organ 20 mg dipotong-potong halus di dalam tabung mikro 1,5 ml dan ditambahkan 900µl GT buffer untuk dihomogenkan. Tabung disentrifugasi 12.000 rpm selama 3 menit. Sebanyak 600µl supernatan ditambahkan kedalam 40µl silica, dihomogenkan dengan memvortex selama 20 detik hingga larutan menjadi keruh. Selanjutnya disentrifugasi 12.000 rpm selama 15 detik, dan supernatan dibuang sebelum ditambahkan 1000 µl ethanol 70%. Vortex selama 20 detik hingga keruh, dan sentrifugasi kembali 12.000 rpm selama 15 detik. Supernatan dibuang dan ditambahkan 500 µl DEPC ddH2O, homogenkan dengan memvortex. Inkubasikan pada suhu 55ºC selama 10 menit. Sentrifugasi 12.000 rpm selama 2 menit, supernatan dipindahkan kedalam tabung 1,5 ml baru. Ekstrak RNA dapat disimpan pada suhu -70C sebelum digunakan.
23 berlangsung pada suhu 42°C selama 1 jam. Inaktivasi proses reverse transcriptionpada suhu 70°C selama 15 menit.
Menentukan Fragmen Gen ORF 1 IMNV
Seleksi awal (screening) untuk menentukan sampel positif IMNV menggunakan nested reverse transcription polymerase chain reaction (nested RT-PCR) dengan dua pasang primer 4587F-4914R untuk first step, dan primer 4725F-4863R untuk nested PCR (OIE, 2010). Amplifikasi RT-PCR IMNV ini merupakan one step RT-PCR dimana sampel berupa ekstrak RNA udang vaname ditranskripsi balik (reverse transcription) dengan primer spesifik bersamaan dengan proses amplifikasi. Selanjutnya produk PCR yang dihasilkan digunakan sebagai salinan untuk nested PCR IMNV dengan primer 4725F-4863R. Visualisasi produk PCR dengan gel elektroforesis 1,5% (w/v) agarose pada target pita 328 bp (first step) dan 139 bp (nested PCR). Sampel yang terdeteksi positif IMNV dipisahkan untuk seleksi fragmen gen ORF1 IMNV.
Amplifikasi fragmen gen ORF1 IMNV pada urutan nukleotida 218-682 digunakan kombinasi 2 pasang primer yaitu primer 218F-545R dan 412F-682R sesuai rancangan Andrade et al., (2007). Sampel yang menjadi salinan pada amplifikasi fragmen gen ORF1 IMNV ini berupa cDNA, sehingga sampel berupa ekstraksi RNA harus ditranskripsi balik menjadi cDNA dengan primer spesifik 218F. Formulasi dan profil amplifikasi nested RT-PCR IMNV disajikan pada Tabel 2.
Tabel 2 Formulasi bahan amplifikasi nested RT-PCR IMNV dan ampifikasi fragmen gen ORF1 IMNV (218-682)
(Promega) 12,5 µl Green MastermixGo taq (Promega) NFW hingga volume 25µl NFW hingga volume
25µl
24
semalaman. Selanjutnya produk PCR disentrifugasi 12.000 rpm pada suhu 4 ºC selama 15 menit, ethanol dibuang hingga menyisakan pelet DNA. Pencucian dengan menambahkan ethanol 70% sebanyak 60 µl dan sentrifugasi kembali selama 3 menit. Untuk melarutkan pelet digunakan Nuclease Free Water sebanyak 20-30 µl. Konsentrasi purifikasi diukur menggunakan GenQuant spectrofotometer. Hasil purifikasi ini digunakan untuk sekuensing dan ligasi pada kloning gen.
Karakterisasi Molekuler (Sekuensing)
Penentuan urutan basa DNA (sekuensing) memerlukan produk PCR berupa fragmen DNA yang telah dipurifikasi. Sekuensing menggunakan metode dideoksi pada empat reaksi terpisah. Setiap produk PCR yang disekuensing memerlukan primer tunggal untuk setiap reaksinya. Tahapan sekuensing dimulai dengan amplifikasi hasil purifikasi. Bahan yang digunakan untuk setiap reaksi amplifikasi adalah Big Dye Reaction Mix TM (2,5x) 4 µl, sequen buffer (5x) 2µl, sekuen primer tunggal (F218; R545; F412; R682) 3,2 pmol (~1µl), salinan hasil purifikasi produk PCRproduk PCR 10 ng/100 bp (~1-2 µl), nuclease free water hingga volume akhir 20µl. Keseluruhan bahan dimasukkan dalam tabung 0,2 ml untuk proses amplifikasi (cycle sequencing). Profil amplifikasi cycle sequencing dimulai dengan denaturasi awal pada suhu 96ºC selama 1 menit, 25 siklus 96ºC 10 detik, 50ºC 5 detik, 60ºC selama 4 menit. Setelah proses amplifikasi dilanjutkan dengan purifikasi produk PCR menggunakan ethanol absolut. Ethanol absolut ditambahkan 3 kali volume produk PCR setiap reaksi, dihomogenkan dengan membolak-balik tabung sebelum diinkubasi pada suhu ruang selama 15 menit. Campuran disentrifugasi 2500xg (4000-5000 rpm) untuk mengendapkan DNA. . Supernatan sellanjutnya dibuang dan pelet DNA dicuci dengan menambahkan ethanol 70% sebanyak 3 kali volume produk PCR per-reaksi dan disentrifugasi pada 4000 rpm suhu 4ºC selama 15 menit. Supernatan dibuang dan pelet DNA dikeringkan untuk menguapkan sisa-sisa ethanol selama 10-15 menit.
Denaturasi sampel diawali dengan menambahkan Hi-Di Formamide kedalam tabung sampel hasil purifikasi cycle sequencing. Volume Hi-Di Formamide yang ditambahkan sama banyak dengan volume produk cycle sequencing. Vortex dan spin larutan dilakukan selama 1 menit, selanjutnya sampel dipanaskan pada suhu 95ºC selama 2-5 menit dan segera pindahkan ke dalam es (suhu 4ºC) sebelum dimasukkan kedalam mesin sequencer. Sebanyak 10-13 µl sampel dimasukkan dalam 96 well microplate, dan tutup dengan septa sebelum dimasukkan dalam tray mesin sequencer. Hasil sekuensing tersebut disimpan dalam bentuk ABI file. Hasil sekuen kedua produk PCR 327 bp dan 270 bp digabungkan membentuk urutan nukleotida sepanjang 464 bp.Urutan nukleotida hasil sekuensing diedit secara manual berdasar kromatogram, menggunakan program BioEdit. Homologi dari urutan nukleotida sejenis yang tersimpan dalam database GenBankdianalisis menggunakan program BLAST (Basic Local Alignment Search Tool) (http://www.ncbi.nlm.nih.gov/).
Limit deteksi nested RT-PCR dan real time RT-PCR IMNV.
25 positif IMNV kit IQ-Real adalah 106 salinan virus IMNV, selanjutnya diencerkan hingga 101untuk pembuatan standar kurva pengujian. Standar kurva ini akan digunakan untuk kuantifikasi jumlah salinan virus IMN pada sampel yang diuji dengan kit IQ-Real qRT-PCR IMNV. Limit deteksi qRT-PCR IMNV dengan TaqMan probe belum dapat dibuat standar kurva uji untuk kuantifikasi salinan virus karena kontrol positif IMNV belum terkuantifikasi jumlah salinannya. Limit analitik pengujian IMNV dengan nested RT-PCR dan qRT-PCR IMNV TaqMan probe diperoleh melalui pembuatan seri pengenceran RNA sampel positif IMNV hingga pengenceran 10-3 sebagai template pada pengujian dengan nested RT-PCR dan qRT-PCR IMNV Taqman probe. Pengenceran ini bertujuan untuk memperoleh limit deteksi kedua metoda tersebut. Formulasi bahan amplifikasai sesuai dengan Tabel 3.
Tabel 3 Formulasi bahan dan profil amplifikasi qRT-PCR TaqMan NFW hingga volume 25µl Total volume/ reaksi : 25µl RTsuhu 42ºC 30’; (40 siklus) suhu
93ºC 15”, suhu 60ºC 1’ RT suhu 50°C 30’; 95°C 10’; (40 siklus) suhu 95°C 15”, suhu 60°C 1’
Sensitifitas diagnostik nested RT-PCR dan qRT-PCR IMNV pada sampel udang vaname (klinis dan sub klinis)
Sampel udang vaname dari Lampung yang memiliki gejala klinis dan sub klinis terinfeksi IMNV diperiksa dengan nested RT-PCR dan qRT-PCR IMNV. Sensitifitas uji nested RT-PCR dan qRT-PCR IMNV diperoleh dengan membandingkan hasil pengujian kedua metoda tersebut. Pengujian real time RT-PCR menggunakan kit IQ Real IMNV Quantitative System (Farming Intelligene) yang telah dilengkapi dengan kontrol positif yang terkuantifikasi, sedangkan nested RT-PCR menggunakan 2 pasang primer untuk first step dan nested (OIE, 2010). Deteksi produk PCR dengan gel elektroforesis (1,5% agarose), sampel positif IMNV ditandai dengan munculnya pita DNA 328 bp (first step) dan atau 139 bp (nested) (OIE, 2010).
Kloning fragmen gen ORF1 IMNV