BIOAVAILABILITAS KAROTENOID
EKSTRAK BUAH MERAH (
Pandanus conoideus
Lam.)
PADA HATI DAN PLASMA TIKUS
MATHELDA KURNIATY RORENG
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Bioavailabilitas Karotenoid Ekstrak Buah Merah (Pandanus Conoideus Lam.) pada Hati Dan Plasma Tikus adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2011
ABSTRACT
MATHELDA KURNIATY RORENG. Carotenoid Bioavailability of Red Fruit (Pandanus conoideus Lam.) Extract on Rat Liver and Plasma. Under direction of NURHENI SRI PALUPI and ENDANG PRANGDIMURTI.
Red fruit (Pandanus conoideus Lam.) is a native Papuan fruit. This fruit has potential as functional food because it contains carotenoid compounds that have antioxidant activity and provitamin A activity. The high content of carotenoid in red fruit makes the fruit used empirically to prevent and cure various diseases. However, it has not been known how much carotenoid from red fruit can be absorbed and utilized by the body. This study aims (1) to evaluate the caratenoid bioavailability of red fruit extract; (2) to the determine of the retinol accumulation factor and (3) to determine malondialdehyde content in rat liver. The study was conducted with the approaches of depletion and repletion carotenoid. After 14 week depletion period and 2 weeks repletion period, it was obtained that retinol accumulation factor in red fruit extract group was 49.02 and positive control group was 42.41. This showed that to generate 1 µg retinol in rat liver required 49.02 µg -carotene from red fruit extract and 42.41 µg pure -carotene. Rat liver malondialdehyde content in standards, negative control, positive control, and red fruit extract group respectively 8.97, 25.31, 20.68 and 4β.86 ρmol/g.
RINGKASAN
MATHELDA KURNIATY RORENG. Bioavailabilitas Karotenoid Ekstrak Buah Merah (Pandanus Conoideus Lamk) Pada Hati Dan Plasma Tikus. Dibimbing oleh NURHENI SRI PALUPI dan ENDANG PRANGDIMURTI.
Buah merah (Pandanus conoideus Lam.) merupakan buah spesifik daerah Papua. Kandungan -karoten buah merah yang tinggi menyebabkan buah ini berpotensi dikembangkan sebagai pangan fungsional sumber provitamin A. Data WHO (2009) menunjukkan bahwa tingkat prevalensi defisiensi vitamin A pada anak-anak Indonesia usia balita sangat tinggi, diperkirakan mencapai 4261000 balita (19.6%). Begitu pula pada ibu hamil, tingkat prevalensi defisiensi vitamin A cukup tinggi yaitu sekitar 748000 ibu hamil (17.1%). Akibat dari adanya defisiensi vitamin A ini menyebabkan terjadinya gangguan fisiologis antara lain gangguan pertumbuhan, penglihatan, dan sistim imun yang pada akhirnya akan berpengaruh terhadap produktivitas. Kandungan karotenoid yang tinggi pada buah merah tidak menjamin bahwa keseluruhan komponen tersebut dapat diserap, diubah menjadi vitamin A (retinol) dan dimanfaatkan oleh tubuh.
Tujuan penelitian ini adalah: (1) Mengevaluasi bioavailabilitas karotenoid ekstrak buah merah dengan menentukan faktor akumulasi retinol pada hati tikus setelah mengalami deplesi dan replesi provitamin A; (2) Menguji kapasitas antioksidan ekstrak buah merah dengan cara pengukuran kadar malondialdehida (MDA) hati tikus.
Penelitian dilakukan dengan metode pendekatan deplesi dan replesi vitamin A pada tikus percobaan. Setelah sebelumnya melalui masa adaptasi, pada masa deplesi tikus dikelompokkan menjadi 2 kelompok yaitu kelompok standar yang diberikan ransum standar dan kelompok defisiensi vitamin A yang diberikan ransum tanpa vitamin A. Selama masa deplesi diukur kandungan retinol hati setiap 2 minggu hingga diperoleh penurunan kandungan retinol hati sekitar 95% yaitu pada minggu ke-14. Pada masa replesi selama 2 minggu tikus dikelompokkan menjadi 4 kelompok (n=6) yaitu kelompok standar (ransum AOAC), kelompok kontrol negatif (ransum tanpa vit. A), kelompok kontrol positif (ransum tanpa vit.A + -karoten), serta kelompok ekstrak buah merah (ransum tanpa vit.A + ekstrak buah merah). Jumlah kandungan -karoten dari ekstrak buah merah yang ditambahkan pada ransum setara dengan kandungan -karoten pada ransum kontrol positif yaitu 180 µg per hari. Selanjutnya dilakukan analisis kandungan -karoten pada setiap ransum tikus. Setelah masa replesi seluruh tikus diterminasi dengan cara cervical dislocation. Plasma dan hati tikus dianalisis kandungan retinol dengan menggunakan High Performance Liquid Chromatography (HPLC). Bioavailabilitas karotenoid dievaluasi dengan Faktor Akumulasi Retinol pada hati tikus selama masa replesi, yang ditentukan dengan cara membagi konsumsi ransum -karoten dengan total akumulasi retinol dalam hati.
Akumulasi retinol hati pada kelompok standar, kontrol negatif, kontrol positif, dan ekstrak buah merah masing-masing adalah 442.68 µg, tidak terdeteksi, 27.64 µg dan 19.68 µg. Faktor akumulasi retinol kelompok ekstrak buah merah adalah 42.41 dan kelompok kontrol positif adalah 49.02 yang berarti untuk menghasilkan 1 µg retinol pada hati tikus dibutuhkan 42.41 µg -karoten dari ekstrak buah merah dan 49.02 -karoten murni.
Penurunan retinol plasma selama masa deplesi mencapai 97.93%. Retinol plasma kelompok ekstrak buah merah setelah masa replesi mengalami peningkatan 178.42% dengan kandungan retinol sebesar 0.33 µg/ml. Nilai ini lebih tinggi dibandingkan kelompok standar dan kontrol positif dengan kandungan retinol plasma masing-masing 0.31 µg/ml dan 0.28 µg/ml. Kelompok kontrol negatif menunjukkan penurunan kandungan retinol plasma sebesar 25% dengan nilai 0.09 µg/ml.
Kandungan MDA (malondialdehida) pada hati tikus kelompok standar, kontrol negatif, kontrol positif, dan ekstrak buah merah masing-masing 8.9695 ρmol/gram,β5.γ07β ρmol/gram, 20.6806 ρmol/gram, dan 42.8602 ρmol/g.
Hasil penelitian menunjukkan bahwa bioavailabilitas karotenoid ekstrak buah merah cukup tinggi dengan nilai faktor akumulasi retinol relatif (bioavailabilitas relatif) mencapai 86.52%. Dengan demikian ekstrak buah merah berpotensi dikembangkan sebagai pangan fungsional sumber provitamin A.
@ Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
BIOAVAILABILITAS KAROTENOID
EKSTRAK BUAH MERAH (
Pandanus conoideus
Lam.)
PADA HATI DAN PLASMA TIKUS
MATHELDA KURNIATY RORENG
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Mayor Ilmu Pangan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
HALAMAN PENGESAHAN
Judul Tesis : Bioavailabilitas Karotenoid Ekstrak Buah Merah (Pandanus Conoideus Lam.) pada Hati dan Plasma Tikus Nama Mahasiswa : Mathelda Kurniaty Roreng
NRP : F251060141
Disetujui: Komisi Pembimbing
Dr. Ir. Nurheni Sri Palupi, M.Si
Ketua Anggota
Dr. Ir. Endang Prangdimurti, M.Si
Diketahui :
Ketua Program Mayor Dekan Sekolah Pascasarjana
Ilmu Pangan
Dr. Ir. Ratih Dewanti Hariyadi, M.Sc Dr.Ir. Dahrul Syah,M.Sc.Agr
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Pengasih karena atas berkat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis ini.
Penelitian ini mengkaji Bioavailabilitas Karotenoid Ekstrak Buah Merah (Pandanus Conoideus Lam.) pada Hati dan Plasma Tikus. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah yang mendukung pengembangan buah merah sebagai pangan fungsional yang bermanfaat bagi kesehatan.
Pelaksanaan penelitian ini karena didukung oleh berbagai pihak. Dengan setulus hati penulis menyampaikan terima kasih kepada:
1. Dr. Ir. Nurheni Sri Palupi, M.Si dan Dr. Ir. Endang Prangdimurti, M.Si, selaku komisi pembimbing yang membimbing dalam penelitian.
2. Dr. Ir. Hanifah Nuryani Lioe, M.Si selaku dosen penguji pada sidang tesis. 3. Dirjen Pendidikan Tinggi Republik Indonesia atas Beasiswa Pendidikan
Pascasarjana di Institut Pertanian Bogor.
4. Ayahanda Daniel Kalambo, Ibunda Dina Pakiding serta kedua adik tercinta Kurniawan Prasetya Roreng, SE dan Agung Christian Roreng, S.STP atas segala cinta kasih, doa dan motivasi yang tiada henti.
5. Rekan-rekan IPN 2006, FORMASIP dan Forum Wacana Papua atas
kebersamaan dan kerja samanya.
6. Staf administrasi Mayor Ilmu Pangan dan Teknisi di lingkungan SEAFAST Center yang telah membantu selama masa studi.
Penulis menyadari bahwa tesis ini masih banyak kekurangan oleh sebab itu penulis mengharapkan masukan untuk perbaikan penulisan di masa mendatang. Semoga tesis ini dapat bermanfaat bagi para pembaca.
Bogor, Juli 2011
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 2 Maret 1980 di Jayapura Papua. Penulis adalah anak pertama dari 3 bersaudara dari pasangan Daniel Kalambo dan Dina Pakiding. Penulis menamatkan sekolah di SD Inpres Ridge II Biak, SMP Negeri 2
Biak dan SMU Negeri 1 Biak. Pada tahun 2003 penulis menyelesaikan studi pada Jurusan Teknologi Pertanian Fakultas Pertanian dan Kehutanan, Universitas Hasanuddin di Makassar. Pada tahun 2004 penulis diterima bekerja sebagai staf pengajar pada Jurusan Teknologi Pertanian Universitas Negeri Papua di Manokwari Provinsi Papua Barat. Pada Tahun 2006 penulis diterima sebagai mahasiswa Pascasarjana Program Mayor Ilmu Pangan IPB. Selama menempuh studi di IPB, penulis mengikuti beberapa pelatihan dan seminar. Pelatihan yang diikuti adalah Pelatihan Auditor Sistem HACCP (Hazard Analysis Critical Control Point) yang diselenggarakan di Bogor pada bulan Mei 2007 oleh
M-BRIO Training Body. Penulis juga berkesempatan untuk mengikuti International Seminar Emerging Issues and Technology Developments in Foods and
Ingredients di Jakarta pada bulan September 2010. Pada seminar tersebut penulis
DAFTAR ISI
Bioavailabilitas Karotenoid ... 18
Radikal Bebas dan Kerusakan Sel... 19
Mekanisme Karotenoid Sebagai Antioksidan ... 21
METODE PENELITIAN
DAFTAR TABEL
Halaman
1 Sifat fisikokimia ekstrak buah merah... 6
2 Kandungan senyawa bioaktif buah merah pada beberapa metode ekstraksi ... 6
3 Beberapa macam karotenoid yang mempunyai aktivitas provitamin A 16
4 Angka kecukupan gizi vitamin A (Widyakarya Nasional Pangan dan Gizi VIII) ... 17
5 Komposisi zat gizi ransum standar ... 27
6 Komposisi untuk 1 gram vitamin campuran ... 28
7 Pengelompokan ransum tikus selama pemeliharaan ... 29
8 Data kandungan -karoten ekstrak buah merah yang dperoleh dari metode pengepresan dan modifikasinya ... 37
9 Komposisi per kg ransum pada setiap kelompok perlakuan ... 39
10 Hasil analisis proksimat ransum ... 39
11 Rata-rata konsumsi ransum dan kenaikan berat badan harian masa deplesi 42
12 Rata-rata konsumsi ransum dan kenaikan berat badan harian masa replesi... ... 43
13 Konsumsi -karoten, total retinol hati dan faktor akumulasi retinol... 50
14 Nilai FAR pada beberapa bahan pangan segar ... 51
DAFTAR GAMBAR
Halaman
1 Tanaman buah merah ... 4
2 Beberapa kultivar buah... 4
3 Struktur kimia beberapa jenis hidrokarbon karotenoid ... 9
4 Struktur kimia beberapa jenis oksi karotenoid ... 10
5 Mekanisme penyerapan karotenoid ... 13
6 Pemecahan -karoten menjadi retinaldehida, reduksi retinaldehida menjadi retinol serta oksidasi retinaldehida menjadi asam retinoat ... 14
7 Mekanisme Peroksidasi Lipid ... 21
8 Skema penelitian ... 25
9 Ekstraksi minyak buah merah metode ... 26
10 Ekstraksi minyak buah merah metode pengepresan ... 36
11 Pemeliharaan tikus percobaan ... 40
12 Tikus defisiensi vitamin A... 41
13 Berat badan tikus selama masa deplesi vitamin A... 42
14 Kenaikan berat badan tikus selama masa replesi vitamin A ... 44
15 Berat berat badan tikus selama masa replesi vitamin A ... 44
16 Penurunan kandungan retinol plasma selama masa deplesi ... 45
17 Kandungan retinol plasma setelah masa replesi ... 46
18 Penurunan kandungan retinol hati selama masa deplesi ... 47
19 Kandungan retinol hati setelah masa replesi ... 48
20 Kandungan total retinol hati masa replesi... 49
DAFTAR LAMPIRAN
Halaman
1 Data proksimat kasein ... 64
2 Perhitungan komposisi ransum tikusi ... 64
3 Food intake ... 65
10 Kromatogram standar retinol plasma ... 80
11 Kurva standar retinol plasma ... 80
12 Kromatogram retinol plasma kelompok standar... ... 81
13 Kromatogram retinol plasma kelompok kontrol negatif... 81
14 Kromatogram retinol plasma kelompok kontrol positif ... 82
15 Kromatogram retinol plasma kelompok ekstrak buah merah ... 82
16 Retinol plasma tikus ... 83
17 Kromatogram standar retinol hati... 84
18 Kurva standar retinol hati ... 84
19 Kromatogram retinol hati kelompok standar ... 85
20 Kromatogram retinol hati kelompok kontrol negatif... 85
21 Kromatogram retinol hati kelompok kontrol positif ... 86
22 Kromatogram retinol hati kelompok ekstrak buah merah ... 86
23 Retinol hati tikus ... 87
24 Contoh perhitungan faktor akumulasi retinol (FAR) ... 88
25 Kurva standar kadar MDA hati ... 88
26 Kadar MDA hati tikus Kadar MDA hati tikus ... 89
27 Sidik ragam pengaruh intervensi ransum sumber vit. A terhadap retinol plasma ... 90
28 Sidik ragam pengaruh intervensi ransum sumber vit. A terhadap retinol hati ... 90
29 Sidik ragam pengaruh intervensi ransum sumber vit. A terhadap MDA hati.. ... 90
31 Sidik ragam pengaruh intervensi ransum sumber vit. A terhadap kenaikan berat badan tikus ... 91 32 Sidik ragam pengaruh intervensi ransum sumber vit. A terhadap berat
hati tikus... 91 33 Sidik ragam pengaruh intervensi ransum sumber vit. A terhadap berat
ginjal tikus... 91 34 Sidik ragam pengaruh intervensi ransum sumber vit. A terhadap berat
limpa tikus... 91 35 Sidik ragam pengaruh intervensi ransum sumber vit. A terhadap total
retinol hati ... 92 36 Sidik ragam pengaruh intervensi ransum sumber vit. A akumulasi retinol hati ... 92 37 Sidik ragam pengaruh intervensi ransum vitamin A terhadap konsumsi
ransum selama masa replesi ... 92 38 Sidik ragam pengaruh intervensi ransum vitamin A terhadap konsumsi
-karoten ... 93 39 Sidik ragam pengaruh intervensi ransum vitamin A terhadap faktor
PENDAHULUAN
Latar BelakangBuah merah (Pandanus conoideus Lam.) adalah salah satu jenis buah asli daerah Papua. Buah ini berpotensi sebagai pangan fungsional karena kandungan senyawa karotenoid yang tinggi sehingga bermanfaat bagi kesehatan tubuh. Karotenoid memiliki beberapa aktivitas biologis yaitu aktivitas vitamin A, aktivitas antioksidan, perlindungan dari sinar ultraviolet, pengaturan fungsi imun dan pengaturan pembelahan dan proliferasi sel (Olson 1989). Karotenoid dapat
mencegah beberapa penyakit degeneratif dan kronis seperti hiperkolesterolemia dan penyakit jantung. Hal ini karena adanya aktivitas antioksidan dan kemampuan karotenoid untuk menghambat radikal bebas (Kritchevsky 1999; Cho et al. 2004; Dutta et al. 2005). Beberapa penelitian mengenai khasiat buah merah telah
dilaporkan antara lain secara in vitro ekstrak buah merah dapat menekan proliferasi sel kanker paru A549 dan secara in vivo menekan proliferasi sel LLC (Lewis lung cancer), Sarcoma180 dan A549 pada tikus (Nishigaki et al. 2010). Ekstrak buah merah juga menurunkan proliferasi tumor kelenjar susu mencit C3H secara in vivo (Pujasari et al. 2008), memiliki aktivitas antiproliferasi terhadap sel kanker HeLa dan K-562 secara in vitro (Selly 2008), serta meningkatkan proliferasi sel limfosit mencit baik secara in vitro maupun in vivo (Susanti 2006).
Betakaroten merupakan karotenoid utama yang memiliki aktivitas provitamin A yang berfungsi untuk penglihatan, diferensiasi jaringan, reproduksi, serta imunitas (Ball 2000). Kandungan -karoten yang tinggi pada buah merah menyebabkan buah merah potensial untuk dikembangkan sebagai salah satu pangan fungsional sumber provitamin A. Data WHO (2009) menunjukkan bahwa di Indonesia tingkat prevalensi serum retinol <0.70 µ mol/l cukup tinggi. Nilai tesebut merupakan indikator biokimia resiko defisiensi vitamin A yang mana dari jumlah total balita dan ibu hamil di Indonesia pravelensi defisiensi vitamin A masing-masing mencapai 4261000 balita (19.6%) dan 748000 ibu hamil (17.1%).
mendukung usaha penanggulangan masalah kekurangan vitamin A yang
merupakan salah satu masalah gizi utama di Indonesia.
Kandungan komponen aktif yang tinggi pada suatu bahan pangan tidak menjamin bahwa keseluruhan komponen tersebut dapat diserap dan dimanfaatkan oleh tubuh. Oleh sebab itu diperlukan informasi mengenai bioavailabilitas suatu
komponen aktif bahan pangan. Pengukuran bioavailabilitas dilakukan secara kuantitatif terhadap kegunaan zat gizi dalam membantu proses pertumbuhan dan fisiologi (Zakaria et al. 2000). Pengukuran ini dapat dilakukan dengan memberikan perlakuan deplesi vitamin A pada tikus hingga kondisi defisiensi vitamin A, selanjutnya diberikan perlakuan replesi sumber provitamin A. Bioavailabilitas dinyatakan dengan nilai faktor akumulasi retinol yang diperoleh dengan membandingkan akumulasi retinol hati terhadap konsumsi -karoten selama masa replesi provitamin A. Pengukuran bioavailabilitas karotenoid ekstrak buah merah perlu dilakukan untuk mengetahui jumlah karotenoid yang dapat diserap dan diubah menjadi retinol dalam tubuh, sehingga retinol tersebut dapat dimanfaatkan sebagai vitamin A dan antioksidan.
Tujuan
Tujuan penelitian ini adalah mengevaluasi bioavailabilitas karotenoid dari buah merah secara in vivo. Tujuan khusus penelitian ini adalah :
1. Mengevaluasi bioavailabilitas karotenoid ekstrak buah merah dengan menentukan faktor akumulasi retinol pada hati tikus setelah mengalami deplesi dan replesi provitamin A.
2. Menguji kapasitas antioksidan ekstrak buah merah dengan cara pengukuran kadar malondialdehida (MDA) hati tikus.
Manfaat
TINJAUAN PUSTAKA
Buah Merah (Pandanus conoideus Lam.)Tanaman buah merah (Pandanus conoideus Lam.) berasal dari famili Pandanaceae, genus Pandanus dan spesies Conoideus. Pandanus adalah genus
kompleks palaetropical yang terdiri atas sekitar 600-700 spesies dan umumnya tumbuh pada daerah tropis, terutama di pulau Pasifik, Malaysia dan Australia (Lechat et al. 1996; Jong & Chau 1998; Sadsoeitoeboen 1999).
Tanaman buah merah banyak tersebar di Papua terutama di daerah
pegunungan. Pada habitat aslinya, tanaman buah merah tumbuh baik di dataran rendah (40 m dpl) sampai dataran tinggi (2000 m dpl). Tanaman ini tumbuh bergerombol dan tumbuh dengan baik pada suhu di bawah 17 oC, curah hujan rata 186 mm per bulan, penyinaran matahari 75% serta tekanan udara
rata-rata 896 milibar (mb). Tanaman buah merah tumbuh secara kompetitif di lingkungan dengan kondisi tanah lembab dengan pH netral, suhu 23-33 o
Tanaman buah merah termasuk tanaman berbentuk semak, perdu, atau pohon. Daunnya tunggal berbentuk lanset sungsang, berwarna hijau tua dan letaknya berseling. Batangnya bercabang banyak, tegak, bergetah, dan berwarna coklat bercak putih. Tinggi tanaman ini mencapai 16 m. Akar tanamannya berfungsi sebagai penyokong tegaknya tanaman dan tergolong akar serabut dengan tipe perakaran dangkal. Buahnya panjang dan memiliki bentuk silindris, ujung tumpul, dan pangkal menggantung (Gambar 1). Panjang buahnya antara 96-102 cm dengan diameter 15-20 cm. Bobot buah mencapai 7-8 kg. Buah berwarna merah bata saat muda dan merah terang saat matang. Perkembangbiakkan buah merah melalui pertunasan dan biji. Tanaman buah merah yang tumbuh dan berbuah akan mengeluarkan tunas-tunas di sekitar tanaman induk (Budi & Paimin 2004). Tanaman buah merah mulai menghasilkan buah pada umur 3-5 tahun tergantung jenisnya. Kultivar-kultivar buah pandan yang telah diketahui dan
dibudidayakan oleh masyarakat memiliki waktu berbunga yang berbeda-beda dalam satu tahun. Mulai dari berbunga hingga panen membutuhkan waktu sekitar enam bulan (Orocomna 2003).
C, dan kelembaban udara antara 73-98% (Sadsoeitoeboen 1999).
Gambar 1 Tanaman buah merah (Lisangan 2005)
Ciri morfologi buah merah dalam populasi P. conoideus dapat dibedakan menjadi empat kultivar, yaitu kultivar merah pendek, merah coklat, merah
panjang dan kuning (Sadsoeitoeboen 1999). Komposisi kimia buah merah bervariasi pada berbagai kultivar dan dipengaruhi oleh tempat tumbuh (Sarungallo et al. 2008). Hasil eksplorasi dari 16 kultivar buah merah yang berasal dari
dataran rendah, dataran sedang dan dataran tinggi di Papua menunjukkan bahwa kadar total karoten tertinggi adalah pada daerah dataran rendah dengan total karoten sebesar 594.15-3309.42 ppm. Total karoten buah merah dari dataran sedang berkisar 603,16-857,9 ppm dan dataran tinggi berkisar 332,65-749,06 ppm. Dijelaskan pula bahwa kandungan total tokoferol tertinggi adalah pada buah merah yang berasal dari dataran rendah berkisar 2.294,12-11.917,81 ppm. Sedangkan pada dataran sedang berkisar 964,52-2.853,23 ppm dan pada dataran tinggi berkisar 1848.96-6780.49 ppm.
Buah merah di daerah Papua umumnya dikonsumsi dalam bentuk minyak buah merah. Masyarakat mengolah buah merah dengan cara bakar batu (cara esasi
atau esasouk) dimana buah akan masak setelah lebih dari satu jam pembakaran. Cara memasak ini dilakukan bersama-sama dengan ubi jalar dan sayuran lainnya. Setelah itu buah merah diperas dan hasil perasan ditampung untuk memasak sayur
tumis. Buah ini juga dimanfaatkan sebagai saus untuk penggurih nasi, ubi dan sagu serta digunakan sebagai bahan pewarna makanan (Wiriadinata 1995; Sadsoitoeboen 1999).
Ekstraksi Minyak Buah Merah
Ekstraksi minyak adalah suatu cara untuk mendapatkan minyak atau lemak dari bahan yang diduga mengandung minyak atau lemak. Setiap jenis sumber minyak memerlukan cara ekstraksi yang berbeda antara satu sumber dengan sumber lainnya, dimana dapat dilakukan dengan cara rendering, pengepresan mekanik dan ekstraksi pelarut ( Ketaren 1986).
Cara ekstraksi dengan rendering merupakan suatu cara ekstraksi minyak
atau lemak dari bahan yang mengandung minyak atau lemak dengan kadar air tinggi. Cara ekstraksi ini membutuhkan panas untuk menggumpalkan protein sehingga air akan menguap dan lemak dapat dipisahkan. Rendering dapat dilakukan dengan dua cara yaitu cara wet rendering dan dry rendering. Wet
rendering dilakukan dengan menambahkan sejumlah air selama proses pemanasan
dalam ketel terbuka atau tertutup pada temperatur sekitar 50 oC selama 4-6 jam. Pada proses dry rendering selama pemanasan berlangsung tidak ditambahkan air dalam ketel terbuka yang dilengkapi steam jacket serta alat pengaduk. Pemanasan dilakukan pada suhu 105-110 o
Kandungan minyak pada beberapa kultivar buah merah asal Manokwari bervariasi dimana kandungan minyak buah merah kultivar merah panjang 22.47% (bk), kultivar merah pendek 23.80% (bk), kultivar merah coklat 10.31% (bk) dan kultivar kuning 8.18% (bk) (Sherly 1999). Buah merah mengandung 35.93% minyak (bk) dengan komposisi asam palmitoleat 19.58%, asam stearat 0.38% dan asam oleat 79.92% (Murningsih 1992).
Susanti (2006) melaporkan bahwa metode ekstraksi akan berpengaruh
terhadap sifat fisikokimia ekstrak buah merah. Data selengkapnya pada Tabel 1.
Tabel 1 Sifat fisikokimia ekstrak buah merah
Parameter Satuan Buah segar Metode tradisional
Metode ekstraksi juga sangat berpengaruh terhadap komponen kandungan bioaktif dari ekstrak buah merah yang dihasilkan. Perbandingan data dari beberapa penelitian sebelumnya dapat dilihat pada Tabel 2.
Tabel 2 Kandungan senyawa bioaktif buah merah pada beberapa metode ekstraksi
Metode
Khasiat Buah Merah
Buah merah secara empiris diketahui bermanfaat bagi kesehatan tubuh. Hal ini telah dibuktikan oleh beberapa penelitian. Susanti (2006) melaporkan bahwa ekstrak buah merah yang diperoleh dengan metode pengepresan mampu meningkatkan proliferasi sel limfosit limpa (splenosit) mencit secara in vivo dan in vitro. Pada pengujian secara in vivo jumlah sel limfosit awal adalah 7.9 x 105
(sel/ml kultur sel). Setelah pemberian ekstrak buah merah selama 8 minggu dosis 1.0 ml/ekor/hari, jumlah sel limfosit meningkat menjadi 2.9 x 107 (sel/ml kultur sel). Pada pengujian in vitro jumlah sel limfosit awal pada kultur adalah 2.9 x 106
Ekstrak buah merah juga berpotensi sebagai antikanker. Pengujian aktivitas antikanker ini dilaporkan oleh Mun‘im et al. (2006). Histologi paru-paru hewan uji menunjukkan bahwa pemberian sari buah merah secara statistik tidak menyebabkan perbedaan yang bermakna, tetapi pada dosis 0.21 ml/200 g berat badan mampu menghambat pertumbuhan kanker pada paru-paru tikus hasil induksi 7,12-Dimetilbenz(a)antrasen (DMBA). Dilaporkan pula bahwa fraksi minyak maupun fraksi air yang diperoleh dengan metode pengepresan mempunyai aktivitas antiproliferasi terhadap sel kanker HeLa dan K-562. Aktivitas antiproliferasi kedua fraksi dapat mendekati bahkan melebihi aktivitas yang dimiliki oleh kontrol positif (doxorubicin) pada konsentrasi yang semakin tinggi. Pada pengujian terhadap sel HeLa, aktivitas antiproliferasi fraksi ekstrak buah merah memiliki hasil yang sedikit lebih rendah dari pada kontrol positif (53%) yaitu sebesar 52% pada dosis 20 µ l/ml kultur sel (dosis standar). Namun pada fraksi air menunjukkan hasil yang lebih tinggi 62% pada konsentrasi 40 µ l/ml kultur sel. Selanjutnya untuk pengujian aktivitas antiproliferasi pada sel K-562 diperoleh hasil bahwa fraksi ekstrak buah merah mempunyai aktivitas antiproliferasi yang lebih rendah dari kontrol positif (66%) yaitu 61% untuk konsentrasi 40 µ l/ml kultur sel. Sebaliknya fraksi air menunjukkan aktivitas antiproliferasi yang lebih baik yaitu 77% untuk konsentrasi 40 µ l/ml kultur sel (Selly 2008).
Ekstrak buah merah juga dilaporkan berpengaruh terhadap pertumbuhan tikus dan fungsi hati (Sari 2008). Pada pengujian secara in vivo dilaporkan bahwa
pemberian fraksi ekstrak buah merah dan fraksi air buah merah (metode pengepresan) dengan konsentrasi masing-masing 300 mg/kg BB, 600 mg/kg BB dan 1200 mg/kg BB memiliki nilai tertinggi NPR (Net Protein Ratio), NPU (Net
Protein Utilization) dan BV (Biological Value) pada kelompok tikus yang
diberikan fraksi ekstrak sebesar 1200 mg/kg BB. Pengujian fungsi hati menggunakan fraksi air dan ekstrak buah merah dengan konsentrasi 500 mg/kg BB, 1000 mg/kg BB dan 1500 mg/kg BB menunjukkan hasil terbaik profil darah, kadar MDA dan SGPT/SGOT pada kelompok tikus yang diberikan fraksi ekstrak buah merah dengan konsentrasi 1000 mg/kg BB.
Hasil berbeda mengenai khasiat ekstrak buah merah dilaporkan oleh Djuartina (2006) yang melakukan penelitian mengenai pengaruh pemberian minyak buah merah (MBM) pada hati tikus yang cedera akibat D-galaktosamin. Setelah perlakuan selama 4 minggu, hasil pengukuran malondialdehid (MDA) plasma menunjukan D-galaktosamin ini dapat meningkatkan MDA plasma setiap minggunya. Efek protektif MBM terhadap D-galaktosamin masih ada pada minggu pertama. Hal ini diduga disebabkan oleh antioksidan yang terdapat dalam MBM pada minggu pertama masih dapat menetralisir stres oksidatif yang ditimbulkan oleh D-galaktosamin. Disamping itu, diduga D-galaktosamin belum bekerja maksimal merusak pada minggu pertama. Namun pada akhir penelitian, MDA plasma kelompok MBM + D-galaktosamin lebih tinggi (0.67 µ/ml)
dibandingkan kelompok D-galaktosamin (0.62 µ/ml). Diduga karena stres oksidatif yang ditimbulkan MBM+galaktosamin lebih tinggi dibandingkan D-galaktosamin itu sendiri. Hasil analisis MDA jaringan hati, menunjukkan kandungan MDA hati kelompok kontrol posisitif sebesar 2.71 nmol/g. Pada
Karotenoid
Sifat Fisik dan Kimia Karotenoid
Karotenoid merupakan pigmen alami yang tersebar luas di alam. Karotenoid berkontribusi memberikan warna kuning, oranye, dan ungu pada pangan nabati maupun hewan. Lebih dari 650 karotenoid telah ditemukan dan diisolasi dari berbagai sumber namun hanya 60 jenis yang tersedia dalam pangan dan hanya 20 karotenoid yang dapat dideteksi dalam plasma dan jaringan pada manusia (During & Harrison 2004).
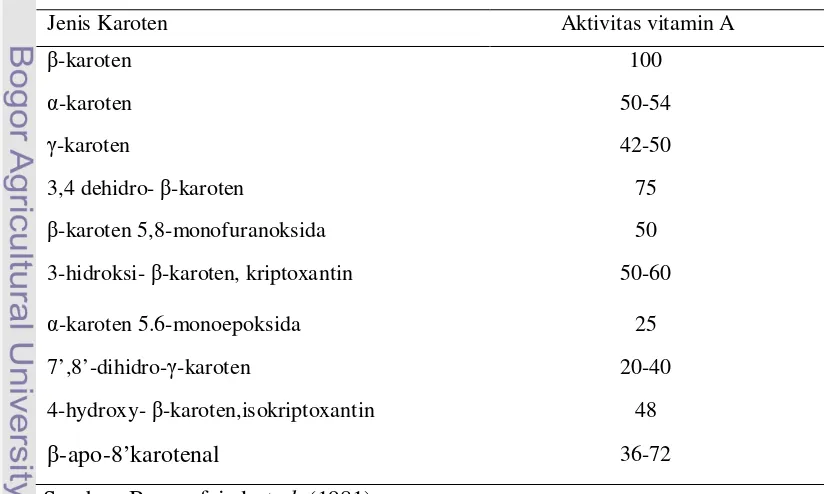
Karotenoid adalah kelompok senyawa yang tersusun dari unit isopren atau turunannya. Berdasarkan unsur-unsur penyusunnya, karotenoid dibagi menjadi dua golongan utama yaitu: (a) golongan hidrokarbon karotenoid yang tersusun oleh unsur-unsur atom C dan H seperti α, , dan -karoten dan (b) golongan oksi karotenoid atau xantofil yang tersusun oleh unsur-unsur atom C, H, OH seperti lutein, violaxantin, neoxantin, zeaxantin dan kriptoxantin. Dari total karotenoid, kadar karoten hidrokarbon umumnya lebih tinggi (60-70%) dibandingkan dengan kadar oksi karotenoid (Bauernfeind et al. 1981).
Karotenoid bersifat larut dalam lemak sehingga larut dalam pelarut lemak seperti heksan, aseton, kloroform, benzene dan petroleum eter. Jenis karotenoid yang paling banyak ditemukan adalah -karoten, lutein, likopen, αkaroten, -kriptoxantin dan zeaxantin (Khacik F et al. 1992). Struktur kimia dari beberapa jenis karotenoid disajikan pada Gambar 3 dan Gambar 4.
-karoten
α-karoten
-karoten
Lutein
-kriptoxantin
Zeaxantin
Rubixantin
Gambar 4 Struktur kimia beberapa jenis oksi karotenoid (Rodriguez & Kimura 2004)
Jenis karotenoid yang paling banyak dijumpai pada bahan pangan adalah -karoten. -karoten merupakan molekul asimetris dimana separuh bagian kiri merupakan bayangan cermin dari bagian kanannya. -karoten mempunyai 40 atom karbon yang terdiri dari 8 unit isoprene, 11 ikatan rangkap dan mempunyai 2 cincin -ionone yang terletak masing-masing satu cincin pada ujung molekulnya (Furr & Clark 1997). α-karoten mempunyai satu cincin -ionone dan satu cincin α-ionone sedangkan -karoten hanya mengandung satu cincin -ionone dan lainnya merupakan cincin terbuka. α-karoten dan -karoten mempunyai aktivitas biologis kira-kira setengah dari nilai -karoten. Karotenoid bersifat stabil di alam. Namun isolatnya mudah mengalami perubahan molekul, isomerisasi dan degradasi oleh panas, cahaya, oksigen, trace element, dan asam (Bauernfeind et al. 1981). Karotenoid memiliki banyak ikatan rangkap sehingga mudah
mengalami degradasi oksidasi. Oksidasi ini terbagi atas oksidasi kimia, autooksidasi, oksidasi cahaya (photooxidation) dan oksidasi enzimatik. Proses
karbon sehingga membentuk asam karboksilat yang akhirnya menentukan sifat
akhir karotenoid. Autooksidasi merupakan reaksi oksidasi spontan antara suatu senyawa dengan oksigen dan atau sinar UV pada suhu kamar, dimana akan terbentuk peroksida dan hidroperoksida. Photooksidasi merupakan reaksi oksidasi yang diinduksi oleh cahaya. Reaksi yang dapat terjadi adalah: 1) kehilangan satu
atau lebih elektron dari suatu senyawa kimia sebagai hasil dari photoeksitasi senyawa tersebut dan 2) reaksi antara suatu senyawa dengan oksigen yang dipengaruhi oleh adanya cahaya. Oksidasi enzimatik yang terjadi secara in vivo dikatalis oleh berbagai enzim. Lipoksigenase merupakan salah satu enzim oksidatif utama pada tanaman. Enzim ini dikatalis oleh molekul oksigen asam lemak tidak jenuh yang mengandung cis,cis-1,4-pentadiene menjadi cis,trans-conjugated hydroperoxida. Enzim ini mengubah pigmen pada jaringan sayuran
seperti klorofil dan karotenoid (Gross 1991).
Rantai poliene konjugasi yang terdapat pada senyawa karotenoid mempengaruhi karakteristik warna senyawa tersebut yang sangat bervariasi mulai dari kurang berwarna (phytoene), kuning (4.4’diaponeurosporene), orange ( -karoten), merah (capsanthin), merah muda (bacterioruberin), dan akan berwarna biru dengan semakin meningkatnya jumlah ikatan rangkap konjugasi (Krinsky et al. 2004).
Faktor-faktor yang Mempengaruhi Kandungan Karotenoid
Peningkatan suhu dan paparan sinar matahari akan meningkatkan karotegenesis pada buah. Iklim tropis sangat mendukung biosintesis karotenoid, yang terlihat dari konsentrasi karotenoid yang tinggi pada buah-buahan tropis (Rodriguez 2001). Gross (1991) menjelaskan pula bahwa tingkat kematangan
merupakan salah satu faktor yang mempengaruhi komposisi karotenoid. Kematangan sayuran dan pemasakan buah-buahan umumnya akan meningkatkan karotenogenesis. Daun muda dan daun tua umumnya memiliki jenis karotenoid yang sama namun berbeda dalam konsentrasi.
produksi. Proses pengolahan dan penyimpanan pangan harus dilakukan secara
optimum untuk mencegah atau mengurangi degradasi komponen yang dapat berpengaruh terhadap bioavailabilitas. Perubahan karotenoid selama pengolahan dan penyimpanan terjadi melalui perubahan fisik (misalnya pengupasan), isomerisasi geometris, reaksi enzimatik atau oksidasi non enzimatik (Rodriguez &
Kimura 2004). Parada dan Aguilera (2007) menjelaskan pula bahwa pengolahan pangan seperti penghancuran (grinding), fermentasi dan pemanasan suhu rendah dapat meningkatkan availabilitas dengan cara merusak dinding sel jaringan, memisahkan kompleks matriks pangan atau nutrisi serta mengubah struktur molekul yang lebih reaktif.
Degradasi -karoten sangat dipengaruhi oleh suhu dan lamanya pemanasan. Semakin tinggi suhu dan semakin lama pemanasan mengakibatkan degradasi -karoten semakin tinggi. Struktur senyawa -karoten yang mempunyai 11 ikatan rangkap yang terkonjugasi mengakibatkan -karoten mudah terdegradasi oleh panas. -karoten yang terdegradasi tersebut menghasilkan senyawasenyawa yang mudah menguap dan tidak mudah menguap. Degradasi -karoten oleh panas menghasilkan 6 jenis senyawa mudah menguap yaitu 2-metil heksana, 3-metil heksana, heptana, siklo oktanona, toluene dan (orto, meta atau para) xilena (Sahidin et al. 2000).
Pencernaan, Penyerapan dan Metabolisme Karotenoid
Karotenoid merupakan molekul yang larut dalam lemak sehingga proses penyerapannya mengikuti jalur penyerapan lemak pangan. Pada proses awal pencernaan, karotenoid akan dilepaskan dari matriks pangan dengan adanya aksi asam lambung dan enzim pencernaan. Pelepasan karotenoid dari matriks pangan
Diet yang mengandung karotenoid provitamin A sebagian dilepaskan dari
protein matriks makanan oleh kerja enzim pepsin lambung dan berbagai enzim proteolitik dalam saluran usus bagian atas. Selama proses dalam saluran pencernaan, karotenoid terdispersi dalam usus bagian atas oleh asam-asam empedu. Sebagian karotenoid telah mengalami esterifikasi dan sisanya masih
dalam bentuk karotenoid bebas. Ester-ester karotenoid, karotenoid bebas dan vitamin A yang terdispersi dalam emulsi lipida membentuk kilomikron dengan bantuan asam empedu, berdifusi ke dalam lapisan glikoprotein membran mikrofili sel-sel epitel usus (Linder 1989). Proses penyerapan terjadi dengan cara difusi pasif. Proses ini membutuhkan kelarutan misel dalam lapisan air di sekitar membran sel mikrofili enterosit. Misel akan berdifusi ke dalam membran dan melepaskan karotenoid dan komponen lipid lainnya pada sitosol sel. Mekanisme menyerapan karotenoid dapat dilihat pada Gambar 5.
Gambar 5 Mekanisme penyerapan karotenoid ( Deming & Erdman 1999)
Setelah penyerapan selesai, -karoten dan karotenoid provitamin A lainnya diubah menjadi vitamin A (retinal) oleh enzim -karoten-15,15’-dioxygenase ( C-15,15’-DIOX). Retinal kemudian direduksi menjadi retinol,
Gambar 6 Pemecahan -karoten menjadi retinaldehida, reduksi retinaldehida menjadi retinol serta oksidasi retinaldehida menjadi asam retinoat (Bender 2003).
Efisiensi penyerapan karotenoid dipengaruhi oleh ada tidaknya komponen lain dalam pangan seperti lemak dan protein (Shiau et al. 1990). Makanan yang mengandung asam lemak tidak jenuh dilaporkan dapat meningkatkan aktivitas
Karotenoid yang telah bergabung dengan sel mukosa intestinal menjadi
kilomikron akan dilepas ke dalam limfa. Kilomikron kemudian dicerna secara cepat oleh lipase lipoprotein dan sisa kilomikron dengan cepat dipindahkan ke hati dan jaringan lainnya. Very Low Density Lipoprotein (VLDL) selanjutnya merupakan pembawa utama karotenoid sehingga low density lipoprotein (LDL)
menunjukkan konsentrasi tertinggi karotenoid di dalam plasma. Karotenoid juga ditemukan pada berbagai jaringan. Walaupun konsentrasi tinggi ditemukan pada kelenjar adrenal dan corpus luteum namun tempat penyimpanan utama karotenoid adalah pada hati dan jaringan adiposa. Karotenoid pangan yang tidak terserap akan dieksresikan melalui feces. Beberapa metabolit karotenoid juga terdeteksi pada feces. Walaupun metabolit polar karotenoid kemungkinan terdapat dalam bentuk konjugasi dan dapat dikeluarkan melalui urin, namun informasi mengenai hal tersebut sangat terbatas (Olson 1994).
Estimasi waktu paruh dilaporkan 11-12 hari untuk likopen, -karoten, α -karoten, lutein dan zeaxantin (Miccozzi et al. 1992). Karena itu perlu dipahami bahwa kemampuan penyerapan karotenoid dan perubahannya menjadi vitamin A tidak sama untuk setiap jenis karotenoid. Karotenoid provitamin A hanya dapat diubah jika dibutuhkan oleh tubuh sehingga mencegah potensi toksisitas akibat kelebihan dosis vitamin A (Dutta et al. 2005).
Efek Biologis Karotenoid
lainnya. Vitamin A juga dibutuhkan untuk pertumbuhan tulang yang normal. Bila
kekurangan vitamin A, pemanjangan tulang akan terhambat. Oleh sebab itu anak-anak yang kekurangan vitamin A akan mengalami pertumbuhan yang terganggu. Bila diberikan suplemen, anak-anak akan memperoleh berat tubuh yang lebih baik dan memiliki tubuh yang lebih tinggi. Vitamin A juga penting untuk pembentukan
enamel pada pertumbuhan gigi (Olson 2001).
Molekul -karoten dapat membentuk dua molekul retinol sedangkan α -karoten dan -kriptoxantin hanya sebagian yang aktif sebagai vitamin A. Nilai Internasional Unit (IU) aktivitas vitamin A didasarkan pada hasil evaluasi biologis kemampuan suatu senyawa untuk mendukung pertumbuhan hewan coba dalam kondisi defisiensi vitamin A (1 IU= 10.47 nmol retinol = 0.3 µg retinol bebas atau 0.344 µg retinil asetat). Karena absorpsi karoten yang relatif rendah dan metabolisme yang tidak sempurna untuk menghasilkan retinol maka 6 µg -karoten dinyatakan sama dengan 1 µg retinol ekuivalen (RE) dimana ratio molar dari 3.2 mol -karoten ekuivalen dengan 1 mol retinol. Saat ini dikenal pula istilah retinol activity equivalent (RAE) yang ditetapkan oleh Institut Medicine (2001). 1 RAE = 1 µg all-trans retinol, 12 µg -karoten dan β4 µg α-karoten atau
-kriptoxantin. Pada basis ini 1 IU aktivitas vitamin A = 3.6 µg -karoten atau 7.2 µg karotenoid provitamin A lainnya (Bender 2003).
Tabel 3 Beberapa macam karotenoid yang mempunyai aktivitas provitamin A
Jenis Karoten Aktivitas vitamin A
-karoten 100
α-karoten 50-54
-karoten 42-50
3,4 dehidro- -karoten 75
-karoten 5,8-monofuranoksida 50
3-hidroksi- -karoten, kriptoxantin 50-60
α-karoten 5.6-monoepoksida 25
7’,8’-dihidro- -karoten 20-40
4-hydroxy- -karoten,isokriptoxantin 48
-apo-8’karotenal 36-72
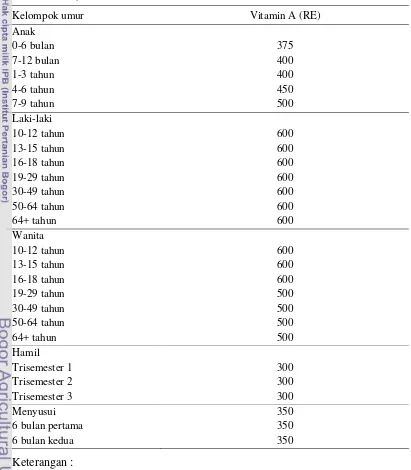
Kebutuhan vitamin A berbeda-beda pada setiap individu tergantung pada
umur dan jenis kelamin serta pada wanita dipengaruhi oleh kondisi khusus seperti masa kehamilan dan menyusui. Kecukupan gizi vitamin A bagi orang Indonesia dapat dilihat pada Tabel 4.
Tabel 4 Angka kecukupan gizi vitamin A (Widyakarya Nasional Pangan dan Gizi VIII)
Kelompok umur Vitamin A (RE)
Anak
1 retinol equivalent ( g RE) = 1 g all-trans-retinol
= β g all-trans- -karoten suplemen = 6 g all-trans- -karoten bahan pangan
Bioavailabilitas Karotenoid
Definsi bioavailabilitas menurut FDA (Food and Drug Administration) adalah kecepatan atau tingkat penyerapan senyawa aktif yang terkandung dalam obat (Shi & Le Maguer 2000). Definisi ini juga berlaku buat senyawa aktif atau nutrisi yang terdapat dalam pangan. Jackson (1997) menjelaskan bahwa bioavailabilitas merupakan fraksi nutrisi tercerna dari pangan yang dapat diserap oleh usus halus, dimetabolisme dan disimpan dalam tubuh. Hal ini dijelaskan pula oleh Boyer & Liu (2004) bahwa walaupun seluruh nutrisi dapat dikonsumsi, namun pada kenyataannya selama pencernaan tidak ada nutrisi yang secara keseluruhan dapat diubah menjadi bentuk yang dapat diserap
Bioavailabilitas nutrisi biasanya ditentukan dalam plasma darah manusia (in vivo assay) sehingga terdapat berbagai faktor yang mempengaruhi antara lain keragaman individu, kondisi fisiologi, dosis, dan adanya komponen makanan lainnya (Faulks & Southon 2005). Bioavailabilitas karotenoid bervariasi dari 10%
pada bahan segar hingga 50% pada minyak dan produk komersial (Deming & Erdman 1999). Papas (1999) menjelaskan bahwa bioavailabilitas karotenoid dari bahan pangan, ekstrak atau produk sintetik sangat beragam karena dipengaruhi oleh proses pengolahan dan penyimpanan pangan.
Penentuan bioavailabilias dapat dilakukan secara in vivo dengan
menggunakan manusia atau secara in vitro yang menirukan kondisi yang terjadi di dalam tubuh. Metode in vivo secara langsung memberikan data bioavailabilitas dan biasanya digunakan untuk pangan dan nutrisi yang memiliki keragaman atau variasi yang tinggi. Respon ditentukan setelah manusia atau hewan percobaan mengkonsumsi nutrisi tunggal (alami atau sintetik) yang kemudian dibandingkan dengan dosis nutrisi yang sama yang berasal dari sumber pangan (Yeum & Russel 2002).
dikonsumsi akan dihasilkan 1 µg retinol. Rumondang (1993) melaporkan pula
bahwa pengujian bioavailabilitas karotenoid pada ubi jalar, nilai FAR ubi jalar goreng sebesar 1/6.62. Hasil ini lebih baik dibandingkan nilai FAR pada ubi jalar rebus yaitu sebesar 1/7.39
Pengujian biovailabilitas karotenoid produk bahan pangan lainnya
dilaporkan oleh Meridian (2000) yang melakukan pengujian terhadap minuman emulsi karoten minyak sawit dengan nilai FAR sebesar 1/9.09. Wylma (2003) menjelaskan pula bahwa pengujian bioavailabilitas karotenoid terhadap bubuk daun cincau hijau menunjukkan nilai FAR sebesar 1/13.21.
Radikal Bebas dan Kerusakan Sel Radikal Bebas
Radikal bebas adalah senyawa oksigen reaktif yang merupakan senyawa dengan elektron yang tidak berpasangan. Senyawa atau atom tersebut berusaha mencapai keadaan stabil dengan jalan menarik elektron lain sehingga terbentuk radikal baru. Reaksi radikal bebas ini berlangsung secara berantai (cascade reaction) (Jakus 2002).
Radikal bebas dapat berasal dari sumber endogenus yaitu pada reaksi reduksi oksidasi normal dalam mitokondria, peroksisom, detoksifikasi senyawa senobiotik, metabolisme obat-obatan dan fagositasi. Sedangkan radikal bebas dari sumber eksogenus berasal dari asap rokok, radiasi, inflamasi, latihan olahraga berlebihan, diet tinggi asam lemak tidak jenuh, dan karsinogen (Langseth 1995).
Radikal bebas dapat bersifat positif dan negatif. Sifat positifnya antara lain dalam jumlah terkontrol berperan dalam proses fungsi biologis, misalnya dalam bakterisidal dan bakteriolisis. Juga beperan sebagai mediator respon terhadap infeksi patogen, sebagai signal apoptosis sel atau jalur signal tranduksi, second messenger serta berperan pada sintesis eikosanoid. Sifat negatif radikal bebas
adalah dapat menyebabkan stres oksidatif. Hal ini terjadi karena terjadi ketidakseimbangan antara radikal bebas dengan antioksidan. Radikal bebas dalam
Pengukuran radikal bebas dalam sistem biologi dilakukan secara langsung
dan tidak langsung. Teknik pengukuran langsung yaitu RPE Resonan Paramagnetik Elektronik (RPE) dan Proton Magnetik Resonansi Resolusi Tinggi (PMRRT). Teknik tersebut menggunakan senyawa yang dapat menangkap sinyal radikal bebas pada sistem in vivo. Pengukuran secara langsung sangat sulit
dilakukan karena radikal bebas bereaksi sangat cepat, sehingga sering dilakukan dengan metode pengukuran tidak langsung melalui pengukuran produk turunan seperti malondialdehida (MDA) dan 4-hidroksinonenal. Dua turunan tersebut sering digunakan untuk pengukuran reaksi radikal bebas lipid (Nabet 1996).
Kerusakan Sel
Kerusakan sel merupakan gangguan atau perubahan yang dapat mengurangi viabilitas dan fungsi esensial sel. Target kerusakan sel yaitu: (1) lipida melalui oksidasi PUFA (poly unsaturated fatty acid) dengan tahapan inisiasi, propagasi dan terminasi; (2) protein (glikoprotein) melalui inaktivasi
enzim, mengikat protein atau reseptor; (3) DNA melalui perusakan penyusun DNA (asam nukleat), lipoprotein, dan karbohidrat pada tahap mutasi, inisiasi dan promosi kanker (Costa et al. 2005).
Stres oksidatif merupakan suatu keadaan yang timbul akibat reaksi metabolik yang menggunakan O2
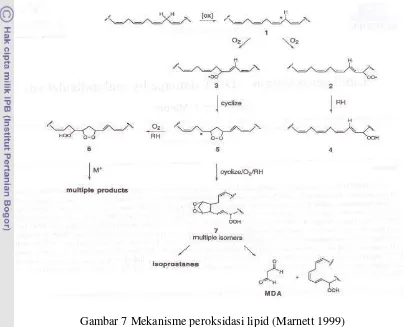
Pengaruh radikal bebas yang diketahui paling awal adalah oksidasi lipid. Oleh sebab itu kerusakan oksidatif karena oksidasi lipid ini paling sering diteliti. Produk oksidasi lipid banyak ditemukan dalam cairan biologis, dapat diukur
, yang mengakibatkan terganggunya sistim
dengan berbagai cara yaitu :(a) aldehida dalam plasma seperti MDA, TBARs dan
4-hidroksinonenal, (b) penurunan PUFA dalam plasma, (c) diena terkonjugasi dalam plasma, (d) hidroperoksida dalam plasma (Winklhofer-Roob et al. 1995). Mekanisme peroksidasi lipid dapat dilihat pada Gambar 7.
Gambar 7 Mekanisme peroksidasi lipid (Marnett 1999)
Mekanisme Karotenoid sebagai Antioksidan
Karotenoid yang dikonsumsi baik dari makanan maupun dari suplemen dapat bersifat sebagai antioksidan melalui quenching singlet oxygen dan scavenging free radical. -karoten merupakan quencher (peredam) singlet oksigen yang paling baik. Menurut Foote (1λ76), 1 molekul -karoten dapat meredam 250-1000 molekul singlet oksigen pada kecepatan 1.3x1010 M-1S-1. Transfer energi dari singlet oksigen ke peredamnya akan menghasilkan pembentukan triplet oksigen dan triplet-state quencher dengan reaksi berikut : 1
O2* + CAR 3O2 + 3CAR*
Kecepatan quenching singlet oxygen oleh karotenoid sangat tergantung pada jumlah ikatan konjugasinya. Faktor lainnya yang berpengaruh adalah jenis
dan jumlah gugus fungsi pada bagian cincin molekul karotenoid yang
berpengaruh terhadap kelarutan karotenoid. Kobayashi dan Sakamoto (1999) membandingkan aktivitas quenching dari -karoten dan astaxanthin, kemudian melaporkan bahwa aktivitas quenching astaxanthin menurun dengan meningkatnya sifat hidrofobik, dan sebaliknya terjadi peningkatan quenching
-karoten. Lebih lanjut Lee dan Min (1990) mengevaluasi efektivitas 5 karotenoid dalam quenching terhadap klorofil dengan sensitizer photooksidasi pada minyak kedelai. Data yang diperoleh menunjukkan efektivitas quenching meningkat dengan semakin banyaknya ikatan rangkap pada karotenoid dan jumlah karotenoid yang ditambahkan. Menurut Beutner et al. (2000), karotenoid dengan 7 atau lebih sedikit ikatan rangkap kurang efektif sebagai quencher karena tidak dapat menerima energi dari singlet oksigen.
Proses autooksidasi seperti peroksidasi lipid berhubungan dengan reaksi rantai radikal yang melibatkan radikal peroksil (ROO ). Antioksidan pemutus rantai tersebut seperti halnya karotenoid dapat menghambat kecepatan dan efisiensi pengikatan (scavenging) radikal bebas dengan reaksi sebagai berikut:
Initiator + RH R (Tahap inisiasi)
Hasil radikal turunan antioksidan (CAR) tidak sesuai untuk propagasi
reaksi. Hal ini antara lain disebabkan oleh tidak terjadinya reaksi abstraksi atom H atau reaksi dengan oksigen membentuk radikal peroksil lainnya (Krinsky et al. 2004).
+ CAR ROOH + CAR (Penghambatan oleh karotenoid)
Packer et al. (2005) melaporkan bahwa terdapat hubungan antara struktur
radikal 2,2’-azino-bis-(3-ethyl-benzthiazoline-6-sulfonate) diammonium salt
(ABTS), karoten dengan 11 ikatan rangkap konjugasi lebih aktif menangkap radikal dibandingkan dengan xantofil (kecuali pada -kriptoxantin).
Pengikatan radikal secara in vivo akan berhubungan dengan pencegahan beberapa penyakit. Konsumsi pangan kaya karotenoid seperti buah-buahan dan
METODE PENELITIAN Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Pengawasan Mutu dan Keamanan Pangan SEAFAST Center, Laboratorium Hewan Percobaan Bersama SEAFAST Center dan Dept. ITP, serta F-Technopark FATETA Kampus IPB
Darmaga Bogor. Penelitian berlangsung dari bulan Maret 2009 hingga Juli 2010.
Bahan dan Peralatan
Bahan utama yang digunakan dalam penelitian ini adalah buah merah jenis merah panjang (kultivar Hityom) berasal dari daerah Manokwari Papua Barat. Bahan-bahan yang digunakan untuk ransum tikus adalah minyak jagung, kasein teknis, selulosa teknis, mineral mix, vitamin mix, maizena dan aquades. Hewan percobaan yang digunakan adalah tikus putih (strain Sprague dawley) jantan berumur 21 hari yang diperoleh dari Badan Pengawas Obat dan Makanan Jakarta. Bahan kimia yang digunakan untuk analisis adalah HCl, H2O, K2SO4, HgO,
H2SO4, NaOH, Na2S2O3, H3BO3
Alat-alat yang digunakan dalam penelitian ini meliputi peralatan ekstraksi minyak, peralatan bedah tikus, peralatan gelas untuk analisis kimia, timbangan analitik OHouse, vortex, sentrifus, oven, tanur, alat destilasi, labu Kjeldahl, labu Soxhlet, rotavapor, kolom C18 (15 cm) Vydac TP501, spektrofotometer Shimadzu UV-VIS 160 (Japan) dan HPLC (High Performance Liquid Chromatography) Shimadzu C-R6A Chromatopac (Japan).
, heksan, KCl, EDTA, aseton, KOH, larutan PBS, TCA, etanol, petroleum eter, asetonitril, dan metanol (Merck USA). Bahan kimia sebagai standar digunakan kristal -karoten (Sigma Germany cat. no C-9750) dan all trans retinol (Sigma Germany cat.no R-7632).
Metode Penelitian
Ekstraksi pengepresan
(modifikasi Andarwulan
et al
. 2006)
Ekstraksi pengepresan
(modifikasi Andarwulan
et al
. 2006)
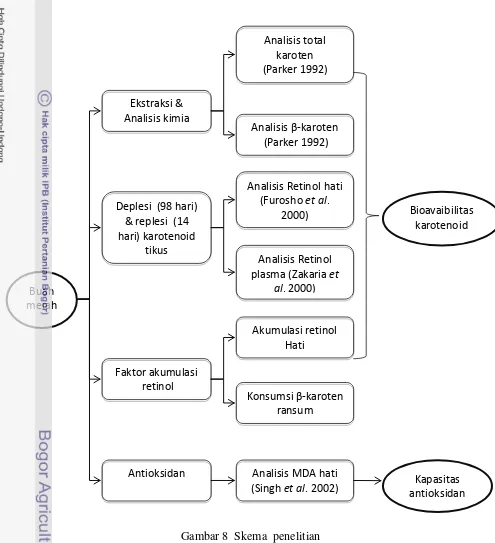
Gambar 8 Skema penelitian
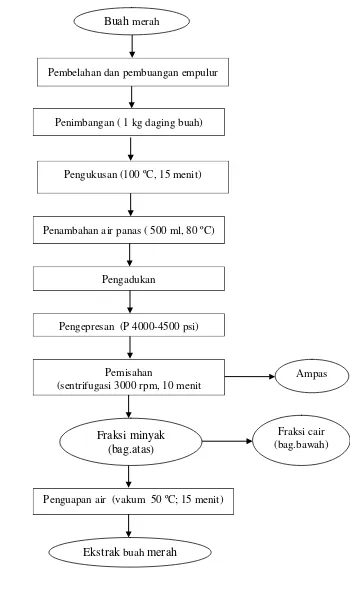
Penelitian Tahap I: Ekstraksi dan analisis kimia minyak buah merah Ekstraksi buah merah dilakukan dengan menggunakan metode pengepresan (Andarwulan et al. 2006) yang telah dimodifikasi (Gambar 9).
Gambar 9 Ekstraksi minyak buah merah Pengepresan (P 4000-4500 psi)
Pemisahan
(sentrifugasi 3000 rpm, 10 menit
Penguapan air (vakum 50 ºC; 15 menit) Pengadukan
Penambahan air panas ( 500 ml, 80 ºC) Pembelahan dan pembuangan empulur
Penimbangan ( 1 kg daging buah)
Pengukusan (100 ºC, 15 menit) Buah merah
Ekstrak buah merah
Ampas
Fraksi cair (bag.bawah) Fraksi minyak
Ekstrak buah merah yang diperoleh kemudian dianalisis kandungan kimia
meliputi total karoten dan -karoten. Data kandungan -karoten ekstrak buah merah yang diperoleh digunakan sebagai acuan untuk menentukan jumlah ekstrak buah merah yang ditambahkan pada ransum tikus perlakuan ekstrak buah merah.
Penelitian Tahap II: Pengujian bioavailabilitas karotenoid ekstrak buahmerah pada tikus percobaan
Pengujian bioavailabilitas karotenoid ekstrak buah merah dilakukan dengan metode pendekatan deplesi dan replesi vitamin A pada tikus percobaan. Pada masa deplesi tikus diberikan ransum tanpa adanya vitamin A hingga mengalami defisiensi vitamin A. Selanjutnya pada masa replesi tikus diberikan ransum dengan kandungan provitamin A yang berupa -karoten murni dan ekstrak buah merah.
(a) Persiapan ransum standar dan ransum tanpa vitamin A
Ransum standar yang digunakan mengacu pada AOAC (2005). Komposisi komponen ransum disajikan pada Tabel 5 sedangkan komposisi vitamin mix diuraikan pada Tabel 6.
Tabel 5 Komposisi zat gizi ransum standar
Komponen Jumlah (%)
Pati Ditambahkan sehingga menjadi 100
Sumber: AOAC (2005).
(b) Persiapan ransum -karoten murni dan ekstrak buah merah
dikonsumsi agar terjadi akumulasi vitamin A di hati yaitu 180 µg -karoten
Asam p-aminobenzoat 10 mg
Inositol 10 mg
Asam nikotinamid 4 mg
Ca-pantotenat 4 mg
Glukosa Untuk membuat 1 gram
Sumber : AOAC (2005).
(c) Perlakuan dan Pemeliharaan Tikus
ransum yang diintervensi dengan ekstrak buah merah. Pengelompokan
ransum tikus selama pemeliharaan dapat dilihat pada Tabel 7.
Tabel 7 Pengelompokan ransum tikus selama pemeliharaan
Kelompok Masa adaptasi Masa deplesi Masa replesi
Kontrol Ransum standar Ransum standar Ransum standar
Kontrol negatif Ransum standar Ransum tanpa vit.A Ransum tanpa vit.A
Kontrol positif Ransum standar Ransum tanpa vit.A Ransum tanpa vit A + -karoten Ekstrak buah merah Ransum standar Ransum tanpa vit.A Ransum tanpa vit
A+ ekstrak buah merah
Ransum diberikan setiap hari pada pukul 16.00 – 20.00 WIB dan sisa ransum ditimbang setiap hari. Air minum diberikan secara ad libitum. Setiap tiga hari berat badan tikus ditimbang. Selama pemeliharaan setiap ekor tikus ditempatkan dalam kandang terpisah untuk memudahkan pemeliharaan.
(d) Pembedahan tikus
Setelah melewati masa replesi selama 2 minggu, seluruh tikus diterminasi dengan cara cervical dislocatio. Proses ini dilakukan secara steril (menggunakan alkohol 70%) dan dilakukan dengan cepat. Darah diambil dari
jantung dengan menggunakan alat suntik, lalu dimasukkan ke dalam tabung darah yang telah berisi antikoagulan dipotassium ethylene diamine tetraacetic acid (K2
Analisis
EDTA). Darah kemudian disentrifus pada 600 g dan plasma yang diperoleh disimpan pada suhu -20 ºC sampai dilakukan analisis retinol. Organ hati diambil dan kemudian ditimbang. Organ hati dibungkus dengan aluminum foil dan disimpan pada suhu -20 ºC untuk selanjutnya dianalisis retinol dan kadar MDA.
Analisi Kadar Protein (AOAC 2005)
Sampel ditimbang dalam labu Kjeldahl lalu ditambahkan 2 g K2SO4, 50 mg
ditambahkan untuk setiap 10 mg sampel di atas 15 mg. Sampel dididihkan selama
1-1.5 jam hingga cairan menjadi jernih. Kemudian didinginkan, ditambahkan sedikit air secara perlahan-lahan dan didinginkan lagi. Isi labu dipindahkan ke dalam alat destilasi dan dibilas 5-6 kali. Air cucian dipindahkan ke dalam alat destilasi. Erlenmeyer 125 ml berisi 5 ml larutan borat jenuh dan 2-4 tetes indikator
(metil merah + metil biru) ditempatkan di bawah kondensor. Ujung tabung kondensor harus terendam di bawah larutan asam borat jenuh. Kemudianalat destilasi ditambahkan 8-10 ml larutan NaOH-Na2S2O3 lalu didestilasi sampai
tertampung kira-kira 15 ml destilat dalam erlenmeyer. Tabung kondensor dan isi erlenmeyer dititrasi dengan HCl 0.1 N sampai terjadi perubahan warna menjadi abu-abu atau biru. Kadar protein yang diperoleh dapat dihitung dengan cara berikut:
Protein (% bb) = % N x faktor konversi (6.25)
Analisis Kadar Lemak (AOAC 2005)
Labu dkeringkan dalam oven bersuhu 105-110 ºC selama 1 jam, kemudian didinginkan dalam desikator dan ditimbang. Sampel dibungkus dengan kertas saring, dimasukkan dalam labu yang berisi heksan. Dilakukan reflux selama 5 jam. Pelarut yang ada dalam labu didestilasi. Selanjutnya labu yang berisi lemak hasil ekstraksi dipanaskan dalam oven suhu 105 ºC. Setelah beratnya konstan, labu beserta lemaknya ditimbang. Kadar lemak dihitung sebagai berikut:
Analisis Kadar Air (AOAC 2005)
Analisis Kadar Abu (AOAC 2005)
Sampel ditimbang dalam cawan pengabuan kemudian dibakar dalam tanur (550 ºC) sampai diperoleh abu berwarna abu-abu atau sampai beratnya tetap.
Analisis Kadar Karbohidrat (By difference)
Penetapan karbohidrat dilakukan dengan perhitungan berikut: Karbohidrat (%) = 100 – (% P + % L + % air + % abu)
Keterangan: P = protein L = lemak
Analisis Total Karoten (Modifikasi Packer 1992)
Sampel ditimbang (± 1 gram) selanjutnya didispersikan 3 ml KOH 5%
dalam metanol di dalam tabung reaksi bertutup. Kemudian tabung berisi sampel divorteks dan dihembus dengan gas N2. Selanjutnya tabung reaksi dipanaskan
pada suhu 60 ºC selama 60 menit di dalam penangas air dengan kondisi gelap. Tabung reaksi kemudian didinginkan dan ditambahkan 2 ml air bebas ion dan 6 ml heksan. Headspace dihembus dengan gas N2,
Bagian bawah ekstrak yang pertama, diekstrak lagi dengan penambahan 6 ml heksan, divorteks dan lapisan atas dipindahkan ke tabung reaksi yang berisi hasil ekstraksi pertama. Ekstraksi dilakukan hingga ekstrak yang diperoleh berwarna pucat. Selanjutnya hasil ekstrak tersebut dicuci dengan aquades dan ekstrak dipindahkan ke tabung bersih lainnya sambil disaring dengan menggunakan sodium sulfat anhydrous.
ditutup dan dikocok dengan tangan selama 1 menit. Sampel selanjutnya divorteks dan larutan bagian atas dipindahkan ke tabung reaksi yang bersih.
acetonitril:metanol = 1:1. Selanjutnya dilakukan pengukuran absorbansi dengan
menggunakan spektrofotometer pada panjang gelombang 450 nm.
Kandungan total karotenoid dalam ekstrak dihitung dengan menggunakan nilai E 1%
Perhitungan :
( 1 cm) untuk -karoten yaitu 2600. Setelah pengukuran absorbansi dilakukan, larutan dievaporasi kembali sampai kering untuk digunakan pada
analisis kandungan -karoten.
T
Keterangan :
10 = faktor konversi dari persen kadar -karoten standar menjadi satuan mg/ml atau g/ l
E 1%1cm
(1:1) pada panjang gelombang 450 nm = 2600
= nilai koefisien ekstingsi -karoten dalam metanol:asetonitril
A = nilai absorbansi
FP = faktor pengenceran pada saat pengukuran absorbansi
V = volume yang diukur absorbansinya (µl)
B = berat sampel yang dianalisis total karotenoidnya (g)
Analisis β-karoten (Modifikasi Packer 1992 )
Sampel yang telah dianalisis total karoten selanjutnya dievaporasi kembali dan dilarutkan dalam 1 ml fase gerak asetonitril:diklorometan:metanol (60:35:5). Selanjutnya sampel sebanyak 20 µ l disuntikkan ke dalam kolom C18 HPLC dengan detektor yang digunakan adalah UV-VIS, panjang gelombang 450 nm dan laju alir 1 ml/menit
Persiapan Standar β-karoten
sebagai berikut:
10 (mg/ml) =
2600 absorbansi pada 450 nm konsentrasi -karoten semu
Larutan konsentrasi semu tersebut kemudian diinjeksikan pada HPLC dengan fase gerak asetonitril:diklorometan:metanol (60:35:5) untuk mendapatkan persen kemurnian all trans -karoten pada 450 nm. Kemudian persen kemurnian dikalikan dengan konsentrasi -karoten semu sehingga diperoleh konsentrasi -karoten yang sesungguhnya. Selanjutnya dibuat seri larutan standar -karoten (6.7, 3.35, 1.675, 0.8375 µg/g) yang kemudian diinjeksikan pada HPLC sehingga diperoleh kurva standar -karoten.
Analisis Retinol Plasma (Zakaria et al. 2000)
Plasma sebanyak 0.5 ml ditambahkan 0.5 ml etanol dan kemudian
dicampurkan. Selanjutnya ditambahkan 4 ml heksan dan dicampurkan dengan cara divorteks. Ekstraksi dilakukan sebanyak dua kali. Filtrat yang diperoleh dievaporasi dengan rotavapor. Kemudian residu kering dilarutkan dalam 1 ml fase
gerak metanol:acetonitril (1:1). Sebanyak 20 µl sampel diinjekkan ke dalam
kolom C18 HPLC dengan detektor yang digunakan adalah UV-VIS, panjang gelombang 325 nm dan laju alir 1 ml/menit.
Analisis Retinol Hati (Furusho et al. 2000)
Sampel hati sebanyak 0.5 gram disaponifikasi dengan 30% KOH dalam etanol yang mengandung 0.5% BHT (4 ml) selama 30 menit dengan suhu 60 ºC. Setelah dingin, ditambahkan 4 ml aquades dan diekstrak dengan menggunakan pelarut heksan sebanyak 4 ml. Ekstraksi ini diulang sebanyak 3 kali. Kemudian
hasil ekstrak dicuci dengan 4 ml air dan dikeringkan dengan sodium sulfat anhydrous. Larutan selanjutnya dikeringkan dengan rotavapor. Sampel dilarutkan
kembali dengan 1 ml fase gerak metanol:acetonitril (1:1) dan selanjutnya 20 µl
Persiapan Standar Retinol
Kristal all-trans retinol ditimbang sebanyak 100 mg dalam labu takar 100 ml, dilarutkan dengan sempurna dalam 100 ml acetonitril-isopropanol (65:35), kemudian dibuat satu seri larutan standar retinol yang selanjutnya diinjeksikan pada HPLC sehingga diperoleh kurva standar retinol.
Analisis Kadar MDA (Singh et al. 2002) Preparasi sampel hati
Sebanyak 1.25 g hati dicacah dalam kondisi dingin dalam 5 ml larutan PBS (phosphat buffer saline) yang mengandung 11.5 g/L KCl. Homogenat yang dihasilkan kemudian disentrifugasi pada 4000 rpm hingga diperoleh supernatan jernih.
Prosedur Pengukuran
Sebanyak 0.5 ml supernatan hati ditambah 2 ml HCl dingin (0.25 N) yang mengandung 15% TCA, 0.38% TBA dan 0.5% BHT. Campuran dipanaskan menggunakan waterbath dengan suhu 80 ºC selama 1 jam. Setelah dingin, campuran disentrifugasi pada 3500 rpm selama 10 menit. Absorbansi supernatan diukur menggunakan spektrofotometer pada panjang gelombang 532 nm. Sebagai larutan standar digunakan TEP (tetraetoksipropana).
Penentuan Faktor Akumulasi Retinol (FAR) (Zakaria et al. 2000)
Faktor akumulasi retinol diperoleh dengan menghitung ratio total akumulasi retinol hati terhadap total -karoten ransum yang dikonsumsi selama masa replesi.
Untuk menghitung faktor akumulasi retinol menggunakan rumus berikut:
KRHr - KRHo FAR =
BK
Keterangan :
FAR = faktor akumulasi retinol
KRHr = kandungan total retinol hati akhir replesi (µg)
KRHo = kandungan total retinol hati awal replesi/akhir deplesi (µg)
BK = total -karoten yang dikonsumsi selama replesi (µg)
Faktor akumulasi retinol relatif diperoleh dengan membandingkan faktor akumulasi retinol kontrol positif dan perlakuan ekstrak buah merah, dengan rumus sebagai berikut :
FAR kelompok kontrol positif
FAR relatif (%) = x 100% FAR kelompok ekstrak buah merah
Analisis Statistik
HASIL DAN PEMBAHASAN Komposisi Kimia Ekstrak Buah Merah
Ekstrak buah merah pada penelitian ini diperoleh dari hasil ekstraksi metode pengepresan dengan rendemen 8%. Ini berarti dari 100 g pipilan daging buah merah dapat dihasilkan 8 g ekstrak. Rendemen ini lebih rendah dibandingkan
dengan rendemen dari metode ekstraksi lainnya terutama ekstraksi secara wet rendering yang menghasilkan rendemen 15.92% (Murtiningrum 2004). Namun metode pengepresan ini merupakan metode terbaik untuk mempertahankan kandungan -karoten yang mudah rusak akibat pengaruh pemanasan. Menurut Andarwulan et al. (2006), ekstraksi buah merah dengan metode pengepresan merupakan metode yang lebih tepat dalam mengekstrak minyak buah merah dibandingkan dengan metode tradisonal (pemasakan dan pemanasan) dan metode modifikasi suhu pemasakan. Dilaporkan bahwa kandungan -karoten ekstraksi pengepresan adalah 458γ ppm sedangkan -karoten pada ekstraksi tradisional sebesar 1852 ppm.
Data yang diperoleh dari analisis kimia ekstrak buah merah menunjukkan
bahwa total karoten ekstrak buah merah adalah 2658.55 ppm. Sedangkan kandungan -karoten sebesar 102.71 ppm. Data kandungan -karoten ini menunjukkan hasil yang lebih rendah dengan data yang dilaporkan pada beberapa penelitian sebelumnya yang berkisar antara 123-4583 ppm (Budi 2001;
Murtingrum 2004; Andarwulan et al. 2006). Secara khusus untuk membandingkan kandungan -karoten ekstrak buah merah dari metode pengepresan, data dari beberapa penelitian dapat dilihat pada Tabel 8.
Tabel 8 Data kandungan -karoten ekstrak buah merah yang dperoleh dari metode pengepresan dan modifikasinya.
Perlakuan Kandungan -karoten
(ppm) Sumber
Pengepresan basah (pasta kering dengan perbandingan bahan dan air 1:4)
604.53 Pohan dan Wardayani 2006.
Pengepresan kering (kukus dan blender)
655.17 Pohan dan Wardayani 2006.
Pengepresan dengan perbandingan bahan dan air (1:2)
4583.00 Andarwulan et al. 2006
Tabel 8 menunjukkan bahwa terdapat variasi yang sangat tinggi pada hasil analisis -karoten ekstrak buah merah dengan metode ekstraksi pengepresan dengan berbagai modifikasinya. Hasil tersebut sangat dipengaruhi oleh jenis kultivar buah merah, tempat tumbuh, cara preparasi awal serta metode analisis -karoten yang digunakan. Buah merah yang digunakan pada penelitian ini adalah jenis Hityom yang berasal dari daerah Manokwari Papua Barat sedangkan buah
Ransum Tikus
Komposisi ransum tikus pada penelitian ini didasarkan pada Asssociation of Official Analytical Chemistry (2005). Ransum tikus dibedakan menjadi 4
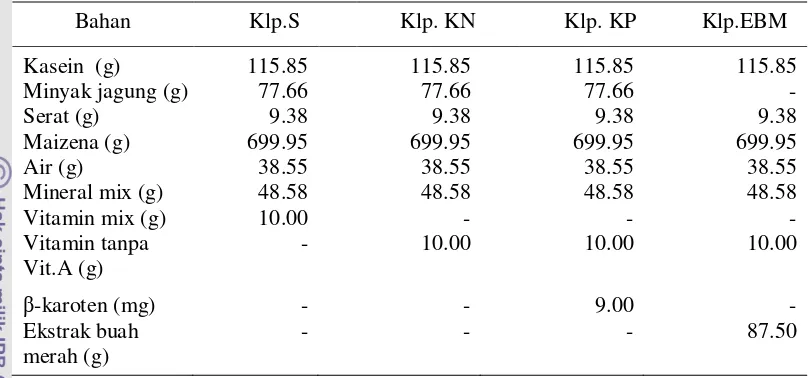
macam ransum sesuai dengan kelompok perlakuan tikus. Kelompok standar (S) mendapatkan ransum standar AOAC selama pemeliharaan. Tiga kelompok
lainnya mendapatkan ransum tanpa vitamin A pada masa deplesi. Pada masa replesi, kelompok kontrol negatif (KN) tetap mendapatkan ransum tanpa vitamin A. Kelompok kontrol positif (KP) mendapatkan ransum tanpa vitamin A yang diintervensi dengan -karoten murni sedangkan kelompok ekstrak buah merah (EBM) mendapatkan ransum tanpa vitamin A yang diintervensi dengan ekstrak buah merah.
Jumlah intervensi bahan sumber vitamin A pada ransum tikus disesuaikan dengan kebutuhan harian vitamin A tikus yaitu 180 µg per hari (Moore 1969). Dari hasil perhitungan (Lampiran 2) diketahui bahwa -karoten murni yang ditambahkan pada setiap ransum tikus (20 g/hari/tikus) adalah 0.18 mg. -karoten terlebih dahulu dilarutkan dalam minyak jagung sebelum dicampurkan dengan bahan ransum lainnya. Ekstrak buah merah yang ditambahkan adalah sebesar 1.75 g dimana ekstrak tersebut langsung dicampurkan dengan bahan lainnya. Komposisi ransum tikus untuk setiap dikelompok dapat dilihat pada Tabel 9.
Hasil analisis kandungan -karoten ransum kontrol positif adalah 3.94 µg/g sedangkan ransum kelompok ekstrak buah merah adalah 3.96 µg/g. Hasil ini menunjukkan bahwa terjadi penurunan kandungan -karoten sebesar 56.23% pada ransum kontrol positif ( -karoten) dan 56% pada ransum yang diintervensi ekstrak buah merah. Karotenoid memiliki banyak ikatan rangkap sehingga mudah mengalami oksidasi. Dalam hal ini yang terjadi adalah autooksidasi yang merupakan reaksi spontan antara senyawa dengan oksigen. Proses ini dapat
Tabel 9 Komposisi per kg ransum pada setiap kelompok perlakuan
Ket: S=standar, KN=kontrol negatif, KP=kontrol positif, EBM=ekstrak buah merah
Analisis proksimat dilakukan terhadap ransum tikus. Data yang diperoleh menunjukkan komposisi ransum yang tidak berbeda nyata antara setiap jenis ransum (Tabel 10).
Tabel 10 Hasil analisis proksimat ransum
Ransum Kadar Air
Kondisi Tikus Selama Masa Adaptasi
Seluruh tikus mengalami masa adaptasi selama 10 hari. Tujuan adaptasi adalah untuk menyesuaikan kondisi tikus dengan lingkungan yang baru
Gambar 11 Pemeliharaan tikus percobaan
Rata-rata berat badan tikus pada awal masa adaptasi adalah 54.56 g dan berat badan tikus pada akhir adaptasi mencapai 86.17 g. Beberapa tikus tidak
mengalami kenaikan berat badan dan beberapa diantaranya bahkan mengalami penurunan berat badan selama masa adaptasi. Hal ini disebabkan karena tikus-tikus tersebut kurang dapat beradaptasi dengan cepat sehingga menimbulkan stres yang berpengaruh terhadap pola makan dan metabolisme tubuh tikus. Namun pada akhir masa adaptasi, pertumbuhan dan peningkatan berat badan tikus-tikus tersebut kembali normal.
Masa adaptasi diakhiri dengan terminasi 2 ekor tikus untuk melihat status awal retinol plasma dan hati tikus sebelum perlakuan penelitian. Rata-rata kandungan retinol plasma tikus adalah 5.81 µg/ml. Sedangkan rata-rata kandungan retinol hati tikus adalah 3.75 µg/g.
Kondisi Tikus Selama Masa Deplesi