PENGARUH NISBAH REAKTAN LIGNIN-NaHSO
3DAN pH
PADA PRODUK NATRIUM LIGNOSULFONAT
TESAR DZIKRULLOH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
TESAR DZIKRULLOH. Pengaruh Nisbah Reaktan Lignin-NaHSO3 dan pH pada Produk
Natrium Lignosulfonat. Dibimbing oleh Dra. GUSTINI SYAHBIRIN, MS dan Drs. DUDI TOHIR MS.
Lignin diisolasi dari lindi hitam dengan pereaksi H2SO4 20%. Sulfonasi terhadap
lignin menghasilkan NaLS yang dapat dimanfaatkan sebagai zat pendispersi, pengikat, penukar ion, dan aditif pada beton. Pada penelitian ini dilakukan sulfonasi terhadap lignin dengan nisbah reaktan lignin-NaHSO3 1:0.4, 1:0.5, dan 1:0.6 dan pH awal 5, 6, atau 7.
Parameter yang diamati ialah kemurnian, pH akhir, dan Rendemen NaLS. Kenaikan pH awal meningkatkan pH akhir dan rendemen NaLS, tetapi menurunkan kemurniannya. Kenaikan nisbah lignin-NaHSO3 meningkatkan rendemen dan menurunkan kemurnian,
tetapi tidak berpengaruh pada pH akhir NaLS. Kondisi optimum yang dipilih pada pH awal 6 dan nisbah lignin-NaHSO3 1:0.6. Pencirian gugus fungsi menggunakan
spektrofotometri inframerah menunjukkan telah terjadi reaksi sulfonasi terhadap lignin. Hal ini dapat dilihat dengan terbentuknya serapan baru pada bilangan gelombang 626 nm yang menunjukkan ikatan C–S.
ABSTRACT
TESAR DZIKRULLOH. Study The Influence of Reactant Ratio Lignin-NaHSO3 and pH
Towards Sodium Lignosulfonate Product. Supervised by Dra. GUSTINI SYAHBIRIN, MS and Dr. DUDI TOHIR, MS.
Lignin was isolated from black liquor using H2SO4 20%. Sulfonation of lignin
produced NaLS which can be used as dispersants, binders, ion exchangers, and concrete additives. In this research, sulfonation was carried out towards lignin with ratio of lignin-NaHSO3 of 1:0.4, 1:0.5, and 1:0.6, and initial pH of 5, 6, or 7. Parameters observed were
purity, final pH, and yield of NaLS. The upsurge of initial pH increased the final pH and NaLS yield, but decreased its purity. The upsurge of ratio of lignin-NaHSO3 increased
NaLS yield and decreased its purity, but did not affect the final pH of NaLS. The chosen optimum condition was on pH of 6 and ratio of lignin-NaHSO3 of 1:0.6. Characterization
PENDAHULUAN
Latar Belakang
Perkembangan industri pulp dan kertas dari tahun ke tahun semakin meningkat seiring dengan meningkatnya permintaan. Permintaan dunia untuk berbagai jenis kertas pada tahun 1990 sebesar 239,428,000 juta ton dan meningkat menjadi 369,085,000 juta ton pada tahun 2005 (Pulp and Paper Industry 2006). Produksi pulp Indonesia pada tahun 2006 sebesar 5.7 juta ton dan meningkat menjadi 5.8 juta ton pada tahun 2007 (Indra 2007). Peningkatan produksi pulp dan kertas juga diikuti oleh meningkatnya masalah pencemaran lingkungan.
Pulping adalah proses pemisahan serat selulosa dari bahan-bahan berlignoselulosa baik kayu maupun nonkayu dengan cara kimia, mekanis, atau semikimia. Pulping cara kimia melibatkan bahan kimia, di antaranya proses sulfit, kraft, dan soda. Pulping cara mekanis dapat berupa penggilingan atau asah batu dan thermomechanical pulping, sedangkan pulping cara semikimia merupakan gabungan dari cara kimia dan mekanik, misalnya proses soda dingin, soda panas, dan semikimia sulfit netral (TAPPI 2003; Klyosov et al. 1997).
Hasil samping proses pembuatan pulp ialah larutan sisa pemasak berupa limbah cair yang dikenal dengan lindi hitam (black liquor) yang secara potensial dapat mencemari lingkungan. Limbah industri pulp tersebar ke seluruh ekosistem dan menema. Menurut Rudatin (1989), belum banyak manfaat yang dapat diambil dari lindi hitam kecuali dibakar kembali untuk memperoleh nilai kalornya. Pemanfaatan lindi hitam menjadi bahan-bahan yang bernilai ekonomis umumnya sangat tergantung pada bahan-bahan pembantu serta proses yang digunakan, yang biasanya sangat mahal. Pengolahan lindi hitam di dalam industri pulp dan kertas umumnya berorientasi pada upaya pemanfaatan kembali bahan kimia pemasak yang terkandung di dalamnya, sedangkan seluruh senyawa organik dalam lindi hitam dimanfaatkan sebagai bahan bakar (Lubis 2007).
Lignin merupakan komponen terbesar dalam lindi hitam sekitar 46% dari padatan totalnya (Sjostrom 1995). Reaksi sulfonasi terhadap lignin menghasilkan lignosulfonat (Syahmani 2000). Lignosulfonat antara lain digunakan sebagai pengatur viskositas pada pengeboran minyak (Fengel & Wegener
1995), potensi penggunaan lignosulfonat ini sangat besar untuk sumur-sumur minyak di Indonesia (Syahmani 2000). Jain & Kulkarni (1991) menyatakan bahwa hidrofilisitas gugus sulfonat menyebabkan lignosulfonat dapat berfungsi sebagai zat pendispersi, pengikat, penukar ion, dan zat aditif pada beton.
Penelitian ini bertujuan mengkaji pengaruh nisbah reaktan lignin-natrium bisulfit (NaHSO3) dan pH pada produk
natrium lignosulfonat (NaLS).
TINJAUAN PUSTAKA
Lindi Hitam
Lindi hitam merupakan limbah cair yang berwarna coklat kehitaman, berbau seperti telur busuk dengan persen padatan 2.0– 80.0%, pH 10–13, bobot jenis 1.02–1.60 g/ml yang dihasilkan dari pembuatan pulp (Weyerhaeuser 2004). Pulping merupakan proses pelarutan lignin untuk memisahkan selulosa.
Menurut Sjostrom (1995), lindi hitam merupakan campuran sangat kompleks yang mengandung sejumlah besar komponen dengan struktur dan susunan yang berbeda. Bahan organik dalam lindi hitam yang dihasilkan setelah pembuatan pulp pada dasarnya terdiri atas lignin, produk-produk degradasi karbohidrat, ekstraktif, dan produk-produk hasil reaksi.
Lignin
Gambar 1 Struktur p-koumaril alkohol (a), koniferil alkohol (b), dan sinapil alkohol (c) (Sjostrom 1995).
Fenger dan Wegener (1995) menyatakan bahwa p-koumaril alkohol, koniferil alkohol, dan sinapil alkohol merupakan prekursor pembentuk lignin (Gambar 1). Lignin dapat dibagi menjadi beberapa kelas menurut unsur-unsur strukturnya, yaitu (Sjostrom 1995; Achmadi 1990):
a. Lignin guaiasil: terdapat pada kayu lunak, sebagian besar merupakan produk polimerisasi dari koniferil alkohol (Gambar 2).
b. Lignin guaiasil-siringil: terdapat pada kayu keras dan rerumputan, didominasi oleh produk polimerisasi dari kopolimer koniferil alkohol dan sinapil alkohol.
Gambar 2 Model struktur lignin guaiasil (Santoso 2003).
Lignin berbentuk amorf dan berwarna coklat cerah. Lignin tidak larut dalam air, asam, dan hidrokarbon. Karena sifatnya tidak larut dalam asam, asam sering digunakan untuk uji kuantitatif lignin. Lignin tidak dapat mencair, tetapi dapat melunak dan kemudian menjadi hangus bila dipanaskan. Lignin yang diperdagangkan larut dalam alkali encer dan dalam beberapa senyawa organik (Santoso 1995).
Kurang lebih setengah dari bahan organik yang terdapat dalam larutan sisa pemasak pulp adalah lignin. Berbagai teknik isolasi telah dipelajari, namun pada prinsipnya sama, yaitu diawali dengan proses pengendapan padatan. Menurut Sjostrom (1995), isolasi lignin dibedakan menjadi 3 metode, yaitu isolasi dengan metode pengasaman, metode enzimatis, dan metode asah batu.
Pereaksi yang biasa digunakan untuk mengendapkan lignin ialah H2SO4 pekat dan
HCl pekat (Salminah 2001). Pengendapan lignin dalam larutan sisa pemasak terjadi sebagai akibat terjadinya reaksi kondensasi pada unit-unit penyusun lignin, yaitu p -koumaril alkohol, koniferil alkohol, dan sinapil alkohol.
Proses isolasi lignin dengan metode pengasaman banyak digunakan untuk mendapatkan lignin dengan kemurnian yang tinggi (Kim et al. 1987). Asam dengan konsentrasi 20% menghasilkan rendemen dan kemurnian yang tinggi (Ibrahim et al. 2004; Lubis 2007).
Proses isolasi lignin meliputi:
1. Pengendapan lignin dengan H2SO4 20%.
2. Pelarutan endapan lignin dengan menggunakan NaOH 1 N. 3. Pengendapan kembali dengan menggunakan H2SO4 20%.
4. Pencucian dengan H2SO4 0.01 N.
5. Pencucian dengan air deionisasi. 6. Pengeringan dengan oven.
Lignosulfonat
Lignosulfonat adalah turunan lignin yang mengandung gugus sulfonat pada rantai propana (Gambar 3). Lignosulfonat dapat diisolasi dari lindi hitam proses sulfit dengan ultrafiltrasi. Lignosulfonat berbobot molekul tinggi terkonsentrasi, sedangkan senyawa yang berbobot molekul rendah, seperti asam hidroksi dan ekstraktif, dilewatkan melalui membran (Jain & Kulkarni 1991).
CH CH CH2OH
OH OCH3
CH CH CH2OH
OH
CH CH CH2OH
OH H3CO OCH3
b
c
a
α γ3 1
4 5
3
HC CH2
CH2
SO3Na NaO3S
OH
Gambar 3 Lignin tersulfonasi pada posisi
C-α dan C-γ.
Lindi hitam yang dihasilkan melalui proses soda tidak mengandung lignosulfonat tetapi mengandung lignin. Oleh karena itu, untuk menghasilkan lignosulfonat dilakukan sulfonasi terhadap lignin. Tujuan sulfonasi adalah meningkatkan hidrofilitas lignin yang tidak larut dalam air dengan cara memasukan gugus sulfonat yang lebih polar dibandingkan dengan gugus hidroksil (Syahmani 2000).
BAHAN DAN METODE
Alat dan Bahan
Bahan-bahan yang digunakan ialah larutan sisa pemasak pulp (lindi hitam) proses soda (NaOH) dari industri kertas PT Kertas Padalarang, NaHSO3, H2SO4, NaOH,
kertas saring, akuades, kertas pH, NaCl, HCl, etanol, larutan CuSO4, larutan Pb-asetat netral, tartrat alkalis, indikator fenolftalein, dan metil jingga.
Alat-alat yang digunakan antara lain cawan, gelas ukur, Erlenmeyer, corong kaca, neraca analitik, mortar, pengaduk, oven, pendingin tegak, penangas air, pompa vakum, corong Büchner, alat sentrifus, pH– meter, tanur, alat titrasi, gelas piala, desikator, spektrofotometer UV, dan spektrofotometer FTIR.
Metode Penelitian
Analisis Pendahuluan (Lindi Hitam) Kadar Air (SNI 06-2235-1991)
Sebanyak 5 g lindi hitam (A) dimasukkan ke dalam cawan yang telah diketahui bobotnya. Cawan yang berisi sampel dimasukkan ke dalam oven bersuhu 103–105 oC selama 3 jam, didinginkan dalam desikator, dan ditimbang. Pengeringan dilakukan dan ditimbang sampai bobotnya konstan (B). Kadar air contoh ditentukan dengan persamaan berikut:
Kadar air = − ×100%
A B A
Kadar Abu (SNI 06-2235-1991)
Cawan dipanaskan dalam tanur, didinginkan dalam desikator, dan ditimbang. Sebanyak 3 g contoh (A) dimasukkan ke dalam cawan, dipanaskan dalam tanur selama 3 jam, didinginkan dalam desikator, dan ditimbang sampai bobotnya konstan (B). Pengeringan dilakukan pada suhu 600 oC. Kadar abu contoh ditentukan dengan persamaan berikut:
Kadar abu = ×100%
A B
pH
Lindi hitam diukur pH-nya dengan menggunakan pH-meter.
Bobot Jenis (SNI 06-2235-1991)
Air dimasukkan ke dalam piknometer yang telah diketahui bobotnya (m1).
Kemudian piknometer yang berisi air ditimbang (m2) dan lindi hitam di masukkan
ke dalam piknometer dan ditimbang (m3).
Suhu air diukur dan ditentukan densitas air pada suhu tersebut (da). Massa jenis
ditentukan dengan persamaan
Massa jenis lindi hitam =
d
am
m
m
m
)
(
)
(
1 2 1 3−
−
Padatan Total (SNI 06-2235-1991)
Sebanyak 10 ml lindi hitam dimasukkan ke dalam cawan porselen yang telah diketahui bobotnya, kemudian cawan ditimbang (A). Sampel diuapkan di atas penangas air sampai kering, dan dimasukkan ke dalam oven 105oC
selama 4 jam. Setelah itu, sampel didinginkan di dalam desikator dan ditimbang. Pemanasan dan penimbangan dilakukan sampai bobotnya tetap (B). Padatan total dihitung menggunakan persamaan
Padatan Total = ×100%
A B
Isolasi Lignin
Proses isolasi lignin mengacu pada metode yang dikembangkan oleh Kim et al. (1987). Lindi hitam terlebih dahulu disaring menggunakan kertas saring, kemudian sebanyak 200 ml filtrat dimasukkan ke dalam Erlenmeyer dan ligninnya diendapkan dengan titrasi H2SO4 20%. Titrasi dilakukan secara
(g) contoh bobot 3.1 [NaOH] NaOH
ml × ×
Endapan lignin dipisahkan dari lindi hitam yang telah diasamkan menggunakan alat sentrifus.
Kemurnian lignin ditingkatkan dengan cara endapan dilarutkan kembali dengan penambahan larutan NaOH 1 N, lalu endapan disaring dengan kertas saring sehingga dihasilkan larutan lignin dengan kemurnian yang lebih tinggi. Larutan lignin kemudian diendapkan kembali dengan cara titrasi menggunakan H2SO4 20% (seperti proses
pengendapan pertama). Endapan dikeringkan pada suhu 60oC (Lampiran 1).
Karakterisasi Lignin Rendemen
Rendemen lignin dihitung berdasarkan perbandingan bobot antara lignin kering dengan jumlah volume total lindi hitam yang digunakan. Rendemen dinyatakan dalam persen bobot per volume lindi hitam (%[b/v]).
Kemurnian Lignin (Tappi T 222 05-74) Sebanyak 1 g lignin (A) hasil isolasi dimasukkan ke dalam gelas piala 100 ml dan ditambahkan 15 ml H2SO4 72%. Penambahan
asam sulfat dilakukan secara perlahan di dalam bak perendaman sambil diaduk dengan pengaduk kaca selama 2–3 menit. Setelah itu, gelas piala ditutup dengan kaca arloji dan dibiarkan pada suhu 20 oC (dalam bak perendaman) selama 2 jam dan sesekali diaduk.
Sampel dari gelas piala dipindahkan ke dalam labu Erlenmeyer berukuran 1000 ml yang berisi 300 ml air dan diencerkan sampai volumenya 575 ml sehingga konsentrasi H2SO4 mencapai 3%. Larutan dipanaskan
sampai mendidih dan dibiarkan selama 4 jam dengan api kecil. Volume dijaga tetap dengan menggunakan pendingin tegak, kemudian endapan lignin yang terbentuk dibiarkan mengendap sempurna. Larutan didekantasi dan endapan dipindahkan ke kertas saring yang telah diketahui bobotnya. Endapan lignin dicuci dengan air panas sampai bebas asam (diuji dengan lakmus). Sampel dikeringkan pada oven 105 oC dan ditimbang sampai bobotnya konstan (B). Kemurnian lignin ditentukan dengan persamaan berikut:
Kemurnian lignin lignin = ×100%
A B
Kadar Metoksil (ASTM 15120-81)
Sebanyak 0.5 g lignin dibasahi dengan 5 ml etanol, disuspensikan dalam 100 ml akuades yang berisi 1 g NaCl dan dinetralkan dengan NaOH 0.1 N. Sebanyak 25 ml NaOH 0.25 N ditambahkan ke dalam larutan, dikocok, dan dibiarkan selama 30 menit pada suhu kamar dalam keadaan tertutup. Kemudian ditambahkan 25 ml HCl 0.25 N dan dititrasi dengan NaOH 0.1 N sampai terbentuk warna merah muda. Kadar metoksil dihitung dengan persamaan
Kadar Metoksil (%) =
Bobot Molekul (Santoso 1995)
Sebanyak 0.5 g lignin isolat dimasukkan ke dalam Erlenmeyer 250 ml dan dibasahi dengan 5 ml etanol. Campuran dibubuhi dengan 1 g NaCl, ditambahkan 100 ml akuades, dan 6 tetes indikator fenolftalein. Larutan tersebut dititrasi dengan NaOH 0.05 N sampai pH 7.5. Bobot ekivalen lignin isolat ditentukan dengan persamaan sebagai berikut:
Bobot ekivalen =
NaOH N) (ml lignin gram 1000 × ×
Bobot molekul = Bobot ekivalen
×
2Salminah (2001) menyatakan bahwa lignin merupakan senyawa kimia bivalen sehingga bobot molekul lignin 2 kali bobot ekivalennya.
Pencirian Lignin Menggunakan Metode Spektrofotometri FTIR
Metode pencirian lignin dengan FTIR mengacu kepada Nada et al. (1998); Ibarra et al. (2005). Satu mg lignin dicampur dengan 300 mg KBr, dibuat pelet, dan selanjutnya dianalisis dengan spektrofotometer FTIR.
Sintesis NaLS
Sebanyak 5 g lignin dicampurkan dengan NaHSO3 (1:0.4, 1:0.5, dan 1:0.6), kemudian
disuspensikan dalam 150 ml air. Nilai pH suspensi dinaikkan menjadi (5, 6, dan 7) dengan penambahan NaOH 1 N (Dilling et al.
1990). Campuran direfluks sambil diaduk agar campuran bereaksi sempurna pada suhu pemanasan 100oC selama 4 jam (Syahmani 2000). Hasil refluks didistilasi untuk menghilangkan air pada proses sulfonasi, kemudian disaring dengan corong Büchner. Filtrat mengandung NaLS dan NaHSO3 sisa
5
bisulfit, lalu endapan disaring dengan menggunakan corong Büchner. Filtrat dikeringkan pada suhu 60oC (Lampiran 2).
Karakterisasi NaLS
Kadar Air, Kadar Abu, dan Bobot Jenis.
Metode yang digunakan sama dengan yang dilakukan pada analisis pendahuluan.
pH NaLS
Sebanyak 1 g NaLS yang telah dilarutkan ke dalam 10 ml akuades dan diukur pH-nya menggunakan pH-meter.
Viskositas
Viskometer Ostwald dibersihkan menggunakan akuades dan dibilas dengan larutan NaLS 50% (b/v). Sebanyak 20 ml larutan dimasukkan ke dalam alat Ostwald melalui tabung yang tidak ada bolanya. Larutan dihisap dari tabung yang ada bolanya sampai melebihi batas atas. Waktu alir ialah waktu yang dibutuhkan oleh larutan untuk bergerak turun dari batas atas sampai batas bawah. Viskositas ditentukan dengan persamaan η=
Vl
t
hdgr
8
4Gula Pereduksi (Sudarmadji et al. 1976) Sebanyak 3 g contoh dimasukkan ke dalam gelas piala 100 ml. Akuades sebanyak 50 ml ditambahkan dan larutan dipanaskan. Larutan Pb-asetat netral ditambahkan tetes demi tetes sampai tidak terbentuk warna keruh, kemudian larutan dipindahkan ke labu takar 100 ml dan ditambahkan akuades sampai tanda tera. Sebanyak 50 ml larutan ditambah 25 ml larutan CuSO4 dan 25 ml
tartrat alkalis, kemudian campuran dipanaskan sampai terbentuk endapan merah bata. Endapan disaring, dicuci dengan alkohol dan eter. Kadar gula pereduksi ditentukan dengan bantuan tabel Hammond.
Penentuan Kemurnian NaLS (WTL 1995) Sebanyak 0.1 g sampel kering dilarutkan dalam 100 ml akuades, kemudian dipipet 5 ml larutan tersebut ke dalam gelas kimia berukuran 250 ml, dan diencerkan sampai 200 ml. pH larutan diatur menjadi 4–5 dengan penambahan NaOH 0.125 N atau HCl 0.2 N, dipindahkan ke dalam labu volumetrik 250 ml, dan diencerkan sampai volumenya 250 ml. Absorbans larutan diukur relatif terhadap air deionisasi dalam kuvet 1 cm
pada 232 nm. Penentuan kemurnian NaLS standar dilakukan dengan prosedur yang sama. Kemurnian lignosulfonat ditentukan dengan persamaan sebagai berikut:
% NaLS =
10 sampel gram faktor 232 × × ×FP A
Pencirian NaLS Menggunakan Metode Spektrofotometri FTIR
Metode yang digunakan sama dengan yang dilakukan pada pencirian lignin.
Rancangan Percobaan (Matjik &
Sumertajaya 2002)
Rancangan percobaan yang digunakan dalam penelitian adalah Rancangan Acak Lengkap Faktorial dengan dua faktor perlakuan, yaitu tiga taraf nisbah reaktan lignin-NaHSO3α yaitu 1:0.4 (α1), 1:0.5 (α2),
dan 1:0.6 (α3), serta tiga taraf pH β yaitu pH 5 (β1), pH 6 (β2), dan pH 7 (β3). Model rancangan percobaan penelitian adalah sebagai berikut
Yijk =
α
i + βj + αβij + εijk• Yijk = nilai kemurnian nisbah
lignin-===== NaHSO3 ke-i dengan pH awal
ke-==== j, dan ulangan ke-k
•
α
i = pengaruh nisbah lignin-NaHSO3===== ke-i
• βj = pengaruh pH awal ke-j
•
α
βij = interaksi antara nisbah reaktan ke-=====i dengan pH awal ke-j, dan===== ulangan ke-k
• εijk = pengaruh acak dari nisbah
lignin-===== NaHSO3 ke-i, pH awal ke-j, dan
===== ulangan ke-k
• αβij = interaksi antara nisbah reaktan
ke-==== i dengan pH ke-j
• εijk = galat dari nisbah reaktan ke-i, pH
==== awal ke-j dan ulangan ke-k
HASIL DAN PEMBAHASAN
Analisis Pendahuluan
air diperoleh sebesar 95.46% (Lampiran 3), lebih tinggi dibandingkan dengan hasil penelitian Lubis (2007), yaitu 94.12%. Kadar abu, bobot jenis, dan kadar padatan total berturut-turut 15.08% (Lampiran 4), 1.0058 g/ml (Lampiran 5), dan 4.57% (Lampiran 6) lebih kecil dibandingkan literatur, hal ini disebabkan oleh lamanya penyimpanan lindi hitam.
Tabel 1 Analisis pendahuluan lindi hitam
Parameter Nilai Nilai pustaka*
Warna Coklat kehitaman
Coklat kehitaman Bau Telur
busuk
Telur busuk
pH 10.26 9.50
Kadar air (%) 95.46 94.12 Kadar abu (%) 15.08 16.70 Bobot jenis
(g/ml)
1.0058 1.0300
Kadar padatan total (%)
4.57 5.88
Keterangan: * = Lubis 2007
Gambar 4 Lindi hitam
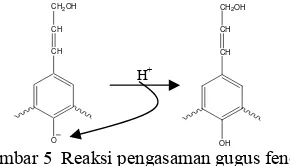
Isolasi Lignin
Lignin diisolasi dari lindi hitam sebagai endapannya dengan asam sulfat 20% (Gambar 5). Endapan lignin dilarutkan dalam NaOH 1 N dan disentrifus ulang untuk memisahkan endapan putih yang ikut mengendap dengan lignin, endapan putih tersebut merupakan asam organik yang tidak larut bersama lignin ketika pH dinaikan (Kim
et al. 1987).
Gambar 5 Reaksi pengasaman gugus fenolat.
Pengendapan dan pelarutan ulang yang dilakukan menghasilkan lebih banyak ion
natrium pada lignin yang dihasilkan. Efek pemurnian ini dapat diminimumkan dengan mencuci endapan menggunakan larutan H2SO4 sehingga kation-kation tersebut akan
berkurang. Sementara anion asam sulfat dikurangi dengan pencucian menggunakan akuades (Kim et al. 1987). Lignin hasil isolasi berwarna coklat (Gambar 6).
Gambar 6 Lignin hasil isolasi
Rendemen lignin yang dihasilkan ialah 1.14% (Lampiran 7). Hasil ini lebih rendah dibandingkan dengan hasil penelitian Salminah (2001) dan Ibrahim et al. (2003), yaitu 1.60% dan 1.27–1.42%. Hal ini dikarenakan lindi hitam yang digunakan pada penelitian berbahan baku jerami, sedangkan Salminah dan Ibrahim menggunakan lindi hitam yang berbahan baku kayu. Sixta (2006) menyatakan bahwa kadar lignin jerami sebesar 16–21%, lebih rendah dibandingkan dengan kayu 25–31%.
Karakterisasi Lignin
Metode Klason digunakan untuk menentukan kemurnian lignin. Pereaksi yang digunakan ialah asam sulfat 72% yang menghidrolisis ikatan eter antara lignin dan selulosa. Kemurnian lignin yang dihasilkan sebesar 83.34% (Lampiran 8), hasil ini lebih tinggi dibandingkan hasil penelitian Lubis (2007), yaitu 79.95%. Pengotor yang masih terdapat pada lignin ialah selulosa yang berikatan dengan lignin melalui ikatan eter.
Bobot ekivalen lignin selama proses pembuatan pulp menjadi rendah akibat terjadinya reaksi depolimerisasi. Keadaan basa menyebabkan terjadinya reaksi hidrolisis yang memecah ikatan-ikatan eter antara unit-unit fenil propana dan menurunkan bobot molekul lignin (Sjostrom 1995). Bobot ekivalen lignin yang dihasilkan sebesar 1863.82 g/ekivalen (Lampiran 9). Hasil ini lebih tinggi dibandingkan dengan hasil penelitian Lubis (2007), yaitu 1833.00 gram/ekivalen. Barsinai & Wayman (1976) menyatakan bahwa penambahan asam kuat
CH CH CH2OH
O
CH CH CH2OH
7
OH
+
CH3OHOH O CH CH CH2OH
OH O CH CH CH2OH
CH3
menyebabkan lignin terpolimerisasi kembali sehingga bobot molekulnya menjadi tinggi.
Metoksil termasuk salah satu gugus fungsi yang terdapat dalam lignin. Fengel dan Wegener (1995) menyatakan bahwa kadar metoksil lignin jerami padi berkisar 16–18%. Kadar metoksil yang dihasilkan sebesar 2.52% (Lampiran 10). Hal ini disebabkan terjadinya demetilasi lignin pada pemasakan pulp oleh nukleofil ion hidroksida (Gambar 7) (Fengel & Wegener 1995).
Gambar 7 Reaksi demetilasi lignin.
Sintesis NaLS
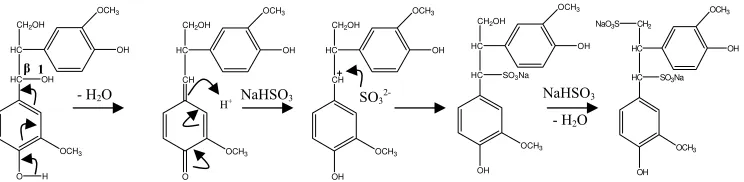
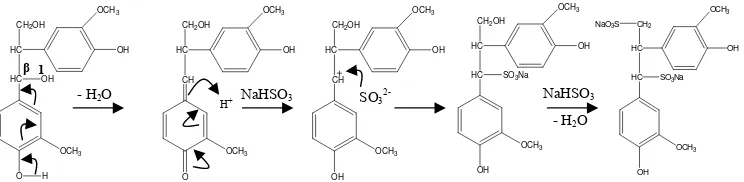
Gugus sulfonat dimasukkan ke dalam lignin dan menggantikan gugus hidroksil atau eter pada atom karbon dari rantai samping propana (Sjostrom 1995). Pasangan elektron
π pada rantai samping fenilpropana lebih cenderung berbaur dan kurang terikat pada inti karbon sehingga terkutubkan negatif. Reaksi sulfonasi diawali dengan reaksi adisi oleh spesi asam yang bersifat elektrofilik menghasilkan suatu karbokation. Karbokation yang terbentuk distabilkan oleh cincin benzena, kemudian karbokation diserang oleh nukleofilik SO3
2-membentuk lignosulfonat. Sjostrom (1995) menyatakan reaksi sulfonasi lignin serupa dengan reaksi sulfonasi 1,2-guaiasilpropana-1,3-diol yang merupakan salah satu dilignol dari penggabungan karbon-β dengan karbon-1.
Langkah pertama berlangsung melalui pemecahan gugus α-hidroksil (eliminasi air), kemudian pembentukan karbokation diikuti serangan nukleofilik terhadap kuinon metida menghasilkan natrium 1,2-diguasilpropana-α -sulfonat- -ol, dilanjutkan dengan reaksi serupa menghasilkan natrium 1,2-diguaiasilpropana-α--disulfonat (Gambar 8). NaLS yang diperoleh mempunyai warna coklat yang lebih terang dibandingkan lignin (Gambar 9).
Keterangan:
(1) pH awal 7 dan nisbah reaktan 1:0.6 (2) pH awal 7 dan nisbah reaktan 1:0.5 (3) pH awal 7 dan nisbah reaktan 1:0.4 (4) pH awal 6 dan nisbah reaktan 1:0.6 (5) pH awal 6 dan nisbah reaktan 1:0.5 (6) pH awal 6 dan nisbah reaktan 1:0.4 (7) pH awal 5 dan nisbah reaktan 1:0.6 (8) pH awal 5 dan nisbah reaktan 1:0.5 (9) pH awal 5 dan nisbah reaktan 1:0.4 Gambar 9 NaLS hasil sintesis pada berbagai
======== perlakuan awal.
Kadar Air dan Kadar Abu NaLS
Kadar air dan kadar abu merupakan parameter dasar yang biasa digunakan untuk menganalisis bahan organik. Kadar air berkaitan dengan daya simpan bahan, sedangkan kadar abu memperlihatkan kandungan bahan anorganiknya. Kadar air dan kadar abu NaLS berturut-turut sebesar 4.65% (Lampiran 11) dan 20.93% (Lampiran 12) (Tabel 2).
β 1
HC HC
CH2OH
OH OCH3 OCH3 O H OH H+ CH HC
CH2OH
OH OCH3
OCH3 O
SO3 2-CH HC
CH2OH
OH OCH3 OCH3 OH HC HC CH2 OH OCH3 OCH3 OH
SO3Na NaO3S
HC HC
CH2OH
OH OCH3
OCH3 OH
SO3Na
NaHSO3
- H2O
- H2O
NaHSO3
Gambar 8 Reaksi sulfonasi terhadap 1,2-diguaiasilpropana-1,3-diol.
6.00 6.20 6.40 6.60 6.80 7.00 7.20
5.00 6.00 7.00 pH aw al
pH
a
k
hir
1:0.4 1:0.5 1:0.6
Viskositas dan Bobot Jenis NaLS
Aliran yang menimbulkan gesekan internal dalam suatu fluida, baik cairan maupun gas, disebut sebagai viskositas (kekentalan). Bobot jenis ialah perbandingan bobot terhadap volumenya. Nilai viskositas dan bobot jenis NaLS berturut-turut sebesar 1067 cps (Lampiran 13) dan 1.38 g/cm3 (Lampiran 14) (Tabel 2).
Gula Pereduksi pada NaLS
Gula pereduksi merupakan komponen pengotor utama pada NaLS (Fengel & Wegener 1995). Kandungan gula pereduksi NaLS sebesar 5.69% (Lampiran 15) (Tabel 2). Hal ini disebabkan oleh masih adanya selulosa yang terikat pada lignin (Sjostrom 1995).
Tabel 2 Karakteristik produk NaLS.
Parameter Nilai Nilai*
NaLS (%) 68.62-83.57
80.00
Gula pereduksi (%) 4.53 7.00
Kadar abu (%) 20.26 22
Kadar air (%) 4.65 < 6.00
pH (10% larutan) 6.42-7.11 7.00
Viskositas (cps) 1067 1000
Bobot jenis (g/cm3) 1.3536 1.2764
Keterangan : * = WTL 1995
Nilai pH NaLS
Pengukuran pH bertujuan untuk mengetahui derajat keasaman NaLS yang dihasilkan. Hasil analisis keragaman dengan selang kepercayaan 95% (α = 0.05) menunjukkan bahwa nisbah reaktan lignin-NaHSO3 tidak berbeda nyata terhadap pH
akhir NaLS (Lampiran 16).
Hasil uji Duncan menunjukkan bahwa pH awal 6 dan 7 tidak berbeda nyata terhadap pH akhir yang dihasilkan. Namun, keduanya berbeda nyata dibandingkan pH awal 5. pH awal 6 & 7 menghasilkan pH akhir NaLS yang lebih tinggi dibandingkan pH awal 5 (Gambar 10). Hal tersebut disebabkan banyaknya gugus sulfonat yang tersubstitusi pada pH awal 5. Rivai (2004) menyatakan bahwa semakin banyak terbentuknya gugus sulfonat maka keasaman semakin tinggi.
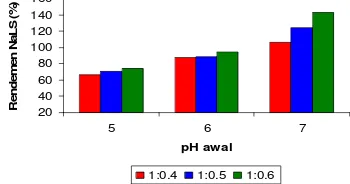
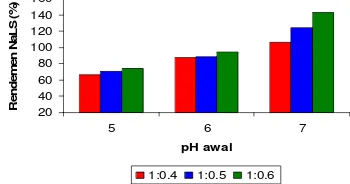
Rendemen NaLS
Rendemen NaLS ialah persentase perbandingan bobot NaLS yang dihasilkan terhadap bobot lignin awal. Hasil analisis keragaman dengan selang kepercayaan 95% (α = 0.05) menunjukkan bahwa pH awal dan nisbah reaktan lignin-NaHSO3 berpengaruh
nyata terhadap rendemen NaLS yang dihasilkan (Lampiran 17).
Rendemen NaLS paling besar diperoleh pada pH awal 7 dan nisbah 1:0.6 (Gambar 11) (Lampiran 17). Semakin tinggi pH maka kelarutan lignin semakin tinggi, sehingga memperbesar luas permukaan lignin yang selanjutnya akan memperbesar peluang terjadinya tumbukan antar molekul. Konsentrasi reaktan yang tinggi juga memperbesar peluang terjadinya tumbukan antarmolekul. Sykes (1989) menyatakan bahwa kecepatan reaksi berbanding lurus dengan jumlah tumbukan yang terjadi di antara molekul-molekul zat yang melakukan reaksi. 20 40 60 80 100 120 140 160
5 6 7
pH awal Re ndem e n N a L S ( % )
1:0.4 1:0.5 1:0.6
Gambar 11 Rendemen NaLS pada berbagai
nisbah lignin-NaHSO3
Kemurnian NaLS
Hasil analisis keragaman dengan selang kepercayaan 95% (α = 0.05) menunjukkan bahwa nisbah reaktan lignin-NaHSO3 dan pH
awal berbeda nyata terhadap kemurnian yang Gambar 10 pH akhir NaLS pada berbagai
======== nisbah lignin-NaHSO3
9
Vibrasi cincin aromatik Uluran O- H
Vibrasi C-H aromatic diluar bidang
Uluran C-H
Uluran C-H
Uluran eter
dihasilkan (Lampiran 18). Kemurnian yang paling tinggi didapat pada pH awal 5 dan nisbah 1:0.4 (Gambar 12) (Lampiran 18). Hal ini dikarenakan reaksi sulfonasi pada pH awal 5 berlangsung lebih sempurna jika dibandingkan pH awal 6 dan 7. Sykes (1989) menyatakan bahwa masuknya gugus nukleofilik akan lebih mudah dalam keadaan asam karena mudahnya pembentukan karbokation. Fengel dan Wegener (1995) menyatakan bahwa reaksi sulfonasi lebih cepat terjadi pada pH yang rendah.
60.00 65.00 70.00 75.00 80.00 85.00
5.00 6.00 7.00
pH aw al
ke
m
u
rn
ia
n
(
%
)
1:0.4 1:0.5 1:0.6
Gambar 12 Kemurnian NaLS pada berbagai
h- mmmmmnisbah lignin-NaHSO3.
Pencirian Gugus Fungsi pada Lignin
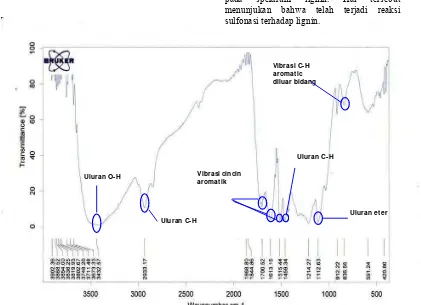
Pita serapan pada bilangan gelombang 3432 cm-1 menunjukkan uluran O-H, pita serapan pada bilangan gelombang 2933 dan 1459 cm-1 menunjukkan uluran C-H dari gugus metil. Dua pita serapan pada bilangan gelombang 1613 dan 1515 cm-1 merupakan karakteristik dari cincin aromatik dan pita serapan pada 1112 cm-1 menunjukkan uluran eter. Pita serapan pada 836 cm-1 menunjukkan vibrasi C-H aromatik di luar bidang, sedangkan pita serapan yang khas pada bilangan gelombang 1214 cm-1 menunjukkan adanya guaiasil (Gambar 13) (Santoso 2001). Guaiasil merupakan salah satu zat penyusun lignin (Lin & Dence 1991).
Pencirian Gugus Fungsi pada NaLS
Spektrum FTIR lignin relatif sama dengan NaLS (Gambar 13 & 14). Nilai serapan ditampilkan pada tabel 3. NaLS mempunyai pita serapan pada bilangan gelombang 626 cm-1 yang menunjukkan adanya uluran C-S, serapan ini tidak terlihat pada spektrum lignin. Hal tersebut menunjukan bahwa telah terjadi reaksi sulfonasi terhadap lignin.
Tabel 3 Pencirian gugus fungsi lignin.
Bilangan gelombang lignin hasil isolasi
(cm-1)
Bilangan gelombang (cm-1) (Santoso 2003)
Bilangan gelombang (cm-1) (Ibrahim 2003)
Gugus fungsi
3432 3424 3433 Uluran O-H
2933 2930 2940-2930 Uluran C-H gugus metil
1613 1605 1610 Vibrasi cincin aromatik
1515 1513 1516 Vibrasi cincin aromatik
1459 - 1464 Uluran C-H gugus metil
1214 1211 - Ciri lignin guaiasil
1112 - 1117 Uluran eter
836 - 840-830 Vibrasi C-H aromatik di
luar bidang
Bilangan gelombang NaLS hasil sintesis
(cm-1)
Bilangan gelombang (cm-1) (Nada et al. 1997)
Bilangan gelombang (cm-1) (Syahmani 2000)
Gugus fungsi
3432 3440-3430 3466 Uluran O-H
2927 2940-2930 2921-2851 Uluran C-H gugus metil
1610 1610-1590 1595 Vibrasi cincin aromatik
1512 1505 1508 Vibrasi cincin aromatik
1459 1458 1463 Uluran C-H gugus metil
1206 - 1267 Ciri lignin guaiasil
1123 - 1122 Uluran eter
835 844 Vibrasi C-H aromatik di luar bidang
626 630 626 Uluran C-S
Tabel 4 Pencirian gugus fungsi NaLS
Uluran C-H
Uluran eter
Vibrasi C-H aromatik di luar bidang
Uluran O- H
Uluran C-H Vibrasi cincin aromatik
Uluran C-S
11
SIMPULAN DAN SARAN
Simpulan
Reaksi sulfonasi terhadap lignin oleh NaHSO3 menghasilkan NaLS dengan
kemurnian 68.62–83.57%, pH (10% larutan) 6.42–7.11, dan rendemen 68.36-144.43%. Kenaikan pH awal meningkatkan pH akhir dan rendemen NaLS, tetapi menurunkan kemurniannya. Kenaikan nisbah lignin-NaHSO3 meningkatkan rendemen dan
menurunkan kemurnian, tetapi tidak berpengaruh pada pH akhir NaLS. Kondisi optimum reaksi sulfonasi lignin yang dipilih ialah pada pH awal 6 dan nisbah lignin-NaHSO3 1:0.6. Reaksi sulfonasi telah
berlangsung, hal ini dapat dilihat dari adanya pita serapan pada bilangan gelombang 626 cm-1 yang menunjukan adanya uluran C-S.
Saran
Variasi suhu sebaiknya dilakukan untuk mengetahui pengaruhnya terhadap produk NaLS. Hasil NaLS yang dihasilkan sebaiknya diuji menggunakan NMR untuk meyakinkan hasil yang diperoleh.
DAFTAR PUSTAKA
Achmadi SS. 1990. Bahan Pengajaran Kimia Kayu. Departemen Pendidikan dan Kebudayaan Direktorat Jendral Pendidikan Tinggi. Bogor: Pusat Antar Universitas Ilmu Hayat, Institut Pertanian Bogor.
[ASTM] American Society for Testing and Material. 1981. Methoxyl content of pulp and wood. ASTM 15120-81.
Dilling P et al, penemu; United State Patent. 9 Jan 1990. Production of Lignosulphonate Additives. 4 892 588.
Fengel D, Wegener G. 1995. Kayu: Kimia, Ultrastruktur, dan Reaksi-Reaksi. Sastrohamidjojo H, penerjemah; Yogyakarta: UGM Pr. Terjemahan dari: Wood: Chemistry, Ultrastructure, and Reactions.
Ibrahim MN, Chuah SB, Wan Rosli WD. 2004. Characterization of Lignin Precipitated from Soda Black Liquor of Oil Palm Empty Fruit Bunch Fibers By Various Mineral Acid. AJSTD 21:57-67.
Indra RM. 9 Januari 2007. Ekspor Bubur Kertas Indonesia Naik. Tempo:1.
Jain RK, Kulkarni AG. 1991. Utilization of Alkaline Spent Pulping Liquor from Bagasse as Source of Industrial Dispersant. Di dalam: Pant R, editor. Proceedings of the Workshop on Wood Pulping Refining, Bagasse Newsprint, Lignin Utilizaton and Cellulose Derivatives; Bandung, 10-13 Nov 1991. Bandung: Departemen Perindustrian. hlm 199-218.
Judoamidjojo RM, Said EG, Hartoto L. 1989. Biokonversi. Departemen Pendidikan dan Kebudayaan Direktorat Jendral Pendidikan Tinggi. Bogor: Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor.
Kim H, Hill MK, Fricke AL. 1987. Preparation of Kraft Lignin From Black Liquor. Tappi Journal 12:112-115.
Klyosov AA, Philippidis GP, Monovoukas YA. penemu: United States Patent. 7 Jul 1997. Method of Recovering Lignin from Pulp and Paper Sludge. 5 777 086.
[terhubung berkala]. http://www.google.com/patents?hl=en&lr
=&vid=USPAT5777086&id=k74jAAAA EBAJ&oi=fnd&dq=lignin+recovery+fro m+paper+sludge+klyosov. [21 Agustus 2006].
Lin SY, Dence CW. 1992. Methods in Lignin Chemistry. Berlin Heidelberg: Springer-Verlag.
Lubis AA. 2007. Isolasi Lignin dari Lindi Hitam (Black Liquor) Proses Pemasakan Soda dan Proses Sulfat (Kraft) [skripsi]. Bogor. Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Matjik AA dan Sumertajaya IM. 2002. Perancangan Percobaan dengan Aplikasi SAS dan Minitab Jilid 1. Bogor: IPB Press.
[Pulp and Paper Industry]. 2006. World and Paper Demand by Grade 1980-2010. [terhubung berkala]. http://www. pulpandpapertechnology.com/projects/sil ao/silao3.html [21 Agustus 2006]
Rini DS. 2003. Minimasi Limbah Dalam Industri Pulp and Paper. [terhubung berkala]. http://www.terranet.or.id /tulisandetil.php?id=1306 [ 4 Juli 2006]
Rivai M. 2004. Kajian Pengaruh Nisbah Reaktan H2SO4 dan Lama Reaksi
Terhadap Kinerja Surfaktan Metil Ester Sulfonat yang Dihasilkan. [tesai]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Rudatin S. 1989. Potensi dan Prospek Pemanfaatan Lignin dari Limbah Industri Pulp dan Kertas di Indonesia. Departemen Perindustrian RI. Balai Besar Penelitian dan Pengembangan Industri Selulosa: Bandung. Berita Selulosa (25) 1 : 14-17.
Salminah M. 2001. Karakteristik Lignin Hasil Isolasi Larutan Sisa Pemasak Pulp Proses Semikimia pada Berbgai Tingkat pH [skripsi]. Bogor: Fakultas Kehutanan, Institut Pertanian Bogor.
Santoso A. 1995. Pencirian Isolat Lignin dan Upaya Menjadikannya Sebagai Bahan Perekat Kayu Lapis [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Santoso A. 2003. Sintesis dan Pencirian Resin Lignin Resorsinol Formaldehida untuk Perekat Kayu Lamina. [disertasi]. Program Pascasarjana, Institut Pertanian Bogor.
Sixta H. 2006. Handbook of Pulp. Weinheim: LEY-VCH Verlag GmbH & Co. KGaA.
Sjostrom E. 1993. Kimia Kayu, Dasar-Dasar, dan Penggunaannya. Ed ke-2. Sastrohamidjojo H, penerjemah; Yogyakarta: UGM pr. Terjemahan dari: Wood Chemistry, Fundamentals, and Applications.
[SNI] Standar Nasional Indonesia. 1991. Cara Uji Massa Jenis, Senyawa-Senyawa Organik dan Anorganik dalam Lindi Hitam. SNI 06-2235-1991.
Sudarmadji S, Haryono B, Suhardi. 1974. Prosedur Analisa Untuk Bahan Makanan dan Pertanian. Yogyakarta: Liberty.
Syahmani. 2000. Isolasi, Sulfonasi dan Asetilasi Lignin dari Tandan Kosong Sawit dan Studi Pengaruhnya Terhadap Proses Pelarutan Urea [tesis]. Program Pascasarjana, Institut Teknologi Bandung.
Sykes P. 1989. Penuntun Mekanisme Reaksi Kimia Organik. Ed ke-2. Hartono et al., penerjemah; Jakarta: PT Gramedia pr. Terjemahan dari: A Guidebook to Mechanism in Organic Chemistry.
[TAPPI] Technical Association of the Pulp and Paper Industry. Lignin Content of Pulp and Wood. T222 05-74.
[TAPPI] Technical Association of the Pulp and Paper Industry. 2003. About Pulp and Paper. [terhubung berkala]. http://www.tappiphilliphines.com/aboutp ulp/id.html [4 Juli 2006]
[Weyerhaeuser Company]. 2004 Material Safety Data Sheet of Lignin. [terhubung berkala]. http://www.weyerhaeuser.com/ environment/msds/pdfs/074.pdf [7 Juli 2006]
PENGARUH NISBAH REAKTAN LIGNIN-NaHSO
3DAN pH
PADA PRODUK NATRIUM LIGNOSULFONAT
TESAR DZIKRULLOH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pengaruh Nisbah Reaktan Lignin-NaHSO
3dan pH pada Produk
Natrium Lignosulfonat
Nama
: Tesar Dzikrulloh
NIM
: G44202044
Disetujui:
Pembimbing I,
Pembimbing II,
Dra. Gustini Syahbirin, MS
Drs. Dudi Tohir, MS
NIP 131842414 NIP 131851277
Diketahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, MS
NIP 131473999
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini dilaksanakan di Laboratorium Kimia Organik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Laboratorium Fisiologi dan Toksikologi Departemen Proteksi Tanaman, Fakultas Pertanian sejak bulan Oktober 2006 sampai Mei 2007, dengan judul Pengaruh Nisbah Reaktan dan pH pada Produk Natrium Lignosulfonat.
Terima kasih penulis ucapkan kepada Ibu Dra. Gustini Syahbirin, MS sebagai pembimbing I dan Bapak Drs. Dudi Tohir, MS selaku pembimbing II atas bimbingannya selama penelitian dan penyusunan karya ilmiah ini. Ucapan terima kasih juga penulis ucapkan kepada staf Laboratorium Kimia Organik, staf Laboratorium Terpadu, staf Laboratorium Fisiologi dan Toksikologi IPB atas bantuannya. Selain itu, penulis mengucapkan terima kasih kepada Kak Budi, Ayu, Tuti, Dewi, David, Afni, Hera, Tri, Budhi, Fifi, Mirah, dan Steven yang telah banyak membantu selama pelaksanaan penelitian, Mas Heri yang telah banyak membantu untuk urusan administrasi serta teman-temanku seangkatan yang membantu baik secara langsung maupun tidak langsung. Ucapan terima kasih disampaikan kepada Bapak, Ibu, dan Kakak-kakakku dan adik-adikku atas segala doa, restu, dukungan, dan kasih sayangnya yang telah membantu hingga karya ilmiah ini dapat diselesaikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2007
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 16 Januari 1985 dari ayah Dahlan Hidayat dan ibu Titin Gustini. Penulis merupakan putra ketiga dari delapan bersaudara.
Tahun 2002 penulis lulus dari MAN Cipasung dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Lindi hitam ... 1
Lignin ... 1
Lignosulfonat ... 2
BAHAN DAN METODE Bahan dan Alat ... 3
Metode Penelitian ... 3
HASIL DAN PEMBAHASAN Analisis Pendahuluan ... 5
Isolasi Lignin ... 6
Karakterisasi Lignin ... 6
Sintesis NaLS ... 7
Kadar Air dan Kadar Abu NaLS ... 7
Viskositas dan Bobot Jenis NaLS ... 8
Gula Pereduksi pada NaLS ... 8
pH NaLS ... 8
Rendemen NaLS ... 8
Kemurnian NaLS ... 8
Pencirian Gugus Fungsi Lignin ... 9
Pencirian Gugus Fungsi NaLS ... 9
SIMPULAN DAN SARAN Simpulan ... 11
Saran ... 11
DAFTAR PUSTAKA ... 11
DAFTAR TABEL
Halaman
1 Analisis pendahuluan lindi hitam ... 6
2 Karakteristik produk NaLS ... 8
3 Pencirian gugus fungsi lignin ... 10
4 Pencirian gugus fungsi NaLS ... 10
DAFTAR GAMBAR
Halaman
1 Struktur p-koumaril alkohol, koniferil alkohol, dan sinapil alkohol ... 12 Model struktur lignin guaiasil ... 2
3 Lignin tersulfonasi pada posisi C-α dan C-γ ... 3
4 Lindi hitam ... 6
5 Reaksi pengasaman gugus fenolat ... 6
6 Lignin hasil isolasi ... 6
7 Reaksi demetilasi lignin ... 7
8 Reaksi sulfonasi terhadap1,2-diguaiasilpropana-1,3-diol. ... 7
9 NaLS hasil sintesis ... 7
10 pH akhir NaLS pada berbagai nisbah lignin-NaHSO3 .. ... 8
11 Rendemen NaLS pada berbagai nisbah lignin-naHSO3. ... 8
12 Kemurnian NaLS pada berbagai nisbah lignin-NaHSO3 ... 8
13 Spektrum FTIR lignin ... 9
14 Spektrum FTIR NaLS ... 10
DAFTAR LAMPIRAN
Halaman
1 Bagan alir isolasi lignin ... 14
2
Bagan alir sintesis NaLS ... 15
3 Kadar air lindi hitam ... 16
4 Kadar abu lindi hitam ... 16
5 Bobot jenis lindi hitam. ... 16
6 Padatan total lindi hitam ... 17
7 Rendemen lignin ... 17
8 Kemurnian lignin ... 17
9 Bobot ekivalen lignin ... 18
10 Kadar metoksil lignin ... 18
11 Kadar air NaLS ... 18
12 Kadar abu NaLS ... 19
13 Bobot jenis NaLS ... 19
14 Viskositas NaLS ... 19
15 Kadar gula pereduksi ... 20
16 Nilai kemurnian NaLS ... 20
17 Pengaruh nisbah reaktan lignin-NaHSO3 terhadap pH akhir NaLS ... 21
18 Pengaruh nisbah reaktan lignin-NaHSO3 terhadap kemurnian NaLS ... 24
14
Larutan lindi hitam
Endapan lignin
Larutan lignin
Endapan lignin disaring
ditambahkan H2SO4 20%
ditambahkan NaOH 1 N
ditambahkan H2SO4 20%
dicuci dengan H2SO4 0.01 N 5 kali
dicuci dengan akuades 2 kali dikeringkan
Isolat lignin Lampiran 1 Bagan alir isolasi lignin (Kim et al. 1978)
Karakterisasi isolat lignin Lindi hitam
Padatan non-lignin
Larutan non-lignin
Padatan non-lignin
direfluks
disaring
dikeringkan
didistilasi
Air
Metanol
NaHSO3
MeOH
Lampiran 2 Bagan alir sintesis NaLS (Syahmani 2000)
Isolat lignin
Nisbah reaktan: 1:0.4, 1:0:5, 1:0,6 (lignin-NaHSO3)
pH: 5-7, suhu: 100oC, waktu : 4 jam
Campuran
NaLS + NaHSO3
Filtrat NaLS dan MeOH
NaLS
Karakterisasi NaLS hasil optimasi
16
Lampiran 3 Kadar air lindi hitam
Ulangan A (g) B (g) kadar air (%)
1 5.0025 0.2291 95.42 2 5.0012 0.0227 95.45 3 5.0013 0.2245 95.51
rerata 95.46
Keterangan:
A : bobot contoh mula-mula B : bobot contoh kering
Contoh perhitungan (ulangan 1): Kadar air = x 100% A
B -A
Kadar air =
0025 . 5
) 2291 . 0 0025 . 5 ( −
× 100%
Kadar air = 95.42%
Lampiran 4 Kadar abu lindi hitam
Ulangan A (g) B (g) kadar abu (%)
1 5.0023 0.0358 15.76 2 5.0013 0.0328 14.44 3 5.0008 0.0342 15.06
rerata 15.08
Keterangan: A : bobot cuplikan B : bobot abu
Contoh perhitungan (ulangan 1): Kadar abu =
cuplikan air)massa
kadar (1
abu massa
− × 100%
=
0023 . 5 ) 9546 . 0 1 (
0358 . 0
− × 100%
= 15.76%
Lampiran 5 Bobot jenis lindi hitam
Ulangan m1 (gram) m2 (gram) m3 (gram) da(g/cm3) Bobot jenis (g/cm3)
1 10.0032 19.8573 19.9163 0.9998 1.0058 2 10.0031 19.8578 19.9156 0.9998 1.0057 3 10.0032 19.8564 19.9172 0.9998 1.0059
rerata 1.0058 Keterangan:
m1 = bobot piknometer kosong
m2 = bobot piknometer + air
m3 = bobot piknometer + contoh
da = bobot jenis air pada suhu 26o
Contoh perhitungan (ulangan 1): Bobot jenis NaLS = da m m
m m
⎟ ⎠ ⎞ ⎜
⎝ ⎛
− −
1 2
Lanjutan Lampiran 5
Bobot jenis NaLS = ⎟
⎠ ⎞ ⎜
⎝ ⎛
− −
0232 . 10 8578 . 19
0032 . 10 8573 . 19
0.9998 g/cm3
= 1.0058 g/cm3
Lampiran 6 Padatan total lindi hitam
Ulangan kadar air (%) padatan total (%)
1 95.42 4.58 2 95.45 4.55 3 95.51 4.59 rerata 4.57 Contoh perhitungan (ulangan 1):
Padatan total = (1─kadar air) x 100%
= (1─0.9546) x 100% = 4.58%
Lampiran 7 Rendemen lignin
Ulangan volume contoh (ml) bobot lignin (g) Rendemen (%)
1 200.00 2.2824 1.14
2 200.00 2.2814 1.14
3 200.00 2.2774 1.14
rerata 1.14 Contoh perhitungan (ulangan 1) :
Rendemen lignin = x 100% (ml) contoh volume
(gram) lignin bobot
= x 100%
ml 200.00
g 2.2824
= 1.14%
Lapiran 8 Kemurnian lignin
Ulangan Bobot contoh (g) bobot lignin (g) Kemurnian (%)
1 2.0023 1.6603 82.92
2 2.0012 1.6708 83.49
3 2.0008 1.6722 83.58
rerata 83.34 Contoh perhitungan :
Kemurnian =
(g) contoh bobot
(g) lignin
bobot x 100%
= x 100% 2.0023
1.6603
18
Lampiran 9 Bobot ekivalen lignin
Ulangan Bobot contoh (g) Volume NaOH (ml) Bobot ekivalen (g/ek)
1 0.5003 5.25 1904.76
2 0.5001 5.45 1834.86
3 0.5009 5.40 1851.85
rerata 1863.82 Contoh perhitungan (ulangan 1):
Bobot ekivalen =
NaOH x v) (ml
(g) contoh bobot x 1000
=
NaOH 0.05) x (5.25
(g) 5.0003 x 1000
=
0.2625 5,000.3
= 1904.76 mol/ekiv
Lampiran 10 Kadar metoksil lignin
Ulangan A (g) B (ml) Kadar metoksil (%) 1 0.5002 4.20 2.60 2 0.5009 4.10 2.54 3 0.5001 3.90 2.41
rerata 2.52
Contoh perhitungan (ulangan 1) : Kadar metoksil =
A
3.1 x NaOH N) x (B
=
5.002
3.1 x NaOH N) 0.1 x ml (4.20
= 2.60%
Lampiran 11 Kadar air NaLS
Ulangan A (g) B (g) kadar air (%) 1 1.0034 0.9530 4.68 2 1.0063 0.9591 4.69 3 1.0001 0.9543 4.58
rerata 4.65
Keterangan:
A : bobot contoh mula-mula B : bobot contoh kering
Contoh perhitungan (ulangan 1): Kadar air = x 100% A
B -A
Kadar air =
0034 . 1
) 9530 . 0 0034 . 1 ( −
× 100%
Lampiran 12 Kadar abu NaLS
Ulangan A (g) B (g) kadar abu (%)
1 1.0067 0.1989 20.72 2 1.0026 0.2018 21.11 3 1.0013 0.2002 20.96
rerata 20.93
Keterangan: A : bobot cuplikan B : bobot abu
Contoh perhitungan (ulangan 1): Kadar abu =
cuplikan air)massa
kadar (1
abu massa
− × 100%
=
0067 . 1 ) 046 . 0 1 (
1989 . 0
− × 100%
= 20.93%
Lampiran 13 Bobot jenis NaLS
Ulangan m1 (gram) m2 (gram) m3 (gram) da(g/cm3) Bobot jenis (g/cm3)
1 10.0232 19.8913 23.3812 0.9998 1.3536 2 10.0228 19.8234 23.3289 0.9998 1.3485 3 10.0225 19.8244 23.2921 0.9998 1.3538
rerata 1.3519 Keterangan:
m1 = bobot piknometer kosong
m2 = bobot piknometer + air
m3 = bobot piknometer + contoh
da = bobot jenis air pada suhu 26o
Contoh perhitungan (ulangan 1): Bobot jenis NaLS = da m m
m m
⎟ ⎠ ⎞ ⎜
⎝ ⎛
− −
1 2
1 3
= ⎟
⎠ ⎞ ⎜
⎝ ⎛
− −
0232 . 10 8913 . 19
0232 . 10 3812 . 23
0.9998 g/cm3
= 1.3536 g/cm3
Lampiran 14 Viskositas NaLS
Ulangan Viskositas (cps) 1 1064 2 1067 3 1070
rerata 1067
Nilai viskositas diperoleh dari persamaan
η =
8Vl t Pr4
=
8Vl t hdgr4
20
Lanjutan Lampiran 14
d = massa jenis (gr/cm3)
g = percepatan gravitasi (980 cm/det2) r = jari-jari kapiler (cm)
t = waktu alir (detik) l = panjang pipa kapiler (cm)
Lampiran 15 Kadar gula pereduksi
Ulangan
Bobot contoh (gram)
Bobot Cu2O
(gram) Bobot gula pereduksi (gram)
Kadar gula pereduksi (%)
1 1.0032 0.0255 0.0562 5.6020 2 1.0025 0.0261 0.0572 5.7057 3 1.0011 0.0262 0.0577 5.7636
rerata 5.6904
Contoh perhitungan (ulangan 1) =
(gram) contoh bobot
(gram) pereduksi gula
bobot
x 100%
=
gram 1.0032
gram 0.0562
x 100%
= 5.6020%
Lampiran 16 Nilai kemurnian NaLS
Nilai Kemurnian NaLS diperoleh dari persamaan
% Natrium Lignosulfonat =
10
232
×
×
×
g
faktor
FP
A
Keterangan: A232 = absorbansi yang terukur pada λ 232 nm
FP = faktor pengenceran
faktor = faktor NaLS (35) g = bobot sampel
Contoh perhitungan (pH awal 6; nisbah Lignin-NaHSO3 1:0.4; ulangan 1):
% Natrium Lignosulfonat =
10 1 . 0 35
5000 5410 . 0
× ×
×
=
80
.
14
%
Lampiran 17 Pengaruh nisbah reaktan lignin-NaHSO3 dan pH terhadap pH akhir NaLS
Keterangan
Σy... = jumlah semua data nilai pH akhir
Σyi.. = jumlah data nilai pH akhit pada nisbah ke-i
Σy.j. = jumlah data nilai pH akhir pada pH awal ke-j
Σyij. = jumlah data nilai pH akhir pada nisbah ke-i dan pH awal ke-j
a. Model linear: Yijk = μ +
α
i + βj + αβij + εijkKeterangan:
Yijk = nilai pH akhir nisbah lignin-NaHSO3 ke-i dengan pH awal ke-j, dan ulangan ke-k
μ = rata-rata pH akhir
α
i = pengaruh nisbah lignin- NaHSO3 ke-iβj = pengaruh pH awal ke-j
α
βij= interaksi antara nisbah reaktan ke-i dengan pH awal ke-j, dan ulangan ke-kεijk = pengaruh acak dari nisbah lignin-NaHSO3 ke-i, pH awal ke-j, dal ulangan ke-k
b. Hipotesis yang diuji
Pengaruh nisbah lignin-NaHSO3
Ho: α1 = α2 = α3
H1: setidaknya ada satu
αi
≠ 0, i = 1, 2, 3 Pengaruh pH awalHo: β1 = β2 = β3
H1: setidaknya ada satu β i≠ 0, i = 1, 2, 3
Pengaruh interaksi nisbah lignin-NaHSO3 dengan pH awal
Ho: αβij = 0
Lanjutan Lampiran 17
c. Tabel ANOVA
5 6 7
1:0.4 6.44 6.74 6.98
6.53 6.53 6.93
Σyij. 12.92 13.27 13.91 40.15
1:0.5 6.42 7.33 6.98
6.42 6.91 7.01
Σyij. 12.84 14.24 13.99 41.07
1:0.6 6.60 7.10 7.00
6.44 7.12 6.98
Σyij. 13.04 14.22 13.98 41.24
22
Sumber keragaman db JK KT F hitung
pH awal 2 0.9721 0.4805 33.4843*
Nisbah 2 0.1146 0.0573 3.5679
Nisbah vs pH awal 4 0.2049 0.0512 3.9930*
Galat 9 0.1292 0.0143
Total 17 1.4208
Keterangan: * = Hipotesis ditolak
db nisbah lignin-NaHSO3 = a – 1 = 3 – 1 = 2
db pH awal = b – 1 = 3 – 1 = 2
db nisbah vs pH awal = (a-1)(b-1) = 2 x 2 = 4
db galat = ab (r-1) = 3x3 (2-1) = 9
db total = abr-1 = (3x3x2) – 1 = 18 – 1 = 17
Fk =
c
x
b
x
a
y...
2 = 2 x 3 x 3 46 . 122 2= 833.1362
JKT = (6.442+…+6.982) – fk = 834.557 – 833.1362 = 1.4208
JKP = 2 ) 13.98 ... 97 . 12
( 2+ + 2
- fk = 1.2916
JKpH awal =
2 x 3 ) 88 . 41 73 . 41
(38.852+ 2+ 2
- fk = 0.9721
JKnisbah =
2 x 3 ) 24 . 41 07 . 41
(40.152+ 2+ 2
- fk = 0.1146
JKnisbah vs pH awal = JKP - JKnisbah - JKpH awal = 1.2916 - 0.9721 - 0.1146 = 0.2049
JKG = JKT - JKP = 1.4208 - 1.2916 = 0.1292
KTpH awal =
db JKpHawal =
2 8172 .
7 = 0.48605
KTnisbah =
db JKnisbah =
2 1146 .
0 = 0.0573
KTnisbah vs pH awal =
db JKpHawal vsnisbah=
4 2048 .
0 = 0.0512
KTG = db JKG = 9 1920 . 0 = 0.0662
F hitung pH awal = 33.4843
F hitung nisbah = 3.5679
F hitung nisbah vs pH awal = 3.9930
d. Uji lanjut Duncan
R2 = r0.05(2,9)
k
KTG
= 0.2710
R3 = r0.05(3,9)
k
KTG
= 0.2829
pH awal Jumlah nilai pH akhir
5 38.85 a
6 41.73 b
7 41.88 b
Keterangan : Angka yang diikuti huruf yang sama dalam satu kolom tidak berbeda nyata berdasarkan uji Duncan
24
Keterangan
Σy... = jumlah semua data rendemen NaLS
Σyi.. = jumlah data rendemen NaLS pada nisbah ke-i
Σy.j. = jumlah data rendemen NaLS pada pH awal ke-j
Σyij. = jumlah data rendemen NaLS pada nisbah ke-i dan pH awal ke-j
a. Model linear: Yijk = μ +
α
i + βj + αβij + εijkKeterangan:
Yijk = nilai rendemen NaLS nisbah lignin-NaHSO3 ke-i dengan pH awal ke-j,
ggggggggggdanulangan ke-k
μ = rata-rata bobot NaLS sebenarnya
α
i = pengaruh nisbah lignin-NaHSO3 ke-iβj = pengaruh pH awal ke-j
α
βij= interaksi antara nisbah reaktan ke-i dengan pH awal ke-j, dan ulangan ke-kεijk = pengaruh acak dari nisbah lignin-natrium bisulfit ke-i, pH awal ke-j, dan ulangan ke-k
b. Hipotesis yang diuji
Pengaruh nisbah lignin-NaHSO3
Ho: α1 = α2 = α3
H1: setidaknya ada satu
α
i≠ 0, i = 1, 2, 3 Pengaruh pH awal Ho: β1 = β2 = β3
H1: setidaknya ada satu β i≠ 0, i = 1, 2, 3
Pengaruh interaksi nisbah lignin-NaHSO3 dengan pH awal
Ho: αβij = 0
Lanjutan Lampiran 18 Nisbah
lignin-natrium bisulfit
pH awal Σyi..
5 6 7
1:0.4 62.43 84.19 103.15
70.62 91.97 110.04
Σyij. 133.05 176.16 213.19 522.40
1:0.5 74.12 91.48 123.12
68.54 85.94 124.93
Σyij. 142.66 177.42 248.05 568.13
1:0.6 72.24 91.75 146.49
76.90 97.09 138.89
Σyij. 149.14 188.84 285.38 623.36
c. Tabel ANOVA
Sumber keragaman db JK KT F hitung
pH awal 2 8,836.46 4418.23 240.02*
Nisbah 2 851.91 425.96 23.14*
Nisbah vs pH awal 4 565.77 141.44 7.68*
Galat 9 165.67 18.41
Total 2 10,419.83
Keterangan: * = Hipotesis ditolak
db nisbah lignin-NaHSO3 = a – 1 = 3 – 1 = 2
db pH awal = b – 1 = 3 – 1 = 2
db nisbah vs pH awal = (a-1)(b-1) = 2 x 2 = 4
db galat = ab (r-1) = 3x3 (2-1) = 9
db total = abr-1 = (3x3x2) – 1 = 18 – 1 = 17
Fk =
c
x
b
x
a
y...
2 = 2 x 3 x 3 89 . 713 , 1 2= 163,189.94
JKT = (62.432+…+138.892) – fk = 10,419.83
JKP = 2 ) 38 . 285 ... 05 . 133
( 2+ + 2
- fk = 10,254.15
JKpH awal =
2 x 3 ) 38 . 285 84 . 188
(424.852+ 2+ 2 - fk = 8,836.46
JKnisbah =
2 x 3 ) 36 . 623 13 . 568
(522.402+ 2+ 2
- fk = 851.91
JKnisbah vs pH awal = JKP - JKnisbah - JKpH awal = 10,254.15–851.91–8,836.46 = 565.77
JKG = JKT - JKP = 10,254.15–8,836.46 = 165.67
KTpH awal =
db JKpHawal =
2 46 . 836 ,
8 = 4,418.23
KTnisbah =
db JKnisbah =
2 91 .
851 = 425.96
KTnisbah vs pH awal =
db JKpHawal vsnisbah=
4 77 .
565 = 141.44
KTG = db JKG = 9 67 . 165 = 18.40
F hitung pH awal = 240.02
F hitung nisbah = 231.40
F hitung nisbah vs pH awal = 7.68
26
d. Uji lanjut Duncan
R2 = r0.05(2,9)
k
KTG
= 0.3305
R3 = r0.05(3,9)
k
KTG
= 0.3449
pH awal Rendemen NaLS
5 424.85 a
6 542.42 b
7 746.62 c
Nisbah Rendemen NaLS
1:0.4 522.40 a
1:0.5 568.13 a
1:0.6 623.36 b
Keterangan : Angka yang diikuti huruf yang sama dalam satu kolom tidak berbeda nyata berdasarkan uj Duncan
Keterangan
Σy... = jumlah semua data kemurnian natrium lignosulfonat
Σyi.. = jumlah data kemurnian pada nisbah ke-i
Σy.j. = jumlah data pada pH awal ke-j
Σyij. = jumlah data kemurnian pada nisbah ke-i dan pH awal ke-j
a. Model linear: Yijk = μ +
α
i + βj + αβij + εijkKeterangan:
Yijk = nilai kemurnian nisbah lignin-NaHSO3 ke-i dengan pH awal ke-j, dan ulangan
aaaaaaaaaaake-k
μ = rata-rata kemurnian
α
i = pengaruh nisbah lignin-NaHSO3 ke-iβj = pengaruh pH awal ke-j
α
βij = interaksi antara nisbah reaktan ke-i dengan pH awal ke-j, dan ulangan ke-kεijk = pengaruh acak dari nisbah lignin-NaHSO3 ke-i, pH awal ke-j, dan ulangan ke-k
b. Hipotesis yang diuji
Pengaruh nisbah lignin-NaHSO3
Ho: α1 = α2 = α3
H1: setidaknya ada satu
αi
≠ 0, i = 1, 2, 3 Pengaruh pH awalHo: β1 = β2 = β3
H1: setidaknya ada satu β i≠ 0, i = 1, 2, 3
Pengaruh interaksi nisbah lignin-NaHSO3 dengan pH awal
Ho: αβij = 0
Lanjutan Lampiran 19 Nisbah
lignin-natrium bisulfit
pH awal Σyi..
5 6 7
1:0.4 80.14 84.35 76.68
80.00 82.79 75.90
Σyij. 160.14 167.14 152.58 479.86
1:0.5 77.12 76.29 71.13
76.02 77.43 70.59
Σyij. 153.14 153.72 141.72 448.58
1:0.6 84.48 79.86 68.12
83.24 78.42 69.32
Σyij. 167.72 158.28 137.44 463.44
28
c. Tabel ANOVA
Sumber keragaman db JK KT F hitung
pH awal 2 259.8204 129.9102 207.1272*
Nisbah 2 81.6041 40.8020 65.0543*
Nisbah vs pH awal 4 78.8577 19.7144 31.4324*
Galat 9 5.6452 0.6273
Total 17 425.9274
Keterangan: * = Hipotesis ditolak
db nisbah lignin-NaHSO3 = a – 1 = 3 – 1 = 2
db pH awal = b – 1 = 3 – 1 = 2
db nisbah vs pH awal = (a-1)(b-1) = 2 x 2 = 4
db galat = ab (r-1) = 3x3 (2-1) = 9
db total = abr-1 = (3x3x2) – 1 = 18 – 1 = 17
Fk =
c
x
b
x
a
y...
2 = 2 x 3 x 3 88 . 1392 2= 107629.4408
JKT = (80.142+…+69.322) – fk = 425.9274
JKP = 2 ) 137.44 ... 14 . 160
( 2+ + 2
- fk = 420.2822
JKpH awal =
2 x 3 ) 74 . 431 86 . 479
(481.002+ 2+ 2 - fk = 259.8204
JKnisbah =
2 x 3 ) 44 . 463 58 . 448
(479.862 + 2+ 2
- fk = 81.6041
JKnisbah vs pH awal = JKP - JKnisbah - JKpH awal = 420.2822 – 81.6041 – 259.8204 = 78.8557
JKG = JKT - JKP = 429.9274 – 420.2822 = 5.6452
KTpH awal =
db JKpHawal =
2 8204 .
259 = 129.9102
KTnisbah =
db JKnisbah =
2 6041 .
81 = 40.8020
KTnisbah vs pH awal =
db JKpHawal vsnisbah=
4 8577 .
78 = 19.7144
KTG = db JKG = 9 6452 . 5 = 0.6237
F hitung pH awal = 207.1272
F hitung nisbah = 365.0543
F hitung nisbah vs pH awal = 31.4324
d. Uji lanjut Duncan
R2 = r0.05(2,9)
k
KTG
= 1.7920
R3 = r0.05(3,9)
k
KTG
= 1.8704
pH awal Jumlah nilai % kemurnian
5 481.00 a
6 479.14 b
7 431.74 c
Nisbah Jumlah nilai % kemurnian
1:0.4 479.86 a
1:0.5 448.58 b
1:0.6 463.44 c
PENGARUH NISBAH REAKTAN LIGNIN-NaHSO
3DAN pH
PADA PRODUK NATRIUM LIGNOSULFONAT
TESAR DZIKRULLOH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
TESAR DZIKRULLOH. Pengaruh Nisbah Reaktan Lignin-NaHSO3 dan pH pada Produk
Natrium Lignosulfonat. Dibimbing oleh Dra. GUSTINI SYAHBIRIN, MS dan Drs. DUDI TOHIR MS.
Lignin diisolasi dari lindi hitam dengan pereaksi H2SO4 20%. Sulfonasi terhadap
lignin menghasilkan NaLS yang dapat dimanfaatkan sebagai zat pendispersi, pengikat, penukar ion, dan aditif pada beton. Pada penelitian ini dilakukan sulfonasi terhadap lignin dengan nisbah reaktan lignin-NaHSO3 1:0.4, 1:0.5, dan 1:0.6 dan pH awal 5, 6, atau 7.
Parameter yang diamati ialah kemurnian, pH akhir, dan Rendemen NaLS. Kenaikan pH awal meningkatkan pH akhir dan rendemen NaLS, tetapi menurunkan kemurniannya. Kenaikan nisbah lignin-NaHSO3 meningkatkan rendemen dan menurunkan kemurnian,
tetapi tidak berpengaruh pada pH akhir NaLS. Kondisi optimum yang dipilih pada pH awal 6 dan nisbah lignin-NaHSO3 1:0.6. Pencirian gugus fungsi menggunakan
spektrofotometri inframerah menunjukkan telah terjadi reaksi sulfonasi terhadap lignin. Hal ini dapat dilihat dengan terbentuknya serapan baru pada bilangan gelombang 626 nm yang menunjukkan ikatan C–S.
ABSTRACT
TESAR DZIKRULLOH. Study The Influence of Reactant Ratio Lignin-NaHSO3 and pH
Towards Sodium Lignosulfonate Product. Supervised by Dra. GUSTINI SYAHBIRIN, MS and Dr. DUDI TOHIR, MS.
Lignin was isolated from black liquor using H2SO4 20%. Sulfonation of lignin
produced NaLS which can be used as dispersants, binders, ion exchangers, and concrete additives. In this research, sulfonation was carried out towards lignin with ratio of lignin-NaHSO3 of 1:0.4, 1:0.5, and 1:0.6, and initial pH of 5, 6, or 7. Parameters observed were
purity, final pH, and yield of NaLS. The upsurge of initial pH increased the final pH and NaLS yield, but decreased its purity. The upsurge of ratio of lignin-NaHSO3 increased
NaLS yield and decreased its purity, but did not affect the final pH of NaLS. The chosen optimum condition was on pH of 6 and ratio of lignin-NaHSO3 of 1:0.6. Characterization
PENDAHULUAN
Latar Belakang
Perkembangan industri pulp dan kertas dari tahun ke tahun semakin meningkat seiring dengan meningkatnya permintaan. Permintaan dunia untuk berbagai jenis kertas pada tahun 1990 sebesar 239,428,000 juta ton dan meningkat menjadi 369,085,000 juta ton pada tahun 2005 (Pulp and Paper Industry 2006). Produksi pulp Indonesia pada tahun 2006 sebesar 5.7 juta ton dan meningkat menjadi 5.8 juta ton pada tahun 2007 (Indra 2007). Peningkatan produksi pulp dan kertas juga diikuti oleh meningkatnya masalah pencemaran lingkungan.
Pulping adalah proses pemisahan serat selulosa dari bahan-bahan berlignoselulosa baik kayu maupun nonkayu dengan cara kimia, mekanis, atau semikimia. Pulping cara kimia melibatkan bahan kimia, di antaranya proses sulfit, kraft, dan soda. Pulping cara mekanis dapat berupa penggilingan atau asah batu dan thermomechanical pulping, sedangkan pulping cara semikimia merupakan gabungan dari cara kimia dan mekanik, misalnya proses soda dingin, soda panas, dan semikimia sulfit netral (TAPPI 2003; Klyosov et al. 1997).
Hasil samping proses pembuatan pulp ialah larutan sisa pemasak berupa limbah cair yang dikenal dengan lindi hitam (black liquor) yang secara potensial dapat mencemari lingkungan. Limbah industri pulp tersebar ke seluruh ekosistem dan menema. Menurut Rudatin (1989), belum banyak manfaat yang dapat diambil dari lindi hitam kecuali dibakar kembali untuk memperoleh nilai kalornya. Pemanfaatan lindi hitam menjadi bahan-bahan yang bernilai ekonomis umumnya sangat tergantung pada bahan-bahan pembantu serta proses yang digunakan, yang biasanya sangat mahal. Pengolahan lindi hitam di dalam industri pulp dan kertas umumnya berorientasi pada upaya pemanfaatan kembali bahan kimia pemasak yang terkandung di dalamnya, sedangkan seluruh senyawa organik dalam lindi hitam dimanfaatkan sebagai bahan bakar (Lubis 2007).
Lignin merupakan komponen terbesar dalam lindi hitam sekitar 46% dari padatan totalnya (Sjostrom 1995). Reaksi sulfonasi terhadap lignin menghasilkan lignosulfonat (Syahmani 2000). Lignosulfonat antara lain digunakan sebagai pengatur viskositas pada pengeboran minyak (Fengel & Wegener
1995), potensi penggunaan lignosulfonat ini sangat besar untuk sumur-sumur minyak di Indonesia (Syahmani 2000). Jain & Kulkarni (1991) menyatakan bahwa hidrofilisitas gugus sulfonat menyebabkan lignosulfonat dapat berfungsi sebagai zat pendispersi, pengikat, penukar ion, dan zat aditif pada beton.
Penelitian ini bertujuan mengkaji pengaruh nisbah reaktan lignin-natrium bisulfit (NaHSO3) dan pH pada produk
natrium lignosulfonat (NaLS).
TINJAUAN PUSTAKA
Lindi Hitam
Lindi hitam merupakan limbah cair yang berwarna coklat kehitaman, berbau seperti telur busuk dengan persen padatan 2.0– 80.0%, pH 10–13, bobot jenis 1.02–1.60 g/ml yang dihasilkan dari pembuatan pulp (Weyerhaeuser 2004). Pulping merupakan proses pelarutan lignin untuk memisahkan selulosa.
Menurut Sjostrom (1995), lindi hitam merupakan campuran sangat kompleks yang mengandung sejumlah besar komponen dengan struktur dan susunan yang berbeda. Bahan organik dalam lindi hitam yang dihasilkan setelah pembuatan pulp pada dasarnya terdiri atas lignin, produk-produk degradasi karbohidrat, ekstraktif, dan produk-produk hasil reaksi.
Lignin
Gambar 1 Struktur p-koumaril alkohol (a), koniferil alkohol (b), dan sinapil alkohol (c) (Sjostrom 1995).
Fenger dan Wegener (1995) menyatakan bahwa p-koumaril alkohol, koniferil alkohol, dan sinapil alkohol merupakan prekursor pembentuk lignin (Gambar 1). Lignin dapat dibagi menjadi beberapa kelas menurut unsur-unsur strukturnya, yaitu (Sjostrom 1995; Achmadi 1990):
a. Lignin guaiasil: terdapat pada kayu lunak, sebagian besar merupakan produk polimerisasi dari koniferil alkohol (Gambar 2).
b. Lignin guaiasil-siringil: terdapat pada kayu keras dan rerumputan, didominasi oleh produk polimerisasi dari kopolimer koniferil alkohol dan sinapil alkohol.
Gambar 2 Model struktur lignin guaiasil (Santoso 2003).
Lignin berbentuk amorf dan berwarna coklat cerah. Lignin tidak larut dalam air, asam, dan hidrokarbon. Karena sifatnya tidak larut dalam asam, asam sering digunakan untuk uji kuantitatif lignin. Lignin tidak dapat mencair, tetapi dapat melunak dan kemudian menjadi hangus bila dipanaskan. Lignin yang diperdagangkan larut dalam alkali encer dan dalam beberapa senyawa organik (Santoso 1995).
Kurang lebih setengah dari bahan organik yang terdapat dalam larutan sisa pemasak pulp adalah lignin. Berbagai teknik isolasi telah dipelajari, namun pada prinsipnya sama, yaitu diawali dengan proses pengendapan padatan. Menurut Sjostrom (1995), isolasi lignin dibedakan menjadi 3 metode, yaitu isolasi dengan metode pengasaman, metode enzimatis, dan metode asah batu.
Pereaksi yang biasa digunakan untuk mengendapkan lignin ialah H2SO4 pekat dan
HCl pekat (Salminah 2001). Pengendapan lignin dalam larutan sisa pemasak terja