Aeromonas caviae
WS7b DAN EKSPRESINYA PADA
TANAMAN KENTANG KULTIVAR DESIREE
NI MADE ARMINI WIENDI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
suami tercinta Alex Hartana,
dan
anak-anak tersayang
Dengan ini saya menyatakan bahwa disertasi yang berjudul Konstruksi FuSi Transkripsi Gen Kltinase Asal Aeromonas cav;ae WS7b dan Ekspresinya Pad .. Tanaman Kentang Kultivar Desiree adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber ir,formasi yang berasal atau dikutip dari karya yang telah diterbitkan maupun tidak diterbitkan dan penulis lain telah disebutkan dalam teks dan dicantumkan dalam Dattar Pustaka di
NI MADE ARMINI MEND!. Konstruksi Fusi TianskJipsi Gen Kitinase asal Aeromonas
caviae
WS7b dan Ekspresinya Pada Tanaman Kentang Kultivar Desiree. Ditlimbing oleh G. A. WATIIMENA, ANTONIUS SUWANTG, HA.iRIAL ASWIDINNOOR, MEITY S. SINAGA, dan SUHARSONO.NI MADE ARMINI WIENDI. Construction of Transcriptional Fustons of Chitinase Gene from Aeromonas cav;ae WS7b and Their Expresskm in
rotato
cv Oeosiree. Advisors: G. A. WATTIMENA, ANTONIUS SUWANTO, HAJRIAL ASWlDINNOOR, MEITY S. SINAGA, and SUHARSONOFungal and nematode disease are a major limiting factor
in
potato production areas, not only plants are kilted and reduced in the field, but also cause signifICant production losses (30--100%). Chitin, a セQNTMャゥョォ・、@ polymer of N-aoetytglucosamine, is a major structural component in the cell walls of nematode andmost
fungi except theOomycetes. Chitinase catatyse the hydrolysis of chitin. Due
to the
absenceof
chitin in the plant cells it should be possible to engineer chitinase gene expression in these cells without negative effects on plant growth and development. A 2925 bp bacterial chitinase gene (chi) from soH borne bacteria Aeromonas caviae stnir1 WS7b codes for chitinolitic protein of 864 amino acids. The 35SCaMV promoter was transcriptionally fused into the5'
chi gene and the 3' endwas
fused to an octopin synthase potyadenylation site to generate a binary plasmid designated as pARS51. A second binary plasmid, pARS52, containschi
gene fused to 35SCaMV promoter in reversed orientation relative to the 35SCaMV promotor orientation. Nucleotide modifICation for over expresstion of chi gene was performed through oligonucleotide mutagenesis around ATG of chi gene and fused to 35SCaMV promotor and ocs poIyadenyiation site to generate a binary plasmid pChIM0D631. The nptll gene was used for a kanamycin resistance selection for transformed plant cells. Each of the resulting constructions were introduced into A. tumefaciens LB4404 and used to generate multiple independent transgenic potato cv. Desiree. We analysed the expression ofchi
gene from fifty independent plants which transformed with either pARS51 or pARS52. Forty eight plants yietded PCR amplificationwith
the expected size. Two transformants which transformed with pARS52 have no expected band. Soothem hybridization showed variability in T-DNA copy numbers from 1-5 copies. Transcription analysis of chi gene using RT-PCR with two spesific primers are (ARCHI1: 5'CCATGGTAAGTCCAAAACTTTCCCTG). (ARCHI2: 5'GTCCATCCGCCGACA GACGGCA), and promoter primer of 35SCaMV, annealed to the translational codon of chi gene. Seven independent transgenic plants canying chi from pARS51 yielded PCR amplifICation with the expected size with different intensity of DNA bands. Crude protein isolated from transgenic and non transgenic plants was found inhibitory toFusariUm oxysporum
in in vitro assay. The effect of inhibition of crude protein vary among transgenic lines. Phenotype evaluation of 11 transgenic lines carrying chi gene from pARS51, 1 line from pARS52, 1 line without T -DNA, and nontransgenic plant, were conducted for in vitro tuberizatton. Line 511.8 has the higest amount of mini tuber. Phenotype of transgenic lines at To andGo
showed vary among transgenic lines compared to the nontransgenic line. Three transgenicpotato
6nes carrying chi gene from pARS51 (511.8, 511.9 and 511.t7) have the highest amount of tuber production in the greenhousetest.
Therefore, these transgenic potato lines could beAeromonas caviae
WS7b DAN EKSPRESINYA PADA
TANAMAN KENTANG KULTIVAR
desireセ@
NI MADE ARMINI WIENDI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Sekolah Pascasarjana Institut Pertanian Bogar
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama Ni Made Armini Wiendi
NIM : 95520
Disetujui Komisi Pembimbing
Prof. Dr. Ir. G.A. Wattimena. MSc.
Prof. Or. Ir. Antonius Suwanto. MSc. Anggota
Dr. Ir. Meity . Sinaaa. MSc. Anggota
Ketua Program Studi Agronomi
Or. Ir. Satrivas lIyas. MS.
Tanggal Ujian: 6 Junl 2005
Ketua
Diketahui
t2
セM' ,
---Or.lr. atrial Aswidlnnoor. MSc. Anggota
Dr. Ir Suharsono OEA
Anggota
セ・ォッャBィ@ Pascasaljana
Tanggal Lulu.:
27
J\ll
2Ilfi
Konstruksl lusl transkripsi
gen
kltlnase asal Aen:mronascaviae
WS7b dan ekspreslnya セ、。@ tanam;,n kentang kutth,a; Il9t;lree mal upakan judul disertasi yang dibuat penulis sebsgai salahsatu
syarat untuk memperoleh gelar Doktor pads Program Sludi Agronomi, Sekotah Pascasarjana, Institut Pertanian Bogor,Bogor.
Puji syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa atas segala berkat dan karunia-NYA mulai dari awal kuliah sampai karya ilmiah ini berhasil diselesaikan.
Penulis mengucapkan terima' kasih yang tidak terhingga kepada 8apak Prof. Dr. Ir. G.A. Wattimena, MSc; Prof. Dr. Ir. Antonius Suwanto, MSc; Dr. Ir. Hajrial Aswidinnoor, MSc; Or. Ir. Meity S. Sinaga, MSc; dan Dr. Suharsono, DEA, atas semus
bimbingan dan saran yang telah diberikan selama penyusunan proposal, penelman,
sampai dengan penulisan disertasi ini.
Penulis mengucapkan terima kasih kepada Bapak
Dr.
Surnamo, MSc; Dr. Sri Hendrastuti Hidayat; dan Dr. Endang Nurhayati atas kesediaanllya menjadi penguji diluar komisi, dan atas semua saran-saran.
Terima kasih penulis ucapkan kepada pengelola Program beasiswa TMPD dan
Program Sandwich, URGE, Direldorat Jendral Pendidikan Tinggi; dan Program Riset
Unggulan Terpadu IX, atas dukungan dana yang telah diberikan selama pendidikan
dan penelrtian ini. Penulis juga mengucapkan terima kasih kepada Prof. Dr. Ir. G. A. Wattimena. MSc yang teiah membantu dana penelrtian dari Proyek Hibah Tim •
URGE. Penulis mengucapkan terima kasih kepada Prof Dr. Antonius Suwanto yang
dan Hortikultura, Oekan Fakultas Pertanian, dan Rektor InstiM Pertanian Bogor, yang
telah memberikan kesempatan kepada penulis untuk mengikuti pendidikan program
Doktor. Terima kasih juga penulis ucapkan kepada Oekan Sekolah p。ウ」。ウ。セ。ョ。L@
Institut Pertanian Bogor, atas segala bantuan yang diberikan selama pendidikan
benangsung.Terima kasih juga penulis ucapkan kepada Direktur PP Bioteknoiogi,
Direktur PP IImu Hayat, IPB, yang telah memberikan kesempatan kepada penulis
untuk melaksanakan penelitian di Pusat penelnian tersebut. Kepada Head of
Department of Genomtca, PRI, The Nethenands, Prof. Dr. W. J. Stiekema, penulis mengucapkan terima kasih atas kesempatan yang diberikan untuk melaksanakan
penelitian sehingga sebagian dari penelitian untuk program Doktor dapat diselesaikan
dengan baik, serta bimbingan dan saran yang diberikan selama penulis menjalani
program Sandwich. Kepada Dr Andy Pereira, Dept. Of Genomica, PRI, The
Netherlads, penulis mengucapkan lerima kasih atas sagala bimbingan dan
saran-saran di bidang bioloQi molekular selama penulis melaksanakan penelitian. Terima
kasih juga penulis ucapkan kepada Or Oyah Manuhara yang telah banyak membantu
dalam melakukan percobaan analisis antifungal.
Kepada teman-teman Or. Ella Matzkwitch; Dr. Raffaella Grico; Nayelly
Martinez, MSc; Gert van Anckel; Dr Dion Florae; dan Dr. Edwin, penulis ucapkan
terima kasih atas segala bantuannya telah mengajarkan tehnik-tehnik molekular dan
juga literatur yang sangat membantu penyelesaian karya ilmiah ini. Penulis juga
mengucapkan terima kasih kepada Ir. Pribowo Dwi Saputro, Ir. Abraham Karuniawan dan Ir Rosyida Aif'Yanti yang telah banyak membantu penetitian evaluasi tanaman
transgenik baik secara In vitro maupun in vNo. Penults juga mengucapkan terima kasih kepada BapakJlbu
stat
pengajar di Oepartemen Agronomi dan Hortikultura,Fakultas Pertanian, IPS, atas semangat dan dorongan yang diberikan.
Secara khusus penulis menyampaikan penghargaan dan terima kasih yang ,
dorongan dan doa yang tiada henti sehingga penulis dapat menyelesaikan pendidikan. Juga kepada Ayahnda almarhum, lbunda, dan kakak serta adik yang telah memberikan perhatian, dorongan dan semangat, penulis ucapkan terima kasih.
Penulis berharap semoga karya ilmiah ini bennanfaat dan dapat memberikan sumbangan pemikiran dibidang ilmu pengetahuan terutama dalam perakitan tanaman transgenik resisten penyakit.
Penulis dilahirtan di Oenpasar- Bali pada tangpal 12 Apri! 1961 sebag3i anak
ketujull ciari sepuluh bersaudara dari pasangan I Nycman Windi (A1marhum) dan Ni
Nyoman Rodja. Pendidikan sarjana ditempuh di Jurusan Agronomi, Fakultas Pertanian, Institut Pertanian Bogar dan lulus tahu" 1985. Penulis metanjutkan pendidikan Magister tii Program Sludi Agronomi, Program Pascasarjana, Institut Pertanian Bogar dan lulus pada tahun 1992. Pada tahu" 1995 penulis diterima pada
program studi yang sarna untuk menempuh program Doktor. Beasiswa pendidikan
diperoleh dari TMPD. Penelitian program Doktor sebagian dikerjakan di Department
of Genomica, Plant Research International, Wageningen, The Netherlands, dengan
beasiswa Sandwich Program, URGE, Oirektorat Jendral Perguruan Tinggi dari bulan
Oktober 1999 sampai dengan Agustus 2000.
Penulis menjadi
stat
pengajar di Departemen Agronomi dan Hotikultura,Fakultas Pertanian, InstiM Pertanian Bogor, sejak tahun 1987 sampai dengan
sekarang. Pada tanggal 3 Juni 1989 penulis menikah dengan Alex Hartana, dan telah
dikaruniai dua orang putri dan seorang putra yaitu Andina Prameswari, Amanda
Haiamar.
DAFTAR TABEL...
XV
DAFTAR GAMBAR...
XVI
DAFTAR LAMPI RAN ...
XX
I
PENDAHULUAN.c... ...
1
1.1 Latar Belakang... ... 1
1.2 Tujuan Penelitian ...
6
1.3 Hipotesis ... _...
7
II
TINJAUAN PUSTAKA ... ... ... ...
82.1 Tanaman Kentang ...
8
2.2 Mekanisrne Pertahanan Tanaman Terhadap Cendawan Patogen ... 11
2.3 Patogenesis Cendawan Patogen ... _...
17
2.3.1 Mekanisme Inleksi oleh Patogen...
17
2.3.2 Interaksi Gen Antara Inang dan Palogen ...
18
2.4 Enzim Kitinase... .... ... ... ... ... ... ... ... ... ...
19
2.4.1 Pengelompokan Enzim Kitinase...
21
2.4.2 Gen Penyandi Enzim Kitinase...
22
2.4.3 Mekanisme Hidrolisis Kitin oleh Enzim Kitinase ...
23
2.5 Rekayasa Genetika Tanaman Resisten Cendawan Patogen ...
28
2.6 Ekspresi Gen pada Tanaman Transgenik...
34
2.6.1 Metode Transformasi Gen Spesifik...
34
2.6.2 Target Integrasi Gen Spesifik pada Genom Tanaman...
38
2.6.3 Jumlah Copy Gen Spesifik pada Genom Tanaman...
40
2.6.4 Posisi Integrasi Gen Spesifik pada Genom Tanaman ...
44
2.6.5 Promotor Gen Spesifik...
45
2.6.6 Sekuen DNA Dan Gen Spesifik...
50
2.6.7 Metilasi DNA Gen Spesifik pada Tanaman ...
56
III BAHAN DAN METODE ... ... ... .... ... ... ... ... ...
62
3.1. Tempal dan Waktu PenelHian ...
62
3.2. Bahan-bahan Penelitian...
64
3.2.1 Bahan Tanaman ...
64
3. 3. Isolasi dan Verifikasi DNA...
68
3.3.1 Isolasi DNA Plasmid Sa!deri... ... ...
6e
3.3.2 Verifikasi DNA Plasmid ... ...
70
3.3.3 Purifikasi Fragmen
dエセ@dari Gel Agarose. ...
70
3.3.4 Reaksi
Fill-inPada Fragmen DNA...
71
3.3.5 Transformasi dan Seleksi Plasmid Rekombinan pada 8akteri...
72
3.3.6 Isolasi dan Verifikasi DNA Genom Total Tanaman Kentang...
73
3.4 Amplifikasi DNA Secara
In Vitrodengan Polymerase Chain Reaction (PCR)
75
3.4.1 Sekuensing DNA dengan peR ...
75
3.4.2 Modifikasi Basa Nukleotida DNA dengan PCR...
76
3.4.3 Analisis T-DNA pada Genom Tanaman Transgenik dengal"! PCR...
77
3.5 Isolasi RNA Total Tanaman Transgenik...
78
3.6 Isolasi Protein Kasar
(crude protein)Tanaman Kentang Transgenik...
79
3.7 Metode Penelitian ...
80
Percobaan I Sekuensing dan Analisis Sekuen DNA Geo
chiAsal Balderi
Aeromonas cav;aestrain WS7b .... ... ...
80
1.1 Sekuensing DNA dari Gen
chi......80
1.2 Analisis Sekuen DNA dari Gen
chi
...
81
Percobaan II Konstruksi Fusi Transkripsi Gen
chiAsal Bakteri
Aeromonas caviaestrain WS7b ke dalam Vektor Binary ...
81
11.1 Konstruksi Fusi Transkripsi Gen
chi ...81
11.2 Modifikasi Basa Nukleotida Gen
chi ...88
Percobaan III Transformasi Gen
chike dalam Tanaman Kentang Kultivar
Desiree dan Analisis Tanaman Transgenik ...
91
111.1 Transtonnasi Gen
chike dal?lm Sel Kentang...
91
111.2 Analisis T-ONA Tanaman Kandidat Tanaman Transgenik...
93
111.3 Analisis mRNA pada Individu Tanaman Transgenik ...
95
Percobaan IV
PercobaanV
Evaluasi Aktivitas Antifungal Enzim Kitinase Dari
Tanaman Transgenik Terhadap Pertumbuhan Hifa
Cendawan
Fusarium oxysporum ... .Evaluasi Keragaan Fenotipe Tanaman Kentang Transgenik
Pembawa Gen
chiSecara
In Vitrodan
In VivoPada
Generasi To dan Go ... .
97
Secara
In Vitro...
... ...
98
V.2. Tahap II Evaluasi Keragaan Fenotipe Tanaman Kentang Transgenik
Generasi To... .
99
V.3. Tahap III Evaluasi ker3gaan Fef'lotipe Tanaman
k・ョセ。ョY@Transgenik Generasi Umbi Go ... ...
101
IV HASIL DAN PEMBAHASAN. .... ... ...
103
4.1
Sekuen Gen
chi
Asal Aeromonas
caviae
WS7b...
103
4.2 Konstruksi Fusi Transkripsi dan Modifikasi Gen
chi
...
107
4.3 Transformasi Gen
chi
Kedalam Sel Kentang dan Analisis Molekular
Tanaman Transgenik ...
113
4.4 Analisis T-ONA pada Kandidat Tanaman Transgenik Kentang ...
116
4.5 Analisis Transkripsi Gen
chi
pada Tanaman Transgenik Kentang...
122
4.6 Pengujian Aktivitas Antifungal dan Protein Total Tanaman Transgenik
Kentang ... ...
124
4.7 Evaluasi Daya Pengumbian Tanaman Trallsgeni Kentang Secara
In Vitro... 1284.8 Evaluasi Keragaan Fenotipe Tanaman Kentang Transgenik Generasi
Umbi To
132
4.9 Evaluasi Keragaan Fenotipe Tanaman Kentang Transgenik Generasi
Umbi Go
142
Pembahasan Umum ...
152
KESIMPULAN ... ...
157
SARAN. ...
158
DAFTAR PUSTAKA...
159
Halaman
1 Gatur bakteri. cendawan, darl p!asmid yang digunakan dalam
penelitian
ini... ...
66
2
Jumtah eksplan kentang Desiree membentuk kalus dan eksplan
terkontaminasi ." ... ", ... '" ... _,., ... '...
1143
Kecepatan dan keserempakan pembentukan umbi dari galur -galur
kentang transgenik dan nontransgenik secara
in vitro ....... ' ... ,' ... "....129
4 Rata-rata jumlah umbi per botol dan bobot basah umbi per umbi pada sistemMPC dan
Mec
dan tanaman kentang transgenik dan nontransgenik ...
130
5
Rekapitulasi
hasit uji F peubah kUantitatif pada gatur transgenik dan
non transgenik... 134
6 Pengamatan tinggi tanaman, jumlah buku, jumlah cabang dan diameter
batang utama pada 8 MST ... '"...
136
7 Rata-rata jumlah bunga, jumlah bunga jadi buah, waktu berbunga, panjang
tangkai dan putik bunga, diameter
korola ... '"
138 8 Pengamatan jumlah umbi, babot umbi, diameter umbi, dan jumlah mata umbidan tanaman TO ... " ... ". ... ... ... ... 140 9 Rekapitulasi Uji F terhadap beberapa peubah pada percobaan evaluasi
keragaan fenotipe galur kentang transgenik pembawa gen kitinase
G
o .... ___
144 10 Nilai rata-rata tinggi tanaman, jumlah buku, dan jumlah batang pada umur8 MST...
145
11 Rata-rata jumlah bUnga tiap tanaman, waktu berbunga, panjang tangkaibunga , diameter korola, dan panjang tangkai tandan.. ... ... 146
12
Rata-rala jumlah bunga jadi buah, jumlah buah tiap tanaman, bobot tiap
buah, dan diameter buah ... 147
13 Nilai rata-rata jumlah umbi tiap tanaman,
bobot
tiap umbi,bobot
umbiHalaman
1 Diagram homologi yang dapat menginduksi gene silencing dan transgen
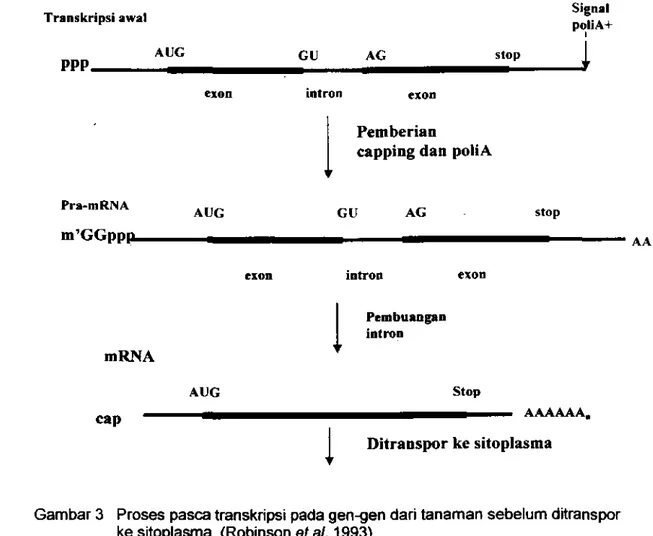
pada tanaman (Matzke et al. 1994)... 41 2 StruktUf gen tanaman dan mekanisme ekspresir:ya membentuk mRNA
(Robinson et
al.1993)...
46
3 Proses pasca transkripsi pacta gen-gen dari tanaman sebelum
ditranspor ke sitoplasma (Robinson at al.1993) ... ,... 53 4 Skema alur percobaan dalam penelitian konstruksi tusi transkripsi gen
kitinase asal bakteri
A.
caviae strain WS7b dan ekspresinya padatanaman kentang kultivar Desiree ...... ", ... '...
64
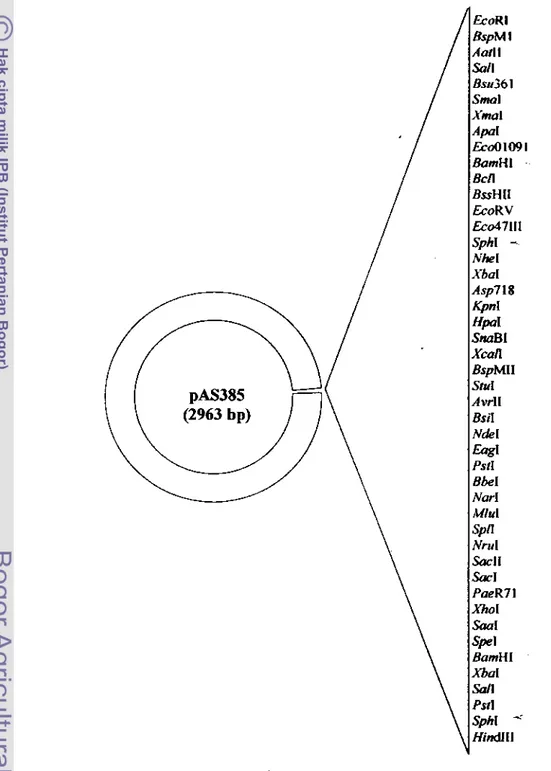
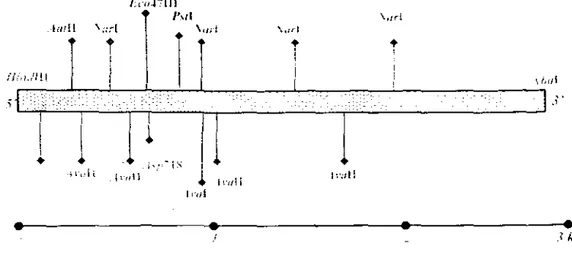
5 Peta plasmid pAS385 yang digunakan dalam penelitian ini ... 82 6 Peta plasmid pART7 (a) dan pART27(b) yang digunakan dalam penelitian ini 83
7
Skema pemotongan pAS385 dengan enzimEcoRV
dan isolasi fragmengen
chi
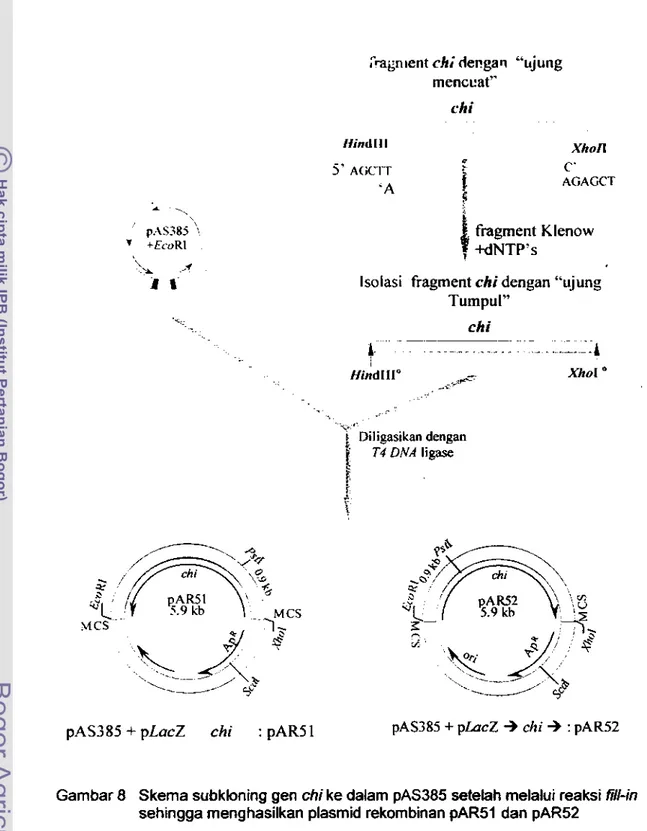
dari pWS506 ... 848 Skema subkloning gan
chi
ke dalam pAS385 setelah melalui reaksifill-in
sehingga menghasilkan plasmid rekombinan pAR51 dan pAR52 ... 85
9 Subkloning gan
chi
searah promotor 35SCaMV ke dalam plasmid dan dilanjutkan ke plasmid pART27 untuk menghasilkan ptasmidrekombinan pARS51...
86
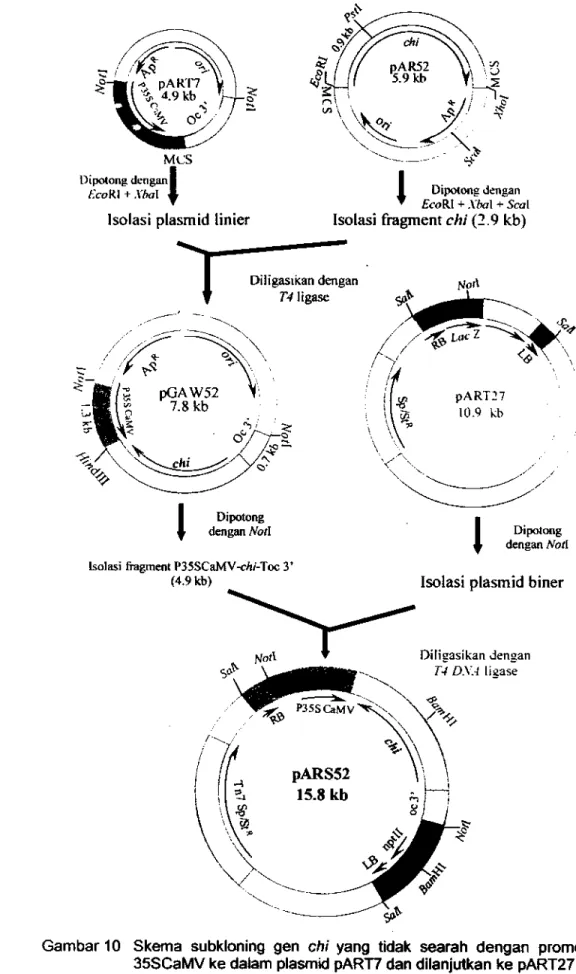
10 Skema subkloning gen
chi
yang tidak searah dengan promotor 35SCaMVke dalam plasmid pART? dan dilanjutkan ke pART27 untuk menghasilkan
plasmid rekombinan pARS52... ... 87
11
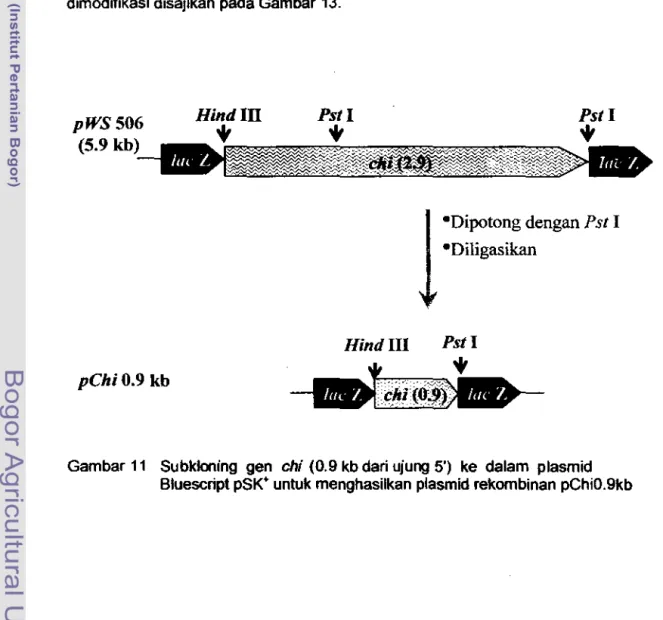
Subkloning gen
chi(0.9 kb dan ujung 5') ke dalam plasmid
Bluescript pSK· untuk menghasilkan plasmid rekombinan pChiO.9kb ... 89
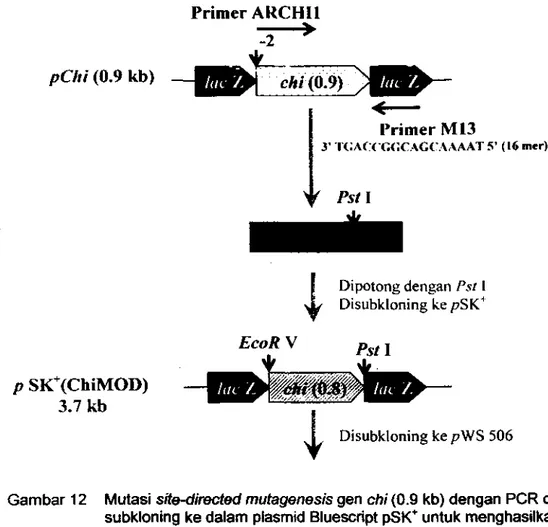
12 Mutasi
site-directed mutagenesisgell
chi(0.9 kb) dengan PCR dan
subkloning ke dalam plasmid BluescriptpSt<'"
untuk menghasilkanplasmid rekombinan pSK'(ChiMOD)...
90
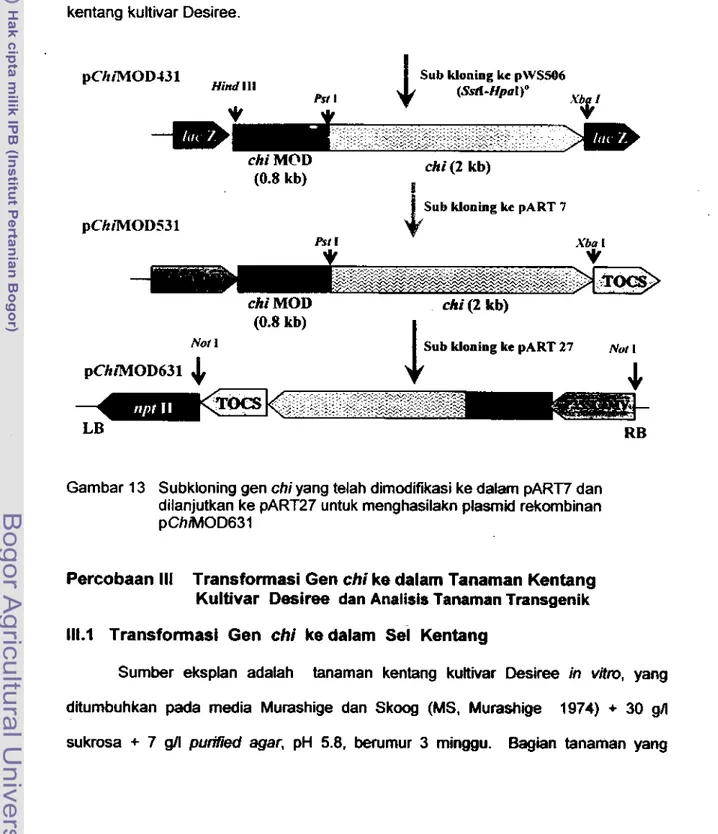
13 SUbkloning gen
chiyang telah dimodifikasi ke dalam pART? dan
dilanjutkan ka pART27 untuk menghasilkan ptasmid rekombinan
pChiM0D63 ...
91
14 Sekuen gen
chiasal bakteri Aeromonas
caviaeWS7b (Malik at
aI.2003). Sekuen yang berwama merah adalah kodon inisiasi dan kodon
16 Pohon pilogenetik gen
chi
dan tanaman, balden, dan c:endawan yang dibuat berdasarkan sekuen bacaan(ORF: Open Reading Frame)
dari mz:lsing-masir.g gen. eh!ORF adalah gen eM yang bcraec:.1 dan baktenAeromonas caviae
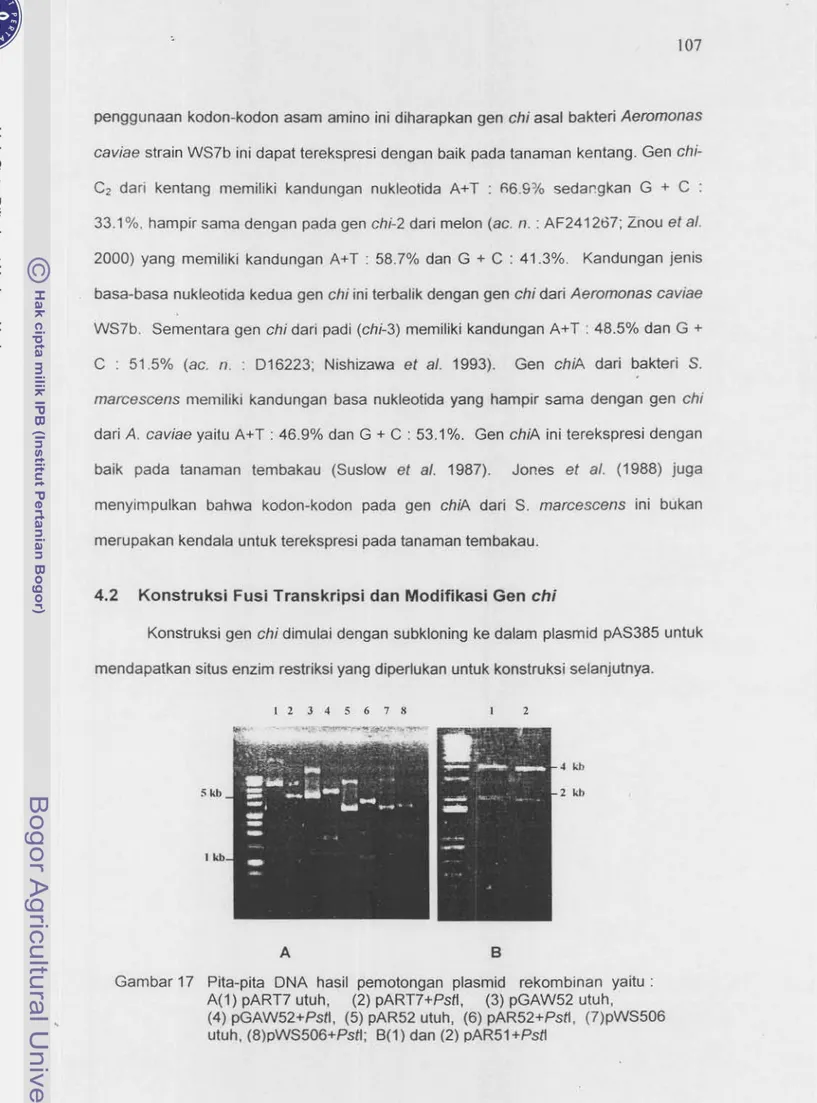
WS7b yang digunakan dalam penelitian ini ... 10617 Pita-pita DNA hasil pemotongan plasmid rekombinan yaitu :
A(1) pART7 utuh,
(2) pART7+PsII,
(3) pGAW52 uteh,
(4) pGAW52+Psft, (5) pAR52 utuh, pAR52+Psft, (7)pWS506 utuh,
(8)pWS506+PsII; 8(1) dan (2) pAR51+Psft ...
107
18 Pita-pita hasil pemotongan plasmid rekombinan pGAW51 dan
pGAW52. (A) lajur 1-2: pGAW51+8amHI,lajur
3-4:
pGAW51+PsII;
(8) Lajur 1 : pGAW51+8amHI, lajur 2: pGAW51+Noft;
(C)
pGAW52+Xhol+Xbal ...
108
19 Pita-pita DNA hasil pemotongan plasmid rekombinan pARS51 danpARS52. (A) Lajur 1 :pARS51 +8amHI, lajur 2 : pARS51 +Noft; (8)
Lajur1 : pART27+Noft, lajur 2-5: pARS52+Noft; (C) Lajur 1 :
pART27+SaR, lajur 2-5; pARS52+SaR ... ...
110
20 Pita-pita DNA hasil pemotongan plasmid rekombinan yang dibawa oleh
A.
Tumefaciens,(A)
Lajur 1-5: pARS51+Pstl;(8) Lajur 1-5 : pARS52+Psft ...
111
21 Peta plasmid rekombinan pARS51 (15.8 kb) yang membawa genchi
searahpromoter 35SCaMV, dan pARS52 (15.8 kb) yang membawa gen
chitidaksearah promoter 35SCaMV ... ... ... ... ... ... 111 22 Pita-pita DNA hasil pemotongan plasmid pembawa gen chi yang
telah dimodifikasi dengan enzim restliksi. (A) Lajur 1-3: pSK+
(ChIMOO)+Psft+Hindlll; (8) Lajur 1-2: pChIM0D431+Hindlll;
(C) Lajur 1-3: pChIM00531+Noft; (0) Lajur 1-3: pChIM0D631+Noft ...
112
23
Peta plasmid pChiM0D631(15.7 kb) yang membawa gen chi yang
telah dimodifikasi ... ... ... ... ... 113 24 Kalus yang beregenerasi membentuk tunas adventif (1) dan kalus yang
mencoklat dan mati (2) ... ... ... ... ... ...
115
25 Perkembangan eksplan kentang setelah kokultivasi dengan balderiAgrobacterlum tumefaciens
LBA4404 yang membawa genchi.
(1) Kalusmembentuk tunas adventif, (2) perkembangan lanjut tunas adventif, (3)
tunas adventif berumur 2
minggu...
11526 Tunas adventif kandidat tanaman transgenik kentang berumur 4 minggu
yang di kokultivasi dengan agrobalderium yang membawa pARS51 ... 116 27 Hasil amplifikasi PCR gen
chi
dengan primer ARCHI1 dan ARCHI2Lajur 1-25 adalah individu kandidat transgenik yang dianalisis ... 118
28 Hasil ampUfikasi PCR gen
chi
dengan primer P35SC3IMV dan ARCHI2pada 25 :ndividu kandidat transgenik i<entang yar.g ciitransformasi dengan pARS51 menghasilkan fragmen 1100 bp. Lajur 1 : kontrol tanaman non transgenik, Lajur 2-2 adalah individu kandidat transgenik
yang dianalisis .... ... ... 118
29 Hasil amplifikasi PCR gen
chi
dengan primer ARCHil dan ARCHI2
pada 25 individu kandidat transgenik yang ditransformasi dangan pARS52 menghasilkan fragmen berukuran 850 bp. Lajur 1-25 adalah individu kandidat transgenik yang dianalisis. Individu nomor 17 dan 23 (tanda panah) tidakmembawa gen
chi...
... ...
11930 Pelekatan oelacak
(probe)pada T-DNA dari plasmid pARS51 dan
pARS52 pada saat hibndisasi Southern ... . ... 120
31 Hasil analisis Hibndisasi Southern terhadap 11 individu tanaman
pembawa gen
chi
dari pARS51 (pARS51 : 1-11), 10 individu
pembawa gen
chi
dari pARS52 (pARS52 : 1-10), nontransgenik (0),
dan kontrol pelacak
(probe:
a dan b). DNA genom tanaman 10 }Jg... 12232 Hasil amplifikasi PCR dengan eDNA dan mRNA gen chi sebagai cetakan
(template).
Lajur 1 : kontrol - : air, lajur 2 : kontrol + : DNA tanaman transgenik, lajur 3-9 : fragmen 850 bp hasil amptifikasi eDNA dan tanaman no 1-5,10,11 pembawa pARS51 dengan pnmerARCHlldan ARCHI2, lajur 10: kontrol+ untuk primer P35ScaMV
dan ARCHI2 yang menghasilkan fragmen sebesar 1100 bp, lajur
11-17 : hasil amplifikasi eDNA dari !anaman no 1-5,10,11...
123
33 Penghambatan pertumbuhan miselia cendawanFusarium oxysporum
oleh protein kasar dan (0) tanaman nontransgenik, (1-11)
tanaman transgenik dan pARS51 nomor 1-11, (12) tanaman tanpa
T-DNA, dan (13) !anaman transgenik dari pARS52 nomor 1...
126
34 Hita cendawan
Fusarium oxysporum
setelah 7 hansejak diberi periakuan protein total tanaman transgenik kentang yang
membawa gen
chi
dari pARS 51. (1) hija yang diberi
ー・セ。ォオ。ョ@air; (2)
hila dengan
ー・セ。ォオ。ョ@protein dalam konsentrasi rendah 10
セァL@(3-4) hila
yang mendapat per1akuan protein tinggi antara 30 - 50 jJg
setelah 14 hari ... ... ... ... ...
127
35 Umbi mikrodarigalur-galurlransgenik: 511.4,511.6,511.10,511.13,526.7,
dan nontransgenik dengan sistem MPC pada 4 MSP ._._ ... _... 131
36 Umbi mikro dari galur-galur lransgenik 511.2, 511.4, 511.7, 511.8, 526.1,
dan nontransgenik sistem MCC pada 4 MSP ... _ ... _... 131
pada 6 MST ...
134
39 Individu tanaman kentang transgenik dan nontransgenik pada umur 8 MST:
(a)511.2, (b)511.4, (c)511.6, (d)511.8, (e)511.9, (1)511.11, (g)511.17,
(h)511.21, (i)526.18, fj)Nontransgenik ...
137
40 Susunan letak anak daun primer pada tangkai daun utama pada tanaman
kentang transgenik dan nontransgenik. (a)Non Transgenik, (b)526.18,
(c)511.8. Anak panah pada a: posisi daun subtenninal dengan rlaun tennina!.
Anak panah pada b: wama tangkai daun.. ... ...
138
41
Morfologi umbi Kentang generasi Ke-O. Alrisan melintang umbi. B:penampakan
kulit luar umbi. Anak panah pada
A:
warna daging umbi. Anak panah kiri pada B:
menunjukkan mata tunas. Anak panah kanan pada B:warna kulit umbi...
141
42 Molfologi bunga tanaman kentang. (1) mahkota bunga, (2) putik,
(3) anthera...
146
43 Buah kentang galur nontransgenik dan galur transgenik. (A)non
transgenik; (B) 511.8;
(C)
526.1; (0) 526.18...
148
44 Umbi kentang (A) nontransgenik, dan transgenik (B) 511.8
(C) 526.18; (0) 526.1...
150
45 Dendogram kemiripan galur-galur kentang transgenik dan non
Halaman
1 Verifikasi plasmid pAS385 dan pWS506 dengan berbagai jenis enzim
restriksi .. '" .... " ... '" .. " ... '" ... " ... " .. _ .. " ... ".... 179
2 Kodon-kodon asam amino yang digunakan pada gen
chi
(2925 bp) dari1.1
Latar
Belakang
Penyakit taoaman merupakan salah saw セョケ・ィ。「@ kehilangan produksi pada
taoaman pertanian, yaitu penyakit yang disebabkan oIeh cendawan, virus, balderi dan nematoda. Patogen cendawan dan nematoda telah terbukti bertanggungjawab secara sangat "yata dalam menurunkan produksi dan menyebabkan terjadinya epidemik pada
banyak areal pertanian terutama di negara tropis. Pengendalian terhadap penyakit ini menjadi sangat penting guna meningkatkan pencapaian ーイッ、セォウゥ@ yang optimum, serta
menjaga proses produksi yang berkelanjutan.
Saat ini telah banyak bukti-bukti yang menunjukkan bahwa mekanisme pengendalian penyakit dengan bahan kimia, dalam hal ini fungiskla, bakterisida,
maupun nematisida yang dilakukan secara kontinyu akan memberikan masalah baru
yaitu timbulnya ras-ras patogen baru yang lebih viruten, tercemamya lingkungan yang
mengakibatkan matinya mikroorgantsme nonpatogenik,
serta
tercemamya produkpertanian akan bahan kimia beracun. Berdasarkan permasalahan tersebut harus
dicari jalan keluar guna menanggulangi penyakit yang disebabkan oleh cendawan
maupun nematoda, yang ramah terhadap lingkungan
serta
produksi pertanian yangbebas bahan kimia beracun. Menurut
li
dan Gray (2005), pemanfaatan gen-gen spesifik guna merakit kultivar baru yang resisten terhadap penyakit cendawan maupunnematoda merupakan altematif yang dapat diterapkan.
Tanaman resisten yang terserang patogen akan mernproduksi sejumlah protein
yang diyakini berperan dalam mekanisme pertahanan dan tanaman terhadap
kerusakan yang ditimbulkan ッセィ@ infeksi patogen (Payne
et
81.1990; Keen et al. 2000).Protein yang dimaksud adalah enzim-enzim
yang
ter1ibat datam proses lignifikasi dan proses sintesis fltoaleksin, sepertl enzim yang ter1ibat dalam proses hidrolisis senyawa komponen penyusun dinding sel patogen. Protein-protein ini dikelompokkan kedalamSebagai salah satu sumber karbohtdrat yang penting dan banyak dikonsumsi di
Indonesia, kentang (So/anum tuberosum L) sedang diusahakan menjadi bahan pangan nonberas
cti
Indonesia. Dasar pemilihan kema!lg meniadi panga" pendampingberas karena keseimbangan kalan, vitamin. mineral, dan asarr. amino esensial yang
dikandung. Dalam setiap 100 9 bahan yang dapat dikonsumsi terdapat 56 kalori, 0.1 9 temak, 2.0 9 protein. 19.1 9 karbohidrat. 12 mg Ca, 45 mg P, 1.9 mg Fe, 0.101 mg
vitamin 81, 0.023 vitamin 82, 0.67 mg niacin, 3 9 vitamin C, dan 81.6 9 air (Yamaguchi 1983). Konsumsi kentang oleh masyarakat di Indonesia terus meningkat
dari 1.9 kg per kapita tahun 1985. meningkat hingga 4.3 kg pada tahun'1995 (FAO 1995). Produksi dalam negeri masih belum mampu memenuhi peningkatan pennintaan ini. Produksi kentang di Indonesia baru mencapai 1.1 juta ton pada tahun
1997 (Wattimena 2000). Kebutuhan akan kentang, terutama kentang untuk ,french
fries dan chips, masih dipenuhi pemerintah melalui impor dari Australia, Amerika,
China, dan Thailand, dengan total impor tahun 1998 sebesar 7622.9 ton (BPS Impor
1998).
Rendahnya produksi kentang dalam negeri disebabkan oleh rendahnya
produlctifitas yaitu hanya 15.83 ton per hektar, sementara potensinya dapat mencapai
30- 40 tonlha (Kusumo dan Adiyogo 1989). Sumber data BPS (2003) menunjukkan
produktifrtas kentang di Indonesia saat ini hanya mencapai 14.8 ton per hektar dengan
luas areal pertanaman hanya 55 971 hektar yang tersebar di Pulau
Jaws,
Sumatera dan Sulawesi. Kendala yang dihadapi dalam proses produksi antara lain terbatasnyabibit yang bennutu. Sampai saat ini sebagian besar petani masih mengandalkan bibit
produksi sendiri yang berkualitas rendah. Hanya sedikit petani yang memUtki modal
mampu mengimpor umbi untuk bibit. Tahun 1998 impor bibit kentang dan Belanda
mencapai 362.9 ton senitai US$ 265 000 (BPS Impor 1998).
Serangan hama dan penyakit merupakan kendala lain yang cukup penting
jenis hama dan penyakit cukup banyak. Menurut Mendoza 1987, tanaman kentang
dapat terinfeksi oleh 38 jenis cendawan patogen, 68 nematoda, 23 virus, 6 bakteri, 2
mikoplasma, 1.l8 ゥョセゥ、」ZiL@ dan 1 viroid. Di Indonesia sendiri yang merupakan negara tropis, penyakit oteh cendawan rhyttJphthora infestans, Fusarium vxysporom, dan nematoda bintil akar Meloidogyne sp. maupun nematoda sist:t Globodera sp, merupakan penyakit penting disamping virus. Lahan pertanian kentang yang ada di
sentra-sentra produksi di Indonesia sebagian besar sudah terinfeksi oleh nematoda.
Serangan nematoda yang terjadi dapat memperparah serangan cendawan patogen
pada tanaman. Menurut Wattimena (2000) serangan cendawan pada pertanaman
kentang di Indonesia dapat menurunkan produksi dan 30% sampai 100%. Bibit unggul yang resisten temadap cendawan patogen tersebut di atas masih belum tersedia.
sehingga pengendaliannya masih menggunakan cara kimiawi. Sibit yang diimpor juga
tidak resisten terhadap penyakit cendawan dan nematoda yang ada di Indonesia,
bahkan memiliki resiko membawa patogen baru atau ras patogen baru apabila
sistem
karantina kurang ketat. Kentang kultivar Desiree adalah salahsatu
kentangyang
memiliki kualitas umbi yang sangat baik untuk french fries danch4Js '
imun terhadapPVA (Potato Virus A), namun sangat rentan terhadap serangan patogen cendawan maupun nematoda (NIVAA 2004).
Menurut Hawkes (1994), pemuliaan tanaman kentang melalui persilangan juga
tidak mudah mengingat spesies kentang budidaya merupakan tanarnan autotetraploid, sementara gen-gen ketahanan terhadap cenctawan patogen terdapat pada spesies liamya yang diploid. Kendala lain adalah adanya sifat
seN-incompatibility
karenafactor alefe. Persilangan antara dua spesies yang berbeda ploidi akan menghasilkan hibrida yang fertilitasnya rendah atau bahkan steril, oleh karena itu pertu dicari jalan keluar untuk mengatasi masalah tersebut.
cendawan maupun nematoda.
Melalui teknik ini memungkinkan untuk mengintegrasikan gen-gen asing yang mengendalikan sifattertentu
ke dalam genomtaoaman. Gen-gen asing yang sJ)E:sifik in! dapat berasal
tJoak
sajadan
tanarnan oamun juga dan bakteri, cendawan. maupun hew::m Geo yang diintegrasikan mulaidari satu sampai beberapa geo sekaligus (Dale et al. 1993, Chen et al. 1996). Teknik rekayasa genetika ini telah rutin digunakan pada beberapa spesies tanaman untuk merakit varietas yang resisten terhadap hama dan penyakit. cekaman lingkungar:-. Tanaman yang menerima geo asing ini tidak kehilangan sifat agronominya seperti produksi taoaman.
Ditemukannya geo-geo spesifik yang dapat berperan di dalam mekanisme pertahanan tanaman terhadap cendawan dan nematoda, serta tetah bel1tembangnya
teknik rekayasa genetika, maka terbuka peluang untuk merakit kultivar kentang yang
resisten terhadap patogen ini. Salah satu gen yang dapat digunakan adalah gen yang
menghasilkan protein antifungal yaitu gen chi yang mengekspresikan enzim kltlnase (Poly QNTMサnM。」・エケャMゥャセャオ」ッウ。ュゥョャ、・I@ glycano hydrolase). Enzim kitina ... pada tanaman merupakan bagian dari sistem pertahanan alami. diproduksi secara konstitutif
dalam jumlah sedikit dan akan meningkat secara simultan sebagai respon terhadap
cekaman lingkungan, serangan patogen. maupun penuaan (Graham dan Sticklen
1994). Enzim kitinase adalah enzim yang dapat menghidrolisis kitin
(Poly..p-1,4-N-acetylglucosamine), yaitu suatu polimer penyusun dinding hifa yang utama dari
cendawan serta dinding sel dari nematoda (Chohen-Kupiec
dan
Chet 1998). Kitin terutama terdapat pada ujung dan septum dari hifa,serta
dinding sal nematoda, danAeromonas caviae (Sitrit et a/. 1995). Gen-gen penyandi enzim ini tetah berhasil diisola:si. Hasil hidrolisis kitin juga dapat berfungsi sebagai elisitor yang dapat mer.gakti:kan sistem ー・イエ。ョ。ョセョ@ alami taoaman (Graham dan Sticklen 1994).
T elah banyak penelitian yang dilakukan daiam merakit tanaman resisten terhadap cendawan dengan mentransfonnasikan geo chi yang mengekspresikan enzim kitinase ke dalam genom taoaman. seperti geo chi yang berasal-dari taoaman. Geo chi yang berasal dan bakteri S. marcescens H」セ[aI@ dapat terekspresi pada tanaman tembakau dibawah kendali promotor 35SCaMV. Tanaman tembakau transgenik yang membawa geo tersebut meningkat aktivitas enzim kitinasenya
30-40%, demikian juga resistensinya terhadap serangan Alternaria longipes, dibandingkan dengan tanaman nontransgenik (Suslow etal. 1988). Gen inijuga dapat terekspresi dengan baik pada tanaman tembakau dibawah kendali promotor rbcS
(Jones et al. 1988), demikian juga setelah dilakukan modifikasi sehingga ekspresinya meningkat (Lund et al. 1989; Howie et al. 1994). Bakteri tanah Aeromonas
CBviae
strain WS7b, adalah isolat bakteri tanah yang berasal dari Pulau Bangka, Indonesia,
juga memiliki aktifltas enzim kitinase. Gen yang menyandikan enzim kitinase ini telah
bernasil diisolasi serta dipelajari ekspresi gennya pada bakteri Escherichia coli dan
Pseudomonas flourescens. Pengujian terhadap aktifltas kitinolitiknya juga dipelajari
dengan menumbuhkan balderi tersebut pada media yang mengandung kolotdal kitin
(Wenuganen 1997; Malik etal. 2003).
Penelitian ini dilakukankan untuk mempelajari ekspresi gen chi yang berasal dari Aeromonas caviae strain WS7b pada tanaman kentang kultivar Desiree.
Tanaman transgenik yang dihasilkan diharapkan resisten terhadap serangan
cendawan dan
nematoda.
Tanaman transgenik yang diperoteh dari hasil transfonnasigen
asing dengan bantuan bakteri Agrobacterium tumefaciens. sering mengalami perubahan fenotipe sebagai akibat dari adanya gen asing yang menyisip secara acakgenom inti dapat terintegrasi di dalam gen yang menentukan suatu sifat sehingga gen
tersebut menjadi termutasi. Jika gen yang tennutasi menentukan sitat penting dalam
tanaman maka feilotipe tanGtman terseilut akan oerubah. Oalam merakit kultivar
transgenik tidak dikehendaki adan'j8 pembahan fenotipe awat, sehingga per1u dilakukan evaluasi fenotipe terhadap galur-galur yang diperoleh. Dan hasil analisls molekular tanaman transgenik dan evaluasi fenotipe yang dilakukan dapat dipilih
galur-galur yang diinginkan yaitu galur-galur yang memiliki gen chi dalam ァ・ョッュョセ。@ dan mampu diekspresikan. tetapi tidak mengubah fenotipe asalnya. Galur-galur terpilih dapat dievaluasi lebih lanjut resistensi terhadap cendawan patogen dan nematoda, dan
diharapkan dapat dihasilkan varietas kentang baru yang unggul.
1.2 Tujuan Penelitian
Penelitian ini bertujuan untuk:(1) Menganalisis sekuen DNA serta memodifikasi RBS (Ribosome Binding Site) dari gen chi yang berasal dan balderi Aeromonas caviae strain
WS7b
(2) Mengkonstruksi gen chi asal balden Aeromonas caviae strain WS7b serta hasil modifikasinya, kedalam vektor biner secara fusi transkripsi
untuk dapat ditransformasikan ke dalam sel tanaman kentang
(3) Mempelajari ekspresi gen chi tersebut pada tanaman kentang kuttivar Desiree yang 、ゥエイ。ョウヲッセゥ@ dengan bantuan Agrobacterium tumefaclens LBA4404
(4) Mengevaluasi aktivitas antifungal enzim kitinase dan tanaman
transgenik terhadap pertumbuhan cendawan
Fusarium oxysporum
secara in vitro
(5) Melakukan evaluasi keragaan fenotipe tanaman transgenik pembawa gen
1.3 Hipotesis
Hipotesis yang <4iajukan dalam penelitian ini adalah:
(1) Sekuen gen chi yang berasal dan bakteri Aeromonas caviae strain WS7b tidak berbeda
jengall
sekuen gen chi yang berasal dantao8ma"
kenta"!](2) Geo chi a!;;al balderi Aeromonas caviae strain WS7b dapat tertranskr;psi pada tan8man kentang kultivar Desiree dibawah kendali promotor konstitutif 35SCaMV dan terminator octopin
(3) Enzim kitinase yang dihasilkan dari taoaman kentang transgenik pembawa geo chi dapat menghambat perkembangan hifa cendawan Fusarium oxysporum
(4) Galur-galur taoama" kentang transgenik pembawa geo chi rnemiliki fenotipe yang tidak berbeda dengan nontrasgeniknya
2.1 Tanaman Kentang
T anaman kentang yang dibudidayakan diyakini oleh para ahli berasal dati spesies liamya yang ditemukan di Amerika Selatan, yaitu Peru dan Bolivia Hhセ・ウ@
1978 dan 1994), dan penyebarannya ke benua Eropa terjadi pada abad ke 16. Kentang (Solanum tuberosum L) yang dibudidayakan di Eropa dicluga masuk melalui
negara Spanyol. Kentang yang dikembangkan di negara Spanyol adalah dan spesies
S. tuberosum L. subspesies andigena yang telah mampu beradaptasi dati daerah dengan fotoperiodisitas netral ke daerah dengan fotoperiodisitas panjang. Spesies kentang inilah yang kemudian disebarkan ke negara-negara di benua Asia セ。ョ@
Australia seabad kemudian. Menurut Bradshaw (1994) bahwa kentang yang dibudidayakan saat ini merupakan spesies autotetraploid yang mempunyai sifat berpasangan antar kromosom homolog secara kuadrivalen (kromosom homok)g
berpasangan empat-empat saat terjadi meiosis).
Cara perbanyakan kentang dapat melalui dua cara yaitu: (1) seksual dengan biji;
dan (2) aseksual dengan umbi, stek batang, dan umbi mikro hasil perbanyakan secara
in vitro. Melalui perbanyakan klonal tanaman kentang dengan kultur jaringan dapat menjamin ketersediaan bibit yang kontinyu dan bebas patogen. Perbanyakan klemal
secara langsung sangat kecil leemungkinan terjadinya valiasi somaklonal, seperti yang
dilaporkan oleh Sree Ramulu dan Dijkhuis (1986), Stiekema et af. (1988); dan
Wilkinson (1994). Variasi somaklonal akan terjadi bila perbanyakannya melalui tahap
pembentukan kalus atau dengan kultur protoplas. Dengan cara ini variasi kromosom
yang mungkin terjadi adalah defesi, inversi, translokasi. atau uneuploidi. Variasi yang
terjadi ini temyata dapat menjadi sumber keragaman genetik bagi pemulia tanaman
karena diperotehnya galur-galur yang memiliki keragaman dalam hasil, kualitas hasil,
infestans, Fusarium oxysprorum, bakteri Erwinia carotovOta, virus PVY, PVX, PlRV,
serta ketahanan terhadap nernatoda (Kumar 1994).
Pemuliaan tanaman kentang budtdaya ditu;ui(ar. オGャエオセ@ mendapaikal1
tanamall
resistsn sangat intensif di1akukan sejak tahun 1900, sej& edanya serangan Phytophthora sp. di Irlandia, meialui cara persilangan antara spesies liar dengan spesies budidaya. Sumber gen ketahanan pada kentang sudah banyak diketahuiseperti ketahanan terhadap cendawan, bakteri, virus, nematoda, dan serangga.
Disamping itu tetah ditemukan spesies yang memiliki geo ketahanan terhadap stres
lingkungan meliputi kek.eringan, 5uhu tinggi, serta frost (Hawkes 1994). Spesies S.
phureja, S. microdontum, S. demissum, S. stoloniferum dan S. tuberosum subsp.
andigena diketahui memiliki geo ketahanan ter1ladap Phytophthora Infestans. Spesies S. tuberosum subsp. tuberosum maupun andigena diketahui memiliki gen ketahanan terhadap cendawan Synchytrium endobioticum, sedangkan S. chacoense
memiliki gen ketahanan terhadap cendawan Streptomyces scabies.
Walaupun sumber gen ketahanan pada tanam3n kentang telah banyak diketahui
namun perakitan kultivar baru melalui persilangan tidak mudah. Hal ini disebabkan
oleh adanya sifat 58"- incompatibility, disamping ploidi yang sangat beragam mulai
dari diploid hingga hexaploid. Pada kentang diploid memiliki sifat se/f- incompatibility
yang disebabkan oleh S alele yang dapat menyebabkan pertumbuhan polen
terhambat (Hawkes 1994). Persilangan antara spesies liar dengan spesies budidaya
pada tingkat ploidi yang tidak sarna senng menghasilkan hibrida yang sten!.
Persilangan antar spesies yang berbeda ploidi mungkin dapat terjadi bila keduanya
memiliki sifat perpasangan kromosom pada meiosis sarna. Contohnya S. chacoense
(diploid) x S. stoioniferom (tetraploid) yang sarna cara _sangan kromosomnya yaitu bivalen, akan menghasilkan turunan walaupun dengan fertilitas yang rendah.
Tujuan pemuliaan kentang yang utama adalah merakit kultivar barn yang resisten terhadap serangan patogen baik yang disebabkan oIeh serangga, cendawan,
bakteri, maupun virus. Proses pemuliaan dimulai dt:!ngan イZGィZ[GB|jェ、Zョエゥセャ」。ウゥ@ sifat-sifat
ke!ahan<ln yang ada pada ウー・ウゥ・セMウー・ウエ・ウ@ kentang balk pada spesies Ilcir m8upun pada varietas budidayanya. Visker at
a/.
(2002), menemukan adanya keterkaitan antara sitat re5istensi tanaman kentang terhadap Phytophthora ;nfestans. yang terdapat pada kromoSom III dan V, dengan sifat penuaan daun yang terdapat pada kromosom V. Hasil yang diperoleh ini masih menjadi tanda tanya apakah kedua sifatini dikendalikan oleh geo yang berbeda oamun terpaut sangat dekat, atau dikendalikan
o\eh satu geo yang bertindak secara pleiotropik. Sitat resistensi terhadap virus pada
tanaman kentang kultivar Pentland Ivory ditemukan oleh Marano et a/. (2002). Oilaporkan bahwa gen Nb merupakan gen dominan yang mengontrol sifat hipersensitif terhadap PYX, dan gen int diketahui terdapat pada kromosom V. Hasil penelitian dari Marczewski et a/. (2002) menemukan bahwa sifat resistensi temadap PVS (Potato Virus S) dikendalikan oleh gen Ns yang terdapat pada kromosom VIII. Gen inipun dilaporkan merupakan gen yang dominan.
Kultivar Desiree termasuk kuttivar yang memiliki daging umbi berwama kuning
pucat dengan kulit umbi berwarna me:-ah (NIVAA 2004). Kentang kuttivar ini umbinya
terutama ditujukan uotuk fresh con:;LJm,;Ncm. chips, maulJun frelll;/J fr;"es. t\"ultivar ini temyata rentan terhadap penyakit yang diS€;babkan oleh cendawan sepert: Phytophthora infestans dan cendawan patogen lainnya, rentan terhadap PLRV (pot&to
leaf roll virus), namun imun terhadap PYA (potato virus A), resisten terhadap PVX (potato virus X). dan pW (potato virus
vn).
Kultivar ini agak tahan terhadap kondisi kekeringan, dengan umur panen antara agak pendek sampai agak panjang. Produksiper hektar kultivar ini termasuk tinggi menurut kriteria
yang
dikeluarkan oleh NIV AA (2004). Menurut Sosinski dan Douches (1996), kultivar desiree termasuk ke dalamgrup bersama-sama dengan kultivar Spunta, Red Pontiac, Noc1and, dan Rosa, berdasarkan hasil RAPD yang dilakukan terhadap 39 kuttivar kentang yang dikembangkan di Amerika. Dan penetitian yang dilakukannya ditemukan bahwa kuttivar yang diperbanyak secara vegetatif dengan kultur jaringan temyata tidak menimbulkan variasi genetik berdasarkan hasil "analisis dengan metode RAPD (Random Amplified PoIymo<phic DNA).
2.2 Mekanisme Pertahanan Tanaman Terhadap
Cendawan Patogen
Pembentukan struktur penghalang pada dinding sel dan kutikula dan permukaan daun merupakan suatu ウエイ。エセゥ@ pertahanan tanaman yang umum diketahui pada banyak jenis tanaman. Beberapa contoh struktur penghalang tersebut adalah iapisan lilin
yang
menutupi sel epidermis dan ketebalan dindilg sel merupakan suatu cara untuk mencegah infeksi patogen. Respon tanaman terhadap serangan patogen adalah dengan mengaktifkan berbagai mekanisme pertahanan ataminya. yang dapat diketahui dengan adanya perubahan flSik dan perubahan biokimia tertentu (Broglie at al. 1993). Perubahan flSik berupa penebalan dinding sel (disebul juga callose) akibatlignifikasi (Vance
fit
al. 1980). Perubahan biokimiayang terjadi
antara lain: adanya sintesis dan akumulasi fitoaleksin yaitu suatu ウ・ョセG。キ。@ hasil metabolit sekunder yang toksik bagi bakteri maupun cendawan parogen (Beyr.on 1S97), tanin, senyawa yang menyerupai asam ャ・ュセォ@ (fatty acid-like substances) (Lowtvn 9t al. 1992), dan dikeluarkannya elisitor berupa oligosakarida oleh tanarnan (Nothnagel et al. 1983). Senyawa-senyawa ini dapat melindungi tanaman secara menyeluruh terhadap serangan patagen namun dapat juga hanya menekan perkembangan patogen sampai tingkat yang signifikan sehingga tidak menurunkan produksi. Mekanisme pertahanan.
yang lain adalah tidak adanya faktor pengenal pada tanaman yang dapat digunakan patogen untuk menentukan inang yang sesuai. Tanaman juga dapat mempertahankan diri dengan tidak memproduksi senyawa metabotit yang dipertukan oleh patogen sehingga patogen tidak berkembang.
respon yang menginduksi kematian
seI
secara cepat mengefilingi patogen sehingga ter10kalisasi (apoptosis). Selama respon ini berlangsung, terjadi pengiriman signal kebagian tanaman yan{:j tidEik ierillf,*si untuk rnengaidiiKan mekanisme pertahanan
inducible dan selanjutnya aka" timoul resistensi yang bersifat sistemik (Systemic Acquired Resistance, SAR) untuk mengurangi tlngkat keparahan sl;:rangan (Agrios
1997). Dalam hal ini resistensi melibatkan gen-gen SAR.
Pemicu timbulnya respon hipersensitif pada tanaman yang terserang cendawan diduga adanya produksi radikal oksigen yang teraktifasi (reacUve oxygen
species, ROS) seperti peroksida, hidrogen peroksida dan radikal hidroksida (Hammond, Kosack dan Jones 1996). Radikal oksigen ini diproduksi beberapa detik
atau menit setelah terjadi kontak aotara sel tanaman dengan sel cendawan atau elisitor yang disekresikan oleh cendawan. ROS aka" dikeluarkan oleh NAOPH
oksidase dari plasma membran. ROS dapat toksik bagi cendawan dan dapat
berperan sebagai senyawa oksfdatif bagi senyawa glikoprotein dan fenolik dan dinding
sel tanaman sehingga suitt dipenetrasi atau didegradasi oleh cefldawan (Dumer dan
Klessig 1995). Secara paralel juga tementuk senyawa yang berkaitan dengan
pertahanan seperti 8sam jasmonik dan etiten. Molekul tersebut menginduksi
tementuknya asam salisilat (Ryals et
a/.
1996; Sandermann et al. 1998), asam absisik(Lee et al. 1996), yang akhimya akan menginduksi protein dan enzim yang langsung berperan dalam sistem pertahanan.
Sebagai akibat dan aktifnya jalur' mekanisme pertahanan tanaman maka
gen-gen yang ter1ibat akan dieksprest"kan, salah satunya adalah PR gen-gen
yang
akan menghasilkan protein yang dikenal dengan sebutan pathogenesis-related protein(PR-protein) seperti yang dilaport<an Van Loon (1985) dan Payne at ./. (1990).
ini. PR-protein akan dtekspresikan bukan hanya sebagai respon dari adanya serangan
patogen namun juga akibat adanya stres lingkungan seperti kandungan Iogam berat
yang i.inggi (Nasser et al. 1990), ket:elingan (Grosset et ai. 1H90), polusi udara (Ernst at el. 199/') dan kadar garam Hnggi (King at al. 19136) dan luka. Tanaman akan memproduksi PR- protein yang berbeda pada organ
yang
oerbeda dan エ・イエゥョァセゥ@terutama pada daun yang mengalami penuaan, akar (Felix dan Meins 1986), dan organ pembungaan (Richard et al. 1992). Konsentrasi protein ini pada tanaman saat
terinfeksi patogen dapat mencapai 10%
dan
total protein sel (SHntzi at al. 1993). PR-protein stabil pada pH rendah, sementara enzim dan PR-protein lain akan terdegradasi. PR-protein juga dilaporkan tahan temadap enzim proteolitik endogen maupun eksogen, sehingga membuat protein ini tahan terhadap lingkungan dimana dia berperan seperti di dinding sel, interselular dan vakoula. Telah ditemukan ada 5 kelompok PR-protein yang dimiliki oleh tanaman yang dikelompokkan berdasarkan fungsi, serologi, sekuen protein, berat molekul dan karakteristik lain.Kelompok 1 dari PR·protein. PR-protein ini pertama ォ。セ@ ditemukan pa.da tanaman dikotiledon seperti pada kentang, tomat, tembakau, dan tanaman monokotil seperti barley dan jagung (White et al. 1987). Data sekuen yang dapat diakses dari bank data tidak memberikan petunjuk yang jelas ten tang aktifitas biologi dari kelompok protein ini (Stintzi et at. 1993). Namun demikian hasil uji aktifitas enzimatik menunjukkan kemampuan penghambatan perkembangan cendawan in vitro. Protein PR-1 dari tomat (Nidermann et al. 1993)"dan PR-1g dari tembakau (Nidermann et al. 1995) dan PR-la dan PR-lb (Cutt et 81. 1989) mampu menghambat peri<embangan cendawan Phytophthora infestans secara in vitro.
Kelompok 2 dart PR-proteln. PR-protein dari kelompok ini adalah セQNSM
unit glukosa (Stintzi
et al.
1993). Protein ini akan menghidrolisis13-1,3- gluean
yanglt1enjadi komponen dinding sel cendawan patogen, dan hasil ィゥ、イッャゥウゥウョケセ@ dapat menjadi elisnor aktif yang dapat mendorong diaktifkannya mekanisme pertahanan
taoaman.
Pada tanaman dikenal ada 3 kelas enzim glukanase (Meins at a/. 1993) yang
merr.iliki aktifrtas penghambatan yang berbeda. Kelas I merupakan enzim yang berslfat basa dan tertokalisasi di vakuola serta memiliki daya menghambat yang kuat
terhadap
Fusarium solan;
(Mauch etaJ.
1988). Kelas II memiliki sifat 85am dan tertokalisasi ektraselular, serta marnpu menghambat perkembangan berbagai cendawan patogen (Leah et al. 1991). Kelas III merupakan enzim yang bersifat 85amdan tidak memilki aktifrtas antifungal, seperti enzim glukanase PR-Q (Payne 1990).
Enzim glukanase yang dihasilkan oleh setiap spesies tanaman berbeda dalam aktifitas antifungal karena substratnya spesifik.
Kelompok 3 dart PR-protein. Kelompok 3 dari PR-protein adalah enzim kitinase. Enzim kitinase mampu menghidrolisis kitin yang merupakan suatu homopolimer yang tidak dapat larut dari {3-1,4- N-acetyJgJucosamine (Boller et al. 1987). Kitinase yang dihasilkan oleh tanaman merupakan endokitinase dan eksokitinase, sedangkan yang dihasilkan oleh bakteri merupakan eksokitinase (Cornelissen dan Melchers 1993). Sarnpai saat ini telah diidentifikasi 86 jenis endokitinase pada berbagai jenis tanaman, dan masing-masing memiliki aktifitas yang berbeda baik sebagai enzim penghk1roVsis maupun sebagai reseptor untuk signal terekspresinya mekanisme pertahanan tanaman. Ary et aJ. (1989) menemukan pula eozim kitinase yang memiliki aktifltaS menghambat enzim a-amylase.
tabung pok!n dan dinding
set
endospenna (Fischer dan Stone 1981). sementara substrat bagi enzim kitinase yang ada dalam tanaman diduga adalah glycolipid(Collinge et al. 1993). Berdasartc:an hasil penelitian in '.Iitro diketahui enzim kitlnase ini mampu menghambat peritembC'"gan cendawan yang memiliki kitin pada dinding hifanya (Mauch et al. 1988) dengan cara menghidrolisis kitin tersebut. Hasil hidrolisis kitin ini menjarti oligosakarida yang dapat bertindak sebagai etisitor bagi tanaman untuk mengaktifkan mekanisme pertahanannya (Ham st a/. 1991, Boller 1987).
Kelompok 4 darl PR-protein. Protein yang termasuk kedalarn PR-protein 4 ini adalah protein ekstraselular yang memiliki berat molekul 13-14.5 kDa. Protein ini ditemukan pada tanamsn tembakau yang terinfeksi oteh Tobacco
Mosaic ViruslTMV
(Kauffmann et al.
1990).
Protein ini memiliki kesamaan dalam sekuen 8sam amino dengan protein dari genwin
1 danwin
2 yang dimiliki oleh tanaman kentang (Friedrichet a/. 1992) yaitu protein yang terinduksi akibat luka, dan protein gen hevein dari
tanaman karet (Hejgaard at a/. 1991) yang merupakan antifungal.
Kelompok 5 dart PR-proteln. Kelompok 5 dan PR-.,.-n ini rneliputi protein-protein yang menyerupai protein-protein thaumatin (thaumatin-like protein-proteins) (Kauffmann at a/.
1990). Thaumatin adalah protein yang rasanya manis dan tanaman Thaumatoooccus
daniel/i, yaitu semak yang terdapat di Afrika. Protein yang juga termasuk kedalam
PR-protein 5 ini adalah PR-protein osmotin yang ditemukan pada
set
tembakau yang mampuberadaptasi pada kondisi konsentrasi NaCl tinggi (Singh at a/. 1987).
Berbagai protein yang tennasuk kedalam kelompok 5 dan PR-protein ini
memiliki aktifrtas menghambat perkembangan hifa cendawan dan menghidrolisis spora
cendawan. Zeamatin adalah PR-protein 5 dan tanaman ;agung dapat menghambat
perkembangan cendawan candida albicBns dan T1'ichod8nnB reese; (Kobayashi at a/. 1995) dengan menghidrolisis hifa. Protein osmotIn dan ternbakau dan lorna! memiliki aktifitas antifungal terhadap Phytophthora infastans juga dengan cara menghidrolisis
2.3
Patogenesls Cen_n PatogBn
Spora (seksual) atau konidia (aseksual) mungkin merupakan titik awat dan juga
akhir dari perkembangan cendawan. Spora merupakan bentuk reproduksi dari cendawan sekaligus juga merupakan stuktur bertahan dalam lingkungan yang tidak
optimal yang ditandai dengan rendahnya proses metabolisme yang terjadi, kandungan air yang rendah, dan tidak adanya pergerakan sitoplasmik (Gregory 1966). Jika kondisi lingkungan optimal maka spara akan berkecambah dan berkembang membentuk hifa
yang akhimya akan membentuk misetium. Kandungan dinding seI hita cendawan
80-90% terdiri dari poIisakarida seperti kitin, Idtosan, glukan, selulosa. patio dan heteropolimer lainnya (Griffin 1976). Kandungan dinding selini
juga menjadi satu karakter yang digunakan dalam mengklasifikasikan cendawan. Cendawan patogendiduga mengenali inangnya melalui senyawa yang dikeluarkan oteh tanaman seperti
asam lernak atau fenolik. Cendawan berpenetrasi ke
dalam
set
tanaman secara pasif melalui stomata, lentisel, atau luka, atau berpenetrasi aktif dengan membentUk tempatpenetrasi dengan memproduksi enzim yang dapat mendegradasi dinding sel tanaman.
2.3.1 Mekanisme Infeksi oleh Patogen
Dalam menginfeksi tanaman inang, cendawan patogen memmki beberapa
mekanisme yang dapat dipergunakan untuk memulai suatu penetrasi yaitu :
memproduksi enzim pendegradasi polimer, enzim pendetoksifikasi fltoaleksin,
memproduksi zat pengatur tumbuh tanaman, dan toksin (Clarkson 1992; Crane et
al.
1996). Bagian pennukaan tanaman diprotek.si
oIeh
kutikula yang sebagian besar mengandung insoluable polyester yang disebut kutin. Walaupun ada cendawanpatogen yang dapat melakukan penetrasi
Iewat
stomata,
namun banyak cendaWan yang menghasilkan enzim kutinase untuk mendegradasi kutin pada kutikula. Contohcendawan yang dapat memproduksi kutinase adalah - .
haematococca
yangsuatu enzim yang dapat melakukan demetilasi terhadap
senyawa
fitoaleksin tanaman inang, dengan demikian patogen tersebut toteran hidup pada inangyang
menghasilkan frtoaleksin tersebut. Contohnya adala!"! Nectria haematococcayang
toleran terhadap pisatin yang dihasUkan tanaman kacangpoIong,
dan GibbereHa pulicaris yang taleran terhadap rishitin yang dihasilkan tanaman kentang (Clarkson1992).
Senyawa lain yang dapat diproduksi oleh cendawan patogen adalah toksin. Toksin ini diproduksi oleh cendawan pada
saat
sudah melakukan penetrasi, yang ditujukan untuk menghambat proses pengaktifan mekanisme pertahanan tanamanyaitu menghambat ekspresi gen...gen PR-protein, atau menghambat proses metabolisme sel sehingga terjadi cytostatis yang akan ber1anjut pada kematian sel
(Crane et al. 1996). Toksin ini merupakan senyawa dengan berat molekul rendah dari
hasil metabolisme sekunder cendawan.
Berdasar1<an kespesifikannya, ada 10ksin yang selek1if
dan
ada yang tidak. Toksin yang sifatnya selektif misalnya HC-toxin yang dikontrol oleh gen Tox2 yangdihasilkan oleh cendawan Cochlioboius camonum, merupakan toksin yang hanya mampu menghasilkan infeksi pada galur jagung mutan pada gen Hm1 yang memproduksi enzim reduktase. Contoh toksin yang tidak spesifik adalah asam fusarat
(fusaric acid) yang dihasilkan oleh Fusarium oxysporom, dan fusicoccin yang dihasilkan oteh Fusicoccum amygdali (Clarkson 1992).
2.3.2. Inleraksi Gen Antara Inang dan Palogen
Terjadinya penyaktt pada tanaman diketahui akibat dari adanya interaksi antara
tanaman dan patogen secara genetik (Agrios 1997; Greenberg 1997; Ji
el./.
1998;Melack dan Lawton 1998; Keen
el ./.
2000;). Tanaman yang resisten terhadap serangan patogen dikontrol oleh gen tunggal yang disebut gen R (Resistance gs"..),patogen yang tidak memiliki gen tersebut mampu
mengmeksi
tanaman. Interaksi genantara tanaman dan patogen merupakan interaksi antara gen
R
yang spesifik dengangen
avr
dart patogen.Ji et al. (1998) membuat suatu hipotests i>ahwa
gen
R dart tansrnsn mengkode suatu reseptor yang dapat mengenali produk genavr.
Pengenalan oleh tanaman iniakan menginduksi mekanisme pertahansn tanaman yang akan membuat tanaman menjadi resisten. Jika salah satu dart gen
R
atauavr
tidak ada maka tansman. tidak akan mampu mengenali patogen dan patogen dapat berkembang (Jackson dan Taylor1996). Sampai saat ini telah diisolasi 149 gen resisten (gen R) dart tanaman tembakau, arabidopsis,
tomat.
padi dan jagung (Bent 1996, Belkhadir at 01. 2004).Tanaman yang rentan menjadi resisten temadap cendawan patogen setelah menerirna
gen R yaitu cf-9 dan cf-2 dart tanaman tomat (Dixon at al. 1996).
Ji et a/. (1998) dan Belkhadir et a/. (2004) melapol1<an bahwa respon yang terjadi
skibat interaksi antara gan
R
danavr
ditandai denganadanya
perubahan dari ion kalsium yang cepa\. tingginya kandungan oksidatif akstraseIular, dan pada beberapakasus terjadi kematian
seI
ter10kalisasi cepat yang dikensl dengan respon hipersensitif (hypersensitive response IHR). Kalompok protein resisten (R) kaya akan asam-aminoleusin yang berutang (LRR= Leucines-rich repeats) dan situs pelekatan nukleotida (NBS= nucleotide-binding site). Protein-protein resistan ini mirip dengan protein yang berfungsi dalam sistem imunitas yang dimiliki oleh mamalia. Mekanisme interaksi
.
antara protein R dengan protein avr secara セオャ。イ@ masih belum begitu jelas diketahui dan masih merupakan hipotesis.
2.4 Enzim Kltinase
Seperti tetah diuraikan sebelumnya, enzim kitinase tennasuk kedalam PR-protein pada kelompok 3. Enzim kitinase atau enzim
Poly
QLTMHセ@1J-1,4-II-acetylglucosamlne (GlcNAc), yang merupakan penyusun utama dinding hila cendawan patogen dan nematoda (Chohen-Kupiec dan Chet 1998) dan merupakan
po!imer keclua teroanyak di alam setelah selulosa. Enzim kitinase ini dihasilkan secara
konstitutif I1li:IUpUil terinduksi baik oIeh tanaman (Graham dan Sticklen 1994), bakteri (Burberg at a/. 1995; Roffey et al. 1990; dan Gooday 1990), cendowan Trichoderma harzianum (Haran at 81. 1996), virus {Sun st a/. 1999; Hiramatsu st al. 1999), dan serangga (Ding at al. 1998).Enzim kitinase tanaman yang pertama
kaliberhasil diisolasi adalah endokitinase
tanaman yang dapat menghidrolisis kitin menjadi polimer yang lebih pendek anta", 1 sampai5
monomer (Graham dan Sticklen 1994). Setelah dilakukan penelitian tentan9 enzim kitinase taoaman, temyata ada tanaman yang memiliki eksokitinase seperti tanarnan melon, bit gula, wortel, dan Havea brasiliensis (Broglie dan Broglie 1993). Enzim eksokitinase ini juga memiliki aktifitas kitinolitik dengan hasil degradasinya berupa dimer dan monomer. Contoh tanaman yang memilikl enzim endokitinase antara lain tanaman kedelai, tembakau, dan tomat.Enzim kitinase yang dihasilkan oleh bakteri
Serratia marcescens
merupakan endokitinase (Joneset
81. 1988; Brurberget
81. 1995), yang dihasilkan olehstreptomyces Iwidans
adalah eksokitinase (Miyashita dan Fujii 1993), sedangkan cendawan T.harzianum
menghasilkan kecluanya (Haran at al. 1996). Walaupun jenis enzim kitinase yang dihasilkan oIeh mikroorganisme ini berbeda namun hasil degradasi kitinnya samayaitu
dalam bentuk monomer. Kitinase yang dihasilkan oleh S.Jwidans
danT.
harzianum
merupakan enzim ekstraselular, sedangkan yang dihasilkan oIeh S.marcescens
merupakan enzim intraselular dan baru berfungsi bilaseI
balderi ini mengalami tisis. Enzim kitinase yang dihasilkanofeh
balderiAeromonas
caviae
strain WS7b merupakan enzim ekstraselular (Wenuganen 1997).sehingga menghasilkan bentuk mulfuner GIcNAc seperti chitotetraosa, chitotriosa, atau dimer seperti dt.-acetylchitobiosa. Enzim kitinase yang tergokmg kedalam eksokitinase dibagi lagi menjadi dua yaitu: (1) chitobisldase yang menghidrolisis
di-acetylchltobiosa; (2) 1-4-p..N..acetylglucosamlnldase
yang
menghidrolisis produk dan endokitinase dan chitobisidase sehingga menghasilkan monomer GIcNAc (Chohen-Kupiec dan Chet 1998 ).
2.4.1 Pengelompokan Enzim Kitinase
EnZim kitinase dikelompokkan menjadi 5 kelas berdasarbn struktur primer dan proteinnya (Graham dan Stickle" 1994; Chohen-Kupiec dan Chet 1998 ). dan enzim
ini dikelompokkal kedalam famili 18 dan 19 daism famili enzim glycosyl hidrolase. Struktur primer dart protein enzim kitinase aka" menentukan aktifitas kitinolitiknya.
Enzirn Kitinase Kelas I: adalah kitinase basa yang kaya akan asam amino cistein pada N-tenninal serta memiliki daerah pengikatan
kijin
(Chitin-binding), dan ter10kalisasi pada vakolJla sel. Sekuenyang
kaya cistein ini terpaut dengan sekuen pendekyang
kaya akan gtysinlproUn yang merupakan daerah katalitik dan enzim tersebut. Berdasarkan hasH pengujianin vitro
ketas ini dapat menghambat pertumbuhan cendawan (Mauch .t81.1988).Enzim Kitinase Kelas II: adalah kitinase asam yang N-terminalnya sedikit mengandung cistein, namun memiliki homologi yang cukup tinggi pada daerah katalitik dengan enzim kitinase kelas I, namun tidak memiliki daerah chifin.. binding. Kelompok ini teookalisasi pada daerah ekstraselular dan umumnya banyak ditemukan pada tanaman dikotil. Kitinase kelas II diisotasi dari tanaman bar1ey menunjukkan aktifltas antifungal, namun yang diisotasi dan
tembakau
tidak memiliki aldifitas ini(sela-bオオセ@
at
81. 1993).tidak memiliki signal untuk ditransk>kasikan ke vakoula (lawton at al. 1992). dan diduga hanya berperan sebagai elisitor saat tanaman terserang cendaW3n.
Enzlm Kitinase Kelas IV: memiliki N-tenninal yang kaya akan asam amino clstein, sekuen yang mirlp dengan kelas I oamun lebih pendek, dan memiliki aktifltas antifungal tiga kali lebih tinggi dan kelas
I.
Tanaman dapat menghasilkan lebih dan satu jenis enzim kitinase (Broglie dan Broglie 1393) yang semuanya tennasuk kedalammekanisme pertahanan tanaman.
Enzim Kitinase Kelas V: kelas enzim ini kebanyakan dihasilkan ッセィ@ bakteri, oamun ada juga yang dihasilkan oleh tar.aman seperti tembakau. Sekuen enzim ini memiliki kemiripan dengan kelas III dan dikeJompokkan kedalam famili 18 dan glycosyl hydrolase.
2.4.2 Gen Penyandi Enzim Kitinase
Geo yang mengontrol enzim kitinase adalah gen
chi.
Pengetompokan eozim kitinaseyang
dibuat ッセィ@ Levorson dan Chlan (1997) berdasarkan sekuen gen dan struktur molekul yang mengekspresikan enzim tersebut. Enzim kitinase dikelompokan kedalam 5 kelas berdasarkan ada tidaknya N-terminal hevein domain dan kesamaan setwen kitinolitiknya. yailu Chia1, Chia2. Chla3, Chla4, dan Ch1a5. Balden S. marcescens memiliki 2 jenis enzim kitinase yaitu ChiA dan ChiB yang masing-masing dikontrol oIeh genchiA
danche
(Brurberg at al. 1995), kitinase dar! bakteri Streptomyces lividans tennasuk tipe chiA (Miyashita dan Fujii 1993), dan yang dihasilkan oIeh Bacillus circulans tenn